双特异性双抗体的药物制剂及其用途的制作方法
alpha chain and functions as a specific il-3 receptor antagonist,”blood 87:83-92;l.等(2001)“interleukin-3 receptor alpha chain(cd123)is widely expressed in hematologic malignancies,”haematologica 86(12):1261-1269;masten,b.j.等(2006)“characterization of myeloid and plasmacytoid dendritic cells in human lung,”j.immunol.177:7784-7793;korpelainen,e.i.等(1995)“interferon-gamma upregulates interleukin-3(il-3)receptor expression in human endothelial cells and synergizes with il-3in stimulating major histocompatibility complex class ii expression and cytokine production,”blood 86:176-182)。
17.已经报道cd123在包括aml和mds的广泛的血液系统恶性肿瘤中的恶性细胞上过度表达(l.等(2001)“interleukin-3receptor alpha chain(cd123)is widely expressed in hematologic malignancies,”haematologica 86(12):1261-1269)。cd123的过度表达与aml的预后较差有关(tettamanti,m.s.等(2013)“targeting of acute myeloid leukaemia by cytokine-induced killer cells redirected with a novel cd123-specific chimeric antigen receptor,”br.j.haematol.161:389-401)。
18.iii.cd3
19.cd3是由四条不同的链组成的t细胞共受体(wucherpfennig,k.w.等(2010)“structural biology of the t-cell receptor:insights into receptor assembly,ligand recognition,and initiation of signaling,”cold spring harb.perspect.biol.2(4):a005140;第1-14页)。在哺乳动物中,该复合物包含cd3γ链、cd3δ链和两条cd3ε链。这些链与称为t细胞受体(tcr)的分子缔合,以在t淋巴细胞中产生激活信号。在没有cd3的情况下,tcr无法适当组装并且被降解(thomas,s.等(2010)“molecular immunology lessons from therapeutic t-cell receptor gene transfer,”immunology 129(2):170
–
177)。发现cd3结合所有成熟t细胞的膜,并且几乎不结合其他细胞类型的膜(参见,janeway,c.a.等(2005)in:immunobiology:the immune system in health and disease,”第6版.garland science publishing,ny,第214-216页;sun,z.j.等(2001)“mechanisms contributing to t cell receptor signaling and assembly revealed by the solution structure of an ectodomain fragment of the cd3ε:γheterodimer,”cell 105(7):913-923;kuhns,m.s.等(2006)“deconstructing the form and function of the tcr/cd3 complex,”immunity.2006年2月;24(2):133-139)。
20.iv.aml和mds
21.aml和mds被认为在小部分的白血病干细胞(lsc)中出现并且通过其得以持续,该白血病干细胞通常处于休眠状态(即不是迅速分裂的细胞),因此抵抗细胞死亡(凋亡)和常规化疗剂。lsc的特征在于高水平的cd123表达,其在正常人的骨髓中相应的正常hsc群体中不存在(jin,w.等(2009)“regulation of th17 cell differentiation and eae induction by map3k nik,”blood 113:6603-6610;jordan,c.t.等(2000)“the interleukin-3receptor alpha chain is a unique marker for human acute myelogenous leukemia stem cells,”leukemia 14:1777-1784)。cd123在45%-95%的aml、85%的毛细胞白血病(hcl)和40%的急性b淋巴细胞白血病(b-all)中表达。cd123表达还与多种其他恶性肿瘤/前恶性肿瘤(pre-malignancies)相关:慢性髓细胞白血病(cml)祖
细胞(包括急变期(blast crisis)cml)、霍奇金里德斯特恩伯格(hodgkin’s reed sternberg)(rs)细胞、转化的非霍奇金淋巴瘤(nhl)、一些慢性淋巴细胞性白血病(cll)(cd11c+)、急性t淋巴细胞白血病的亚群(t-all)(16%,最不成熟的,大部分是成人的)、pdc dc2恶性肿瘤和cd34+/cd38-mds骨髓细胞恶性肿瘤。
22.aml是克隆性疾病,其特征在于在骨髓中转化的髓样祖细胞的增殖和积聚,其最终导致造血功能障碍。aml的发病率随着年龄而增加,并且年长患者通常比年轻患者具有更差的治疗效果(robak,t.等(2009)“current and emerging therapies for acute myeloid leukemia,”clin.ther.2:2349-2370)。不幸地,现在,大多数具有aml的成年人死于他们的疾病。
23.aml的治疗最初集中在诱导缓解(诱导疗法)。一旦达到缓解,治疗转为致力于巩固这种缓解(缓解后或巩固疗法),并且在一些情况下,转为维持疗法。针对aml的标准缓解诱导范例是用蒽环类抗生素/阿糖胞苷组合的化学疗法,然后巩固化学疗法(通常用更高剂量的药物,所述药物与在诱导时期期间使用的药物相同)或人类干细胞移植,这取决于患者耐受强化治疗的能力和单独用化学疗法治愈的可能性(参见,例如,roboz,g.j.(2012)“current treatment of acute myeloid leukemia,”curr.opin.oncol.24:711-719)。
24.诱导疗法中频繁使用的剂包括阿糖胞苷(也称为arac)和蒽环类抗生素。arac通过干扰dna合成而杀死癌细胞(和其他快速分裂的正常细胞)。与arac治疗相关的副作用包括对感染的抵抗力下降,白细胞生成减少的结果;由于血小板生成减少引起的出血;和由于红细胞的潜在减少引起的贫血。其他副作用包括恶心和呕吐。蒽环类抗生素(例如,柔红霉素(daunorubicin)、多柔比星(doxoubicin)和伊达比星(idarubicin))具有数种作用方式,包括抑制dna和rna合成、破坏dna的更高阶结构和生成损伤细胞的氧自由基。蒽环类抗生素的最严重的不良反应是心脏毒性,其相当限制施用的终生剂量,并且在一定程度上限制它们的有用性。
25.因此,不幸地,尽管在新诊断的aml的治疗中有重大进展,但20%至40%的患者用标准诱导化学疗法未实现缓解,并且预计50%至70%的进入首次完全缓解期的患者在3年内复发。在复发时或针对具有抗性疾病的患者的最佳策略仍不确定。已经确定干细胞移植为具有首次或随后缓解期的aml患者中最有效的抗白血病治疗的形式(roboz,g.j.(2012)“current treatment of acute myeloid leukemia,”curr.opin.oncol.24:711-719)。
技术实现要素:
26.本发明涉及包括双特异性双抗体的稳定水性药物制剂(双抗体制剂),并且涉及用于稳定所述双抗体的水性稳定剂溶液。本发明特别地涉及包括包含能够同时地结合至cd123和cd3的序列优化的cd123 x cd3双特异性双抗体(dart-a)的双抗体药物产品的这种药物制剂(dart-a dp制剂)。本发明进一步涉及这种dart-a dp制剂和稳定剂在患者中的如aml或mds的血液系统恶性肿瘤的治疗中的用途。
27.详细地,本发明提供了包括双抗体(例如cd123 x cd3双抗体)、磷酸钠缓冲液、氯化钠和聚山梨酯80(“ps80”)的稳定水性药物制剂。
28.本发明另外提供了这种稳定水性药物制剂的实施方式,其中磷酸钠具有约5mm至约30mm的浓度,并且特别是其中磷酸钠的浓度是约10mm。
29.本发明另外提供了这种稳定水性药物制剂的实施方式,其中ps80具有约0.05mg/ml至约0.3mg/ml的浓度,并且特别是其中ps80具有约0.1mg/ml的浓度。
30.本发明另外提供了这种稳定水性药物制剂的实施方式,其中氯化钠具有约100mm至约300mm的浓度,并且特别是约150mm的浓度。
31.本发明另外提供了这种稳定水性药物制剂的实施方式,其中制剂具有约5.5至约7.0的ph,并且特别是约6.0的ph。
32.本发明另外提供了这种稳定水性药物制剂的实施方式,其中制剂包括约10mm磷酸钠、约150mm氯化钠和约0.1mg/ml ps80,并且其中制剂具有约6.0的ph。
33.本发明另外提供了这种稳定水性药物制剂的实施方式,其中双抗体具有约0.01mg/ml至约1mg/ml的浓度,并且特别是约0.1mg/ml的浓度。
34.本发明特别地涉及这种稳定水性药物制剂的实施方式,其中双抗体是包括两条、三条或四条多肽链的共价结合的双特异性双抗体。本发明另外提供了这种稳定水性药物制剂,其中共价结合的双抗体是cd123 x cd3双抗体,并且更具体地,其中cd123 x cd3双抗体包括:
35.a)具有seq id no:42的氨基酸序列的第一多肽链;和
36.b)具有seq id no:44的氨基酸序列的第二多肽链,以及
37.其中第一和第二多肽链通过二硫键彼此共价结合。
38.本发明另外提供了这种稳定水性药物制剂的实施方式,其中制剂包括约0.1mg/ml的双抗体、约10mm磷酸钠、约150mm氯化钠和约0.1mg/ml ps80,并且其中制剂的ph是约6.0。
39.本发明另外提供了包括任何以上所述的稳定水性药物制剂的容器,并且特别地,其中这种容器是无菌地填充的玻璃小瓶。
40.本发明另外提供了无菌填充在小瓶中的这种稳定水性药物制剂的实施方式,其中溶液在25℃维持双抗体的单体纯度约3个月。
41.本发明另外提供了无菌填充在小瓶中的这种稳定水性药物制剂的实施方式,其中溶液在2-8℃维持双抗体的单体纯度约48个月。
42.本发明另外提供了包括任何以上所述的稳定水性药物制剂的密封包装。
43.本发明另外提供了用于稳定双抗体的水性稳定剂溶液,其包括磷酸钠、ps80、苯甲醇(“ba”)和对羟基苯甲酸甲酯(“mp”)。
44.本发明另外提供了水性稳定剂溶液,其中磷酸钠具有约15mm至约25mm的浓度,并且特别是其中磷酸钠的浓度是约20mm。
45.本发明另外提供了这种水性稳定剂溶液,其中ba具有约11.5mg/ml至约15.5mg/ml的浓度,并且特别是其中ba的浓度是约13.2mg/ml。
46.本发明另外提供了这种水性稳定剂溶液,其中mp具有约3.5mg/ml至约5.5mg/ml的浓度,并且特别是其中mp的浓度是约4.25mg/ml。
47.本发明另外提供了任何这种水性稳定剂溶液的实施方式,其中ps80具有约0.1mg/ml至约0.4mg/ml的浓度,并且特别是其中ps80的浓度是约0.25mg/ml。
48.本发明另外提供了任何这种水性稳定剂溶液的实施方式,其中溶液具有约7.7至约8.7的ph,并且特别是其中ph是约8.2。
49.本发明另外提供了这种水性稳定剂溶液的实施方式,其中稳定剂溶液包括约20mm
磷酸钠、约13.2mg/ml ba、约4.25mg/ml mp和约0.25mg/ml ps80,以及其中溶液的ph是约8.2。
50.本发明特别地涉及这种水性稳定剂溶液,其中双抗体是包括两条、三条或四条多肽链的共价结合的双特异性双抗体。
51.本发明另外提供了这种水性稳定剂溶液,其中共价结合的双抗体是cd123 x cd3双抗体,并且更特别地,其中cd123 x cd3双抗体包括:
52.a)具有seq id no:42的氨基酸序列的第一多肽链;和
53.b)具有seq id no:44的氨基酸序列的第二多肽链;以及
54.其中第一和第二多肽链通过二硫键彼此共价结合。
55.本发明另外提供了这种水性稳定剂溶液的实施方式,其中溶液在约25℃维持双抗体的单体纯度约3-5天。
56.本发明另外提供了这种水性稳定剂溶液的实施方式,其中溶液在约25℃维持双抗体的单体纯度约5-7天。
57.本发明另外提供了这种水性稳定剂溶液的实施方式,其中溶液在约25℃抑制或防止微生物生长约3-5天。
58.本发明另外提供了这种水性稳定剂溶液的实施方式,其中溶液在约25℃抑制或防止微生物生长约5-7天。
59.本发明另外提供了在小瓶中的这种水性稳定剂溶液的实施方式,其中溶液在2-8℃具有至少约2年的保质期或在25℃具有至少约3个月的保质期。
60.本发明另外提供了包括任何以上所述的稳定水性稳定剂溶液的容器,并且特别地,其中这种容器是无菌填充的玻璃小瓶。
61.本发明另外提供了包括任何这种水性稳定剂溶液的密封包装。
62.本发明另外提供了用于稳定双抗体的水性稳定剂溶液,其包括氯化钠和ps80。
63.本发明另外提供了这种水性稳定剂溶液的实施方式,其中氯化钠具有约100mm至约300mm的浓度,并且特别是约150mm的浓度。
64.本发明另外提供了这种水性稳定剂溶液的实施方式,其中ps80具有约0.05mg/ml至约0.3mg/ml的浓度,并且特别是约0.10mg/ml的浓度。
65.本发明另外提供了这种水性稳定剂溶液的实施方式,其中溶液具有约5.5至约7.0的ph,并且特别是其中ph是6.0。
66.本发明另外提供了这种水性稳定剂溶液的实施方式,其中溶液包括约150mm氯化钠、约0.10mg/ml ps80以及其中溶液的ph是约6.0。
67.本发明特别地涉及这种水性稳定剂溶液,其中双抗体是包括两条、三条或四条多肽链的共价结合的双特异性双抗体。
68.本发明另外提供了这种水性稳定剂溶液,其中共价结合的双抗体是cd123 x cd3双抗体,并且更特别地,其中cd123 x cd3双抗体包括:
69.a)具有seq id no:42的氨基酸序列的第一多肽链;和
70.b)具有seq id no:44的氨基酸序列的第二多肽链;以及
71.其中第一和第二多肽链通过二硫键彼此共价结合。
72.本发明另外提供了这种水性稳定剂溶液的实施方式,其中溶液在约25℃维持双抗
体的单体纯度约3-5天。
73.本发明另外提供了这种水性稳定剂溶液的实施方式,其中溶液在约25℃维持双抗体的单体纯度约5-7天。
74.本发明另外提供了这种水性稳定剂溶液的实施方式,其中溶液在约25℃抑制或防止微生物生长约3-5天。
75.本发明另外提供了这种水性稳定剂溶液的实施方式,其中溶液在约25℃防止微生物生长约5-7天。
76.本发明另外提供了在小瓶中的这种水性稳定剂溶液的实施方式,其中溶液在2-8℃具有至少约2年的保质期或在25℃具有至少约3个月的保质期。
77.本发明另外提供了包括任何以上所述稳定水性稳定剂溶液的容器,并且特别地,其中这种容器是无菌填充的玻璃小瓶。
78.本发明另外提供了包括任何这种水性稳定剂溶液的密封包装。
79.本发明另外提供了用于稳定双抗体的水性稳定剂溶液,其包括磷酸钠、氯化钠、ps80和ba。本发明另外提供了这种水性稳定剂溶液的实施方式,其中磷酸钠具有约5mm至约30mm的浓度。
80.本发明另外提供了这种水性稳定剂溶液的实施方式,其中磷酸钠的浓度是约10mm。
81.本发明另外提供了这种水性稳定剂溶液的实施方式,其中氯化钠具有约100mm至约300mm的浓度。
82.本发明另外提供了这种水性稳定剂溶液的实施方式,其中氯化钠的浓度是约150mm。
83.本发明另外提供了这种水性稳定剂溶液的实施方式,其中ba具有约7.0mg/ml至约11.0mg/ml的浓度。
84.本发明另外提供了这种水性稳定剂溶液的实施方式,其中ba的浓度是约9.0mg/ml。
85.本发明另外提供了这种水性稳定剂溶液的实施方式,其中ps80具有约0.05mg/ml至约0.3mg/ml的浓度。
86.本发明另外提供了这种水性稳定剂溶液的实施方式,其中ps80的浓度是约0.10mg/ml。
87.本发明另外提供了这种水性稳定剂溶液的实施方式,其进一步包括重组人白蛋白(“rha”)。
88.本发明另外提供了这种水性稳定剂溶液的实施方式,其中rha具有约0.05mg/ml至约0.15mg/ml的浓度,并且特别是其中rha的浓度是约0.10mg/ml。
89.本发明另外提供了这种水性稳定剂溶液的实施方式,其中溶液具有约5.5至约7.0的ph,并且特别是其中ph是6.0。
90.本发明特别地提供了这种水性稳定剂溶液的实施方式,其中溶液包括约10mm磷酸钠、约150mm氯化钠、约9.0mg/ml ba、约0.1mg/ml ps80和约0.1mg/ml rha以及其中溶液的ph是约6.0。
91.本发明特别地提供了这种水性稳定剂溶液的实施方式,其中溶液包括约10mm磷酸
钠、约150mm氯化钠、约0.1mg/ml ps80以及其中溶液的ph是约6.0。
92.本发明另外提供了这种水性稳定剂溶液的实施方式,其中双抗体是共价结合的双特异性双抗体。
93.本发明另外提供了这种水性稳定剂溶液,其中共价结合的双抗体是cd123 x cd3双抗体并且更特别地,其中cd123 x cd3双抗体包括:
94.a)具有seq id no:42的氨基酸序列的第一多肽链;和
95.b)具有seq id no:44的氨基酸序列的第二多肽链;以及
96.其中第一和第二多肽链通过二硫键彼此共价结合。
97.本发明另外提供了这种水性稳定剂溶液的实施方式,其中溶液在约25℃维持双抗体的单体纯度约3天。
98.本发明另外提供了这种水性稳定剂溶液的实施方式,其中溶液在约25℃抑制或防止微生物生长约3-5天。
99.本发明另外提供了这种水性稳定剂溶液的实施方式,其中溶液在2-8℃具有至少约2年的保质期或在25℃具有至少约3个月的保质期。
100.本发明另外提供了包括任何这种水性稳定剂溶液的容器(尤其是玻璃小瓶容器)。
101.本发明另外提供了包括任何这种水性稳定剂溶液的密封包装。
102.本发明另外提供了试剂盒,其包括:
103.a)容器a,其包括稳定水性药物制剂,制剂包括约0.01mg/ml至约1mg/ml的双抗体、约5mm至约30mm磷酸钠缓冲液、约100mm至约300mm氯化钠和约0.05mg/ml至约0.3mg/ml ps80以及制剂具有约5.5至约7.0的ph;和
104.b)容器b,其包括用于稳定双抗体的水性稳定剂溶液,溶液包括约15mm至约25mm磷酸钠缓冲液、约11.5mg/ml至约15.5ba、约3.5mg/ml至约5.5mg/ml mp和约0.1mg/ml至约0.4mg/ml ps80以及溶液具有约7.7至约8.7的ph;和任选地
105.c)用于组合容器a和b的内含物以将组合后的溶液施用给需要其的受试者的说明书。
106.本发明另外提供了试剂盒,其包括:
107.a)容器a,其包括稳定水性药物制剂,制剂包括约0.01mg/ml至约1mg/ml的双抗体、约5mm至约30mm磷酸钠缓冲液、约100mm至约300mm氯化钠和约0.05mg/ml至约0.3mg/ml ps80以及制剂具有约5.5至约7.0的ph;和
108.b)(i)容器b,其包括用于稳定双抗体的水性稳定剂溶液,溶液包括约5mm至约30mm磷酸钠、约100mm至约300mm氯化钠、约7.0mg/ml至约11.0mg/ml ba、约0.05mg/ml至约0.3mg/ml ps80以及溶液具有约5.5至约7.0的ph;或
109.(ii)容器b,其包括用于稳定双抗体的水性稳定剂溶液,溶液包括约5mm至约30mm磷酸钠、约100mm至约300mm氯化钠、约0.05mg/ml至约0.3mg/ml ps80以及溶液具有约5.5至约7.0的ph;或
110.(iii)容器b,其包括用于稳定双抗体的水性稳定剂溶液,溶液包括约100mm至约300mm氯化钠、约0.05mg/ml至约0.3mg/ml ps80以及溶液具有约5.5至约7.0的ph;和任选地
111.c)用于组合容器a和b的内含物以将组合后的溶液施用给需要其的受试者的说明书。
112.本发明另外提供了这种试剂盒的实施方式,其中双抗体是包括两条、三条或四条多肽链的共价结合的双特异性双抗体。
113.本发明另外提供了这种试剂盒,其中共价结合的双抗体是cd123 x cd3双抗体,并且更特别地,其中cd123 x cd3双抗体包括:
114.a)具有seq id no:42的氨基酸序列的第一多肽链;和
115.b)具有seq id no:44的氨基酸序列的第二多肽链;以及
116.其中第一和第二多肽链通过二硫键彼此共价结合。
117.本发明另外提供了这种试剂盒的实施方式,其中容器a中的稳定水性药物制剂包括约0.1mg/ml的双抗体、约10mm磷酸钠、约150mm氯化钠和约0.1mg/ml ps80以及其中制剂具有约6.0的ph。
118.本发明另外提供了这种试剂盒的实施方式,其中容器b中的水性稳定剂溶液包括约20mm磷酸钠、约13.2mg/ml ba、约4.25mg/ml mp和约0.25mg/ml ps80以及其中溶液具有约8.2的ph。
119.本发明另外提供了这种试剂盒的实施方式,其中容器b中的水性稳定剂溶液包括约10mm磷酸钠、约150mm氯化钠、约9.0mg/ml ba、约0.1mg/ml ps80以及其中溶液具有约6.0的ph。
120.本发明另外提供了这种试剂盒的实施方式,其中容器b中的水性稳定剂溶液包括约10mm磷酸钠、约150mm氯化钠、约0.1mg/ml ps80以及其中溶液具有约6.0的ph。
121.本发明另外提供了这种试剂盒的实施方式,其中容器b中的水性稳定剂溶液包括约150mm氯化钠、约0.10mg/ml ps80,并且其中溶液具有约6.0的ph。
122.本发明另外提供了这种试剂盒的实施方式,其中水性稳定剂溶液进一步包括以约0.05mg/ml至约0.3mg/ml的浓度的rha。
123.本发明另外提供了这种试剂盒的实施方式,其中rha的浓度是约0.1mg/ml。
124.本发明另外提供了这种试剂盒的实施方式,其中受试者是人患者。
125.本发明另外提供了这种试剂盒的实施方式,其中容器a和容器b是玻璃小瓶。
126.本发明另外提供了密封包装,其包括任何以上所述的试剂盒,并且任选地用于这种试剂盒的储存和/或使用的说明书。
127.本发明另外提供了包括使用以上所述的试剂盒之一施用双抗体给需要其的受试者的方法,其中容器b的水性稳定剂溶液包括磷酸钠、ps80、ba、mp并且具有约7.7至约8.7的ph;
128.并且其中在方法中:
129.(a)将容器b的水性稳定剂溶液放置在容器c中并且混合;
130.(b)将容器a的稳定水性药物制剂放置在容器c中并且混合以获得给药溶液;
131.(c)将包含给药溶液的容器c附接至用于施用至受试者的装置。
132.本发明另外提供了这种方法的实施方式,其中容器c包括用于静脉输注的盐水。
133.本发明另外提供了使用以上所述的试剂盒之一施用双抗体给需要其的受试者的方法,其中容器b的水性稳定剂溶液包括磷酸钠、氯化钠、ps80、ba和任选地rha中的一种或多种,并且具有约5.5至约7.0的ph;
134.并且其中在方法中:
135.(a)将容器a的稳定水性药物制剂放置在容器b的水性稳定剂溶液中并且混合以获得给药溶液;
136.(b)任选地稀释给药溶液;
137.(c)将给药溶液放置在容器c中;和
138.(d)将包含最终给药溶液的容器c附接至用于施用至受试者的装置。
139.本发明另外提供了这种方法的实施方式,其中容器c包括用于静脉输注的盐水或抑菌盐水。
140.本发明另外提供了这种方法的实施方式,其中施用是通过输液泵的。
141.本发明另外提供了这种方法的实施方式,其中施用是移动的(ambulatory)。
142.本发明另外提供了这种方法的实施方式,其中装置是单个移动泵。
143.本发明另外提供了这种方法的实施方式,其中装置是双移动泵。
144.本发明另外提供了这种方法的实施方式,其中装置是注射泵。
145.本发明另外提供了这种方法的实施方式,其中通过连续输注至少约24小时施用。
146.本发明另外提供了这种方法的实施方式,其中通过连续输注至少约48小时施用。
147.本发明另外提供了这种方法的实施方式,其中通过连续输注至少约96小时施用。
148.本发明另外提供了这种方法的实施方式,其中通过连续输注至少约7天施用。
149.本发明另外提供了这种方法的实施方式,其中以约0.10ml/小时至约2.5ml/小时的流速发生施用。
150.本发明另外提供了这种方法的实施方式,其中以约0.5ml/小时至约10.0ml/小时的流速发生施用。
151.本发明另外提供了这种方法的实施方式,其中通过以约0.1ml/小时至约2.0ml/小时的流速连续输注至少24小时施用。
152.本发明另外提供了这种方法的实施方式,其中通过以约0.5ml/小时至约6ml/小时的流速连续输注至少48小时施用。
153.本发明另外提供了这种方法的实施方式,其中通过以约0.6ml/小时至约3.0ml/小时的流速连续输注至少96小时施用。
154.本发明另外提供了这种方法的实施方式,其中通过以约0.3ml/小时至约3.0ml/小时的流速连续输注至少96小时施用。
155.本发明另外提供了这种方法的实施方式,其中通过以约0.5ml/小时的流速连续输注至少96小时施用。
156.本发明另外提供了这种方法的实施方式,其中通过以约0.3ml/小时至约3.0ml/小时的流速连续输注至少7天施用。
157.本发明另外提供了这种方法的实施方式,其中通过以约0.5ml/小时的流速连续输注至少7天施用。
158.本发明另外提供了这种方法的实施方式,其中流速防止受试者的静脉阻塞。
159.本发明另外提供了这种方法的实施方式,其中双抗体是cd123 x cd3双抗体并且以选自30-500ng/kg/天组成的组的治疗剂量施用给受试者。
160.本发明另外提供了这种方法的实施方式,其中给药溶液包括40ml的水性稳定剂溶液。
161.本发明另外提供了这种方法的实施方式,其中给药溶液包括约0.03mg/ml至约0.04mg/ml ps80、约1.7mg/ml至约2.1mg/ml ba和约0.55mg/ml至约0.7mg/ml mp。
162.本发明另外提供了这种方法的实施方式,其中所述给药溶液包括约100mm至约300mm氯化钠、约0.05mg/ml至约0.15mg/ml ps80,并且所述溶液具有约5.5至约7.0的ph。
163.本发明另外提供了这种方法的实施方式,其中患者是人受试者。
164.本发明另外提供了治疗血液系统恶性肿瘤的方法,其包括向需要其的受试者施用治疗有效量的给药溶液,该给药溶液包括:
165.(a)(1)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂以及包括磷酸钠、ps80、ba和mp的水性稳定剂溶液;或
166.(2)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述磷酸钠具有约5mm至约30mm的浓度,以及包括磷酸钠、ps80、ba和mp的水性稳定剂溶液;或
167.(3)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述磷酸钠具有约10mm的浓度,以及包括磷酸钠、ps80、ba和mp的水性稳定剂溶液;或
168.(4)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述ps80具有约0.05mg/ml至约0.3mg/ml的浓度,以及包括磷酸钠、ps80、ba和mp的水性稳定剂溶液;或
169.(5)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述ps80具有约0.1mg/ml的浓度,以及包括磷酸钠、ps80、ba和mp的水性稳定剂溶液;或
170.(6)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述氯化钠具有约100mm至约300mm的浓度,以及包括磷酸钠、ps80、ba和mp的水性稳定剂溶液;或
171.(7)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述氯化钠具有约150mm的浓度,以及包括磷酸钠、ps80、ba和mp的水性稳定剂溶液;或
172.(8)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述制剂具有约5.5至约7.0的ph,以及包括磷酸钠、ps80、ba和mp的水性稳定剂溶液;或
173.(9)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述制剂具有约6.0的ph,以及包括磷酸钠、ps80、ba和mp的水性稳定剂溶液;或
174.(10)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述cd123 x cd3双抗体具有约0.01mg/ml至约1mg/ml的浓度,以及包括磷酸钠、ps80、ba和mp的水性稳定剂溶液;或
175.(11)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述cd123 x cd3双抗体的浓度是约0.1mg/ml,以及包括磷酸钠、ps80、ba和mp的水性稳定剂溶液;或
176.(12)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述cd123 x cd3双抗体包括:
177.a)具有seq id no:42的氨基酸序列的第一多肽链;和
178.b)具有seq id no:44的氨基酸序列的第二多肽链;以及
179.其中所述第一多肽链和所述第二多肽链通过二硫键彼此共价结合,以及包括磷酸钠、ps80、ba和mp的水性稳定剂溶液;或
180.(13)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述制剂包括约0.1mg/ml的所述cd123 x cd3双抗体、约10mm磷酸钠、约150mm氯化钠和约0.1mg/ml ps80,并且其中所述制剂的ph是约6.0,以及包括磷酸钠、ps80、ba和mp的水性稳定剂溶液;或
181.(14)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述溶液在25℃维持所述cd123 x cd3双抗体的单体纯度约3个月,以及包括磷酸钠、ps80、ba和mp的水性稳定剂溶液;或
182.(15)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述溶液在2-8℃维持所述cd123 x cd3双抗体的单体纯度约48个月,以及包括磷酸钠、ps80、ba和mp的水性稳定剂溶液;或
183.(b)(1)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,以及包括磷酸钠、氯化钠、ps80和ba的水性稳定剂溶液;或
184.(2)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述磷酸钠具有约5mm至约30mm的浓度,以及包括磷酸钠、氯化钠、ps80和ba的水性稳定剂溶液;或
185.(3)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述磷酸钠具有约10mm的浓度,以及包括磷酸钠、氯化钠、ps80和ba的水性稳定剂溶液;或
186.(4)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述ps80具有约0.05mg/ml至约0.3mg/ml的浓度,以及包括磷酸钠、氯化钠、ps80和ba的水性稳定剂溶液;或
187.(5)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述ps80具有约0.1mg/ml的浓度,以及包括磷酸钠、氯化钠、ps80和ba的水性稳定剂溶液;或
188.(6)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述氯化钠具有约100mm至约300mm的浓度,以及包括磷酸钠、氯化钠、ps80和ba的水性稳定剂溶液;或
189.(7)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述氯化钠具有约150mm的浓度,以及包括磷酸钠、氯化钠、ps80和ba的水性稳定剂溶液;或
190.(8)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述制剂具有约5.5至约7.0的ph,以及包括磷酸钠、氯化钠、ps80和ba的水性稳定剂溶液;或
191.(9)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述制剂具有约6.0的ph,以及包括磷酸钠、氯化钠、ps80和ba的水性稳定剂溶液;或
192.(10)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制
剂,其中所述cd123 x cd3双抗体具有约0.01mg/ml至约1mg/ml的浓度,以及包括磷酸钠、氯化钠、ps80和ba的水性稳定剂溶液;或
193.(11)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述cd123 x cd3双抗体的浓度是约0.1mg/ml,以及包括磷酸钠、氯化钠、ps80和ba的水性稳定剂溶液;或
194.(12)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述cd123 x cd3双抗体包括:
195.a)具有seq id no:42的氨基酸序列的第一多肽链;和
196.b)具有seq id no:44的氨基酸序列的第二多肽链;以及
197.其中所述第一多肽链和所述第二多肽链通过二硫键彼此共价结合,以及包括磷酸钠、氯化钠、ps80和ba的水性稳定剂溶液;或
198.(13)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述制剂包括约0.1mg/ml的所述cd123 x cd3双抗体、约10mm磷酸钠、约150mm氯化钠和约0.1mg/ml ps80,并且其中所述制剂的ph是约6.0,以及包括磷酸钠、氯化钠、ps80和ba的水性稳定剂溶液;
199.(14)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述溶液在25℃维持所述cd123 x cd3双抗体的单体纯度约3个月,以及包括磷酸钠、氯化钠、ps80和ba的水性稳定剂溶液;或
200.(15)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,所述溶液在2-8℃维持所述cd123 x cd3双抗体的单体纯度约48个月,以及包括磷酸钠、氯化钠、ps80和ba的水性稳定剂溶液;或
201.(c)(1)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,以及包括氯化钠和ps80的水性稳定剂溶液;或
202.(2)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述磷酸钠具有约5mm至约30mm的浓度,以及包括氯化钠和ps80的水性稳定剂溶液;或
203.(3)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述磷酸钠具有约10mm的浓度,以及包括氯化钠和ps80的水性稳定剂溶液;或
204.(4)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述ps80具有约0.05mg/ml至约0.3mg/ml的浓度,以及包括氯化钠和ps80的水性稳定剂溶液;或
205.(5)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述ps80具有约0.1mg/ml的浓度,以及包括氯化钠和ps80的水性稳定剂溶液;或
206.(6)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述氯化钠具有约100mm至约300mm的浓度,以及包括氯化钠和ps80的水性稳定剂溶液;或
207.(7)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述氯化钠具有约150mm的浓度,以及包括氯化钠和ps80的水性稳定剂溶液;或
208.(8)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述制剂具有约5.5至约7.0的ph,以及包括氯化钠和ps80的水性稳定剂溶液;或
209.(9)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述制剂具有约6.0的ph,以及包括氯化钠和ps80的水性稳定剂溶液;或
210.(10)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述cd123 x cd3双抗体具有约0.01mg/ml至约1mg/ml的浓度,以及包括氯化钠和ps80的水性稳定剂溶液;或
211.(11)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述cd123 x cd3双抗体的浓度是约0.1mg/ml,以及包括氯化钠和ps80的水性稳定剂溶液;或
212.(12)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述cd123 x cd3双抗体包括:
213.a)具有seq id no:42的氨基酸序列的第一多肽链;和
214.b)具有seq id no:44的氨基酸序列的第二多肽链;以及
215.其中所述第一多肽链和所述第二多肽链通过二硫键彼此共价结合,以及包括氯化钠和ps80的水性稳定剂溶液;或
216.(13)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述制剂包括约0.1mg/ml的所述cd123 x cd3双抗体、约10mm磷酸钠、约150mm氯化钠和约0.1mg/ml ps80,并且其中所述制剂的ph是约6.0,以及包括氯化钠和ps80的水性稳定剂溶液;
217.(14)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,其中所述溶液在25℃维持所述cd123 x cd3双抗体的单体纯度约3个月,以及包括氯化钠和ps80的水性稳定剂溶液;或
218.(15)包括cd123 x cd3双抗体、磷酸钠缓冲液、氯化钠和ps80的稳定水性药物制剂,所述溶液在2-8℃维持所述cd123 x cd3双抗体的单体纯度约48个月,以及包括氯化钠和ps80的水性稳定剂溶液。
219.本发明另外提供了使用任何以上所述的试剂盒治疗血液系统恶性肿瘤的方法。
220.本发明另外涉及以上所述给药溶液用于血液系统恶性肿瘤的治疗的用途。
221.本发明另外涉及以上所述试剂盒用于血液系统恶性肿瘤的治疗的用途。
222.本发明另外涉及其中这种血液系统恶性肿瘤选自以下组成的组:aml、包括cml急变期和与cml相关的阿伯森致癌基因(abelson oncogene)(bcr-abl易位)的cml、mds、b-all、t-all、包括cll的里克特综合征(richter’s syndrome)和里克特转变(richter’s transformation)的cll、hcl、母细胞性浆细胞样树突状细胞肿瘤(bpdcn)、套细胞淋巴瘤(mcl)和小淋巴细胞淋巴瘤(sll)的nhl、霍奇金淋巴瘤(hodgkin's lymphoma)、系统性肥大细胞增生症和伯基特淋巴瘤(burkitt's lymphoma)的实施方式。
223.本发明特别地涉及其中这种血液系统恶性肿瘤是aml、bpdcn、mds或t-all的实施方式。
224.本发明特别地涉及其中受试者是人受试者的实施方式。
附图说明
225.图1说明了包括两条多肽链的具有两个表位结合位点的两条链共价结合的双抗体
(例如,cd123 x cd3双特异性双抗体,dart-a)的第一和第二多肽链的总体结构,每条多肽链具有e-螺旋或k-螺旋异源二聚体-促进结构域(下面提供可替选的异源二聚体-促进结构域)。半胱氨酸残基可存在于如示出的连接体中和/或异源二聚体-促进结构域中(参见图3-4)。识别相同表位的vl和vh结构域使用相同的阴影或填充图案显示。在这个图中以及在所有图中提供结合分子结构域的示意性展示中的波浪线(www)代表一个或多个任选的异源二聚体-促进结构域,其是优选地存在的。
226.图2提供了包括两条多肽链的具有两个表位结合位点的代表性共价结合的双抗体分子的示意图,每条多肽链具有ch2和ch3结构域,使得缔合的链形成fc区的全部或部分。识别相同表位的vl和vh结构域使用相同的阴影或填充图案显示。
227.图3提供了显示包括两对多肽链(即,总共四条多肽链)的具有四个表位结合位点的代表性共价结合的四价双抗体的示意图。半胱氨酸残基在异源二聚体-促进结构域中示出,其中任选的半胱氨酸残基存在于连接体中。每一对中的一条多肽链拥有ch2和ch3结构域,使得缔合的链形成fc区的全部或部分。识别相同表位的vl和vh结构域使用相同的阴影或填充图案显示。两对多肽链可以是相同的。在这种实施方式中,其中两对多肽链是相同的并且vl和vh结构域识别不同表位,所得的分子拥有四个表位结合位点并且关于每个结合的表位是双特异性的和二价的。
228.图4提供了包括三条多肽链的具有两个表位结合位点的代表性共价结合的双抗体分子的示意图。该多肽链中的两条拥有ch2和ch3结构域,使得缔合的链形成fc区的全部或部分。半胱氨酸残基可存在于异源二聚体-促进结构域中(如示出)和/或在连接体中(参见图1和3)。包含vl和vh结构域的多肽链进一步包含异源二聚体-促进结构域。识别相同表位的vl和vh结构域使用相同的阴影或填充图案显示。
229.图5a-5b示出在两种具有ps80的磷酸盐缓冲盐水(pbs)制剂和两种不具有ps80的pbs制剂中连续搅拌后dart-a浊度(图5a)和亚可见颗粒计数(图5b)。dart-a样品在2-8℃保持并且以600rpm搅拌24小时。
230.图6示出dart-a的热稳定性。使用差示扫描量热法(dsc)来测试在两种药物产品制剂:不具有ps80(仅dart-a dp缓冲液)或具有ps80(dart-a dp缓冲液+ps80)中dart-a的稳定性。对照和含有ps80的dp制剂两者包括150mm nacl、10mm磷酸钠,在ph 6.0。dsc在64℃的融化温度(tm)进行。
231.图7示出与参考标准品(下图)相比,比较了在5
±
3℃保存24个月后的老化dart-a dp制剂(上图)的氨基酸水平上的肽和修饰的肽图分析结果。图中展示了使用与电喷雾电离质谱联用的液相色谱(lc-esims)的两个样品的胰蛋白酶肽图结果。
232.图8a-8d提供了在5
±
3℃储存dart-a dp制剂48个月后如通过结合至cd123(图8a)或cd3(图8b)示出的dart-a的相对效力。图8c示出在5
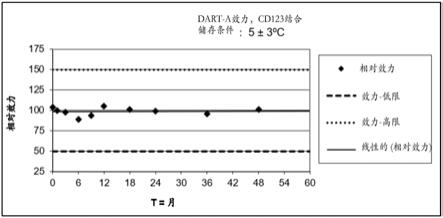
±
3℃储存dart-a dp制剂48个月后,如通过se-hplc测量的dart-a单体的百分率。图8d示出在5
±
3℃储存dart-a dp制剂48个月后,如通过ce-sds测量的dart-a的纯度百分比。
233.图9提供了用于dart-a的稳定剂的开发的总结。开发稳定剂1与dart-a dp制剂混合,以减少由于使用双移动泵施用期间吸收引起的蛋白质损失。进行了研究以比较稳定剂1(包含rha)和修饰的稳定剂1(仅包含ps80)。测试了可替选的防腐剂,并且这些研究导致了用于单个移动泵施用的稳定剂2的开发。
234.图10提供了用于单个泵施用的稳定剂2的开发进行的研究的总结。如图所示,在一系列步骤中评估了防腐剂的选择。
235.图11示出了用于连续施用用稳定剂1稀释的dart-a的双泵移动输注配置。示出了移动输注配置研究中的采样点(点#1-#5)。
236.图12a-12b示出了通过用稳定剂1稀释dart-a dp制剂将dart-a给药溶液装载到药物盒上的制备。图12a示出了dart-a高浓度(5000ng/ml)给药溶液的制备。图12b示出了dart-a低浓度(100ng/ml)给药溶液的制备。
237.图13示出了用于单个移动泵施用的给药溶液的制备。将稳定剂2(40ml)添加到含有270ml标称体积的250ml盐水袋中(可替选地/任选地,可以利用含有盐水的移动泵盒代替盐水袋)。在添加所需体积的含有dart-a的水性药物制剂之前,将盐水袋充分混合。将盐水袋充分混合,得到最终给药溶液。在室温储存72小时期间监测dart-a和防腐剂稳定性。
238.图14示出了可用于向患者施用包括dart-a dp制剂和稳定剂2的给药溶液的1移动输液泵(deltec、st、paul、mn)。
具体实施方式
239.本发明涉及包括双特异性双抗体的稳定水性药物制剂(双抗体制剂)和用于稳定和施用所述双抗体的水性稳定剂溶液。本发明特别地涉及包括能够同时地结合至cd123和cd3的序列优化的cd123 x cd3双特异性单价双抗体dart-a的这种dart-a dp制剂。本发明进一步涉及这种dart-a dp制剂和稳定剂在治疗患者的如aml或mds的血液系统恶性肿瘤中的用途。
240.i.双特异性双抗体
241.本发明涉及包括双特异性双抗体的制剂,特别地包括两条、三条或四条链的共价结合的双抗体。如以下提供的,这种共价结合的双抗体可进一步包括fc结构域。
242.已经描述了稳定的共价结合的异源二聚体非单特异性双抗体,称为双抗体(参见例如pct公开号wo 2006/113665、wo 2008/157379、wo 2010/027797、wo 2010/033279、wo 2010/080538、wo 2011/109400、wo 2012/018687、wo 2012/162067、wo 2012/162068、wo 2014/159940、wo 2015/021089、wo 2015/026892和wo 2015/026894)。这种共价结合的双抗体包括两条或更多条共价复合的多肽并且涉及将一个或多个半胱氨酸残基工程化至每个所采用的多肽种类中,其允许二硫键形成,从而将一对或多对这种多肽链彼此共价结合。例如,已经示出添加半胱氨酸残基至这种构建体的c末端,以允许在涉及的多肽链之间的二硫键合,从而稳定所得的双抗体,而不会干扰双抗体的结合特征。
243.最简单的共价结合的双抗体包括两条多肽链,每条多肽链包三个结构域(图1)。第一多肽链包括:(i)包含第一免疫球蛋白的轻链可变结构域的结合区的结构域(vl1),(ii)包含第二免疫球蛋白的重链可变结构域的结合区的第二结构域(vh2)和(iii)用作促进与第二多肽链的异源二聚化(“异源二聚体-促进结构域”)并且将双抗体的第一多肽与第二多肽链共价结合的第三结构域。第二多肽链包含互补的第一结构域(vl2结构域)、互补的第二结构域(vh1结构域)和第三结构域,其与第一多肽链的第三结构域复合以便促进异源二聚化(“异源二聚体-促进结构域”)并且与第一多肽链的共价结合。这种分子是稳定的、有效的
并且具有同时地结合两个或更多个抗原的能力。在一个实施方式中,第一和第二多肽链的第三结构域各自包含半胱氨酸(“c”)残基,其用于通过二硫键将多肽结合在一起。多肽链之一或两者的第三结构域可另外拥有ch2-ch3结构域的序列,使得双抗体多肽的复合形成fc结构域,其能够结合至细胞(如b淋巴细胞、树突状细胞、自然杀伤细胞、巨噬细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞和肥大细胞)的fc受体(参见例如图2-4)。这种共价结合的分子的几个实例在以下详细地描述,并且这种分子的许多变体已经在其他地方描述(参见例如美国专利公开号2013-0295121、2010-0174053、2007-0004909、2009-0060910,欧洲专利公开号ep 2714079、ep 2601216、ep 2376109、ep 2158221和pct公开号wo 2012/162068、wo 2012/018687、wo 2010/080538、wo 2006/113665)。
244.a.缺乏fc结构域的共价结合的双抗体
245.缺乏fc的共价结合的双抗体的第一多肽链优选地包括,在n-端至c-端方向上:n-端、能够结合第一或第二表位的单克隆抗体的vl结构域(即vl1或vl2)、第一间插间隔子肽(连接体1)、能够结合第二表位的单克隆抗体的vh结构域(如果这种第一多肽链包含vl1)或能够结合第一表位的单克隆抗体的vh结构域(如果这种第一多肽链包含vl2)、任选地包含半胱氨酸残基的第二间插间隔子肽(连接体2)、异源二聚体-促进结构域和c-端(图1)。
246.第二多肽链包括,在n-端至c-端方向上:n-端、能够结合第一或第二表位的单克隆抗体的vl结构域(即vl1或vl2,并且是不被选择用于包含在双抗体的第一多肽链中的vl结构域)、间插间隔子肽(连接体1)、能够结合第一或第二表位的单克隆抗体的vh结构域(即vh1或vh2,并且是不被选择用于包含在双抗体的第一多肽链中的vh结构域)、任选地包含半胱氨酸残基的第二间插间隔子肽(连接体2)、异源二聚体-促进结构域和c-端(图1)。采用的对特定表位特异性的vl和vh结构域优选地是从相同单克隆抗体获得的或衍生的。然而。这种结构域可衍生自不同的单克隆抗体,条件是它们缔合以形成能够免疫特异性结合这种表位的功能结构结构域。这种不同的单克隆抗体在本文中被称作“相应的”抗体。
247.第一多肽链的vl结构域与第二多肽链的vh结构域相互作用以形成第一功能表位结合结构域,其对表位之一(例如第一表位)是特异性的。同样地,第二多肽链的vl结构域与第一多肽链的vh结构域相互作用以便形成第二功能表位结合结构域,其对另一个表位(即第二表位)是特异性的。因此,第一和第二多肽链的vl和vh结构域的选择是“协调的”,使得双抗体的两条多肽链共同地包括能够结合第一表位和第二表位两者的vl和vh结构域(即它们共同地包括vl1/vh1和vl2/vh2)。
248.最优选地,间插间隔子肽(即“连接体1”,其分离这种vl和vh结构域)的长度被选择为基本上或完全防止多肽链的vl和vh结构域彼此结合(例如包含0、1、2、3、4、5、6、7、8或9个间插连接体氨基酸残基)。因此,第一多肽链的vl和vh结构域基本上或完全不能够彼此结合。同样地,第二多肽链的vl和vh结构域基本上或完全基本上或完全不能够彼此结合。优选的间插间隔子肽(连接体1)具有序列(seq id no:1):gggsgggg。
249.第二间插间隔子肽(“连接体2”)的长度和组合是基于促进这种二聚化的一个或多个多肽结构域(即“异源二聚体-促进结构域”)的选择而选择的。通常,第二间插间隔子肽(连接体2)将包括3-20个氨基酸残基。特别地,在采用的异源二聚体-促进结构域包括/不包括半胱氨酸残基的情况下,利用含有半胱氨酸的第二间插间隔子肽(连接体2)。含有半胱氨酸的第二间插间隔子肽(连接体2)将包含1、2、3或更多个半胱氨酸。优选的含有半胱氨酸的
间隔子肽(连接体2)具有序列ggcggg(seq id no:2)。可替选地,连接体2不包括半胱氨酸(例如astkg(seq id no:3))和含有半胱氨酸的异源二聚体-促进结构域,如使用以下所述的。任选地,使用含有半胱氨酸的连接体2和含有半胱氨酸的异源二聚体-促进结构域两者。
250.示例性异源二聚体-促进结构域包括例如包括相反电荷的多肽螺旋的那些。优选的异源二聚体-促进结构域将包括“e-螺旋”异源二聚体-促进结构域(seq id no:4:evaalek-evaalek-evaalek-evaalek),其谷氨酸残基将在ph 7形成负电荷,或“k-螺旋”异源二聚体-促进结构域(seq id no:5:kvaalke-kvaalke-kvaalke-kvaalke),其赖氨酸残基将在ph7形成正电荷。这种带电结构域的存在促进了第一和第二多肽之间的缔合,因此促进了异源二聚体形成。可利用包括以上所述的e-螺旋和k-螺旋序列的修饰的异源二聚体-促进结构域,以便包括一个或多个半胱氨酸残基。这种半胱氨酸残基的存在允许存在于一条多肽链上的螺旋与存在于另一条多肽链上的互补螺旋变成共价结合,从而使多肽链彼此共价结合并且增加双抗体的稳定性。这种特别地优选的实例是包括具有氨基酸序列(seq id no:6)的修饰的e-螺旋和具有氨基酸序列(seq id no:7)的修饰的k-螺旋的异源二聚体-促进结构域。
251.b.包括fc结构域的双特异性双抗体
252.将igg ch2-ch3结构域添加至双抗体多肽链之一或两者,使得双抗体链的复合导致fc结构域的形成,增加了生物半衰期和/或改变了双抗体的效价。这种双抗体包括两条或更多条多肽链,其序列允许多肽链彼此共价结合以形成能够同时结合第一表位和第二表位的共价缔合的双抗体。将igg ch2-ch3结构域并入双抗体多肽的两者上将允许两链双特异性含有fc结构域的双抗体形成(图2)。
253.可替选地,将igg ch2-ch3结构域并入双抗体多肽中仅一者上将允许更复杂的四链双特异性含有fc结构域的双抗体形成(图3)。添加包括第二ch2-ch3 fc结构域,但缺乏任何结合结构域的第三多肽链允许三链双特异性含有fc结构域的双抗体的形成(图4)。
254.这种分子的ch2-ch3结构域可为任何同种型的(例如igg1、igg2、igg3或igg4)。分子可进一步包括铰链结构域。当存在时,铰链结构域可为任何同种型的(例如igg1、igg2、igg3或igg4),并且是优选地相同同种型的作为所需fc结构域。ch2-ch3结构域可进一步包括一个或多个氨基酸取代基以减少或消除至fc-受体的结合(参见例如us 5,624,821)和/或以增加血清半衰期(参见例如us 7,083,784)和/或以促进存在于两条不同多肽链上的ch2-ch3结构域之间的异源二聚化(参见例如us 5,731,168和us 7,183,076)。
255.具有减少或消除的效应子功能的ch2和ch3结构域的一个示例性igg1序列将包括取代l234a/l235a(seq id no:8):
256.257.其中x是赖氨酸(k)或不存在。
258.具有增加的血清半衰期的ch2和ch3结构域的一个示例性igg1序列可将通过取代l234a/l235a提供的减少或消除的效应子功能和将通过取代m252y/s254t/t256e提供的增加的血清半衰期组合(seq id no:9):
[0259][0260][0261]
其中x是赖氨酸(k)或不存在。
[0262]
异源二聚体化的ch2和ch3结构域的示例性igg1氨基酸序列将在一条链上包括t366w(“杵(knob)”)取代并且在另一条链上包括t366s/l368a/y407v(“臼(hole)”)取代。这些取代可与减少或消除效应子功能和/或增加血清半衰期的其他取代组合。
[0263]
携带杵的ch2-ch3结构域的一个示例性igg1氨基酸序列进一步组合通过取代l234a/l235a提供的减少或消除的效应子功能(seq id no:10):
[0264][0265]
其中x是赖氨酸(k)或不存在。
[0266]
携带臼的ch2-ch3结构域的一个示例性igg1氨基酸序列进一步组合通过取代l234a/l235a提供的减少或消除的效应子功能(seq id no:11):
[0267][0268]
其中x是赖氨酸(k)或不存在。
[0269]
本发明的含有fc结构域的双抗体分子可包括另外的间插间隔子肽(连接体),通常这种连接体将并入在异源二聚体-促进结构域(例如e-螺旋或k-螺旋)和ch2-ch3结构域之间和/或在ch2-ch3结构域和可变结构域(即vh或vl)之间。典型地,另外的连接体将包括3-20个氨基酸残基并且可任选地包含igg铰链结构域的全部或部分(优选地,igg铰链结构域
的含有半胱氨酸的部分拥有1、2、3或更多个半胱氨酸残基)。可在本发明的双特异性含有fc结构域双抗体分子中采用的示例性连接体包括:gggs(seq id no:12)、ggcggg(seq id no:13)、astkg(seq id no:14)、apsss(seq id no:15)、apssspme(seq id no:16)。另外地,氨基酸ggg或lepkss(seq id no:17)可紧跟着dkthtcppcp(seq id no:18)以形成交替的连接体:gggdkthtcppcp(seq id no:19)和lepkssdkthtcppcp(seq id no:20)。本发明的双特异性含有fc结构域的分子除了连接体之外可并入igg铰链结构域或并入igg铰链结构域代替连接体。示例性铰链结构域包括:来自igg1的epkscdkthtcppcp(seq id no:21)、来自igg2的erkccvecppcp(seq id no:22)、来自igg3的elktplgdtthtcprcpepkscdtpppcprcpepkscdtpppcprcpepks cdtpppcprcp(seq id no:23)、来自igg4的eskygppcpscp(seq id no:24)和eskygppcppcp(seq id no:25),igg4铰链可变体包括稳定的s228p取代(如通过以kabat所示的eu索引所编号)以减少链交换。
[0270]
如在图3中提供的,本发明的含有fc结构域的双抗体可包括四条链。这种双抗体的第一和第三多肽链包含三个结构域:(i)含有vl1的结构域、(ii)含有vh2的结构域、(iii)异源二聚体-促进结构域和(iv)含有ch2-ch3序列的结构域。第二和第四多肽链包含:(i)含有vl2的结构域、(ii)含有vh1的结构域和(iii)异源二聚体-促进结构域,其中异源二聚体-促进结构域促进第一/第三多肽链与第二/第四多肽链的二聚化。代表性四链双特异性含有fc结构域的双抗体的多肽链的通用结构在表1中提供:
[0271][0272]
hpd=异源二聚体-促进结构域
[0273]
如在图4中提供的,本发明的含有fc结构域的双抗体可包括三条多肽链。这种双抗体的第一多肽包含三个结构域:(i)含有vl1的结构域、(ii)含有vh2的结构域和(iii)含有ch2-ch3序列的结构域。这种双抗体的第二多肽包含:(i)含有vl2的结构域、(ii)含有vh1的结构域和(iii)促进异源二聚化和与双抗体的第一多肽链共价结合的结构域。这种双抗体的第三多肽包括ch2-ch3序列。因此,这种双抗体的第一和第二多肽链缔合在一起以形成能够结合第一或第二表位的vl1/vh1表位结合结构域以及能够结合这种表位中的另一者的vl2/vh2表位结合结构域。第一和第二多肽通过其各自第三结构域中涉及半胱氨酸残基的二硫键彼此键合。特别地,第一和第三多肽链彼此复合以形成通过二硫键稳定的fc结构域。代表性三链双特异性含有fc结构域的双抗体的多肽链的通用结构在表2中提供:
[0274][0275]
hpd=异源二聚体-促进结构域
[0276]
ii.dart-a的多肽链
[0277]
dart-a是能够同时地并且特异性地结合至cd123的表位和cd3的表位的序列优化的双特异性双抗体(“cd123 x cd3”双特异性双抗体)(us专利公开号us 2016-0200827、在pct公开号wo 2015/026892中,在al-hussaini,m.等(2016)“targeting cd123 in acute myeloid leukemia using a t-cell-directed dual-affinity retargeting platform,”blood 127:122-131中,在vey,n.等(2017)“a phase 1,first-in-human study of mgd006/s80880(cd123 x cd3)in aml/mds,”2017asco年会,6月2日-6日,2017,芝加哥,il:摘要tps7070中,这些文件中的每个通过引用以其整体并入本文)。发现dart-a相对于相似组成的其他非序列优化的cd123 x cd3双特异性双抗体展现出增强的功能活性,并且因此称为“序列优化的”cd123 x cd3双特异性双抗体。pct申请号pct/us2017/050471描述了用于向患者施用dart-a的优选的给药方案,并且通过引用以其整体并入本文。
[0278]
dart-a具有在图1中示出的通用结构并且包括第一多肽链和第二多肽链。双特异性双抗体的第一多肽链将在n-端至c-端方向上包括n-端、能够结合至cd3的单克隆抗体的轻链可变结构域(vl结构域)(vl
cd3
)、间插连接体肽(连接体1)、能够结合至cd123的单克隆抗体的重链可变结构域(vh结构域)(vh
cd123
)和c-端。这种vl
cd3
结构域的优选的序列是seq id no:26:
[0279][0280]
vl
cd3
的抗原结合结构域包括cdr1 seq id no:27:rsstgavttsnyan、cdr2 seq id no:28:gtnkrap和cdr3 seq id no:29:alwysnlwv。
[0281]
这种连接体1的优选的序列是seq id no:1:gggsgggg。这种vh
cd123
结构域的优选的序列是seq id no:30:
[0282][0283]
vh
cd123
的抗原结合结构域包括cdr1 seq id no:31:dyymk、cdr2 seq id no:32:diipsngatfynqkfkg和cdr3 seq id no:33:shllrasfay。
[0284]
第二多肽链将在n-端至c-端方向上包括n-端、能够结合cd123的单克隆抗体的vl结构域(vl
cd123
)、间插连接体肽(例如连接体1)、能够结合cd3的单克隆抗体的vh结构域(vh
cd3
)和c-端。这种vl
cd123
结构域的优选的序列是seq id no:34:
[0285][0286]
vl
cd123
的抗原结合结构域包括cdr1 seq id no:35:kssqsllnsgnqknylt、cdr2 seq id no:36:wastres和cdr3seq id no:37:qndysypyt。
[0287]
这种vh
cd3
结构域的优选的序列是seq id no:38:
[0288][0289]
vh
cd3
的抗原结合结构域包括cdr1 seq id no:39:tyamn、cdr2 seq id no:40:rirskynnyatyyadsvkd和cdr3 seq id no:41:hgnfgnsyvswfay。
[0290]
本发明的序列优化的cd123 x cd3双特异性双抗体被工程化,使得这种第一和第二多肽通过半胱氨酸残基沿着它们的长度彼此共价结合。这种半胱氨酸残基可引入分离多肽的vl和vh结构域的间插连接体(例如连接体1)中。可替选地并且更优选地,将第二肽(连接体2)引入每条多肽链中,例如,在这种多肽链的n-端至vl结构域或c-端至vh结构域的位置。这种连接体2的优选的序列是seq id no:13:ggcggg。
[0291]
如以上提供的额,异源二聚体的形成可通过进一步工程化这种多肽链以包含相反电荷的多肽螺旋来驱动。因此,在优选的实施方式中,多肽链之一将被工程化以包含“e-螺旋”结构域(seq id no:4:evaalekevaalekevaalekevaalek),而两条多肽链中的另一个将被工程化以包含“k-螺旋”结构域(seq id no:5:kvaalkekvaalkekvaalkekvaalke)。
[0292]
提供哪种螺旋给第一或第二多肽链是不重要的。然而,本发明的优选的序列优化的cd123 x cd3双特异性双抗体dart-a具有第一多肽链,其具有序列(seq id no:42):
[0293][0294]
dart-a链1包括:seq id no:26
─
seq id no:1
─
seq id no:30
─
seq id no:13
─
seq id no:4。编码dart-a链1的多核苷酸是seq id no:43:
[0295]
[0296][0297]
dart-a的第二多肽链具有序列(seq id no:44):
[0298][0299]
dart-a链2包括:seq id no:34
─
seq id no:1
─
seq id no:38
─
seq id no:13
─
seq id no:5。编码dart-a链2的多核苷酸是seq id no:45:
[0300]
[0301][0302]
iii.dart-a的特性
[0303]
如通过人和食蟹猴细胞所测试的,发现dart-a具有同时结合cd123和cd3的能力(表3)。发现提供dart-a会引起t细胞激活、介导母细胞减少、驱动t细胞扩增、诱导t细胞激活以及引起靶癌细胞的重定向杀伤。
[0304][0305]
更特别地,在具有高cd123表达(kasumi-3(ec
50
=0.01ng/ml))、中cd123表达(molm13(ec
50
=0.18ng/ml)和thp-1(ec
50
=0.24ng/ml))和中低或低cd123表达(tf-1(ec
50
=0.46ng/ml)和rs4-11(ec
50
=0.5ng/ml))的靶细胞系中,无论cd3表位结合特异性如何,dart-a被发现在亚-ng/ml范围中以实现50%的最大活性(ec50)所需的浓度展现出强大的重定向杀伤能力。类似地,在具有来自不同供体的t细胞的多个靶细胞系中也观察到了
dart-a的重定向杀伤,并且在不表达cd123的细胞系中没有观察到重定向杀伤活性。结果汇总在表4中。
[0306][0307]
此外,当将人t细胞和肿瘤细胞(molm13或rs4-11)组合并且皮下注入到nod/scidγ(nsg)敲除的小鼠中,molm13肿瘤在0.16、0.5、0.2、0.1、0.02和0.004mg/kg剂量水平被显著地抑制。在molm13模型中,0.004mg/kg和更高的剂量是有效的(active)。与rs4-11模型相比,molm13模型中与抑制肿瘤生长相关的较低dart-a剂量与体外数据一致,其表明molm13细胞比rs4-11细胞具有更高水平的cd123表达,其与molm13细胞中对在体外dart-a介导的细胞毒性增加的敏感性相关。
[0308]
发现dart-a对来自aml患者的原发性aml标本(骨髓单核细胞(bmnc)和外周血单核细胞(pbmc))有活性。用dart-a孵育原发性aml骨髓样品导致白血病细胞群体随时间耗竭,伴随着残余t细胞(cd4和cd8两者)的相伴扩增以及t细胞激活标志物(cd25和ki-67)的诱导。在cd8和cd4 t细胞两者中均观察到颗粒酶b和穿孔素水平的上调。与未处理对照或对照dart相比,用dart-a孵育原发性aml骨髓样品导致白血病细胞群体随时间的耗竭。当计数t细胞(cd8和cd4染色)和测定激活(cd25染色)时,与未处理或对照dart样品相比,dart-a样品中的t细胞扩增并且被激活。还发现dart-a能够介导人和食蟹猴pbmc两者中pdcs细胞的
耗竭,食蟹猴pdcs用仅仅10ng/kg dart-a早在输注后4天的时候耗竭。在dart-a处理的动物中,观察到细胞因子干扰素-γ、tnf-α、il-6、il-5、il-4和il-2的水平未升高。这些数据表明,dart-a介导的靶细胞杀伤是通过颗粒酶b和穿孔素途径介导的。
[0309]
对cd123阴性靶标(u937细胞)或对照dart没有观察到活性,表明观察到的t细胞激活严格取决于靶细胞接合(engagement),并且dart-a对cd3的单价接合不足以触发t细胞激活。
[0310]
总而言之,dart-a是基于抗体的分子,其接合tcr的cd3ε亚基以针对表达cd123(在数种血液系统恶性肿瘤中上调的抗原)的细胞重定向t淋巴细胞。dart-a以相似的亲和力结合人和食蟹猴的抗原,并且重定向来自两种物种的t细胞以杀伤cd123+细胞。用每周递增剂量的dart-a一周输注4或7天的猴子,无论给药方案如何,在治疗起始后72小时示出循环的cd123+细胞耗竭,其在整个治疗的4周中持续。也发生循环t细胞的减少,但是在4天剂量方案在猴子中的随后输注之前恢复到基线,与dart-a介导的调动(mobilization)一致。dart-a施用增加了循环的pd1+,但不增加tim-3+t细胞;此外,对来自处理的猴子的t细胞的离体分析展现出未改变的重定向靶细胞裂解,表明没有衰竭。毒性仅限于dart-a第一次输注后细胞因子的最小瞬时释放,而不是在随后的施用之后、甚至在递增剂量时,并且在红细胞团(mass)中最小可逆的减少伴随着在cd123+骨髓祖细胞中的减少。
[0311]
iv.药物制剂
[0312]
本发明的稳定水性药物制剂(例如dart-a dp制剂)包括共价结合的双抗体,其包含两条、三条或四条多肽链(例如dart-a)和任选地药学上可接受的载体,与水性稳定剂使用。
[0313]
如本文使用的,术语“药学上可接受的载体”用于指由监管机构批准或列于美国药典或另一种公认的药典中适合于递送至动物,更特别地人类的稀释剂、佐剂(例如弗氏佐剂(freund’s adjuvant)(完全和不完全))、赋形剂或媒介物。这种药物载体可为无菌液体,如水和油,其包括石油、动物、植物或合成来源的那些油,如花生油、大豆油、矿物油、芝麻油等。当静脉内施用药物组合物时,水是优选的载体。盐水溶液以及水性葡萄糖和甘油溶液也可用作液体载体,特别是用于注射溶液。合适的药物赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、干脱脂奶粉、甘油、丙烯、乙二醇、水、乙醇等。如果需要,组合物还可包含少量的湿润剂或乳化剂或ph缓冲剂。这些组合物可以采取溶液、混悬液、乳剂、片剂、丸剂、胶囊、散剂、缓释制剂等的形式。
[0314]
如本文使用的,术语“约”指标准偏差
±
10%。
[0315]
如本文使用的,术语“水性”指包含水的溶液。
[0316]
如本文使用的,术语“稳定的”指在药物制剂中或在给药溶液中双抗体的单体纯度,其中所述单体纯度的损失是单体的双抗体的小于约20%、或更优选地损失小于约15%、或更优选地损失小于约10%、或更优选地损失小于约5%、或更优选地损失小于约4%、或更优选地损失小于约3%、或更优选地损失小于约2%、或更优选地损失小于约1%、或更优选地损失小于约0.6%、或更优选地损失小于约0.4%、或更优选地损失小于约0.2%(例如dart-a),其中在制剂中的hmw和/或lmw种类双抗体(例如dart-a)通过se-hplc测量。
[0317]
在药物制剂中的双抗体的单体纯度在25℃维持至少约1个月、在25℃至少约2个月、在约25℃至少约3个月、在2-8℃至少约6个月、在2-8℃至少约12个月、在2-8℃至少约18
个月、在2-8℃至少约24个月、在2-8℃至少约36个月或在2-8℃至少约48个月。优选地,在药物制剂中的双抗体的单体纯度在25℃维持至少约3个月。更优选地,在药物制剂中的双抗体的单体纯度在2-8℃维持至少约48个月。
[0318]
a.优选的水性稳定剂
[0319]
本发明特别地涉及水性稳定剂溶液,其将用作维持双抗体,特别地具有两条、三条或四条多肽链的共价结合的双抗体(例如dart-a)的单体纯度,用作维持蛋白质稳定性,用作减少或防止双抗体(例如dart-a)对容器表面的非特异性吸附和/或用作减少或防止在储存期间在药物制剂中的微生物生长。
[0320]
如本文使用的,术语“水性稳定剂溶液”表示含有水的溶液:
[0321]
(1)用作维持制剂(例如dart-a dp制剂)的双抗体的单体纯度(即用作抑制双抗体的多聚化的程度,如相对于在不存在这种水性稳定剂情况下可观察到的dart-a聚集);或
[0322]
(2)用作维持蛋白质稳定性(即作用抑制亚可见颗粒,如双抗体如dart-a的低分子量的片段,或双抗体如dart-a的高分子量的聚集体,相对于在不存在这种水性稳定剂情况下可观察到的那个或那些);或
[0323]
(3)用作抑制或防止制剂(例如dart-a dp制剂)的双抗体对容器(例如iv袋、iv管等)的表面的非特异性吸附;或
[0324]
(4)用作抑制或防止在其储存期间在双抗体制剂(例如dart-a dp制剂)内的微生物生长(如铜绿假单胞菌(pseudomonas aeruginosa)、金黄色葡萄球菌(staphylococcus aureus)、大肠杆菌(escherichia coli)、白色念珠菌(candida albicans)、巴西曲霉(aspergillus brasiliensis)等的生长)。
[0325]
如本文使用的,如果其存在导致单体的双抗体的单体纯度的损失小于约20%、或更优选地损失小于约15%、或更优选地损失小于约10%、或更优选地损失小于约5%、或更优选地损失小于约4%、或更优选地损失小于约3%、或更优选地损失小于约2%、或更优选地损失小于约1%、或更优选地损失小于约0.6%、或更优选地损失小于约0.4%、或更优选地损失小于约0.2%的单体的双抗体(例如dart-a),则水性稳定剂溶液被认为用作维持双抗体的单体纯度,其中在制剂中的hmw和/或lmw种类的双抗体(例如dart-a)通过se-hplc测量。
[0326]
如本文使用的,如果其存在导致蛋白质稳定性的损失小于约20%、或更优选地损失小于约15%、或更优选地损失小于约10%、或更优选地损失小于约5%、或更优选地损失小于约4%、或更优选地损失小于约3%、或更优选地损失小于约2%、或更优选地损失小于约1%、或更优选地损失小于约0.6%、或更优选地损失小于约0.4%、或更优选地损失小于约0.2%的单体的双抗体(例如dart-a),则水性稳定剂溶液被认为用作维持双抗体的蛋白质稳定性,其中在制剂中的高分子量和/或低分子量的双抗体(例如dart-a)通过se-hplc测量。
[0327]
如本文使用的,如果其存在导致双抗体浓度(例如dart-a浓度)的损失小于约20%、或更优选地损失小于约15%、或更优选地损失小于约10%、或更优选地损失小于约5%、或更优选地损失小于约4%、或更优选地损失小于约3%、或更优选地损失小于约2%、或更优选地损失小于约1%、或更优选地损失小于约0.6%、或更优选地损失小于约0.4%、或更优选地损失小于约0.2%的单体的双抗体,则水性稳定剂溶液被认为用作抑制或防止
制剂的双抗体(例如dart-a dp制剂的dart-a)对容器的表面的非特异性吸附,其中制剂中hmw和/或lmw种类的双抗体(例如dart-a)通过se-hplc测量。
[0328]
如本文使用的,如果其防止或抑制这种微生物生长大于约10%、或更优选地大于约20%、或更优选地大于约30%、或更优选地大于约约40%、或更优选地大于约50%、或更优选地大于约70%、或更优选地大于约90%、或更优选地大于约95%、或更优选地大于约97%、或更优选地大于约98%、或更优选地如果其存在完全防止可检测的微生物生长,则水性稳定剂溶液被认为用作抑制或防止在其储存期间在双抗体制剂(例如dart-a dp制剂)内的微生物生长。
[0329]
1.稳定剂1
[0330]
稳定剂1是被设计为与dart-a dp制剂组合以制备用于静脉内施用的dart-a给药溶液的媒介物。在某些实施方式中,这种施用使用两种输液泵(即注射器泵或移动泵)。
[0331]
在优选的实施方式中,将dart-a dp制剂添加至包括稳定剂1的容器中。混合容器并且将溶液任选地稀释以制备给药溶液。将给药溶液放置在容器中并且附接至用于施用至受试者的装置。
[0332]
在一个实施方式中,特别地是适合于小儿施用的实施方式,这种水性稳定剂,稳定剂1,包括磷酸钠、氯化钠、ps80和ba中的一种或多种。在具体的实施方式中,特别地是适合于小儿施用的实施方式,这种水性稳定剂,稳定剂1,包括磷酸钠、氯化钠、ps80,并且不包括ba。
[0333]
在优选的实施方式中,这种水性稳定剂将具有:
[0334]
(a)约5mm至约30mm并且更优选地约10mm的磷酸钠浓度;
[0335]
(b)约100mm至约300mm并且更优选地约150mm的氯化钠浓度;
[0336]
(c)约7.0mg/ml至约11.0mg/ml并且更优选地约9.0mg/ml的ba浓度;
[0337]
(d)约0.05mg/ml至约0.3mg/ml并且更优选地约0.10mg/ml的ps80浓度;
[0338]
以及
[0339]
(e)约5.5至约7.0的ph并且更优选地约6.0的ph。
[0340]
在进一步优选的实施方式中,这种水性稳定剂将具有:
[0341]
(a)约5mm至约30mm并且更优选地约10mm的磷酸钠浓度;
[0342]
(b)约100mm至约300mm并且更优选地约150mm的氯化钠浓度;
[0343]
(c)约0.05mg/ml至约0.3mg/ml并且更优选地约0.10mg/ml的ps80浓度;
[0344]
以及
[0345]
(d)约5.5至约7.0的ph并且更优选地约6.0的ph。
[0346]
在进一步优选的实施方式中,这种水性稳定剂将另外地包括rha,并且更优选地约0.05mg/ml至约0.15mg/ml并且更优选地约0.10mg/ml的rha浓度。
[0347]
因此,例如,这种水性稳定剂可包括:
[0348]
(a)约5mm至约30mm并且更优选地约10mm的磷酸钠浓度,以及:
[0349]
(1)约150mm的氯化钠浓度;
[0350]
(2)约9.0mg/ml的ba浓度;
[0351]
(3)约0.10mg/ml的ps80浓度;和
[0352]
(4)约6.0的ph;
[0353]
并且将任选地另外地包括以约0.10mg/ml的浓度的rha;或
[0354]
(b)约5mm至约30mm并且更优选地约10mm的磷酸钠浓度,以及:
[0355]
(1)约150mm的氯化钠浓度;和
[0356]
(3)约0.10mg/ml的ps80浓度;和
[0357]
(3)约6.0的ph;或
[0358]
(c)约100mm至约300mm并且更优选地约150mm的氯化钠浓度,以及
[0359]
(1)约10mm的磷酸钠浓度;
[0360]
(2)约9.0mg/ml的ba浓度;
[0361]
(3)约0.10mg/ml的ps80浓度;和
[0362]
(4)约6.0的ph;
[0363]
并且将任选地另外地包括以约0.10mg/ml的浓度的rha;或
[0364]
(d)约100mm至约300mm并且更优选地约150mm的氯化钠浓度,以及
[0365]
(1)约10mm的磷酸钠浓度;
[0366]
(2)约0.10mg/ml的ps80浓度;和
[0367]
(3)约6.0的ph;或
[0368]
(e)约7.0mg/ml至约11.0mg/ml并且更优选地约9.0mg/ml的ba浓度;以及
[0369]
(1)约10mm的磷酸钠浓度;
[0370]
(2)约150mm的氯化钠浓度;
[0371]
(3)约0.10mg/ml的ps80浓度;和
[0372]
(4)约6.0的ph;
[0373]
并且将任选地另外地包括以约0.10mg/ml的浓度的rha;或
[0374]
(f)约0.05mg/ml至约0.3mg/ml并且更优选地约0.10mg/ml的ps80(ps80)浓度;以及
[0375]
(1)约10mm的磷酸钠浓度;
[0376]
(2)约150mm的氯化钠浓度;
[0377]
(3)约9.0mg/ml的ba浓度;和
[0378]
(4)约6.0的ph;
[0379]
并且将任选地另外地包括以约0.10mg/ml的浓度的rha;或
[0380]
(g)约0.05mg/ml至约0.3mg/ml并且更优选地约0.10mg/ml的ps80(ps80)浓度;以及
[0381]
(1)约10mm的磷酸钠浓度;
[0382]
(2)约150mm的氯化钠浓度;
[0383]
(3)约6.0的ph;或
[0384]
(h)约5.5至约7.0的ph并且更优选地约6.0的ph,以及
[0385]
(1)约10mm的磷酸钠浓度;
[0386]
(2)约150mm的氯化钠浓度;
[0387]
(3)约9.0mg/ml的ba浓度;
[0388]
(4)约0.10mg/ml的ps80浓度;和
[0389]
并且将任选地另外地包括以约0.10mg/ml的浓度的rha;或
[0390]
(i)约5.5至约7.0的ph并且更优选地约6.0的ph,以及
[0391]
(1)约10mm的磷酸钠浓度;
[0392]
(2)约150mm的氯化钠浓度;
[0393]
(3)约0.10mg/ml的ps80浓度;或
[0394]
(j)约0.05mg/ml至约0.15mg/ml并且更优选地约0.10mg/ml的rha浓度,以及
[0395]
(1)约10mm的磷酸钠浓度;
[0396]
(2)约150mm的氯化钠浓度;
[0397]
(3)约9.0mg/ml的ba浓度;和
[0398]
(4)约0.10mg/ml的ps80浓度;和
[0399]
(5)约6.0的ph。
[0400]
在优选的实施方式中,这种水性稳定剂将包括约10mm磷酸钠、约150mm氯化钠、约9.0mg/ml ba、约0.10mg/ml ps80和将具有约6.0的ph,以及将另外地包括约0.10mg/ml的rha。
[0401]
在另一个优选的实施方式中,这种水性稳定剂将包括约10mm磷酸钠、约150mm氯化钠、约0.10mg/ml ps80和将具有约6.0的ph。
[0402]
在优选的实施方式中,这种水性稳定剂将足以在约25℃维持共价结合的双抗体(例如cd123 x cd3双抗体)制剂(如dart-a dp制剂)的单体纯度至少约1天、至少约2天、至少约3天、至少约4天或至少约5天。
[0403]
在优选的实施方式中,这种水性稳定剂将足以在约25℃防止或抑制微生物生长至少约1天、至少约2天、至少约3天、至少约4天或至少约5天。最优选地,这种水性稳定剂将足以在25℃防止或抑制微生物生长至少约5天。
[0404]
在优选的实施方式中,这种水性稳定剂溶液具有在2-8℃至少约2年或在25℃至少约3个月的保质期。
[0405]
2.稳定剂2
[0406]
稳定剂2是被设计为与dart-a dp制剂一起用于静脉内施用的稳定剂。在某些实施方式中,这种施用使用单输液泵配置(即注射器或移动泵)。
[0407]
在优选的实施方式中,稳定剂2用于预涂覆与单输液泵一起使用的容器。将dart-a dp制剂添加至预涂覆的容器中并且混合以获得给药溶液。将包括给药溶液的容器附接至用于施用至受试者的装置。
[0408]
在第二实施方式中,这种水性稳定剂,稳定剂2,包括:磷酸钠、ps80、ba和mp。在优选的实施方式中,这种水性稳定剂将具有:
[0409]
(a)约15mm至约25mm并且更优选地约20mm的磷酸钠浓度;
[0410]
(b)约11.5mg/ml至约15.5mg/ml并且更优选地约13.2mg/ml的ba浓度;
[0411]
(c)约3.5mg/ml至约5.5mg/ml并且更优选地约4.25mg/ml的mp浓度;
[0412]
(d)约0.1mg/ml至约0.4mg/ml并且更优选地约0.25mg/ml的ps80浓度;和
[0413]
(e)约7.7至约8.7的ph并且更优选地约8.2的ph。
[0414]
因此,例如,这种水性稳定剂可包括:
[0415]
(a)约15mm至约25mm并且更优选地约20mm的磷酸钠浓度,以及:
[0416]
(1)约13.2mg/ml的ba浓度;
[0417]
(2)约4.25mg/ml的mp浓度;
[0418]
(3)约0.25mg/ml的ps80浓度;和
[0419]
(4)约8.2的ph;
[0420]
或
[0421]
(b)约11.5mg/ml至约15.5mg/ml并且更优选地约13.2mg/ml的ba浓度,以及
[0422]
(1)约20mm的磷酸钠浓度;
[0423]
(2)约4.25mg/ml的mp浓度;
[0424]
(3)约0.25mg/ml的ps80浓度;和
[0425]
(4)约8.2的ph;
[0426]
或
[0427]
(c)约3.5mg/ml至约5.5mg/ml并且更优选地约4.25mg/ml的mp浓度;以及:
[0428]
(1)约20mm的磷酸钠浓度;
[0429]
(2)约13.2mg/ml的ba浓度;
[0430]
(3)约0.25mg/ml的ps80浓度;和
[0431]
(4)约8.2的ph;
[0432]
或
[0433]
(d)约0.1mg/ml至约0.4mg/ml并且更优选地约0.25mg/ml的ps80浓度;以及:
[0434]
(1)约20mm的磷酸钠浓度;
[0435]
(2)约13.2mg/ml的ba浓度;
[0436]
(3)约4.25mg/ml的mp浓度;和
[0437]
(4)约8.2的ph;
[0438]
或
[0439]
(e)约7.7至约8.7的ph并且更优选地约8.2的ph,以及:
[0440]
(1)约20mm的磷酸钠浓度;
[0441]
(2)约13.2mg/ml的ba浓度;
[0442]
(3)约4.25mg/ml的mp浓度;和
[0443]
(4)约0.25mg/ml的ps80浓度。
[0444]
在优选的实施方式中,这种水性稳定剂将包括约20mm磷酸钠、约13.2mg/ml ba、约4.25mg/ml mp和约0.25mg/ml ps80,并且将具有约8.2的ph。
[0445]
在优选的实施方式中,这种水性稳定剂将足以在约25℃维持共价结合的双抗体(例如cd123 x cd3双抗体)制剂(如dart-a dp制剂)的单体纯度至少约1天、2天、至少约3天、至少约4天、至少约5天、至少约6天或至少约7天。
[0446]
在优选的实施方式中,这种水性稳定剂将足以在25℃防止或抑制微生物生长至少约1天、至少约2天、至少约3天、至少约4天、至少约5天、至少约6天或至少约7天。最优选地,这种水性稳定剂将足以在25℃防止或抑制微生物生长至少约7天。
[0447]
在优选的实施方式中,这种水性稳定剂溶液具有在2-8℃至少约2年或在25℃至少约3个月的保质期。
[0448]
3.稳定剂3
[0449]
稳定剂3是被设计为与双特异性双抗体制剂(例如dart-a dp制剂)组合以制备用
于静脉内施用的双特异性双抗体给药溶液(例如dart-a给药溶液)的媒介物。在某些实施方式中,这种施用使用单输液泵配置(即注射器或移动泵)。
[0450]
在一个实施方式中,将双特异性双抗体制剂添加至包括稳定剂3的容器。混合容器并且将溶液任选地稀释以制备给药溶液。将给药溶液放置在容器中并且附接至用于施用至受试者的装置。
[0451]
在另一个实施方式中,特别地为适合于无防腐剂和无缓冲液施用的实施方式,这种稳定剂3包括氯化钠和ps80,并且不包括磷酸钠或ba。
[0452]
在另一个实施方式中,这种水性稳定剂包括:
[0453]
(a)约100mm至约300mm的氯化钠浓度;
[0454]
(b)约0.05mg/ml至约0.3mg/ml的ps80浓度;
[0455]
和
[0456]
(c)约5.5至约7.0的ph。
[0457]
在另一个实施方式中,这种水性稳定剂将包括约150mm氯化钠、约0.10mg/ml ps80,并且将具有约6.0的ph。
[0458]
在具体的实施方式中,这种水性稳定剂将足以在约25℃维持共价结合的双抗体(例如cd123 x cd3双抗体)制剂(如dart-a dp制剂)的单体纯度至少约1天、至少约2天、至少约3天、至少约4天或至少约5天。
[0459]
在某些实施方式中,这种水性稳定剂与抑菌盐水一起使用。
[0460]
在具体的实施方式中,这种水性稳定剂将足以在约25℃防止或抑制微生物生长至少约1天、至少约2天、至少约3天、至少约4天或至少约5天。最优选地,这种水性稳定剂将足以在25℃防止或抑制微生物生长至少约5天。
[0461]
在具体的实施方式中,这种水性稳定剂溶液具有在2-8℃至少约2年或在25℃至少约3个月的保质期。
[0462]
b.双抗体制剂
[0463]
通常,将本发明的双抗体制剂(例如dart-a dp制剂)的组分以单位剂型例如液体制剂在指示活性剂的量的气密地(hermetically)密封的容器如小瓶、安瓿或小袋中混合在一起提供。双抗体制剂(如dart-a dp制剂)优选地以液体溶液提供。这种液体溶液应在2℃和8℃之间保存在其原始容器中,直至准备施用。在通过输注施用双抗体制剂的情况下,它可用包含无菌盐水的容器、袋子或输液瓶进行分配。在通过注射施用双抗体制剂的情况下,可提供盐水,使得成分可在如本文详述的施用之前混合。这种制剂包括预防或治疗有效量的包含两条、三条或四条多肽链的共价结合的双抗体。在一个具体的实施方式中,这种制剂包括预防或治疗有效量的dart-a。
[0464]
v.试剂盒
[0465]
本发明还提供了包括包含双抗体制剂(例如dart-a dp制剂)、稳定剂1、稳定剂2或稳定剂3的一个或多个容器的药物包装或试剂盒。另外地,用于疾病治疗的一种或多种其他预防或治疗剂也可以包括在药物包装或试剂盒中。任选地,与这种容器相关的可以是政府机构制定的调控药物或生物产品的制造、用途或销售的形式的通知(notice),该通知反映了政府结构批准制造、用途或销售用于人类施用。任选地,与这种容器相关的可以是产品标签,其描述了用于制备和施用包括双抗体制剂(例如dart-a dp制剂)、稳定剂1、稳定剂2或
稳定剂3的给药溶液的指示或说明。
[0466]
本发明提供了包括双抗体制剂(例如dart-a dp制剂)、稳定剂1、稳定剂2或稳定剂3并且可用于以上方法的试剂盒。在这种试剂盒中,双抗体制剂(例如dart-a dp制剂)、稳定剂1、稳定剂2或稳定剂3优选地被包装在优选地指示其中包含的组分的量的气密地密封的容器中,如安瓿、小瓶、小袋等中。容器可以以任何药学上可接受的材料的形式,如玻璃、树脂、塑料等。这种试剂盒的双抗体制剂(例如dart-a dp制剂)、稳定剂1、稳定剂2或稳定剂3优选地以液体溶液提供。这种液体溶液应在2℃和8℃之间保存在它们的原始容器中,直至准备施用。这种水性稳定剂溶液具有在2-8℃至少约2年或在25℃至少约3年的保质期。试剂盒可进一步包括在一个或多个容器中的一种或多种其他的用于癌症治疗的预防和/或治疗剂;和/或试剂盒可进一步包括一种或多种结合一种或多种与癌症相关的癌症抗原的细胞毒性抗体。在某些实施方式中,其他的预防或治疗剂是化学治疗剂。在其他实施方式中,预防或治疗剂是生物治疗剂或激素治疗剂。
[0467]
a.特别地适合于与稳定剂1使用的试剂盒
[0468]
本发明特别地涉及试剂盒,特别是与稳定剂1使用的试剂盒,其包括:
[0469]
(a)容器a,其包括包含约0.01mg/ml至约1mg/ml的包含两条、三条或四条多肽链的共价结合的双抗体,如cd123 x cd3双抗体(并且特别是cd123 x cd3双抗体,如dart-a),约5mm至约30mm磷酸钠缓冲液,约100mm至约300mm氯化钠和约0.05mg/ml至约0.3mg/ml ps80的稳定水性药物制剂,其中所述制剂具有约5.5至约7.0的ph;以及
[0470]
(b)(i)容器b,其包括用于稳定所述双抗体的水性稳定剂溶液,所述溶液包括约5mm至约30mm磷酸钠缓冲液,约100mm至约300mm氯化钠,约7.0mg/ml至约11.0mg/ml ba,约0.05mg/ml至约0.3mg/ml ps80,并且所述溶液具有约5.5至约7.0的ph;或
[0471]
(ii)容器b,其包括用于稳定所述双抗体的水性稳定剂溶液,所述溶液包括约5mm至约30mm磷酸钠缓冲液,约100mm至约300mm氯化钠,约0.05mg/ml至约0.3mg/ml ps80,并且所述溶液具有约5.5至约7.0的ph;和任选地,
[0472]
(c)用于组合容器a和容器b的内含物以将组合后的给药溶液施用给需要其的受试者的说明书。
[0473]
在优选的实施方式中,这种容器a将包括约0.1mg/ml的所述双抗体、约10mm磷酸钠、约150mm氯化钠和约0.1mg/ml ps80,并且制剂将具有约6.0的ph。
[0474]
在优选的实施方式中,这种容器b将包括约10mm磷酸钠、约150mm氯化钠、约9.0mg/ml ba、约0.1mg/ml ps80,并且其中所述溶液具有约6.0的ph。
[0475]
在另一个优选的实施方式中,这种容器b将包括约10mm磷酸钠、约150mm氯化钠、约0.1mg/ml ps80,并且其中所述溶液具有约6.0的ph。
[0476]
在进一步优选的实施方式中,这种容器b将进一步包括以约0.05mg/ml至约0.15mg/ml的浓度的rha,并且更优选地将进一步包括以约0.1mg/ml的浓度的rha。
[0477]
b.特别地适合于与稳定剂2使用的试剂盒
[0478]
本发明特别地涉及试剂盒,特别是与稳定剂2使用的试剂盒,其包括:
[0479]
(a)容器a,其包括包含约0.01mg/ml至约1mg/ml的包含两条、三条或四条多肽链的共价结合的双抗体,如cd123 x cd3双抗体(并且特别是cd123 x cd3双抗体,如dart-a)、约5mm至约30mm磷酸钠缓冲液、100mm至300mm氯化钠和约0.05mg/ml至约0.3mg/ml ps80的稳
定水性药物制剂;其中所述制剂具有约5.5至约7.0的ph;以及
[0480]
(b)容器b,其包括用于稳定所述双抗体(例如cd123 x cd3双抗体)的水性稳定剂溶液,所述溶液包括约15mm至约25mm磷酸钠缓冲液、约11.5mg/ml至约15.5mg/ml ba、约3.5mg/ml至约5.5mg/ml mp和约0.1mg/ml至约0.4mg/ml ps80;其中所述溶液具有约7.7至约8.7的ph;和任选地
[0481]
(c)用于组合容器a和容器b的内含物以将组合后的给药溶液施用给需要其的受试者的说明书。
[0482]
在优选的实施方式中,这种容器a将包括约0.1mg/ml的所述双抗体、约10mm磷酸钠、约150mm氯化钠和约0.1mg/ml ps80,并且制剂将具有约6.0的ph。
[0483]
在优选的实施方式中,这种容器b将包括约20mm磷酸钠、约13.2mg/ml ba、约4.25mg/ml mp和约0.25mg/ml ps80。
[0484]
c.特别地适合于与稳定剂3使用的试剂盒
[0485]
本发明特别地涉及试剂盒,特别是与稳定剂3使用的试剂盒,其包括:
[0486]
(a)容器a,其包括包含约0.01mg/ml至约1mg/ml的包含两条、三条或四条多肽链的共价结合的双抗体,如cd123 x cd3双抗体(并且特别是cd123 x cd3双抗体,如dart-a)、约5mm至约30mm磷酸钠缓冲液、约100mm至约300mm氯化钠和约0.05mg/ml至约0.3mg/ml ps80的稳定水性药物制剂,其中所述制剂具有约5.5至约7.0的ph;以及
[0487]
(b)容器b,其包括用于稳定所述双抗体的水性稳定剂溶液,所述溶液包括约100mm至约300mm氯化钠、约0.05mg/ml至约0.3mg/ml ps80,并且所述溶液具有约5.5至约7.0的ph;和任选地,
[0488]
(c)用于组合容器a和容器b的内含物以将组合后的给药溶液施用给需要其的受试者的说明书。
[0489]
在优选的实施方式中,这种容器a将包括约0.1mg/ml的所述双抗体、约10mm磷酸钠、约150mm氯化钠和约0.1mg/ml ps80,并且制剂将具有约6.0的ph。
[0490]
在另一个优选的实施方式中,这种容器b将包括约150mm氯化钠、约0.1mg/ml ps80,并且其中所述溶液具有约6.0的ph。
[0491]
vi.施用方法
[0492]
可提供本发明的dart-a dp制剂用于通过向受试者施用有效量的包括但不限于本发明的cd123 x cd3双特异性双抗体,dart-a的共价结合的双抗体来治疗、预防和改善与疾病、障碍或感染相关的一种或多种症状。在优选的实施方式中,这种药物制剂是基本上纯的(即基本上不含限制其效果或产生不期望的副作用的物质)。在具体的实施方式中,受试者是动物,优选地哺乳动物,如非灵长类(例如牛科动物、马、猫科动物、犬科动物、啮齿动物等)或灵长类(例如,猴子如食蟹猴、人等)。在优选的实施方式中,受试者是人。
[0493]
施用本发明的双抗体制剂(例如dart-a dp制剂)的方法包括但不限于肠胃外施用(例如皮内、肌内、腹膜内、静脉内和皮下)。在具体的实施方式中,静脉内施用本发明的双抗体制剂(例如dart-a dp制剂)。双抗体制剂(例如dart-a dp制剂)可与其他生物活性试剂一起施用。
[0494]
通过输注施用优选地使用输液泵来完成。“输液泵”是医疗设备,其以受控的方式,尤其是在限定的速率并且持续延长的时段将流体递送至患者的身体。输液泵可以机械地供
给动力,但是更优选地是电力地供给动力。一些输液泵是“固定式”输液泵并且设计在患者的床边使用。其他的称为“移动式(ambulatory)”输液泵,设计为便携式或可穿戴式。“注射器”泵是一种输液泵,其中将待递送的流体保持在腔室(例如注射器)的贮液器中并且可移动的活塞用于控制腔室的体积且因此流体的递送。在“弹性体”输液泵中,流体被保持在可伸展的球囊贮液器中,并且来自球囊的弹性壁的压力驱动了流体递送。在“蠕动”输液泵中,一组滚子在一段易弯曲的管上向下挤压,将流体向前推动。在“多通道”输液泵中,可以从多个贮液器以多种速率递送流体。“智能泵”是指配备有计算机控制的流体递送系统以便能够响应不良药物相互作用的风险或当泵的参数设置超出指定限制时发出警报的输液泵。输液泵的实例是众所周知的,并且在例如[匿名的]2002“general-purpose infusion pumps,”health devices 31(10):353-387中和在美国专利号10,029,051、10,029,047、10,029,045、10,022,495、10,022,494、10,016,559、10,006,454、10,004,846、9,993,600、9,981,082、9,974,901、9,968,729、9,931,463、9,927,943等中提供。
[0495]
优选地,本发明的双抗体制剂,特别是dart-a dp制剂通过一个或多个移动泵促进的输注施用,以便患者将在治疗方案期间是活动的。
[0496]
在优选的实施方式中,将双抗体制剂,特别是dart-a dp制剂施用给在约1-7天(例如约1天、约2天、约3天、约4天、约5天、约6天或约7天的方案)或大于7天的治疗方案中,或在约12小时至168小时(例如约12小时、约18小时、约24小时、约30小时、约36小时、约42小时、约48小时、约54小时、约60小时、约66小时、约72小时、约78小时、约84小时、约90小时、约96小时、约102小时、约108小时、约114小时、约120小时、约126小时、约132小时、约138小时、约144小时、约150小时、约156小时、约162小时或约168小时的方案)或在大于168小时的治疗方案中的这种受试者或患者。
[0497]
将有效用于治疗、预防或改善与障碍相关的一种或多种症状的本发明的双抗体制剂的量可通过取决于待施用的双抗体(例如dart-a)的剂量的标准临床技术确定。在给药溶液中待采用的双抗体制剂,特别是dart-a dp制剂的精确量还将取决于施用的路径和情况的严重程度,并且应该根据执业医生的判断和每个患者的情况来决定。有效剂量可从源自体外或动物模型测试系统的剂量反应曲线中外推出来。这种剂量优选地基于接受受试者的体重(kg)确定。
[0498]
本发明的稳定水性药物双抗体制剂和稳定剂特别地用于包括两条、三条或四条多肽链(例如dart-a)的共价结合的双抗体以非常低的浓度(例如5-500ng/kg/天)施用和/或连续施用(例如通过连续输注)超过6-96小时或长达7天。这种实施方式在以下进一步详细提供。
[0499]
a.包括双抗体制剂和稳定剂1的给药溶液的施用
[0500]
包括双抗体制剂(如dart-a dp制剂)和稳定剂1的给药溶液特别地适合于使用两个注射器泵或两个移动泵静脉内施用(图11)。稳定剂1特别地适合于在小儿患者、具有低体重的患者和/或需要较高的总iv流速(例如大于来自两种泵的组合流的约5ml/hr)的患者的治疗中使用。组合双抗体制剂(例如dart-a dp制剂)和稳定剂1以获得双抗体给药溶液(例如dart-a dp给药溶液)。不具有ba的稳定剂1特别地适合于在小儿患者的治疗中使用。这种稳定剂1溶液特别地适合于在与dart-a dp制剂组合以获得dart-a给药溶液后24小时内施用。
[0501]
在这种两泵系统中,使用第一泵(泵1)以将双抗体给药溶液(例如dart-a dp给药溶液)递送至三通阀的一个端口。泵1优选地提供了以1ml/hr或更小的流速并且特别地,以约0.9ml/hr或更小、约0.8ml/hr或更小、约0.7ml/hr或更小、约0.6ml/hr或更小、约0.5ml/hr、约0.4ml/hr、约0.3ml/hr、约0.2ml/hr或约0.1ml/hr或更小的流速的给药溶液。
[0502]
采用第二泵(泵2)以将盐水(0.9%氯化钠注射液usp)递送至三通阀的第二端口(例如,以10ml/hr的流速),以便确保提供的流量(例如10ml/hr)可足以防止静脉阻塞(即大于约5ml/hr的流速)。组合的流静脉内施用给患者。两泵输注配置是需要的,因为双抗体给药溶液(例如dart-a dp给药溶液)的输注速率优选地为1ml/hr或更小并且推荐的流速是大于10ml/hr,以便保持中心静脉导管(cvc)端口打开,没有任何血液凝结。泵2以10ml/hr递送盐水以维持至少10ml/hr的组合流速。
[0503]
治疗剂量的施用将优选地进行至少6小时、至少12小时、至少18小时、至少24小时或至少30小时(例如通过以约0.1ml/小时至约2.0ml/小时的流速连续输注至少24小时施用)。
[0504]
在一个具体的实施方式中,至少约30ng/kg/天至至少约500ng/kg/天的剂量将施用给患者或受试者。这种剂量的施用将优选地持续至少24小时、持续至少36小时、至少48小时、至少60小时、至少72小时、至少84小时、至少96小时或至少7天(即168小时)。因此,例如,双抗体给药溶液(例如dart-a dp给药溶液)的施用可通过以约0.5ml/小时至约6ml/小时的流速连续输注至少48小时、以约0.6ml/小时至约3.0ml/小时的流速连续输注至少96小时、以约0.3ml/小时至约3.0ml/小时的流速连续输注至少96小时、以约0.3ml/小时的流速连续输注至少96小时、以约0.3ml/小时至约3.0ml/小时的流速连续输注至少7天或以约0.5ml/小时的流速连续输注至少7天等。
[0505]
为了产生高剂量浓度,将等分的稳定剂1与等分的的双抗体制剂(例如dart-a dp制剂)混合,以便产生具有约0.1mg/ml双抗体浓度的初始稀释的双抗体制剂(例如稀释的dart-a dp制剂)。然后,该初始稀释的双抗体制剂用另外的稳定剂1进一步稀释1:20(例如5ml的初始稀释的双抗体制剂与95ml的另外的稳定剂1混合)并且轻轻地混合,以产生具有约5000ng/ml双抗体浓度的高剂量双抗体给药溶液(例如dart-a dp给药溶液)。
[0506]
为了产生低剂量浓度,等分的的稳定剂1与等分的双抗体制剂(例如dart-a dp制剂)混合以便产生具有约0.1mg/ml双抗体浓度的初始稀释的双抗体制剂。然后,该初始稀释的双抗体制剂浓度用另外的稳定剂1进一步稀释1:100(例如1ml的初始稀释的双抗体制剂与99ml的另外的稳定剂1混合)并且轻轻地混合,以产生具有约1000ng/ml双抗体浓度的第二稀释的双抗体制剂。然后,该第二稀释的双抗体制剂用另外的稳定剂1进一步稀释1:10(例如10ml的第二稀释的双抗体制剂与90ml的另外的稳定剂1混合)并且轻轻地混合,以产生具有在约100ng/ml或大于约100ng/ml双抗体浓度的低剂量双抗体给药溶液(例如低剂量dart-a dp给药溶液)。
[0507]
b.包括dart-a dp制剂和稳定剂2的dart-a dp给药溶液的施用
[0508]
包括双抗体制剂(例如dart-a dp制剂)和稳定剂2的给药溶液特别地适合于使用单个注射器泵或单个移动泵静脉内施用。图14示出可用于所述给药溶液的施用的移动泵的实例。为了形成使用稳定剂2的给药溶液,40ml的稳定剂2可添加至容器,如250ml盐水袋(标称体积270ml),从而形成310ml的总体积。然后,将所需量的双抗体制剂(例如dart-a dp制
剂)添加至盐水袋以提供最终的给药溶液,其然后可使用单个移动泵施用给患者(图15)。
[0509]
优选地,至少约30ng/kg/天至至少约500ng/kg/天的剂量将施用给患者或受试者。这种剂量的施用将优选地持续至少24小时、至少36小时、至少48小时、至少60小时、至少72小时、至少84小时、至少96小时或至少7天(即168小时)。因此,例如,双抗体给药溶液(例如dart-a dp给药溶液)的施用可通过以约0.5ml/小时至约6ml/小时的流速连续输注至少48小时、以约0.6ml/小时至约3.0ml/小时的流速连续输注至少96小时、以约0.3ml/小时至约3.0ml/小时的流速连续输注至少96小时、以约0.3ml/小时的流速连续输注至少96小时、以约0.3ml/小时至约3.0ml/小时的流速连续输注至少7天或以约0.5ml/小时的流速连续输注至少7天等。
[0510]
历史上,如果特别地需要在96小时内连续输注,以60ml/天的最小流速,防止静脉阻塞所需的最小流速为约2.5ml/hr。然而,已经发现0.3ml/小时至3.0ml/小时之间的流速对于连续施用是有效的,而不会引起静脉阻塞。在需要较低的流速情况下,优选地以约0.3ml/小时至约3ml/小时的流速连续输注至少96小时或至少7天。在可使用较低流速的情况下,特别需要以约0.5ml/小时的流速连续输注至少96小时。可替选地,特别需要以约0.5ml/小时的流速连续输注至少7天(168小时)。
[0511]
c.包括双特异性双抗体制剂和稳定剂3的双特异性双抗体给药溶液的施用
[0512]
包括双特异性双抗体制剂(如dart-a dp制剂)和稳定剂3的给药溶液特别地适合于使用单个注射器泵或单个移动泵静脉内施用。稳定剂3特别地适合于在小儿患者的治疗中或在其他症状的治疗中使用,其中无防腐剂和无缓冲溶液的稳定剂是优选的。图14示出可用于所述给药溶液的施用的移动泵的实例。为了形成给药溶液,稳定剂3可添加至容器,如iv袋,其包含盐水或抑菌盐水袋(标称体积100ml)。抑菌盐水特别地适合于具有稳定剂3的双特异性双抗体的施用。例如,18ml的稳定剂3可添加至包含70ml的抑菌盐水的iv袋,从而形成84ml的总体积。然后,将所需量的双抗体制剂(例如dart-a dp制剂)添加至盐水袋以提供最终的给药溶液,其然后可使用单个移动泵施用给患者(图15)。
[0513]
在某些实施方式中,至少约30ng/kg/天至至少约500ng/kg/天的剂量将施用给患者或受试者。这种剂量的施用将持续至少24小时、持续至少36小时、持续至少48小时、持续至少60小时、持续至少72小时、持续至少84小时、持续至少96小时或持续至少7天(即168小时)。因此,例如,双抗体给药溶液(例如dart-a dp给药溶液)的施用可通过以约0.5ml/小时至约6ml/小时的流速连续输注至少48小时、以约0.6ml/小时至约3.0ml/小时的流速连续输注至少96小时、以约0.3ml/小时至约3.0ml/小时的流速连续输注至少96小时、以约0.3ml/小时的流速连续输注至少96小时、以约0.3ml/小时至约3.0ml/小时的流速连续输注至少7天或以约0.5ml/小时的流速连续输注至少7天等。在需要较低流速的情况下,可使用以约0.3ml/小时至约3ml/小时的流速连续输注至少96小时或至少7天。在可使用较低流速的情况下,可使用以约0.5ml/小时的流速连续输注至少96小时或以约0.5ml/小时的流速连续输注至少7天(168小时)。
[0514]
vii.本发明的组合物的用途
[0515]
本发明的双抗体制剂和稳定剂对施用具有两条、三条或四条多肽链的共价结合的双抗体给需要其的受试者是有用的。特别地,dart-a dp制剂可用于治疗任何与cd123的表达相关的或特征在于cd123的表达的疾病或状况。特别地,dart-a dp制剂可用于治疗血液
系统恶性肿瘤。因此,在没有限制的情况下,dart-adp制剂可在aml、包括cml急变期和与cml相关的阿伯森致癌基因(bcr-abl易位)的cml、mds、b-all、包括里克特综合征和里克特转变的cll、hcl、bpdcn、nhl、mcl、sll、霍奇金淋巴瘤、系统性肥大细胞增生症和伯基特淋巴瘤的诊断或治疗中采用。dart-a可另外地在用于以上所述状况的治疗的药物制造中使用。
[0516]
dart-adp制剂特别地适合于在aml、bpdcn、mds和t-all的治疗中使用。
[0517]
viii.本发明的实施方式
[0518]
本发明涉及以下实施方式e1-e129:
[0519]
e1稳定水性药物制剂,其包括双抗体、磷酸钠缓冲液、氯化钠和聚山梨酯80(ps80)。
[0520]
e2根据e1所述的稳定水性药物制剂,其中磷酸钠具有约5mm至约30mm的浓度。
[0521]
e3根据e2所述的稳定水性药物制剂,其中磷酸钠的浓度是约10mm。
[0522]
e4根据e1-e3中任一项所述的稳定水性药物制剂,其中ps80具有约0.05mg/ml至约0.3mg/ml的浓度。
[0523]
e5根据e4所述的稳定水性药物制剂,其中ps80的浓度是约0.1mg/ml。
[0524]
e6根据e1-e5中任一项所述的稳定水性药物制剂,其中氯化钠具有约100mm至约300mm的浓度。
[0525]
e7根据e6所述的稳定水性药物制剂,其中氯化钠的浓度是约150mm。
[0526]
e8根据e1-e7中任一项所述的稳定水性药物制剂,其中制剂具有约5.5至约7.0的ph。
[0527]
e9根据e8所述的稳定水性药物制剂,其中ph是约6.0。
[0528]
e10根据e1-e11中任一项所述的稳定水性药物制剂,其中制剂包括约10mm磷酸钠、约150mm氯化钠和约0.1mg/mlps80,并且其中制剂具有约6.0的ph。
[0529]
e11根据e1-e11中任一项所述的稳定水性药物制剂,其中双抗体具有约0.01mg/ml至约1mg/ml的浓度。
[0530]
e12根据e1-e11中任一项所述的稳定水性药物制剂,其中双抗体的浓度是约0.1mg/ml。
[0531]
e13根据e1-e12中任一项所述的稳定水性药物制剂,其中双抗体是具有两条、三条或四条多肽链的共价结合的双特异性双抗体。
[0532]
e14根据e1-e13中任一项所述的稳定水性药物制剂,其中双抗体是cd123xcd3双抗体。
[0533]
e15根据e14所述的稳定水性药物制剂,其中cd123xcd3双抗体包括:
[0534]
a)具有seqidno:42的氨基酸序列的第一多肽链;和
[0535]
b)具有seqidno:44的氨基酸序列的第二多肽链;以及其中第一多肽链和第二多肽链通过二硫键彼此共价结合。
[0536]
e16根据e1-e15中任一项所述的稳定水性药物制剂,其中制剂包括约0.1mg/ml的双抗体、约10mm磷酸钠、约150mm氯化钠和约0.1mg/mlps80,并且其中制剂的ph是约6.0。
[0537]
e17根据e1-e16中任一项所述的稳定水性药物制剂,其中溶液在25℃维持双抗体的单体纯度约3个月。
[0538]
e18根据e1-e16中任一项所述的稳定水性药物制剂,其中溶液在2-8℃维持双抗
体的单体纯度约48个月。
[0539]
e19容器,其包括根据e1-e18中任一项所述的稳定水性药物制剂。
[0540]
e20根据e19所述的容器,其中容器是玻璃小瓶。
[0541]
e21密封包装,其包括根据e1-e18中任一项所述的稳定水性药物制剂或根据e19-e20中任一项所述的容器。
[0542]
e22用于稳定双抗体的水性稳定剂溶液,其包括磷酸钠、ps80、苯甲醇(ba)和对羟基苯甲酸甲酯(mp)。
[0543]
e23根据e22所述的水性稳定剂溶液,其中磷酸钠具有约15mm至约25mm的浓度。
[0544]
e24根据e23所述的水性稳定剂溶液,其中磷酸钠的浓度是约20mm。
[0545]
e25根据e21-24中任一项所述的水性稳定剂溶液,其中ba具有约11.5mg/ml至约15.5mg/ml的浓度。
[0546]
e26根据e25所述的水性稳定剂溶液,其中ba的浓度是约13.2mg/ml。
[0547]
e27根据e22-26中任一项所述的水性稳定剂溶液,其中mp具有约3.5mg/ml至约5.5mg/ml的浓度。
[0548]
e28根据e27所述的水性稳定剂溶液,其中mp的浓度是约4.25mg/ml。
[0549]
e29根据e22-28中任一项所述的水性稳定剂溶液,其中ps80具有约0.1mg/ml至约0.4mg/ml的浓度。
[0550]
e30根据e29所述的水性稳定剂溶液,其中ps80的浓度是约0.25mg/ml。
[0551]
e31根据e22-30中任一项所述的水性稳定剂溶液,其中溶液具有约7.7至约8.7的ph。
[0552]
e32根据e31所述的水性稳定剂溶液,其中ph是约8.2。
[0553]
e33根据e22-32中任一项所述的水性稳定剂溶液,其中稳定剂溶液包括约20mm磷酸钠、约13.2mg/mlba、约4.25mg/mlmp和约0.25mg/mlps80,并且其中溶液的ph是约8.2。
[0554]
e34根据e22-e33中任一项所述的水性稳定剂溶液,其中双抗体是具有两条、三条或四条多肽链的共价结合的双特异性双抗体。
[0555]
e35根据e22-e34中任一项所述的水性稳定剂溶液,其中双抗体是cd123xcd3双抗体。
[0556]
e36根据e35所述的水性稳定剂溶液,其中cd123xcd3双抗体包括:
[0557]
(a)具有seqidno:42的氨基酸序列的第一多肽链;和
[0558]
(b)具有seqidno:44的氨基酸序列的第二多肽链;以及其中第一多肽链和第二多肽链通过二硫键彼此共价结合。
[0559]
e37根据e22-e36中任一项所述的水性稳定剂溶液,其中溶液在约25℃维持双抗体的单体纯度约5-7天。
[0560]
e38根据e22-e37中任一项所述的水性稳定剂溶液,其中溶液在约25℃防止微生物生长约5-7天。
[0561]
e39容器,其包括根据e22-e38中任一项所述的水性稳定剂溶液。
[0562]
e40根据e39所述的容器,其中容器是玻璃小瓶。
[0563]
e41密封包装,其包括根据e23-e38中任一项所述的水性稳定剂溶液或根据e39-e40中任一项所述的容器。
[0564]
e42用于稳定双抗体的水性稳定剂溶液,其包括氯化钠和ps80。
[0565]
e43根据e42所述的水性稳定剂溶液,其中氯化钠具有约100mm至约300mm的浓度。
[0566]
e44根据e43所述的水性稳定剂溶液,其中氯化钠的浓度是约150mm。
[0567]
e45根据e42-e44中任一项所述的水性稳定剂溶液,其中ps80具有约0.05mg/ml至约0.3mg/ml的浓度。
[0568]
e46根据e45所述的水性稳定剂溶液,其中ps80的浓度是约0.10mg/ml。
[0569]
e47根据e42-e46中任一项所述的水性稳定剂溶液,其中溶液具有约5.5至约7.0的ph。
[0570]
e48根据e47所述的水性稳定剂溶液,其中ph是6.0。
[0571]
e49根据e42-e48中任一项所述的水性稳定剂溶液,其中溶液包括约150mm氯化钠、约0.1mg/mlps80,并且其中溶液的ph是约6.0。
[0572]
e50根据e42-e49中任一项所述的水性稳定剂溶液,其中双抗体是具有两条、三条或四条多肽链的共价结合的双特异性双抗体。
[0573]
e51根据e42-e50中任一项所述的水性稳定剂溶液,其中双抗体是cd123xcd3双抗体。
[0574]
e52根据e51所述的水性稳定剂溶液,其中cd123xcd3双抗体包括:
[0575]
a)具有seqidno:42的氨基酸序列的第一多肽链;和
[0576]
b)具有seqidno:44的氨基酸序列的第二多肽链;以及其中第一多肽链和第二多肽链通过二硫键彼此共价结合。
[0577]
e53根据e42-e52中任一项所述的水性稳定剂溶液,其中溶液在约25℃维持双抗体的单体纯度约3-5天。
[0578]
e54根据e42-e53中任一项所述的水性稳定剂溶液,其中溶液在约25℃防止微生物生长约3-5天。
[0579]
e55容器,其包括根据e42-e54中任一项所述的水性稳定剂溶液。
[0580]
e56根据e55所述的容器,其中容器是玻璃小瓶。
[0581]
e57密封包装,其包括根据e42-e54中任一项所述的水性稳定剂溶液或根据e55-e56中任一项所述的容器。
[0582]
e58用于稳定双抗体的水性稳定剂溶液,其包括磷酸钠、氯化钠、ps80和ba中的一种或多种。
[0583]
e59根据e58所述的水性稳定剂溶液,其中磷酸钠具有约5mm至约30mm的浓度。
[0584]
e60根据e59所述的水性稳定剂溶液,其中磷酸钠的浓度是约10mm。
[0585]
e61根据e58或e59中任一项所述的水性稳定剂溶液,其中氯化钠具有约100mm至约300mm的浓度。
[0586]
e62根据e61所述的水性稳定剂溶液,其中氯化钠的浓度是约150mm。
[0587]
e63根据e58-e62中任一项所述的水性稳定剂溶液,其中ba具有约7.0mg/ml至约11.0mg/ml的浓度。
[0588]
e64根据e63所述的水性稳定剂溶液,其中ba的浓度是约9.0mg/ml。
[0589]
e65根据e58-e64中任一项所述的水性稳定剂溶液,其中ps80具有约0.05mg/ml至约0.3mg/ml的浓度。
[0590]
e66根据e65所述的水性稳定剂溶液,其中ps80的浓度是约0.10mg/ml。
[0591]
e67根据e58-e66中任一项所述的水性稳定剂溶液,其进一步包括重组人白蛋白(rha)。
[0592]
e68根据e67所述的水性稳定剂溶液,其中rha具有约0.05mg/ml至约0.15mg/ml的浓度。
[0593]
e69根据e68所述的水性稳定剂溶液,其中rha的浓度是约0.10mg/ml。
[0594]
e70根据e58-e69中任一项所述的水性稳定剂溶液,其中溶液具有约5.5至约7.0的ph。
[0595]
e71根据e70所述的水性稳定剂溶液,其中ph是6.0。
[0596]
e72根据e58-e71中任一项所述的水性稳定剂溶液,其中溶液包括:a)约10mm磷酸钠、约150mm氯化钠、约9.0mg/mlba、约0.1mg/mlps80和约0.1mg/mlrha,并且其中溶液的ph是约6.0;或b)约10mm磷酸钠、约150mm氯化钠、约0.1mg/mlps80,并且其中溶液的ph是约6.0。
[0597]
e73根据e58-e72中任一项所述的水性稳定剂溶液,其中双抗体是具有两条、三条或四条多肽链的共价结合的双特异性双抗体。
[0598]
e74根据e58-e73中任一项所述的水性稳定剂溶液,其中双抗体是cd123xcd3双抗体。
[0599]
e75根据e74所述的水性稳定剂溶液,其中cd123xcd3双抗体包括:
[0600]
(a)具有seqidno:42的氨基酸序列的第一多肽链;和
[0601]
(b)具有seqidno:44的氨基酸序列的第二多肽链;以及其中第一多肽链和第二多肽链通过二硫键彼此共价结合。
[0602]
e76根据e58-e76中任一项所述的水性稳定剂溶液,其中溶液在约25℃维持双抗体的单体纯度约3-5天。
[0603]
e77根据中任一项所述的水性稳定剂溶液e58-e76,其中溶液在约25℃防止微生物生长约3-5天。
[0604]
e78容器,其包括根据e58-e77中任一项所述的水性稳定剂溶液。
[0605]
e79根据e78所述的容器,其中容器是玻璃小瓶。
[0606]
e80密封包装,其包括根据e58-e77中任一项所述的水性稳定剂溶液或根据e78-e79中任一项所述的容器。
[0607]
e81试剂盒,其包括:
[0608]
(a)容器a,其包括稳定水性药物制剂,制剂包括约0.01mg/ml至约1mg/ml的双抗体、约5mm至约30mm磷酸钠缓冲液、约100mm至约300mm氯化钠和约0.05mg/ml至约0.3mg/mlps80,并且制剂具有约5.5至约7.0的ph;以及
[0609]
(b)容器b,其包括用于稳定双抗体的水性稳定剂溶液,溶液包括约15mm至约25mm磷酸钠缓冲液、约11.5mg/ml至约15.5mg/mlba、约3.5mg/ml至约5.5mg/mlmp和约0.1mg/ml至约0.4mg/mlps80,并且溶液具有约7.7至约8.7的ph;以及
[0610]
(c)用于组合容器a和b的内含物以将组合后的溶液施用给需要其的受试者的说明书。
[0611]
e82试剂盒,其包括:
[0612]
(a)容器a,其包括稳定水性药物制剂,制剂包括约0.01mg/ml至约1mg/ml的双抗体、约5mm至约30mm磷酸钠缓冲液、约100mm至约300mm氯化钠和约0.05mg/ml至约0.3mg/mlps80,并且制剂具有约5.5至约7.0的ph;以及
[0613]
(b)(i)容器b,其包括用于稳定双抗体的水性稳定剂溶液,溶液包括约5mm至约30mm磷酸钠、约100mm至约300mm氯化钠、约7.0mg/ml至约11.0mg/mlba、约0.05mg/ml至约0.15mg/mlps80,并且溶液具有约5.5至约7.0的ph;或
[0614]
(ii)容器b,其包括用于稳定双抗体的水性稳定剂溶液,溶液包括约5mm至约30mm磷酸钠、约100mm至约300mm氯化钠、约0.05mg/ml至约0.15mg/mlps80,并且溶液具有约5.5至约7.0的ph;或
[0615]
(iii)容器b,其包括用于稳定双抗体的水性稳定剂溶液,溶液包括约100mm至约300mm氯化钠、约0.05mg/ml至约0.15mg/mlps80,并且溶液具有约5.5至约7.0的ph;和任选地,
[0616]
(c)用于组合容器a和b的内含物以将组合后的溶液施用给需要其的受试者的说明书。
[0617]
e83根据e81或e82中任一项所述的试剂盒,其中双抗体是具有两条、三条或四条多肽链的共价结合的双特异性双抗体。
[0618]
e84根据e81-e83中任一项所述的试剂盒,其中双抗体是cd123xcd3双抗体。
[0619]
e85根据e84所述的试剂盒,其中双抗体包括:
[0620]
a)具有seqidno:42的氨基酸序列的第一多肽链;和
[0621]
b)具有seqidno:44的氨基酸序列的第二多肽链;以及其中第一多肽链和第二多肽链通过二硫键彼此共价结合。
[0622]
e86根据e81-e85中任一项所述的试剂盒,其中容器a中的稳定水性药物制剂包括约0.1mg/ml的双抗体、约10mm磷酸钠、约150mm氯化钠和约0.1mg/mlps80,并且其中制剂具有约6.0的ph。
[0623]
e87根据e81或e83-e86中任一项所述的试剂盒,其中容器b中的水性稳定剂溶液包括约20mm磷酸钠、约13.2mg/mlba、约4.25mg/mlmp和约0.25mg/mlps80,并且其中溶液具有约8.2的ph。
[0624]
e88根据e82-e86中任一项所述的试剂盒,其中容器b中的水性稳定剂溶液包括:i)约10mm磷酸钠、约150mm氯化钠、约9.0mg/mlba、约0.1mg/mlps80,并且其中溶液具有约6.0的ph;或
[0625]
ii)约10mm磷酸钠、约150mm氯化钠、约0.1mg/mlps80,并且其中溶液具有约6.0的ph;或
[0626]
(iii)约150mm氯化钠、约0.1mg/mlps80,并且其中所述溶液具有约6.0的ph。
[0627]
e89根据e82-e86中任一项所述的试剂盒,其中水性稳定剂溶液进一步包括以约0.05mg/ml至约0.3mg/ml的浓度的rha。
[0628]
e90根据e89所述的试剂盒,其中rha的浓度是约0.1mg/ml。
[0629]
e91根据e81-e90中任一项所述的试剂盒,其中受试者是人患者。
[0630]
e92根据e81-e91中任一项所述的试剂盒,其中容器a和容器b是玻璃小瓶。
[0631]
e93密封包装,其包括试剂盒和任选地用于根据e81-e92中任一项所述的试剂盒
的储存和/或使用的说明书。
[0632]
e94施用双抗体给需要其的受试者的方法,其包括使用根据e81、e83-e85、e87或e91-e93中任一项所述的试剂盒,其中容器b的水性稳定剂溶液包括磷酸钠、ps80、ba、mp,并且具有约7.7至约8.7的ph;
[0633]
以及其中在方法中:
[0634]
(a)将容器b的水性稳定剂溶液放置在容器c中并且混合;
[0635]
(b)将容器a的稳定水性药物制剂放置在容器c中并且混合以获得给药溶液;
[0636]
(c)将包含给药溶液的容器c附接至用于施用至受试者的装置。
[0637]
e95根据e94所述的方法,其中容器c包括用于静脉内输注的盐水。
[0638]
e96施用双抗体给需要其的受试者的方法,其包括使用根据e82-e86或e88-e93中任一项所述的试剂盒,其中容器b的水性稳定剂溶液包括磷酸钠、氯化钠、ps80和ba中的一种或多种,和任选地rha,并且具有约5.5至约7.0的ph;
[0639]
以及其中在方法中:
[0640]
(a)将容器a的稳定水性药物制剂放置在容器b的水性稳定剂溶液中并且混合以获得给药溶液;
[0641]
(b)任选地稀释给药溶液;
[0642]
(c)将给药溶液放置在容器c中;以及
[0643]
(d)将包含最终的给药溶液的容器c附接至用于施用至受试者的装置。
[0644]
e97根据e96所述的方法,其中容器c包括用于静脉内输注的盐水或抑菌盐水。
[0645]
e98根据e94-e97中任一项所述的方法,其中施用是通过输液泵。
[0646]
e99根据e94-e98中任一项所述的方法,其中施用是移动的。
[0647]
e100根据e94-e98中任一项所述的方法,其中装置是单个移动泵。
[0648]
e101根据e94-e98中任一项所述的方法,其中装置是双移动泵。
[0649]
e102根据e94-e98中任一项所述的方法,其中装置是注射器泵。
[0650]
e103根据e94-e102中任一项所述的方法,其中通过连续输注至少约24小时施用。
[0651]
e104根据e94-e102中任一项所述的方法,其中通过连续输注至少约48小时施用。
[0652]
e105根据e94-e102中任一项所述的方法,其中通过连续输注至少约96小时施用。
[0653]
e106根据e94-e102中任一项所述的方法,其中通过连续输注至少约7天施用。
[0654]
e107根据e94-e106中任一项所述的方法,其中施用以约0.10ml/小时至约2.5ml/小时的流速发生。
[0655]
e108根据e94-e106中任一项所述的方法,其中施用以约0.5ml/小时至约10.0ml/小时的流速发生。
[0656]
e109根据e94-e102中任一项所述的方法,其中通过以约0.1ml/小时至约2.0ml/小时的流速连续输注至少24小时施用。
[0657]
e110根据e94-e102中任一项所述的方法,其中通过以约0.5ml/小时至约6ml/小时的流速连续输注至少48小时施用。
[0658]
e111根据e94-e102中任一项所述的方法,其中通过以约0.6ml/小时至约3.0ml/小时的流速连续输注至少96小时施用。
[0659]
e112根据e94-e102中任一项所述的方法,其中通过以约0.3ml/小时至约3.0ml/
小时的流速连续输注至少96小时施用。
[0660]
e113根据e94-e102或e112中任一项所述的方法,其中通过以约0.5ml/小时的流速连续输注至少96小时施用。
[0661]
e114根据e94-e102中任一项所述的方法,其中通过以约0.3ml/小时至约3.0ml/小时的流速连续输注至少7天施用。
[0662]
e115根据e94-e102或e114中任一项所述的方法,其中通过以约0.5ml/小时的流速连续输注至少7天施用。
[0663]
e116根据e94-e115中任一项所述的方法,其中流速防止受试者的静脉阻塞。
[0664]
e117根据e94-e116中任一项所述的方法,其中cd123xcd3双抗体以选自30-500ng/kg/天组成的组的治疗剂量施用给受试者。
[0665]
e118根据e94-e95、e97-e99、e102-e117中任一项所述的方法,其中给药溶液包括40ml的水性稳定剂溶液。
[0666]
e119根据e94-e95、e97-e99、e102-e118中任一项所述的方法,其中给药溶液包括约0.03mg/ml至约0.04mg/mlps80、约1.7mg/ml至约2.1mg/mlba和约0.55mg/ml至约0.7mg/mlmp。
[0667]
e120根据e96-e118中任一项所述的方法,其中给药溶液包括约100mm至约300mm氯化钠、约0.05mg/ml至约0.15mg/mlps80,并且溶液具有约5.5至约7.0的ph。
[0668]
e121根据e94-e120中任一项所述的方法,其中患者是人受试者。
[0669]
e122治疗血液系统恶性肿瘤的方法,其包括根据e94-e121任一项所述的施用方法或使用根据e81-e92中任一项所述的试剂盒施用双抗体给需要其的受试者。
[0670]
e123根据e81-e92中任一项所述的试剂盒用于血液系统恶性肿瘤的治疗的用途。
[0671]
e124根据e122所述的方法或根据e123所述的用途,其中血液系统恶性肿瘤选自由以下组成的组:急性髓细胞白血病(aml)、包括cml急变期和与cml相关的阿伯森致癌基因(bcr-abl易位)的慢性髓细胞白血病(cml)、脊髓发育不良综合征(mds)、急性b淋巴细胞白血病(b-all)、急性t淋巴细胞白血病(t-all)、包括cll的里克特综合征和里克特转变的慢性淋巴细胞白血病(cll)、毛细胞白血病(hcl)、母细胞性浆细胞样树突状细胞肿瘤(bpdcn)、包括套细胞淋巴瘤(mcl)和小淋巴细胞淋巴瘤(sll)的非霍奇金淋巴瘤(nhl)、霍奇金淋巴瘤、系统性肥大细胞增生症和伯基特淋巴瘤。
[0672]
e125根据e124所述的方法或所述的用途,其中血液系统恶性肿瘤是aml。
[0673]
e126根据e124所述的方法或所述的用途,其中血液系统恶性肿瘤是bpdcn。
[0674]
e127根据e124所述的方法或所述的用途,其中血液系统恶性肿瘤是mds。
[0675]
e128根据e124所述的方法或所述的用途,其中血液系统恶性肿瘤是t-all。
[0676]
e129根据e122-e128中任一项所述的方法或所述的用途,其中受试者是人受试者。
[0677]
实施例
[0678]
现在已经总体上描述了本发明,通过参考下列实施例将更容易理解本发明,下列实施例通过举例提供并且不意欲限制本发明,除非另有说明。
[0679]
实施例1
[0680]
包含cd123xcd3双抗体的稳定水性药物制剂的开发
[0681]
如以上公开的,cd123 x cd3双抗体,dart-a是能够同时结合至cd123和cd3的双特异性单价双抗体。dart-a包括具有seq id no:42的氨基酸序列的第一多肽链和具有seq id no:44的氨基酸序列的第二多肽链,并且具有图1中示出的通用结构。开发包括dart-a的稳定水性药物制剂,dart-a dp制剂作为小瓶中的液体制剂。
[0682]
1.1.dart-a dp制剂的开发
–
研究设计和结果
[0683]
在dart-a dp制剂的开发期间使用的分析测试方法在以下表5中列出。
[0684][0685]
进行了三个研究以提供用于毒理学动物研究和临床应用的dart-a dp制剂。这些研究评估了以下制剂属性:
[0686]
(1)表面活性剂水平对dart-a稳定性和聚集的影响
[0687]
(2)赋形剂和蛋白质浓度对dart-a聚集和颗粒形成的影响
[0688]
(3)通过质谱分析技术的dart-a肽图
[0689]
1.2.表面活性剂水平对dart-a稳定性和降解的影响
[0690]
为了将dart-a配制成0.1mg/ml浓度,将dart-a稀释在制剂缓冲液(ph 6.1的10mm磷酸钠和150mm氯化钠)中。观察到初始的亚可见颗粒形成和溶液浊度是可以接受的。然而,在运输后一个月,观察到浊度增加和超过最初的释放规格的亚可见颗粒水平升高。在具有和不具有ps80(0.1mg/ml)的两个开发批次上进行了强制搅拌研究,以确定颗粒形成和外观变化的原因。在强制搅拌研究期间,将dart-a样品保持在2-8℃,并且以600rpm搅拌超过24小时。
[0691]
图5a-5b示出含有ps80的制剂在24小时搅拌后示出dart-a的低浊度。当不存在ps80时,dart-a dp制剂的浊度增加三到五倍。在亚可见颗粒计数数据中也观察到了这种趋势,其中与包含ps80的溶液比较,无ps80的双抗体制剂具有五至六倍高的≥10μm的颗粒数。
[0692]
如图6所示,使用差示扫描量热法(dsc)评估了包含ps80的制剂的热稳定性。图6示出在存在和不存在ps80的情况下类似的dsc分布。ps80的存在不会影响dart-a dp制剂的热稳定性。
[0693]
为了进一步表征在ps80存在下的dart-a相容性,进行了加速应力研究,以确定
dart-a聚集是否是温度依赖性的,以及聚集是否影响dart-a效力。在研究中,将具有和不具有ps80的dart-a在25
±
2℃和40
±
2℃孵育,并且与5
±
3℃保存的样品进行比较。加速应力研究还评估了残留的过氧化物(1.0μeq/l)对dart-a蛋白质稳定性的影响,因为聚山梨酯经历导致过氧化物形成的自氧化,其可潜在地导致蛋白质的氧化降解。研究的结果在以下表6-8中呈现。
[0694][0695]
表6示出在5
±
3℃、25
±
2℃和40
±
2℃储存六周后,ps80的添加减少了hmw形成。在40℃孵育六周后,所有三个样品示出单体dart-a蛋白主峰百分比的轻微下降。这些下降与hmw和lmw种类两者的轻微增加有关。
[0696][0697]
表7显示对于pbs或pbs+ps80制剂,在25
±
2℃或40
±
2℃孵育后溶液浊度没有变化。然而,含有过氧化氢的制剂示出在40
±
2℃增加的浊度。对于所有三种制剂,在40
±
2℃孵育六周产生蛋白质浓度的类似下降。
[0698][0699]
表8示出当在5
±
3℃和25
±
2℃两者孵育时,在所有三种制剂中电荷变体无显著差异。在40
±
2℃孵育产生酸性变体的显著增加。然而,在所有三种制剂中的这种增加是一致
的。
[0700]
加速应力稳定性研究的结果暗示,当暴露于典型的储存或加速应力温度时,ps80确实影响蛋白质稳定性。强制搅拌研究的结果证实了这一点,其示出ps80的存在限制了在典型运输和处理期间可发生的制剂中dart-a的浊度和亚可见颗粒的增加。基于这些结果,将0.1mg/ml ps80添加至dart-a dp制剂(在ph 6.0,10mm磷酸钠和150mm氯化钠)。
[0701]
1.3.长期储存对dart-a结构和功能的影响
[0702]
在第二项研究中,在5
±
3℃和25
±
2℃的长期储存期间评估了以0.1mg/ml的浓度的dart-a制剂(10mm磷酸钠、150mm nacl和0.1mg/ml ps80缓冲液),以确定制剂如何维持蛋白质结构和功能。dart-a制剂组成在以下表9中列出。
[0703][0704]
依照建议的最终临床表现(在5ml i型硼硅酸盐玻璃小瓶中5ml溶液体积)将dart-a制剂装入小瓶,并且依照以下表10中的稳定性矩阵(stability matrix)倒置保存。
[0705][0706]
150mm nacl+ps80制剂中0.1mg/ml dart-a的稳定性结果在以下表11和表12中示出。
[0707][0708]
a.se-hplc:hmw%=高分子量种类%,lmw%=低分子量种类%
[0709]
以上结果示出在推荐的5
±
3℃的温度储存48个月后不影响dart-a的结构和功能。如在亚可见颗粒、se-hplc和还原/非还原ce-sds结果中观察到的,制剂限制了dart-a的聚
集和降解。如通过cd3和cd123结合结果所证实的,dart-a效力没有显著地变化。
[0710][0711]
b.se-hplc:hmw%=高分子量种类%,lmw%=低分子量种类%
[0712]
以上结果示出在25
±
2℃的加速温度孵育六个月后,dart-a制剂仍符合亚可见颗粒计数的美国药典(usp)规范。此外,se-hplc聚集和ce-sds降解分布与在5
±
3℃保存的dart-a相比具有优势。
[0713]
基于组合的稳定性结果,得出的结论是,在推荐的存储温度(5
±
3℃)48个月和在加速温度(25
±
2℃)条件下三个月10mm磷酸钠、150mm nacl和0.1mg/ml ps80缓冲液提供可接受的蛋白质稳定性。因此,为临床和商业dart-a dp制剂选择ph 6.0的10mm磷酸钠、150mm氯化钠、0.1mg/ml ps80缓冲液。
[0714]
dart-a dp制剂是澄清至稍微乳白色、无色至浅黄色或浅棕色的无菌、稳定水性药物溶液,其中由在ph 6.0的约5mm至约15mm磷酸钠、约100mm至约200mm氯化钠和约0.05mg/ml至约0.3mg/ml ps80组成的缓冲液中dart-a浓度为约0.01mg/ml至约1mg/ml。
[0715]
1.4.通过肽图的dart-a稳定性分析
[0716]
通过比较参考标准品与在2-8℃保存24个月的dart-a dp制剂,进一步用液相色谱偶联的电喷雾电离质谱法(lc-esims)评估配制的dart-a(即dart-a dp制剂)的稳定性。将样品作为完整分子及其胰蛋白酶肽分析。单个测试结果总结如下。
[0717]
1.5.完整dart-a
[0718]
通过使多电荷离子在其esi质谱中解卷积获得以道尔顿(da)表示质量的完整dart-a。参考标准品和老化的制剂光谱中的主要组分分别示出测量的质量为58,897da和58,898da。这些结果与58,898da的理论质量紧密地匹配,该理论质量来源于dart-a的氨基酸序列以及n-端谷氨酰胺向焦谷氨酸转化。来自每个样品的光谱中第二个观察到的组分具有小于主要组分的128da的质量;这与c-端赖氨酸的剪切(clipping)相符。esi质谱图中的次要组分可能是由于加合物(adduct)离子形成和其他修饰。通过胰蛋白酶肽图进一步研究了对dart-a的这些修饰。
[0719]
1.6.胰蛋白酶肽图
[0720]
在这项研究中,将dart-a消化成胰蛋白酶肽,以检查对dart-a的潜在修饰。用前体离子和片段离子的精确质量测量鉴定了肽及其在氨基酸水平的修饰。结果在以下图7中示出。图7中的结果示出除了n-端pyroe形成和c-端赖氨酸剪切以外,肽图揭示的如脱酰胺和氧化的其他修饰的水平对于这两个样品都是较小的。老化的dart-a在类型和它们相应的修饰程度方面与其参考标准品一致。
[0721]
1.7.dart-a dp制剂长期稳定性
[0722]
通过elisa结合、se-hplc和ce-sds评估了在2-8℃保存48个月的dart-a dp制剂的稳定性,以鉴定可影响dart-a功能性的单体的任何减少和/或hmw聚集体和/或lmw降解产品的形成。这些研究的结果绘制在图8a-8d中,并且示出dart-a dp制剂在推荐的储存条件下长期储存展现出可接受的物理稳定性。基于迄今为止进行的研究、质谱型表征和gmp批次稳定性,推荐将dart-a dp制剂用于临床研究和商业化。
[0723]
实施例2
[0724]
用于dart-a dp制剂的施用的水性稳定剂溶液的开发
[0725]
如上所述,开发了用于稳定dart-a的优选的水性稳定剂溶液作为小瓶中的液体制剂。然而,dart-a在极低的浓度下是有效的(active),因此dart-a dp制剂在施用之前被稀释。为了这个目的,以定制的稳定剂溶液稀释dart-a dp制剂,以抑制在剂量制备和作为连续24小时静脉内(iv)输注施用dart-a dp制剂的施用期间dart-a与注射器或移动盒和iv管的非特异性结合。
[0726]
制备了用于稳定dart-a的第一稳定水性稳定剂溶液,稳定剂1,并且其由ph 6.0的10mm磷酸钠、150mm氯化钠、0.1mg/ml ps80、9.0mg/ml ba和0.1mg/ml rha组成。稳定剂1设计为与dart-a dp制剂组合用于使用两个注射器泵或两个移动泵静脉内施用。
[0727]
评估了对dart-a dp制剂和稳定剂1的改进以使得能够单个泵施用。如以下详细地描述,基于可替代的防腐剂筛选研究,开发了新型的水性稳定剂溶液,稳定剂2,以确定防腐剂的有效浓度,其会:(a)被认为在提议的kvo(保持静脉通畅)流速是安全的,(b)抑制剂量制备的溶液中的微生物生长和(c)不影响dart-a dp制剂的稳定性。
[0728]
2.1稳定剂1和稳定剂2溶液的开发-研究设计和结果
[0729]
在以下表13中列出了在稳定剂1和稳定剂2的开发期间使用的分析测试方法的列表。
[0730]
[0731]aelisa定量测定是可以定量dart-a的ng/ml浓度的测定。
[0732]
*
以下实施例5中详述了所有方法。
[0733]
用于稳定剂的制剂开发如在图9-10中描述的阶段中进行。
[0734]
稳定剂1由ph 6.0的10mm磷酸钠、150mm氯化钠、0.1mg/ml ps80、9.0mg/ml ba和0.1mg/ml rha组成,并且被设计为与dart-a dp制剂组合用于使用两个注射器泵或两个移动泵静脉内施用。ba用于在储存期间抑制微生物生长以用于连续施用。然而,ba可导致蛋白质聚集和颗粒形成的增加。为了抑制潜在的颗粒形成和蛋白质吸附至施用流经路径表面,将ps80和rha添加至稳定剂溶液。为了从两泵施用配置过渡到单个移动泵配置,还需要评估潜在的阻断剂和可替代的防腐剂的另外的制剂开发研究。这些研究在以下进一步详细地描述。
[0735]
2.2.阻断剂的选择
[0736]
阶段1稳定剂1溶液包含0.1mg/ml rha以限制非特异性dart-a蛋白结合至施用组分的表面。rha是常见的阻断剂,其在蛋白质添加之前通过结合至反应位点起作用。为了降低商品的制造成本(cog),评估了表面活性剂ps80(其已经在溶液中)作为取代的阻断剂。图9总结了为了评估单独ps80在抑制颗粒形成和吸附的有效性进行的研究。
[0737]
在该研究期间测试了四个水平的ps80,以评估表面活性剂的阻断活性。简而言之,将测试稳定剂溶液(ph 6.0的10mm磷酸钠、150mm氯化钠、1.6mg/ml ba和0、0.05、0.1或0.2mg/ml ps80)添加至含有生理盐水的iv袋。充分混合后,将dart-a dp制剂添加至相同的iv袋。将含有给药溶液的袋在25
±
2℃孵育,并且在0、24小时和48小时(最长的建议施用时间)收集样品。使用flr/se-hplc分析每个样品,并且使用elisa以量化dart-a蛋白质回收率进行验证。研究结果在以下表14中可见。
[0738][0739][0740]
根据以上elisa定量测定结果,在48小时后,利用0.01%ps80和1.6mg/ml ba的dart-a回收率高于88%。这些结果在该类型生物测定的典型变化范围内(50%-150%)。另外,由于回收率高于91%,因此苯甲醇的不存在对ps80抑制蛋白质吸附的能力没有影响。这些结果表明0.05mg/ml ps80或0.1mg/ml ps80的水平提供了足够的阻断活性。
[0741]
2.3.能够单个泵施用的防腐剂选择研究
[0742]
稳定剂1溶液包含0.9%ba以用作防腐剂。在从两泵施用至单泵施用的变化中,ba浓度理想地降低以满足患者安全标准。这些标准规定,ba的最大允许的每日摄入量理想地不应超过5mg/kg。使用这些标准并且对于各种临床情况(即低的患者体重,保持静脉通畅流速)规划,如下确定单个泵施用的目标ba浓度。
[0743]
·
5mg/kg/天是最大允许的ba剂量
[0744]
·
假设40kg患者,ba每天的最大量:200mg
[0745]
·
泵递送以保持静脉通畅:5ml/hr
[0746]
·
希望在24小时内连续输注
→
最小流速是120ml/天
[0747]
·
溶液中最小ba浓度是1.7mg/ml(200mg/120ml)或0.17%
[0748]
在一系列研究中评估了稳定剂防腐剂的选择。图10总结了进行的不同研究,并且以下更详细地描述每个研究。
[0749]
2.4.较低苯甲醇浓度的防腐剂有效性
[0750]
在该研究中,评估了五种不同的ba浓度(在以下表15中列出),以确定在48小时内抑制微生物生长所需的最低ba浓度。
[0751][0752][0753]
模拟了单个移动泵剂量制备方案和施用配置。对于该研究,在添加dart-a dp制剂之前,组合盐水、ps80、rha和ba。在分装以形成最终制剂之前,合并十个小瓶的重构的(reconstituted)铜绿假单胞菌(pseudomonas aeruginosa)(atcc 9027)。在制剂制备步骤完成后,从混合瓶中收集t0样品。将相应的泵盒填充剩余的稳定剂溶液,并且在32
±
2℃孵育。在样品盒内在24小时和48小时时间点充分地混合,以确保在样品采集之前均匀的铜绿假单胞菌悬浮液。收集后,立即对样品进行生物负荷测试。微生物挑战测试结果在以下表16中可见。
[0754][0755]
tntc:数量太多无法计数,代表显著的微生物生长
[0756]
以上结果表明,对于铜绿假单胞菌,ba的有效防腐剂浓度位于0.24%和0.17%之间。然而,在建议的单个泵施用配置下,对于40kg患者该有效的ba水平仍高于平均每日摄入量。结果还示出,稳定剂溶液中rha的存在不影响微生物生长,且将其从稳定剂1溶液中去除不改变防腐剂的有效性。
[0757]
2.5.可替选的防腐剂评估研究
[0758]
在该研究中,三种防腐剂(ba、间甲酚和mp)通过比较它们在加速应力条件(40
±
2℃)下对dart-a稳定性和聚集的影响来评估。为了形成最终的制剂,根据重量分析组合各个组分。稳定剂溶液的最终组成在以下表17中列出。
[0759][0760]
将每种稳定剂溶液等分至玻璃小瓶中,在40
±
2℃孵育,并且在0、1和2周后分析。每种溶液的结果在表18中可见。
[0761][0762][0763]
以上结果示出在40
±
2℃孵育两周后,在所有三种稳定剂溶液内,ph和渗透压保持恒定,而可见颗粒的数量增加。然而,与包含ba和mp的溶液相比,含有间甲酚的溶液包含更多的可见和亚可见颗粒,并且由于≥10μm的颗粒数量,不符合usp规范。此外,含有mp的溶液在两周后示出dart-a蛋白质聚集增加,而在其他两种溶液中没有观察到。基于以上研究,包含ba的目标水平(≤0.17%)和mp的低水平(≤0.17%)的组合通过评价它们对dart-a蛋白质聚集的影响而进一步评估。以类似于单试剂研究的方式建立溶液组合,其中根据重量分析组合各个组分。所测试组合的最终组成以下表19中列出。
[0764][0765]
所有溶液在5
±
3℃和25
±
2℃测试,并且在第0、1、3、5和7天分析。每种溶液的结果在以下表20和表21中可见。
[0766]
[0767][0768]
**ccn:透明、无色、无可见颗粒ccv:透明、无色、极少可见颗粒;ccf:透明、无色、很少的可见颗粒;ir:无效的结果
[0769]
[0770][0771]
**ccn:透明、无色、无可见颗粒;ccv:透明、无色、极少可见颗粒;ccf:透明、无色、很少的可见颗粒;ccm:透明、无色、许多可见颗粒
[0772]
以上结果表明,在所有稳定剂溶液中没有观察到ph或渗透压的显著变化。此外,所有稳定剂溶液满足关于亚可见颗粒计数的usp规范。在七天后,在所有稳定剂溶液中观察到很少可见的颗粒。尽管由于无效的分析测试结果无法获得hmw种类的初始水平,但在所有溶液中在7天后hmw种类的水平是可接受的。因此,从产品质量的角度来看,所有这些溶液条件被认为是可接受的。
[0773]
2.6.评估苯甲醇和对羟基苯甲酸甲酯的组合作为防腐剂的微生物挑战测试
[0774]
进行了微生物挑战测试以评估包含≤0.17%ba和≤0.1%mp的稳定剂溶液的防腐剂影响。选择了微生物挑战测试,因为它更准确地代表了建议的剂量制备和稀释方案,其中将无菌地制备剂量且可被引入溶液中的微生物数量将很少。微生物挑战测试以两个阶段进行。第一阶段确定ba和mp的有效浓度,而第二阶段依照usp规范测试最终制剂。每个阶段在以下详细地描述。
[0775]
2.7.有效的苯甲醇和对羟基苯甲酸甲酯浓度的确定
[0776]
在该研究中,评估了ba和mp的组合(在以下表22中列出),以确定168小时内抑制微生物生长所需的ba和mp的有效浓度。在铜绿假单胞菌(细菌)和白色念珠菌(c.albicans)(真菌)两者中测试了这些组合,以比较跨生物体的防腐剂有效性。
[0777][0778]
为了研究,模拟了单个移动泵的剂量制备方案。在添加在至最终给药溶液之前,将铜绿假单胞菌和白色念珠菌微生物重构并且合并。将每种溶液添加至其相应的盒中,并且在盒装满后立即收集t0样品。该程序说明了可与注射器应力暴露有关的微生物生长模式的任何变化。在t0收集后,将相应的盒在32
±
2℃孵育。在24小时、72小时和168小时时间点充分地混合,以确保在样品采集之前均匀的微生物悬浮液。收集后,立即对样品进行微生物挑战测试。微生物挑战测试结果在以下表23和表24中可见。
[0779][0780][0781]
tntc:太多而无法计数,代表显著的微生物生长
[0782][0783]
从5ml铺板的样品体积观察到报告为“》50”的平板为tntc(太多而无法计数)
[0784]
从0.1ml铺板的样品体积观察到报告为“》2500”的平板为tntc
[0785]
tntc:太多而无法计数,代表显著的微生物生长
[0786]
来自表23和表24的结果示出稳定剂1溶液中的ba浓度(0.9%)是杀细菌(bactericidal)和杀真菌的(fungicidal),而仅单个泵配置目标ba浓度(0.17%)不抑制生长。以上结果还表明,与单独的ba相比,mp和ba的组合增加了稳定剂溶液的抗微生物性能。然而,在24小时内仅观察到0.17%ba+0.05%mp组合的抑制细菌和抑制真菌的性能。由于对患者安全的考虑,稳定剂溶液中的ba浓度受到限制,以增加防腐剂的有效性持续期间,在稳定剂溶液中的mp浓度可提高至0.1%。然而,当浓缩的稳定剂溶液呈现为20ml添加体积时,该mp的水平导致高的溶液ph值(≥9.0)、溶液浊度和ps80不混溶性。为了解决这些问题,进行了一系列稳定剂溶液优化研究,以确定最终浓缩的稳定剂溶液。
[0787]
第一项研究探索了在浓缩的稳定剂溶液中的较低水平的ps80,以确定是否可以解决浊度和溶液不稳定性或不混溶性的问题。结果示出,在包含浓度低于0.003%的ps80的最终给药溶液中,dart-a蛋白质回收率显著降低。然而,该浓度的ps80在室温保持混浊。进行了评估较大浓缩的稳定剂溶液添加量展示的后续研究,以确定降低浓缩的稳定剂溶液中所有赋形剂的水平是否有助于解决高浊度问题。该研究的结果示出,具有ps80最终水平大于0.003%的40ml添加稳定剂体积在储存时不形成液滴,而只是轻微乳白色。为了确定最佳的浓缩的稳定剂溶液ph,进行了改变制剂缓冲液强度的研究。第一项研究示出,提高浓缩的稳定剂溶液中的磷酸钠水平有效地降低溶液ph值。然而,低于ph 8.4,mp的目标水平不会在溶液中保持。结果,在后续的研究中评估了mp的可变浓度。这些结果示出,在ph≤8.0时,目标mp浓度的30-50%保留在溶液中。基于先前ps80和mp研究的结果,进行了评估mp和ps80的可变浓度的最终研究,以确定解决在可接受ph时溶液浊度的最佳组合。该研究的结果示出,包括20mm磷酸钠、13.2mg/ml ba、4.25mg/ml mp和0.25mg/ml ps80的浓缩的稳定剂2溶液是可接受的,并且在储存时只有轻微乳白色,其中最终溶液ph为8.2。在250ml盐水袋中稀释40ml的该稳定剂溶液时,所得的给药溶液将包含0.17%ba和0.055%mp。该组合先前仅24小时示出抑制细菌和抑制真菌的作用。然而,在高ph环境中mp的抗微生物作用减弱,并且稳定剂溶液的重新配制显著降低了最终给药溶液的ph。结果,在给药溶液中具有0.17%ba和0.05%mp的最终防腐剂水平的重新配制的稳定剂2溶液的防腐剂有效性通过usp推荐的微生物的微生物挑战测试检查。
[0788]
2.8.微生物挑战测试以确定最终的防腐剂浓度
[0789]
为了满足当前防腐剂的usp标准,当针对某些usp推荐的微生物测试制剂时,必须
在所需的施用时间内没有观察到生长。基于以前的研究,白色念珠菌和巴西曲霉(a.brasiliensis)微生物对给药溶液中的防腐剂最有抵抗力;因此,仅测试了这两种微生物。仅测试了0.17%ba+0.05%mp稳定剂溶液,并且将其与无防腐剂对照比较。在72小时内监测微生物生长,其中在0、48小时和72小时的时间点采样。剂量制备、设置和方法以与先前进行的微生物挑战测试相似的方式进行。该研究的结果在以下表25中可见。
[0790][0791][0792]
根据表25中的结果,给药溶液中0.17%ba+0.05%mp的组合对巴西曲霉和白色念珠菌两者是抑制真菌的,因为48小时和72小时计数不比0小时计数大0.5log。结果,提供了在最终给药溶液中的0.17%ba和0.05%mp的防腐剂浓度的稳定剂2,将能够在48小时内单个泵施用dart-a。
[0793]
2.9.所有五种usp推荐的微生物的证实的微生物挑战测试
[0794]
为了证实稳定剂2一旦在盐水(即在给药溶液中)中稀释后的抗微生物性能,通过sgs life sciences进行了微生物生长测试。测试所需的usp推荐的微生物在以下表26中列出。
[0795][0796]
制备高给药溶液(以1,000ng/kg的150kg患者组)以代表最大防腐剂稀释度。另外,将ba和mp的目标浓度调节至0.157%和0.05%的较低的防腐剂浓度,以证明在稍微更低的水平防腐剂的有效性。对具有目标浓度在10cfu/ml和100cfu/ml之间的所有五种usp推荐的微生物进行了微生物生长研究。微生物生长结果在以下表27中列出。
[0797][0798]
基于以上结果,稍微低于预期的目标浓度的稳定剂2的稀释度,满足120小时内无生长的标准,因为与微生物的初始浓度比较,每种微生物的log生长值没有增加》0.5log的值。这些研究表明,使用为单个泵施用设计的剂量制备方案稀释的稳定剂2可在120小时的时期内成功地限制微生物生长。
[0799]
2.10.最终稳定剂2溶液中赋形剂的允许范围
[0800]
为了促进患者的顺应性和舒适性,可以实施在剂量制备后来自iv袋或盒子的制剂的四天连续施用。转变到四天施用将需要使kvo速率降低至2.5ml/hr,其允许更多防腐剂在溶液中,而不达到可接受的每日摄入量(adi)水平。基于在4天内来自250ml袋施用的adi值,将允许稳定剂溶液中允许的赋形剂范围的以下上限。
[0801]
·
ba上限:25.8mg/ml
[0802]
·
mp上限:51.7mg/ml
[0803]
然而,高于15.5mg/ml的ba水平导致溶液不稳定性或不混溶性,并且高于5.3mg/ml的mp水平产生ph高于8.4的最终溶液。因此,最终稳定剂2溶液中ba和mp的建议允许范围如下:
[0804]
·
ba目标浓度:13.2mg/ml(允许范围:11.6mg/ml至15.5mg/ml)
[0805]
·
mp目标浓度:4.25mg/ml(允许范围:3.9mg/ml至5.3mg/ml)
[0806]
由于转变到四天施用涉及降低kvo速率,故最低预期dart-a给药溶液浓度(对应于以30ng/kg的剂量给药40kg的患者)必须从10ng/ml增加至20ng/ml。用低于目标浓度(0.25mg/ml)的ps80进行通过elisa(rhil3rα)评估的蛋白质回收率研究,其以该20ng/ml蛋白质浓度模拟临床剂量制备和施用。这些研究的结果总结在以下表28中。
[0807][0808]
蛋白质回收率研究示出,当利用0.10mg/ml ps80稳定剂制剂时,在储存24小时和
施用96小时后,该较高的20ng/ml给药溶液的完全回收。四天施用将仅允许较高ps80规格中的细微变动,因为该限制是由溶液外观(即混溶性)驱动的。假设250ml盐水袋用于剂量制备,则最终稳定剂溶液中ps80的建议的允许范围如下:
[0809]
·
ps80目标浓度:0.25mg/ml(允许范围:0.10mg/ml至0.35mg/ml)
[0810]
2.11.结论
[0811]
以上研究支持了在ph 6.0的10mm磷酸钠、150mm氯化钠、0.1mg/ml ps80中具有0.1mg/ml的最终组成的dart-a dp制剂。这种dart-a dp制剂可为在5cc小瓶中的5ml填充物。
[0812]
以上研究进一步支持了由10mm磷酸钠、150mm氯化钠、0.1mg/ml ps80、9.0mg/ml ba和0.1mg/ml rha组成的ph 6.0的第一稳定剂溶液,稳定剂1,与dart-a dp制剂组合用于使用两个注射器泵或两个移动泵的静脉内施用。稳定剂1特别地用于在小儿患者、具有低体重的患者和/或需要更高iv流速(例如大于约5ml/hr)的患者中使用。由10mm磷酸钠、150mm氯化钠和0.1mg/ml ps80组成并且没有ba的ph 6.0的稳定剂1特别优选地用于小儿患者中。这种没有ba的稳定剂1溶液特别地适合于与dart-a dp制剂组合后24小时内施用。
[0813]
为了支持单个移动泵施用,需要对稳定剂1多次改变。第一个改变涉及去除当前的阻断剂rha。第二个制剂改变涉及ba防腐剂,其对于单个移动泵施用的稳定剂1中是过于浓缩的。根据以上所述的研究,由20mm磷酸钠、13.2mg/ml ba、4.25mg/ml mp和0.25mg/ml ps80组成的ph 8.2的第二稳定剂溶液,稳定剂2将支持单个泵施用。当在250ml盐水袋(具有270ml的标称体积)中稀释时,所得给药溶液包含0.03mg/ml ps80、1.7mg/ml ba和0.55mg/ml mp。随后添加dart-a dp制剂以形成最终给药溶液,并且适合于使用单个移动泵的四天的连续iv施用。
[0814]
实施例3
[0815]
利用稳定剂1溶液的dart-a双泵移动输注相容性研究
[0816]
该实施例总结了在双泵移动输注配置中dart-a dp制剂(在稳定剂1中稀释)与输注组分的相容性和dart-a回收率。输注配置使用两个移动泵,其中泵1递送dart-a dp制剂(在稳定剂1中稀释),并且泵2递送盐水以维持至少10ml/hr的组合流速。
[0817]
研究的目的是:
[0818]
(a)用于评估在室温连续输注24、48和72小时期间用稳定剂1稀释的dart-a dp制剂与输注组分的相容性和总dart-a回收率;
[0819]
(b)用于测试稳定剂1的ba含量和评估在室温摇晃24、48和72小时的药物盒中dart-a的稳定性;和
[0820]
(c)用于评估在高温(37℃)摇晃72小时的药物盒中dart-a的稳定性。
[0821]
3.1.研究设计
[0822]
设计了使用两个移动泵的输注配置,以连续施用dart-a dp给药溶液。如图11示出,将dart-a dp制剂(用稳定剂1稀释)装入移动泵1的药物盒中,并且以约1ml/hr或更小的流速流经施用装置(管)进入三通旋塞阀的端口b。将盐水溶液(0.9%氯化钠注射液,usp)装入移动泵2的药物盒中,并且以5ml/hr流经施用装置(管)进入三通旋塞阀的端口a。将dart-a dp制剂和盐水混合,并且流经具有0.2μm内联(in-line)过滤器的扩展装置进入中心静脉导管(cvc),以施用给受试者。这种2泵输注配置是必需的,因为dart-a dp给药溶液的输注
速率是1ml/hr或更小,并且推荐的流速是》10ml/hr,以保持cvc端口畅通而无任何血液凝结。泵2以10ml/hr递送盐水,以维持至少10ml/hr的组合流速。如在图12a-12b中所示,待装入药物盒上的给药溶液通过用稳定剂1稀释dart-a dp制剂来制备。
[0823]
该研究通过测试30ng/kg/天至1000ng/kg/天的剂量,使用划类的方法(bracketed approach)来覆盖宽的剂量范围。表29示出用于80kg体重的受试者作为示例来确定剂量浓度、剂量体积和流速的剂量计算。用于其他受试者的剂量计算可使用它们相应的体重进行类似地计算。
[0824][0825][0826]
3.2.采样计划
[0827]
进行了三项研究,以评估在室温(22℃
±
2℃)和在高温(37℃)在摇晃长达72小时的输注期间dart-a dp制剂与输注组分的相容性、药物回收率和装入药物盒的dart-a的稳定性。图13描述了这些研究中使用的五(5)个采样点(#1-#5)。
[0828]
3.2.1.研究1
[0829]
研究1评估了在进入点、采样点#5以及在室温(22℃
±
2℃)连续输注24、48和72小时期间的相容性和总dart-a回收率。
[0830]
3.2.2.研究2
[0831]
将dart-a dp制剂用稳定剂1稀释以制备dart-a给药溶液。稳定剂1包含0.9%ba作为抗微生物防腐剂。研究2测试了ba含量,并且评估了在室温(22℃
±
2℃)在摇晃(100rpm)持续24、48和72小时,药物盒中dart-a的稳定性。使用se-hplc测量dart-a的稳定性。由于最高dart-a dp制剂剂量(5000ng/ml)在稳定剂中具有最高的稀释的防腐剂浓度,并且代表最坏情况的场景,因此仅测试最高剂量样品的ba浓度。如在图11中所示,在采样点#2采集样品。
[0832]
3.2.3.研究3
[0833]
研究3评估了在37℃在摇晃(100rpm)长达72小时,药物盒中稀释的dart-a的稳定性。如在图11中示出,在72小时的时间点,在采样点#2采集样品。
[0834]
3.3.结果和讨论
[0835]
以上相容性研究的结果在以下表30中总结。
[0836][0837]at0=时间(t)=0
[0838]
如在研究中制备的低浓度通过dart-a定量测定(通过elisa(rhil3rα)评估)确定为116.7ng/ml。如在图11和表29中所示,dart-a以1.0ml/ml注入,并且通过以10ml/hr注入的盐水进行稀释,在t0时预期的dart-a浓度是116.7ng/ml x 1.0ml/hr
÷
(1.0ml/hr+10ml/hr)=10.6ng/ml。
[0839]
如在研究中制备的高浓度通过dart-a定量测定(通过elisa(rhil3rα)评估)确定为5067.5ng/ml。如在图11和表29中所示,dart-a以0.66ml/hr注入,并且通过以10ml/hr注入的盐水进行稀释,在t0时预期的dart-a浓度是5067.5ng/ml x 0.66ml/hr
÷
(0.66ml/hr+10ml/hr)=313.7ng/ml。
[0840]
对于低浓度和高浓度输注,从采样点#5在24、48和72小时采集样品。如上,使用dart-a定量测定以确定dart-a浓度,并且使用具有荧光检测器的se-hplc(flr se-hplc)以分析dart-a单体峰面积。针对预期的t0样品计算数据以获得dart-a回收率。如在表30中所示,基于定量测定的dart-a回收率,对于低剂量在63.2%和121.7%之间,对于高剂量在75.0%和93.8%之间。与其他结合elisa测定类似,这些范围在该类型的生物测定的典型变化内(50%-150%)。基于se-hplc单体峰面积这些相同样品的dart-a回收率,对于低剂量在80.5%和106.8%之间,对于高剂量在81.8%和99.5%之间。
[0841]
在研究1中从采样点#5在24、48和72小时采集的样品也进行了颗粒计数测试。如在表31中所示,所有样品的颗粒计数都低,并且满足usp规范。
[0842][0843]
在研究2中从采样点#2在24、48和72小时采集的样品通过dart-a定量测定和具有荧光检测器的se-hplc分析。如在表32中所示,如通过定量测定中dart-a的完整结合活性证实的,所有样品保持活性,并且如通过se-hplc测定中单体峰面积的最小减少示出所有样品是稳定的。通过两种测定评估的dart-a回收率在91.1%至110.8%之间。
[0844][0845][0846]
在研究2中从高浓度条件的采样点#2在24、48和72小时采集的样品也进行了ba含量分析。如在表33中所示,ba含量可能由于蒸发和/或吸附而稍微下降,但即使在100rpm摇晃长达72小时下在25℃孵育后保持至少0.75%。该ba浓度高于先前研究中测试的防腐剂有效性浓度,其中0.61%的ba浓度提供了足够的抗微生物活性。
[0847][0848]
在研究3中采集的样品通过dart-a定量测定和具有荧光检测的se-hplc进行分析。如在表34中所示,在100rpm摇晃长达72小时在37℃孵育后,如通过定量测定中dart-a的完整结合活性证实的,样品保持活性,并且如通过se-hplc测定中单体峰面积的最小减少证明样品是稳定的。通过两种测定评估的dart-a回收率在82.0%和95.1%之间。
[0849][0850][0851]
3.4.结论
[0852]
基于该研究的结果,双泵移动输注配置能够在室温以可接受的dart-a回收率连续施用dart-a dp给药溶液24、48和72小时。连续输注期间采集的所有样品的颗粒计数都非常低,并且满足usp规范。当测试最坏情况稀释场景时,用于dart-a dp给药溶液制备的稳定剂1中的ba含量保持在有效水平。装入药物盒中的dart-a在室温并且甚至在高温(37℃)在摇晃(100rpm)长达72小时的连续输注期间仍保持有效并且稳定。这些研究表明,稀释的dart-a dp制剂与输注组分相容,并且可以与双泵移动输注配置一起使用,用于在室温连续施用dart-a dp制剂。dart-a可通过如下施用:在第1天将稀释的dart-a dp制剂装入药物盒中以覆盖(cover)前2天所需的药物剂量,且在第3天重新装入以覆盖治疗的接下来2天所需的药物剂量。在治疗周期期间,每天将预先填充到药物盒中的盐水装入移动泵2上。
[0853]
实施例4
[0854]
利用稳定剂2溶液的dart-a单个泵相容性研究
[0855]
该实施例总结了使用用于制备dart-a dp给药溶液的稳定剂2进行的相容性和微生物挑战研究。在剂量制备后长达72小时和输注后96小时,评估了划为潜在的低和高剂量浓度类别的20ng/ml和0.1mg/ml剂量的单个泵配置中dart-a的稳定性,并且示出是可接受
的。基于研究的结果,在添加dart-a dp制剂之前,将40ml的稳定剂2溶液稀释在含有250ml生理盐水的iv袋中(具有270ml的标称体积),以制备用于使用单个泵配置施用的最终给药溶液。储存长达72小时后,给药溶液可在室温从用于支持四天连续施用的盐水袋中在96小时内连续地施用。
[0856]
在使用在0.9%氯化钠usp(生理盐水)中的稳定剂2的给药溶液制备中,dart-a dp制剂可通过使用移动泵或输液泵在四天内连续iv输注施用。在添加dart-a dp制剂之前,将稳定剂2添加至生理盐水iv袋中,以防止双抗体吸附至iv袋和iv管上。当在剂量制备期间将稳定剂2用生理盐水稀释时,用于施用的给药溶液将包含1.7mg/ml ba、0.55mg/ml mp和0.032mg/ml ps80。ps80被包含在制剂中,以防止dart-a吸附至iv袋和线路的表面,且ba和mp两者都被包含以防止在剂量制备、储存和施用期间微生物生长。
[0857]
在剂量制备期间稀释后,最终给药溶液将包含20ng/ml至约1250ng/ml的浓度范围的dart-a,以能够两天至四天(48-96小时)施用30ng/kg/天至约高达500ng/kg/天的剂量。用于dart-a的稀释计算的量基于受试者的重量(用于模拟研究的最小和最大范围)和所需的剂量(表35)。
[0858]
进行了研究以支持在含有稳定剂2的生理盐水袋中稀释的dart-a dp制剂的稳定性和相容性和使用移动和输液泵iv配置的该dart-a dp给药溶液的施用。研究的目的在于阐明dart-a dp制剂与含有所需剂量范围内的稳定剂2的生理盐水袋以及与预期的输注组分是相容的。
[0859][0860]
给药溶液制备将需要两步骤的过程,其涉及添加稳定剂2至生理盐水袋中,然后添加dart-a dp制剂。代表性的低和高的最终给药溶液浓度在表36中总结。
[0861][0862]
a.使用0.1mg/ml dart-a dp制剂制备的剂量
[0863]
研究的目的如下:
[0864]
(a)用于评估当剂量使用稳定剂2制备并且在室温保存72小时时,稀释的dart-a的稳定性和回收率;
[0865]
(b)用于测试当制备的给药溶液在室温保存72小时,随后施用时,稳定剂2溶液防腐剂的水平;和
[0866]
(c)用于评估在室温连续输注48小时(10ng/ml和1,250ng/ml)期间和在室温储存后96小时(20ng/ml和0.1mg/ml),稳定剂2溶液中稀释的dart-a与单个移动泵输注组分的相
容性和回收率。
[0867]
使用划类的方法来测试最高浓度(1,250ng/ml)和最低浓度(20ng/ml),其分别对应于代表性的500ng/kg/天和30ng/kg/天的治疗剂量。此外,还制备并且评估了10ng/ml和0.1mg/ml(100,000ng/ml)的给药溶液浓度。评估了10ng/ml的较低浓度,以证明给药溶液低于40kg患者的最低目标剂量的相容性。0.1mg/ml给药溶液浓度超出目标施用剂量范围外,但用作剂量浓度以评估满足表征百分比hmw种类的尺寸排阻色谱法(se-hplc)和表征药物产物电荷变体的毛细管等电聚焦(cief)方法的定量(loq)阈值的限制。
[0868]
4.1.研究设计
[0869]
用于相容性研究的剂量制备可按照在图13中描述的建议的单个移动泵剂量制备方案。作为相容性研究的部分,在室温储存72小时期间监控dart-a蛋白质和防腐剂稳定性。在储存后,按照在图14中所示的建议的单个移动泵剂量施用配置施用。
[0870]
仅测试具有iv钉(spike)的cadd施用设置。使用用于蛋白质浓度的划类策略(bracketing strategy)进行连续施用240ml的给药溶液(5ml/hr 48小时或2.5ml/hr 96小时)。在下面部分中描述了用于剂量制备和施用的方法。
[0871]
4.2.给药溶液制备
[0872]
通过将40ml的稳定剂2添加至250ml生理盐水袋(具有270ml的标称体积)中,然后添加计算量的dart-a dp制剂来实现以上所述的目标药物浓度来制备给药溶液。给药溶液在室温在生理盐水袋中储存72小时,同时储存期间最小化对光的暴露。
[0873]
b.braun excel生理盐水袋用于该研究。标准惯例规定,生理盐水袋包含大于包装上注明的250ml体积。根据制造商的规范,每个b.braun excel袋的标称填充体积是270ml。该体积用于计算制剂开发期间稳定剂2的赋形剂浓度,以确保防腐剂的最终浓度处于或低于adi水平。给药溶液的制备将需要两步骤过程,其涉及将稳定剂2稀释于盐水袋中,然后添加dart-a dp制剂。
[0874]
通过将40ml的稳定剂2添加至iv袋来制备每个剂量。在添加至iv袋之前,稳定剂2小瓶被充分摇晃。稳定剂溶液添加后,每个盐水袋通过将袋子颠倒五分钟轻轻混合。混合后,使用1ml注射器(低剂量制备)或5ml注射器(高剂量制备)将预定体积的dart-a dp制剂(参见表34)添加至每个袋中。每个袋通过颠倒袋子五分钟再次彻底混合。混合后,使用新的60ml注射器从盐水袋中除去所有的空气。
[0875]
剂量制备后,从每个袋采集15ml用于外观、ph、渗透压和亚可见微粒t=0小时分析。在所有样品产生后完成所有其他分析方法。每个袋在室温孵育72小时。储存72小时后,在被输注之前从每个袋中采集15ml溶液用于分析,以测试给药溶液与施用组分的相容性。
[0876]
4.3.给药溶液施用
[0877]
储存后,通过与0.22μm过滤的非dehp pvc iv施用扩展设置偶联的iv袋钉(spike)将制备的每种浓度的给药溶液连接至移动泵,并且以10ng/ml和1,250ng/ml在48小时内连续输注以及在室温用于以20ng/ml并且也处于0.1mg/ml的四天施用的最低起始剂量在96小时内连续输注。
[0878]
使用被编程为以5ml/hr 48小时或2.5ml/hr 96小时递送dart-a剂量的smiths medical cadd legacy-1移动泵评估剂量施用期间的相容性。如以上图14所见,具有iv袋钉的smiths medical cadd施用设置用于将包含给药溶液的盐水袋直接地连接至移动泵。将
输注的dart-a dp给药溶液收集在用盐水稀释的稳定剂2预涂覆的250ml玻璃瓶中,以防止在样品采集期间非特异性蛋白质结合。在样品采集之前,从瓶中移除过量的用盐水稀释的稳定剂2并且使其干燥。输注完成一半后,用新的空的预涂覆的250ml玻璃瓶替换先前的收集瓶。这样确保最终输注的给药溶液准确地表示48小时或96小时样品的保留时间。在剂量制备的时间(t=0小时)且从采集器皿中的最终分配池(输注后样品,输注t=48小时,输注t=96小时)中采集样品,并且测试视觉外观、亚可见微粒、ph、渗透压、通过反相色谱法(rp-hplc)的防腐剂浓度、通过荧光尺寸排阻色谱法(flr se-hplc)和elisa测定的蛋白质回收率以及cd3和cd123结合的效力。使用报告基因生物测定法分析了在0.1mg/ml浓度的样品的效力。
[0879]
4.4.分析测试
[0880]
在剂量制备时(t=0小时)、在室温储存(t=72小时)后和在输注(输注时间,t=48小时或t=96小时)后分析了所有给药溶液。用于分析相容性的分析测试在以下表37中列出(nt:在指定剂量下属性未被测试)。
[0881][0882]
4.5结果
[0883]
在iv袋中室温储存72小时,随后在室温使用单个泵配置输注后,低和高剂量溶液的相容性和稳定性结果在以下表38中列出。
[0884]
[0885][0886]
在剂量制备时(t=0小时)、在储存后(t=72小时)和输注后(输注t=48小时或输注t=96小时),观察到所有溶液为清澈的、无色的、无可见的微粒。对于1250ng/ml给药溶液,使用se-hplc方法或对于所有其他溶液,通过elisa(cd3结合)计算蛋白质回收率。对于所测试的给药溶液,dart-a输注后的蛋白质回收率%(相对于t=0计算的蛋白质浓度)是可接受的。另外,当与t=0相比时,在输注后样品中没有观察到ph、可见外观和渗透压的显著变化。与t=0相比,在给药溶液的输注后样品中,≥2μm、≥10μm和≥25μm的颗粒的亚可见颗粒计数没有增加。总体而言,表37中的结果示出,当给药溶液用移动输液泵施用时,ph、蛋白质回收率、效力、亚可见颗粒和视觉外观没有显著的产品变化。以20ng/ml的最低潜在剂量浓度96小时的较长输注时间的四天施用对产品质量没有影响。
[0887]
0.1mg/ml最终溶液的dart-a表征结果在以下表39中示出。
[0888][0889]
a.通过elisa定量(cd3结合)计算蛋白质回收率
[0890]
b.效力被报道为相对于dart-a参考标准品计算的相对效力(%)
[0891]
c.av=酸性变体,bv=碱性变体
[0892]
d.hmw=高分子量种类,lmw=低分子量种类
[0893]
表39示出在该浓度通过se-hplchmw和lmw没有变化。如由cief监测的电荷异质性在分析方法的可变性范围内示出微小变化。使用报告基因生物测定测量的相对效力值在方法的接受标准(50
–
150%)内。在储存和施用期间观察到视觉外观没有变化。使用usp推荐的微生物评估的剂量配制溶液的微生物生长数据支持将给药溶液用于四天连续施用的使用。
[0894]
4.6.结论
[0895]
相容性研究表明,当以测试的最低(20ng/ml)和最高(1,250ng/ml)剂量浓度在稳定剂2稳定的生理盐水溶液袋中稀释且在室温保存72小时时,dart-a dp制剂是稳定的。相容性研究还示出,当在室温使用单个泵在96小时过程内通过输注施用时,给药溶液是相容的。微生物生长数据支持给药溶液用于连续四天施用的使用。
[0896]
实施例5
[0897]
利用稳定剂2溶液的dart-a的四天和七天施用
[0898]
该实施例总结了使用稳定剂2制备用于dart-a的4天和7天施用的dart-a dp给药溶液的相容性和微生物挑战研究的一个代表性方案。利用以30-500ng/kg/天剂量的家用单个移动泵在iv袋或盒中的dart-a的稳定性将被评估用于使用约0.3ml/小时至约0.5ml/小时的低流速的4天和7天施用。在以3250ng/ml(3.25mg/ml)剂量的单个泵配置中dart-a的稳定性将在剂量制备后长达24小时和储存4天(96小时)和7天(168小时)评估。基于研究的结果,在添加dart-a dp制剂之前,稳定剂2溶液将在含有生理盐水的iv袋中稀释,以制备用于使用单个泵配置施用的最终给药溶液。储存长达24小时后,给药溶液可在室温从盐水袋在4天(96小时)或7天(168小时)内连续地施用,以支持4天或7天连续施用。
[0899]
四天施用
[0900]
dart-a dp制剂可通过使用配备有iv袋或盒的移动泵在4天内连续iv输注施用。用于dart-a dp制剂稀释的计算量基于受试者的重量(78kg的平均体重用于模拟研究)。表40
描述了用于制备给药溶液的步骤的示例性方案。使用在0.9%氯化钠usp(生理盐水)中的稳定剂2将dart-a dp制剂稀释在给药溶液中。将生理盐水(45ml)添加至空的iv袋中。然后在添加dart-a dp制剂(1.95ml)之前,将稳定剂2(8ml)添加至iv袋中,以防止双抗体吸附到iv袋和iv管。当在剂量制备期间将稳定剂2用生理盐水稀释时,用于施用的给药溶液(60ml总体积)包含约1.8mg/ml ba、约0.56mg/ml mp和约0.033mg/ml ps80。在剂量制备期间稀释后,最终给药溶液将包含约3250ng/ml的dart-a浓度,以允许500ng/kg/天剂量的4天施用。
[0901][0902][0903]
七天施用
[0904]
dart-a dp制剂还可通过使用配备有iv袋或盒的移动泵在7天内连续iv输注施用。用于dart-a稀释的计算量基于受试者的重量(78kg的平均体重用于模拟研究)。表41描述了用于制备给药溶液的步骤的示例性方案。使用在0.9%氯化钠usp(生理盐水)中的稳定剂2在给药溶液中稀释dart-a dp制剂。将生理盐水(70ml)添加至空的iv袋中。然后在添加dart-a dp制剂(3.25ml)之前,将稳定剂2(18ml)添加至iv袋中,以防止双抗体吸附到iv袋和iv管。当在剂量制备期间将稳定剂2用生理盐水稀释时,用于施用的给药溶液(100ml总体积)将包含约2.4mg/ml ba、约0.77mg/ml mp和约0.047mg/ml ps80。在剂量制备期间稀释后,最终给药溶液将包含约3250ng/ml的dart-a浓度,以允许500ng/kg/天剂量的7天施用。
[0905][0906][0907]
如在表40和表41中所示,正在进行研究以支持在含有稳定剂2的生理盐水袋中稀释的dart-a dp制剂的稳定性和相容性以及使用移动iv袋和盒配置的该dart-a dp给药溶液的4天和7天施用。研究的目的是证明dart-a dp制剂可以以所需的30-500ng/kg/天的剂量与含有稳定剂2的普通iv袋相容,并且对于以约0.3ml/小时至约0.5ml/小时的流速的4天和7天施用与预期的输注组分相容。研究的目的在于评估室温储存后,在室温连续输注4天(96小时)和7天(168小时)期间,稳定剂2溶液中稀释的dart-a与单个移动泵输注组分的相容性和回收率。
[0908]
5.1.研究设计
[0909]
用于相容性研究的剂量制备可按照在图13中描述的建议的单个移动泵剂量制备方案。作为相容性研究的部分,dart-a蛋白质和防腐剂稳定性将在室温储存24小时期间监测。在储存后,施用可按照在图14中示出的建议的单个移动泵剂量施用配置。
[0910]
将进行48ml的给药溶液的连续施用(0.5ml/hr 4天(96小时))用于4-天施用或84ml的给药溶液的连续施用(0.5ml/hr 7天(168小时))。在以下部分中描述了将用于剂量制备和施用的方法。
[0911]
5.2.给药溶液制备
[0912]
给药溶液将通过如表40(4天施用)和表41(7天施用)所示制备,以实现适合于78kg
患者的以500ng/kg/天剂量的目标药物浓度。给药溶液将在室温在普通iv袋中保存24小时,同时储存期间最小化对光的暴露。
[0913]
给药溶液的制备将需要三步骤过程,其涉及将生理盐水添加至空的静脉输注(iv)袋中,在含有生理盐水的iv袋中稀释稳定剂2,然后添加dart-a dp制剂。在添加至iv袋之前,稳定剂2小瓶将被充分摇晃。在稳定剂溶液添加后,每个iv袋将通过颠倒袋五分钟轻轻混合。混合后,将预定体积的dart-a dp制剂(参见表40或表41)添加到每个袋中。每个袋将通过颠倒五分钟再次彻底混合。混合后,将使用注射器从iv袋中除去所有空气。
[0914]
剂量制备后,将从每个袋采集等分试样用于外观、ph、渗透压和亚可见微粒t=0小时分析。将在所有样品产生后完成所有其他分析方法。每个袋将在室温孵育24小时至8天。储存时间结束后,在被输注之前,等分试样的给药溶液将从每个袋中采集用于分析,以测试给药溶液与施用组件(component)的相容性。
[0915]
5.3.给药溶液施用和分析测试
[0916]
描述了如何可施用制备的给药溶液的实施例。储存后,制备的给药溶液将通过与过滤的施用扩展设置偶联的iv袋钉连接至移动泵,并且在室温在4天(96小时)或7天(168小时)的过程内连续地输注。剂量施用期间的相容性将使用移动泵(例如,smiths medical cadd legacy-1移动泵)评估,该泵将被编程为将dart-a剂量以0.3ml/小时或0.5ml/小时递送4天(96小时)或以0.3ml/小时或0.5ml/小时递送7天(168小时)。如以上图14中所示,具有iv袋钉的smiths medical cadd施用设置可用于直接地将包含给药溶液的盐水袋连接至移动泵。输注的dart-a dp给药溶液将被采集在用盐水稀释的稳定剂2冲洗的玻璃瓶中以在样品收集期间除去外来颗粒。在样品采集之前,从瓶中取出过量的盐水稀释的稳定剂2并且使其干燥。输注完成一半后,新的空的玻璃瓶将替换先前的采集瓶。这将确保最终输注的给药溶液准确地表示4天(96小时)或7天(168小时)样品的保留时间。在剂量制备的时间(t=0小时)且从采集器皿中的最终分配池(输注后样品,输注t=4天/96小时,和输注t=7天/168小时)中采集样品,并且将基本上如本文所述(参见特别地,实施例7)进行用于视觉外观、亚可见微粒、ph、渗透压、通过反相色谱法(rp-hplc)的防腐剂浓度、通过荧光尺寸排阻色谱法(flr se-hplc)和elisa测定的蛋白质回收率以及通过报告基因生物测定法的效力的分析测试。
[0917]
实施例6
[0918]
利用稳定剂3溶液的双特异性双抗体的四天和七天施用
[0919]
该实施例总结了使用稳定剂3(包括150mm氯化钠和0.1mg/ml ps80,ph 6.0)制备双特异性双抗体给药溶液,如dart-a dp给药溶液,用于双特异性双抗体(例如dart-a)的4天和7天施用的相容性和微生物挑战研究的一个代表性方案。利用以30-500ng/kg/天剂量的家用移动泵在iv袋或盒中的双特异性双抗体的稳定性将被评估,用于使用约0.3ml/小时至约0.5ml/小时的低流速的4天和7天施用。在以25ng/ml至3250ng/ml(3.25mg/ml)剂量的单个泵配置中双特异性双抗体的稳定性将在剂量制备后长达24小时和储存4天(96小时)和7天(168小时)时评估。基于研究的结果,在添加双特异性双抗体制剂之前,稳定剂3溶液将在含有抑菌生理盐水的iv袋中稀释,以制备用于使用单个泵配置施用的最终给药溶液。储存长达24小时后,给药溶液可在室温从盐水袋在4天(96小时)或7天(168小时)内连续地施用,以支持4天或7天连续施用。
[0920]
稳定性研究
[0921]
进行了稳定性研究以评估代表性的三链双特异性双抗体(“bd”)的相容性和总回收率。bd包括fc结构域并且能够在室温(22℃
±
2℃)连续输注6小时期间结合cd3和b7-h3。双特异性双抗体制剂用稳定剂3稀释以制备双特异性双抗体给药溶液。该研究测试了一次性注射器中双特异性双抗体的稳定性。在t=0和在6小时采集样品。使用se-hplc测量双特异性双抗体的稳定性。采集的样品也进行颗粒计数测试。如在表42和表43中所示,所有样品的颗粒计数都低且满足usp规范。
[0922][0923][0924][0925]
这些短期(6小时)稳定性研究表明,低剂量、稀释的双特异性双抗体制剂与稳定剂3和输注组件两者相容。稀释的双特异性双抗体制剂和稳定剂3可与单个泵配置一起使用,以在室温以可接受的双特异性双抗体回收率和低颗粒计数连续施用双特异性双抗体制剂。
[0926]
四天施用
[0927]
双特异性双抗体制剂(例如dart-a dp制剂)可通过使用配备有iv袋或盒的单个移动泵在4天内连续iv输注施用。用于双特异性双抗体制剂稀释的计算量基于受试者的重量(78kg的平均体重用于模拟研究)。表44描述了用于制备dart-a dp给药溶液的步骤的示例性方案。使用在抑菌盐水(0.9%ba、0.9%氯化钠,usp)中的稳定剂3在给药溶液中稀释dart-a dp制剂。将抑菌盐水(45ml)添加至空的iv袋中。然后在添加dart-a dp制剂(1.95ml)之前,将稳定剂3(8ml)添加至iv袋中,以防止dart-a吸附到iv袋和iv管。当在剂量
制备期间将稳定剂3用抑菌盐水稀释时,用于施用的给药溶液(60ml总体积)包含约7.5mg/ml ba和0.013mg/ml ps80。在剂量制备期间稀释后,最终给药溶液将包含约3250ng/ml的dart-a浓度,以允许500ng/kg/天剂量的4天施用。
[0928][0929]
七天施用
[0930]
双特异性双抗体制剂(例如dart-a dp制剂)还可通过使用配备有iv袋或盒的单个移动泵在7天内连续iv输注施用。用于双特异性双抗体稀释的计算量基于受试者的重量(78kg的平均体重用于模拟研究)。表45描述了用于制备dart-a dp给药溶液的步骤的示例性方案。使用在抑菌盐水(0.9%ba、0.9%氯化钠,usp)中的稳定剂3在给药溶液中稀释dart-a dp制剂。将抑菌盐水(70ml)添加至空的iv袋中。然后在添加dart-a dp制剂(3.25ml)之前,将稳定剂3(18ml)添加至iv袋中,以防止dart-a吸附到iv袋和iv管。当在剂量制备期间将稳定剂3用抑菌盐水稀释时,用于施用的给药溶液(100ml总体积)将包含约7.5mg/ml ba和0.013mg/ml ps80。在剂量制备期间稀释后,最终给药溶液将包含约3250ng/ml的dart-a浓度,以允许500ng/kg/天剂量的7天施用。
[0931]
[0932][0933]
如在表44和表45中所示,正在进行研究以支持在含有稳定剂3的抑菌盐水袋中稀释的dart-a dp制剂的稳定性和相容性,以及使用移动iv袋和盒配置的该dart-a dp给药溶液的4天和7天施用。研究的目的是证明dart-a dp制剂以所需30-500ng/kg/天的剂量与含有稳定剂3的抑菌盐水袋相容,并且对于以约0.3ml/小时至约0.5ml/小时的流速的4天和7天施用与预期的输注组件相容。研究的目的在于评估室温储存后,在室温连续输注4天(96小时)和7天(168小时)期间,稳定剂3溶液中稀释的dart-a与单个移动泵输注组件的相容性和回收率。
[0934]
6.1.研究设计
[0935]
用于相容性研究的剂量制备可按照在图13中描述的建议的单个移动泵剂量制备方案。作为相容性研究的部分,dart-a蛋白质和防腐剂稳定性将在室温储存24小时期间监测。在储存后,施用可按照在图14中示出的建议的单个移动泵剂量施用配置。
[0936]
将进行48ml的给药溶液的连续施用(0.5ml/hr 4天(96小时))用于4-天施用或84ml的给药溶液的连续施用(0.5ml/hr 7天(168小时))。在以下部分中描述了将用于剂量制备和施用的方法。
[0937]
6.2.给药溶液制备
[0938]
给药溶液将通过如表44(4天施用)和表45(7天施用)所示制备,以实现适合于78kg患者的以500ng/kg/天剂量的目标药物浓度。给药溶液将在室温在普通iv袋中保存24小时,同时储存期间最小化对光的暴露。
[0939]
给药溶液的制备将需要三步骤过程,其涉及将生理盐水添加至空的静脉注射(iv)袋中,在含有生理盐水的iv袋中稀释稳定剂3,然后添加dart-a dp制剂。在添加至iv袋之前,稳定剂3小瓶将被充分摇晃。在稳定剂溶液添加后,每个iv袋将通过颠倒袋五分钟轻轻混合。混合后,将预定体积的dart-a dp制剂(参见表44或表45)添加到每个袋中。每个袋将通过颠倒五分钟再次彻底混合。混合后,将使用注射器从iv袋中除去所有空气。
[0940]
剂量制备后,将从每个袋采集等分试样用于外观、ph、渗透压和亚可见微粒t=0小时分析。将在所有样品产生后完成所有其他分析方法。每个袋将在室温孵育24小时至8天。储存时间结束后,在被输注之前,等分试样的给药溶液将从每个袋中采集用于分析,以测试给药溶液与施用组件的相容性。
[0941]
6.3.给药溶液施用和分析测试
[0942]
描述了如何可施用制备的给药溶液的实施例。储存后,制备的给药溶液将通过与过滤的施用扩展设置偶联的iv袋钉连接至移动泵,并且在室温4天(96小时)或7天(168小时)的过程内连续地输注。剂量施用期间的相容性将使用移动泵(例如,smiths medical cadd legacy-1移动泵)评估,该泵将被编程为将dart-a剂量以0.3ml/小时或0.5ml/小时递送4天(96小时)或以0.3ml/小时或0.5ml/小时递送7天(168小时)。如以上图14中所示,具有iv袋钉的smiths medical cadd施用设置可用于直接地将包含给药溶液的抑菌盐水袋连接至移动泵。输注的dart-a dp给药溶液将被采集在用抑菌盐水稀释的稳定剂3冲洗的玻璃瓶中以在样品采集期间除去外来颗粒。在样品采集之前,从瓶中移除过量的抑菌盐水稀释的稳定剂3并且使其干燥。输注完成一半后,新的空的玻璃瓶将替换先前的采集瓶。这将确保最终输注的给药溶液准确地表示4天(96小时)或7天(168小时)样品的保留时间。在剂量制备的时间(t=0小时)且从采集器皿中的最终分配池(输液后样品,输注t=4天/96小时,输注t=7天/168小时)中采集样品,并且将基本上如本文所述(参见特别地,实施例6)进行用于视觉外观、亚可见微粒、ph、渗透压、通过反相色谱法(rp-hplc)的防腐剂浓度、通过荧光尺寸排阻色谱法(flr se-hplc)和elisa测定的蛋白质回收率以及通过报告基因生物测定法的效力的分析测试。
[0943]
实施例7
[0944]
材料和方法
[0945]
7.1.hiac液体颗粒计数
[0946]
根据usp《787》进行颗粒计数分析。仅对在5
±
3℃储存的样品进行分析。总之,在60分钟脱气之前,将每个样品温热到室温。分析了thermo scientific标准品和rodi水,以确保正确的机器功能。为了最小化残留,从低到高浓度分析样品。在样品之间,用水冲洗探针。
[0947]
7.2.差示扫描量热法(dsc)
[0948]
差示扫描量热法测量在温度上升期间蛋白质展开的能量。峰代表表观熔融温度,并且峰下的面积代表热转变的焓。使用60℃/小时的升温速率,在20℃至90℃范围内收集重复样品的数据。
[0949]
7.3.毛细管等电聚焦(cief)
[0950]
进行cief分析以表征药物产品电荷变体。该配置包括具有alcott 720nv自动进样器的ice系统。制备样品为0.1mg/ml的最终浓度,并且在分析之前在5
±
3℃离心样品40分钟。
[0951]
7.4.液相色谱电喷雾电离质谱法(lc-esims)
[0952]
对于rs和老化的dp样品,在lc分离之后,用电喷雾电离质谱法(esi-ms)分析完整分子。在分析之前,用去污剂-out吐温旋转柱去除老化的dp中的ps80。然后通过lc-esi-ms分析样品。使用maxent1算法对通过电喷雾电离(esi)生成的蛋白质的多电荷离子的质谱去卷积,以提供完整分子的分子量。
[0953]
7.5.具有荧光检测的尺寸排阻高效液相色谱(flr se-hplc)
[0954]
进行flr se-hplc分析以测量蛋白质纯度、单体纯度和蛋白质稳定性。flr se-hplc配置包括荧光(flr)检测器(λ
x
=280nm,λe=340nm)、350mm流动相(175mm nah2po4、175mm na2so,ph 6.3)的流动相组合物和tosobio tsk g3000swxl尺寸排阻柱。在分析之前,将样品稀释至0.1mg/ml,并且在5
±
3℃保存24至96小时。每次30分钟运行,注入8μg的蛋白质(或100μl样品浓度低于0.1mg/ml)。监测hmw和lmw种类以及单体峰。
[0955]
7.6.胰蛋白酶肽图
[0956]
使用lc-ms在与waters xevo g2-xs qt仪器偶联的waters acuity uplc h-class bio上进行了简化的肽图实验。使用mse采集进行所有实验,以确认肽序列并且以阐明氨基酸修饰。使用waters unifi生物制药系统溶液处理样品。
[0957]
7.7.elisa(rhil3rα)
[0958]
简而言之,将测定板用可溶性重组人il-3受体α(rhil3rα)包被过夜。用磷酸盐缓冲盐水(pbs)中的5%牛血清白蛋白(bsa)封闭非特异性位点后,将板与dart-a标准校准物、质量对照和测试样品一起孵育。通过固定化的rhil3rα捕获标准校准物、质量对照和测试样品中存在的dart-a。通过添加2a5-生物素(识别dart蛋白质的e-螺旋/k-螺旋抗-(ek)抗体异源二聚化区域的生物素化抗体)和sulfo-tag标记的链霉亲和素(电化学发光(ecl)标签)来检测捕获的dart-a。添加msd读取缓冲液后,将板插入sector imager 2400板读取器中。当对板电极施加电压时,结合的sulfo-tag标签产生ecl信号,其被板读取器捕获。记录每个孔发出的ecl信号的定量测量值,并且使用4参数逻辑法(4pl)拟合将由标准校准物发出的ecl计数用于生成标准曲线。然后从样品的ecl计数和描述标准曲线的等式中内推dart-a样品的浓度。
[0959]
7.8.cd3结合测定
[0960]
通过在elisa中定量dart-a与固定化的可溶性重组人cd3(shcd3-fos-jun)的结合,间接酶联免疫吸附测定(elisa)用于评估dart-a的抗-cd3臂的效力。两条cd3链(δ和γ)包含fos蛋白或jun蛋白,以增强cd3复合物的适当折叠和功能性。elisa对dart-a的特异性是通过dart-a识别cd3抗原,然后使用针对e/k螺旋的特异性抗体检测结合的dart-a提供的。将可溶性cd3-fos-jun包被在elisa板的表面上。添加dart-a样品,允许其与shcd3-fos-jun结合。结合的dart-a的检测是用生物素缀合抗体(1f5-bt)完成的,该抗体识别dart分子的e/k螺旋。通过添加比色ap底物(ap-黄1组分底物)实现结合探针抗体的定量。通过ap氧化ap-黄产生可以在405
±
10nm处读取的有色产物。通过使用设置为405
±
10nm的最佳波长的分光光度计测量颜色强度量化测定。将数据拟合成具有以下变量约束的四参数模型:将每个剂量响应曲线的最大值、最小值和斜率设置为在板上的所有剂量应答曲线之间共享;对每条曲线独立地确定ec
50
。每个测定板包含dart-a校准参考标准样品和一到两个测试物品,以及用以控制板内变异性的第二组参考标准品(阳性对照)。测定运行可包含多个板,条件是每个板上包括校准和阳性对照参考标准样品。可报告的结果是相对效力,其用dart-a参考标准品校准曲线的ec
50
值除以测试物品的ec
50
计算。
[0961]
7.9.cd123结合测定
[0962]
通过在elisa中定量dart-a与固定化的重组白介素3受体(rhil3-r)的结合,间接酶联免疫吸附测定(elisa)被用于评估dart-a的抗-cd123臂的效力。elisa对dart-a的特异
性是通过dart-a识别il3r抗原,然后使用针对e/k螺旋的特异性抗体检测结合的dart-a提供的。将可溶性il3r包被在elisa板的表面上。添加dart-a样品,允许其与il3r结合。结合的dart-a的检测是用生物素缀合抗体(1f5-bt)完成的,该抗体识别dart分子的e/k螺旋。通过添加比色ap底物(ap-黄1组分底物)实现结合探针抗体的定量。通过ap氧化ap-黄产生可以在405
±
10nm处读取的有色产物。通过使用设置为405
±
10nm的最佳波长的分光光度计测量颜色强度量化测定。将数据拟合成具有以下变量约束的四参数模型:将每个剂量响应曲线的最大值、最小值和斜率设置为在板上的所有剂量响应曲线之间共享;对每条曲线独立地确定ec
50
。每个测定板包含dart-a校准参考标准样品和一到两个测试物品,以及用以控制板内变异性的第二组参考标准品(阳性对照)。测定运行可包含多个板,条件是每个板上包括校准和阳性对照参考标准样品。报告的结果是相对效力,其用dart-a参考标准品校准曲线的ec
50
值除以测试物品的ec
50
计算。
[0963]
7.10.报告基因生物测定
[0964]
基于抗体的或类似抗体的药物可用于通过抗体依赖性细胞介导的细胞毒性(adcc)靶向并且杀死癌细胞。该adcc样的报告生物测定法使用jurkat效应细胞系(promega,inc.),其已经用连接至其激活反映且测量adcc活性的荧光素酶基因的nfat响应元件工程化。kasumi-3细胞是表达cd123受体的人淋巴母细胞,并且在该生物测定中用作dart-a的靶标。当在jurkat效应细胞和kasumi3靶细胞存在下添加dart-a时,其结合至在kasumi细胞上的cd123受体和在jurkat效应细胞上的cd3受体。该交联导致jurkat效应细胞和nfat途径的激活。然后,nfat应答元件能够驱动萤火虫萤光素酶报道基因的表达,其在添加检测底物(bio-glo)后可以使用发光阅读器准确地和直接地定量。
[0965]
对于该测定,可以将一个测试物品与dart-a参考标准品一起在单个测定板上运行。可以通过包括多个板来运行其他的测试物品。dart-a参考标准品必须在每个测定板上包括,并且与测试物品一起稀释至150至0.0006ng/ml的范围内的浓度(最终浓度50至0.002ng/ml)。将一次性使用的解冻然后装小瓶的细胞稀释至指定浓度,并且与dart-a稀释液一起在96孔板中于37℃孵育20-24小时。然后使用bio-glo通过测量的由酶促反应发射的发光量评估jurkat效应细胞的adcc报告基因激活。将数据拟合到4参数约束模型中,并且确定诱导一半响应的测试物品的浓度ec50,并且将其与参考标准品的ec50进行比较。可报告的结果是相对效力,其是对于每种测试物品相对于同一测定板上的dart-a参考标准品计算的。
[0966]
7.11.用于ba和mp回收率的rp-hplc
[0967]
使用反相(rp)hplc分析测量防腐剂回收率。rp-hplc配置包括光电二极管阵列(pda)检测器(λ
ba
=254nm,λ
mp
=340nm);400%乙腈、0.1%甲酸的流动相组合物;和5μm eclipse-xdb-c18 液相色谱柱。将样品稀释十倍。柱温设置为40
±
5℃。每运行10分钟,注入50μl溶液。
[0968]
7.12.微生物挑战测试
[0969]
进行了微生物挑战测试以评估稳定剂溶液的防腐剂作用。简而言之,根据表36制备了高浓度(1250ng/ml)的给药溶液。将usp《51》推荐的微生物引入具有在10cfu/ml和100cfu/ml之间的目标浓度的溶液中。将溶液在每种微生物的usp《51》推荐的温度保存,并且在预定时间点采集样品。样品的测试根据usp《1227》进行。与微生物的初始浓度相比,没
有微生物生长的阈值被确定为不大于0.5log菌落计数。
[0970]
本说明书中提及的所有出版物和专利以相同的程度通过引用并入本文,如同每个单独的出版物或专利申请被明确且单独地指出以其全部内容通过引用并入一样。尽管本发明已经结合其具体实施方式进行了描述,但是应当理解它能进一步改变,并且本技术意欲涵盖本发明的任何变化、用途或调整,其总体上遵循本发明的原理并且包括落入本发明所属领域内的已知或惯用实践内的并且可适用于前文所提出的实质特征的这种偏离。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1