抗FcRn抗体在治疗天疱疮和类天疱疮疾病中的用途的制作方法
抗fcrn抗体在治疗天疱疮和类天疱疮疾病中的用途
技术领域
1.本发明涉及用于通过施用新生儿fc受体(fcrn)抑制剂来治疗天疱疮和/或类天疱疮疾病的方法,该抑制剂包括但不限于与fcrn结合的抗体或其抗原结合片段。
背景技术:
2.天疱疮和类天疱疮疾病是皮肤和/或粘膜的自身免疫性发疱疾病。天疱疮影响皮肤的外层(表皮),并引起病变和易破裂的水疱。类天疱疮影响介于表皮与真皮之间的较下层的皮肤,产生不易破裂的紧绷水疱。在过去几十年里,利用类固醇疗法已经使天疱疮的预后得到了明显改善。然而,死亡率仍是一个问题(1.6%至12%的病例死亡)(hsu等人, br j dermatol.[英国皮肤病学杂志] 2016;174(6):1290-8;kasperkiewicz等人, nat rev dis primers.[自然综述:疾病起源] 2017;3:17026.;langan等人, bmj.[英国医学杂志] 2008;337:a180)。在这些病例中,死亡通常是由治疗相关的全身感染引起的,并且有较小的比例是由重叠感染的病变引起的。
[0003]
虽然类固醇极大地改善了患有天疱疮或类天疱疮疾病的患者的结局,但类固醇与严重且持久的副作用相关;因此,应尽可能地限制类固醇的使用。尽管针对某些自身免疫性障碍的其他目前可用的治疗(包括免疫抑制剂、静脉注射免疫球蛋白(ivig)、血浆去除术和抗cd20单克隆抗体(mab)(如利妥昔单抗(rituximab))可能有效,但它们可能与重大不良作用以及延迟或非持久应答有关。
[0004]
因此,需要用于治疗天疱疮和类天疱疮疾病的新方法。
技术实现要素:
[0005]
本发明涉及用于治疗天疱疮和/或类天疱疮疾病的方法。
[0006]
在一方面,提供了治疗有需要的受试者的天疱疮和/或类天疱疮疾病的方法,该方法包括向该受试者施用fcrn抑制剂,其中该fcrn抑制剂以至少10 mg/kg该受试者体重的剂量施用。在一个实施例中,该fcrn抑制剂以至少10 mg/kg该受试者体重的剂量施用,每周施用一次,持续至少五周。在一个实施例中,该fcrn抑制剂以10 mg/kg该受试者体重的剂量施用。在一个实施例中,该fcrn抑制剂每周施用一次,持续五周。在一个实施例中,该fcrn抑制剂以10 mg/kg该受试者体重的剂量施用,每周施用一次,持续五周。
[0007]
本文提供了治疗有需要的受试者的天疱疮和/或类天疱疮疾病的方法,其中该天疱疮是寻常型天疱疮(pemphigus vulgaris)、落叶型天疱疮(pemphigus foliaceus)、副肿瘤性天疱疮(paraneoplastic pemphigus)、药物诱发天疱疮、地方性天疱疮(巴西天疱疮(fogo selvagem))、红斑性天疱疮(pemphigus erythematosus)(塞-阿二氏综合征(senear-usher syndrome))、或增殖性天疱疮(pemphigus vegetans)。在一个实施例中,该类天疱疮疾病是大疱性类天疱疮(bullous pemphigoid)、粘膜类天疱疮(mucous membrane pemphigoid)、妊娠性类天疱疮(pemphigoid gestationis)、获得性大疱性表皮松解症(epidermolysis bullosa acquisita)、抗层粘连蛋白g1/抗p200类天疱疮、或扁平苔癣类
天疱疮(lichen planus pemphigoid)。在一个实施例中,该天疱疮是落叶型天疱疮。在一个实施例中,该天疱疮是寻常型天疱疮。
[0008]
本文提供了治疗有需要的受试者的天疱疮和/或类天疱疮疾病的方法,其中该受试者:(1) 基于以下已被诊断患有寻常型天疱疮或落叶型天疱疮:(i) 与寻常型天疱疮或落叶型天疱疮一致的临床病史,(b) 高于正常上限的抗dsg 1或抗dsg3抗体的存在,和/或 (c) 针对寻常型天疱疮或落叶型天疱疮的、至少一项呈阳性的基于组织的测试的病史;(2) 经历着活动性寻常型天疱疮或落叶型天疱疮并且患有以下:(i) 持续超过两周的病变,和/或 (ii) 皮肤或粘膜中至少三个活动性病变或至少两个活动性病变,其中该至少两个活动性病变中的至少一个是直径为至少1 cm的皮肤病变;和/或 (3) 展现出至少四分的天疱疮疾病面积指数(pdai)总活动性评分。
[0009]
本文提供了治疗有需要的受试者的天疱疮和/或类天疱疮疾病的方法,该方法进一步包括:(a) 测量该受试者的igg水平,其中施用该fcrn抑制剂导致igg水平下降;(b) 测量该受试者的循环免疫复合物(cic)水平,其中施用该fcrn抑制剂导致cic水平下降;(c) 测量该受试者的pdai总活动性评分,其中施用该fcrn抑制剂导致pdai总活动性评分下降;(d) 测量该受试者的抗dsg1抗体滴度,其中施用该fcrn抑制剂导致抗dsg1抗体滴度下降;(e) 测量该受试者的抗dsg3抗体滴度,其中施用该fcrn抑制剂导致抗dsg3抗体滴度下降;(f) 测量该受试者的抗上皮细胞抗体(aeca)滴度,其中施用该fcrn抑制剂导致aeca滴度下降;或 (g) 测量该受试者的补体成分3(c3)水平,其中施用该fcrn抑制剂导致该c3水平下降。
[0010]
本文提供了治疗有需要的受试者的天疱疮和/或类天疱疮疾病的方法,其中该受试者表现出以下病症中的一种或多种,并且其中该fcrn抑制剂的施用减少了以下病症中的一种或多种的发生:(a) 充满液体的皮肤水疱;(b) 破裂的水疱;(c) 皮肤上的鳞状红肿疼痛斑块;(d) 在水疱部位处的灼烧、疼痛和发痒;和/或 (e) 由于破裂和发炎的水疱引起的慢性皮肤感染。
[0011]
本文提供了治疗有需要的受试者的天疱疮和/或类天疱疮疾病的方法,该方法包括向该受试者施用fcrn抑制剂,其中该fcrn抑制剂是抗fcrn抗体或其抗原结合片段,其中该抗fcrn抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区包含cdr1、cdr2和cdr3(hcdr1、hcdr2和hcdr3),该轻链可变区包含cdr1、cdr2和cdr3(lcdr1、lcdr2和lcdr3);并且其中:(a) hcdr1包含seq id no: 3的氨基酸序列;hcdr2包含seq id no: 4的氨基酸序列;hcdr3包含seq id no: 5的氨基酸序列;lcdr1包含seq id no: 6的氨基酸序列;lcdr2包含seq id no: 7的氨基酸序列;并且lcdr3包含seq id no: 8的氨基酸序列;(b) hcdr1包含seq id no: 11或seq id no: 12的氨基酸序列;hcdr2包含seq id no: 13或seq id no: 14的氨基酸序列;hcdr3包含seq id no: 15、seq id no: 16、seq id no: 17、seq id no: 18、或seq id no: 19的氨基酸序列;lcdr1包含seq id no: 20的氨基酸序列;lcdr2包含seq id no: 21的氨基酸序列;并且lcdr3包含seq id no: 22的氨基酸序列;(c) hcdr1包含seq id no: 11的氨基酸序列;hcdr2包含seq id no: 13的氨基酸序列;hcdr3包含seq id no: 19的氨基酸序列;lcdr1包含seq id no: 20的氨基酸序列;lcdr2包含seq id no: 21的氨基酸序列;并且lcdr3包含seq id no: 23或seq id no: 24的氨基酸序列;(d) hcdr1包含seq id no: 25的氨基酸序列;hcdr2包含seq id no: 26的氨基酸序
列;hcdr3包含seq id no: 27的氨基酸序列;lcdr1包含seq id no: 28的氨基酸序列;lcdr2包含seq id no: 29的氨基酸序列;并且lcdr3包含seq id no: 30的氨基酸序列;(e) hcdr1包含seq id no: 31的氨基酸序列;hcdr2包含seq id no: 32的氨基酸序列;hcdr3包含seq id no: 33的氨基酸序列;lcdr1包含seq id no: 34的氨基酸序列;lcdr2包含seq id no: 35的氨基酸序列;并且lcdr3包含seq id no: 36的氨基酸序列;(f) hcdr1包含seq id no: 37的氨基酸序列;hcdr2包含seq id no: 38的氨基酸序列;hcdr3包含seq id no: 39的氨基酸序列;lcdr1包含seq id no: 40的氨基酸序列;lcdr2包含seq id no: 41的氨基酸序列;并且lcdr3包含seq id no: 42的氨基酸序列;或 (g) hcdr1包含seq id no: 43的氨基酸序列;hcdr2包含seq id no: 44的氨基酸序列;hcdr3包含seq id no: 19的氨基酸序列;lcdr1包含seq id no: 20的氨基酸序列;lcdr2包含seq id no: 45的氨基酸序列;并且lcdr3包含seq id no: 23的氨基酸序列。
[0012]
在一个实施例中,提供了治疗有需要的受试者的天疱疮和/或类天疱疮疾病的方法,该方法包括向该受试者施用fcrn抑制剂,其中该fcrn抑制剂是抗fcrn抗体或其抗原结合片段,其中该抗fcrn抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区包含cdr1、cdr2和cdr3(hcdr1、hcdr2和hcdr3),该轻链可变区包含cdr1、cdr2和cdr3(lcdr1、lcdr2和lcdr3);并且其中hcdr1包含seq id no: 3的氨基酸序列;hcdr2包含seq id no: 4的氨基酸序列;hcdr3包含seq id no: 5的氨基酸序列;lcdr1包含seq id no: 6的氨基酸序列;lcdr2包含seq id no: 7的氨基酸序列;并且lcdr3包含seq id no: 8的氨基酸序列。
[0013]
在一个实施例中,该fcrn抑制剂是抗fcrn抗体或其抗原结合片段,该抗fcrn抗体或其抗原结合片段包含重链可变区和轻链可变区,其中:(1) 该重链可变区包含seq id no: 1的序列,或与该seq id no: 1的序列具有至少80%同一性的序列;并且 (2) 该轻链可变区包含seq id no: 2的序列,或与该seq id no: 2的序列具有至少80%同一性的序列。在一个实施例中,该fcrn抑制剂是抗fcrn抗体或其抗原结合片段,该抗fcrn抗体或其抗原结合片段包含重链可变区和轻链可变区,其中该重链可变区包含seq id no: 1的序列,并且该轻链可变区包含seq id no: 2的序列。
[0014]
在一个实施例中,该fcrn抑制剂是抗fcrn抗体或其抗原结合片段,该抗fcrn抗体或其抗原结合片段包含重链和轻链,其中:(1) 该重链包含seq id no: 9的氨基酸序列,或与seq id no: 9的序列具有至少80%同一性的序列;并且 (2) 该轻链包含seq id no: 10的氨基酸序列,或与seq id no: 10的序列具有至少80%同一性的序列。在一个实施例中,该fcrn抑制剂是抗fcrn抗体或其抗原结合片段,该抗fcrn抗体或其抗原结合片段包含重链和轻链,其中该重链包含seq id no: 9的氨基酸序列,并且该轻链包含seq id no: 10的氨基酸序列。
[0015]
本文提供了治疗有需要的受试者的天疱疮和/或类天疱疮疾病的方法,该方法包括向该受试者施用fcrn抑制剂,其中该fcrn抑制剂是fc区或其fcrn结合片段,并且其中该fc区包含seq id no: 46、seq id no: 47、或seq id no: 48的氨基酸序列。
附图说明
[0016]
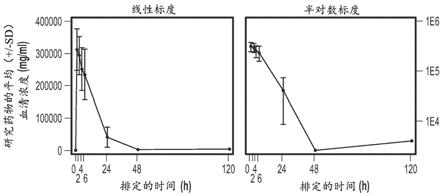
图1a和图1b示出了在第0天(图1a)和第28天(图1b)输注10 mg/kg研究药物1小时
后的平均血清浓度-时间曲线(线性标度和半对数标度)。对于平均浓度的计算和平均浓度-时间曲线的生成,将所有低于定量限(125 ng/ml)值设定为0,除非当单个blq(低于定量限值)落在2个可定量值之间时,在这种情况下将其忽略。药代动力学群体由如下所有受试者组成,这些受试者接受了至少1个剂量的研究药物并且具有足够的给药后血液样品以获得药代动力学参数。图中排除了超出排定的采样时间窗口的实际采样时间。
[0017]
图2示出了血清总igg水平相对于基线的变化百分比(
±ꢀ
sd)。基线定义为第0天访视(给药前)的测量结果。如果缺失,则使用第一次施用研究药物前的最后一次测量结果。
[0018]
图3示出了如通过循环免疫复合物(cic)-血清c1q结合测定所确定的cic水平相对于基线的变化百分比(
±ꢀ
sd)。基线定义为第0天访视(给药前)的测量结果。如果缺失,则使用第一次施用研究药物前的最后一次测量结果。
[0019]
图4示出了抗桥粒芯蛋白1(抗dsg1)抗体水平相对于基线的变化百分比(
±ꢀ
sd)。基线定义为第0天访视(给药前)的测量结果。如果缺失,则使用第一次施用研究药物前的最后一次测量结果。
[0020]
图5示出了抗桥粒芯蛋白3(抗dsg3)抗体水平相对于基线的变化百分比(
±ꢀ
sd)。基线定义为第0天访视(给药前)的测量结果。如果缺失,则使用第一次施用研究药物前的最后一次测量结果。
[0021]
图6示出了天疱疮疾病面积指数(pdai)总活动性评分相对于基线的变化百分比(
±ꢀ
sd)(安全性群体)。基线定义为第0天访视(给药前)的测量结果。
具体实施方式
[0022]
应理解的是,本发明不限于所描述的特定方法和条件,因此方法和条件可以变化。还应理解的是,本文所用的术语仅出于描述特定实施例的目的,而并不意图进行限制。
[0023]
除非另外定义,否则本文所用的所有技术和科学术语具有与本披露的发明所属领域的普通技术人员通常所理解的相同的含义。
[0024]
在一方面,提供了治疗天疱疮和/或类天疱疮疾病的方法,这些方法包括向有需要的受试者施用fcrn抑制剂。fcrn抑制剂靶向导致多种免疫球蛋白g(igg)介导的自身免疫性障碍(包括igg介导的天疱疮和igg介导的类天疱疮疾病)的病理学的关键机制。fcrn是igg的细胞内转运整合膜fc受体。虽然最初将fcrn鉴定为在新生儿生命中发挥作用的受体,但今天已知fcrn在整个成年生命中继续发挥作用。fcrn主要存在于早期酸性核内体中,在其中,fcrn通过以下来调节血清igg浓度:结合内吞的单体igg并保护它不在溶酶体隔室中被降解,并将igg运输到细胞表面以在中性细胞外ph下释放。通过该机制,fcrn导致igg的血清半衰期较长,因为未被fcrn结合的igg会进入溶酶体途径并被降解。
[0025]
在生命的第一阶段,fcrn通过介导igg穿过母体胎盘或新生儿肠壁进行转移,在后代出生之前和之后赋予其被动免疫。fcrn在整个成年生命中继续发挥作用,并在多种组织(例如,肺和肝的上皮、血管内皮)以及单核细胞、巨噬细胞和树突状细胞中表达。
[0026]
fcrn缺陷小鼠对致病性igg自身抗体引起的自身免疫性疾病更具抵抗力,因为它们无法维持高浓度的致病性血清igg。因此,特异性阻断fcrn-igg相互作用可用于促进致病性igg抗体的降解,例如以治疗igg介导的自身免疫性疾病。fcrn还在主要组织相容性复合物(mhc)ii类抗原呈递和igg复合抗原的mhc i类交叉呈递中起着关键作用。当抗原以含igg
的免疫复合物(ic)形式呈递时,树突状细胞cd8-cd11b
+
cd11c
+
(炎性树突状细胞)在低抗原剂量下、以高度依赖于fcrn表达的途径显示出显著的交叉呈递。该途径涉及通过fcγ受体将ic内化到酸性核内体中。随后,抗原呈递细胞(apc)内fcrn对ic的结合启动了特定的机制,这些机制使得携带抗原的ic转运到隔室中,在这些隔室中抗原被加工成肽表位,这些肽表位与装载到mhc上相容。因此,树突状细胞中的fcrn增强mhc ii抗原的呈递并诱导抗原特异性cd4
+ t细胞的增殖,并且在抗原呈递到cd8
+ t细胞(细胞毒性t细胞)中展现出基本作用。后一种cd8
+ t细胞途径称为交叉呈递,并涉及细胞外抗原交叉进入mhc i类依赖性途径。阻断fcrn-ig ic相互作用可抑制ic的抗原呈递并且随后抑制由免疫相关抗原呈递刺激的t细胞活化。与apc(如树突状细胞)中的igg ic的相互作用也可促进如il-12、ifnγ和tnfα等炎性细胞因子的分泌。因此,阻断fcrn-ig ic相互作用可用于抑制固有免疫细胞和抗原激活的t细胞产生炎性细胞因子。
[0027]
天疱疮是一类罕见的影响皮肤和粘膜的发疱自身免疫性疾病。天疱疮(包括但不限于寻常型天疱疮和落叶型天疱疮)的发病机制与igg自身抗体与角质形成细胞抗原的结合有关。致病性自身抗体的主要抗原靶标是桥粒芯蛋白1和3(dsg 1和dsg 3),这些桥粒芯蛋白属于构成桥粒(一种负责维持细胞粘附的蛋白质结构)的一部分的钙粘蛋白家族蛋白。igg自身抗体与dsg的结合导致表皮角质形成细胞粘附的丧失,进而导致表皮内发疱以及松弛的水疱和糜烂的临床表现。阻断fcrn降低了天疱疮患者的总igg水平,包括致病性自身抗体水平的相应降低。这可导致患有天疱疮(包括但不限于寻常型天疱疮和落叶型天疱疮)患者的粘膜表现和皮肤表现的减少。
[0028]
类天疱疮疾病的特征是存在对抗真皮-表皮连接处不同结构组分的自身抗体。连接蛋白将基底角质形成细胞的细胞骨架连接到真皮的细胞外基质,并且类天疱疮自身抗体的结合导致表皮的分离。许多类天疱疮疾病(包括但不限于大疱性类天疱疮和粘膜类天疱疮)的发病机制都与igg自身抗体与抗原(包括但不限于层粘连蛋白332和/或半桥粒蛋白bp180或bp230)的结合有关。如上所述,阻断fcrn可降低总igg水平,包括致病性自身抗体水平的相应降低,这有益于患有igg自身抗体介导的类天疱疮疾病的患者。
[0029]
在一方面,提供了用于通过向有需要的受试者施用治疗有效量的fcrn抑制剂(例如,特异性结合fcrn的抗体或其抗原结合片段,或本文所描述的任何其他“fcrn抑制剂”)来治疗天疱疮和/或类天疱疮疾病的方法。在本文中,特别提供了抗fcrn抗体的参考文献,以说明代表性的fcrn抑制剂,并且不限制本发明的范围。
[0030]
如本文所用,术语“治疗(treating/treat)”等意指缓解或减轻至少一种症状或适应症的严重程度以暂时或永久地消除症状的原因,或获得有益的或所希望的临床结果。有益的或所希望的临床结果包括但不限于以下:症状的缓解;病症、障碍或疾病程度的减轻;病症、障碍或疾病的状态的稳定(即,未恶化);病症、障碍或疾病的发作延迟或进展减缓;病症、障碍或疾病状态的改善;以及病症、障碍或疾病的(部分或总体上的)缓解(可检测或不可检测)或好转(enhancement)或改善。治疗包括在没有过度水平的副作用的情况下引起临床上显著的响应。治疗还包括与未接受治疗时的预期生存期相比延长的生存期。可通过本文所披露的方法减轻或消除的天疱疮症状包括但不限于充满液体的皮肤水疱,破裂的水疱,皮肤上的鳞状红肿疼痛斑块,在水疱部位处的灼烧、疼痛和发痒,和/或由于破裂和发炎的水疱引起的慢性皮肤感染。可通过本文所披露的方法减轻或消除的类天疱疮疾病的症状
包括但不限于充满液体的皮肤水疱、破裂的水疱、皮肤发痒、湿疹和蜂巢样皮疹(hive-like rash)。当口腔粘膜被感染时,症状可以进一步包括疼痛、灼烧、被感染的内层组织脱落以及对酸性食物敏感。
[0031]
在本文所描述的方法中,向有需要的受试者施用治疗有效量的fcrn抑制剂。“受试者”意指哺乳动物,包括但不限于人或非人哺乳动物,如牛、马、犬、绵羊、或猫等。在本文中,个体和患者也是受试者。“治疗有效量”意指本文所阐述的fcrn抑制剂当施用于哺乳动物时可有效产生治疗效果的量。
[0032]
在一些实施例中,该天疱疮是寻常型天疱疮、落叶型天疱疮、副肿瘤性天疱疮、药物诱发天疱疮、地方性天疱疮(巴西天疱疮)、红斑性天疱疮(塞-阿二氏综合征)、或增殖性天疱疮。
[0033]
在一些实施例中,该类天疱疮疾病是大疱性类天疱疮、粘膜类天疱疮、妊娠性类天疱疮、获得性大疱性表皮松解症、抗层粘连蛋白g1/抗p200类天疱疮、或扁平苔癣类天疱疮。
[0034]
在一方面,fcrn抑制剂的施用促进单体形式的致病性igg抗体的降解。在另一方面,fcrn抑制剂的施用促进以含igg免疫复合物(ic)形式呈现的致病性igg抗体的降解。
[0035]
在一方面,提供了降低有需要的受试者的总igg水平的方法,该方法包括选择患有天疱疮和/或类天疱疮疾病的受试者并向该受试者施用一个或多个剂量的治疗有效量的fcrn抑制剂。在一些实施例中,与对照水平相比,总igg水平降低约5%、约10%、约15%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约100%。“对照水平”可以指在来自罹患或已经诊断患有天疱疮和/或类天疱疮疾病的一个或多个个体的一个或多个样品中测量的水平。该水平能以个体为基础来测量,也能以总体为基础来测量,如平均值。在一些实施例中,针对其病症正在受监测的同一个体测量对照水平,但在不同时间处获得。在某些实施例中,“对照”水平可以指在更早时间(例如,更早的周、月、或年)从同一患者获得的水平。在一些实施例中,在患者接受针对天疱疮和/或类天疱疮疾病的任何疗法之前,从该患者获得对照水平。
[0036]
在一方面,提供了降低有需要的受试者的循环免疫复合物(cic)水平的方法,该方法包括选择患有天疱疮和/或类天疱疮疾病的受试者并向该受试者施用一个或多个剂量的治疗有效量的fcrn抑制剂。在一些实施例中,与对照水平相比,cic水平降低约5%、约10%、约15%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约100%。
[0037]
在另一方面,提供了降低有需要的受试者的抗dsg 1和/或抗dsg 3抗体水平的方法,该方法包括选择患有天疱疮和/或类天疱疮疾病的受试者并向该受试者施用一个或多个剂量的治疗有效量的fcrn抑制剂。在一些实施例中,与对照水平相比,抗dsg 1水平和/或抗dsg 3抗体水平降低约5%、约10%、约15%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约100%。
[0038]
本文所披露的方法包括施用治疗有效量的fcrn抑制剂。如本文所用,“fcrn抑制剂”是指能够抑制、阻断、消除或干扰fcrn与igg之间相互作用的任何分子。在一些实施例中,fcrn抑制剂可以是抗体或其抗原结合片段、小分子化合物、核酸、多肽或其功能片段或变体。合适的fcrn抑制剂的其他非限制性实例包括rnai分子(如抗fcrn rnai分子)、反义分子(如抗fcrn反义rna)、以及显性阴性蛋白(如显性阴性fcrn蛋白)。
[0039]
如本文所用,术语“抗体”是指包含四条多肽链(通过二硫键互相连接的两条重(h)链和两条轻(l)链)的免疫球蛋白分子以及其多聚体(例如,igm)。在典型的抗体中,每条重链包含重链可变区(在本文中缩写为hcvr或vh)和重链恒定区。重链恒定区包含三个结构域,即ch1、ch2和ch3。每条轻链包含轻链可变区(在本文中缩写为lcvr或vl)和轻链恒定区。轻链恒定区包含一个结构域(cl1)。vh和vl区可进一步细分为高变区,也称为互补决定区(cdr),其间穿插有称为框架区(fr)的更加保守的区域。每个vh和vl由三个cdr和四个fr构成,它们自氨基-末端至羧基-末端按以下顺序排列:fr1,cdr1,fr2,cdr2,fr3,cdr3,fr4。在本发明的不同实施例中,抗fcrn抗体(或其抗原结合部分)的fr可以与人种系序列相同,或可以经天然或人工修饰。氨基酸共有序列可以基于两个或更多个cdr的并排分析进行定义。
[0040]
如本文所用,术语抗体的“抗原结合部分”、抗体的“抗原结合片段”等包括任何天然存在的、可酶促获得的、合成的或基因工程化的多肽或糖蛋白,该多肽或糖蛋白与抗原特异性结合以形成复合物。抗体的抗原结合片段可以使用任何合适的标准技术从例如全抗体分子中获得,这些标准技术例如蛋白水解消化技术或重组基因工程技术,该重组基因工程技术涉及对编码抗体可变结构域和任选地恒定结构域的dna进行操作和表达。这种dna是已知的和/或可容易地从例如商业来源、dna文库(包括例如噬菌体抗体文库)获得,或可以被合成。dna可以通过化学方法或通过使用分子生物学技术进行测序和操作,例如,以将一个或多个可变结构域和/或恒定结构域排列成合适的构型,或以引入密码子,创建半胱氨酸残基,修改、添加或删除氨基酸,等等。
[0041]
抗原结合片段的非限制性实例包括:(i) fab片段;(ii) f(ab')2片段;(iii) fd片段;(iv) fv片段;(v) 单链fv(scfv)分子;(vi) dab片段;以及 (vii) 由模拟抗体高变区(例如,分离的互补决定区(cdr),如cdr3肽)或限制性fr3-cdr3-fr4肽的氨基酸残基组成的最小识别单位。其他工程化的分子(如结构域特异性抗体、单结构域抗体、结构域缺失的抗体、嵌合抗体、cdr移植抗体、双抗体、三抗体、四抗体、微型抗体、纳米抗体(例如,单价纳米抗体、二价纳米抗体等)、小模块免疫药物(smip)和鲨鱼可变免疫球蛋白新抗原受体(ignar)结构域)也涵盖在如本文所用的表述“抗体结合片段”的范围内。
[0042]
抗原结合片段将通常包含至少一个可变结构域。可变结构域可以具有任何大小或氨基酸组成,并且将通常包含至少一个cdr,该cdr与具有一个或多个框架序列的框架相邻或在该框架中。在其中vh结构域与vl结构域相缔合的抗原结合片段中,vh和vl结构域可以以任何合适的排列相对于彼此定位。例如,可变区可以是二聚体并且含有vh-vh、vh-vl或vl-vl二聚体。可替代地,抗原结合片段可以含有单体vh或vl结构域。
[0043]
在某些实施例中,抗原结合片段可以含有与至少一个恒定结构域共价连接的至少一个可变结构域。可以在本文所披露的抗原结合片段内发现的可变结构域和恒定结构域的示例性非限制性构型包括:(i) vh-ch1;(ii) vh-ch2;(iii) vh-ch3;(iv) vh-ch1-ch2;(v) vh-ch1-ch2-ch3;(vi) vh-ch2-ch3;(vii) vh-cl;(viii) vl-ch1;(ix) vl-ch2;(x) vl-ch3;(xi) vl-ch1-ch2;(xii) vl-ch1-ch2-ch3;(xiii) vl-ch2-ch3;以及 (xiv) vl-cl。在可变结构域和恒定结构域的任何构型(包括上面列出的示例性构型中的任一种)中,可变结构域和恒定结构域可以彼此直接连接,或可以通过整个或部分的铰链区或接头区连接。铰链区可以由至少2个(例如,5个、10个、15个、20个、40个、60个或更多个)氨基酸组成,这些氨基酸在单个多肽分子中在相邻的可变结构域和/或恒定结构域之间形成柔性或半柔
性的连接。此外,本文所提供的抗体的抗原结合片段可以包含上面列出的可变结构域和恒定结构域构型中的任一种的同源二聚体或异源二聚体(或其他多聚体),这些可变结构域和恒定结构域构型彼此非共价缔合和/或与一个或多个单体vh或vl结构域缔合(例如,通过一个或多个二硫键)。
[0044]
在一些实施例中,本文所披露的方法包括施用抗fcrn抗体或其抗原结合片段,其中该抗fcrn抗体是嵌合抗体、人源化抗体或人抗体。
[0045]
如本文所用,“嵌合抗体”是指如下多肽,该多肽至少包含与另一种蛋白质的至少一部分(典型地是来自人抗体的免疫球蛋白恒定结构域)连接的抗体分子的抗原结合部分。
[0046]
如本文所用,“人源化抗体”是指具有如下框架区(fr)和如下互补决定区(cdr)的抗体,该框架区基本上具有人免疫球蛋白的氨基酸序列,该互补决定区基本上具有非人免疫球蛋白的氨基酸序列(“输入”序列)。在某些实施例中,抗体的人源化可以降低免疫原性。在某些实施例中,人源化抗体的框架是两种或更多种人抗体的复合物。在其他实施例中,该抗体的表面暴露的框架残基被人抗体的框架残基替换以形成人源化抗体。在一个优选的实施例中,选择框架以尽量减少在广泛的群体范围内预测为t细胞表位的氨基酸序列的存在。
[0047]
如本文所用,术语“人抗体”是指具有来自人种系免疫球蛋白序列的可变区和恒定区的抗体。尽管如此,本文所提供的人抗体可以包括例如在cdr中且特别在cdr3中不由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性诱变或通过体内体细胞突变引入的突变)。
[0048]
适用于本文所披露方法的抗fcrn抗体进一步包括结合特征已通过直接突变、亲和力成熟方法、噬菌体展示或链改组而得到改善的那些抗体。亲和力和特异性可以通过使cdr突变以及筛选具有所需特征的抗原结合位点来修饰或改善(参见例如,yang等人, j. mol. biol.[分子生物学杂志], 254: 392-403 (1995))。cdr可以按多种方式突变。一种方式是使单个残基或残基的组合随机化,以便在其他方面相同的抗原结合位点的群体中,所有二十种氨基酸都在特定位置被发现。可替代地,可以通过易错pcr方法对一系列cdr残基诱导突变(参见例如,hawkins等人, j. mol. biol.[分子生物学杂志], 226: 889-896 (1992))。例如,含有重链和轻链可变区基因的噬菌体展示载体可以在大肠杆菌(e. coli)的增变菌株中繁殖(参见例如,low等人, j. mol. biol.[分子生物学杂志], 250: 359-368 (1996))。这些诱变方法是本领域技术人员已知的许多方法的示例。
[0049]
在一些实施例中,本文所披露的方法中使用的抗fcrn抗体或其抗原结合片段可以直接从表达抗fcrn抗体或其抗原结合片段的杂交瘤中获得。在其他实施例中,抗fcrn抗体或其抗原结合片段可以被克隆并在合适的宿主细胞(例如,cho细胞、ns/0细胞、hek293细胞)中重组表达。合适的宿主细胞包括植物细胞、哺乳动物细胞和微生物(如大肠杆菌和酵母)。可替代地,抗fcrn抗体或其抗原结合片段可以在转基因非人动物或植物(例如,转基因小鼠)中重组产生。
[0050]
在一些实施例中,本文所披露的方法中使用的fcrn抑制剂是经由抗fcrn抗体或其抗原结合片段的可变区特异性地结合fcrn的抗体或其抗原结合片段。术语“特异性地结合”等意指抗体或其抗原结合片段与抗原形成在生理条件下相对稳定的复合物。用于确定抗体是否与抗原特异性结合的方法是本领域众所周知的,且包括例如平衡透析、表面等离子体共振等。例如,“特异性地结合”fcrn的抗体包括以如下解离常数(kd)结合fcrn或其部分的
抗体:小于约500 nm、小于约300 nm、小于约200 nm、小于约100 nm、小于约90 nm、小于约80 nm、小于约70 nm、小于约60 nm、小于约50 nm、小于约40 nm、小于约30 nm、小于约20 nm、小于约10 nm、小于约5 nm、小于约4 nm、小于约3 nm、小于约2 nm、小于约1 nm或小于约0.5 nm,如在表面等离子体共振测定中所测量的。然而,特异性地结合人fcrn的分离的抗体可以对其他抗原(如来自其他(非人)物种的fcrn分子)具有交叉反应性。
[0051]
根据某些示例性实施例,fcrn抗体或其抗原结合片段包含重链可变区(hcvr)、轻链可变区(lcvr)和/或互补决定区(cdr),这些区包含美国专利申请公开号us 2018/0291101中所阐述的抗fcrn抗体或其抗原结合片段中任一种的氨基酸序列,该美国专利申请通过引用以其全文特此并入。
[0052]
在某些示例性实施例中,抗fcrn抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区包含seq id no: 1的氨基酸序列,该轻链可变区包含seq id no: 2的氨基酸序列。
[0053]
根据某些实施例,抗fcrn抗体或其抗原结合片段包含三个重链cdr(hcdr1、hcdr2和hcdr3)和三个轻链cdr(lcdr1、lcdr2和lcdr3),其中hcdr1包含seq id no: 3的氨基酸序列;hcdr2包含seq id no: 4的氨基酸序列;hcdr3包含seq id no: 5的氨基酸序列;lcdr1包含seq id no: 6的氨基酸序列;lcdr2包含seq id no: 7的氨基酸序列;并且lcdr3包含seq id no: 8的氨基酸序列。
[0054]
在某些实施例中,本文所提供的方法包括使用抗fcrn抗体,其中该抗体包含含有seq id no: 9的氨基酸序列的重链。在一些实施例中,抗fcrn抗体包含含有seq id no: 10的氨基酸序列的轻链。
[0055]
包含含有seq id no: 9的氨基酸序列的重链和含有seq id no: 10的氨基酸序列的轻链的示例性抗体是人源化的、亲和力成熟的igg4-к单克隆抗体(mab),该单克隆抗体阻断igg和ic与fcrn的相互作用并抑制fcrn在免疫应答中的多种作用。
[0056]
根据某些示例性实施例,本文所提供的方法包括使用该抗体或其生物等效物。如本文所用,术语“生物等效物”是指作为药物等效物或药物替代物的抗fcrn抗体或其结合fcrn的蛋白质或片段,这些药物等效物或药物替代物当在相似的实验条件下以相同的摩尔剂量(单剂量或多剂量)施用时,其吸收速率和/或程度未显示出与参考抗体(例如,包含含有seq id no: 9的氨基酸序列的重链和含有seq id no: 10的氨基酸序列的轻链的抗体)有显著差异。术语“生物等效物”包括与fcrn结合并且在安全性、纯度和/或效力方面与该参考抗体没有临床意义的差异的抗原结合蛋白。
[0057]
在一些实施例中,抗fcrn抗体或其抗原结合片段包含与seq id no: 1具有至少80%、至少90%、至少95%、至少98%、或至少99%序列同一性的重链可变区。
[0058]
在一些实施例中,抗fcrn抗体或其抗原结合片段包含与seq id no: 2具有至少80%、至少90%、至少95%、至少98%、或至少99%序列同一性的轻链可变区。
[0059]
序列同一性可以通过本领域已知的方法(例如,gap、bestfit和blast)测量。
[0060]
还提供了抗fcrn抗体或其抗原结合片段用于治疗天疱疮和/或类天疱疮疾病的用途,其中这些抗fcrn抗体或其抗原结合片段包含本文所披露的具有一个或多个保守氨基酸取代的重链或轻链可变区和/或cdr氨基酸序列中的任一种的变体。例如,提供了具有重链或轻链可变区和/或cdr氨基酸序列的抗fcrn抗体或其抗原结合片段的用途,这些重链或轻
链可变区和/或cdr氨基酸序列相对于本文所披露的重链或轻链可变区和/或cdr氨基酸序列中的任一种具有例如10个或更少、8个或更少、6个或更少、4个或更少等的保守氨基酸取代。
[0061]
可以用于本文所提供的方法的背景中的其他抗fcrn抗体或其抗原结合片段包括但不限于抗fcrn抗体dx-2500、dx-2504、dx-2507、hl161、洛利昔珠单抗(rozanolixizumab)(ucb7665)和m281。可以用于本文所提供的方法的背景中的另外的fcrn抑制剂包括专利权合作条约申请pct/us 2009/002536、pct/us 2012/040409、pct/kr 2014/005495、pct/kr 2015/004424、pct/ep 2013/059802、pct/ep 2014/074409、pct/us 2016/015720、或pct/us 2017/044765,或美国专利号7,662,928中描述的fcrn抑制剂(包括抗fcrn抗体)。将所有前述出版物中鉴定fcrn抑制剂、抗fcrn抗体及其抗原结合片段的部分通过引用特此并入。
[0062]
在一些实施例中,fcrn抑制剂是抗fcrn抗体或其抗原结合片段,该抗fcrn抗体或其抗原结合片段包含三个重链cdr(hcdr1、hcdr2和hcdr3)和三个轻链cdr(lcdr1、lcdr2和lcdr3),其中hcdr1包含氨基酸序列eyamg(seq id no: 11)或vyamg(seq id no: 12);hcdr2包含氨基酸序列sigssggqtkyadsvkg(seq id no: 13)或sigssggptkyadsvkg(seq id no: 14);hcdr3包含氨基酸序列lstgely(seq id no: 15)、lsirelv(seq id no: 16)、lsivdsy(seq id no: 17)、lslgdsy(seq id no: 18)、或laigdsy(seq id no: 19);lcdr1包含氨基酸序列tgtgsdvgsynlvs(seq id no: 20);lcdr2包含氨基酸序列gdsqrps(seq id no: 21);并且lcdr3包含氨基酸序列csyagsgiyv(seq id no: 22)。
[0063]
在一些实施例中,fcrn抑制剂是抗fcrn抗体或其抗原结合片段,该抗fcrn抗体或其抗原结合片段包含三个重链cdr(hcdr1、hcdr2和hcdr3)和三个轻链cdr(lcdr1、lcdr2和lcdr3),其中hcdr1包含氨基酸序列eyamg(seq id no: 11);hcdr2包含氨基酸序列sigssggqtkyadsvkg(seq id no: 13);hcdr3包含氨基酸序列laigdsy(seq id no: 19);lcdr1包含氨基酸序列tgtgsdvgsynlvs(seq id no: 20);lcdr2包含氨基酸序列gdsqrps(seq id no: 21);并且lcdr3包含氨基酸序列ssyagsgiyv(seq id no: 23)或asyagsgiyv(seq id no: 24)。
[0064]
在一些实施例中,fcrn抑制剂是抗fcrn抗体或其抗原结合片段,该抗fcrn抗体或其抗原结合片段包含三个重链cdr(hcdr1、hcdr2和hcdr3)和三个轻链cdr(lcdr1、lcdr2和lcdr3),其中hcdr1包含氨基酸序列gftfsnygmv(seq id no: 25);hcdr2包含氨基酸序列yidsdgdntyyrdsvkg(seq id no: 26);hcdr3包含氨基酸序列givrpfly(seq id no: 27);lcdr1包含氨基酸序列kssqslvgasgktyly(seq id no: 28);lcdr2包含氨基酸序列lvstlds(seq id no: 29);并且lcdr3包含氨基酸序列lqgthfpht(seq id no: 30)。
[0065]
在一些实施例中,fcrn抑制剂是抗fcrn抗体或其抗原结合片段,该抗fcrn抗体或其抗原结合片段包含三个重链cdr(hcdr1、hcdr2和hcdr3)和三个轻链cdr(lcdr1、lcdr2和lcdr3),其中hcdr1包含氨基酸序列gfslstygvgvg(seq id no: 31);hcdr2包含氨基酸序列niwwdddkrynpslen(seq id no: 32);hcdr3包含氨基酸序列tpayygshppfdy(seq id no: 33);lcdr1包含氨基酸序列rtsediytnla(seq id no: 34);lcdr2包含氨基酸序列vaktlqd(seq id no: 35);并且lcdr3包含氨基酸序列lqgfkfpwt(seq id no: 36)。
[0066]
在一些实施例中,fcrn抑制剂是抗fcrn抗体或其抗原结合片段,该抗fcrn抗体或其抗原结合片段包含三个重链cdr(hcdr1、hcdr2和hcdr3)和三个轻链cdr(lcdr1、lcdr2和
lcdr3),其中hcdr1包含氨基酸序列fsywv(seq id no: 37);hcdr2包含氨基酸序列tiyysgntyynpslks(seq id no: 38);hcdr3包含氨基酸序列ragiltgylds(seq id no: 39);lcdr1包含氨基酸序列ggnnigsksvh(seq id no: 40);lcdr2包含氨基酸序列ddsdrps(seq id no: 41);并且lcdr3包含氨基酸序列qvwdsssdhvv(seq id no: 42)。
[0067]
在一些实施例中,fcrn抑制剂是抗fcrn抗体或其抗原结合片段,该抗fcrn抗体或其抗原结合片段包含三个重链cdr(hcdr1、hcdr2和hcdr3)和三个轻链cdr(lcdr1、lcdr2和lcdr3),其中hcdr1包含氨基酸序列tyamg(seq id no: 43);hcdr2包含氨基酸序列sigasgsqtryads(seq id no: 44);hcdr3包含氨基酸序列laigdsy(seq id no: 19);lcdr1包含氨基酸序列tgtgsdvgsynlvs(seq id no: 20);lcdr2包含氨基酸序列gdserps(seq id no: 45);并且lcdr3包含氨基酸序列ssyagsgiyv(seq id no: 23)。
[0068]
在其他实施例中,本文所披露的方法中使用的fcrn抑制剂是经由fc区或其结合fcrn的片段结合fcrn的fcrn抑制剂。在一个实施例中,经由fc区或其结合fcrn的片段结合fcrn的fcrn抑制剂包含抗体可变区和/或ch1结构域。在一个实施例中,经由fc区或其结合fcrn的片段结合fcrn的fcrn抑制剂不包含抗体可变区和/或ch1结构域。在一个实施例中,fcrn抑制剂是pct/ep 2011/050071、pct/us 2014/072087或pct/ib 2016/000398中所描述的fcrn抑制剂。将前述出版物中鉴定fcrn抑制剂的部分通过引用特此并入。在一个实施例中,fcrn抑制剂包含含有seq id no: 46、seq id no: 47或seq id no: 48的fc结构域。
[0069]
本披露的方法可以使用本文所披露和/或通过引用并入的fcrn抑制剂、抗fcrn抗体或其抗原结合片段中的任一种。
[0070]
在本文所披露的方法中,包含fcrn抑制剂的治疗性组合物能以任何方便的方式施用,包括通过注射、输注、输血、植入或移植。本文所描述的方法中使用的组合物能以皮下、皮内、瘤内、结节内、髓内、肌内、颅内方式,通过静脉内注射或淋巴管内注射,通过静脉内输注或淋巴管内输注,或以腹膜内方式施用于患者。在一个实施例中,本文所披露的方法中使用的组合物优选地通过静脉内输注来施用。在另一个实施例中,本文所披露的方法中使用的组合物优选地通过皮下输注或注射来施用。
[0071]
在某些实施例中,将fcrn抑制剂(如抗fcrn抗体或其抗原结合片段)通过静脉内输注施用于哺乳动物,即,在某个时间段内将该抗体或其抗原结合片段引入哺乳动物的静脉中。在某些实施例中,该时间段是约5分钟、约10分钟、约30分钟、约1小时、约2小时、约4小时、或约8小时。
[0072]
在某些实施例中,本文所披露的方法包括以多剂量(例如,作为特定治疗性给药方案的一部分)向有需要的受试者施用fcrn抑制剂(如抗fcrn抗体或其抗原结合片段)。在一些实施例中,该治疗性给药方案可以包括以每周一次或每隔一周一次的频率向受试者施用一个或多个剂量的fcrn抑制剂。
[0073]
在某些实施例中,该一个或多个剂量在至少一个治疗周期中施用。治疗周期可以包括一个或多个初始剂量、一个或多个第二剂量、以及一个或多个第三剂量。根据该方面,这些方法包括向有需要的受试者施用至少一个治疗周期,该至少一个治疗周期包括施用3个、5个、8个或更多个剂量的fcrn抑制剂(如抗fcrn抗体或其抗原结合片段)。在一个实施例中,治疗周期包括3个剂量的fcrn抑制剂。在一个实施例中,治疗周期包括5个剂量的fcrn抑制剂。在一个实施例中,治疗周期包括8个剂量的fcrn抑制剂。
[0074]
单个剂量内含有的fcrn抑制剂的量可以表示为抗体的毫克数/千克受试者体重(即,mg/kg)。在某些实施例中,每个剂量的fcrn抑制剂(如抗fcrn抗体或其抗原结合片段)包含10或30 mg/kg患者体重。在一个实施例中,每个剂量的fcrn抑制剂包含10 mg/kg患者体重。在一个实施例中,每个剂量的fcrn抑制剂包含30 mg/kg患者体重。
[0075]
在一些实施例中,一个或多个初始剂量作为负荷剂量施用。在一些实施例中,该一个或多个初始负荷剂量之后是作为维持剂量施用的一个或多个第二剂量。在其他实施例中,一个或多个初始剂量和第二剂量之后是一个或多个第三剂量。初始剂量、第二剂量和/或第三剂量可以均含有相同量的fcrn抑制剂(如抗fcrn抗体或其抗原结合片段)。然而,在某些实施例中,初始剂量、第二剂量和/或第三剂量中含有的fcrn抑制剂的量彼此不同(例如,适当地更高或更低)。
[0076]
在一些实施例中,将包含抗fcrn抗体或其抗原结合片段的一个或多个初始剂量施用于患有天疱疮和/或类天疱疮疾病的患者,其中该一个或多个初始剂量包含30 mg/kg受试者体重的抗fcrn抗体或其抗原结合片段。在一些实施例中,该一个或多个初始剂量之后是一个或多个第二剂量,其中该一个或多个第二剂量包含10 mg/kg该受试者体重的抗fcrn抗体或其抗原结合片段。在一个实施例中,该一个或多个初始剂量每周施用一次。在一个实施例中,该一个或多个第二剂量每隔一周施用一次。
[0077]
在一方面,提供了治疗有需要的受试者的天疱疮和/或类天疱疮疾病的方法,该方法包括向该受试者施用抗fcrn抗体或其抗原结合片段,其中该fcrn抗体或其抗原结合片段以10 mg/kg该受试者体重的剂量每周施用一次。在一个实施例中,抗fcrn抗体其抗原结合片段以10 mg/kg的剂量施用,每周施用一次,持续至少五周。在一个实施例中,抗fcrn抗体或其抗原结合片段以10 mg/kg的剂量施用,每周施用一次,持续五周。在一个实施例中,抗fcrn抗体包含重链和轻链,该重链包含seq id no: 9的氨基酸序列,该轻链包含seq id no: 10的氨基酸序列。在一个实施例中,抗fcrn抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区包含seq id no: 1的氨基酸序列,该轻链可变区包含seq id no: 2的氨基酸序列。在一个实施例中,抗fcrn抗体或其抗原结合片段包含三个重链cdr(hcdr1、hcdr2和hcdr3)和三个轻链cdr(lcdr1、lcdr2和lcdr3),其中hcdr1包含seq id no: 3的氨基酸序列;hcdr2包含seq id no: 4的氨基酸序列;hcdr3包含seq id no: 5的氨基酸序列;lcdr1包含seq id no: 6的氨基酸序列;lcdr2包含seq id no: 7的氨基酸序列;并且lcdr3包含seq id no: 8的氨基酸序列。
[0078]
在一方面,提供了治疗有需要的受试者的天疱疮和/或类天疱疮疾病的方法,该方法包括向该受试者施用初始剂量的抗fcrn抗体或其抗原结合片段,其中该初始剂量包含30 mg/kg受试者体重的抗fcrn抗体或其抗原结合片段。在一些实施例中,该初始剂量每周施用一次。在一个实施例中,抗fcrn抗体或其抗原结合片段以30 mg/kg受试者体重的初始剂量施用,每周施用一次,持续至少三周。在一个实施例中,抗fcrn抗体或其抗原结合片段以30 mg/kg受试者体重的初始剂量施用,每周施用一次,持续三周。在某些实施例中,该方法进一步包括向该受试者施用第二剂量的抗fcrn抗体或其抗原结合片段,其中该第二剂量包含10 mg/kg该受试者体重的抗fcrn抗体或其抗原结合片段。在一个实施例中,该第二剂量每隔一周施用。在一个实施例中,该第二剂量每隔一周施用,持续至少五周。在一个实施例中,该第二剂量每隔一周施用,持续五周。在一个实施例中,抗fcrn抗体包含重链和轻链,该重链包
含seq id no: 9的氨基酸序列,该轻链包含seq id no: 10的氨基酸序列。在一个实施例中,抗fcrn抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区包含seq id no: 1的氨基酸序列,该轻链可变区包含seq id no: 2的氨基酸序列。在一个实施例中,抗fcrn抗体或其抗原结合片段包含三个重链cdr(hcdr1、hcdr2和hcdr3)和三个轻链cdr(lcdr1、lcdr2和lcdr3),其中hcdr1包含seq id no: 3的氨基酸序列;hcdr2包含seq id no: 4的氨基酸序列;hcdr3包含seq id no: 5的氨基酸序列;lcdr1包含seq id no: 6的氨基酸序列;lcdr2包含seq id no: 7的氨基酸序列;并且lcdr3包含seq id no: 8的氨基酸序列。
[0079]
在某些实施例中,每个剂量包含100
ꢀ‑ꢀ
4500 mg的fcrn抗体或其抗原结合片段,例如100、500、1,000、1,500、2,000、2,500、3,000、3,500、4,000、4,500 mg或更多的抗fcrn抗体或其抗原结合片段。在一个实施例中,该剂量包含10 mg/kg的抗fcrn抗体或其抗原结合片段。在一个实施例中,该剂量包含30 mg/kg的抗fcrn抗体或其抗原结合片段。在一个实施例中,抗fcrn抗体包含重链和轻链,该重链包含seq id no: 9的氨基酸序列,该轻链包含seq id no: 10的氨基酸序列。在一个实施例中,抗fcrn抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区包含seq id no: 1的氨基酸序列,该轻链可变区包含seq id no: 2的氨基酸序列。在一个实施例中,抗fcrn抗体或其抗原结合片段包含三个重链cdr(hcdr1、hcdr2和hcdr3)和三个轻链cdr(lcdr1、lcdr2和lcdr3),其中hcdr1包含seq id no: 3的氨基酸序列;hcdr2包含seq id no: 4的氨基酸序列;hcdr3包含seq id no: 5的氨基酸序列;lcdr1包含seq id no: 6的氨基酸序列;lcdr2包含seq id no: 7的氨基酸序列;并且lcdr3包含seq id no: 8的氨基酸序列。
[0080]
在一个实施例中,fcrn抑制剂可以与一种或多种药学上可接受的赋形剂一起配制。
[0081]
本文所披露的方法中使用的药物组合物可以特别配制成固体或液体形式,包括适用于肠胃外施用的那些,例如,作为例如无菌溶液或悬浮液通过皮下、瘤内、肌内或静脉内注射或输注。
[0082]
可注射配制品或用于输注本文所披露的方法中使用的药物组合物的配制品可以通过已知的方法制备。因此,制备的可注射或可输注配制品优选地填充在适当的注射安瓿或适合输注的小瓶或袋子中。
[0083]
药学上可接受的赋形剂可以是药学上可接受的材料、成分或媒介物,如液体或固体填充剂、稀释剂、载体、制造助剂(例如,润滑剂、滑石粉、硬脂酸镁、硬脂酸钙或硬脂酸锌、或硬脂酸)、溶剂或封装材料(涉及将用于施用的治疗性化合物携带或运输至受试者)、膨胀剂、盐、表面活性剂和/或防腐剂。可用作药学上可接受的赋形剂的材料的一些实例包括:糖类,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,如羧甲基纤维素钠、乙基纤维素和乙酸纤维素;明胶;滑石粉;蜡;油,如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和大豆油;二元醇,如乙二醇和丙二醇;多元醇,如甘油、山梨醇、甘露醇和聚乙二醇;酯,如油酸乙酯和月桂酸乙酯;琼脂;缓冲剂;水;等渗盐水;ph缓冲溶液;膨胀剂,如甘露醇、甘氨酸、聚乙二醇和山梨醇;表面活性剂,如聚山梨醇酯、泊咯沙姆(poloxamer)、曲通、十二烷基硫酸钠(sds)、月桂醇硫酸钠(sodium laurel sulfate)、聚乙二醇、聚丙二醇以及乙二醇和丙二醇的共聚物;防腐剂,如十八烷基二甲基苄基氯化铵、六
甲氯铵、苯扎氯铵、苄索氯铵、芳香醇(如苯酚)、丁醇和苯甲醇、对羟基苯甲酸烷基酯(如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯)、儿茶酚、间苯二酚、环己醇、3-戊醇和间甲酚,以及药物配制品中采用的其他非毒性相容物质。
[0084]
其他合适的赋形剂可以在标准医药文献中找到,例如在“remington's pharmaceutical sciences [雷明顿药物科学]”, the science and practice of pharmacy [药剂学科学与实践], 第19版 mack publishing company [麦克出版公司], 伊斯顿, 宾夕法尼亚州, (1995)中。
[0085]
在一些实施例中,将包含本文所披露的方法中使用的fcrn抑制剂和药学上可接受的载体的组合物冻干并在施用前以重构用组合物形式提供。
[0086]
本技术中引用的氨基酸序列列于表1中。
[0087]
表1.氨基酸序列表1.氨基酸序列
将所有引用的出版物通过引用以其全文并入本文。此外,当术语在通过引用并入本文的参考文献中的定义或使用与本文所提供的该术语的定义不一致或相反时,适用本文所提供的该术语的定义,而不适用该参考文献中该术语的定义。
[0088]
为了便于更好地理解本发明,给出了特定实施例的以下实例。以下实例不应解读为限制或限定本发明的整个范围。
[0089]
实例实例1:施用于天疱疮患者的抗fcrn抗体的临床试验。
[0090]
该研究是一项1b/2期、多中心、开放标签临床试验,其中将抗fcrn抗体施用于天疱疮患者。
[0091]
该研究中所使用的示例性抗fcrn抗体是人单克隆抗fcrn抗体,其包含以下:包含seq id no: 9的氨基酸序列的重链和包含seq id no: 10的氨基酸序列的轻链;包含seq id no: 1/2的hcvr/lcvr氨基酸序列对;以及包含seq id no: 3-8的重链和轻链cdr序列(以下称为“研究药物”)。
[0092]
研究持续时间表2中总结了每个群组的受试者参与持续时间。
[0093]
表2.受试者参与持续时间研究群体确诊天疱疮(寻常型天疱疮或落叶型天疱疮)的年龄为18岁及以上的男性或女性受试者。
[0094]
纳入标准
ꢀ‑ꢀ
受试者必须符合以下标准才有资格参加该研究:(1) 愿意并能够阅
读、理解并签署知情同意书;(2) 筛选时年龄 ≥ 18岁的男性或女性;(3) 有基于所有以下3个标准的寻常型天疱疮或落叶型天疱疮的诊断记录:(a) 与寻常型天疱疮或落叶型天疱疮(限定为粘膜和/或皮肤病变的临床表现)一致的有记录的临床病史,(b) 高于正常上限(uln)的抗dsg 1或3抗体的存在,和/或 (c) 至少一项呈阳性的基于组织的测试(例如,活检、直接免疫荧光法 [dif])的病史;(4) 有限定为病变持续 》 2周,以及3个皮肤或粘膜活动性病变或2个活动性病变(其中至少一个是直径 》 1 cm的皮肤病变)的活动性疾病:(a) 如果用利妥昔单抗或其他抗cd20 mab治疗,则筛选之前 》 9个月,施用最后剂量,(b) 如果用其他免疫抑制剂(即,硫唑嘌呤、霉酚酸酯、甲氨蝶呤、氨苯砜、环孢菌素、他克莫司(tacrolimus)、西罗莫司(sirolimus)、或低剂量环磷酰胺 [≤ 100 mg/天])治疗,则在筛选之前剂量必须持续稳定4周(限定为剂量变化 《 25%),(c) 使用稳定的皮质类固醇剂量,其限定为 ≤ 1 mg/kg的强的松或等效物并且在筛选之前2周内不可增加超过50%,(d) 在进入该研究时针对天疱疮病变的允许的局部疗法包括用于皮肤的凡士林或aquaphor
®
或者用于口的氯己定,(e) 允许在筛选之前持续4周对导致 《 10%的天疱疮疾病面积指数(pdai)总活动性评分的病变稳定使用局部低强度氢化可的松(≤ 1%)、他克莫司、西罗莫司或吡美莫司(pimecrolimus);允许在筛选之前持续4周对口腔病变稳定使用地塞米松酏剂溶液(仅漱口(swish)并吐出),(f) 如果皮质类固醇使用不规律,则在筛选之前2周内不允许使用脉冲皮质类固醇;(5) 体重指数(bmi)》 18.5 kg/m2;(6) 在第一剂量的研究药物之前,有阴性妊娠测试记录(针对有生育潜力的妇女);(7) 有生育潜力的女性必须同意从筛选阶段直至最终研究访视期间禁欲,或者使用以下医学上可接受的避孕形式中的任何两种(每年失败率 《 1%):口服避孕药、含或不含杀精子软膏的避孕套、含杀精子软膏的隔膜或子宫帽、或宫内节育器(iud);其男性伴侣做过输精管切除术的女性必须同意使用另外一种医学上可接受的避孕形式;(8) 无生育潜力(定义为手术不育(子宫切除术、双侧卵巢切除术、或双侧输卵管结扎术后的状态)或绝经后至少12个月)的女性在研究期间不需要避孕;(9) 其女性伴侣具有生育潜力的男性,包括手术不育(输精管切除术后)的男性,必须同意从筛选阶段直至最终研究访视期间禁欲或使用医学上可接受的避孕形式;以及 (10) 筛选时的pdai总活动性评分 》 4。
[0095]
排除标准
ꢀ‑ꢀ
符合以下标准中任一项的受试者不具备参加该研究的资格:(1) 无法或不愿遵守该方案的受试者;(2) 筛选之前3年内有活动性非血液系统恶性肿瘤或非血液系统恶性肿瘤史(不包括非黑色素瘤皮肤癌和原位宫颈癌);(3) 人类免疫缺陷病毒(hiv)或丙型肝炎抗体阳性;(4) 乙型肝炎表面抗原阳性;(5) 活动性感染或复发性感染史;(6) 在筛选的30天内接受ivig治疗;(7) 在筛选之前3个月内接受了任何细胞毒性剂(硫唑嘌呤除外)或任何非抗cd20 mab疗法;(8) 在筛选之前30天内对研究药物或装置的任何暴露;(9) 在筛选的30天内经受血浆去除术或免疫吸附;(10) 在筛选之前任何时间接受细胞疗法,包括嵌合抗原受体和t细胞(car-t);(11) 参与者当前具有可能已经危及其安全性或依从性、妨碍该研究的成功进行或干扰对结果的解释的任何医疗状况;(12) 在筛选的3个月内使用任何全身或局部免疫抑制药物(不包括纳入标准允许的剂量);或 (13) 筛选时血清总igg 《 600 mg/dl。
[0096]
研究变量关于安全性的主要终点包括基于生命体征、体检、心电图(ecg)、临床安全性实验
室测试、不良事件(ae)的发生率、治疗期出现的不良事件(teae)和严重不良事件(sae)对研究药物安全性的确定,按剂量和给药方案、严重程度、以及与研究药物的关系进行总结。主要终点是以下测量结果:(i) 与基线相比,研究药物诱导的igg水平最低点的降低,和 (ii) 与基线相比,研究药物诱导的pdai总活动性评分的下降。
[0097]
该研究的次要终点包括:(1) 基于绝对血清水平和总igg、igg亚型(igg
1-4
)、免疫球蛋白a(iga)、免疫球蛋白m(igm)、白蛋白、cic、抗dsg1和抗dsg3抗体滴度以及补体成分3(c3)和抗上皮细胞抗体(aeca)水平相对于基线的变化百分比,通过间接免疫荧光法对药效动力学(pd)生物标志物的确定,按剂量、给药方案和访视进行总结;(2) 对包括以下的pk参数的确定:半衰期(t
1/2
)、根据浓度-时间曲线直接确定的最大血清浓度(c
max
)、观察到峰值血清浓度的时间(t
max
)、从给药前(时间0)到给药后24小时血清浓度-时间曲线下的面积(auc
0-24
)、以及从给药前(时间0)到无穷时间的血清浓度时间曲线下的面积(auc
0-∞
);根据最大血清浓度和相应的t
max
直接确定的最大血清浓度,按剂量、给药方案、访视和时间点进行总结;(3) 基于相对于基线的绝对变化和变化百分比,通过对pdai的响应来评估天疱疮疾病活动性,按剂量、给药方案和访视进行总结;(4) 使用pdai来评估天疱疮严重程度和疾病活动性;以及 (5) 研究药物的免疫原性,如通过与研究药物结合的抗体和中和抗体的存在所确定的,按剂量、给药方案、访视和时间点进行总结。表3中提供了pk参数的概述。
[0098]
该研究的另外的终点包括:(1) 按剂量、给药方案和访视进行总结的该研究药物的作用机制及对病理生理学的影响,如通过以下所确定的:(a) 通过浊度法得到的补体成分3(c3)水平,(b) 通过间接免疫荧光法得到的抗上皮细胞抗体(aeca)滴度,(c) 通过基因分型得到的fc γ r2a受体(fcgr2a)单核苷酸多态性(snp),(d) 通过总rna测序(rnaseq)确定的疾病和炎性标志物的存在,(e) 免疫表型分型,包括通过流式细胞术测量t细胞、单核细胞、自然杀伤(nk)细胞和b细胞,(f) 用于探索研究药物分布和消除的尿igg水平,以及 (g) 用于确定与天疱疮相关的免疫应答的探索性生物标志物;(2) 研究期间对皮质类固醇使用的评价,将其按剂量、给药方案和访视进行总结;(3) 通过对自身免疫性大疱性疾病生活质量(abqol)问卷的响应和skindex-29评分来评估研究药物对受试者健康相关生活质量(hr-qol)的影响,按剂量、给药方案和访视进行总结;(4) 对如通过摄影所确定的皮肤和粘膜病变外观变化的定性评估,按剂量、给药方案和访视进行呈现;以及 (5) 对不同时间点皮肤活检中研究药物水平的确定(皮肤活检任选)。
[0099]
表3. pk参数和描述
pk参数描述c
max
直接从数据中观察到的最大观察血清浓度t
max
达到直接来自数据的最大观察浓度的时间λz通过对数浓度与时间曲线的末端线性部分的线性回归而计算的表观一阶末端消除速率常数t
1/2
末端消除半衰期,计算为ln(2)/λzauc
0-24
从零时间到剂量施用后24小时的aucauc
0-∞
从零时间到无穷时间的auc(为auc
0-t
+c
last/λz
,其中c
last
为最后可定量的浓度)
研究设计多达8名诊断患有天疱疮(寻常型天疱疮或落叶型天疱疮)的受试者接受了每周10 mg/kg的研究药物 x 5个剂量(群组1)。
[0100]
多达12名诊断患有天疱疮(寻常型天疱疮或落叶型天疱疮)的受试者接受了每周
30 mg/kg的研究药物 x 3个剂量(负荷剂量),然后每隔一周接受10 mg/kg的研究药物 x 5个剂量(维持剂量)(群组2)。
[0101]
两个群组中的受试者均完成了以下评估阶段:筛选、治疗和随访。表4中提供了群组的概述。
[0102]
施用途径:iv。
[0103]
表4.群组概述。a多达3名患有落叶型天疱疮的受试者入选。b两名或更少的患有落叶型天疱疮的受试者入选。
[0104]
伴随药物和程序对受试者在入选之前至少3个月内接受的所有天疱疮治疗以及受试者在入选之前14天至研究结束期间接受的所有其他治疗进行了记录。
[0105]
允许的药物:(1) 用于治疗研究期间发生的活动性感染的局部抗生素;(2) 用于口腔念珠菌病的局部或全身治疗;(3) 必要时用于暂时缓解疼痛的局部利多卡因(lidocaine);(4) 受试者在研究期间所经历的任何ae的医学上指示的伴随治疗;(5) 潜在的输注相关反应(irr)(包括输注后头痛)的药物治疗:预防性使用对乙酰氨基酚、iv水合、苯海拉明(diphenhydramine)、组胺2(h2)阻断剂(例如,雷尼替丁(ranitidine)、法莫替丁(famotidine));(6) 应用于导致 《 10%的pdai总活动性评分的单个病变的低强度局部皮质类固醇(例如,氢化可的松 ≤ 1%);(7) 应用于导致 《 10%的pdai总活动性评分的单个病变的局部他克莫司、西罗莫司或吡美莫司;(8) 如果剂量在整个试验参与中保持稳定,则将地塞米松酏剂溶液用于口腔病变(仅漱口并吐出);以及 (9) 以下全身免疫抑制剂的稳定方案:硫唑嘌呤、霉酚酸酯、低剂量甲氨蝶呤、氨苯砜、环孢菌素、他克莫司、西罗莫司、皮质类固醇或低剂量口服环磷酰胺(≤ 100 mg/天)。在未被列为禁止的情况下,针对共存病症的伴随药物和治疗(包括针对天疱疮的那些)是允许的。
[0106]
除非上述规定允许,否则研究期间不允许使用以下药物:(1) 利妥昔单抗或其他抗cd20抗体;(2) 研究药物以外的单克隆抗体;(3) 除了列为允许的那些药物以外的任何其他局部或全身免疫抑制药物;(4) 输注前的iv皮质类固醇(除了在接受皮质类固醇以治疗先前对研究药物的输注反应的受试者中);(5) 任何研究药物或装置;以及 (6) 筛选的2周到最后剂量的研究药物后28天内的疫苗接种。
[0107]
皮质类固醇入选前:在筛选前因天疱疮或任何其他病症而服用的皮质类固醇必须处于 《 1 mg/kg的剂量并且剂量水平在筛选之前的2周内不得增加超过50%。在筛选之前的2周内不允许类固醇的脉冲给药。
[0108]
从筛选至最后剂量的研究药物之后的2周:因天疱疮或任何其他病症而服用的皮
质类固醇的剂量应在从筛选至最后剂量的研究药物之后的2周期间保持稳定(剂量水平变化 《 10%)。在此时间段期间不应开始或中止皮质类固醇,但经历irr、需要皮质类固醇作为irr管理的一部分的受试者除外。此类受试者可能在随后的研究药物输注之前已经预防性地接受了皮质类固醇。
[0109]
从最后剂量的研究药物之后的2周至研究参与的结束:只有在施用最后剂量的研究药物至少2周后,才可以按以下建议的时间表开始缓慢的皮质类固醇减量:如果是每天 》 30 mg的强的松,每两周减少不超过10 mg,直到最后剂量。如果受试者将受益于超过所允许的类固醇减量的天疱疮治疗的变化,则这应视情况而定。
[0110]
实验室测试使用中心实验室建立的方法进行实验室测试(血液学、尿分析、血清化学、病毒学、血清学、妊娠测试、pd、pk和ada)。本研究中测试的临床安全性实验室小组列于表5中。
[0111]
表5.临床安全性实验室小组。alt = 丙氨酸氨基转移酶;ast = 天冬氨酸氨基转移酶;bun = 血尿素氮;cbc = 全血细胞计数;hiv = 人类免疫缺陷病毒;ldh = 乳酸脱氢酶;vzv = 水痘带状疱疹病毒。水痘带状疱疹病毒。
[0112]
药代动力学(pk)采样
以下pk参数在群组1中确定:t
1/2
、c
max
、t
max
、auc
0-24
和auc
0-∞
。对于群组2,所研究的pk参数为c
max
和t
max
。对于群组2,所确定的pk参数为研究药物的最大血清浓度和相关的t
max
。
[0113]
药效动力学采样收集pd样品用于整个研究的分析。白蛋白的测量结果来自临床安全性实验室的结果。根据表6所示的时间表收集每种类型的pd标志物的样品。
[0114]
表6.药效动力学评估。尿igg仅在群组1中收集。尿igg仅在群组1中收集。
[0115]
天疱疮疾病面积指数(pdai)在经验证的问卷可用的区域中使用pdai测量天疱疮的严重程度和疾病活动性。在筛选时确定pdai总活动性评分。为了有资格参与研究,患者的疾病严重程度分级必须 》 4。假设受试者有资格,则在治疗期和随访期期间进行pdai。通过pdai将疾病严重程度分类为
轻度(0至8)、中度(9至24)和重度(≥ 25)(shimizu等人, j dermatol.[皮肤病学杂志] 2014; 41(11):969-73)。如下确定pdai评分:针对疾病活动性为0至250分(针对皮肤为 ≤ 120,针对头皮为 ≤ 10,以及针对粘膜为 ≤ 120),以及针对受损为0至13分(针对皮肤为 ≤ 12,以及针对头皮为 ≤ 1)(rosenbach等人, j invest dermatol.[皮肤病学研究杂志] 2009; 129(10):2404-10)。
[0116]
健康相关生活质量评估对于群组2,在经验证的问卷可用的区域中使用abqol和skindex-29评估健康相关生活质量。abqol问卷是在澳大利亚开发的,其作为一种基于患者的测量方法用于在自身免疫性大疱性疾病患者中量化疾病负担、监测疾病活动性以及评估对治疗性干预的响应(sebaratnam等人, jama dermatol.[美国医学会杂志
•
皮肤病学] 2013; 149(10):1186-91;sebaratnam等人, qual life res.[生活质量研究] 2015; 24(9):2257-60)。skindex-29的开发是为了测量皮肤病对患者生活质量的影响,使用的是自我管理的30个问题的皮肤病学调查(chren等人, j invest dermatol.[皮肤病学研究杂志] 1996; 107(5):707-13.)。
[0117]
统计考虑在研究数据的分析中采用了三个群体:(1) 由接受了至少一个剂量的研究药物的所有受试者组成的安全性群体;(2) 由接受了至少一个剂量的研究药物并且具有可用的给药后pd数据的所有受试者组成的pd群体;以及 (3) 由接受了至少一个剂量的研究药物并且具有可用的给药后pk数据的所有受试者组成的pk群体。针对安全性群体进行主要安全性分析。在适当的情况下,针对安全性群体、pd群体和pk群体统计了人口统计数据、受试者配置、筛选和基线特征。
[0118]
样本量。没有进行正式的样本量计算。受试者的数量是基于可行性选择的,并认为该数量足以满足研究目标。
[0119]
评估标准基线分析。基线特征包括病史、体检、生命体征和ecg,并使用描述性统计按剂量、给药方案和访视进行总结。
[0120]
安全性分析。对基于生命体征、体检、ecg、临床安全性实验室测试、ae的发生率、teae和sae对研究药物的评价按剂量和给药方案、严重程度、以及与研究药物的关系进行总结。
[0121]
剂量发现分析。使用描述性统计,对基于相对于基线的总igg水平和pdai总活动性评分的响应对研究药物的评价按剂量和给药方案、访视和时间点(如适用的话)进行总结。
[0122]
统计方法使用国际医学用语词典(medical dictionary for regulatory activities,meddra
®
;第19版或更高版本)系统器官类(soc)和优选术语(从逐字术语分类),对治疗期出现的ae(teae)进行总结。使用最严重分级,将优选术语出现至少一次的受试者的发病率和百分比包括在内。还总结了每个优选术语的事件数。分开总结因果关系(与研究药物的关系 [相关/不相关])。使用soc和优选术语,按受试者和剂量列出了导致退出、剂量改变或治疗停止的teae、sae和ae。确定ae的持续时间并将其连同采取的行动和结局一起包括在列表中。
[0123]
对实验室结果按时间点、剂量和给药方案进行总结。总结了实验室异常情况的发生率。总结了第一剂量的研究药物后最差的研究分级。将未编码的变量的结果以中心实验室的正常范围以下、之内或以上呈现在列表中。使用描述性统计,总结了每个计划的时间点处的生命体征测量结果和相对于基线的变化。对pd/pk结果按剂量和给药方案进行总结。研究药物的pd/pk参数的描述性统计包括平均值、标准偏差(sd)、变异系数(cv)、中值、最小值和最大值。
[0124]
对免疫原性结果按群组、访视和时间点进行总结。描述性统计包括平均值、sd、cv、中值、最小值和最大值。
[0125]
对疾病活动性标志物结果按剂量、给药方案和访视进行总结。描述性统计包括平均值、sd、中值、最小值和最大值。
[0126]
对pdai结果按评分(总活动性评分、总受损评分)、群组和访视进行总结。描述性统计包括相对于基线的绝对变化和相对于基线的变化百分比。
[0127]
群组1参与者的结果群组和施用的治疗入选群组1的所有八名受试者均按照方案中所计划的在研究期间施用了全部五次每周一次的输注。在八名患者中,四名受试者完成了研究。其余四名患者由于医生决定(三名患者)或由于接受了禁止的伴随药物(一名患者)而退出研究。早期退出研究的四名受试者被认为是100%依从性的,因为他们没有缺失任何剂量并且未在随访期期间退出研究。没有报告任何受试者因ae而中断输注、停止研究药物、减少剂量或停止研究。在退出的四名患者中,两名患者在第34天(在第29天接受了最后剂量的研究药物之后的5天)退出,一名患者在第78天(在第29天接受了最后剂量的研究药物之后的49天)退出,并且一名患者在第85天(在第29天接受了最后剂量的研究药物之后的56天)退出。群组的人口统计数据总结可在表7中找到。
[0128]
表7.人口统计数据总结。
[0129]
研究药物的血清浓度图1示出了在第0天和第28天输注10 mg/kg研究药物1小时后针对研究药物的平均血清浓度-时间曲线(线性标度和半对数标度)。在第0天和第28天输注10 mg/kg 1小时后研究药物的pk参数(未转换)总结提供于表8中。平均cmax从第0天时的313.1
ꢀµ
g/ml降低至第28天时的292.1
ꢀµ
g/ml。auc0-last在第0天时为3727 h*
µ
g/ml且在第28天时为3220 h*
µ
g/ml(表8)。如cmax(292.1
ꢀµ
g/ml)和auc0-last(3220 h*
µ
g/ml)所指示的,在10 mg/kg iv的5次每周一次的剂量后无研究药物的明显积累。
[0130]
表8.患有天疱疮的受试者的药代动力学参数估计(群组1,10 mg/kg)mg/kg)igg、igg亚型、iga、igm到第30天(第五次每周一次剂量之后)时,平均总igg水平相对于基线降低最大值57.3%,并在接下来的研究中恢复。
[0131]
直到施用后第30天均观察到血清总igg浓度的下降(n = 8)。到第30天(在5次每周一次的10 mg/kg研究药物的剂量后)时,平均血清总igg水平达到了相对于基线57.3%的最大降低。到第56天时,平均总igg水平已经恢复至基线以下17.5%(6/8受试者),并且继续增加(针对达到第112天最终随访访视的那些受试者(4/8受试者))(图2)。igg子类相对于基线的平均变化百分比的最低点也一致地在第30天时达到。直到第112天均观察到平均尿igg浓度大约14%的下降(n = 4)。
[0132]
iga或igm的水平无有意义的变化。血清iga相对于基线的平均变化百分比的范围
在0.1%(第7天)与15.4%(第84天)之间。血清igm相对于基线的平均变化百分比的范围在7.4%(第42天)与10.5%(第112天)之间。
[0133]
循环免疫复合物(cic)使用c1q结合测定和raji细胞免疫复合物测定来评估循环免疫复合物。raji测定评估了ic与raji细胞的细胞表面上的补体受体的结合。相比之下,c1q测定被固定在固定相中。如通过血清c1q结合测定所证明的,在第33天(n = 8),平均循环igg ic水平达到基线以下51.4%的最低点,并且到第56天时恢复至基线。cic的平均降低百分比在第42天时为34%(n = 6),在第84天时为21%(n = 5),并且在第112天时为11%(n = 4)。如通过raji细胞免疫复合物测定所证明的,cic相对于基线的平均变化百分比的最低点为第42天时的21%(n = 5)。cic的平均百分比在第56天开始增加。图3展示了通过血清c1q结合测定和raji细胞免疫复合物测定得到的cic相对于基线的变化百分比图。
[0134]
白蛋白在施用研究药物后,没有观察到白蛋白水平有临床意义的改变。除了1名受试者外,群组1中所有受试者的白蛋白水平均在参考范围内;一名受试者在第7天和第14天访视时有处于边界低水平的白蛋白。
[0135]
抗dsg1和抗dsg3抗体如图4和图5所示,在施用研究药物后,平均抗dsg1和抗dsg3抗体水平降低。在基线处,平均(sd)抗dsg1抗体水平为53.9(42.61)u/ml。在第33天时(n = 7),平均(sd)抗dsg1抗体水平为63.1(62.77)u/ml(相对于基线降低2.5%)。在第56天时(n = 5),平均(sd)抗dsg1抗体水平为51.2(62.66)u/ml(相对于基线降低8.7%)。在基线处,平均(sd)抗dsg3抗体水平为120.9(67.71)u/ml(n = 8)。在第33天时(n = 7),平均(sd)抗dsg3抗体水平为95.6(66.39)u/ml(相对于基线降低20.4%)。在第56天时(n = 5),平均(sd)抗dsg3抗体水平增加至114.0(81.22)u/ml(相对于基线降低3.3%)。这些结果表明,研究药物有效地降低igg和cic的水平并且降低抗dsg 1和3(天疱疮疾病中致病性自身抗体的主要抗原靶标)的自身抗体的水平。
[0136]
c3和抗上皮细胞抗体(aeca)在整个研究持续时间内,群组1中所有受试者的补体成分(c3)水平均在正常参考范围(90
ꢀ‑ꢀ
180 mg/dl)内。在整个研究持续时间内,群组1中的所有受试者均对抗基底膜区(bmz)抗体的筛选测试呈阴性。在研究期间的某个时间点,群组1中的所有8名受试者均对抗细胞间物质(ics)筛选测试呈阳性。在研究期间的某个时间点,这8名受试者中的七名还对ics滴度呈阳性。
[0137]
免疫原性的分析共7/8 [87.5%]的受试者在用10 mg/kg(群组1)的研究药物iv治疗后形成了ada:4名受试者在第14天时形成(n = 8),滴度范围为2至18;7名受试者在第28天时形成(n = 8),滴度范围为6.6至1560;并且5名受试者在第56天时形成(n = 6),滴度范围为45.5至2140。在完成了研究并在第112天时进行了ada评估的4名受试者中,3名为ada阳性。ada的存在似乎对研究药物的pk或pd没有显著影响。未观察到与ada的出现相关的对研究药物的降低igg的作用的明显影响。对于在第14天形成ada的4名受试者,igg水平随着研究药物的给药继续下降。通过auc测量的个体和平均药物暴露在第28天没有显著下降。对于在第14天形成ada
的受试者,igg水平随着研究药物的给药继续下降。在第28天有1560的高ada滴度的一名受试者在第四次和第五次每周一次的剂量后分别经历了两次2级输注相关反应。然而,高ada滴度并不一定与输注相关反应相关。
[0138]
天疱疮疾病面积指数(pdai)评分在施用研究药物后,在所有访视中观察到pdai总活动性评分的一致下降。pdai总活动性评分相对于基线的平均变化百分比的最低点大约为45.7%并且在第84天访视时达到(图6)。
[0139]
安全性分析一般而言,在iv施用10 mg/kg下,该研究在天疱疮患者中耐受性良好。没有导致研究药物停止、中断或减少的死亡或teae。在7名受试者中共报告20个有关的teae(全部为1级和2级)。最常见的有关teae为1级头痛(75%),其无论治疗或不治疗都会缓解。在1名受试者中有2个报告的sae(疾病进展和急性肾损伤),经评估与研究药物无关。一名受试者在第4次和第5次剂量时发展了输注相关反应,这些输注相关反应呈现为风团和发痒并经口服苯海拉明25 mg治疗而得到缓解。该受试者在发展输注相关反应时具有高ada滴度。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1