使用扩增的干细胞产品改善患有恶性血液病的患者的治疗结果的组合物和方法与流程
使用扩增的干细胞产品改善患有恶性血液病的患者的治疗结果的组合物和方法
1.相关申请的交叉引用
2.本技术要求于2019年5月17日提交的美国临时申请号62/849,588和于2019年5月23日提交的美国临时申请号62/852,147的权益,其公开内容通过引用以其全文并入本文。
技术领域
3.本发明涉及用于改善患有急性髓性白血病(aml)或另一种恶性血液病的患者的治疗结果的方法和组合物。扩增的干细胞产品包含在无需匹配(即,不考虑)脐带血单元彼此之间的hla类型或其与患者的hla类型的情况下,组合的(例如,合并的)源自多个供体的造血干细胞或造血干细胞与祖细胞。扩增的干细胞产品可以在化疗方案(例如不同强度的诱导方案、补救方案或巩固方案)后施用。
背景技术:
4.急性髓性白血病(aml)是成人急性白血病的主要原因,占所有成人白血病的大部分。尽管进行了广泛研究,但aml仍与长期生存率低有关。所有患者的5年总生存率(seer)为约28.3%,20岁及以上患者为约24%。相比之下,对于年龄小于20岁的患者,5年总生存率为约67%。常规化疗可有效实现一些aml患者疾病初步缓解。然而,由于该疾病具有高异质性,约30%的aml患者对化疗没有反应。需要注意的是,化疗在大多数患者中未能完全清除疾病,并且超过70%的缓解患者在初始治疗后2年内出现复发性aml。
5.目前尚无针对复发性aml患者的标准治疗方案,这与预后不良有关。复发性aml可由被称为微小残留病(mrd)的现象引起,该现象由对化疗具有抗性的aml细胞群介导。mrd被认为由白血病干细胞(lsc)群介导,因为该细胞群具有耐受化疗和其他治疗的能力。因此,开发靶向aml和解决mrd以实现疾病无复发清除的治疗方法一直是活跃的研究领域。
6.异基因造血干细胞移植(allo-hsct)已被研究作为aml患者的治愈性治疗选择,并且与常规化疗相比,其无病生存率更高。这些移植物通常源自骨髓、外周血和/或脐带血,特别是在通过施用例如gm-csf在供体中动员干细胞之后的外周血移植物。移植物的细胞是血液和免疫细胞的异源混合物,包括干细胞、红细胞、白细胞(包括t细胞、nk细胞等)和血小板。造血干细胞包含极少量的造血干细胞移植物细胞,通常少于总细胞群的1%。供体来源的t细胞介导的抗白血病作用有助于提高患者的生存率,因为已有报道表明自体和t细胞耗竭的移植物与较高的复发率相关。allo-hsct在临床上的使用受合适的hla匹配供体短缺的限制,并且与毒性和其他相关并发症有关。已有报道表明免疫应答导致正常组织损伤(例如,移植物抗宿主病(gvhd))。
7.微移植(输注非移植干细胞移植物)和/或非移植供体淋巴细胞输注已经研究作为aml患者的潜在治愈性治疗方法。已报道来自单个供体的动员pbsc的无关供体不匹配微移植为患者提供一些获益,但患者继续出现复发。(punwani等人,2018,leuk.res.rep.9:18-20)。hla不匹配的同种异体细胞疗法也已被研究用于使用部分匹配的动员外周血细胞治疗
aml。(mohrbacher等人,2014,blood 124:5944)。据报道,8名患者中有5名达到完全缓解/完全缓解伴有血液学不完全恢复(cr/cri)持续3至10+个月,然而作者报道尽管移植部分匹配,但缓解并不如所希望的那么持久。
8.因此,仍需要开发靶向aml和其他恶性血液病的治疗,以实现该疾病的无复发清除。本领域还仍需要开发毒性较小的疗法以及使用现有的治疗方案改善患有aml(包括复发性/难治性aml、新发aml和治疗相关性aml),以及其他恶性血液病(例如骨髓增生异常综合征(mds)、骨髓增生性肿瘤(mpn)和非霍奇金淋巴瘤(nhl))的患者的治疗结果。
技术实现要素:
9.提供本发明内容以简化形式介绍选择的概念,这些概念将在以下的具体实施方式中进一步描述。本发明内容不旨在确定要求保护的主题的关键特征,也不旨在帮助确定要求保护的主题的范围。
10.本发明提供了用于改善患有急性髓性白血病(aml)或其他恶性血液病的患者的治疗结果的方法,该方法通过向需要治疗的患者施用化疗方案或其周期,然后向该患者施用固定剂量的扩增的干细胞产品,其中在无需匹配该扩增的干细胞产品的hla类型与该患者的hla类型的情况下进行施用。该扩增的干细胞产品是源自至少两个人类供体的造血干细胞或造血干细胞与祖细胞的合并的基于细胞的产品,其中在无需与其他供体的hla类型匹配并且无需与患者的hla类型匹配的情况下,将来自供体的造血干细胞或造血干细胞与祖细胞组合。该扩增的干细胞产品的t细胞和红细胞耗竭。
11.还提供了用于改善患有aml或其他恶性血液病的人类患者的治疗结果的方法,包括:(a)选择用于向患者施用的扩增的造血干细胞产品,其中该选择不考虑(即,无需匹配)扩增的干细胞产品的hla类型或患者的hla类型;(b)对患者实施化疗方案或其周期;和(c)向患者施用固定剂量的选定扩增的干细胞产品。该扩增的干细胞产品是源自至少两个人类供体的造血干细胞或造血干细胞与祖细胞的合并的基于细胞的产品,其中在无需与其他供体的hla类型匹配并且无需与患者的hla类型匹配的情况下,将来自供体的造血干细胞或造血干细胞与祖细胞组合。如上所述,该扩增的干细胞产品的t细胞和红细胞耗竭。
12.本发明进一步提供了用于治疗患有aml或其他恶性血液病的患者的方法,该方法通过向患者施用化疗方案或其周期,然后向该患者施用固定剂量的扩增的干细胞产品,其中在无需匹配该扩增的干细胞产品的hla类型与该患者的hla类型的情况下进行施用。该扩增的干细胞产品是源自至少两个人类供体的造血干细胞或造血干细胞与祖细胞的合并的基于细胞的产品,其中在无需与其他供体的hla类型匹配并且无需与患者的hla类型匹配的情况下,将来自供体的造血干细胞或造血干细胞与祖细胞组合。如上所述该扩增的干细胞产品的t细胞和红细胞耗竭。
13.在某些实施方案中,固定剂量的扩增的干细胞产品含有约50个至约4亿个活cd34+细胞。在某些实施方案中,固定剂量的扩增的干细胞产品含有约5000万个、约7500万个、约1亿个、约2亿个、约3亿个、或约4亿个活cd34+细胞。在一些实施方案中,扩增的干细胞产品被制备、冷冻保存并储存以供以后作为“现成”产品使用。冷冻保存的扩增的干细胞产品向患者施用之前解冻。
14.扩增的干细胞产品是至少两个扩增的造血干细胞群和/或至少两个扩增的造血干
细胞与祖细胞群的合并,其中每个细胞群源自单独的供体。在一些实施方案中,每个细胞群从单独的脐带血单元或胎盘血单元(即,从出生时不同的人)获得。合并中至少两个细胞群的hla类型彼此不匹配。任选地,扩增的干细胞产品是扩增前合并的两个或更多个造血干细胞群或造血干细胞与祖细胞群的合并,然后该合并被扩增,或扩增后合并细胞群。任选地,扩增的干细胞产品是扩增前合并的两个或更多个人脐带血或胎盘血干细胞群或干细胞群和祖细胞群的合并,然后该合并被扩增,或扩增后合并细胞群。在一个实施方案中,合并中的细胞群全部源自相同人种(例如,非裔美国人、高加索人、亚洲人、西班牙裔、美洲原住民、澳大利亚原住民、因纽特人、太平洋岛民)的个体的脐带血和/或胎盘血,或全部源自相同种族(例如,爱尔兰人、意大利人、印度人、日本人、中国人、俄罗斯人等)的脐带血和/或胎盘血。在另一个实施方案中,在不考虑人种或种族的情况下,将合并中的造血干细胞或造血干细胞与祖细胞组合。
15.在又一个实施方案中,改善患有aml或另一种恶性血液病的患者的治疗结果的方法包括,在所述施用之前,离体扩增从至少两个人出生时的脐带血和/或胎盘血中获得的分离的人脐带血干细胞或干细胞和祖细胞的步骤。优选地,扩增步骤包括使人脐带血干细胞,或干细胞和祖细胞,与notch功能激动剂接触。激动剂可以是delta蛋白或serrate蛋白,或者delta蛋白或serrate蛋白的片段,该片段能够结合notch蛋白。在另一个实施方案中,扩增步骤包括使造血干细胞或干细胞和祖细胞与delta1
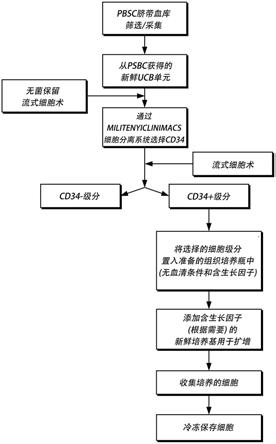
ext igg
(dxi)接触。
16.在另一个实施方案中,提供了一种用于改善患有恶性血液病的人类患者的治疗结果的方法,该方法包括:(a)从至少两个人出生时的脐带血和/或胎盘血中获得的分离的人脐带血干细胞或干细胞和祖细胞中富集造血干细胞,或造血干细胞与祖细胞,以产生富集造血干细胞或造血干细胞与祖细胞的细胞群;(b)离体扩增富集造血干细胞或造血干细胞与祖细胞的细胞群,以产生扩增的干细胞产品;(c)对患者实施化疗方案或其周期;和(d)向有需要的人类患者施用固定剂量的扩增的干细胞产品,其中在无需匹配该扩增的干细胞产品的扩增造血干细胞或扩增造血干细胞与祖细胞的hla类型与患者的hla类型并且无需匹配该扩增的干细胞产品的扩增造血干细胞或扩增造血干细胞与祖细胞彼此之间的hla类型的情况下进行施用。在优选的实施方案中,扩增造血干细胞是cd34+细胞。该方法可以进一步包括在步骤(b)后冷冻和储存扩增的干细胞产品和在步骤(c)前解冻扩增的干细胞产品的步骤。在某些实施方案中,患者患有aml,例如新发aml、复发性/难治性aml或治疗相关性aml,或其他恶性血液病,例如非霍奇金淋巴瘤、骨髓增生异常综合征(mds)或骨髓增生性肿瘤(mpn)。
17.定义
18.尽管在本发明的实践或测试中可以使用与本文描述的那些相似或等同的任何方法和材料,但是描述了优选的方法和材料。出于本发明的目的,以下术语定义如下。
19.如本文所用,“扩增的干细胞产品”是指富集造血干细胞或干细胞和祖细胞的细胞群,这些细胞群已接受用于扩增这些细胞群的造血干细胞或造血干细胞与祖细胞的技术,该技术已被证明可导致(i)在由此扩增的细胞的等分试样中,造血干细胞,或造血干细胞与祖细胞数增加,或(ii)通过有限稀释分析确定的严重联合免疫缺陷(scid)再增殖细胞数量增加,如输注由此扩增的细胞的等分试样的非肥胖糖尿病/严重联合免疫缺陷(nod/scid)小鼠中移植增强所示;相对于未接受扩增技术的细胞的等分试样所见。(参见美国专利公开
号2013/0095079;delaney等人,2010,nature med.16(2):232-236)。通常,造血干细胞或造血干细胞与祖细胞是cd34+。在一些实施方案中,造血干细胞或造血干细胞与祖细胞源自人脐带血和/或人胎盘血。在一些实施方案中,扩增的干细胞产品使用notch激动剂扩增方法进行制备。在一些实施方案中,扩增的干细胞产品使用dxi扩增方法进行制备。扩增的干细胞产品的t细胞和红细胞耗竭。
20.如本文所用,“化疗方案”是指用于化疗的方案,其定义了待使用的药物、它们的剂量、治疗的频率和持续时间,以及其他考虑因素。此类方案可以在联合化疗中联合数种化疗药物。化疗中使用的大多数药物具有细胞生长抑制作用或细胞毒性。
附图说明
21.本发明的前述方面和许多伴随的优点将变得更容易理解,因为通过参考以下具体实施方式并结合附图可以更好地理解这些优点,其中:
22.图1示出了显示用于富集cd34+细胞群和扩增富集细胞群的示例性程序的流程图。
23.图2示出了在实施例3中描述的临床研究期间的受试者处置。
具体实施方式
24.尽管已经说明和描述了说明性实施方案,但是应当理解,在不背离本发明的精神和范围的情况下可以在其中进行各种改变。
25.造血干/祖细胞移植,特别是自体造血干/祖细胞移植,通常用于实体瘤或多发性骨髓瘤高剂量化疗后挽救骨髓再生障碍。已发现同种异体造血干细胞移植通过根除患病的血液和免疫系统并通过输注健康供体造血干细胞移植物恢复血液稳态,可用于治疗白血病和其他恶性血液病。同种异体造血干细胞移植中一直存在的问题之一是缺乏与患者具有足够hla抗原和/或等位基因匹配以成功治疗的同种异体供体。最近,已经设计了通过选择扩增的造血干/祖细胞样品而不考虑扩增的人脐带血干/祖细胞样品的hla类型或患者的hla类型来为免疫低下的人类患者提供造血功能的方法和组合物。造血干细胞/祖细胞样品可用于在接受造血干细胞移植或高剂量化疗后具有高发病率和死亡率风险的人类患者,以暂时替代或补充造血功能或降低危及生命的感染率。出乎意料的是,已发现未进行hla分型且其中细胞产品不包含t细胞的扩增造血干细胞或造血干细胞与祖细胞产品可用于治疗和/或增加人急性髓性白血病(aml)或某些其他恶性血液病患者预后改善的机会。
26.本发明提供了用于患有aml或其他恶性血液病的患者的治疗方法,和用于改善该患者的治疗结果的方法,该方法通过对有需要的患者实施化疗方案,然后向该患者施用固定剂量的扩增的干细胞产品,其中在无需匹配该扩增的干细胞产品的hla类型与患者的hla类型的情况下进行施用。扩增的干细胞产品是基于细胞的产品,包含彼此之间的hla或其与患者的hla类型不匹配的造血干细胞或造血干细胞与祖细胞。在一些实施方案中,扩增的干细胞产品是源自混合来自至少两个不同的人类供体的脐带血单元或胎盘血单元的造血干细胞或造血干细胞与祖细胞的合并产品,包含彼此之间的hla或其与患者的hla类型不匹配的造血干细胞或造血干细胞与祖细胞。短语“无需匹配hla类型”、“不匹配的”等意指不采取任何步骤使患者与扩增的干细胞产品中的造血干细胞或造血干细胞与祖细胞之间的任何hla抗原或等位基因(hla类型)匹配。扩增的干细胞产品的选择在无需匹配向其施用扩增的
干细胞产品的患者的hla类型的情况下进行。类似地,关于造血干细胞或造血干细胞与祖细胞的来源,例如,来自脐带血单元或胎盘血单元,扩增的干细胞产品源于这些来源,短语“无需匹配hla类型”意指不采取任何步骤使扩增的干细胞产品中的造血干细胞或造血干细胞与祖细胞之间的任何hla抗原或等位基因(hla类型)匹配。还应注意的是,扩增的干细胞产品的t细胞和红细胞耗竭。
27.扩增的干细胞产品通常在化疗方案后施用。化疗方案可以是单药或多药方案。在一些实施方案中,化疗方案是诱导方案或巩固方案。诱导方案包括使用化疗作为没有替代疗法的晚期癌症患者的主要治疗。巩固方案包括在缓解期后立即使用的重复治疗周期,尤其是在白血病中。在一些实施方案中,化疗方案是补救方案。补救方案包括在初始治疗后恶性肿瘤复发的患者中使用化疗以期治愈或延长生命。在一些实施方案中,扩增的干细胞产品在化疗方案后约12至约48小时,或优选在化疗方案后约24至36小时施用。在一些实施方案中,扩增的干细胞产品在化疗方案的每个周期后约12至约48小时,或优选在每个周期后约24至36小时施用,其中化疗方案在多于一个周期中进行。
28.在一些实施方案中,在化疗方案的组分及其活性代谢物已经从患者的血液中清除后,向患者施用扩增的干细胞产品。在一些实施方案中,在诱导方案的组分及其活性代谢物已经从患者的血液中清除后,向患者使用扩增的干细胞产品。在一些实施方案中,在巩固方案的组分及其活性代谢物已经从患者的血液中清除后,向患者施用扩增的干细胞产品。在一些实施方案中,在补救方案的组分及其活性代谢物已经从患者的血液中清除后,向患者施用扩增的干细胞产品。在一些实施方案中,在化疗方案(例如诱导、补救或巩固方案)实施超过一个周期,在该方案的组分及其活性代谢物已经从患者血液中清除后,在(一个)周期或每个周期后向患者施用扩增的干细胞产品。如本文所用,“在
……
方案及其活性代谢物已经从患者血液中清除后”是指该方案(例如,诱导方案、补救方案或巩固方案)的组分和这些组分的活性代谢物的清除,这些组分的活性代谢物将影响患者的血液中cd34+干细胞活力,例如通过使cd34+干细胞或祖细胞活力降低至少5%、至少10%、或至少20%。
29.在每个方案或周期后施用扩增的干细胞产品可以改善患有aml或其他恶性血液病的患者的治疗结果,例如通过提高患者得以缓解(例如,完全缓解(cr)或完全缓解未伴不完全血液学恢复(cri))的机会。在一些实施方案中,改善的治疗结果与施用扩增的干细胞产品后患者体内il-2水平增加有关。增加的il-2水平表明患者的免疫应答增加。无意受任何特定理论的束缚,因为扩增的干细胞产品源自多个人类供体的不匹配的脐带血单元,所以扩增的造血干细胞产品包含具有不同hla类型和/或等位基因的造血干细胞或造血干细胞与祖细胞。向患者施用后扩增的干细胞产品的许多不匹配的hla类型或等位基因的存在激活和/或增加患者的免疫应答,这可能是由于抗原负荷增加所致。由此产生的患者免疫应答的激活或刺激可能部分是由于患者自身t细胞和/或nk细胞的激活。
30.扩增的干细胞产品不需要或不期望移植以为患者提供治疗获益。在一些实施方案中,扩增的干细胞产品未瞬时或永久植入患者体内。在一些实施方案中,扩增的干细胞产品未瞬时植入患者体内。植入通常在患者体内检测为混合嵌合现象,表示在施用扩增的干细胞产品后约7至约14天在患者血液中检测到来自扩增的干细胞产品的细胞。在一些实施方案中,扩增的干细胞产品未瞬时或长期显著地增加造血重建。在一些实施方案中,扩增的干细胞产品未降低患者的感染率。
31.频繁感染是用于治疗恶性血液病(例如aml)的化疗方案的常见并发症,并且是治疗失败的重要原因。化疗药物还可以是极度免疫抑制和/或高度骨髓抑制,这可能导致长期中性粒细胞减少。在化疗方案后施用扩增的干细胞产品可以改善治疗结果,而不必预防感染性并发症或促进化疗后的暂时造血恢复,而是通过诱导宿主对白血病的免疫应答。
32.扩增的干细胞产品的制备
33.扩增的干细胞产品包含造血干细胞或造血干细胞与祖细胞,并且其t细胞和红细胞已经基本上耗竭,因此通常包含富集数量的cd34+造血干细胞或造血干细胞与祖细胞。造血干细胞或造血干细胞与祖细胞包含多种hla类型,因为造血干细胞或造血干细胞与祖细胞在合并之前彼此之间不匹配,并且也与患者不匹配。如本文所用,t细胞基本上耗竭是指扩增的干细胞产品中少于1%的cd3+细胞、或少于0.5%的cd3+细胞、或少于0.1%的cd3+细胞。
34.在一些实施方案中,cd34+造血干细胞或造血干细胞与祖细胞源自脐带血或胎盘血。人脐带血和/或人胎盘血是脐带血干细胞的典型来源。此类血液可以通过本领域已知的方法获得。有关在人出生时采集脐带血和胎盘血的讨论,参见,例如,美国专利号5,004,681和7,147,626以及美国专利公开号2013/0095079,其通过引用并入本文。脐带血和/或人胎盘血采集在无菌条件下进行。采集时,脐带血或胎盘血与抗凝剂混合,例如cpd(柠檬酸-磷酸-葡萄糖)、acd(酸性柠檬酸-葡萄糖)、alsever溶液(alsever等人,1941,n.y.st.j.med.41:126)、de gowin溶液(de gowin等人,1940,j.am.med.ass.114:850)、edglugate-mg(smith等人,1959,j.thorac.cardiovasc.surg.38:573)、rous-turner溶液(rous和turner,1916,j.exp.med.23:219)、其他葡萄糖混合物、肝素、二香豆酸乙酯等。参见,通常,hurn,1968,storage of blood,academic press,new york,pp.26-160)。在一个实施方案中,可以使用acd。
35.脐带血可以优选通过从脐带直接引流和/或通过从胎盘根部和扩张的静脉针抽吸获得。优选地,所采集的人脐带血和/或胎盘血没有污染,特别是没有病毒污染。
36.在某些实施方案中,可以对采集的血液进行以下检测,无论是常规的还是在出现临床指征的情况下:
37.细菌培养:为确保没有微生物污染,可以进行既定的检测,例如在需氧和厌氧条件下进行常规医院细菌培养。
38.病原微生物的诊断筛查:为了确保不存在特定的病原微生物,可以采用各种诊断检测。可以通过标准程序对通过血液传播的众多病原体中的任何一种进行诊断筛查。作为一个实例,可以对采集的血液样品(或母体血液样品)进行诊断筛查以检测病毒的存在。基于病毒粒子、病毒编码的蛋白、病毒特异性核酸、病毒蛋白的抗体等的检测,可以使用许多已知的测定系统中的任一种。采集的血液还可用于感染性疾病检测,包括但不限于人类免疫缺陷病毒-1或2(hiv-1或hiv-2)、人类t细胞嗜淋巴细胞病毒i和ii(htlv-i和htlv-ii)、乙型肝炎、丙型肝炎、巨细胞病毒、梅毒、冠状病毒、西尼罗河病毒等。
39.优选地,在采集脐带血之前,确定母体健康史以识别脐带血细胞可能造成的风险,例如,传播遗传或感染性疾病,例如癌症、白血病、免疫疾病、神经系统疾病、肝炎或aids。采集的脐带血可以进行细胞活力、hla分型、abo/rh分型、cd34+细胞计数和总有核细胞计数中的一项或多项检测。
40.一旦在出生时从人类供体采集脐带血和/或胎盘血,血液经处理以产生富集的造血干细胞群,或富集的造血干细胞与祖细胞群。优选地,造血干细胞,或造血干细胞与祖细胞,是cd34+细胞或主要是cd34+细胞。优选地,造血干细胞或造血干细胞与祖细胞群的t细胞和红细胞基本上耗竭,导致细胞群富集cd34+干细胞和/或cd34+干细胞和祖细胞。因此,富集是指造血干细胞,或造血干细胞与祖细胞,在细胞群中的百分比增加(相对于在富集程序之前在该群中的百分比)的过程。纯化是富集的一个实例。在某些实施方案中,相对于富集程序之前的群,cd34+细胞(或其他合适的抗原阳性细胞)的数量在扩增的干细胞产品中占细胞的百分比增加至少25倍、50倍、75倍、100倍、150倍、200倍、250倍、300倍、350倍、400倍或至少350倍,优选100-200倍或100-400倍。
41.在富集处理之前,采集的脐带血和/或胎盘血可以是新鲜的或先前已冷冻保存的。可以使用本领域已知的用于细胞分离/选择的任何合适的技术来进行造血干细胞,或造血干细胞与祖细胞的富集。可以使用依赖于细胞表面标志物差异表达的方法。例如,可以使用抗cd34的单克隆抗体阳性选择表达细胞表面标志物cd34的细胞,从而保留表达cd34的细胞,而不保留不表达cd34的细胞。此外,所采用的分离技术应最大限度地提高待选择的细胞群的活力。所采用的特定技术将取决于分离效率、方法的细胞毒性、操作的简便性和速度,以及复杂设备和/或技术技能的必要性。
42.分离程序可以包括磁性分离、使用抗体包被的磁珠、亲和层析和将抗体附接至固体基质(例如,板)上的“淘选”,或其他方便的技术。提供准确分离/选择的技术包括荧光激活的细胞分选仪,其可以具有不同程度的复杂性,例如,多颜色通道、低角度和钝角光散射检测通道、阻抗通道等。
43.选择过程中使用的抗体可以与以下标志物结合,例如磁珠(其实现直接分离)、生物素(其可以与与支持物结合的抗生物素蛋白或链霉抗生物素蛋白一起除)、荧光染料(其可以与荧光激活的细胞分选仪一起使用)等,以实现易于分离特定细胞类型。可以采用不过度损害剩余细胞活力的任何技术。实例包括,例如,fda批准的处理系统(miltenyl biotec b.v.&co.kg)、dynabeads
tm cd34分离系统(invtrogen inc.)、easysep
tm
人cd34阳性选择试剂盒(stemcell technologies,inc.)等。
44.在优选的实施方案中,处理新鲜脐带血单元以选择,即富集,cd34+细胞,使用直接或间接偶联至磁性颗粒的抗cd34抗体结合磁性细胞分离器,例如,细胞分离系统(miltenyi biotec,bergisch gladbach,germany),其采用与特定单克隆抗体偶联的由氧化铁和葡聚糖组成的纳米级超顺磁性颗粒。细胞分离器是封闭的无菌系统,配备有一次性管组。一次性管组可用于处理采集的脐带血和/或胎盘血以富集cd34+细胞的单一单元并在处理后丢弃。
45.在实施方案中,在富集造血干细胞,或造血干细胞与祖细胞之前,可以合并两个或更多个脐带血和/或胎盘血单元。在另一个实施方案中,cd34+干细胞或cd34+干细胞和祖细胞的个体群可以在富集造血干细胞,或造血干细胞与祖细胞后合并。在具体实施方案中,脐带血和/或胎盘血单元,合并的造血干细胞或造血干细胞与祖细胞群的数量为2、3、4、5、6、7、8、9、10、15、20、25、30、35或40,或前至少任何述数字。在一些实施方案中,该合并含有2至8、2至10、4至8、4至10、2至20、4至20、2至25、或4至25个,并且不超过20或25个脐带血和/或胎盘血单元,或cd34+造血干细胞或造血干细胞与祖细胞群。在不考虑造血干细胞或造血干
细胞与祖细胞的hla类型的情况下,合并脐带血和/或胎盘血单元或造血干细胞或造血干细胞与祖细胞群。在某些实施方案中,合并中的细胞源自相同人种(例如,非裔美国人、高加索人、亚洲人、西班牙裔、美洲原住民、澳大利亚原住民、因纽特人、太平洋岛民)的个体的脐带血和/或胎盘血,或源自相同种族(例如,爱尔兰人、意大利人、印度人、日本人、中国人、俄罗斯人等)个体的脐带血和/或胎盘血。在其他实施方案中,在不考虑人种或种族的情况下合并细胞。
46.任选地,在富集造血干细胞或造血干细胞与祖细胞之前,可以分离脐带血或胎盘血的红细胞和白细胞。一旦发生红细胞和白细胞分离,可以丢弃红细胞级分,并且可以在如上所述的磁性细胞分离器中处理白细胞级分以富集cd34+造血干细胞或造血干细胞与祖细胞。白细胞和红细胞级分的分离可以通过本领域已知的任何方法进行,包括离心技术。可以使用的其他分离方法包括,例如,使用市售产品ficoll
tm
或ficoll-paque
tm
或percoll
tm
(ge healthcare,piscataway,new jersey)。ficoll-paque
tm
通常置于锥形管的底部,并且全血在上方分层。离心后,锥形管中从上至下可见以下层:血浆和其他成分、含有外周血单核细胞(白细胞)的称为血沉棕黄层的一层单核细胞、ficoll-paque
tm
,以及红细胞和粒细胞,它们应该以沉淀形式存在。这种分离技术可以轻松实现收获外周血单核细胞(pbmc)。
47.任选地,在选择cd34+细胞之前,可以检查脐血或胎盘单元的等分试样的总有核细胞计数和/或cd34+细胞含量。在具体实施方案中,在选择cd34+细胞后,回收cd34+和cd34-细胞级分。可选地,可以从cd34-细胞级分的样品中提取dna,用于初始hla分型和将来的嵌合研究,即使cd34+细胞级分与患者或其他脐带血或胎盘血单元的hla匹配尚未完成。
48.cd34+富集的干细胞或干细胞和祖细胞群可以在扩增之前进行后续处理,例如,通过悬浮于适当的细胞培养基中以供储存或运输。在优选的实施方案中,细胞培养基是适于维持cd34+造血干细胞或造血干细胞与祖细胞的活力的细胞培养基。例如,细胞培养基可以是在生长因子存在下(例如,以以下浓度存在:50-300ng/ml的干细胞因子(scf)、50-300ng/ml的flt-3受体配体(flt3l)、50-100ng/ml的血小板生成素(tpo)、50-100ng/ml的白介素-6(il-6)和10ng/ml的白介素-3(il-3))的stemspan
tm
无血清扩增培养基或stemspan
tm
无血清扩增培养基ii(stemcell technologies,vancouver,british columbia)。在更具体实施方案中,使用300ng/ml的干细胞因子、300ng/ml的flt-3受体配体、100ng/ml的血小板生成素、100ng/ml的白介素-6和10ng/ml的白介素-3,或50ng/ml的干细胞因子、50ng/ml的flt-3受体配体、50ng/ml的血小板生成素、50ng/ml的白介素-6和10ng/ml的白介素-3。在另一个优选实施方案中,细胞培养基由补充有10ng/ml重组人白介素3(rhil 3)、50ng/ml重组人白介素-6(rhil-6)、50ng/ml重组人血小板生成素(rhtpo)、50ng/ml重组人flt-3配体(rhflt-3l)和50ng/ml重组人干细胞因子(rhscf)的stemspan
tm
无血清扩增培养基或stemspan
tm
无血清扩增培养基ii(stemcell technologies,vancouver,british columbia)组成。在另一个优选实施方案中,细胞培养基由补充有重组人rhscf、rhflt-3l、rhtpo、rhil-6(各自终浓度为50ng/ml)和rhil-3(终浓度为10ng/ml)的stemspan无血清扩增培养基ii(sfem ii,stemcell technologies,vancouver,british columbia)组成。
49.在具体实施方案中,脐带血和/或胎盘血单元的红细胞耗竭,并且确定红细胞耗竭的级分中cd34+细胞数。优选地,对含有超过350万个cd34+细胞的脐带血和/或胎盘血液样品进行上述富集方法。
50.在根据上述富集方法或本领域已知的其他方法分离造血干细胞或造血干细胞与祖细胞后(例如,从人脐血和/或出生时从人采集的人胎盘血),造血干细胞或造血干细胞与祖细胞被扩增以增加造血干细胞或造血干细胞与祖细胞(例如,cd34+细胞)的数量。可以使用本领域已知的用于扩增造血干细胞或造血干细胞与祖细胞数的任何方法,其产生扩增的(即,数量增加的)造血干细胞或造血干细胞与祖细胞群。优选地,在细胞生长条件(例如,促进有丝分裂)下培养造血干细胞或造血干细胞与祖细胞,使得造血干细胞或造血干细胞与祖细胞生长和分裂(增殖)以获得扩增的cd34+造血细胞干细胞或造血干细胞与祖细胞群。在一个实施方案中,在扩增之前或之后,在无需与其他造血干细胞或造血干细胞与祖细胞的hla类型匹配的情况下,可以合并源自单个人出生时的脐带血和/或胎盘血的造血干细胞或造血干细胞与祖细胞的个体群。在另一个实施方案中,在合并之前扩增造血干细胞或造血干细胞与祖细胞。优选地,用于扩增的技术是已经显示出(i)相对于未扩增的造血干细胞群或干细胞和祖细胞,导致扩增的干细胞产品中造血干细胞,或造血干细胞与祖细胞(例如,cd34+细胞)的数量增加的技术,其中未扩增的细胞群和扩增的细胞群来自相同来源的干细胞或干细胞和祖细胞的不同等分试样,其中对扩增的细胞(而不是未扩增的细胞)进行扩增技术。
51.扩增技术包括但不限于美国专利号7,399,633b2;美国专利公开号2013/0095079;delaney等人,2010年,delaney等人,2010,nature med.16(2):232-236;zhang等人,2008,blood 111:3415-3423;或himburg等人,2010,nature medicine 16(4):475-82中描述的那些,其各自通过引用并入本文,以及以下描述的那些。
52.在一个实施方案中,在存在生长因子的培养基中培养造血干细胞或造血干细胞与祖细胞,并且暴露于细胞生长条件(例如,促进有丝分裂),使得造血干细胞或造血干细胞与祖细胞增殖以获得扩增的造血干细胞或造血干细胞与祖细胞群。在优选的实施方案中,造血干细胞或造血干细胞与祖细胞在一定量的有效抑制分化的notch功能激动剂(通常是固定化的notch功能激动剂)存在下培养,并且暴露于细胞生长条件(例如,促进有丝分裂),使得造血干细胞或造血干细胞与祖细胞增殖以产生扩增的造血干细胞或造血干细胞与祖细胞群。在更优选的实施方案中,造血干细胞或造血干细胞与祖细胞与一定量的notch功能激动剂一起培养,以有效抑制分化并在生长因子存在下,并且暴露于细胞生长条件(例如,促进有丝分裂),使得造血干细胞或造血干细胞与祖细胞增殖以获得扩增的造血干细胞或造血干细胞与祖细胞群。如此获得的扩增的造血干细胞或造血干细胞与祖细胞群可以被冷冻并储存以供以后作为“现成产品”使用。任选地,在移植入患者体内之前(例如,通过分离或稀释)使notch通路激动剂失活或从扩增的造血干细胞或造血干细胞与祖细胞群中去除。
53.在具体实施方案中,将造血干细胞或造血干细胞与祖细胞培养2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25天或更长时间;或者,优选地,将造血干细胞或造血干细胞与祖细胞培养至少10天或约7天至约14天。
54.用于扩增造血干细胞或造血干细胞与祖细胞的示例性培养条件包括在补充有以下人生长因子的无血清培养基中在存在纤连蛋白片段和与人igg的fc结构域融合的细胞外结构域(delta1
ext-igg
)的情况下培养细胞7天至14天:干细胞因子、flt-3受体配体、血小板生成素、白介素-6和白介素-3。优选地,上述生长因子以以下浓度存在:50-300ng/ml干细胞因子、50-300ng/ml flt-3受体配体、50-100ng/ml血小板生成素、50-100ng/ml白介素-6和
10ng/ml白介素-3。在更具体实施方案中,使用300ng/ml干细胞因子、300ng/ml flt-3受体配体、100ng/ml血小板生成素、100ng/ml白介素-6和10ng/ml白介素-3,或50ng/ml干细胞因子、50ng/ml flt-3受体配体、50ng/ml血小板生成素、50ng/ml白介素-6和10ng/ml白介素-3。在更优选的实施方案中,细胞培养基由补充有10ng/ml重组人白介素-3(rhil-3)、50ng/ml重组人白介素-6(rhil-6)、50ng/ml重组人血小板生成素(rhtpo)、50ng/ml重组人flt-3配体(rhflt-3l)、和50ng/ml重组人干细胞因子(rhscf)的stemspan
tm
无血清扩增培养基(stemcell technologies,vancouver,british columbia)组成。在另一个更优选的实施方案中,细胞培养基由补充有重组人rhscf,rhflt-3l、rhtpo、rhil-6(各自终浓度为50ng/ml)和rhil-3(终浓度为10ng/ml)的stemspan无血清扩增培养基ii(sfem ii,stemcell technologies,vancouver,british columbia)组成。
55.在一些实施方案中,dxi介导的扩增如下进行:将delta1
ext igg
(dxi)固定在细胞培养皿的表面上。在具体实施方案中,细胞培养皿在4℃下(或在37℃下至少2小时)用在磷酸盐缓冲盐水中的2.5μg/ml delta1
ext-igg
和5μg/ml(重组人纤连蛋白片段,也称为rfn-ch-296)包被过夜,然后添加造血干细胞或造血干细胞与祖细胞。优选地,细胞培养基由补充有10ng/ml重组人白介素-3(rhil-3)、50ng/ml重组人白介素-6(rhil-6)、50ng/ml重组人血小板生成素(rhtpo)、50ng/ml重组人flt-3配体(rhflt-3l)、和50ng/ml重组人干细胞因子(rhscf)的stemspan
tm
无血清扩增培养基(stemcell technologies,vancouver,british columbia),或补充有重组人rhscf、rhflt-3l、rhtpo、rhil-6(各自终浓度为50ng/ml)和rhil-3(终浓度为10ng/ml)的stemspan无血清扩增培养基ii(sfem ii,stemcell technologies,vancouver,british columbia)组成。
56.zhang等人,2008,blood 111:3415-3423(通过引用并入本文)中阐述了用于扩增造血干细胞或干细胞和祖细胞的其他示例性培养条件。在具体实施方案中,造血干细胞或造血干细胞与祖细胞可以在补充有肝素、干细胞因子、血小板生成素、胰岛素样生长因子-2(igf-2)、成纤维细胞生长因子-1(fgf-1)和angptl3或angptl5的无血清培养基中培养。在具体实施方案中,培养基补充有10μg/ml肝素、10ng/ml干细胞因子、20ng/ml血小板生成素、20ng/ml igf-2和10ng/ml fgf-1,以及100ng/ml angptl3或angptl5,并且细胞培养约19天至23天。在另一个具体实施方案中,造血干细胞或造血干细胞与祖细胞可以通过在补充有10μg/ml肝素、10ng/ml干细胞因子、20ng/ml血小板生成素、10ng/ml fgf-1和100ng/ml angptl5的无血清培养基中培养细胞约11天至19天进行扩增。在另一个具体实施方案中,造血干细胞或干细胞和祖细胞可以通过在补充有50ng/ml干细胞因子、10ng/ml血小板生成素、50ng/ml flt-3受体配体和100ng/ml胰岛素样生长因子结合蛋白-2(igfbp2)或500ng/ml angptl5的无血清培养基中培养细胞约10天进行扩增。在又一个实施方案中,造血干细胞或造血干细胞与祖细胞可以通过在补充有10μg/ml肝素、10ng/ml干细胞因子、20ng/ml血小板生成素、10ng/ml fgf-1、500ng/ml angptl5和500ng/ml igfbp2的无血清培养基中培养细胞约11天进行扩增。参见zhang等人,2008,blood 111:3415-3423,其通过引用并入本文。
57.另一种用于扩增造血干细胞或造血干细胞与祖细胞的示例性培养条件在himburg等人,2010,nature medicine 16(4):475-482中阐述,其通过引用并入本文。在具体实施方案中,造血干细胞或造血干细胞与祖细胞可以在补充有血小板生成素、干细胞因子、flt-3
受体配体和多效素的液体悬浮培养物中培养。在具体实施方案中,液体悬浮培养物补充有20ng/ml血小板生成素、125ng/ml干细胞因子、50ng/ml flt-3受体配体,以及10、100、500或1000ng/ml多效素,并且造血干细胞或造血干细胞与祖细胞培养约7天。
58.在造血干细胞或造血干细胞与祖细胞扩增后,确定细胞和活cd34+细胞的总数。例如,在扩增期间的第14天,可以取样以确定活有核细胞总计数。此外,cd34+细胞的总数可以通过多参数流式细胞术确定,并且,从而确定样品中cd34+细胞的百分比。优选地,停止未导致cd34+细胞绝对数量增加至少10倍的培养。相似地,在冷冻保存前或解冻后,可取扩增的造血干细胞或造血干细胞与祖细胞群的等分试样,用于确定总有核细胞和活cd34+细胞的百分比,以计算扩增群中总活cd34+细胞数。在优选的实施方案中,可以弃去那些含有少于5000万个cd34+活细胞的细胞群。
59.在具体实施方案中,总活cd34+(或其他抗原阳性)细胞数可以被认为是用于治疗用途的最终产物释放的效力测定。活力可以通过本领域已知的任何方法确定,例如,通过台盼蓝拒染或7-氨基-放线菌素d(7-aad)拒染。优选地,总有核细胞计数(tnc)和其他数据用于计算产品的效力。活cd34+细胞的百分比可以通过流式细胞术和使用活细胞排除的染色来评估。活cd34+细胞的百分比=等分试样中7-aad(或其他适当染色剂)拒染的cd34+细胞数除以等分试样的tnc(活的和非活的)。样品中的活cd34+细胞可以计算如下:活cd34+细胞=样品的tnc
×
样品中活cd34+细胞的百分比。活cd34+细胞在富集或扩增过程中的比例增加可以计算如下:培养后总活cd34+细胞/培养前总活cd34+细胞。
60.在一些实施方案中,如上所述,造血干细胞或造血干细胞与祖细胞通过在notch功能激动剂和多种生长因子或细胞因子中的一种的存在下培养细胞达给定时间进行扩增。notch功能的激动剂,也称为notch激动剂,是促进,即,引起或增加,notch通路功能的激活。如本文所用,“notch功能”是指由notch信号传导(信号转导)通路介导的功能,包括但不限于notch细胞内结构域的核转位、rbp-jκ或其果蝇同系物suppressor of hairless的核转位;分裂增强复合体的bhlh基因的激活,例如,mastermind;hes-1基因或kbf2(也称为cbf1)基因的激活;抑制果蝇成神经细胞分离;notch与delta、jagged/serrate、fringe、deltex或rbp-jκ/suppressor of hairless、或其同系物或类似物的结合。有关notch信号转导通路及其对激活的影响的讨论,通常参见kopan等人,2009,cell 137:216-233的综述文章;另见jarriault等人,1998,mol.cell.biol.18:7423-7431;两者均通过引用以其全文并入本文。
61.notch激活是通过将细胞暴露于notch激动剂实现的。notch功能的激动剂可以是但不限于可溶性分子、在细胞表面重组表达的分子、造血干细胞或造血干细胞和前体细胞暴露于细胞单层上的分子、或固定在固相上的分子。示例性notch激动剂是细胞外结合配体delta和serrate,它们与notch的细胞外域结合并激活notch信号转导,或delta或serrate片段,它们与notch细胞外结构域结合并激活notch信号转导。已经从包括多种物种(包括人)中分离的delta和serrate的核酸和氨基酸序列是本领域已知的,并且在国际专利公开号wo 93/12141、wo 96/27610、wo 97/01571和gray等人,1999,am.j.path.154:785-794中公开。在优选的实施方案中,notch激动剂是由融合至myc表位标签(分别为delta
ext-myc
或serrate
ext-myc
)的蛋白的细胞外域组成的delta或serrate蛋白的固定化片段,或融合至igg(分别为delta
ext-igg
或serrate
ext-igg
)的fc部分的蛋白的细胞外结构域组成的delta或serrate蛋白的固定化片段。notch激动剂包括但不限于notch蛋白及其类似物和衍生物(包
括片段);作为notch通路的其他元素的蛋白及其类似物和衍生物(包括片段);其抗体和含有其结合区的此类抗体的片段或其他衍生物;编码蛋白和衍生物或类似物的核酸;以及与notch蛋白或notch通路中的其他蛋白结合或相互作用从而促进notch通路活性的蛋白及其衍生物和类似物。此类激动剂包括但不限于包含细胞内结构域的notch蛋白及其衍生物、编码前述的notch核酸和包含notch配体的notch相互作用结构域(例如,delta或serrate的细胞外结构域)的蛋白。其他激动剂包括但不限于rbpjκ/suppressor of hairless或deltex。fringe可用于增强notch活性,例如与delta蛋白结合使用。这些蛋白、其片段和衍生物可以重组表达和分离或可以化学合成。
62.在另一个具体实施方案中,notch激动剂是重组表达激动notch的蛋白或其片段或衍生物的细胞。细胞以这样的方式表达notch激动剂,使得它可用于造血干细胞或干细胞和祖细胞,其中notch信号转导将被激活,例如,它被分泌,在细胞表面表达等。
63.在又一个具体实施方案中,notch的激动剂是与notch信号通路成员结合的拟肽或肽类似物或有机分子。此类激动剂可以通过选自本领域已知的那些的结合测定进行鉴定,例如在rebay等人,1991,cell 67:687-699和国际专利公开号wo 92/19734中描述的细胞聚集测定,两者均通过引用并入本文。
64.在优选的实施方案中,激动剂是至少由介导与notch蛋白或notch片段结合的notch相互作用基因编码的蛋白片段组成的蛋白,其中notch片段含有负责与激动剂蛋白结合的notch区,例如,notch的表皮生长因子样重复序列11和12。如本文所用,notch相互作用基因应指基因notch、delta、serrate、rbpjκ、suppressor of hairless和deltex,以及delta/serrate家族或deltex家族的其他成员,它们可以通过序列同源性或遗传相互作用进行鉴定以及更通常地,“notch级联”的成员或基因发“notch组”,它们通过分子相互作用(例如,体外结合,或遗传相互作用(如表型所示,例如,在果蝇中)进行鉴定。含有负责与notch结合的区域的notch结合蛋白的示例性片段描述于美国专利号5,648,464;5,849,869;和5,856,441,其通过引用并入本文。
65.通过本文所述方法使用的notch激动剂可以商业获得、通过重组表达产生或经化学合成。
66.在具体实施方案中,将细胞暴露于notch激动剂不是通过与在细胞表面上重组表达notch配体的其他细胞一起孵育来完成的(尽管在其他实施方案中,可以使用该方法),而是通过暴露于无细胞的notch配体,例如,与notch的无细胞配体孵育,该配体固定在固相表面,例如,固定在组织培养基质、培养皿、烧瓶、瓶子、袋子等的表面上。
67.在具体实施方案中,通过notch配体(例如,delta、serrate)与notch受体的细胞外部分结合促进notch活性。notch信号传导似乎由notch的细胞外结构域与其配体之间的物理相互作用触发,这些配体或者膜结合在相邻细胞上,或者固定在固体表面上。全长配体是notch的激动剂,因为它们在一个细胞上的表达触发邻近细胞中表达notch受体的通路的激活。包含蛋白的细胞外结构域或其notch结合部分的可溶性截短delta或serrate分子已固定在固体表面,例如组织培养板,是特别优选的notch通路激动剂。这种可溶性蛋白可以通过抗体或相互作用的蛋白固定在固体表面上,例如,针对delta或serrate作为融合蛋白表达的表位标签的抗体(例如,被抗体9e10识别的myc表位标签)或与delta或serrate表达为融合蛋白的表位标签相互作用的蛋白(例如,与蛋白a结合的免疫球蛋白表位标签)。
68.在另一个具体实施方案中,并且如artavanis-tsakonas等人的美国专利号5,780,300中所述,notch激动剂包括促进或激活细胞过程的试剂,该细胞过程介导notch或notch信号传导通路成员激活所需的成熟或加工步骤,例如notch加工所需的弗林蛋白酶样转化酶kuzbanian,被认为是激活notch通路上游或与notch平行所必需的金属蛋白酶解整合素(adam)(schlondorff和blobel,1999,j.cell sci.112:3603-3617),或者,更通常地,细胞运输和加工蛋白,例如在细胞区室之间运动所需的gtp酶的rab蛋白家族(有关rab gtp酶的综述,参见olkkonen和stenmark,1997,int.rev.cytol.176:1-85)。激动剂可以是增加上述过程之一的活性的任何分子,例如编码弗林蛋白酶、kuzbanian或rab蛋白或其片段或衍生物或显性活性突变体的核酸,或与上述蛋白结合并激活其功能的拟肽或肽类似物或有机分子。
69.美国专利号5,780,300(通过引用并入本文)进一步公开了可用于激活notch通路的notch激动剂分子的类别(及其鉴定方法),例如,触发notch锚蛋白重复与rbp-jκ解离的分子,从而促进rbp-jκ从细胞质移位至细胞核。
70.在一些优选的实施方案中,使用dxi扩增方法。notch激动剂是delta的固定化片段,由与igg fc部分融合的蛋白的细胞外结构域(delta
ext-igg
或dxi)(如美国专利号7,399,633)或固定化的notch-1或notch-2特异性抗体(如美国专利号10,208,286所述(两者均通过引用并入本文))组成。优选地,delta1
ext-igg
固定在细胞培养皿的表面上。在具体实施方案中,细胞培养皿在4℃下(或在37℃下至少2小时)用在磷酸盐缓冲盐水中的2.5μg/ml delta1
ext-igg
和5μg/ml(重组人纤连蛋白片段,也称为rfn-ch-296)包被,然后添加造血干细胞或造血干细胞与祖细胞。优选地,细胞培养基由补充有10ng/ml重组人白介素-3(rhil-3)、50ng/ml重组人白介素-6(rhil-6)、50ng/ml重组人血小板生成素(rhtpo)、50ng/ml重组人flt-3配体(rhflt-3l)、和50ng/ml重组人干细胞因子(rhscf)stemspan
tm
无血清扩增培养基(stemcell technologies,vancouver,british columbia),或补充有重组人rhscf、rhflt-3l、rhtpo、rhil-6(各自终浓度为50ng/ml)和rhil-3(终浓度为10ng/ml)的stemspan无血清扩增培养基ii(sfem ii,stemcell technologies,vancouver,british columbia)组成。造血干细胞或造血干细胞与祖细胞培养约7天至约14天。
71.一旦获得扩增造血干细胞或造血干细胞与祖细胞以形成扩增的干细胞产品,可以采集和冷冻保存扩增的造血干细胞或造血干细胞与祖细胞群,例如,制备“现成”产品。在一个实施方案中,可以将扩增的造血干细胞或造血干细胞与祖细胞群分开并冷冻在一个或多个袋(或单元)中。在另一个实施方案中,可以将两个或更多个扩增的造血干细胞或造血干细胞与祖细胞群合并,分成单独的等分试样,并且将每个等分试样冷冻。在优选的实施方案中,将约50个至约4亿个cd34+细胞冷冻在单个袋(或单元)扩增的干细胞产品中。在另一个优选的实施方案中,约100至约3亿个cd34+细胞被冷冻在扩增的干细胞产品的单个袋(或单元)中。在另一个优选的实施方案中,将约1亿个、2亿个、3亿个或4亿个cd34+细胞冷冻在扩增的干细胞产品的单个袋(或单元)中。
72.在优选的实施方案中,扩增的干细胞产品是新鲜的,即,它在扩增或冷冻保存之前尚未预先冷冻。术语“冷冻的/冷冻”和“低温保存的/低温保存”在本技术中可互换使用。冷冻保存可以通过本领域已知的以活的形式冷冻细胞的任何方法。细胞的冷冻通常具有破坏性。然后通过对细胞膜的渗透作用、细胞脱水、溶质浓度和冰晶形成而发生损伤。当冰在细
胞外形成时,可用的水从溶液中去除并从细胞中排出,导致渗透脱水和溶质浓度升高,最终破坏细胞。有关讨论,参见mazur,p.,1977,cryobiology 14:251-272。
73.这些有害影响可以通过(a)使用冷冻保护剂,(b)控制冷冻速度,以及(c)在足够低的温度下储存以最大限度地减少降解反应来避免。
74.可以使用的冷冻保护剂包括但不限于二甲基亚砜(dmso)(lovelock和bishop,1959,nature 183:1394-1395;ashwood-smith,1961,nature 190:1204-1205)、甘油、聚乙烯吡咯烷(rinfret,1960,ann.n.y.acad.sci.85:576)、聚乙二醇(sloviter和ravdin,1962,nature 196:548)、白蛋白、葡聚糖、蔗糖、乙二醇、异型赤藓糖醇、d-核糖醇、d-甘露醇(rowe等人,1962,fed.proc.21:157)、d-山梨糖醇、异型肌醇、d-乳糖、氯化胆碱(bender等人,1960,j.appl.physiol.15:520)、氨基酸(phan the tran和bender,1960,exp.cell res.20:651)、甲醇、乙酰胺、单乙酸甘油酯(lovelock,1954,biochem.j.56:265)、无机盐(phan the tran和bender,1960,proc.soc.exp.biol.med.104:388;phan the tran和bender,1961,放射生物学,第三届澳大利亚放射生物学会议论文集,ilbery编辑,butterworth,london,p.59)和cs10(biolife solutions inc.,bothell,wa)。在优选的实施方案中,使用dmso,低浓度对细胞无毒的液体。添加血浆(例如,至浓度为约20
±
25%)可增强dmso的保护作用。添加dmso后,细胞应保持在0℃下直至冷冻,因为约1%的dmso浓度在高于4℃的温度下具有毒性。
75.受控的缓慢冷却速率可能很重要。不同的冷冻保护剂(rapatz等人,1968,cryobiology 5(1):18-25)和不同的细胞类型具有不同的最佳冷却速率(有关冷却速度对骨髓干细胞存活的影响以及有关它们的移植潜力参见,例如,rowe和rinfret,1962,blood 20:636;rowe,1966,cryobiology 3(1):12-18;lewis等人,1967,transfusion 7(1):17-32;和mazur,1970,science 168:939-949)。水变成冰的熔化阶段的热应该是最小的。冷却程序可以通过使用例如程序冷冻装置或甲醇浴程序来进行。
76.程序冷冻装置实现确定最佳冷却速率并促进标准的可重复冷却。程序控速冷冻机(例如cryomed或planar)实现将冷冻方案调整至期望的冷却速率曲线。例如,对于10%dmso和20%血浆中的骨髓细胞,从0℃至-80℃,最佳速率为1℃至3℃/分钟。在优选的实施方案中,可以使用该冷却速率。容纳细胞的容器必须在低温下保持稳定,并实现快速传热以有效控制冷冻和解冻。多次少量(1-2ml)可以使用密封的塑料小瓶(例如,nunc,wheaton cryules)或玻璃安瓿瓶,而更大的体积(100-200ml)可以冷冻在金属板之间的聚烯烃袋(例如,delmed)中,以在冷却过程中更好地传热。骨髓细胞袋已通过将它们置入-80℃的冰箱中而成功冷冻,意外地,冷却速度为约3℃/分钟)。
77.在可选的实施方案中,可以使用甲醇浴冷却方法。甲醇浴法非常适合大规模的多个小物品的常规冷冻保存。该方法不需要手动控制冷冻速率,也不需要记录器来监控速率。在优选的实施方案中,dmso处理的细胞在冰上预冷并转移到含有冷冻甲醇的托盘中,该托盘又置于-80℃的机械冰箱(例如harris或revco)中。甲醇浴和样品的热电偶测量表明期望的冷却速率为1℃至3℃/分钟。至少两个小时后,标本已达到-80℃的温度,可以直接置入液氮(-196℃)中永久保存。
78.彻底冷冻后,扩增的干细胞产品可以快速转移到长期低温储存容器中。在优选的实施方案中,样品可以低温储存在液氮(-196℃)或其蒸气(-165℃)中。高效液氮冷冻箱的
可用性极大地促进了这种储存,它类似于具有极低真空和内部超级绝缘的大型保温瓶,从而使热泄漏和氮损失保持在绝对最低限度。
79.合适的货架系统可市售获得,可用于对个体标本进行编目、储存和检索。
80.造血干细胞(特别是来自骨髓或外周血)的操作、冷冻保存和长期储存的注意事项和程序在很大程度上适用于扩增的造血干细胞或干细胞和祖细胞。此类讨论可见于,例如,以下参考文献,其通过引用并入本文:gorin,1986,clinics in haematology 15(1):19-48;骨髓保护、培养和移植,小组会议记录,莫斯科,1968年7月22-26日,国际原子能机构,维也纳,第107-186页。
81.其他活细胞冷冻保存方法或其改良方法是可获得的,并且可以预期使用(例如,冷金属镜技术;livesey和linner,1987,nature 327:255;linner等人,1986,j.histochem.cytochem.34(9):1123-1135;另见senkan等人的美国专利号4,199,022、schwartz的美国专利号3,753,357、fahy的美国专利号4,559,298)。
82.冷冻保存或冷冻的细胞优选快速解冻(例如,保持在37℃-41℃的水浴中)并在解冻后立即冷却。在具体实施方案中,可以将含有冷冻细胞的小瓶浸入温水浴中直至其颈部;轻轻旋转将确保细胞悬浮液在解冻时混合并增加从温水到内部冰块的热传递。一旦冰完全融化,小瓶可以立即置于冰中。
83.在本发明的实施方案中,扩增的干细胞产品被解冻,或其一部分,可以输注至有需要的人类患者(例如,患有aml或其他恶性血液病)中。一些与处理解冻细胞有关的程序是可获得的,并且如认有需要,可以采用。
84.可能需要处理细胞以防止细胞在解冻时结块。为了防止结块,可以使用各种程序,包括但不限于在冷冻前和/或冷冻后添加dnase(spitzer等人,1980,cancer45:3075-3085)、低分子量葡聚糖和柠檬酸盐、羟乙基淀粉(stiff等人,1983,cryobiology 20:17-24)等。
85.如果冷冻保护剂对人体有毒,则应在解冻的扩增的干细胞产品的治疗用途之前去除。在使用dmso作为冷冻保存剂的实施方案中,优选省略该步骤以避免细胞损失。然而,在需要去除冷冻保护剂的情况下,优选在解冻时完成去除。
86.去除冷冻保护剂的一种方法是稀释至微不足道的浓度。这可以通过添加培养基来实现,如有需要,随后进行一个或多个循环的离心以沉淀细胞、去除上清液并重悬细胞。例如,解冻细胞中的细胞内dmso可以降低至不将对回收细胞产生不利影响的水平(小于1%)。这优选缓慢进行,以最大限度地减少在dmso去除过程中发生的潜在破坏性渗透梯度。
87.去除冷冻保护剂后,可以进行细胞计数(例如,通过使用血细胞计数器)和活力检测(例如,通过台盼蓝拒染;kuchler,1977,biochemical methods in cell culture and virology,dowden,hutchinson&ross,stroudsburg,pa.,pp.18-19;1964,methods in medical research,eisen等人,编辑,vol.10,year book medical publishers,inc.,chicago,pp.39-47)以确认细胞存活。活抗原(例如,cd34)阳性细胞的百分比可以通过计算细胞的等分试样中拒染7-aad(或被活细胞拒染的其他合适染料)的抗原阳性细胞数除以总数来确定细胞等分试样中的有核细胞(tnc)(活的和非活的)。然后可以通过将活抗原阳性细胞的百分比乘以tnc来确定活抗原阳性细胞数。
88.在冷冻保存之前和/或解冻之后,可以确定有核细胞的总数,或在具体实施方案
中,可以确定cd34+细胞的总数。例如,可以通过使用血细胞计数器和台盼蓝染料拒染来进行总有核细胞计数。细胞密度高的样品可以稀释至适合手动计数的浓度范围。产品的最终细胞计数针对任何稀释因子进行校正。有核细胞总数=每ml有核细胞数
×
产品体积(以ml计)。可以确定样品中cd34+阳性细胞数,例如,通过使用与荧光染料偶联的抗cd34单克隆抗体的流式细胞术。
89.在某些实施方案中,冷冻保存前的起始造血干细胞或干细胞和祖细胞群、脐带血和/或胎盘血、或扩增的干细胞产品的特性和纯度、或者解冻后扩增的干细胞产品可以进行多参数流式细胞术免疫表型分析,其提供了样品中存在的活抗原阳性细胞的百分比。可以使用一组与荧光染料直接偶联的单克隆抗体来检测每个样品的以下一种或多种细胞表型:
90.1.cd34+hpc
91.2.t细胞(cd3+,包括cd4+和cd8+子集)
92.3.b细胞(cd19+或cd20+)
93.4.nk细胞(cd56+)
94.5.单核细胞(cd14+)
95.6.骨髓单核细胞(cd15+)
96.7.巨核细胞(cd41+)
97.8.树突细胞(谱系阴性/hla-drbright和cd123bright,或谱系阴性/hla-drbright和cd11cbright)。
98.治疗方法
99.根据本发明,提供了用于改善患有aml或其他恶性血液病的患者的治疗结果的方法。还提供了用于治疗患有aml或其他恶性血液病的患者的方法。通过实施化疗方案或其周期对患者进行治疗,然后向患者施用固定剂量的扩增的干细胞产品,其中在无需匹配扩增的干细胞产品的hla类型与患者的hla类型的情况下进行施用。在无需匹配彼此与供体的hla类型并且也无需匹配与患者的hla类型的情况下,扩增的干细胞产品是源自至少两个或至少四个人类供体的造血干细胞或造血干细胞与祖细胞的合并产品。短语“无需匹配hla类型”是指不采取任何步骤使患者之间和/或提供扩增的干细胞产品(或扩增的干细胞产品中的造血干细胞或造血干细胞与祖细胞)的供体之间的任何hla抗原或等位基因匹配。
100.在一些实施方案中,固定剂量的扩增的干细胞产品可以在化疗方案或其周期(例如诱导方案)之后施用。固定剂量的扩增的干细胞产品还可以在巩固方案或其周期之后施用。固定剂量的扩增的干细胞产品还可以在补救方案或其周期之后施用。在一些实施方案中,如有需要或必要,固定剂量的扩增的干细胞产品可以在第二诱导方案或其周期或者诱导方案的第二个周期之后施用。在一些实施方案中,固定剂量的扩增的干细胞产品可以在第二巩固方案或其周期之后施用,或者巩固方案的第二周期是期望的或必要的。在一些实施方案中,固定剂量的扩增的干细胞产品可以在第二补救方案或其周期之后施用,或者补救方案的第二周期是期望的或必要的
101.如上所讨论,扩增的干细胞产品通常在施用方案的末次给药后施用,或对于具有多于一个周期的方案,在方案的每个周期的末次给药之后施用。在一些实施方案中,在方案完成后约12小时至约48小时,或优选在方案完成后约24小时至约36小时施用扩增的干细胞产品。
r或r-fcm或r-fmc或fmc-r(氟达拉滨、环磷酰胺、米托蒽醌加利妥昔单抗);fcr(氟达拉滨、环磷酰胺、利妥昔单抗);fm(氟达拉滨、米托蒽醌);fm-r或r-fm或rfm或fmr(氟达拉滨、米托蒽醌和利妥昔单抗);flag(氟达拉滨、阿糖胞苷、g-csf);flag-ida或flag-ida或ida-flag或ida-flag(氟达拉滨、阿糖胞苷、伊达比星、g-csf);flag-mito或flag-mito或mito-flag或mito-flag或flang(米托蒽醌、氟达拉滨、阿糖胞苷、g-csf);flamsa(氟达拉滨、阿糖胞苷、安吖啶);flamsa-bu或flamsa-bu(氟达拉滨、阿糖胞苷、安吖啶、白消安);flamsa-mel或flamsa-mel(氟达拉滨、阿糖胞苷、安吖啶、美法仑);gdp(吉西他滨、地塞米松、顺铂);gemox或gemox(吉西他滨、奥沙利铂);gemox-r或gemox-r或r-gemox或r-gemox(吉西他滨、奥沙利铂、利妥昔单抗);gclac(g-csf、氯法拉滨和高剂量阿糖胞苷);ia或iac(伊达比星
×
3天加ara-c(阿糖胞苷)
×
7天);ice(异环磷酰胺、卡铂、依托泊苷(vp-16));ice-r或r-ice或rice(ice+利妥昔单抗);m-bacod(甲氨蝶呤、博来霉素、多柔比星环磷酰胺、长春新碱、地塞米松);macop-b(甲氨蝶呤、醛氢叶酸(亚叶酸)、多柔比星、环磷酰胺、长春新碱、泼尼松、博来霉素);mine(美司钠、异环磷酰胺、诺凡酮、依托泊苷);mine-r或r-mine(美司钠、异环磷酰胺、novantrone、依托泊苷加利妥昔单抗);promace-mopp(甲氨蝶呤、多柔比星、环磷酰胺、依托泊苷和mopp);r-benda(利妥昔单抗+苯达莫司汀);r-dhap或dhap-r(利妥昔单抗+dhap);r-fcm或fcm-r(利妥昔单抗+fcm);r-ice或ice-r或rice(利妥昔单抗+ice);或tad(硫鸟嘌呤、阿糖胞苷(ara-c)、柔红霉素)。
109.在一些实施方案中,扩增的干细胞产品的施用可以通过提高患者实现缓解的机会来提高患有aml的患者的治疗结果。在一些实施方案中,扩增的干细胞产品的施用可以通过提高患者实现完全缓解(response/remission)(cr)的机会来改善患有aml的患者的治疗结果,例如,形态学cr、细胞遗传学cr、或分子cr、或完全缓解伴血细胞计数不完全恢复(cri)。在一些实施方案中,改善的治疗结果尤其是形态学无白血病状态、部分缓解或病情稳定。在一些实施方案中,改善的治疗结果与施用扩增的干细胞产品后患者体内il-2水平的增加有关。
110.在一些实施方案中,患有aml的患者为约20岁至约60岁。在一些实施方案中,患有aml的患者小于20岁。在一些实施方案中,患有aml的患者大于60岁或大于70岁。在一些实施方案中,患有aml的患者大于60岁或大于70岁并且正在接受降低强度的化疗方案。
111.扩增的干细胞产品以固定剂量施用于有需要的患有aml或其他恶性血液病的人类患者,以改善患者的治疗结果。优选地,扩增的干细胞产品通过输注(例如静脉输注)施用。本发明包括其他合适的扩增的干细胞产品的施用方法。扩增的干细胞产品可以通过任何方便的途径施用,例如通过推注,并且可以与其他生物活性剂一起施用。
112.施用的扩增的干细胞产品的固定剂量可有效治疗特定疾病或病症,例如aml或其他恶性血液病,例如骨髓增生异常综合征(mds)、骨髓增生性肿瘤(mpn)和非霍奇金淋巴瘤(nhl)。在一些实施方案中,患者患有aml,例如复发性/难治性aml、新发aml、或治疗相关性aml。在一些实施方案中,患者患有骨髓增生异常综合征(mds),例如mds伴多系病态造血(mds-mld);mds伴单系病态造血(mds-sld);mds伴环形铁幼粒细胞(mds-rs);mds伴原始细胞增多(mds-eb);mds伴单纯del(5q)、或未分型mds(mds-u)。在一些实施方案中,患者患有骨髓增生性肿瘤(mpn),例如慢性髓性白血病、真性红细胞增多症(p.vera)、原发性骨髓纤维化、特发性血小板增多症、慢性中性粒细胞白血病、或慢性嗜酸性粒细胞白血病。
113.在具体实施方案中,用于施用的扩增的干细胞产品的合适固定剂量为每剂约5000万、7500万、1亿、2亿、3亿或4亿个cd34+细胞,并且可以向患者施用一次、两次、三次或更多次,根据需要间隔。如果扩增的干细胞产品是冷冻或冷冻保存的产品,则cd34+细胞数是指冷冻或冷冻保存前这些细胞数。在具体实施方案中,如果适用,患者在每个方案或方案的每个周期(例如,对于多周期方案)接受单一固定剂量的扩增的干细胞产品。在具体实施方案中,患者在该方案的每个周期接受固定剂量的扩增的干细胞产品,该施用在该周期完成后进行。在具体实施方案中,患者在每个方案中接受固定剂量的扩增的干细胞产品,该施用在方案完成后进行。
114.药物组合物
115.扩增的干细胞产品可以作为包含固定剂量的药物(治疗)组合物(其是治疗有效量的扩增的干细胞产品)施用于患者,其中施用在无需匹配扩增的干细胞产品与患者的hla类型或与扩增的干细胞产品中的造血干细胞或造血干细胞与祖细胞彼此之间的hla类型的情况下进行。
116.本发明提供了药物组合物。此类组合物包含固定剂量,即治疗有效量的扩增的干细胞产品,以及药学上可接受的载体或辅料。此类载体可以是但不限于盐水、缓冲盐水、葡萄糖、水、甘油、乙醇及其组合。载体和组合物优选是无菌的。制剂应适合施用方式。该药物组合物对于人治疗用途是可接受的。如有需要,该组合物还可以含有ph缓冲剂。
117.在优选的实施方案中,根据常规程序将组合物配制成适用于向人静脉内施用干细胞的药物组合物。通常,用于静脉内施用的组合物是无菌等渗水性缓冲液中的溶液。必要时,组合物还可以包括增溶剂和局部麻醉剂(例如利多卡因)以减轻注射部位的疼痛。
118.本发明还提供了药物包装或试剂盒,包括一个或更多个容器或袋,其中装有一个或更多个剂量的扩增的干细胞产品和稀释剂,例如无菌等渗水性缓冲液。任选地,与这种容器或袋相关的可以是由监管药品或生物产品的生产、使用或销售的政府机构规定的形式的告知,该告知反映了生产、使用或销售机构对人体管理的批准。
119.在一些实施方案中,本发明提供了固定剂量的扩增的干细胞产品用于改善患有aml或其他恶性血液病的患者的治疗结果的用途,该扩增的干细胞产品包含来自多个供体的扩增造血干细胞或造血干细胞与祖细胞的合并,其中尚未匹配造血干细胞或造血干细胞与祖细胞彼此之间或与患者的hla。在一些实施方案中,扩增的造血干细胞或干细胞和祖细胞是cd34+。在一些实施方案中,扩增的干细胞产品的合适固定剂量是约5000万、7500万、1亿、2亿、3亿、或4亿个cd34+细胞。
120.实施例
121.实施例1:从人脐带血单元产生人扩增的干细胞产品
122.以下部分描述了扩增的干细胞产品的生产和储存,如图1中的流程图所示。
123.脐带血/胎盘血单元在出生时从人类供体采集。然后将采集的血液与抗凝剂混合以防止凝血。血液在4℃下隔离储存在受监控的冰箱中。对接收的单元进行评估,并确定待处理用于扩增的单元。收集有关单元的以下信息:接收日期、单元的年龄(以小时计)、供体的胎龄(以周计)、供体的性别、和单元的体积。此外,确定每个单元的总有核细胞计数和总cd34+细胞计数并计算cd34+细胞百分比。如果该单元的cd34+细胞少于350万个,则该单元将被丢弃。当单元被选择进行扩增时,它被从隔离区中移除并分配唯一的批号标识符,其在
整个生产过程中均保留。
124.在计划开始扩增培养之前,组织培养物容器首先用在磷酸盐缓冲盐水(pbs)中的2.5μg/ml的delta1
ext-igg
和5μg/ml的(重组人纤连蛋白片段)(clontech laboratories,inc.,madison,wi)在37℃下包被过夜。然后用pbs洗涤烧瓶,然后用pbs-2%人血清白蛋白(hsa)封闭。使用plus细胞分离系统处理新鲜脐带血单元以选择cd34+细胞。在选择cd34+细胞之前,检查新鲜脐带血的等分试样的总细胞计数和cd34+细胞含量。处理后回收cd34+和cd34-细胞级分。富集后,cd34+细胞的百分比相对于富集前样品中cd34+细胞的百分比增加了88至400倍。将富集的cd34+细胞级分重悬于最终培养基中,其由补充有rhil-3(10ng/ml)、rhil-6(50ng/ml)、rhtpo(50ng/ml)、rhflt-3l(50ng/ml)、rhscf(50ng/ml)的stemspan
tm
无血清扩增培养基ii(stemcell technologies,vancouver,british columbia)组成。
125.将来自多个供体的cd34+富集的细胞以≤1.8
×
104个总有核细胞/cm2容器表面积的浓度添加至特有标记的制备的组织培养容器中,然后置入专门用于该批次产品的单独监控和警报培养箱。cd34+富集的细胞彼此hla不匹配。在培养约2天至约4天后,将原始体积的50%的新鲜培养基(如上)添加至容器中。定期(每1天至3天)将细胞培养容器从培养箱中取出,并通过倒置显微镜检查细胞生长和污染迹象。在约第5天至第8天,轻轻摇动容器以混合细胞,并取出1ml样品用于过程检测。对细胞样品进行计数和针对cd34、cd7、cd14、cd15和cd56的表达的表型分析。在整个培养期间,当细胞密度增加至≥8
×
105个细胞/ml时,根据需要将细胞转移至另外的培养瓶中。在收获细胞用于冷冻保存的前一天,添加新鲜培养基。
126.在第14天,收获扩增的干细胞群用于冷冻保存。搅拌容器并将全部内容物转移至无菌的500ml离心管中。将收获的细胞离心,然后通过在磷酸盐缓冲盐水(pbs)中离心洗涤一次,并重悬于含有人血清白蛋白(has)的冷冻保护剂溶液(无菌、无热原的平衡电解质水溶液(hospira,lake forrest,il))和二甲基亚砜(dmso)或含有10%dmso的cs10冷冻保存培养基中。取样用于完成放行试验。扩增的干细胞产品在控速冷冻机中冷冻,然后转移至气相液氮(ln2)冷冻机中储存。
127.在培养期结束时,产生的细胞群是异质的,由cd34+干细胞和祖细胞以及更成熟的骨髓和淋巴前体组成,如cd34、cd7、cd14、cd15和cd56抗原存在的流式细胞分析所证明。在培养期间cd34+和总细胞数显著增加,cd34+细胞扩增约100倍至约400倍,总细胞数扩增617倍至3337倍(n=9个单独的脐带血单元,按照上述最终扩增程序进行处理)。通过免疫表型测定,基本上完全缺乏t细胞。在功能上,这些细胞能够在nod/scid小鼠模型中进行多谱系人造血移植,如前所述(参见美国专利公开号2013/0095079)。
128.实施例2:从冷冻人脐带血单元产生人扩增干细胞产物
129.制备含有总细胞子代的扩增的干细胞产品,这些细胞子代由选自合并的人脐带血单元(4至20个个体单元的合并)的富集cd34+细胞产生。如下在notch配体delta1
ext-igg
(dxi)和重组细胞因子存在下培养合并的人脐带血单元。
130.选择使用具有约200万至2000万个细胞的脐带血单元。将脐带血单元解冻,然后离心以去除冷冻保护剂,并在选择缓冲液中重悬并合并至单个容器中。选择缓冲液通常是含有1mm edta和其他组分的pbs。脐带血单元通常成对解冻。细胞在选定的缓冲液中洗涤两
次。在不考虑hla抗原或等位基因(即无需匹配)的情况下合并细胞。合并的脐带血单元与顺磁珠一起预孵育,然后由clinimacs处理以使用一次性管组富集cd34+细胞。选择后,将细胞离心,将收集的cd34+细胞悬浮在补充有5种重组人细胞因子il-3(10ng/ml)和il-6、tpo、scf和flt-3l(各为50ng/ml))的细胞培养基(stemspan无血清扩增培养基ii(sfemii)培养基)中。然后对富集的cd34+细胞取样以确定活细胞产量和组合物中cd34+细胞的百分比。使用补充有5种重组人细胞因子(il-3、il-6、tpo、scf、flt-3l)的stemspan sfemii培养基,将cd34+细胞以合适的目标接种密度放入包被的烧瓶中。使用前,用重组蛋白dxi(2.5微克/ml)和重组人纤连蛋白片段(rfn-ch-206)(5微克/ml)包被烧瓶;未结合的蛋白在使用前从烧瓶中洗去。根据需要向烧瓶中加入新鲜的sfemii培养基和细胞因子。当细胞达到足够的细胞数时,使用相同的sfemii培养基和5种细胞因子以合适的目标接种密度收集、合并细胞并传代至更大的容器中。如上所述,容器也用dxi和重组人纤连蛋白片段(rfn-ch-206)预包被过夜。监测容器的细胞密度和活力,并根据需要加入全体积的新鲜sfemii培养基和细胞因子。当细胞达到期望的细胞密度时,通过轻微搅拌收集细胞,通过离心浓缩,去除培养基,并将细胞重悬于洗涤缓冲液中。确定活cd34+细胞计数。洗涤和收获后,将细胞沉淀重悬在含有白蛋白的平衡电解质溶液中。最终干细胞产品通常含有约50个至约1亿个细胞/ml。
131.然后将最终细胞产品添加至冷冻保护剂培养基中,随后无菌装入贴有标签的cryostore袋中,在控速冷冻机中冷冻保存,并在《-150℃下储存在气相液氮(ln2)冷冻机中。这些袋以约20ml/袋的体积装有约50个至约4亿个cd34+细胞。冷冻保护剂培养基含有如所述的在normosol-r或cs10中的约4%的人血清白蛋白(hsa)、10%的二甲基亚砜(dmso)。
132.实施例3:接受扩增的干细胞产品治疗患有aml的患者
133.接受密集骨髓抑制化疗方案的急性髓性白血病患者具有发生危及生命的感染的风险,从而影响整体治疗结果。在i期和2期研究中,研究了非hla匹配、合并的脐带血来源的体外扩增cd34+干细胞产品(dilanubicel或nla101)对严重细菌或真菌感染率的影响。dilanubicel与诱导和巩固化疗联合施用。一项全球2期随机开放标签研究入组计划的220例受试者中的146名至4个治疗臂中的一个:标准护理(soc)单独使用或soc加低、中或高剂量dilanubicel(100
×
106、300
×
106、或800
×
106个cd34+细胞)。每轮化疗至多可给予dilanubicel的3次给药,并在化疗或dilanubicel末次给药后对受试者进行至多84天或30天的随访。当研究停止时,没有观察到对感染率的特殊影响,令人惊讶的是,与仅接受化疗的对照组患者相比,接受dilanubicel治疗的受试者的完全缓解(cr)率更高。此外,接受dilanubicel治疗与血清白介素-2(il-2)水平的暂时剂量依赖性增加有关。没有数据安全监测委员会相关的安全性问题,但观察到一些非预期严重不良事件(sae)。然而,没有观察到移植物抗宿主病或细胞因子释放综合征。
134.材料和方法
135.试验设计:本研究是一项研究dilanubicel降低成年aml受试者中与化疗引起的中性粒细胞减少相关的感染率的安全性和有效性的开放标签、多中心、随机、对照、剂量探索2期研究。本研究在美国(us)、韩国(sk)和澳大利亚(au)的36个中心开展。入组后,受试者按1:1:1:1随机分组至对照组(标准护理(soc)化疗)或3个研究臂中的一个(soc化疗+低剂量、
中剂量或高剂量dilanubicel)。随机分组按地理区域(美国vs sk/au)分层。
136.随机分组至研究臂的受试者有资格在第一个化疗周期后接受单次固定分配剂量的dilanubicel,并在随后的化疗周期后接受至多2次另外的给药(每周期输注一次)。随机分组至soc臂的受试者接受相当的治疗,但在至多3个化疗周期内未输注dilanubicel。所有受试者在随机分组后随访84天,或在末次输注dilanubicel后30天,或在soc臂末次化疗输注后30天,以较长者为准。在完成计划外的中期分析后,本研究在入组146例受试者(66%)后停止。
137.该方案及其修正案已获得相关机构审查委员会和伦理委员会的批准,并且在任何研究程序之前均需要书面知情同意。安全性由独立的数据安全监测委员会(dsmb)监督。
138.患者:有资格的受试者必须患有未经治疗的新发或继发性aml,并且根据当地机构标准计划接受至少2个周期的具有治愈意图的化疗。诱导化疗需要含有蒽环类药物和阿糖胞苷骨架,并且预期导致中度至重度骨髓抑制。还要求受试者的karnofsky评分≥50或东部肿瘤协作组(ecog)的体能状态为0、1或2,并且需要有充分的肾、肝、肺和心脏功能,并且在筛选时没有活动性不受控感染的证据。联合使用粒细胞输血、免疫疗法和其他研究药物被排除。
139.研究治疗:dilanubicel是离体扩增的造血干细胞与祖细胞(hspc)产品,其来源于如上所述的合并的、不匹配的脐带血来源的cd34+细胞。cd34+细胞从筛选的有资格脐带血供体中分离,并在固定的notch配体和重组细胞因子(通常如上所述)存在下培养16天。扩增的干细胞产品冷冻保存直至输注,并以约1亿(低剂量)、3亿(中剂量)和8亿(高剂量)个cd34+细胞/袋的固定剂量(体积为约20ml)提供给研究中心。在给定周期的化疗末次给药后约24小时至36小时,在5分钟至10分钟内静脉内给予dilanubicel。给药前立即施用口服对乙酰氨基酚和静脉内抗组胺药。
140.终点和统计分析:研究的主要终点是在84天研究期间的重度(不良事件通用术语标准(ctcae)3级或更高)细菌或真菌感染的发生率。分析通过计算受试者内特有的≥3级感染的数量并按研究天数归一化进行。使用负二项式回归对治疗臂(soc作为参考)和地理区域的归一化感染率进行回归,以比较治疗臂之间的感染率。从研究第1天开始的研究天数被用作抵消变量,以解释由于死亡或失访导致的不同随访。分别计算事件发生率比和95%置信区间作为关联强度和精确度的度量。
141.关键次要终点包括最佳总体治疗缓解、非格司亭的使用、及发热性中性粒细胞减少的发生率和持续时间、以及安全性。根据修订的国际工作组标准,治疗缓解被定义为完全缓解(cr)或完全缓解伴计数不完全恢复(cri),并使用cochran-mantel-hansel检验比较治疗比,按地理区域分层。
142.结果
143.在入组关闭前为本研究筛选的162例受试者中,入组146例并随机接受研究治疗:37例至低剂量臂,38例至中剂量臂,35例至高剂量臂,以及36例随机分组至soc臂。在研究停止时,低剂量臂有18例受试者(48.6%),中剂量臂有17例受试者(44.7%),高剂量臂有10例受试者(28.6%),相比于soc臂有6例受试者(16.7%)已根据方案完成研究。图2中提供了受试者处置总结。接受dilanubicel治疗的受试者例数在低剂量臂中为33例(89.2%),在中剂量臂中为34例(89.5%),以及在高剂量臂中为34例(97.1%)。在所有3个臂中,每例受试者
接受的dilanubicel剂量的中位数为2。
144.随机分组的受试者的总体中位年龄为60岁(范围,19-77)。受试者的性别平均分配,男性(75例受试者;51.4%)相比于女性(71例受试者,48.6%)。大多数受试者是白人(110例受试者;75.3%)。大多数基线疾病特征在组间相对平衡,尽管在soc臂中有更高比例的受试者具有不利的aml风险。
145.研究期间发生的≥3级细菌或真菌感染总数为:低剂量臂23例,中剂量臂22例,高剂量臂25例,以及soc臂20例。总dilanubicel相比于soc的检测不具有统计学显著性,p=0.9604。每个治疗臂相比于soc臂的比率和相关的95%ci为0.88(0.44,1.77;p=0.7291)低剂量、0.93(0.46,1.88;p=0.8471)中剂量和1.05(0.53,2.09;p=0.8868)高剂量。
146.表1总结了研究过程中按治疗臂列出的完全缓解(cr)(包括形态学cr、细胞遗传学cr、分子cr或cri)相比于非cr(所有其他非cr缓解评估)的最佳总体缓解率。与soc臂相比,每个治疗臂的cr率在数值上均有利,这在中剂量臂(p=0.0024)和总治疗组(p=0.0086)中具有统计学显著性。该观察结果是出乎意料的,特别是考虑到使用单一供体、不匹配的扩增脐带血产品的先前研究(delaney等人,2016,lancet3(7):pe330-339)。尽管cr率不是先前研究的主要终点,但未报告cr率增加。
147.表1:按治疗组列出的完全缓解率
[0148][0149]
注:cr=形态学cr、细胞遗传学cr、分子cr、或cr伴血细胞计数不完全恢复(cri);非cr=无形态学白血病状态、部分缓解、早期评估、治疗失败
[0150]
*p值来自按地理区域分层的cme检测。
[0151]
尽管高剂量臂中安全性事件的总体发生率仅略高于soc臂,但总体上dilanubicel通常耐受性良好,相关事件呈剂量依赖性增加。与dilanubicel相关的最常见不良事件是发热/发热性中性粒细胞减少、输注反应以及炎症体征和症状。与soc臂相比,研究中的死亡发生率在任何扩增的干细胞产品组中均未增加。dsmb在整个研究过程中监测安全性并且没有提出安全性问题。与soc臂相比,每个治疗臂在数值上有利的cr率是非预期的。
[0152]
实施例4:患有恶性血液病的患者接受扩增的干细胞产品治疗
[0153]
患有恶性血液病并接受密集化疗方案的患者接受标准护理(soc)加低、中或高剂量dilanubicel(分别为100
×
106、300
×
106或800
×
106个cd34+细胞)治疗。dilanubicel在每个化疗周期后施用。根据标准实践对患者进行随访,并且在整个研究过程中评估完全缓解(cr)(包括形态学cr、细胞遗传学cr、分子cr或cri)相比于非cr(所有其他非cr缓解评估)的最佳总体缓解率。
[0154]
本发明的范围不受本文描述的具体实施方案的限制。实际上,根据前面的描述和附图,除了本文描述的那些之外,对本发明的各种修改对于本领域技术人员来说将变得显而易见。这种修改旨在落入所附权利要求的范围内。
[0155]
本文引用了各种出版物,包括专利、专利申请出版物和科学文献,出于所有目的其公开内容通过引用以其全文并入。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1