2型糖尿病的治疗的制作方法
2型糖尿病的治疗
1.本发明涉及一种药物组合,所述药物组合包含(a)药物配制品,所述药物配制品包含(i)利西拉来(lixisenatide)或/和其药学上可接受的盐,和(ii)甘精胰岛素或/和其药学上可接受的盐;以及(b)sglt2抑制剂或/和其药学上可接受的盐。
2.糖尿病可以分为以下一般类别(classification and diagnosis of diabetes:standards of medical care in diabetes-2019-diabetes care 2019;42(增刊1):s13
–
s28)
3.1. 1型糖尿病(由于自身免疫性b细胞破坏,通常导致绝对胰岛素缺乏)
4.2. 2型糖尿病(由于经常在胰岛素抵抗的背景下,b细胞胰岛素分泌的逐渐丧失)
5.3.妊娠期糖尿病(gdm)(在妊娠中期或晚期诊断出的糖尿病,其在妊娠前并未明确表现为糖尿病)
6.4.由于其他原因引起的特定类型的糖尿病,例如单基因糖尿病综合征(如新生儿糖尿病和青少年发病的成人型糖尿病[mody])、外分泌胰腺疾病(如囊性纤维化和胰腺炎)以及药物或化学品诱导的糖尿病(如在治疗hiv/aids时或器官移植后使用糖皮质激素)可以基于血浆葡萄糖标准(空腹血浆葡萄糖(fpg)值或在75g口服葡萄糖耐量测试(ogtt)期间的2h血浆葡萄糖(2h pg)值)或hba1c标准来诊断糖尿病
[0007]
糖尿病诊断的标准
[0008]
fpg≥126mg/dl(7.0mmol)。空腹定义为至少8h无热量摄取。*
[0009]
或
[0010]
ogtt期间2h pg≥200mg/dl(11.1mmol/l)。所述测试应当按照who的描述进行,使用含有溶于水的75g无水葡萄糖的当量的葡萄糖负荷。*
[0011]
或
[0012]
a1c≥6.5%(48mmol/mol)。所述测试应当在实验室中使用ngsp认证并标准化为dcct测定的方法进行。*
[0013]
或
[0014]
在具有高血糖症或高血糖危象的典型症状的患者中,随机血浆葡萄糖≥200mg/dl(11.1mmol/l)。
[0015]
*在没有明确高血糖症的情况下,诊断需要来自同一样品或在两个独立测试样品中的两个异常测试结果。
[0016]
2型糖尿病是一种特征在于碳水化合物和脂肪代谢异常的异质综合征。2型糖尿病的病因是多因素的,并且包括影响β细胞功能和组织(肌肉、肝脏、脂肪组织、胰腺)胰岛素敏感性的遗传和环境因素两者(acta clin belg.2003年11月至12月;58(6):335-41.pathophysiology of type 2 diabetes.scheen aj)。葡萄糖代谢的正常调节是由涉及胰岛β细胞和胰岛素敏感性组织的反馈回路决定的,在所述胰岛素敏感性组织中对胰岛素的组织敏感性决定了β细胞反应的大小。当存在胰岛素抵抗时,β细胞通过增加胰岛素输出量来维持正常的葡萄糖耐量。仅在存在胰岛素抵抗的情况下,β细胞无法释放足够的胰岛素时,葡萄糖水平才会升高。尽管β细胞功能障碍具有明显的遗传成分,但环境变化起着至关
重要的作用。(lancet.2014年3月22日;383(9922):1068
–
1083.pathophysiology and treatment of type 2 diabetes:perspectives on the past,present and future steven e.kahn,m.b.,ch.b.,1 mark e.cooper,m.b.,b.s,ph.d.,2和stefano del prato,m.d.3)。
[0017]
2型糖尿病患者罹患许多并发症的风险增加,这主要是由于复杂且相互关联的机制,如高血糖症、胰岛素抵抗、低度炎症和动脉粥样硬化形成加速。心脑血管疾病经常与2型糖尿病相关,并且可能变得危及生命,尤其是冠状动脉病变、中风和心力衰竭。2型糖尿病必须被视为独立的心血管风险因素。肾病在2型糖尿病中很频繁,但是起源混杂。现在,它是终末期肾脏疾病的最高病因。更好的代谢和血压控制以及改善的微量白蛋白尿管理能够减缓疾病进程。然而,自相矛盾地轻微进展的视网膜病变必须在这些年龄相当大的患者中进行筛选和治疗,所述患者总体上具有高眼科风险(jean-louis schlienger presse med.2013;42:839
–
848)。
[0018]
对于患有2型糖尿病的超重或肥胖患者(例如体重指数(bmi)≥30kg/m2的患者)而言,存在特别的风险。在这些患者中,糖尿病的风险与超重的风险重叠,从而导致例如与体重正常的2型糖尿病患者相比,心血管疾病增加。
[0019]
2型糖尿病是一种通常需要逐步加强治疗以维持良好的血糖控制的进行性疾病。也已充分确定,及时治疗2型糖尿病患者对结果具有有益的影响,因此提倡严格控制血糖,以降低微血管或大血管并发症发展或进展的风险(khunti,diabetes care,2013)。
[0020]
尽管长期使用标准护理的口服抗糖尿病疗法,仍会发生进展。即使使用多种口服抗糖尿病药物(oad),大多数患者最终仍将需要添加胰岛素来实现并维持hba1c目标(khunti如上;levin pa,wei w,zhou s,xie l,baser o.outcomes and treatment patterns of adding a third agent to 2 oads in patients with type 2 diabetes.j manag care spec pharm.2014年5月;20(5):501-12.)。
[0021]
未得到充分控制的t2dm患者在开始注射疗法之前,通常从口服抗糖尿病药物的单一疗法逐步发展为双重或三重疗法。
[0022]
胰高血糖素样肽-1受体激动剂(glp-1 ra)在口服疗法控制不充分的大多数患者中是优选的初始注射疗法,并且根据需要结合基础胰岛素疗法进行个体化选择。
[0023]
多项研究已经证明了将glp-1 ra与基础胰岛素组合作为顺序施用的单独注射疗法的有效性(maiorino mi,chiodini p,bellastella g等人free and fixed-ratio combinations of basal insulin and glp-1 receptor agonists versus basal insulin intensification in type 2 diabetes:a systematic review and meta-analysis of randomized controlled trials.diabetes obes metab 2018;20:2309-2313;castellana m,cignarelli a,brescia f,laviola l,giorgino f.glp-1 receptor agonist added to insulin versus basal-plus or basal-bolus insulin therapy in type 2 diabetes:a systematic review and meta-analysis.diabetes metab res rev 2019;35:e3082)。基础胰岛素加上glp-1ra的固定比率组合(frc)代表了促进管理的进一步前进,其中单次注射提供了两种有效的注射疗法的同时施用,这两种疗法具有治疗2型糖尿病的互补作用模式。
[0024]
化合物despro
36
毒晰外泌肽(exendin)-4(1-39)-lys
6-nh2(ave0010,利西拉来)是
毒晰外泌肽-4的衍生物。ave0010作为seq id no:93公开于wo 01/04156中:
[0025]
seq id no:1:利西拉来(44个氨基酸)
[0026][0027]
seq id no:2:毒晰外泌肽-4或艾塞那肽(39个氨基酸)
[0028][0029]
毒晰外泌肽是一组可以降低血葡萄糖浓度的肽。毒晰外泌肽类似物利西拉来的特征在于天然毒晰外泌肽-4序列的c末端截短。利西拉来包含六个不存在于毒晰外泌肽-4中的c末端赖氨酸残基。
[0030]
利西拉来也被称为des-38-脯氨酸-毒晰外泌肽-4(钝尾毒蜥(heloderma suspectum))-(1-39)-肽基五-l-赖氨酰基-l-赖氨酰胺(cas号320367-13-3)。在本发明中,“利西拉来”包括其药学上可接受的盐。本领域技术人员知道利西拉来的合适的药学上可接受的盐。
[0031]
甘精胰岛素是一种人胰岛素类似物。甘精胰岛素是31
b-32
b-二-arg人胰岛素,其中位置a21中的天冬酰胺被甘氨酸进一步取代。甘精胰岛素也被称为gly(a21)-arg(b31)-arg(b32)人胰岛素。甘精胰岛素的cas号是160337-95-1。在本发明中,“甘精胰岛素”包括其药学上可接受的盐。本领域技术人员知道甘精胰岛素的合适的药学上可接受的盐。100u甘精胰岛素对应于3.6378mg甘精胰岛素。
[0032]
利西拉来和甘精胰岛素的组合配制品公开于wo 2014/202483中。这些配制品含有固定剂量比的100u/ml甘精胰岛素和50μg/ml利西拉来或者100u/ml甘精胰岛素和33μg/ml利西拉来。这些配制品以商品名“soliqua”或“suliqua”销售。
[0033]
在日本使用的胰岛素剂量通常低于在白种人患者中使用的剂量,这主要是由于日本患者的体重指数(bmi)和胰岛素抵抗较低(等人,diabetes care.2014;37(3):796-804)。
[0034]
利西拉来已被批准以相同的维持剂量20μg在欧盟、美国和日本每日使用一次。
[0035]
在1期研究pdy6797中评估了白种人和日本患者的利西拉来药代动力学(pk)和药效学(seino等人,diabetes obes metab.2014;16(8):739-47)。已显示白种人与日本患者在安全性和耐受性方面相似,其中这2个种族之间的pk分布高度重叠。此外,对于白种人和日本患者两者,在20μg利西拉来的剂量水平下,观察到了餐后葡萄糖控制变化方面的最佳功效。
[0036]
二甲双胍是1,1-二甲基双胍的国际非专有名称(cas号657-24-9)。二甲双胍是一种用于治疗对饮食改变无反应的非胰岛素依赖型糖尿病(2型糖尿病)的双胍类降血糖药。二甲双胍通过改善胰岛素敏感性和减少葡萄糖的肠吸收来改善血糖控制。二甲双胍通常口服施用。然而,二甲双胍对肥胖患者的2型糖尿病的控制可能不足。因此,在这些患者中,可能需要用于控制2型糖尿病的另外的措施。如本文所用,“二甲双胍”包括其药学上可接受的盐。本领域技术人员知道二甲双胍的合适的药学上可接受的盐。
[0037]
钠-葡萄糖协同转运蛋白2(sglt2)抑制剂具有独立于胰岛素分泌和胰岛素作用的作用机制。通过抑制肾近端小管中的sglt2,它们减少肾葡萄糖重吸收,引起尿葡萄糖排泄,从而降低血浆葡萄糖。除降低血浆葡萄糖之外,这种独特的作用机制还纠正了许多代谢和
血流动力学异常,所述异常是心血管疾病的风险因素(abdul-ghani ma等人,endocr rev 2011;32:515
–
531;abdul-ghani ma等人,diabetes care 2016;39:717
–
725)。尿葡萄糖损失产生负热量平衡,导致体重减轻。sglt2抑制减少近端小管中的钠重吸收并发挥利尿/利尿钠作用(lambers等人,diabetes obes metab 2013;15:853
–
862)。sglt2抑制还通过引起渗透性利尿而促进尿钠排泄。这种利尿钠作用加上更长期的体重减轻部分地导致了收缩压/舒张压的降低(abdul-ghani等人,am j physiol renal physiol 2015;309:f889
–
f900)。
[0038]
sglt2抑制剂通常口服施用。然而,sglt2抑制剂对肥胖患者的2型糖尿病的控制可能不足。因此,在这些患者中,可能需要用于控制2型糖尿病的另外的措施。
[0039]
单独的sglt2抑制剂可能不足以实现充分的血糖控制。sglt2抑制剂与第二抗糖尿病药(如二甲双胍或/和glp-1受体激动剂)组合可能也不足够。因此,在这些患者中需要合适的治疗方案。本发明的问题可以在为这些患者提供合适的治疗方案中看出。
[0040]
第二或第三抗糖尿病药的添加造成了可能发生不希望的副作用的问题。
[0041]
在本发明的实施例中,证明在接受不足以实现充分的血糖控制的sglt2抑制剂的2型糖尿病患者中,添加甘精胰岛素和利西拉来的固定剂量比配制品可以改善血糖控制,具有改善的副作用概况。
[0042]
本发明的第一方面是一种药物组合,所述药物组合包含
[0043]
(a)药物配制品,所述药物配制品包含
[0044]
(i)利西拉来或/和其药学上可接受的盐,和
[0045]
(ii)甘精胰岛素或/和其药学上可接受的盐,
[0046]
以及
[0047]
(b)sglt2抑制剂或/和其药学上可接受的盐。
[0048]
在本发明中,已经发现,鉴于利西拉来和甘精胰岛素的固定剂量比配制品不与sglt2抑制剂组合,利西拉来和甘精胰岛素的固定剂量比配制品与sglt-2抑制剂的组合是有效且安全的。在本文所述的试验中,总共119名2型糖尿病患者接受了甘精胰岛素/利西拉来固定比率组合(frc),并且还接受了sglt2抑制剂。
[0049]
由于在日本使用的胰岛素剂量通常低于在白种人患者中使用的剂量,这主要是由于日本患者的体重指数(bmi)和胰岛素抵抗较低(等人,diabetes care.2014;37(3):796-804),因此在本发明的实施例中,使用组合的不同固定比率。在包括被认为是“白种人”患者的9个国家(加拿大、爱沙尼亚、德国、以色列、意大利、罗马尼亚、斯洛伐克、西班牙、美国)的患者的实施例1和4中,使用每1μg利西拉来2个单位甘精胰岛素u100(即100u/ml)和每1μg利西拉来3个单位甘精胰岛素u100的固定剂量比配制品。在包括日本患者的实施例2、3、5和6中,使用包含每1μg利西拉来1个单位甘精胰岛素u100的固定剂量比配制品。这些配制品提供了适当的剂量范围,在实施例1和4中为10至60个单位,在实施例2、3、5和6中为5至20个单位,满足了这两个群体的每一个中绝大多数患者的需求。
[0050]
实施例1涉及一项研究,其评估了甘精胰岛素/利西拉来固定比率组合在glp-1受体激动剂和二甲双胍(单独或与吡格列酮和/或sglt2抑制剂一起)控制不充分的2型糖尿病成人中的功效和安全性,随后是固定比率组合单组26周扩展期(研究efc 13794)。
[0051]
在实施例1中,研究治疗包括固定剂量比配制品,其在二甲双胍加上或不加上
sglt2抑制剂的基础上,包含100u/ml甘精胰岛素和50μg/ml利西拉来,或包含100u/ml甘精胰岛素和33μg/ml利西拉来。在二甲双胍加上或不加上sglt2抑制剂的基础上,将研究治疗与作为活性比较剂的glp-1受体激动剂的持续治疗进行了比较。
[0052]
实施例4总结了实施例1的数据的亚组分析,将接受sglt2抑制剂的患者与未接受sglt2抑制剂的患者进行了比较。包括了2型糖尿病患者,其接受二甲双胍、选自利拉鲁肽、艾塞那肽、艾塞那肽缓释配制品、阿必鲁肽(albiglutide)和度拉鲁肽(dulaglutide)的glp-1受体激动剂,加上或不加上sglt2抑制剂。在两个治疗组中均观察到功效结果的改善(糖化血红蛋白[hba1c]、空腹血浆葡萄糖[fpg]和餐后2小时血浆葡萄糖[ppg]从基线到第26周的变化)。
[0053]
根据实施例4,与未接受sglt2抑制剂的患者组相比,在接受sglt2抑制剂的患者中,固定比率配制品的效果大于持续glp-1ra的比较治疗。
[0054]
在接受sglt2抑制剂的患者中,在26周后,鉴于活性比较剂,hba1c的改善为0.88%,与之相比在未接受sglt2抑制剂的患者中为0.61%(实施例4的表3)。
[0055]
在接受sglt2抑制剂的患者中,在26周后,鉴于活性比较剂,空腹血浆葡萄糖的改善为2.06mmol/l,与之相比在未接受sglt2抑制剂的患者中为1.64mmol/l(实施例4的表4)。
[0056]
在接受sglt2抑制剂的患者中,在26周后,鉴于活性比较剂,餐后2小时葡萄糖的改善为3.26mmol/l,与之相比在未接受sglt2抑制剂的患者中为2.81mmol/l(实施例4的表5)。
[0057]
在实施例4(表8)中,相比于非使用者,在使用sglt2i的frc组中,已记录的症状性低血糖(血浆葡萄糖≤3.9mmol/l[≤70mg/dl])的报告频率更低(对于sglt2i使用者为每患者每年0.72例事件相比于非使用者为1.62)。
[0058]
总之,实施例4证明,与不使用sglt2抑制剂的患者相比,在使用sglt2抑制剂与甘精胰岛素和利西拉来的固定剂量比配制品的组合的患者中,可以实现改善的血糖控制和改善的副作用概况。
[0059]
实施例2和3涉及在日本患者中进行的临床试验,所述患者接受包含100u/ml甘精胰岛素和100μg/ml利西拉来的固定剂量比配制品。
[0060]
实施例2涉及一项研究,其比较了甘精胰岛素/利西拉来固定比率组合与利西拉来与口服抗糖尿病药物组合在口服抗糖尿病药物控制不充分的日本2型糖尿病患者中的功效和安全性,其安全性扩展期为26周。
[0061]
实施例3涉及一项研究,其比较了甘精胰岛素/利西拉来固定比率组合与甘精胰岛素与口服抗糖尿病药物组合在口服抗糖尿病药物控制不充分的日本2型糖尿病患者中的功效和安全性。
[0062]
在实施例2和3中,在研究期间允许使用以下口服抗糖尿病药物中的一种或两种作为背景疗法:双胍(例如二甲双胍)、噻唑烷二酮(tzd)、α-葡糖苷酶抑制剂(α-gi)、sglt2抑制剂、格列奈(glinide)和磺酰脲(su)。
[0063]
实施例5总结了实施例2的数据的亚组分析,将接受sglt2抑制剂的患者与未接受sglt2抑制剂的患者进行了比较。两个治疗组的功效结果(hba1c和fpg从基线到第26周的变化)在sglt2i使用者和非使用者中大致相似(实施例5的表3、表4)。
[0064]
关于常见的治疗期间出现的不良事件(teae)(实施例5的表6),当与sglt2i非使用者相比时,sglt2i使用者的frc治疗组中胃肠系统障碍系统器官分类(soc)的teae报告频率
更低(分别为17.6%与32.3%)。类似地,与非使用者相比,sglt2i使用者的frc组中已记录的症状性低血糖(血浆葡萄糖≤3.9mmol/l[≤70mg/dl])的报告频率更低(每患者每年的事件数量:分别为0.18和1.14)(实施例5的表7)。
[0065]
实施例6总结了实施例3的数据的亚组分析,将接受sglt2抑制剂的患者与未接受sglt2抑制剂的患者进行了比较。两个治疗组的功效结果(hba1c、fpg和2小时ppg从基线到第26周的变化)在sglt2i使用者和非使用者中大致相似(实施例6的表3、表4、表5)。没有迹象表明sglt2i使用者亚组的frc功效降低。
[0066]
关于常见的teae(实施例6的表7),当与sglt2i非使用者相比时,sglt2i使用者的frc组中胃肠道系统器官分类(soc)的teae报告频率在数字上也更低(分别为22.0%与27.4%)。已记录的症状性低血糖(血浆葡萄糖≤3.9mmol/l)在sglt2i使用者和非使用者中的报告比例相似(实施例6的表8)。
[0067]
总之,实施例5和6证明,与不使用sglt2抑制剂的患者相比,在使用sglt2抑制剂与甘精胰岛素和利西拉来的固定剂量比配制品的组合的患者中,可以实现改善的副作用概况。
[0068]
如本文所用,“sglt2抑制剂”包括其药学上可接受的盐。本领域技术人员知道sglt2抑制剂的合适的药学上可接受的盐。“sglt2抑制剂”在本文中也被称为“sglt-2抑制剂”或“sglt2i”。
[0069]
在本发明中,sglt2抑制剂可以选自依帕列净(empagliflozin)、坎格列净(canagliflozin)、达格列净和埃格列净(ertugliflozin)。例如,sglt2抑制剂可以选自依帕列净、坎格列净和达格列净。
[0070]
技术人员知道待施用的sglt2抑制剂的合适剂量。在本发明的组合中,坎格列净可以按100至300mg范围内的日剂量施用。在本发明的组合中,依帕列净可以按10至25mg范围内的日剂量施用。在本发明的组合中,达格列净可以按5至20mg范围内的日剂量施用。
[0071]
在本发明的药物组合中,药物配制品(a)可以包含浓度为100至500u/ml的甘精胰岛素。例如,药物配制品(a)可以包含浓度为100u/ml的甘精胰岛素。
[0072]
在本发明的药物组合中,药物配制品(a)可以包含浓度为20至150μg/ml的利西拉来。例如,药物配制品(a)可以包含浓度为33μg/ml、50μg/ml或100μg/ml的利西拉来。
[0073]
在本发明的另一方面,药物配制品(a)包含浓度为100u/ml的甘精胰岛素和浓度为33μg/ml、50μg/ml或100μg/ml的利西拉来。
[0074]
本发明的药物组合可以用于例如在人类患者中治疗2型糖尿病。
[0075]
患者可以是白种人患者,或者可以是亚洲患者,例如中国或日本患者。
[0076]
配制品(a)可以包含浓度为100u/ml的甘精胰岛素和浓度为33μg/ml或50μg/ml的利西拉来。此配制品在治疗白种人2型糖尿病患者方面是合适的,但是此配制品的使用不限于此患者组。
[0077]
配制品(a)可以包含浓度为100u/ml的甘精胰岛素和浓度为100μg/ml的利西拉来。此配制品在治疗亚洲2型糖尿病患者(例如中国或日本患者)方面是合适的,但是此配制品的使用不限于此患者组。
[0078]
如本发明的实施例所证明的,如本文所述的组合可以用于改善2型糖尿病患者的血糖控制。在本发明中,“血糖控制的改善”或“血糖控制”例如是指餐后2小时血浆葡萄糖浓
度的改善、空腹血浆葡萄糖浓度的改善、自我监测血浆葡萄糖(smpg)的改善或/和hba
1c
值的改善。
[0079]
例如,“血糖控制的改善”或“血糖控制”可以包括餐后2小时血浆葡萄糖浓度的改善。
[0080]
例如,“血糖控制的改善”或“血糖控制”可以包括餐后2小时血浆葡萄糖浓度的降低。降低意味着例如餐后2小时血浆葡萄糖浓度达到血糖正常值或至少接近这些值。
[0081]
例如,“血糖控制的改善”或“血糖控制”可以包括空腹血浆葡萄糖浓度的改善。
[0082]
例如,空腹血浆葡萄糖浓度的改善可以包括空腹血浆葡萄糖浓度的降低。降低意味着例如空腹血浆葡萄糖浓度达到血糖正常值或至少接近这些值。
[0083]
例如,“血糖控制的改善”或“血糖控制”可以包括自我监测血浆葡萄糖浓度的改善。
[0084]
例如,自我监测葡萄糖浓度的改善可以包括自我监测葡萄糖浓度的降低。降低意味着例如自我监测葡萄糖浓度达到血糖正常值或至少接近这些值。
[0085]
例如,“血糖控制的改善”或“血糖控制”可以包括hba
1c
值的改善。
[0086]
例如,hba
1c
值的改善可以包括hba
1c
值的降低。例如,hba
1c
值的降低意味着hba
1c
值降低到6.5%或7%以下。
[0087]
在本发明中,空腹血浆葡萄糖的血糖正常值是例如《5.6mmol/l的血葡萄糖浓度。
[0088]
在本发明中,如本文所定义的餐后血浆葡萄糖的血糖正常值是例如《7.8mmol/l的血葡萄糖浓度。
[0089]
在本发明中,血糖正常的hba1c值例如《6.5%或《7%。
[0090]
在本发明的另一方面,单独用sglt2抑制剂(例如单独用依帕列净、坎格列净、达格列净或埃格列净)未充分控制待治疗的2型糖尿病。
[0091]
如本文所用,术语“口服抗糖尿病药”包括双胍类、噻唑烷二酮类、α-葡糖苷酶抑制剂、格列奈类和磺酰脲类,但是不限于这些化合物。例如,双胍是二甲双胍。
[0092]
如本文所用,术语“glp-1受体激动剂”或“glp-1ra”包括利西拉来、艾塞那肽、度拉鲁肽、利拉鲁肽和阿必鲁肽,但是不限于这些化合物。艾塞那肽也可以按缓释配制品的形式施用。
[0093]
在另一方面,单独用sglt2抑制剂和口服抗糖尿病药或者单独用sglt2抑制剂和glp-1受体激动剂未充分控制待治疗的2型糖尿病。口服抗糖尿病药可以选自双胍类、噻唑烷二酮类、α-葡糖苷酶抑制剂、格列奈类和磺酰脲类。例如,双胍是二甲双胍。
[0094]
在另一方面,(i)单独用sglt2抑制剂和二甲双胍或者(ii)单独用sglt2抑制剂和glp-1受体激动剂未充分控制待治疗的2型糖尿病。
[0095]
在又另一方面,单独用sglt2抑制剂、二甲双胍和glp-1受体激动剂未充分控制待治疗的2型糖尿病。
[0096]
在本发明中,通过抗糖尿病治疗“未充分控制”意味着此治疗不足以消除2型糖尿病的症状。例如,通过此治疗“未充分控制”意味着患者在例如餐后2小时血浆葡萄糖浓度、smpg、hba1c值或/和空腹血浆葡萄糖浓度方面未达到血糖正常值。例如,抗糖尿病预治疗不足以实现充分的血糖控制。
[0097]
在本发明中,“预治疗”、“在施用本发明的组合之前的治疗”或“根据本发明待治疗
的患者”的治疗涉及患者在接受本发明的组合之前(例如在接受本发明的组合之前的一个、两个、三个月内或在更长时间内)接受的抗糖尿病治疗。
[0098]
如本文所用,“根据本发明待治疗”、“根据本发明的治疗”或“根据本发明的疗法”涉及通过本发明的药物组合治疗2型糖尿病患者。
[0099]
在施用本发明的组合之前用于治疗的二甲双胍可以例如以至少1.0g/天二甲双胍或至少1.5g/天二甲双胍的剂量施用至少3个月,或/和以最大2.0g/天二甲双胍的剂量施用至少3个月或以最大3.5g/天二甲双胍的剂量施用至少3个月。日剂量也可以在500至3000mg(例如1000至2600mg)的范围内。
[0100]
在施用本发明的组合之前用于治疗的glp-1受体激动剂可以选自利西拉来、艾塞那肽、度拉鲁肽、利拉鲁肽和阿必鲁肽。艾塞那肽也可以按缓释配制品的形式施用。
[0101]
例如,在施用本发明的组合之前用于治疗的glp-1受体激动剂可以选自利西拉来、艾塞那肽、度拉鲁肽和利拉鲁肽。
[0102]
包含glp-1受体激动剂(如选自利西拉来、艾塞那肽、度拉鲁肽、利拉鲁肽和阿必鲁肽)的配制品是技术人员已知的。
[0103]
glp-1受体激动剂的典型剂量是技术人员已知的。在本发明中,艾塞那肽的日剂量可以在10-20μg的范围内。缓释配制品中艾塞那肽的周剂量可以为2mg。度拉鲁肽的日剂量可以在0.75-1.5mg的范围内。利拉鲁肽的日剂量可以在1.2-1.8mg的范围内。阿必鲁肽的日剂量可以在30至50mg的范围内。利西拉来的日剂量可以在10-20μg的范围内。
[0104]
待与本发明的药物配制品(a)一起施用的甘精胰岛素的典型日剂量为5至60u,以及对应剂量的利西拉来。例如,在包含100u/ml甘精胰岛素和50μg/ml利西拉来的配制品中,此剂量范围对应于2.5至30μg的利西拉来的日剂量。例如,在包含100u/ml甘精胰岛素和33μg/ml利西拉来的配制品中,此剂量范围对应于约1.6至20μg的利西拉来的日剂量。
[0105]
例如,可以施用10至60u的剂量。此剂量范围在治疗白种人2型糖尿病患者方面是合适的,但是此剂量的使用不限于此患者组。例如,在包含100u/ml甘精胰岛素和50μg/ml利西拉来的配制品中,此剂量范围对应于5至30μg的利西拉来的日剂量。例如,在包含100u/ml甘精胰岛素和33μg/ml利西拉来的配制品中,此剂量范围对应于约3.3至20μg的利西拉来的日剂量。
[0106]
例如,可以施用5至20u的剂量。此剂量范围在治疗亚洲2型糖尿病患者(例如日本或中国患者)方面是合适的,但是此剂量的使用不限于此患者组。例如,在包含100u/ml甘精胰岛素和100μg/ml利西拉来的配制品中,此剂量范围对应于5至20μg的利西拉来的日剂量。
[0107]
如本文所述,不足以充分控制2型糖尿病的预治疗还可以包括用吡格列酮治疗。在施用本发明的组合之前用于治疗的包含吡格列酮的配制品是技术人员已知的。
[0108]
在本发明中,吡格列酮的日剂量可以在15至45mg的范围内,例如30mg。
[0109]
患有根据本发明待治疗的2型糖尿病的2型糖尿病患者可以是肥胖的。如果体重指数为至少30kg/m2(白种人患者)或至少25kg/m2(亚洲患者,例如中国或日本患者),则患者可以被视为是肥胖的。
[0110]
在本发明中,肥胖的2型糖尿病患者可以具有至少30kg/m2、至少31kg
/
m2或至少32kg/m2的体重指数,其例如是白种人患者。如果患者是亚洲患者,例如中国或日本患者,则患者可以具有至少25kg
/
m2或至少26kg/m2的体重指数。在开始使用根据本发明的组合的疗
法之前,2型糖尿病患者可以是肥胖的。
[0111]
待治疗的患者年龄可以小于50岁。患者的年龄还可以为至少50岁。
[0112]
在本发明中,2型糖尿病患者可以具有在7%至9%的范围内、在7.5%至9.5%的范围内或在7.5%至10%的范围内的hba1c值。2型糖尿病患者可以具有至少7.5%、至少7.8%或至少8%的hba1c。这些hba1c值超过了血糖正常值,表明如果用抗糖尿病化合物治疗,2型糖尿病并未得到充分控制。
[0113]
在开始使用根据本发明的组合的疗法之前,当用以下治疗时,患者可以具有如本文所述的hba1c,例如至少7.5%、至少7.8%或至少8%:
[0114]
(a)单独的sglt2抑制剂,
[0115]
(b)如本文所述,sglt2抑制剂与口服抗糖尿病药组合,
[0116]
(c)sglt2抑制剂与二甲双胍组合,或
[0117]
(d)如本文所述,sglt2抑制剂与二甲双胍和glp-1受体激动剂组合。
[0118]
口服抗糖尿病治疗可以选自双胍类、噻唑烷二酮类、α-葡糖苷酶抑制剂、格列奈类和磺酰脲类。例如,如本文所述,双胍是二甲双胍。如本文所述,glp-1受体激动剂可以选自利拉鲁肽、利西拉来、艾塞那肽、艾塞那肽缓释配制品、阿必鲁肽和度拉鲁肽。
[0119]
根据本发明待治疗的2型糖尿病患者可以具有至少8mmol/l、至少8.5mmol/l或至少9mmol/l的空腹血浆葡萄糖浓度。这些血浆葡萄糖浓度超过了血糖正常浓度,表明如果用抗糖尿病化合物治疗,2型糖尿病并未得到充分控制。
[0120]
在开始使用根据本发明的组合的疗法之前,当用以下治疗时,患者可以具有至少8mmol/l、至少8.5mmol/l或至少9mmol/l的hba1c的空腹血浆葡萄糖:
[0121]
(a)单独的sglt2抑制剂,
[0122]
(b)如本文所述,sglt2抑制剂与口服抗糖尿病药组合,
[0123]
(c)sglt2抑制剂与二甲双胍组合,或
[0124]
(d)如本文所述,sglt2抑制剂与二甲双胍和glp-1受体激动剂组合。
[0125]
口服抗糖尿病治疗可以选自双胍类、噻唑烷二酮类、α-葡糖苷酶抑制剂、格列奈类和磺酰脲类。例如,双胍是二甲双胍。如本文所述,glp-1受体激动剂可以选自利拉鲁肽、利西拉来、艾塞那肽、艾塞那肽缓释配制品、阿必鲁肽和度拉鲁肽。
[0126]
例如,在根据本发明待治疗的患者中,在开始根据本发明的疗法之前,已经诊断出2型糖尿病至少1年或至少2年。
[0127]
如本文所用,“自我监测血浆葡萄糖(smpg)”可以是“4点自我监测血浆葡萄糖”或“7点自我监测血浆葡萄糖”。4点和7点自我监测血浆葡萄糖值是例如包括空腹和餐后状况的平均血浆葡萄糖浓度。
[0128]
例如,“4点自我监测血浆葡萄糖”是指每天四次测量血浆葡萄糖并由此计算平均血浆葡萄糖浓度。例如,在早餐前、早餐后、晚餐前和晚餐后进行4点自我监测血浆葡萄糖测量。
[0129]
例如,“7点自我监测血浆葡萄糖”是指每天七次测量血浆葡萄糖并由此计算平均血浆葡萄糖浓度。例如,在早餐前、早餐后、午餐前、午餐后、晚餐前、晚餐后和就寝时进行7点自我监测血浆葡萄糖测量。
[0130]
如本文所用,“空腹自我监测血浆葡萄糖(smpg)”是由患者在早餐前(例如在甘精
胰岛素或/和利西拉来注射和任选地服用二甲双胍之前)测量的。
[0131]
根据本发明待治疗的2型糖尿病患者可以具有至少11.1mmol/l的餐后2小时血浆葡萄糖浓度。这些血浆葡萄糖浓度超过了血糖正常浓度,表明如果用抗糖尿病化合物治疗,2型糖尿病并未得到充分控制。
[0132]“餐后”是糖尿病学领域的技术人员熟知的术语。术语“餐后”描述例如在实验条件下摄入膳食或/和暴露于葡萄糖后的阶段。在健康的人中,此阶段的特征在于血葡萄糖浓度的升高和随后的降低。餐后阶段通常在用餐或/和暴露于葡萄糖后最多2h结束(餐后2h血浆葡萄糖浓度)。
[0133]
餐后血浆葡萄糖的测定是熟知的(参见例如crapo等人,diabetes,1977,26(12):1178-1183)。
[0134]
如本文所公开,患者可以是亚洲患者,例如中国或日本患者。例如,亚洲患者(例如中国或日本患者)可以是肥胖的。亚洲患者(例如中国或日本患者)可以具有至少25kg
/
m2或至少26kg/m2的体重指数。在开始使用根据本发明的组合的疗法之前,亚洲患者(例如中国或日本患者)可以是肥胖的。
[0135]
当用于亚洲患者(例如中国或日本患者)时,本发明的配制品(a)可以包含浓度为100u/ml的甘精胰岛素和浓度为100μg/ml的利西拉来。
[0136]
在本发明的另一方面,在亚洲患者(例如中国或日本患者)中,单独用sglt2抑制剂和口服抗糖尿病药未充分控制待治疗的2型糖尿病。口服抗糖尿病药可以选自双胍类、噻唑烷二酮类、α-葡糖苷酶抑制剂、格列奈类和磺酰脲类。例如,双胍是二甲双胍。
[0137]
在本发明中,可以根据行销授权的条款,根据二甲双胍的公知施用方案来施用二甲双胍。技术人员知道合适的剂型。例如,二甲双胍可以每日一次、每日两次或每天三次施用。例如,将在开始如本文所公开的疗法前应用的二甲双胍剂量继续进行如本文所公开的本发明的治疗。
[0138]
在本发明中,二甲双胍可以口服施用。对于口服施用,二甲双胍可以被配制成固体剂型,如片剂或丸剂。二甲双胍可以与合适的药学上可接受的载体、佐剂或/和辅助物质一起配制。
[0139]
在本发明中,可以根据行销授权的条款,根据sglt-2抑制剂的公知施用方案来施用sglt-2抑制剂。技术人员知道合适的剂型。例如,sglt-2抑制剂可以每日一次、每日两次或每天三次施用。例如,将在开始如本文所公开的疗法前应用的sglt-2抑制剂剂量继续进行如本文所公开的本发明的治疗。
[0140]
在本发明中,sglt-2抑制剂可以口服施用。对于口服施用,sglt-2抑制剂可以被配制成固体剂型,如片剂或丸剂。sglt-2抑制剂可以与合适的药学上可接受的载体、佐剂或/和辅助物质一起配制。
[0141]
本发明的药物组合允许同时、分开或顺序施用(a)包含利西拉来或/和其药学上可接受的盐和甘精胰岛素或/和其药学上可接受的盐的药物配制品,和(b)sglt2抑制剂或/和其药学上可接受的盐,以及任选地(c)二甲双胍或/和其药学上可接受的盐。
[0142]
在本发明中,“分开施用”意味着根据本发明的药物组合可以在分开的药物配制品中施用,其中一种药物配制品(a)包含利西拉来或/和其药学上可接受的盐和甘精胰岛素或/和其药学上可接受的盐,并且第二药物配制品(b)包含sglt2抑制剂或/和其药学上可接
受的盐。任选地,可以施用包含二甲双胍或/和其药学上可接受的盐的第三药物配制品(c)。
[0143]
药物配制品可以同时或以任何顺序相继施用。因此,本发明涉及例如特别是用于治疗2型糖尿病患者的药物组合,所述药物组合包含通过同时、分开或顺序施用的包含利西拉来或/和其药学上可接受的盐和甘精胰岛素或/和其药学上可接受的盐的可注射药物配制品,和包含sglt2抑制剂或/和其药学上可接受的盐的口服药物配制品,以及任选地包含二甲双胍或/和其药学上可接受的盐的口服药物配制品。
[0144]
在本发明中,同时施用可以包括同时或在施用本发明的组合物所必需的时间间隔内(例如在5min、10min或15min内)施用本发明的配制品。
[0145]
在本发明中,顺序施用可以包括以至少15min、至少1h或至少2h的间隔或以至多3h的间隔施用本发明的配制品。如果任选地施用包含二甲双胍或/和其药学上可接受的盐的配制品,则可以独立地选择施用配制品之间的间隔。可以选择任何施用顺序。例如,施用可以从(a)包含利西拉来或/和其药学上可接受的盐和甘精胰岛素或/和其药学上可接受的盐的药物配制品开始,并且可以继续施用包含sglt2抑制剂或/和其药学上可接受的盐的配制品(b),反之亦然。如果任选地施用包含二甲双胍或/和其药学上可接受的盐的配制品(c),则此配制品可以在配制品(a)和(b)之前、之间或之后施用。例如,施用可以从包含二甲双胍或/和其药学上可接受的盐的配制品(c)开始,并且可以继续施用(a)包含利西拉来或/和其药学上可接受的盐和甘精胰岛素或/和其药学上可接受的盐的药物配制品,然后可以继续施用包含sglt2抑制剂或/和其药学上可接受的盐的配制品(b),反之亦然。
[0146]
如本文所公开,包含利西拉来或/和其药学上可接受的盐和甘精胰岛素或/和其药学上可接受的盐的配制品可以通过每天一次注射来施用。例如,如果包含sglt2抑制剂或/和其药学上可接受的盐的口服配制品每日多于一次(例如每日两次或每日三次)施用,则剂量之一可以与包含利西拉来或/和其药学上可接受的盐和甘精胰岛素或/和其药学上可接受的盐的配制品同时施用。例如,如果包含二甲双胍或/和其药学上可接受的盐的任选口服配制品每日多于一次(例如每日两次或每日三次)施用,则剂量之一可以与包含利西拉来或/和其药学上可接受的盐和甘精胰岛素或/和其药学上可接受的盐的配制品同时施用。
[0147]
在本发明中,如本文所述的药物组合可以在添加(add-on)疗法中施用。
[0148]
在本发明中,术语“添加”、“添加治疗”和“添加疗法”涉及根据本发明的治疗,其中继续用至少一种抗糖尿病药进行预治疗。如本文所公开,“添加”、“添加治疗”和“添加疗法”例如意味着在开始根据本发明的治疗之前施用的至少一种抗糖尿病药的剂量可以在本发明的治疗中继续。如果预治疗包括施用sglt2抑制剂,则在添加疗法中,继续用sglt2抑制剂进行治疗,例如以相同剂量进行。如果必要的话,可以修改在预治疗方案中施用的至少一种抗糖尿病药中的一种或多种的剂量。
[0149]
在本发明中,如本文所用的利西拉来包括其药学上可接受的盐。本领域技术人员知道利西拉来的合适的药学上可接受的盐。在本发明中采用的利西拉来的示例性的药学上可接受的盐是利西拉来的乙酸盐。
[0150]
在本发明中,如本文所用的甘精胰岛素包括其药学上可接受的盐。本领域技术人员知道甘精胰岛素的合适的药学上可接受的盐。
[0151]
如本文所述,配制品(a)可以作为液体组合物(例如作为水性配制品)提供。
[0152]
如本文所述,配制品(a)可以含有防腐剂(例如苯酚、间甲酚、对甲酚、对羟基苯甲
酸酯)、等渗剂(例如甘露醇、山梨糖醇、乳糖、右旋糖、海藻糖、氯化钠、甘油)、缓冲物质、盐、酸和碱以及其他赋形剂。在每种情况下,这些物质可以单独存在,或可替代地作为混合物存在。
[0153]
如本文所述,配制品(a)可以包含缓冲物质。缓冲物质(例如像磷酸盐、乙酸盐、柠檬酸盐、精氨酸、甘氨酰甘氨酸或tris(即2-氨基-2-羟甲基-1,3-丙二醇)缓冲剂和对应的盐)可以按5-250mm(例如10-100mm)的浓度存在。其他赋形剂尤其可以是盐或精氨酸。
[0154]
如本文所述,配制品(a)可以包含表面活性剂,例如非离子表面活性剂。例如,表面活性剂可以是药学上惯用的表面活性剂,例如像:多元醇如甘油、山梨糖醇等的部分和脂肪酸酯和醚((例如20和80)、)、或泊洛沙姆。表面活性剂以5-200μg/ml(例如5-120μg/ml或20-75μg/ml)的浓度存在于药物配制品(a)中。
[0155]
如本文所述,配制品(a)可以包含张度剂。合适的张度剂可以选自甘油、右旋糖、乳糖、山梨糖醇、甘露醇、葡萄糖、nacl、含钙或镁的化合物如cacl2。甘油、乳糖、山梨糖醇、甘露醇和葡萄糖的浓度可以在100
–
250mm的范围内。nacl的浓度可以高达150mm。
[0156]
示例性张度剂是甘油。甘油85%可以按10-30mg/ml(例如20mg/ml)的量存在。
[0157]
如本文所述,药物配制品(a)可以包含浓度选自0.3mg/ml至20mg/ml(例如1mg/ml至5mg/ml)的甲硫氨酸。甲硫氨酸的示例性浓度为3mg/ml。例如,液体组合物包含l-甲硫氨酸。
[0158]
如本文所述,药物配制品(a)可以包含合适的防腐剂。合适的防腐剂可以选自苯酚、间甲酚、苯甲醇和对羟基苯甲酸酯。示例性防腐剂是间甲酚。防腐剂(例如间甲酚)可以按至多3mg/ml(例如1-3mg/ml)的浓度存在。例如,浓度为2.7mg/ml。
[0159]
如本文所述,药物配制品(a)可以包含锌。锌浓度可以在0-1000μg/ml的范围内,例如20-400μg/ml锌。示例性锌浓度为30μg/ml。锌可以按氯化锌的形式存在,但是盐不限于氯化锌。
[0160]
如本文所述,药物配制品(a)的ph可以通过盐酸或/和氢氧化钠调节。ph可以在ph 1-6.8、ph 3.5-6.8或ph 3.5-4.5的范围内。例如,ph在4.0-4.5的范围内。示例性ph值为4.0和4.5。
[0161]
在本发明中,药物配制品(a)可以按足以诱导治疗效果的量施用于有需要的2型糖尿病患者。
[0162]
如本文所述,药物配制品(a)可以肠胃外施用。例如,如本文所述的药物配制品(a)可以通过注射(例如像通过皮下注射)施用。
[0163]
如本文所述的药物配制品(a)可以是可注射配制品。已知合适的注射装置,例如所谓的“笔”,其包括包含配制品的药筒和注射针。
[0164]
配制品(a)可以通过每天一次注射施用。例如,配制品(a)可以在早餐前(如早餐前约30min)施用。
[0165]
例如,1ml包含50μg/ml利西拉来的药物配制品(a)可以含有:
[0166][0167]
此配制品适合于皮下注射。在此配制品中,氯化锌的量反映了药物组合物中的总量,包括来自药物物质甘精胰岛素的锌(以氯化锌计算)和在药物产品制造期间引入的氯化锌。
[0168]
例如,1ml包含33μg/ml利西拉来的药物配制品(a)可以含有:
[0169][0170]
此配制品适合于皮下注射。在此配制品中,氯化锌的量反映了药物组合物中的总量,包括来自药物物质甘精胰岛素的锌(以氯化锌计算)和在药物产品制造期间引入的氯化锌。
[0171]
包含100μg/ml利西拉来和100u/ml甘精胰岛素的药物配制品(a)含有的赋形剂的浓度可以与包含50μg/ml利西拉来和100u/ml甘精胰岛素或33μg/ml利西拉来和100u/ml甘精胰岛素的配制品相同。
[0172]
本发明的又另一方面涉及药物组合在制造用于治疗2型糖尿病的药物中的用途,所述药物组合包含
[0173]
(a)药物配制品,所述药物配制品包含
[0174]
(i)利西拉来或/和其药学上可接受的盐,和
[0175]
(ii)甘精胰岛素或/和其药学上可接受的盐,
[0176]
以及
[0177]
(b)sglt2抑制剂或/和其药学上可接受的盐。患者可以是如本文所述的任何患者。药物配制品(a)可以是如本文所述的任何药物配制品。sglt2抑制剂(b)可以是如本文所述的任何sglt2抑制剂。
[0178]
本发明的又另一方面涉及一种治疗有需要的2型糖尿病患者的方法,所述方法包括施用药物组合,所述药物组合包含
[0179]
(a)药物配制品,所述药物配制品包含
[0180]
(i)利西拉来或/和其药学上可接受的盐,和
[0181]
(ii)甘精胰岛素或/和其药学上可接受的盐,
[0182]
以及
[0183]
(b)sglt2抑制剂或/和其药学上可接受的盐。
[0184]
患者可以是如本文所述的任何患者。药物配制品(a)可以是如本文所述的任何药物配制品。sglt2抑制剂(b)可以是如本文所述的任何sglt2抑制剂。
[0185]
以下方面也是本发明的主题
[0186]
项1.一种药物组合,所述药物组合包含
[0187]
(a)药物配制品,所述药物配制品包含
[0188]
(i)利西拉来或/和其药学上可接受的盐,和
[0189]
(ii)甘精胰岛素或/和其药学上可接受的盐,
[0190]
以及
[0191]
(b)sglt2抑制剂或/和其药学上可接受的盐。
[0192]
项2.根据项1所述的药物组合,所述药物组合还包含(c)二甲双胍或/和其药学上可接受的盐。
[0193]
项3.根据项1或2所述的药物组合,其中所述sglt2抑制剂选自依帕列净、坎格列净、达格列净和埃格列净。
[0194]
项4.根据项1至3中任一项所述的药物组合,其中所述sglt2抑制剂选自依帕列净、坎格列净和达格列净。
[0195]
项5.根据前述项中任一项所述的药物组合,其中所述药物配制品(a)包含浓度为100至500u/ml的甘精胰岛素。
[0196]
项6.根据前述项中任一项所述的药物组合,其中所述药物配制品(a)包含浓度为100u/ml的甘精胰岛素。
[0197]
项7.根据前述项中任一项所述的药物组合,其中所述药物配制品(a)包含浓度为20至150μg/ml的利西拉来。
[0198]
项8.根据前述项中任一项所述的药物组合,其中所述药物配制品(a)包含浓度为33μg/ml、50μg/ml或100μg/ml的利西拉来。
[0199]
项9.根据项1至8中任一项所述的药物组合,其中所述药物配制品包含浓度为33μg/ml或50μg/ml的利西拉来。
[0200]
项10.根据项1至8中任一项所述的药物组合,其中所述药物配制品包含浓度为100μg/ml的利西拉来。
[0201]
项11.根据项1至8中任一项所述的药物组合,其中所述药物配制品(a)包含浓度为100u/ml的甘精胰岛素和浓度为33μg/ml、50μg/ml或100μg/ml的利西拉来。
[0202]
项12.根据项1至8和11中任一项所述的药物组合,其中所述药物配制品包含浓度为100u/ml的甘精胰岛素和浓度为33μg/ml或50μg/ml的利西拉来。
[0203]
项13.根据项1至8和11中任一项所述的药物组合,其中所述药物配制品包含浓度为100u/ml的甘精胰岛素和浓度为100μg/ml的利西拉来。
[0204]
项14.根据前述项中任一项所述的药物组合,用于治疗2型糖尿病患者。
[0205]
项15.根据项14所述的用于所述用途的药物组合,其中所述患者是人类患者。
[0206]
项16.根据项14或15所述的用于所述用途的药物组合,其中所述患者是亚洲患者。
[0207]
项17.根据项14至16中任一项所述的用于所述用途的药物组合,其中所述患者是中国或日本患者。
[0208]
项18.根据项14或15所述的用于所述用途的药物组合,其中所述患者是白种人患者。
[0209]
项19.根据项14-18中任一项所述的用于所述用途的药物组合,其中单独用所述sglt2抑制剂未充分控制所述待治疗的2型糖尿病。
[0210]
项20.根据项14-18中任一项所述的用于所述用途的药物组合,其中用选自依帕列净、坎格列净、达格列净和埃格列净或选自依帕列净、坎格列净和达格列净的sglt2抑制剂未充分控制所述待治疗的2型糖尿病。
[0211]
项21.根据项14-18中任一项所述的用于所述用途的药物组合,其中单独用sglt2抑制剂和口服抗糖尿病药未充分控制所述待治疗的2型糖尿病。
[0212]
项22.根据项21所述的用于所述用途的药物组合,其中单独用以下未充分控制所述待治疗的2型糖尿病
[0213]
(a)选自依帕列净、坎格列净、达格列净和埃格列净或选自依帕列净、坎格列净和达格列净的sglt2抑制剂,以及
[0214]
(b)选自双胍类、噻唑烷二酮类、α-葡糖苷酶抑制剂、格列奈类和磺酰脲类的口服抗糖尿病药,其中所述双胍可以是二甲双胍。
[0215]
项23.根据项14-18中任一项所述的用于所述用途的药物组合,其中单独用所述sglt2抑制剂和二甲双胍或单独用sglt2抑制剂和glp-1受体激动剂未充分控制所述待治疗的2型糖尿病。
[0216]
项24.根据项23所述的用于所述用途的药物组合,其中单独用以下未充分控制所述待治疗的2型糖尿病
[0217]
(a)(i)选自依帕列净、坎格列净、达格列净和埃格列净或选自依帕列净、坎格列净和达格列净的sglt2抑制剂,和(ii)二甲双胍,或者
[0218]
(b)(i)选自依帕列净、坎格列净、达格列净和埃格列净或选自依帕列净、坎格列净和达格列净的sglt2抑制剂,和(ii)选自利拉鲁肽、利西拉来、艾塞那肽、阿必鲁肽和度拉鲁肽的glp-1受体激动剂。
[0219]
项25.根据项14-18中任一项所述的用于所述用途的药物组合,其中单独用所述
sglt2抑制剂、二甲双胍和glp-1受体激动剂未充分控制所述待治疗的2型糖尿病。
[0220]
项26.根据项25所述的用于所述用途的药物组合,其中单独用以下未充分控制所述待治疗的2型糖尿病
[0221]
(a)选自依帕列净、坎格列净、达格列净和埃格列净或选自依帕列净、坎格列净和达格列净的sglt2抑制剂,
[0222]
(b)选自双胍类、噻唑烷二酮类、α-葡糖苷酶抑制剂、格列奈类和磺酰脲类的口服抗糖尿病药,其中所述双胍可以是二甲双胍,以及
[0223]
(c)选自利拉鲁肽、利西拉来、艾塞那肽、阿必鲁肽和度拉鲁肽的glp-1受体激动剂。
[0224]
项27.根据项23至26中任一项所述的用于所述用途的药物组合,其中所述glp-1受体激动剂选自利西拉来、艾塞那肽、度拉鲁肽和利拉鲁肽。
[0225]
项28.根据项14-27中任一项所述的用于所述用途的药物组合,其中所述待治疗的患者是肥胖的。
[0226]
项29.根据项14-28中任一项所述的用于所述用途的药物组合,其中所述患者具有至少30kg/m2、至少31kg/m2或至少32kg/m2的体重指数(bmi)。
[0227]
项30.根据项29所述的用于所述用途的药物组合,其中所述患者是白种人患者。
[0228]
项31.根据项14至28中任一项所述的用于所述用途的药物组合,其中所述患者具有至少25kg/m2或至少26kg/m2的体重指数(bmi)。
[0229]
项32.根据项31所述的用于所述用途的药物组合,其中所述患者是亚洲患者,例如中国或日本患者。
[0230]
项33.根据项14至32中任一项所述的用于所述用途的药物组合,其中在开始使用根据项1至8中任一项所述的组合的疗法之前,所述待治疗的患者具有至少7.5%的hba1c。
[0231]
项34.根据项14至33中任一项所述的用于所述用途的药物组合,其中在开始使用根据项1至8中任一项所述的组合的疗法之前,所述待治疗的患者具有至少8mmol/l的空腹血浆葡萄糖浓度。
[0232]
本发明通过以下实施例进一步说明。
[0233]
图1描述了图形研究设计:
[0234]
*另外的逐步调整电话-仅用于frc组
[0235]
**甘精胰岛素/利西拉来固定比率组合(frc)治疗将用peachpen开始。待施用的初始日剂量将为10u:这对应于根据peachpen中使用的2/uμg固定比率,甘精胰岛素10u和利西拉来5μg的初始相关剂量。之后,将在整个研究过程中单独逐步调整剂量,以达到并维持测试smpg:80-100mg/dl(4.4-6-6mmol/l),从而避免低血糖。
[0236]
对于随机分配到frc治疗的患者,在访视3时中止利拉鲁肽、艾塞那肽、阿必鲁肽或度拉鲁肽。被指定接受frc治疗的在进入研究时用每周一次glp-1ra治疗的任何患者直到在最后一次剂量的glp-1ra后至少1周才应当接受其第一次剂量。
[0237]
图2描述了在26周随机治疗期期间按访视的平均hba1c(%)图-mitt群体:
[0238]
s=筛选(第-2周),b=基线
[0239]
frc=固定比率组合,glp-1ra=glp-1受体激动剂
[0240]
所述图包括在26周随机治疗期期间获得的所有计划的测量值,包括在imp中止或
引入救援用药后获得的那些测量值。
[0241]
图3描述了在26周随机治疗期期间按访视的平均空腹血浆葡萄糖(mmol/l[mg/dl])图-mitt群体:
[0242]
s=筛选(第-2周),b=基线
[0243]
frc=固定比率组合,glp-1ra=glp-1受体激动剂
[0244]
所述分析包括在26周随机治疗期期间获得的所有计划的测量值,包括在imp中止或引入救援用药后获得的那些测量值。
[0245]
图4描述了在接受治疗期期间在基线和第26周时的平均7点smpg(mmol/l[mg/dl])图-mitt群体:
[0246]
smpg=自我监测血浆葡萄糖。
[0247]
frc=固定比率组合,glp-1ra=glp-1受体激动剂
[0248]
所述分析包括在26周随机治疗期期间获得的所有计划的测量值,包括在imp中止或引入救援疗法后获得的那些测量值。
[0249]
实施例1
[0250]
一项为期26周的随机、开放标签、活性对照、平行组研究,其评估了甘精胰岛素/利西拉来固定比率组合在glp-1受体激动剂和二甲双胍(单独或与吡格列酮和/或sglt2抑制剂一起)控制不充分的2型糖尿病成人中的功效和安全性,随后是固定比率组合单组26周扩展期(efc13794)
[0251]
1 简介
[0252]
[0253]
[0254][0255]
2 图形研究设计
[0256]
图形研究设计描述于图1中。
[0257]
3 结果总结
[0258]
[0259]
[0260][0261]
4 结果
[0262]
4.1 研究患者
[0263]
4.1.1 患者责任
[0264]
表1-分析群体
[0265][0266]
pk=药代动力学注意:安全性群体患者根据实际接受的治疗(如所治疗)列表。
[0267]
功效群体患者根据他们的随机治疗(如所随机分配)制表。
[0268]
没有患者被随机分组并接受另一种研究治疗
[0269]
在研究期间没有患者改变其治疗
[0270]
4.1.2 研究设置
[0271]
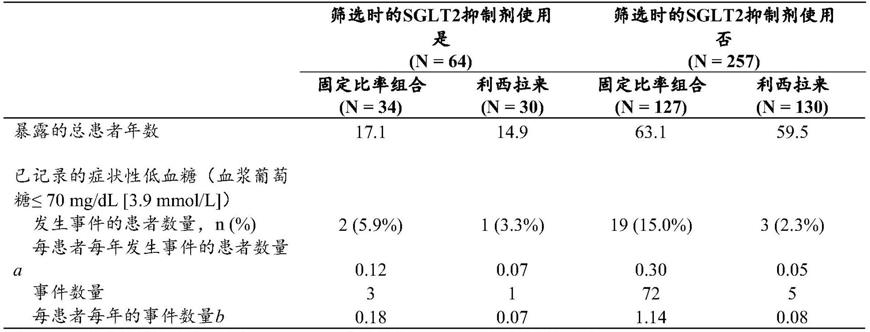
表2
–
26周随机治疗期的患者设置
–
随机群体
[0272]
[0273][0274]
注意:百分比是使用随机患者的数量作为分母来计算的。
[0275]
*患者376000200001是一名65岁女性,有肥胖、高血压、高脂血症、持续性抑郁症和糖尿病并发症(神经病变和肾病)史,在筛选时使用二甲双胍(1.7g/天)和诺和力(victoza)(1.8mg/天)治疗。基线hba1c为7.1%。frc使用了91天,并且剂量向上逐步调整至60u,其中与基线相比,空腹smpg无改善。没有发现对葡萄糖控制不足的合理解释。研究者决定过早并永久中止frc治疗,并重新开始先前的glp-1ra治疗。
[0276]
4.1.3 人口统计学和基线特征
[0277]
表3-筛选或基线时的人口统计学和患者特征-随机群体
[0278]
[0279][0280]
bmi=体重指数。
[0281]a包括具有多于一个种族、未知或未报告的患者
[0282]
表4-筛选或基线时的疾病特征-随机群体
[0283]
[0284]
[0285]
[0286][0287]
sglt2=钠葡萄糖协同转运蛋白2,egfr=估计的肾小球滤过率。
[0288]
糖尿病病程(年)=(知情同意日期-糖尿病诊断日期+1)/365.25
[0289]
2型糖尿病发作的年龄(岁)=(糖尿病诊断年份-出生年份)
[0290]
egfr是使用4个变量的肾脏病膳食改良试验(modification of diet in renal disease)公式得出的。尿白蛋白/肌酐比值以mg/g呈现,并且换算成标准国际单位mg/mmol的换算系数为0.1130。
[0291]
4.2 功效
[0292]
4.2.1 主要功效终点
[0293]
表5-使用mmrm的hba1c(%)从基线到第26周的平均变化-mitt群体
[0294]
[0295]a重复测量混合效应模型(mmrm),包括治疗组(固定比率组合和glp-1受体激动剂)、访视1(第-2周)时hba1c的随机分层(《8.0%,≥8.0%)、筛选时glp-1受体激动剂亚型的随机分层(每日一次/两次配制品,每周一次配制品)、计划访视、治疗-访视交互作用和世界地区作为固定效应,以及基线hba1c值-访视交互作用作为协变量。
[0296]
所述分析包括在26周随机治疗期期间获得的所有计划的测量值,包括在imp中止或引入救援用药后获得的那些测量值。
[0297]
包括在基线时和基线后进行测量的患者。
[0298]
表6-按基线因素的hba1c(%)从基线到第26周的平均变化
–
mitt群体
[0299]
[0300][0301]
bmi=体重指数。sglt2=钠葡萄糖协同转运蛋白2。
[0302]a重复测量混合效应模型(mmrm),包括治疗组(固定比率组合和glp-1受体激动剂)、访视1(第-2周)时hba1c的随机分层(《8.0%,≥8.0%)、筛选时glp-1受体激动剂亚型的随机分层(每日一次/两次配制品,每周一次配制品)、
[0303]
计划访视、亚组因素、按访视治疗、按亚组治疗因素、按亚组访视因素、按亚组按访视治疗因素和世界地区作为固定效应,以及基线hba1c值-访视交互作用作为协变量。
[0304]b固定比率组合与glp-1受体激动剂之间的ls均值的差异。
[0305]
所述分析包括在26周随机治疗期期间获得的所有计划的测量值,包括在imp中止或引入救援疗法后获得的那些测量值。
[0306]
包括在基线时和基线后进行测量的患者。
[0307]
为每个治疗组中具有≥5名患者的类别提供了ls均值和ls均值的差异。
[0308]
4.2.2 次要功效终点
[0309]
表7-在第26周时hba1c值《=6.5%或《7%的患者数量(%)-mitt群体
[0310][0311]
glp-1ra=glp-1受体激动剂
[0312]a使用cochran-mantel-haenszel权重对来自每个层(访视1(第-2周)时hba1c的随机分层[《8.0或≥8.0%],筛选时glp-1受体激动剂亚型的随机分层(每日一次/两次配制品,每周一次配制品))的治疗组(固定比率组合相比于glp-1受体激动剂)之间的比例差异进行加权平均。
[0313]
比例差异=实现hba1c值≤6.5%或《7%的患者比例的差异。
[0314]
使用了在第26周时的所有测量值,包括在imp中止或引入救援疗法后获得的那些测量值。如果在第26周时根本没有评估,则患者被视为无反应者。
[0315]
表8-使用mmrm的空腹血浆葡萄糖(mmol/l)从基线到第26周的平均变化-mitt群体
[0316][0317][0318]a重复测量混合效应模型(mmrm),包括治疗组(固定比率组合和glp-1受体激动剂)、访视1(第-2周)时hba1c的随机分层(《8.0%,≥8.0%)、筛选时glp-1受体激动剂亚型的随机分层(每日一次/两次配制品,每周一次配制品)、计划访视、治疗-访视交互作用、世界地区作为固定效应,以及基线空腹血浆葡萄糖值-访视交互作用作为协变量。
[0319]
所述分析包括在26周随机治疗期期间获得的所有计划的测量值,包括在imp中止或引入救援用药后获得的那些测量值。
[0320]
包括在基线时和基线后进行测量的患者。
[0321]
表9-使用mmrm的平均7点smpg(mmol/l)从基线到第26周的平均变化-mitt群体
[0322]
[0323]
smpg=自我监测血浆葡萄糖。
[0324]a重复测量混合效应模型(mmrm),包括治疗组(固定比率组合和glp-1受体激动剂)、访视1(第-2周)时hba1c的随机分层(《8.0%,≥8.0%)、筛选时glp-1受体激动剂亚型的随机分层(每日一次/两次配制品,每周一次配制品)、计划访视、治疗-访视交互作用和世界地区作为固定效应,以及基线平均smpg值-访视交互作用作为协变量。
[0325]
所述分析包括在26周随机治疗期期间获得的所有计划的测量值,包括在imp中止或引入救援用药后获得的那些测量值。
[0326]
包括在基线时和基线后进行测量的患者。
[0327]
表10-使用ancova的在标准化膳食测试期间餐后2小时血浆葡萄糖(mmol/l)从基线到第26周的平均变化-mitt群体
[0328][0329]
locf=末次观察推进法,glp-1ra=glp-1受体激动剂。
[0330]a协方差分析(ancova)模型,包括治疗组(固定比率组合和glp-1受体激动剂)、访视1(第
[0331]-2周)时hba1c的随机分层(《8.0%,≥8.0%)、筛选时glp-1受体激动剂亚型的随机分层(每日一次/两次配制品,每周一次配制品)和世界地区作为固定效应,以及基线餐后2小时血浆葡萄糖值作为协变量。
[0332]
所述分析包括在26周随机治疗期期间收集的测量值,包括在imp中止或引入救援疗法后获得的那些测量值。
[0333]
包括具有基线和第26周(locf)测量值两者的患者。
[0334]
表11-使用ancova的在标准化膳食测试期间2小时血浆葡萄糖偏移(mmol/l)从基线到第26周的平均变化-mitt群体
[0335][0336][0337]
locf=末次观察推进法,glp-1ra=glp-1受体激动剂。
[0338]a协方差分析(ancova)模型,包括治疗组(固定比率组合和glp-1受体激动剂)、访视1(第-2周)时hba1c的随机分层(《8.0%,≥8.0%)、筛选时glp-1受体激动剂亚型的随机分层(每日一次/两次配制品,每周一次配制品)和世界地区作为固定效应,以及基线2小时血浆葡萄糖偏移值作为协变量。
[0339]
所述分析包括在26周随机治疗期期间收集的测量值,包括在imp中止或引入救援疗法后获得的那些测量值。
[0340]
包括具有基线和第26周(locf)测量值两者的患者。
[0341]
表12-使用mmrm的体重(kg)从基线到第26周的平均变化-mitt群体
[0342][0343]
glp-1ra=glp-1受体激动剂。
[0344]a重复测量混合效应模型(mmrm),包括治疗组(固定比率组合和glp-1受体激动剂)、访视1(第-2周)时hba1c的随机分层(《8.0%,≥8.0%)、筛选时glp-1受体激动剂亚型的随机分层(每日一次/两次配制品,每周一次配制品)、计划访视、治疗-访视交互作用和世界地区作为固定效应,以及基线体重-访视交互作用作为协变量。
[0345]
所述分析包括在26周随机治疗期期间收集的测量值,包括在imp中止或引入救援疗法后获得的那些测量值。
[0346]
包括在基线时和基线后进行测量的患者。
[0347]
表13
–
固定比率组合组在26周随机治疗期期间按访视的每日甘精胰岛素剂量(u)
–
mitt群体
[0348][0349]
患者840000900005因不能耐受较高剂量而在frc 5u停留直到第26周。患者724000200005、724001200003和840007800005错误地使用20u而不是10u开始治疗。患者840006500006在访视21(第12周)那天错过了一次注射,并且记录的剂量为零。
[0350]
表14
–
固定比率组合组在26周随机治疗期期间按访视的每日利西拉来剂量(ug)
–
mitt群体
[0351][0352]
*患者840006300003使用了peach(2u:1μg)笔施用48u的frc日剂量,并且因此在第8周时接受了24μg利西拉来。已经报告了dre。
[0353]
4.3 安全性
[0354]
低血糖事件被记录在特定的低血糖事件表格上,而不是ae crf页面上,并且因此未包括在teae总结中。它们与teae分开总结。如果满足sae标准,则应使用适当的ae crf页面将事件报告为sae,并且因此所述事件包括在teae总结中。
[0355]
4.3.1 治疗期间出现的不良事件
[0356]
表15-不良事件概况的综述:在26周随机治疗期期间的治疗期间出现的不良事件-安全性群体
[0357][0358][0359]
teae:治疗期间出现的不良事件
[0360]
n(%)=发生至少一例teae的患者的数量和百分比
[0361]
表16-在26周随机治疗期期间按主要soc和pt的经历常见的teae(在任何治疗组中pt》=2%)的患者数量(%)-安全性群体
[0362][0363]
teae:治疗期间出现的不良事件,soc:系统器官分类,pt:首选项。
[0364]
meddra版本:21.0。
[0365]
n(%)=发生至少一例teae的患者的数量和百分比。
[0366]
注意:表格按soc国际商定的顺序排序,而pt按字母顺序排序。
[0367]
仅呈现出在至少一个组中具有至少一个pt≥2%的soc。
[0368]
4.3.2 死亡,严重治疗期间出现的不良事件
[0369]
在26周随机治疗期期间没有患者经历任何导致死亡的teae。
[0370]
表17-在26周随机治疗期期间按主要soc和pt呈现的经历严重teae的患者数量(%)-安全性群体
[0371]
[0372][0373]
teae:治疗期间出现的不良事件,soc:系统器官分类,pt:首选项。
[0374]
meddra版本:21.0。
[0375]
n(%)=发生至少一例严重teae的患者的数量和百分比。
[0376]
注意:表格按soc国际商定的顺序排序,而pt按字母顺序排序。
[0377]
4.3.3 导致停药的不良事件
[0378]
表18-在26周随机治疗期期间按主要soc和pt的经历导致永久性治疗中止的teae的患者数量(%)-安全性群体
[0379][0380]
teae:治疗期间出现的不良事件,soc:系统器官分类,pt:首选项。
[0381]
meddra版本:21.0。
[0382]
n(%)=发生至少一例导致永久性治疗中止的teae的患者的数量和百分比。
[0383]
注意:表格按soc国际商定的顺序排序,而pt按字母顺序排序。
[0384]
4.3.4 其他显著的不良事件(包括aesi、实验室检查)
[0385]
在治疗的第125天,确认了一名41岁的女性frc患者的妊娠。没有妊娠、分娩(labor或delivery)的并发症的报告,并且所述患者生了健康的婴儿。没有发现先天性异常。
[0386]
在26周随机治疗期中,没有报告降钙素增加(≥20pg/ml)的teae。
[0387]
表19-在26周接受治疗期期间经历注射部位反应的患者数量(%)-安全性群体
[0388][0389][0390]
arac=过敏反应评估委员会,pt=首选项。
[0391]
26周接受治疗期(on-treatment period)对于没有资格进入扩展期的患者定义为从首次注射研究用药物(imp)直到最后一次注射imp后3天,或者对于有资格进入扩展期的患者定义为直到访视28/第26周(或第183天,如果错过访视28/第26周的话)的时间,无论救援疗法的引入如何。
[0392]
表20-在26周接受治疗期期间发生由arac裁定为过敏反应的事件的患者数量(%)-安全性群体
[0393][0394]
arac=过敏反应评估委员会,imp=研究用药物。
[0395]
26周接受治疗期对于没有资格进入扩展期的患者定义为从首次注射研究用药物(imp)直到最后一次注射imp后3天,或者对于有资格进入扩展期的患者定义为直到访视28/第26周(或第183天,如果错过访视28/第26周的话)的时间,无论救援疗法的引入如何。
[0396]
表21-在26周接受治疗期期间发生由psac积极裁定的胰腺事件的患者数量(%)-安全性群体
[0397][0398][0399]
psac=胰腺安全性评估委员会。
[0400]
26周接受治疗期对于没有资格进入扩展期的患者定义为从首次注射研究用药物(imp)直到最后一次注射imp后3天,或者对于有资格进入扩展期的患者定义为直到访视28/第26周(或第183天,如果错过访视28/第26周的话)的时间,无论救援疗法的引入如何。
[0401]
表22-在26周接受治疗期期间发生设备相关事件问卷中报告的事件的患者数量(%)-安全性群体
[0402][0403]
临床事件=在设备相关问卷中收集的症状性低血糖事件、高血糖不良事件或其他不良事件。
[0404]
26周接受治疗期对于没有资格进入扩展期的患者定义为从首次注射研究用药物(imp)直到最后一次注射imp后3天,或者对于有资格进入扩展期的患者定义为直到访视28/第26周(或第183天,如果错过访视28/第26周的话)的时间,无论救援疗法的引入如何。
[0405]
4.3.5 其他安全性观察-低血糖
[0406]
表23-在26周接受治疗期期间在专用ecrf页面上记录并符合方案定义的症状性低血糖总结-安全性群体
[0407][0408][0409]a:对于每日配制品计算为发生事件的患者数量除以按患者年数计的总暴露量+1天,并且对于每周配制品计算为发生事件的患者数量除以按患者年数计的总暴露量+7天。
[0410]b:对于每日配制品计算为事件的数量除以按患者年数计的总暴露量+1天,并且对于每周配制品计算为事件的数量除以按患者年数计的总暴露量+7天。
[0411]
症状性低血糖=在专用ecrf上记录并且符合严重或已记录的或可能的症状性低血糖的方案定义的症状性低血糖。
[0412]
26周接受治疗期对于没有资格进入扩展期的患者定义为从首次注射研究用药物(imp)直到最后一次注射每日imp后1天(最后一次注射每周imp后7天),或者对于有资格进入扩展期的患者定义为直到访视28/第26周(或第183天,如果错过访视28/第26周的话)的
时间,无论救援疗法的引入如何。
[0413]
frc组中的一名69岁患者经历了严重低血糖事件并伴有意识丧失,其被报告为sae(pt:低血糖性无意识)。所述事件发生在早上8:30am,在frc注射后约40分钟和最后一餐后10小时。根据一名帮助他躺在床上并给他糖的妇女说,患者出现头晕、意识模糊和3分钟的意识丧失。血葡萄糖值在08:51为42mg/dl,并且在09:16为70mg/dl。患者于09:45完全康复。研究者认为所述事件与治疗相关,并且因此相应降低了frc剂量
[0414]
实施例2
[0415]
一项随机、26周、活性对照、开放标签、2个治疗组、平行组和多中心研究,其比较了在口服抗糖尿病药物的基础上甘精胰岛素/利西拉来固定比率组合(lixilan)与利西拉来在口服抗糖尿病药物控制不充分的日本2型糖尿病患者中的功效和安全性,其安全性扩展期为26周(efc14112)
[0416]
[0417]
[0418]
[0419]
[0420]
[0421]
[0422][0423]
实施例3
[0424]
一项随机、26周、活性对照、开放标签、2个治疗组、平行组和多中心研究,其比较了在口服抗糖尿病药物的基础上甘精胰岛素/利西拉来固定比率组合(lixilan)与甘精胰岛素在口服抗糖尿病药物控制不充分的日本2型糖尿病患者中的功效和安全性(efc14114)
[0425]
[0426]
[0427]
[0428]
[0429]
[0430][0431]
实施例4
[0432]
甘精胰岛素和利西拉来的固定剂量比配制品与sglt2i的同时使用
–
实施例1的亚组分析
[0433]
甘精胰岛素和利西拉来的固定剂量比组合(frc)与sglt2抑制剂(sglt2i)的同时使用得到了作为实施例1主题的患者组的亚组分析的支持(研究efc13794)。在这项研究中,26名患者(10.1%)同时接受了frc、二甲双胍和sglt2i。
[0434]
如实施例1所述,frc在单一配制品中提供。
[0435]
在两个治疗组中均观察到功效结果的改善(糖化血红蛋白[hba1c]、空腹血浆葡萄
糖[fpg]和餐后2小时血浆葡萄糖[ppg]从基线到第26周的变化)(表3、表4和表5)。
[0436]
与未接受sglt2抑制剂的患者组相比,在接受sglt2抑制剂的患者中,固定比率配制品的效果大于比较治疗。
[0437]
在接受sglt2抑制剂的患者中,在26周后,鉴于活性比较剂(glp-1ra),hba1c的改善为0.88%,与之相比在未接受sglt2抑制剂的患者中为0.61%(表3)。
[0438]
在接受sglt2抑制剂的患者中,在26周后,鉴于活性比较剂(glp-1ra),空腹血浆葡萄糖的改善为2.06mmol/l,与之相比在未接受sglt2抑制剂的患者中为1.64mmol/l(表4)。
[0439]
在接受sglt2抑制剂的患者中,在26周后,鉴于活性比较剂(glp-1ra),餐后2小时葡萄糖的改善为3.26mmol/l,与之相比在未接受sglt2抑制剂的患者中为2.81mmol/l(表5)。
[0440]
安全性的综述并未揭示sglt2i使用者与非使用者相比的相关差异。在frc组中,没有sglt2i使用者因不良事件而中止治疗,并且没有患者报告体重增加的不良事件。在sglt2i使用者中,任一治疗组中均无患者报告恶心或腹泻,而在frc组中仅1名患者报告了呕吐(表6、表7)。
[0441]
相比于非使用者,在使用sglt2i的frc组中,已记录的症状性低血糖(血浆葡萄糖≤3.9mmol/l[≤70mg/dl])的报告频率更低(对于sglt2i使用者为每患者每年0.72例事件相比于非使用者为1.62)(表8)。
[0442]
表1-按筛选时sglt2抑制剂使用的在筛选或基线时的人口统计学和患者特征-随机群体(efc13794)
[0443]
[0444][0445]
bmi=体重指数,sglt2=钠葡萄糖协同转运蛋白2
[0446]
a 包括具有多于一个种族、未知或未报告的患者
[0447]
表2-按筛选时sglt2抑制剂使用的在筛选或基线时的疾病特征-随机群体(efc13794)
[0448]
[0449]
[0450]
[0451][0452]
sglt2=钠葡萄糖协同转运蛋白2,egfr=估计的肾小球滤过率。
[0453]
糖尿病病程(年)=(知情同意日期-糖尿病诊断日期+1)/365.25
[0454]
2型糖尿病发作的年龄(岁)=(糖尿病诊断年份-出生年份)
[0455]
egfr是使用4个变量的肾脏病膳食改良试验公式得出的。
[0456]
尿白蛋白/肌酐比值以mg/g呈现,并且换算成标准国际单位mg/mmol的换算系数为0.1130。
[0457]
表3-按筛选时sglt2抑制剂使用的hba1c(%)从基线到第26周的平均变化
–
mitt群体(efc13794)
[0458][0459]
sglt2=钠葡萄糖协同转运蛋白2。
[0460]
a 重复测量混合效应模型(mmrm),包括治疗组(固定比率组合和glp-1受体激动剂)、访视1(第-2周)时hba1c的随机分层(《8.0%,≥8.0%)、筛选时glp-1受体激动剂亚型
的随机分层(每日一次/两次配制品,每周一次配制品)、计划访视、亚组因素、按访视治疗、按亚组治疗因素、按亚组访视因素、按亚组按访视治疗因素和世界地区作为固定效应,以及基线hba1c值-访视交互作用作为协变量。
[0461]
固定比率组合与glp-1受体激动剂之间的ls均值的差异。
[0462]
所述分析包括在26周随机治疗期期间获得的所有计划的测量值,包括在imp中止或引入救援疗法后获得的那些测量值。
[0463]
包括在基线时和基线后进行测量的患者。
[0464]
为每个治疗组中具有≥5名患者的类别提供了ls均值和ls均值的差异。
[0465]
表4-按筛选时sglt2抑制剂使用的空腹血浆葡萄糖(mmol/l)从基线到第26周的平均变化
–
mitt群体(efc13794)
[0466][0467]
sglt2=钠葡萄糖协同转运蛋白2。
[0468]
a 重复测量混合效应模型(mmrm),包括治疗组(固定比率组合和glp-1受体激动剂)、访视1(第-2周)时hba1c的随机分层(《8.0%,≥8.0%)、筛选时glp-1受体激动剂亚型的随机分层(每日一次/两次配制品,每周一次配制品)、计划访视、亚组因素、按访视治疗、按亚组治疗因素、按亚组访视因素、按亚组按访视治疗因素和世界地区作为固定效应,以及基线空腹血浆葡萄糖值-访视交互作用作为协变量。
[0469]
固定比率组合与glp-1受体激动剂之间的ls均值的差异。
[0470]
所述分析包括在26周随机治疗期期间获得的所有计划的测量值,包括在imp中止或引入救援疗法后获得的那些测量值。
[0471]
包括在基线时和基线后进行测量的患者。
[0472]
为每个治疗组中具有≥5名患者的类别提供了ls均值和ls均值的差异。
[0473]
表5-按筛选时sglt2抑制剂使用的在标准化膳食测试期间餐后2小时血浆葡萄糖(mmol/l)从基线到第26周的平均变化
–
mitt群体(efc13794)
[0474][0475]
sglt2=钠葡萄糖协同转运蛋白2。
[0476]
a 协方差分析(ancova)模型,包括治疗组(固定比率组合和glp-1受体激动剂)、访视1(第-2周)时
[0477]
hba1c的随机分层(《8.0%,≥8.0%)、筛选时glp-1受体激动剂亚型的随机分层(每日一次/两次配制品,每周一次配制品)、亚组因素、按亚组治疗因素和世界地区作为固
定效应,以及基线餐后2小时血浆葡萄糖值作为协变量。
[0478]
固定比率组合与glp-1受体激动剂之间的ls均值的差异。
[0479]
所述分析包括在26周随机治疗期期间获得的所有计划的测量值,包括在imp中止或引入救援疗法后获得的那些测量值。
[0480]
包括具有基线和第26周(locf)测量值两者的患者。
[0481]
为每个治疗组中具有≥5名患者的类别提供了ls均值和ls均值的差异。
[0482]
表6-不良事件概况的综述:在26周随机治疗期期间按筛选时sglt-2抑制剂使用的治疗期间出现的不良事件-安全性群体(efc13794)
[0483][0484][0485]
sglt2=钠葡萄糖协同转运蛋白2
[0486]
teae:治疗期间出现的不良事件
[0487]
n(%)=发生至少一例teae的患者的数量和百分比
[0488]
表7-在26周接受治疗期期间按主要soc和pt以及按筛选时sglt-2抑制剂使用的经历常见的teae(在任何治疗组中pt≥2%)的患者数量(%)-安全性群体(efc13794)
[0489][0490]
teae:治疗期间出现的不良事件,soc:系统器官分类,pt:首选项,sglt2=钠葡萄糖协同转运蛋白2。
[0491]
meddra版本:21.0
[0492]
n(%)=发生至少一例teae的患者的数量和百分比。
[0493]
注意:根据所有teae总结,表格按soc国际商定的顺序排序,而pt按soc内的递减频率排序。
[0494]
仅呈现出在至少一个治疗组中具有至少一个pt≥2%的soc。
[0495]
表8-在26周接受治疗期期间按筛选时sglt2抑制剂使用的在专用ecrf页面上记录并符合方案定义的已记录的症状性低血糖总结-安全性群体(efc13794)
[0496][0497]
sglt2=钠葡萄糖协同转运蛋白2
[0498]
a 对于每日配制品计算为发生事件的患者数量除以按患者年数计的总暴露量+1天,并且对于每周配制品计算为发生事件的患者数量除以按患者年数计的总暴露量+7天。
[0499]
b 对于每日配制品计算为事件的数量除以按患者年数计的总暴露量+1天,并且对于每周配制品计算为事件的数量除以按患者年数计的总暴露量+7天。
[0500]
已记录的症状性低血糖=在专用ecrf上记录并且符合已记录的症状性低血糖的方案定义的症状性低血糖。
[0501]
26周接受治疗期对于没有资格进入扩展期的患者定义为从首次注射研究用药物(imp)直到最后一次注射每日imp后1天(最后一次注射每周imp后7天),或者对于有资格进入扩展期的患者定义为直到访视28/第26周(或第183天,如果错过访视28/第26周的话)的时间,无论救援疗法的引入如何。
[0502]
实施例5
[0503]
甘精胰岛素和利西拉来的固定剂量比配制品与sglt2i的同时使用
–
实施例2的亚组分析
[0504]
甘精胰岛素和利西拉来的固定剂量比组合(frc)与sglt2抑制剂(sglt2i)的同时使用得到了作为实施例2主题的患者组的亚组分析的支持(研究efc14112)。在这项研究中,34名患者(21.1%)同时接受了frc和sglt2i。
[0505]
如实施例2所述,frc在单一配制品中提供。
[0506]
两个治疗组的功效结果(hba1c和fpg从基线到第26周的变化)在sglt2i使用者和非使用者中大致相似(表3、表4)。
[0507]
安全性的综述并未揭示sglt2i使用者与非使用者之间的差异(表5)。关于常见的治疗期间出现的不良事件(teae)(表6),当与sglt2i非使用者相比时,sglt2i使用者的frc治疗组中胃肠系统障碍系统器官分类(soc)的teae报告频率更低(分别为17.6%与32.3%)。类似地,与非使用者相比,sglt2i使用者的frc组中已记录的症状性低血糖(血浆葡萄糖≤3.9mmol/l[≤70mg/dl])的报告频率更低(每患者每年的事件数量:分别为0.18和1.14)(表7)。与sglt2i非使用者相比,当frc治疗组的患者使用sglt2i作为背景疗法时,未鉴定出新的安全性信号。
[0508]
表1-按筛选时sglt2抑制剂使用的在筛选或基线时的人口统计学和患者特征-随机群体(efc14112)
[0509]
[0510]
[0511][0512]
sglt2=钠葡萄糖协同转运蛋白2,bmi=体重指数,fpg=空腹血浆葡萄糖,dpp-4=二肽基-肽酶-4,ivrs/iwrs=交互式语音/网络响应系统。
[0513]
表2-按筛选时sglt2抑制剂使用的在筛选或基线时的疾病特征-随机群体(efc14112)
[0514]
[0515][0516]
glp-1=胰高血糖素样肽-1,gfr=肾小球滤过率,egfr=估计的肾小球滤过率,sglt2=钠葡萄糖协同转运蛋白2。
[0517]
egfr值是使用idms-mdrd公式的方程式得出的。
[0518]
[0519][0520]
表5-不良事件概况的综述:在26周接受治疗期期间按筛选时sglt-2抑制剂使用的治疗期间出现的不良事件-安全性群体(efc14112)
[0521][0522]
sglt2=钠葡萄糖协同转运蛋白2,teae:治疗期间出现的不良事件。
[0523]
n(%)=发生至少一例teae的患者的数量和百分比。
[0524]
26周接受治疗期定义为在第26周访视(或第183天,如果错过第26周访视的话)时或之前,从首次注射开放标签研究用药物(imp)直到最后一次注射开放标签imp后3天的时间,无论救援疗法的引入如何。
[0525]
表6-在26周接受治疗期期间按主要soc和pt以及按筛选时的sglt-2抑制剂使用呈现的经历常见的teae(在任何治疗组中pt》=2%)的患者数量(%)-安全性群体(efc14112)
[0526]
[0527][0528]
sglt2=钠葡萄糖协同转运蛋白2,teae:治疗期间出现的不良事件,soc:系统器官分类,pt:首选项。
[0529]
meddra 20.1。
[0530]
n(%)=发生至少一例teae的患者的数量和百分比。
[0531]
注意:根据所有teae总结,表格按soc国际商定的顺序排序,而pt的递减频率按soc内的递减频率排序。
[0532]
仅呈现出在至少一个治疗组中具有至少一个pt≥2%的soc。
[0533]
26周接受治疗期定义为在第26周访视(或第183天,如果错过第26周访视的话)时或之前,从首次注射开放标签研究用药物(imp)直到最后一次注射开放标签imp后3天的时间,无论救援疗法的引入如何。
[0534]
表7-在26周接受治疗期期间按筛选时sglt2抑制剂使用的在专用ecrf页面上记录并符合方案定义的已记录的症状性低血糖总结-安全性群体(efc14112)
[0535][0536]
sglt2=钠葡萄糖协同转运蛋白2,imp=研究用药物,ecrf=电子病例报告表。
[0537]
暴露的总患者年数:计算为在26周治疗期期间从首次注射开放标签imp直到最后一次注射开放标签imp后1天的时间。a 计算为发生事件的患者数量除以暴露的总患者年数。
[0538]
b 计算为事件的数量除以暴露的总患者年数。
[0539]
26周接受治疗期定义为在第26周访视(或第183天,如果错过第26周访视的话)时或之前,从首次注射开放标签研究用药物(imp)直到最后一次注射开放标签imp后1天的时间,无论救援疗法的引入如何。
[0540]
实施例6
[0541]
甘精胰岛素和利西拉来的固定剂量比配制品与sglt2i的同时使用
–
实施例3的亚组分析
[0542]
甘精胰岛素和利西拉来的固定剂量比组合(frc)与sglt2抑制剂(sglt2i)的同时使用得到了作为实施例3主题的患者组的亚组分析的支持(研究efc14114)。在这项研究中,
59名患者(22.7%)同时接受了frc和sglt2i。
[0543]
如实施例3所述,frc在单一配制品中提供。
[0544]
两个治疗组的功效结果(hba1c、fpg和2小时ppg从基线到第26周的变化)在sglt2i使用者和非使用者中大致相似(表3、表4、表5)。特别地,没有迹象表明sglt2i使用者亚组的frc功效降低。
[0545]
安全性的综述并未揭示sglt2i使用者与非使用者之间的差异(表6)。关于常见的teae(表7),当与sglt2i非使用者相比时,sglt2i使用者的frc组中胃肠道soc的teae报告频率在数字上也更低(分别为22.0%与27.4%)。与sglt2i非使用者相比,当frc治疗组的患者使用sglt2i作为背景疗法时,未鉴定出新的安全性信号。
[0546]
表1-按筛选时sglt2抑制剂使用的在筛选或基线时的人口统计学和患者特征-随机群体(efc14114)
[0547]
[0548][0549]
sglt2=钠葡萄糖协同转运蛋白2,bmi=体重指数,fpg=空腹血浆葡萄糖,ivrs/iwrs=交互式语音/网络响应系统。
[0550]
表2-按筛选时sglt2抑制剂使用的在筛选或基线时的疾病特征-随机群体(efc14114)
[0551]
[0552][0553]
sglt2=钠葡萄糖协同转运蛋白2,glp-1=胰高血糖素样肽-1。gfr=肾小球滤过率,egfr=估计的肾小球滤过率。
[0554]
egfr值是使用idms-mdrd公式的方程式得出的。
[0555]
[0556]
[0557][0558]
表6-不良事件概况的综述:按筛选时sglt-2抑制剂使用的治疗期间出现的不良事件-安全性群体(efc14114)
[0559][0560]
sglt2=钠葡萄糖协同转运蛋白2,teae:治疗期间出现的不良事件。
[0561]
n(%)=发生至少一例teae的患者的数量和百分比。
[0562]
表7-按主要soc和pt以及按筛选时sglt-2抑制剂使用的经历常见的teae(在任何治疗组中pt》=2%)的患者数量(%)-安全性群体(efc14114)
[0563][0564]
sglt2=钠葡萄糖协同转运蛋白2,teae:治疗期间出现的不良事件,soc:系统器官分类,pt:首选项。
[0565]
meddra 20.1。
[0566]
n(%)=发生至少一例teae的患者的数量和百分比。
[0567]
注意:根据所有teae总结,表格按soc国际商定的顺序排序,而pt的递减频率按soc内的递减频率排序。
[0568]
仅呈现出在至少一个治疗组中具有至少一个pt≥2%的soc。
[0569]
表8-在接受治疗期期间按筛选时sglt2抑制剂使用的在专用ecrf页面上记录并符合方案定义的已记录的症状性低血糖总结-安全性群体(efc14114)
[0570][0571]
sglt2=钠葡萄糖协同转运蛋白2,imp=研究用药物,ecrf=电子病例报告表。
[0572]
暴露的总患者年数:计算为从首次注射开放标签imp直到最后一次注射开放标签imp后1天的时间。
[0573]
a 计算为发生事件的患者数量除以暴露的总患者年数。
[0574]
b 计算为事件的数量除以暴露的总患者年数。
[0575]
任何低血糖=在专用ecrf上记录并且符合严重低血糖、已记录的症状性低血糖或无症状低血糖的方案定义的低血糖。
[0576]
接受治疗期定义为从首次注射开放标签imp直到最后一次注射开放标签imp后1天的时间,无论救援疗法的引入如何。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1