DNMT抑制剂的用途
dnmt抑制剂的用途
技术领域
1.本发明涉及一种对水解代谢酶胞苷脱氨酶具有显著稳定性,且可替代5-氮杂-2
’‑
脱氧胞苷的可口服dnmt抑制剂的用途。
背景技术:
2.慢性髓性白血病(chronic myeloid leukemia,cml)占成人白血病的15-20%,其病症由基因上的t(9;22)(q34;q11)易位导致费城染色体表达所致,该易位所产生的bcr-abl融合蛋白导致abl酪氨酸激酶被持续激活,在造血干细胞水平上无限克隆增殖。另外,在该cml中,病情一般从慢性期逐步发展到过渡期、急性转化期(非专利文献1)。
3.关于cml的治疗方法,除了同种造血干细胞移植外,还没有根治方法,但自2001年atp竞争性abl酪氨酸激酶抑制剂(tyrosine kinase inhibitor,tki)伊马替尼上市以来,使用该药剂极大改善了cml的预后。如今,被期望能够比伊马替尼效果更好的第二代tki(尼洛替尼、达沙替尼、博苏替尼)、第三代tki(普纳替尼)已经可以在临床上进行使用,cml的治疗效果得到进一步改善(非专利文献2)。但是,也有一些关于tki反应难治性病例、因abl酪氨酸激酶结构域内的点突变等产生的tki获得耐药性病例的报告(非专利文献3-4),对其的有效治疗仍然有限。另外,也有报告称表观遗传学的变化参与了cml的病程发展及tki获得耐药性,正在探讨5-氮杂胞苷等dnmts抑制剂的利用(非专利文献5-6)。
4.dnmts是dna甲基转移酶(dna methyltransferases)的简称,是催化dna链中的腺嘌呤环6位氨基的甲基化(腺嘌呤n
6-特异性dna甲基转移酶:ec 2.1.1.72)、胞嘧啶环4位氨基的甲基化(胞嘧啶n
4-特异性dna甲基转移酶:ec 2.1.1.113)或胞嘧啶环5位的甲基化(胞嘧啶环c
5-特异性dna甲基转移酶:ec 2.1.1.37)的酶。特别是催化常在表达基因的启动子区域中发现的称为cpg岛的序列部分的胞嘧啶环5位的甲基化的酶(维持甲基转移酶dnmt1、从头甲基转移酶dnmt3家族),在调节细胞正常发育和分化时,发挥极其重要的作用(非专利文献7~8),因此在生理学上备受瞩目。
5.另外,dnmts与癌的发展密切相关。即,虽然认为在全部cpg的60~90%中,胞嘧啶环5位甲基化,但已知异常水平的dna甲基化与基因表达的沉默密切相关,启动子区域(cpg岛)胞嘧啶环5位高水平地甲基化的基因在其转录、表达中均处于沉默状态(非专利文献9~11)。
6.另一方面,细胞具备在新合成的dna链中相同位置的胞嘧啶环5位引入甲基的机制,使这种“dna甲基化的复制”成为可能的也是dnmts。因此,在癌变细胞中,大多数的肿瘤抑制基因在转录、表达上被抑制且处于沉默状态,因而它们为易于增殖的状态。
7.另外,关于这种胞嘧啶环5位的甲基化,有提案通过dnmt催化活性中心的半胱氨酸残基的sh基攻击dna序列中的胞嘧啶环6位,从而激活胞嘧啶环5位,促进来自甲基供体s-腺苷-l-甲硫氨酸的甲基转移的反应机理。
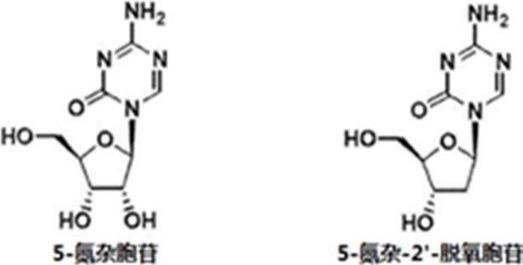
8.发现了5-氮杂胞苷(制品名:vidaza(注册商标))及其2
′‑
脱氧体(地西他滨,制品名:dacogen(注册商标))作为具有上述背景的dnmt选择性酶抑制剂,作为高风险的骨髓增
生异常综合征、急性骨髓白血病的治疗药被用于临床中。另外,这些药剂与胞嘧啶核苷类的化学结构(胞嘧啶环5位碳原子被氮原子取代的结构)酷似,通过核酸生物合成路径,代替2
’‑
脱氧胞苷嵌入dna中,自杀性抑制肿瘤抑制基因启动子区域(cpg岛)中的dnmts对胞嘧啶环5位的甲基化反应,使肿瘤抑制基因的正常表达成为可能,显示出治疗效果。
[0009][0010]
具有上述作用机理的药物可用作广泛的抗癌剂,但所有化合物容易被血液中或肝脏内存在的代谢酶胞苷脱氨酶水解脱氨,因此其仅限于在临床上用作高风险骨髓增生异常综合征、急性骨髓白血病的治疗药,另外,因为其化学性质不稳定,使其仅限于注射剂型。因此,期望能够出现对胞苷脱氨酶具有高稳定性,且可替代5-氮杂胞苷类的可口服药剂。
[0011]
另外,最近,发现了对水解代谢酶胞苷脱氨酶具有高稳定性的化合物sgi-110(guadecitabine)(专利文献1~2),其作为5-氮杂-2
’‑
脱氧胞苷的前驱药物正在被临床开发,但该化合物的二核苷酸结构使其具有高度极性,不易膜渗透,不适合作为口服药剂(非专利文献12~14)。
[0012][0013]
现有技术文献
[0014]
专利文献
[0015]
专利文献1:美国公开2007072796号公报(日本专利5030958号说明书)
[0016]
专利文献2:国际公开2013033176号公报(日本专利6038921号说明书)
[0017]
非专利文献
[0018]
非专利文献1:药物设计、开发和治疗(drug design,development and therapy),2019年,第13卷,p.825-843.
[0019]
非专利文献2:欧洲药物化学杂志(european journal of medicinal chemistry),2019年,第170卷,p.55-72.
[0020]
非专利文献3:血液学治疗进展(therapeutic advances in hematology),2014年,第5卷,第4号,p.107-120.
[0021]
非专利文献4:干细胞研究(stem cell investigation),2018年,第5卷,p.10;血液学的当前观点(current opinion in hematology),2019年,第26卷,第2号,p.119-123.
[0022]
非专利文献5:癌症科学(cancer sciences),2014年,第105卷,第3号,p.297-307.
[0023]
非专利文献6:细胞死亡和疾病(cell death and disease),2017年,第8卷,第10号,e3114.
[0024]
非专利文献7:化学评论(chemical reviews),2015年,第115卷,第6号,p.2240-2254.
[0025]
非专利文献8:生物分子(biomolecules),2017年,第7卷,第1号,e3;基因(basel)(genes(basel)),2019年,第10卷,第2号,e172.非专利文献9:单行本“表观遗传学:参考手册”(epigenetics:a reference manual),2011年,craig jm,wong nc著,caister academic press limited.
[0026]
非专利文献10:细胞与生物科学(cell&bioscience),2014年,第4卷,46.
[0027]
非专利文献11:分子癌(molecular cancer),2017年,第16卷,第1号,29.
[0028]
非专利文献12:肿瘤靶点(oncotarget),2017年,第8卷,第2号,p.2949-2959.
[0029]
非专利文献13:表观遗传学(epigenetics),2016年,第11卷,第10号,p.709-720.
[0030]
非专利文献14:柳叶刀血液学(the lancet haematology),2019年,第6卷,第6号,e317-e327.
技术实现要素:
[0031]
发明要解决的问题
[0032]
本发明的课题是研究制造一种对水解代谢酶胞苷脱氨酶具有高稳定性,且可替代5-氮杂-2
’‑
脱氧胞苷的可口服化合物,不仅作为高风险的骨髓增生异常综合征、急性骨髓白血病的治疗药,也可以作为针对获得tki耐药性的cml(tki耐药性cml)的治疗药或预防药。
[0033]
问题解决方案
[0034]
本发明人为了提供一种比作为高风险的骨髓增生异常综合征等各种骨髓瘤的治疗药5-氮杂-2
’‑
脱氧胞苷(商品名:dacogen(注册商标))更有用的医药品,一直在进行努力研究,发现一种兼具优异的药理作用和物理化学性质的新化合物,其对水解代谢酶胞苷脱氨酶具有高稳定性,且可在活体内易进入核酸生物合成途径。其中,在合成5-氮杂-2
’‑
脱氧胞苷的各种糖部分修饰衍生物,调查其化学反应性和生物活性后,发现对应的糖部分甲硅烷基醚衍生物对胞苷脱氨酶具有优异的稳定性,且显示出抗cml活性,对这一发现在下文反
复进行了进一步详细的探讨,完成了本发明。
[0035]
本发明提供下述发明,由此解决了上述课题。
[0036]
[1]
[0037]
一种tki耐药性cml的预防、治疗药,其中
[0038]
包含式(i)表示的化合物或其盐
[0039][0040]
(式中,r1和r2分别是氢原子或式(ii)表示的甲硅烷基。但是,r1和r2同时为氢原子时除外。)
[0041][0042]
(式中,r3、r4和r5分别是可以具有取代基的烷基或芳基或芳烷基)。
[0043]
[2]
[0044]
含有根据[1]所述的化合物或其盐的tki耐药性cml的预防、治疗药,其中所述r1是式(ii)表示的甲硅烷基,所述r2是氢原子。
[0045]
[3]
[0046]
含有根据[1]所述的化合物或其盐的tki耐药性cml的预防、治疗药,其中所述r2是式(ii)表示的甲硅烷基,所述r1是氢原子。
[0047]
[4]
[0048]
含有根据[1]所述的化合物或其盐的tki耐药性cml的预防、治疗药,其中所述r1和r2分别是式(ii)表示的甲硅烷基。
[0049]
[5]
[0050]
根据[1]所述的tki耐药性cml的预防、治疗药,其中所述r3、r4和r5分别是可以具有取代基的c1~c8烷基或c6~c
10
芳基或c7~c
14
芳烷基。
[0051]
[6]
[0052]
根据[1]~[5]任一项所述的tki耐药性cml的预防、治疗药,其中烷基是甲基、乙基或丙基。
[0053]
[7]
[0054]
根据[1]~[6]任一项所述的tki耐药性cml的预防、治疗药,其中烷基是乙基。
[0055]
[8]
[0056]
根据[5]所述的tki耐药性cml的预防、治疗药,其中所述c6~c10芳基是苯基或萘基。
[0057]
[9]
[0058]
根据[5]所述的tki耐药性cml的预防、治疗药,其中所述c7~c
14
芳烷基是苄基、苯乙基或萘甲基。
[0059]
[10]
[0060]
一种tki耐药性cml的预防、治疗药,其特征在于将[1]~[9]任一项所述的tki耐药性cml的预防、治疗药与伴随用药组合而成。
[0061]
[11]
[0062]
根据[10]所述的tki耐药性cml的预防、治疗药,其中伴随用药是p53基因抑制剂或酶抑制剂。
[0063]
『12]
[0064]
根据[11]所述的tki耐药性cml的预防、治疗药,其中酶抑制剂选自酪氨酸激酶抑制剂(tki)、组蛋白去乙酰化酶抑制剂、组蛋白甲基化酶抑制剂、组蛋白去甲基化酶抑制剂等中的1种以上。
[0065]
[13]
[0066]
根据[11]所述的tki耐药性cml的预防、治疗药,其中p53基因抑制剂或酶抑制剂选自pifithrin、nutlin、ds3201、hbi-8000、曲古抑菌素a(tsa)、苏拉明(suramin)、epz005687和adox等中的1种以上。
[0067]
[14]
[0068]
一种tki耐药性cml的预防或治疗方法,其特征在于
[0069]
给药有效量的式(i)表示的化合物或其盐
[0070][0071]
(式中,r1和r2分别是氢原子或式(ii)表示的甲硅烷基。但是,r1和r2同时为氢原子时除外。)
[0072][0073]
(式中,r3、r4和r5分别是可以具有取代基的烷基或芳基或芳烷基)。
[0074]
[15]
[0075]
一种tki耐药性cml的预防或治疗方法,其特征在于给药有效量的式(i)表示的化合物或其盐和伴随用药
[0076][0077]
(式中,r1和r2分别是氢原子或式(ii)表示的甲硅烷基。但是,r1和r2同时为氢原子时除外。)
[0078][0079]
(式中,r3、r4和r5分别是可以具有取代基的烷基或芳基或芳烷基)。
[0080]
[16]
[0081]
根据[15]所述的tki耐药性cml的预防或治疗方法,其特征在于[15]所述的式(i)表示的化合物或其盐与所述伴随用药同时给药。
[0082]
[17]
[0083]
根据[15]所述的tki耐药性cml的预防或治疗方法,其特征在于[15]所述的式(i)表示的化合物或其盐在所述伴随用药给药前或给药后给药。
[0084]
[18]
[0085]
用于制造tki耐药性cml的预防、治疗药的式(i)表示的化合物或其盐的用途
[0086][0087]
(式中,r1和r2分别是氢原子或式(ii)表示的甲硅烷基。但是,r1和r2同时为氢原子时除外。)
[0088][0089]
(式中,r3、r4和r5分别是可以具有取代基的烷基或芳基或芳烷基)。
[0090]
发明的有益效果
[0091]
根据本发明,推测因为5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物比对应的5-氮杂-2
’‑
脱氧胞苷脂溶性高,所以可以口服,在肠道吸收后,在血液中或肝脏内不受水解代谢酶胞苷脱氨酶的影响,而在cml细胞的细胞膜内或细胞内通过非酶水解被激活,经核酸生物合成途径被纳入dna,由此示出dnmt酶抑制活性,因此有望作为由dnmt诱导表达的tki耐药性cml的治疗药或预防药发挥作用。另外,本发明的5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物有望作为对tki耐药性cml有效的口服dnmt酶抑制剂。
具体实施方式
[0092]
若无特别说明,本说明书和权利要求所使用的用语具有下述意义。
[0093]
本发明的化合物或其盐
[0094]
本发明的化合物是下述式(i)表示的化合物或其盐。
[0095]
[0096]
(式中,r1和r2分别是氢原子或式(ii)表示的甲硅烷基。但是,r1和r2同时为氢原子时除外。)
[0097][0098]
(式中,r3、r4和r5分别是可以具有取代基的烷基或芳基或芳烷基)。
[0099]“烷基”没有特殊限制,为饱和脂肪族烃基,例如是碳原子数为1~8个的直链或支链或环状的烷基,例如甲基、乙基、丙基、异丙基、丁基、仲丁基、异丁基、叔丁基、戊基、己基等c1~c6烷基、庚基、2-甲基己基、5-甲基己基、2,2-二甲基戊基、4,4-二甲基戊基、2-乙基戊基、1,1,3-三甲基丁基、1,2,2-三甲基丁基、1,3,3-三甲基丁基、2,2,3-三甲基丁基、2,3,3-三甲基丁基、1-丙基丁基、1,1,2,2-四甲基丙基、辛基、2-甲基庚基、3-甲基庚基、6-甲基庚基、2-乙基己基、5,5-二甲基己基、2,4,4-三甲基戊基、1-乙基-1-甲基戊基、环丙基、环丁基、环戊基、环己基、环庚基、环辛基等基,但优选c1~c6烷基。c1~c6烷基的优选例为甲基、乙基、丙基。c1~c6烷基的更优选例为乙基。另外,环状烷基的优选例为环戊基和环己基。
[0100]“芳基”是指单环或二环芳香族烃,优选例如苯基、萘基等c6~c
10
芳基,更优选苯基。
[0101]“芳烷基”是指被芳基取代的烷基。优选c7~c
14
芳烷基。c7~c
14
芳烷基的示例包含苄基、苯乙基或萘甲基等,但不限于此。
[0102]“可以具有取代基的烷基、可以具有取代基的芳基或可以具有取代基的芳烷基”是指可以具有取代基,也可以没有取代。被取代时,取代基在所述烷基、芳基或芳烷基的可取代位置上可具有1至5个,优选可以有1~3个,取代基数在2个以上时,各取代基可以相同或不同。取代基可列举烷基、卤原子、氰基、硝基等,但优选的取代基的示例是烷基或卤原子。
[0103]“卤原子”是指氟原子、氯原子、溴原子和碘原子等,优选例为氟原子和氯原子。
[0104]
本发明的式(i)表示的化合物的盐只要是药学上可接受的盐即可,可以是任何盐。其盐例如可举例无机酸盐(例如,盐酸盐、硫酸盐、氢溴酸盐、磷酸盐等)、有机酸盐(例如,乙酸盐、三氟乙酸盐、琥珀酸盐、马来酸盐、富马酸盐、丙酸盐、柠檬酸盐、酒石酸盐、乳酸盐、草酸盐、甲磺酸盐、对甲苯磺酸盐等)等酸加成盐等,但不限于此。
[0105]
本发明的式(i)表示的化合物可以是结晶,晶型可以是单一的,也可以是多个晶型的混合物。该结晶可适用本身公知的结晶化方法,通过结晶化制造。
[0106]
另外,本发明的式(i)表示的化合物可以是溶剂合物(例如水合物等),溶剂合物和非溶剂合物(例如非水合物等)均包含于式(i)表示的化合物中。
[0107]
本发明的5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物(参照式(i))可以是5-氮杂-2
’‑
脱氧胞苷的前驱药物。
[0108]
因为5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物(参照式(i))对胞苷脱氨酶非常稳定,所以从消化道吸收的上述衍生物有望具有难以被存在于血液中或肝脏中的胞苷脱氨酶水解代谢的性质。
[0109]
有望对上述水解代谢酶具有高稳定性的本发明的5-氮杂-2
’‑
脱氧胞苷的糖部分
甲硅烷基醚衍生物(参照式(i))可以是由dnmt诱导表达的tki耐药性cml的治疗药或预防药。
[0110]
本发明的式(i)表示的化合物的制造方法
[0111]
本发明的5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物(参照式(i))以如下方式制造。即,使5-氮杂-2
’‑
脱氧胞苷(参照式(i):r1=r2=h)和具有适当取代基的卤代甲硅烷基化合物在脱卤化氢剂的存在下进行反应,可以容易地获得作为目标的5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物(参照式(i))。
[0112]
(脱卤化氢剂)
[0113]
所使用的脱卤化氢剂可举例有机碱和无机碱。有机碱可举例但不限于咪唑、1-甲基咪唑、吗啉、三乙胺、n,n-二异丙基乙胺、吡啶、4-二甲基氨基吡啶、正丁基锂或叔丁醇钾等,无机碱可举例但不限于氢化钠、碳酸钠、碳酸氢钠、碳酸钾、碳酸氢钾或碳酸铯等。碱的使用量优选为原料化合物的当量以上。进一步,基于1mol原料化合物,通常可举例1.0~50.0当量的范围,优选1.0~10.0当量的范围,更优选1.0~5.0当量的范围。
[0114]
(溶剂)
[0115]
从反应顺利进行等观点来看,本发明的反应优选在溶剂存在下进行。只要反应能够进行,用于本发明的反应的溶剂可以是任何溶剂。
[0116]
溶剂例如可举例n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二甲基亚砜等。只要反应能够进行,溶剂可以以任何量使用。用于本发明的反应的溶剂的使用量可以由本领域技术人员适当地调整。
[0117]
(反应温度)
[0118]
本发明的反应温度没有特殊限制。在一个实施方案中,从提高产率、抑制副产物和经济效率等观点来看,可以举例-20℃~50℃(即,负20℃~正50℃),优选-10℃~30℃(即,负10℃~正30℃),更优选-10℃~20℃(即,负10℃~正20℃),进一步优选-5℃~15℃(即,负5℃~正15℃),特别优选-5℃~10℃(即,负5℃~正10℃)的范围。
[0119]
(反应时间)
[0120]
本发明的反应时间没有特殊限制。在一个实施方案中,从提高产率、抑制副产物和经济效率等观点来看,可以举例0.5~120小时的范围,优选1~72小时的范围,更优选1~48小时的范围,进一步优选1~24小时的范围。但是,本发明的反应时间可以由本领域技术人员适当地调整。
[0121]
本发明的药物组合物
[0122]
本发明的式(i)表示的化合物作为安全药物可以直接地、或者根据本身公知的方法与药学上可接受的载体混合形成药物组合物而用于哺乳动物(如人类、猴、猫、猪、马、牛、小鼠、大鼠、豚鼠、狗、兔等)。
[0123]
关于药学上可接受的载体,可以使用各种常规有机或无机载体物质作为配制材料,例如可举例固体制剂的赋形剂、润滑剂、粘合剂和崩解剂等,液体制剂的溶剂、增溶剂和悬浮剂等,张度剂和缓冲剂等。另外,根据需要可以使用防腐剂、抗氧化剂、着色剂、甜味剂等制剂添加剂。
[0124]
关于药物组合物的剂型,例如可举例片剂、胶囊剂(包括软胶囊剂和微胶囊剂)、颗粒剂、粉剂、糖浆剂、乳剂、悬浮剂或缓释制剂等口服制剂等,这些可以安全地口服给药。但
是,因为也可以是液体制剂给药,所以不限于此。
[0125]
可以根据制剂技术领域中的常规方法制备药物组合物,例如,可以使用日本药典等中描述的方法。
[0126]
本发明的式(i)表示的化合物的用途
[0127]
本发明的式(i)表示的化合物具有多种治疗和预防用途。在优选实施方式中,本发明的化合物用于治疗对使用胞苷类(例如5-氮杂-2
’‑
脱氧胞苷)的治疗敏感的多种疾病。可以使用本发明的化合物治疗的优选适应症包括伴有不希望或不受控的细胞分裂的症状。上述适应症包括各种癌症,但适用对象优选由bcr-abl融合基因诱发表达的cml、更优选tki耐药性cml。另外,也有望对急性淋巴性白血病、急性髓性白血病有效。
[0128]
本发明的tki耐药性cml的伴随用药例如可举例tki、p53基因抑制剂或酶抑制剂等,但不限于此。
[0129]
tki是指伊马替尼(imatinib)、吉非替尼(gefitinib)、厄洛替尼(erlotinib)、索拉非尼(sorafenib)、达沙替尼(dasatinib)、舒尼替尼(sunitini)、拉帕替尼(lapatinib)、尼洛替尼(nilotinib)、帕唑帕尼(pazoponib)、克唑替尼(crizotinib)、芦可替尼(ruxolitinib)、凡德他尼(vandertinib)、维罗非尼((vemurafenib)、阿西替尼(axitinib)、伯舒替尼(bosutinib)、canonzantinib、普纳替尼(ponatinib)、瑞戈非尼(regorafenib)、托法替尼(tofacitinib)、阿法替尼(afatinib)、达拉菲尼(dabrafenib)、依鲁替尼(ibrutinib)、曲美替尼(trametinib)、色瑞替尼(ceritinib)、尼达尼布(nintedanib)、仑伐替尼(lenvatinib)、帕博西尼(palbocitinib)、卡博替尼(carbozantinib)、阿卡替尼(aclabrutinib)、布加替尼(brigatinib)、奈拉替尼(neratinib)、达可替尼(dacomitinib)、吉瑞替尼(gilteritinib)、拉罗替尼(larotrectinib)、劳拉替尼(lorlatinib)和奥西替尼(osimertinib)等(非专利文献2)。
[0130]
p53基因抑制剂或酶抑制剂是指pifithrin、nutlin、ds3201、hbi-8000、曲古抑菌素a(tsa)、苏拉明(suramin)、epz005687和adox等。
[0131]
在本发明的tki耐药性cml的预防或治疗药与伴随用药组合时,tki耐药性cml的预防或治疗药与伴随用药的给药时间没有特殊限制,可以向给药对象同时给药,或间隔时间差给药。tki耐药性cml的预防或治疗药与伴随用药可以分别制剂化,也可以将二者混合为合剂。伴随用药的给药量基于临床中使用的给药量即可,可以根据给药对象、给药途径、疾患和组合适当选择。伴随用药的给药量例如可以为该伴随用药作为单剂使用时的给药量的三分之一至3倍的量。
[0132]
本发明的tki耐药性cml的预防或治疗药和伴随用药的给药方式没有特殊限制,给药时组合tki耐药性cml的预防或治疗药和伴随用药即可。上述给药方式例如可举例,(1)将tki耐药性cml的预防或治疗药和伴随用药同时制剂化得到的单一制剂的给药;(2)将tki耐药性cml的预防或治疗药和伴随用药分别制剂化得到2种制剂,通过同一给药途径的同时给药;(3)将tki耐药性cml的预防或治疗药和伴随用药分别制剂化得到2种制剂,通过同一给药途径间隔时间差的给药;(4)将tki耐药性cml的预防或治疗药和伴随用药分别制剂化得到2种制剂,通过不同给药途径的同时给药;(5)将tki耐药性cml的预防或治疗药和伴随用药分别制剂化得到2种制剂,由不同给药途径间隔时间差的给药(例如,以tki耐药性cml的预防或治疗药
→
伴随用药的顺序给药,或以相反顺序给药)等。
[0133]
通过组合本发明的tki耐药性cml的预防或治疗药和伴随用药,可得到如下优异效果。
[0134]
(1)与单独给药tki耐药性cml的预防或治疗药和伴随用药时相比,可以减少其给药量;
[0135]
(2)可以根据患者的症状(轻症、重症)选择伴随用药的种类;
[0136]
(3)通过选择与tki耐药性cml的预防或治疗药作用机制不同的伴随用药,可以设定较长的治疗期;
[0137]
(4)通过选择与tki耐药性cml的预防或治疗药作用机制不同的伴随用药,可达到治疗效果的持续;
[0138]
(5)通过同时使用tki耐药性cml的预防或治疗药和伴随用药,可得到协同效果。
[0139]
在将本发明的tki耐药性cml的预防或治疗药作为药物制剂向患者给药时,可以将dnmt抑制剂(例如,式(i)表示的化合物)单独制剂化,也可以将其与伴随用药、药学上可接受的载体混合进行制剂化。药物制剂中的dnmt抑制剂(例如,式(i)表示的化合物)的含量一般为0.1~100%(w/w)。另外,在药物制剂中调配伴随用药时,dnmt抑制剂(例如,式(i)表示的化合物)的含量一般为0.1~99.9%(w/w)。
[0140]
在本发明中使用的适当的药物组合物包含活性成分以有效量,即,包含对所治疗的症状达到治疗和/或预防目的的有效量存在的组合物。
[0141]
在本发明中使用的药物组合物作为用于口服给药的剂型提供。在本说明书中提供的药物组合物可以以固体、半固体或液体剂型用于口服给药。在本说明中,口服给药还包括颊部、舌部和舌下给药。用于口服给药的合适的剂型包括但不限于片剂、胶囊剂、丸剂、锭剂、药用糖、芳香制剂、扁囊剂(cachet)、粒剂(pellet)、含药口香糖、颗粒剂、原料药(原末)、发泡制剂或非发泡粉剂或颗粒剂、溶液、乳剂、悬浮液、溶液、粉片(wafer)、散剂(sprinkle)、酏剂和糖浆剂。除活性成分之外,药物组合物还可以含有粘合剂、填充剂、稀释剂、崩解剂、润湿剂、润滑剂、助流剂、着色剂、色素迁移抑制剂、甜味剂以及调味剂,但还可以含有不限于这些实例的一种以上的药学上可接受的载体或赋形剂。
[0142]
药物组合物或剂型中的本发明的式(i)表示的化合物的量例如可以是以下范围中的任一个:约1mg~约2,000mg、约10mg~约2,000mg、约20mg~约2,000mg、约50mg~约1,000mg、约100mg~约500mg、约150mg~约500mg或约150ma~约250mg。
[0143]
当使用本发明的化合物作为抗癌剂时,其有效剂量可以根据癌症的性质和阶段、治疗方针、转移程度、肿瘤的量、体重、年龄、性别、患者的(遗传)种族背景等进行适当选择,但药学上有效量通常根据如临床观察到的症状、癌症的阶段等因素来确定。关于每日剂量,例如,在向人类给药的情况下,为约0.01mg/kg~约10mg/kg(对于体重60kg的成人,为约0.5mg~约500mg),优选约0.05mg/kg~约5mg/kg,更优选约0.1mg/kg~约2mg/kg。此外,可以一次给药或分多次给药。
[0144]
针对这样获得的5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物(参照式(i)),研究了其在胞苷脱氨酶的存在下的稳定性,结果发现,具有本发明的糖部分甲硅烷基醚基的衍生物在任何情况下,即使在胞苷脱氨酶的存在下也非常稳定,确认了这些5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物难以被在血液或肝脏中存在的胞苷脱氨酶水解代谢。另一方面,在5’位具有羟基的5-氮杂-2’一脱氧胞苷(参照式(1):r1=r2=h)在上述条件下
在30分钟内分解。
[0145]
另外,研究了这样获得的5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物(参照式(i))在与生理条件类似的环境中(例如,在37℃,pbs溶液中)的稳定性,确认了在本发明的衍生物中,如果对与甲硅烷基直接连接的取代基进行适当选择,则可以以适当的速度水解并有效地生成相应的5-氮杂-2
’‑
脱氧胞苷(参照式(1):r1=r2=h)。此外,确认了以适当的速度水解的5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物还显示出抗cml活性。
[0146]
因此,本发明的5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物(参照式(i))对上述水解代谢酶具有高稳定性、且在生理条件下具有适当的水解反应性,有可能成为tki耐药性cml治疗药或预防药。
[0147]
以下将示出关于5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物(参照式(i))的制备和对代谢酶胞苷脱氨酶的稳定性、在pbs溶液中的水解反应性的实验细节以及抗cml活性。
[0148]
实施例
[0149]
下文举出实施例进一步说明本发明,但本发明不限于此。
[0150]
在以下实施例中,室温是指约15~30℃。1h-nmr和
13
c-nmr的测定用日本电子jnm-ecz400r进行,并使用cdcl3、dmso-d6或cd3od作为溶剂,示出从内标物四甲基硅烷的化学位移(δ)(ppm)。本说明书中使用的其他标号具有以下含义。s:单峰;d:二重峰;dd:双二重峰;t:三重峰;q:四重峰;m:多重峰;br:宽峰;brs:宽单峰;j:耦合常数。此外,各化合物的质谱数据为使用yamazen smart flash ms系统装置(apci法)测得的数值。下文示出在本研究中获得的关于5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物(参照式(i))的反应时间、柱洗脱溶剂体系、分离产率和仪器数据。
[0151]
实施例1
[0152]3’
,5
’‑
二甲硅氧基-5-氮杂-2
’‑
脱氧胞苷类的合成
[0153][0154]
向5-氮杂-2
’‑
脱氧胞苷(参照式(i):r1=r2=h)(1mm)的无水n,n-二甲基甲酰胺(3ml)悬浮液中添加咪唑(2mm),然后在冰浴下滴加相应的甲硅烷基氯(2.5mm)约10分钟,接着搅拌直至逐渐升至室温且原料消失为止。将反应溶液注入50ml的乙酸乙酯-饱和盐水(2∶1)的混合液中并用乙酸乙酯萃取。将萃取液用饱和盐水(各10ml,两次)洗涤后,经无水硫酸钠干燥,将去除了不可溶物质后的萃取液在减压下干燥而获得的油状残余物用硅胶柱(yamazen smart flash ms系统装置)分离纯化,从而可分离呈白色粉末的目标化合物5-氮
杂-2
’‑
脱氧胞苷的3’,5
’‑
二甲硅烷基醚衍生物(式(i)中,r1和r2是甲硅烷基的化合物)。
[0155]
化合物a:3’,5
’‑
二(o-三甲基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷:3’,5
’‑
di(o-trimethylsilyl)-5-aza-2
’‑
deoxycytidine(在式(i)中,r1=r2=三甲基甲硅烷基)(合成条件、分离方法:反应时间:约1小时,柱洗脱溶剂:乙酸乙酯-甲醇体系,分离产率:70%)
[0156]1h-nmr(cdcl3):8.69(s,1h),6.17(dd,j=6.4和4.4hz,1h),5.89(br s,1h),5.44(br s,ih),4.36(q,j=5.6hz,1h),3.94-3.96(m,1h),3.88(dd,j=11.6和2.8hz,1h),3.71(dd,j=12.0和2.4hz,1h),2.50(q,j=6.8hz,1h),2.17-2.23(m,1h),0.16(s,9h)和0.12(s,9h)。
[0157]
13
c-nmr(cdcl3):166.4,156.2,154.0,87.6,86.6,69.7,60.8,42.2,0.10和-0.69。
[0158]
质量:373.3[m+h]
+
(c
14h28
n4o4si2计算值,mw=372.16)。
[0159]
化合物b:3’,5
’‑
二(o-三乙基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷:3’,5
’‑
di(o-triethylsilyl)-5-aza-2
’‑
deoxycytidine(在式(i)中,r1=r2=三乙基甲硅烷基)(合成条件、分离方法:反应时间:约2小时,柱洗脱溶剂:乙酸乙酯-正己烷体系,分离产率:54%)
[0160]1h-nmr(cdcl3):8.67(s,1h),6.19(dd,j=6.4和4.8hz,1h),5.61(br,1h),5.38(br,1h),4.41(q,j=4.8hz,1h),3.96-3.98(m,1h),3.91(dd,j=11.6和2.8hz,1h),3.76(dd,j=11.6和2.0hz,1h),2.51(dt,j=13.2和6.0hz,1h),2.15-2.21(m,1h),0.92-0.99(m,18h)和0.56-0.68(m,12h)。
[0161]
13
c-nmr(cdcl3):166.4,156.2,154.0,88.0,86.6,70.2,61.5,42.7,6.8,4.7和4.2。
[0162]
质量:457.4[m+h]
+
(c
20h40
n4o4si2计算值,mw=456.26)。
[0163]
化合物c:3’,5
’‑
二(o-正辛基二甲基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷:3’,5
’‑
di(o-n-octyldimethylsilyl)-5-aza-2
’‑
deoxycytidine(在式(i)中,r1=r2=正辛基二甲基甲硅烷基)(合成条件、分离方法:反应时间:约2小时,柱洗脱溶剂:乙酸乙酯-正己烷,分离产率:54%)
[0164]1h-nmr(cd3od):8.61(s,1h),6.10(t,j=5.2hz,1h),4.46(dd,j=10.0和4.8hz,1h),3.97(dd,j=6.4和2.8hz,1h),3.88(dd,j=11.6和3.2hz,1h),3.76(dd,j=11.2和2.4hz,1h),2.41(dt,j=13.6和6.0hz,1h),2.24(dt,j=13.6和5.6hz,1h),1.29-1.34(m,24h),0.87-0.91(m,6h),0.61-0.68(m,4h),0.14(s,6h)和0.12(s,6h)。
[0165]
13
c-nmr(cd3od):166.7,155.8,155.0,88.0,86.5,70.8,61.2,41.6,33.3,31.8,29.16,29.12,29.11,23.0,22.9,22.4,16.0,15.6,13.2,-2.78,-2,89,-3.57和-3.75。
[0166]
质量:569.5[m+h]+(c
28h56
n4o4si2计算值,mw=568.38)。
[0167]
实施例2
[0168]5’‑
甲硅氧基-5-氮杂-2
’‑
脱氧胞苷类的合成
[0169][0170]
向5-氮杂-2
’‑
脱氧胞苷(参照式(i):r1=r2=h)(1mm)的无水n,n-二基甲酰胺(3ml)悬浮液中添加咪唑(1.5mm),然后在冰浴下滴加相应的甲硅烷基氯(1.2mm)约10分钟,接着搅拌直至逐渐升至室温且原料消失为止(约1~17小时)。将反应溶液注入50ml的乙酸乙酯-饱和盐水(2∶1)的混合液中并用乙酸乙酯萃取。将萃取液用饱和盐水(各10ml,两次)洗涤后,经无水硫酸钠干燥,将去除了不可溶物质后的萃取液在减压下干燥而获得的油状残余物用硅胶柱(yamazen smart flash ms系统)分离纯化,从而可分离呈白色粉末的目标化合物5-氮杂-2
’‑
脱氧胞苷的5’位甲硅烷基醚衍生物(式(i)中,r1是甲硅烷基,r2是氢原子的化合物)。
[0171]
化合物d:5
’‑
o-三甲基甲硅烷基-5-氮杂-2
’‑
脱氧胞苷:5
’‑
o-(trimethylsilyl)-5-aza-2
’‑
deoxycytidine(在式(i)中,r1=三甲基甲硅烷基,r2=h)(合成条件、分离方法:反应时间:约1小时,柱洗脱溶剂:乙酸乙酯-甲醇体系,分离产率:10%)
[0172]1h-nmr(cd3od):8.66(s,1h),6.13(t,j=6.0hz,1h),4.35-4.42(m,1h),3.67-4.02(m,9h),2.34-2.50(m,1h),2.20-2.32(m,1h)和0.14(s,9h)。
[0173]
13
c-nmr(cdcl3):166.3,156.0,154.1,87.6,86.8,71.6,62.3,42.6,和0.1。
[0174]
质量:301.3[m+h]
+
(c
11h20
n4o4si计算值,mw=300.13)。
[0175]
化合物e:5
’‑
o-(正辛基二甲基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷:5
’‑
o-(n-octyldimethylsilyl)-5-aza-2
’‑
deoxycytidine(在式(i)中,r1=正辛基二甲基甲硅烷基,r2=h)(合成条件、分离方法:反应时间:约1小时,柱洗脱溶剂∶乙酸乙酯-甲醇体系,分离产率:24%)
[0176]1h-nmr(cd3od):8.65(s,1h),6.12(t,j=5.6hz,1h),4.34-4.37(m,1h),4.00-4.02(m,1h),3.91-3.95(m,1h),3.76-3.79(m,1h),2.45(ddd,j=13.6,6.4和4.4hz,1h),2.24(m,1h),1.27-1.34(m,8h),0.87-0.89(m,4h),
[0177]
0.61-0.63(m,3h)和0.12(s,6h)。
[0178]
13
c-nmr(cd3od):156.2,155.8,155.1,87.9,86.7,70.5,61.8,41.6,33.2,31.8,29.1,22.4,15.6,13.1,-1.38,-2.96,-3.73和-3.83。
[0179]
质量:399.3[m+h]
+
(c
18h34
n4o5si计算值,mw=398.23)。
[0180]
化合物f:5
’‑
o-(三乙基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷:5
’‑
o-(triethylsilyl)-5-aza-2
’‑
deoxycytidine(在式(i)中,r1=三乙基甲硅烷基,r2=h)(合成条件、分离方法:反应时间:约1小时,柱洗脱溶剂:乙酸乙酯-甲醇体系,分离产率:81%)
[0181]1h-nmr(cdcl3):8.62(s,1h),6.26(t,j=6.0hz,1h),6.25(br,1h),5.58(br,1h),4.47-4.51(m,1h),4.09-4.11(m,1h),3.93(dd,j=10.8和2.4hz,1h),3.82(dd,j=11.6和2.0hz,1h),2.64-2.70(m,1h),2.66(br,1h),2.23(dt,j=12.0和6.4hz,1h),0.96(t,j=8.0hz,9h)和0.63(q,j=8.0hz,6h)。
[0182]
13
c-nmr(cdcl3):166.3,156.0,154.1,87.6,86.8,71.6,62.3,42.6,6.7和4.1。
[0183]
质量:343.3[m+h]
+
(c
14h26
n4o4si计算值,mw=342.17)。
[0184]
化合物g:5
’‑
o-(异丙基二甲基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷:5
’‑
o-(i-propyldimethylsilyl)-5-aza-2
’‑
deoxycytidine(在式(i)中,r1=异丙基二甲基甲硅烷基,r2=h)(合成条件、分离方法:反应时间:约1小时,柱洗脱溶剂:乙酸乙酯-甲醇体系,分离产率:48%)
[0185]1h-nmr(dmso-d6):8.38(s,1h),7.51(br s,1h),7.49(br s,1h),6.00(t,j=6.4hz,1h),5.25(d,j=4.8hz,1h),4.16(q,j=4.4hz,1h),3.85-3.62(m,3h),2.25-2.03(m,2h),0.92-0.85(m,6h),0.85-0.74(m,1h)和0.02(s,6h)。
[0186]
13
c-nmr(dmso-d6):166.4,156.0,153.6,87.6,85.6,70.4,62.7,40.6,17.3,14.3和-4.14。
[0187]
质量:329.4[m+h]
+
(c
13h24
n4o4si计算值,mw=328.16)。
[0188]
化合物h:5
’‑
o-(异丙基二乙基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷:5
’‑
o-(i-propyldiethylsilyl)-5-aza-2
’‑
deoxycytidine(在式(i)中,r1=异丙基二乙基甲硅烷基,r2=h)(合成条件。分离方法:反应时间:约1小时,柱洗脱溶剂:乙酸乙酯-甲醇体系,分离产率:56%)
[0189]1h-nmr(dmso-d6):8.42(s,1h),7.55(br s,1h),7.53(br s,1h),6.05(t,j=6.4hz,1h),5.30(d,j=4.4hz,1h),4.24(q,j=4.4hz,1h),3.90-3.72(m,3h),2.29-2.07(m,2h),0.99-0.88(m,13h)和0.68-0.55(m,4h)。
[0190]
13
c-nmr(dmso-d6):166.4,155.9,153.6,87.7,85.6,70.4,63.0,40.6,17.6,12.5,7.34和3.00。
[0191]
质量:357.4[m+h]
+
(c
15h28
n4o4si计算值,mw=356.19)。
[0192]
化合物i:5
’‑
o-(环戊基二甲基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷:5
’‑
o-(c-pentyldimethylsilyl)-5-aza-2
’‑
deoxycytidine(在式(i)中,r1=环戊基二甲基甲硅烷基,r2=h)(合成条件、分离方法:反应时间:约0.5小时,柱洗脱溶剂:乙酸乙酯-甲醇体系,分离产率:13%)
[0193]1h-nmr(dmso-d6):8.39(s,1h),7.49(s,2h),6.00(t,j=6.4hz,1h),5.25(d,j=4.8hz,1h),4.15(q,j=4.0hz,1h),3.86-3.63(m,3h),2.02-2.24(m,2h),1.17-1.72(m,8h),0.94(dq,j=8.4和2.0hz,1h)和0.01(s,6h)。
[0194]
13
c-nmr(dmso-d6):166.4,156.0,153.6,87.6,85.7,70.5,62.7,40.4,27.5,27.2,25.7和-3.2。
[0195]
质量:355.5[m+h]
+
(c
15h26
n4o4si计算值,mw=354.17)。
[0196]
化合物j:5
’‑
o-(环己基二甲基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷:5
’‑
o-(c-hexyldimethylsilyl)-5-aza-2
’‑
deoxycytidine(在式(i)中,r1=环己基二甲基甲硅烷基,r2=h)(合成条件、分离方法:反应时间:约1小时,柱洗脱溶剂:乙酸乙酯-甲醇体系,分
离产率:53%)
[0197]1h-nmr(dmso-d6):8.37(s,1h),7.49(s,2h),5.99(t,j=6.2hz,1h),5.24(d,j=4.8hz,1h),4.15(q,j=4.4hz,1h),3.62-3.85(m,3h),2.03-2.25(m,2h),1.52-1.70(m,5h),0.96-1.20(m,5h),0.64(dt,j=12.4和3.2hz,1h)和0.00(s,6h)。
[0198]
13
c-nmr(dmso-d6):166.4,156.0,153.6,87.7,85.8,70.5,62.8,40.4,27.8,26.9,26.8,26.3和-3.73。
[0199]
质量:369.4[m+h]
+
(c
16h28
n4o4si计算值,mw=368.19)。
[0200]
化合物k:5
’‑
o-(环戊基二乙基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷:5
’‑
o-(c-pentyldiethylsilyl)-5-aza-2
’‑
deoxycytidine(在式(i)中,r1=环戊基二乙基甲硅烷基,r2=h)(合成条件、分离方法:反应时间:约1小时,柱洗脱溶剂:乙酸乙酯-甲醇体系,分离产率:31%)
[0201]1h-nmr(dmso-d6):8.43(s,1h),7.55(s,2h),6.05(t,j=6.2hz,1h),5.30(d,j=3.6hz,1h),4.23(br s,1h),3.69-3.92(m,3h),2.04-2.35(m,2h),1.25-1.83(m,8h),0.83-1.15(m,6h),1.04(m,1h)和0.61(q,j=4.0hz,4h)。
[0202]
13
c-nmr(dmso-d6):166.5,155.9,153.6,87.8,85.7,70.5,63.1,41.5,27.6,27.1,24.0,7.4和3.9。
[0203]
质量:383.3[m+h]
+
(c
17h30
n4o4si计算值,mw=382.20)。
[0204]
实施例3
[0205]3’‑
甲硅氧基-5-氮杂-2
’‑
脱氧胞苷类的合成
[0206][0207]
向3’,5
’‑
二甲硅氧基-5-氮杂-2
’‑
脱氧胞苷(在式(i)中:r1和r2是甲硅烷基的化合物)(1mm)的无水环戊基甲基醚溶液(10ml)中添加樟脑磺酸(1mm),室温下搅拌约1天。将反应液用小苏打溶液中和,过滤不可溶物质,然后将滤液在减压下干燥而获得的油状残余物用硅胶柱(yamazen smart flash ms系统)分离纯化,从而可分离呈白色粉末的目标化合物3’位甲硅氧基-5-氮杂-2
’‑
脱氧胞苷衍生物(式(i)中,r1是氢原子,r2是甲硅烷基的化合物)。这在下文中称为合成法a。
[0208]
另外,向上述3’,5
’‑
二甲硅氧基-5-氮杂-2
’‑
脱氧胞苷(在式(i)中:r1和r2是甲硅烷基的化合物)(1mm)的无水异丙醇溶液(10ml)中加入催化剂量的can(硝酸铈铵,cerium ammonium nitrate),室温下搅拌约1天,由此也可以得到目标化合物3
’‑
甲硅氧基-5-氮杂-2
’‑
脱氧胞苷衍生物(式(i)中,r1是氢原子,r2是甲硅烷基的化合物)。这在下文中称为合成
法b。
[0209]
化合物l:3
’‑
o-(三乙基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷:3
’‑
o-(triethylsilyl)-5-aza-2
’‑
deoxycytidine(在式(i)中,r1=h,r2=三乙基甲硅烷基)(合成条件、分离方法:反应时间:约1天,柱洗脱溶剂:乙酸乙酯-甲醇体系,分离产率:29%(合成法a),50%(合成法b))
[0210]1h-nmr(dmso-d6):8.48(s,1h),7.54(br s,1h),7.51(br s,1h),6.01(t,j=6.4hz,1h),5.10(t,j=5.2hz,1h),4.39-4.42(m,1h),3.81(q,j=3.6hz,1h),3.57-3.63(m,1h),3.51-3.55(m,1h),2.15-2.28(m,2h),0.92(t,j=8.4hz,9h)和0.58(q,j=7.6hz,6h)。
[0211]
13
c-nmr(dmso-d6):165.8,155.9,153.1,87.7,85.1,71.3,60.6,40.7,6.6和4.1。
[0212]
质量:343[m+h]
+
(c
14h26
n4o4si计算值,mw=342.17)。
[0213]
化合物m:3
’‑
o-(正丙基二甲基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷:5
’‑
o-(n-propyldimethylsilyl)-5-aza-2
’‑
deoxycytidine(在式(i)中,r1=h,r2=正丙基二甲基甲硅烷基)(合成条件、分离方法:反应时间:约1.5小时,柱洗脱溶剂:乙酸乙酯-甲醇体系,分离产率:10%(合成法a))
[0214]1h-nmr(dmso-d6):8.48(s,1h),7.53(br s,1h),7.51(br s,1h),5.99(t,j=6.4hz,1h),5.09(br s,1h),4.38-4.41(m,1h),3.79(q,j=4.0hz,1h),3.60(br d,j=12.4hz,1h),3.51(br d,j=12.4hz,1h),2.14-2.25(m,2h),1.29-1.37(m,2h),0.94(t,j=7.2hz,3h),0.56-0.60(m,2h)和0.10(s,6h)。
[0215]
13
c-nmr(dmso-d6):165.9,155.9,153.1,87.5,85.1,71.1,60.5,18.6,17.9,16.2和-1.6。
[0216]
质量:329[m+h]
+
(c
13h24
n4o4si计算值,mw=328.16)。
[0217]
化合物n:3
’‑
o-(异丙基二甲基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷:3
’‑
o-(i-propyldimethylsilyl)-5-aza-2
’‑
deoxycytidine(在式(i)中,r1=h,r2=异丙基二甲基甲硅烷基)(合成条件、分离方法:反应时间:约3小时,柱洗脱溶剂:乙酸乙酯-甲醇体系,分离产率:17%(合成法a))
[0218]1h-nmr(dmso-d6):8.48(s,1h),7.53(br s,1h),7.51(br s,1h),6.01(t,j=6.4hz,1h),5.09(t,j=5.2hz,1h),4.39-4.42(m,1h),3.80(q,j=3.6hz,1h),3.58-3.81(m,1h),3.51-3.55(m,1h),2.17-2.26(m,2h),0.93(br s,3h),0.92(br s,3h),0.81-0.86(m,1h)和0.07(s,6h)。
[0219]
13
c-nmr(dmso-d6):165.9,155.9,153.1,87.5,85.0,71.2,60.5,40.5,16.7,13.8,-3.9和-4.0。
[0220]
质量:329[m+h]
+
(c
13h24
n4o4si计算值,mw=328.16)。
[0221]
试验例1
[0222]
5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物对胞苷脱氨酶的稳定性
[0223]
将约1mg的5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物(参照式(i))溶解于1ml的乙腈中,将10μl的该溶液加入至1ml的pbs,向所获得的溶液中加入10μl的胞苷脱氨酶的pbs溶液,并在37℃下搅拌约1小时。向该反应液中加入1ml的乙腈,离心分离,对上清液进行hplc分析。表1示出了例如5
’‑
o-(三乙基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷(化合物f)时的
分析结果。
[0224]
胞苷脱氨酶:cda(1-146aa),his标记的人类重组胞苷脱氨酶(atgen公司)
[0225]
hplc测定条件:
[0226]
柱:capcell pak adme
[0227]
4.6mm
×
150mm,粒径:3μm
[0228]
洗脱:洗脱液a=含有10mm甲酸铵的纯化水
[0229]
洗脱液b=乙腈
[0230]
梯度模式:a:b=99∶1
→
5∶95、30分钟
[0231]
流速:1.0ml/分钟
[0232]
箱温:40℃
[0233]
检测器:uv240nm
[0234]
(表1)
[0235][0236]
因此,本发明的5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物(参照式(i))对胞苷脱氨酶是极其稳定的。另一方面,5-氮杂-2
’‑
脱氧胞苷在上述反应条件下完全消失。
[0237]
试验例2
[0238]
5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物的非酶促水解
[0239]
将约1mg的5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物(参照式(i))例如5
’‑
o-(三乙基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷(化合物f)溶解于1ml的乙腈中,将5μl的该溶液加入至100μl的10mm pbs溶液,并在37℃下搅拌。通过hplc经时分析该反应物,结果确认了对应的去甲硅烷基化物(5-氮杂-2
’‑
脱氧胞苷:在式(i)中,r1和r2是氢原子)的生成,几乎没有观察到其他分解产物的生成。
[0240]
hplc测定条件与试验例1中的相同。
[0241]
(表2)
[0242][0243]
试验例3
[0244]
5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物的抗cml和抗tki耐药性cml活性
[0245]
将下表中的cml细胞系(bv173,myl,ba/f3 bcr-abl
wt
)和tki耐药性cml细胞系(myl-r,ba/f3 bcr-abl
t315i
)在培养液(10%fbs和rpmi-1640)中以3,000~7,000个细胞/100μl/孔接种于96孔板,在5%二氧化碳气流中,37℃温度下培养约3小时。接着,以成为50μm~0.05μm(myl,ba/f3 bcr-abl
wt
,myl-r,ba/f3 bcr-abl
t315i
)和500nm~0.1nm(bv173)的
方式用培养液稀释的各化合物分别添加100μl至上述96孔板,培养24小时后,进行离心分离(4℃,1500rpm,5分钟),去除上清液的培养液,再次分别添加100μl用培养液稀释的化合物。进一步培养24小时(共48小时)后,重复相同的操作。进一步培养24小时(共72小时)后,使用cck-8试剂(dojindo、ck04)按照所附的手册进行反应后,用读板仪(varioskan flash,thermo fisher scientific公司)测定各孔的450nm和620nm(空白)的吸收。将未添加样品孔的值设为100%时的各样品处理孔的值以相对值表示,算出ic
50
(μm)值(参照表3-1)。另外,分别算出了myl株与myl-r株的ic
50
比值和ba/f3bcr-abl
wt
株与ba/f3 bcr-abl
t315i
株的ic
50
比值。
[0246]
(表3-1)
[0247][0248]
(表3-2)
[0249][0250]
myl-r株是过度表达lyn的myl株,另外,ba/f3 bcr-abl
t315i
株是向ba/f3 bcr-abl
wt
株导入了ablt315i变异的株,均获得了tki耐药性。由表3-1和表3-2的结果可知,5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物(例如,化合物f:5
’‑
o-(三乙基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷)具有非常高的抗cml活性和抗tki耐药性cml活性。另外,该化合物f对myl-r株的抗cml活性大大高于5-氮杂胞苷,与5-氮杂-2
’‑
脱氧胞苷类似。
[0251]
试验例4
[0252]
5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物的dna去甲基化效果
[0253]
使用焦磷酸测序技术测定line-1(长散在核苷酸因子-1,long interspersed nucleotide factor-1)的cpg岛胞嘧啶部分甲基化的比率。
[0254]
向含有bv173细胞株(约50,000个/ml)的溶液添加0.1nm或1.0nm、5.0nm、10.0nm、50.0nm浓度的5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物(例如,化合物f:5
’‑
o-(三乙基甲硅烷基)-5-氮杂-2
’‑
脱氧胞苷)溶液,在rpmi-1640(含有10%fbs和penn-strep)培养基中培养72小时后,从细胞中提取dna,用亚硫酸氢盐处理后,测定line-1的cpg甲基化率(参照表4)。
[0255]
(表4)
[0256]
处理后的化合物浓度甲基化比率未处理 89.7%(
±
6.8)
化合物f0.1nm89.3%(
±
7.13)化合物f1.0nm89.7%(
±
7.41)化合物f5.0nm88.0%(
±
6.68)化合物f10.0nm82.3%(
±
4.92)化合物f50.0nm60.0%(
±
3.74)
[0257]
结果显示,5-氮杂-2
’‑
脱氧胞苷的糖部分甲硅烷基醚衍生物(参照式(i))对bv173株具有去甲基化作用。
[0258]
产业上利用可能性
[0259]
通过本发明,能够为医学领域提供一种对代谢酶胞苷脱氨酶具有高稳定性的dnmt抑制剂作为新的tki耐药性cml治疗药或预防药。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1