减轻FKRP心脏毒性的基因治疗表达系统
减轻fkrp心脏毒性的基因治疗表达系统
技术领域
1.本发明基于fkrp(fukutin相关蛋白)转基因表达的心脏毒性的鉴定。它提供了一种用于减轻心脏中fkrp毒性的表达系统,特别是通过调节,即部分去靶向(detarget)fkrp心脏表达。然后,它为与fkrp缺陷相关的各种疾病(例如肢带型肌营养不良症2i型(lgmd2i)、新命名的肢带型肌营养不良症r9型(lgmd2 r9))的治疗提供了有价值且安全的治疗工具。
背景技术:
[0002]“肌营养不良蛋白聚糖病(dystroglycanopathies)”对导致α-肌营养不良蛋白聚糖(α-dystroglycan,αdg)的继发性异常糖基化的不同遗传病理进行了重新组合。这种蛋白质主要存在于骨骼肌、心脏、眼睛和脑组织中,是一种高度糖基化的膜蛋白,糖基化过程将其在肌肉中的重量从70kda提高到156kda。它是肌营养不良蛋白-糖蛋白复合物的一部分,将细胞骨架连接到细胞外基质(ecm)。其高糖基化水平使αdg能够直接与一些ecm蛋白(例如心肌和骨骼肌中的层粘连蛋白、神经肌肉接头处的集聚蛋白(agrin)和基底膜蛋白多糖(perlecan)、大脑中的神经粘联分子(neurexin)和视网膜中的皮卡丘素(pikachurin))的层粘连蛋白球状结构域结合。αdg的糖基化是一种尚未完全了解的复杂过程。事实上,许多基因已被鉴定为参与αdg糖基化。由于使用高通量测序方法对显示αdg糖基化缺陷的患者进行突变检测,这些发现最近得到了加速。其中一种蛋白质是fukutin相关蛋白(fkrp)。它最初被归类为推定的αdg糖基转移酶,因为它的序列中存在许多糖基转移酶共有的dxd基序,以及在fkrp基因突变的患者中存在αdg低糖基化的证据(breton等人,1999;brockington等人,2001)。最近,fkrp及其同源物fukutin被鉴定为核糖醇-5-磷酸(rbo5p)转移酶,形成添加配体结合部分所必需的di-rbo5p接头(kanagawa等人,2016)。
[0003]
从肢带型肌营养不良症2i型(lgmd2i;muller等人,2005;新名称:肢带型肌营养不良症r9型或lgmd2 r9)、先天性肌营养不良症1c型(mdc1c;brockington等人,2001)到walker-warburg综合征(wws)和肌肉-眼-脑病(meb;beltran-valero de bernabe等人,2004),fkrp基因中的突变可以产生由αdg糖基化缺陷导致的全部病理范围。疾病严重程度与患者数量呈负相关,越严重,患者越少(患病率见www.orphanet.fr:wws(all genes):1-9/1,000,000and lgmd2i:1-9/100,000)。病理类型似乎至少部分与fkrp突变的性质相关。特别是,在蛋白质的276位用异亮氨酸替换亮氨酸的纯合l276i突变总是与lgmd2i相关(mercuri等人,2003)。lgmd2i是一种隐性常染色体肌营养不良症,虽然不均一,但优先影响肩部和骨盆带的肌肉。它是欧洲最常见的lgmd2之一,特别是由于北欧l276i突变的高患病率(sveen等人,2006)。病理的严重程度非常不均一。肌肉症状可能出现在1-30岁之间,从杜兴氏样病到相对良性的病程不等。心脏也可能受到严重心力衰竭和死亡等后果的影响(muller等人,2005)。使用心脏磁共振成像的研究表明,非常高比例的lgmd2i患者(60-80%)会出现心肌功能障碍,例如射血分数降低(wahbi等人,2008)。有趣的是,心脏异常的严重程度与骨骼肌受累无关。基于7名患者的队列,rosales等人(2011)得出结论,lgmd2i通
常会导致轻微的结构和功能性心脏异常,尽管可能会出现严重的扩张型心肌病(一名患者)。petri等人(2015)还观察到,在lgmd2患者中,lgmd 2i型患者(n=28)的lvef(左心室射血分数)从59%(15-72)显著下降至55%(20-61),p=0.03,即每年下降0.4%,并且lvef≤50%与该亚组中死亡率增加相关。
[0004]
gicquel等人(hum mol genet,2017mar 3.doi:10.1093/hmg/ddx066)报道了fkrp
l276i
小鼠模型的产生,其中评估了置于结蛋白启动子和β-血红蛋白(hbb2)基因的多聚腺苷酸化(polya)信号的控制下的鼠fkrp基因的重组腺相关病毒(raav2/9)转移。在肌肉内或静脉内递送后,观察到肌肉病理的改善。它们在mrna和蛋白质水平上获得了fkrp的强表达,并显示了αdg适当糖基化的拯救和层粘连蛋白结合的增加,这导致了营养不良症的组织学和功能性拯救。如在wo2019/008157中所报道的,该构建体的肌肉效率仍然可以通过使用具有突变的fkrp编码序列来提高,从而避免由移码起始密码子产生的补充转录物。
[0005]
因此,基于fkrp的基因替代疗法似乎是对fkrp缺陷引起的病理的一种有希望的治疗。然而,仍然需要安全有效的治疗。
[0006]
关于基因疗法,安全表达系统被定义为确保在靶组织中产生治疗有效量的蛋白质的表达系统,即在需要所述蛋白质以治愈与天然蛋白质缺陷相关的异常的组织中,而没有任何毒性,特别是在基本和重要的器官或组织中。
[0007]
例如,关于神经肌肉疾病,wo2014/167253报道了编码肌微管素(myotubularin)和钙蛋白酶(calpain)3的表达系统在全身施用时具有心脏毒性,而通过在所述构建体中引入在心脏中表达的mirna的靶序列或通过使用在心脏中呈现毒性上可接受的水平的启动子活性或甚至没有活性的启动子序列可以减轻所述毒性。
技术实现要素:
[0008]
本发明旨在通过提供一种确保在靶组织(主要是骨骼组织)中产生治疗有效量的蛋白质并在心脏中产生毒性上可接受的量的蛋白质的表达系统来减轻或治愈与fukutin相关蛋白(fkrp)缺陷相关的破坏性病理,如肢带型肌营养不良症2i型(lgmd2i)。
[0009]
实际上,发明人已经检测到编码fkrp的表达系统的潜在心脏毒性。这是意料之外的,因为患有与fukutin相关蛋白(fkrp)缺陷相关的病理的患者,例如肢带型肌营养不良症2i型(lgmd2i)也经常表现出心脏异常。因此,根据常识,心脏中持续水平的fkrp表达被认为是有益的,特别是减轻fkrp相关疾病的心脏症状。
[0010]
值得注意的是,提供了候选基因和相关病理的列表的文件wo2014/167253对fkrp完全没有提及。另一方面,文件wo2016/138387仅提到了fkrp的推定肝毒性以及在表达系统中可能使用mir122靶序列以降低肝脏中的表达。最后,文件wo2019/008157公开了添加mirna靶序列以抑制组织中的表达的可能性,在这些组织中表达是不希望的,甚至是有毒的,但不鼓励去靶向(detarget)心脏。
[0011]
定义
[0012]
除非另有定义,否则本文所用的所有技术和科学术语具有与本领域普通技术人员通常理解的相同含义。描述中使用的术语仅出于描述特定实施方案的目的,并不旨在进行限制。
[0013]
冠词“一个/一种(a)”和“一个/一种(an)”在本文中用于指代冠词的语法对象中的
一个或多于一个(即,至少一个)。举例来说,“一个要素”是指一个要素或多于一个要素。
[0014]
在提及可测量的值(例如数量、持续时间等)时,本文所用的“约/大约(about)”或“约/大约(approximately)”是指涵盖指定值的
±
20%或
±
10%、更优选
±
5%、甚至更优选
±
1%、并且还更优选
±
0.1%的变化,因为这样的变化适合于执行所公开的方法。
[0015]
范围:在整个本公开中,本发明的各个方面可以以范围格式呈现。应当理解,范围格式的描述仅仅是为了方便和简洁,不应被解释为对本发明范围的不可更改的限制。因此,范围的描述应该被认为已经具体公开了所有可能的子范围以及该范围内的各个数值。例如,对诸如从1到6的范围的描述应该被认为已经具体公开了子范围,例如从1到3、从1到4、从1到5、从2到4、从2到6、从3到6等,以及该范围内的各个数字,例如1、2、2.7、3、4、5、5.3和6。无论范围的广度如何,这都适用。
[0016]“分离的”是指从天然状态改变或取出。例如,活体动物中天然存在的核酸或肽不是“分离的”,而从其天然状态的共存材料部分或完全分离的相同核酸或肽是“分离的”。分离的核酸或蛋白质可以以基本上纯化的形式存在,或者可以存在于非天然环境(例如宿主细胞)中。
[0017]
在本发明的背景中,使用以下常见核酸碱基的缩写。“a”是指腺苷,“c”是指胞嘧啶,“g”是指鸟苷,“t”是指胸苷,“u”是指尿苷。
[0018]“编码氨基酸序列的核苷酸序列”包括彼此为简并版本并且编码相同氨基酸序列的所有核苷酸序列。编码蛋白质或rna或cdna的短语核苷酸序列也可以包括内含子,以至于编码蛋白质的核苷酸序列在一些版本中可以包含内含子。
[0019]“编码”是指多核苷酸(例如基因、cdna或mrna)中的特定核苷酸序列用作合成生物过程中的具有限定的核苷酸序列(即rrna、trna和mrna)或限定的氨基酸序列的其他聚合物和大分子的模板的固有特性以及由此产生的生物学特性。因此,如果基因所对应的mrna能在细胞或其他生物系统中转录和翻译产生蛋白质,则该基因编码蛋白质。编码链(其核苷酸序列与mrna序列相同,通常在序列表中提供)和非编码链(用作基因或cdna转录的模板)都可以称为编码蛋白质或该基因或cdna的其他产物。
[0020]
如本文所用的术语“多核苷酸”被定义为核苷酸链。此外,核酸是核苷酸的聚合物。因此,本文所用的核酸和多核苷酸是可互换的。本领域技术人员的常识是,核酸是可以水解成单体“核苷酸”的多核苷酸。单体核苷酸可以水解成核苷。如本文所用,多核苷酸包括但不限于通过本领域可用的任何方法(包括但不限于重组方法,即使用普通克隆技术和pcr等从重组文库或细胞基因组中克隆核酸序列,以及通过合成方法)获得的所有核酸序列。
[0021]
如本文所用,术语“肽”、“多肽”和“蛋白质”可互换使用,是指由通过肽键共价连接的氨基酸残基组成的化合物。蛋白质或肽必须包含至少两个氨基酸,并且对可以构成蛋白质或肽序列的氨基酸的最大数目没有限制。多肽包括包含通过肽键彼此连接的两个或更多个氨基酸的任何肽或蛋白质。如本文所用,该术语既指短链,其在本领域中也通常称为例如肽、寡肽和寡聚体,也指更长链,其在本领域中通常称为蛋白质,其中有很多类型。“多肽”包括例如生物活性片段、基本上同源的多肽、寡肽、同二聚体、异二聚体、多肽的变体、修饰的多肽、衍生物、类似物、融合蛋白等。多肽包括天然肽、重组肽、合成肽或其组合。
[0022]
蛋白质可能会被“改变”并包含氨基酸残基的缺失、插入或取代,这种氨基酸残基的缺失、插入或取代产生沉默的变化并导致功能等同。只要保留生物活性,可以基于残基的
极性、电荷、溶解性、疏水性、亲水性和/或两亲性质的相似性进行有意的氨基酸取代。例如,带负电荷的氨基酸可以包括天冬氨酸和谷氨酸;带正电荷的氨基酸可以包括赖氨酸和精氨酸;具有相似亲水性值的含有不带电荷的极性头基团的氨基酸可以包括亮氨酸、异亮氨酸和缬氨酸、甘氨酸和丙氨酸、天冬酰胺和谷氨酰胺、丝氨酸和苏氨酸以及苯丙氨酸和酪氨酸。
[0023]
如本文所用,“变体”是指被一个或多个氨基酸改变的氨基酸序列。变体可以具有“保守”变化,其中取代的氨基酸具有相似的结构或化学性质,例如用异亮氨酸替换亮氨酸。变体也可以具有“非保守”变化,例如用色氨酸替换甘氨酸。类似的微小变化也可以包括氨基酸缺失或插入或两者。可以使用本领域众所周知的计算机程序找到确定哪些氨基酸残基可以被取代、插入或缺失而不消除生物学或免疫学活性的指导。
[0024]“同一的”或“同源的”是指两个多肽之间或两个核酸分子之间的序列同一性或序列相似性。当所比较的两个序列的每一个中的一个位置被相同的碱基或氨基酸单体亚基占据时,例如,如果两个dna分子的每一个中的一个位置被腺嘌呤占据,那么分子在该位置是同源的或同一的。两个序列之间的同源性/同一性百分比是两个序列共有的匹配位置数除以所比较的位置数乘以100的函数。例如,如果两个序列的10个位置中有6个匹配,则两个序列是60%同一的。通常,当比对两个序列时进行比较,以获得最大同源性/同一性。
[0025]“载体”是包含分离的核酸并且可用于将分离的核酸递送至细胞内部的物质组合物。许多载体是本领域已知的,包括但不限于线性多核苷酸、与离子或两亲化合物相关的多核苷酸、质粒和病毒。因此,术语“载体”包括自主复制的质粒或病毒。该术语还应当被解释为包括促进核酸转移到细胞中的非质粒和非病毒化合物,例如聚赖氨酸化合物、脂质体等。病毒载体的实例包括但不限于腺病毒载体、腺相关病毒载体、逆转录病毒载体等。
[0026]“表达载体”是指包含重组多核苷酸的载体,其包含与待表达的核苷酸序列可操作地连接的表达控制序列。表达载体包含足够的用于表达的顺式作用元件;用于表达的其他元件可以由宿主细胞或在体外表达系统中提供。表达载体包括本领域已知的所有那些,例如掺入重组多核苷酸的粘粒、质粒(例如,裸露的或包含在脂质体中)和病毒(例如,慢病毒、逆转录病毒、腺病毒和腺相关病毒)。
[0027]
如本文所用的术语“启动子”被定义为由细胞的转录机制或引入的转录机制识别的dna序列,这对于启动多核苷酸序列的特异性转录是必需的。
[0028]
如本文所用,术语“启动子/调控序列”是指与启动子/调控序列可操作地连接的基因产物的表达所需的核酸序列。在一些情况下,该序列可以是核心启动子序列,而在其他情况下,该序列还可以包括基因产物的表达所需的增强子序列和其他调控元件。启动子/调控序列可以例如是一种以组织特异性方式表达基因产物的序列。
[0029]“组成型”启动子是一种核苷酸序列,当其与编码或指定基因产物的多核苷酸可操作地连接时,导致基因产物在细胞的大部分或所有生理条件下在细胞中产生。
[0030]“诱导型”启动子是一种核苷酸序列,当其与编码或指定基因产物的多核苷酸可操作地连接时,基本上仅当细胞中存在与该启动子相对应的诱导物时,才会导致基因产物在该细胞中产生。
[0031]“组织特异性”启动子是一种核苷酸序列,当其与编码基因或由基因指定的多核苷酸可操作地连接时,如果细胞是与该启动子相对应的组织类型的细胞,则导致基因产物优
串联的每个细胞核的载体拷贝数(vcn)。
[0046]
图6:注射pbs(缓冲液)、aav-fkrp、av-fkrp-单个或aav-fkrp-串联2周后对大鼠心脏中的fkrp mrna(a)或蛋白质(b)的评估。星号(*)表示统计学差异。
[0047]
图7:在以剂量7.5e13 vg/kg注射aav-fkrp、aav-fkrp-单个或aav-fkrp-串联(如所示)和hes染色(顶部,比例=50μm)或天狼星红染色(底部)后第15天的大鼠心肌组织学分析)。
[0048]
图8:在注射pbs(缓冲液)、aav-fkrp、av-fkrp-单个或aav-fkrp-串联2周后,对大鼠ta肌肉中的fkrp mrna(a)或蛋白质(b)的评估。
[0049]
图9:注射av-fkrp-单个或aav-fkrp-串联的大鼠的体重曲线。
[0050]
图10:在以剂量7.5e13 vg/kg注射aav-fkrp-单个和aav-fkrp-串联和hes染色(顶部,比例=50μm)或天狼星红染色(底部)后11周的大鼠心肌组织学分析。
具体实施方式
[0051]
本发明基于发明人的发现,即在全身施用后,旨在在骨骼肌中以高水平产生fkrp蛋白的表达系统可同时导致在心脏中的表达具有潜在毒性,从而使所述系统不适合用于治疗用途。
[0052]
本发明为这个新发现的问题提供了技术解决方案,特别是关于除了fkrp转基因的骨骼肌表达之外的过度心脏渗漏。
[0053]
因此,一般而言,本发明涉及包含编码fkrp蛋白的序列的表达系统,所述表达系统允许:
[0054]-蛋白质在靶组织中(有利地在骨骼肌中)以治疗上可接受的水平表达;和
[0055]-蛋白质在所有组织中(特别是在心脏中)以毒性上可接受的水平表达。
[0056]
在本发明的框架中,表达系统通常被定义为允许体内产生fkrp的多核苷酸。根据一方面,所述系统包含编码fkrp蛋白的核酸以及其表达所需的调控元件(至少包含启动子)。所述表达系统然后可以对应于表达盒。或者,所述表达盒可以由载体或质粒携带。本文中使用的“表达系统”一词覆盖了所有方面。
[0057]
根据本发明,靶组织被定义为蛋白质将在其中发挥治疗作用的组织或器官,尤其是在编码该蛋白质的天然基因有缺陷的情况下。根据本发明的特定实施方案,靶组织指横纹骨骼肌,以下称为骨骼肌,即运动能力中涉及的所有肌肉和膈肌。其他潜在的靶组织是视网膜和大脑。
[0058]
如上所述,心脏也会受到与fkrp缺陷相关的各种疾病的影响,因此也是潜在的靶组织。然而,在本技术的框架中,据显示,fkrp在过表达时可显示心脏毒性。因此,关于基因转移,表达系统应该有利于fkrp在心脏中以毒性上可接受的水平而不是以治疗上可接受的水平表达,因为可以使用不同的策略(例如β-阻断剂利尿剂或ace(血管紧张素转化酶)抑制剂)治疗心脏异常。
[0059]
如本技术中所证明的,即使fkrp可以在心脏中发挥治疗作用,它的表达水平也应该受到严格调节,因为这种蛋白质在该组织中的过量(尤其是超过内源量的量)可能证明是有害的甚至是致命的,因此是有毒的。
[0060]
因此,在本发明的背景中,必须保护心脏免受这种潜在毒性的危害。根据特定实施
方案,本发明的表达系统确保fkrp在心脏中以毒性上可接受的蛋白质水平表达。
[0061]
因此,根据特定方面,本发明涉及包含编码fkrp蛋白的序列的表达系统,所述表达系统允许:
[0062]-蛋白质在包括骨骼肌和可能的视网膜和大脑在内的靶组织中以治疗上可接受的水平表达;和
[0063]-蛋白质在所有组织中(特别是在心脏中)以毒性上可接受的水平表达。
[0064]
有利地,本发明涉及用于全身施用的表达系统,所述表达系统包含编码fkrp蛋白的序列,其中:
[0065]-fkrp在骨骼肌中以治疗上可接受的水平表达;和
[0066]-fkrp在心脏中以毒性上可接受的水平表达。
[0067]
根据第一个特征,本发明的表达系统包含编码fkrp蛋白的序列,所述序列对应于转基因。在本发明的背景中,术语“转基因”是指使用本发明的表达系统反式提供的序列,优选开放阅读框。
[0068]
根据特定实施方案,该序列是引入表达系统的相同或等同于机体基因组中存在的内源序列的拷贝。
[0069]
根据另一个特定实施方案,所述内源序列具有一个或多个使蛋白质部分或完全无功能或甚至不存在(缺乏内源蛋白质的表达或活性)或未正确定位在期望的亚细胞区室中的突变。换言之,优选地,本发明的表达系统旨在施用于具有编码蛋白质的序列的缺陷拷贝并具有相关病理的受试者。在该背景中,由本发明的表达系统携带的序列编码的蛋白质因此可以被定义为其突变导致与fkrp缺陷相关的病理的蛋白质。
[0070]
因此,更一般地,本发明的表达系统携带的序列可以被定义为编码在与fkrp缺陷相关的病理的背景中具有治疗活性的蛋白质。治疗活性的概念结合术语“治疗上可接受的水平”被定义如下。
[0071]
编码fkrp蛋白的序列(也称为“开放阅读框”的orf)是核酸序列或多核苷酸,尤其可以是单链或双链dna(脱氧核糖核酸)、rna(核糖核酸)或cdna(互补脱氧核糖核酸)。
[0072]
有利地,所述序列编码功能性蛋白质,即能够确保其天然或基本功能的蛋白质,尤其是在骨骼肌中。这意味着使用本发明的表达系统产生的蛋白质被适当地表达和定位,并且是有活性的。
[0073]
根据优选实施方案,所述序列编码天然蛋白质,所述蛋白质优选是人类来源的。它也可以是该蛋白质的衍生物或片段,只要衍生物或片段保留所需的活性。优选地,术语“衍生物”或“片段”是指与人fkrp序列具有至少60%、优选70%、甚至更优选80%或甚至90%、95%或99%同一性的蛋白质序列。例如,来自另一来源(非人类哺乳动物等)的蛋白质或截短的、甚至突变的但有活性的蛋白质也包含在内。因此,在本发明的背景中,术语“蛋白质”被理解为全长蛋白质(无论其来源如何),以及其功能衍生物和片段。
[0074]
在特定方面,由根据本发明的表达系统治疗的疾病是由至少一种基因中的突变引起的,该突变导致不产生fkrp蛋白或产生完全或部分无功能的蛋白质。根据本发明,表达系统有助于以至少部分地补偿天然蛋白质缺乏的活性形式或量产生该蛋白,或者产生能够补偿天然蛋白质缺乏的另一种蛋白质。因此,表达系统的施用可以在活动性和呼吸方面改善或恢复靶组织(特别是骨骼肌)中的正常表型。
[0075]
本发明的背景中的目的蛋白质有利地是人类来源的fkrp(seq id no:5),即使例如可以使用鼠、大鼠或犬的版本(其序列可从数据库中获得)。
[0076]
根据具体实施方案,fkrp蛋白是由seq id no:5中所示的序列组成或包含seq id no:5(对应于495个氨基酸的蛋白质)中所示的序列的蛋白质。根据具体实施方案,fkrp是与由seq id no:5编码的天然人类fkrp具有相同功能的蛋白质,尤其是使α-肌营养不良蛋白聚糖(αdg)糖基化和/或至少部分减轻一种或多种与fkrp缺陷相关的症状的能力,尤其是如上所述的lgmd2i表型。它可以是其片段和/或衍生物。根据一个实施方案,所述fkrp序列与序列seq id no:5具有大于或等于60%、70%、80%、90%、95%或甚至99%的同一性。
[0077]
任何编码这些蛋白质、其功能性治疗衍生物或片段的序列都可以作为本发明的表达系统的一部分来实施。举例来说,对应的核苷酸序列(cdna)是被鉴定为wo2019/008157中的序列seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:no:7或seq id no:8的序列。
[0078]
根据具体实施方案,编码fkrp的序列包含序列seq id no:1、seq id no:3或seq id no:4的核苷酸1659至3146或由序列seq id no:1、seq id no:3或seq id no:4的核苷酸1659至3146组成。
[0079]
以已知方式的fkrp基因突变可以产生由αdg糖基化缺陷引起的全部病理范围,从肢带型肌营养不良症2i型(lgmd2i;muller等人,2005)、先天性肌营养不良症1c型(mdc1c;brockington等人,2001)到walker-warburg综合征(wws)和肌肉-眼-脑病(meb;beltran-valero de bernabe等人,2004)。因此,根据用于替换或转移基因的策略,反式提供编码治疗性fkrp的序列(其例如是天然的)有助于治疗所述病理。
[0080]
本发明涉及fkrp,其突变导致一种或多种靶组织(尤其是骨骼肌)中的疾病,并且从表达系统产生的fkrp在至少一种组织(尤其是心脏)中表现出毒性。
[0081]
根据本发明,有利地,表达系统必须允许fkrp蛋白在骨骼肌中以治疗上可接受的水平表达。
[0082]
此外,根据另一个优选实施方案,它必须允许fkrp蛋白在心脏中以毒性上可接受的水平表达。
[0083]
在本发明的背景中,术语“蛋白质表达”可以理解为“蛋白质产生”。因此,表达系统必须允许蛋白质以上述水平进行转录和翻译。同样重要的是所述蛋白质的正确折叠和定位。
[0084]
在本发明的背景中定义的水平,即“治疗上可接受的”和“毒性上可接受的”,与蛋白质的量及其活性有关。
[0085]
可以通过使用针对所述蛋白质的抗体进行免疫检测(例如通过蛋白质印迹或elisa,或通过质谱法)对给定组织中产生的蛋白质的量进行评估。或者,可以对相应的信使rna进行定量,例如通过pcr或rt-pcr。这种定量可以在一种组织样本或几种样本上进行。因此,在靶组织是骨骼肌的情况下,它可以在一种肌肉类型或几种肌肉类型(例如四头肌、膈肌、胫骨前肌、三头肌等)上进行。
[0086]
在本发明的背景中,术语“治疗上可接受的水平”是指由本发明的表达系统产生的蛋白质有助于改善患者的病理状况(特别是在生活质量或寿命方面)的事实。因此,与影响骨骼肌的疾病有关,这涉及改善受疾病影响的受试者的肌肉状况或恢复与健康受试者相似
的肌肉表型。如上所述,主要由肌肉的力量、大小、组织学和功能限定的肌肉状态可以通过以下方法之一进行评估:活检,测量肌肉的力量、肌张力、体积或活动性,临床检查,医学影像学,生物标志物等。
[0087]
因此,有助于评估关于骨骼肌的治疗益处并且可以在治疗后的不同时间进行评估的标准特别是以下中的至少一种:
[0088]-增加的预期寿命;
[0089]-增加的肌肉力量;
[0090]-改善的组织学;和/或
[0091]-改善的膈肌功能。
[0092]
在本发明的背景中,术语“毒性上可接受的水平”是指由本发明的表达系统产生的蛋白质不会引起组织的显著改变(特别是在组织学、生理学和/或功能上)的事实。特别是,蛋白质的表达可能不是致命的。在一个特定实施方案中,在所述组织中产生的蛋白质的量必须不超过该组织中所述蛋白质的内源水平,特别是与健康受试者相比。可以从组织学、生理学和功能上评估组织中的毒性。
[0093]
在心脏的特定情况下,蛋白质的任何毒性都可以通过形态学和心脏功能的研究、临床检查、电生理学、影像学、生物标志物、预期寿命监测或组织学分析来评估,包括检测纤维化和/或细胞浸润和/或炎症,例如通过用天狼星红或苏木精(例如苏木精-伊红-藏红花(hes)或苏木精-根皮红(phloxin)-藏红花(hfs))染色。
[0094]
有利地,根据本发明的表达系统的功效和/或毒性水平在动物体内进行评估,可能在具有编码蛋白质的基因的缺陷拷贝并因此受到相关病理影响的动物中进行评估。优选地,表达系统被全身施用,例如通过静脉内(i.v.)注射。
[0095]
根据本发明,优选地,表达系统包含至少一个序列,其允许:
[0096]-阻止蛋白质在蛋白质表达具有毒性的组织中(特别是在心脏中)的表达或降低其表达水平;和/或
[0097]-维持蛋白质在靶组织中(特别是在骨骼肌中,并且可能在视网膜和/或大脑中)的表达或提高其表达水平。
[0098]
根据特定实施方案,本发明涉及一种表达系统,其中它包含至少一个序列:
[0099]-阻止fkrp在心脏中的表达或降低其表达水平;和/或
[0100]-维持fkrp在骨骼肌中的表达或提高其表达水平。
[0101]
在本发明的背景中,术语“阻止表达”优选是指甚至在没有所述序列的情况下没有表达的情况,而术语“降低表达水平”是指通过提供所述序列来降低(或减少)表达的情况。
[0102]
类似地,术语“维持表达”优选是指甚至在没有所述序列的情况下存在相当的表达水平的情况,而术语“提高表达水平”是指通过提供所述序列来提高表达的情况。
[0103]
在本发明的背景中,存在至少三种可以组合的方式来实现期望的目标:
[0104]-使用能够阻止蛋白质在蛋白质表达具有毒性的组织中的表达或降低其表达水平而不降低在靶组织中的表达水平的序列;
[0105]-使用能够确保在靶组织中的高表达水平并在蛋白质表达出现毒性的组织中低表达或不表达的启动子序列;
[0106]-使用具有合适趋向性的载体(优选病毒载体),即对靶组织的趋向性高于对蛋白
质表达出现毒性的组织的趋向性。
[0107]
根据一个方面,本发明涉及一种用于全身施用的表达系统,其包含编码fkrp蛋白的序列,和:
[0108]-允许在骨骼肌中以治疗上可接受的水平表达fkrp的启动子序列和在心脏中表达的mirna的靶序列;或
[0109]-允许在骨骼肌中以治疗上可接受的水平表达fkrp并在心脏中以毒性上可接受的水平呈现启动子活性的启动子序列。
[0110]
适当地,本发明的表达系统包含控制编码蛋白质的序列的转录的启动子序列,优选位于转基因的5’并且与其功能性连接。优选地,这确保了骨骼肌中的治疗上可接受的水平的蛋白质表达。
[0111]
这可以包括诱导型或组成型、天然或合成(人工)启动子。类似地,它们可以是任何来源,包括人类,与转基因具有相同来源或是其他来源。
[0112]
根据第一个实施方案,启动子序列对应于非选择性启动子,即具有低组织特异性并确保在不同组织中(可能在骨骼肌和心脏中)的广泛相似的表达水平的启动子。以下可以作为实例被引用:巨细胞病毒(cmv)、磷酸甘油酸激酶1(pgk)、ef1或cmv早期增强子/鸡β-肌动蛋白(cag)启动子。
[0113]
根据特定实施方案,这是指适合骨骼肌表达但可以在其他组织中,特别在其他肌肉中(例如在心脏中)引起表达的启动子序列。这样的启动子被认为是肌肉特异性的,但它们不是肌肉专有的。以下可以作为实例被引用:来自结蛋白启动子的启动子序列(优选为序列seq id no:6)、骨骼α-肌动蛋白启动子(acta1)、肌肉肌酸激酶(mck)启动子或肌球蛋白重链启动子及其衍生物(例如ck4和mhck7启动子)、或c5-12合成启动子。
[0114]
根据本发明的优选实施方案,出于其在不同组织中的不同启动子活性而选择表达系统的启动子序列。在这种情况下,该序列有助于提高蛋白质在骨骼肌中的表达,同时防止在蛋白质表达具有毒性的组织中(主要在心脏中)的表达。
[0115]
例如,在靶组织是骨骼肌的情况下,启动子优选是肌肉特异性启动子。根据另一个有利特征,所述启动子在心脏中具有低启动子活性或没有启动子活性,从而使蛋白质在该组织中的表达处于毒性上可接受的水平。更有利地,心脏中的低启动子活性是优选的。
[0116]
根据特定实施方案,所述启动子序列可以对应于来自钙蛋白酶3基因的启动子的序列,优选为人类来源,甚至更优选为序列seq id no:7。另一个合适的启动子序列是mirna 206(mir206)的启动子序列,优选为人类来源,更优选为序列seq id no:8。这2个启动子已在文件wo2014/167253中报道,能够确保钙蛋白酶3在骨骼肌中以治疗上可接受的水平表达,并且所述蛋白质在心脏中以毒性上可接受的水平表达。
[0117]
根据具体实施方案,本发明因此涉及一种表达系统,其包含编码fkrp蛋白的序列,所述序列置于具有序列seq id no:7或seq id no:8的启动子的控制下。衍生自序列seq id no:7和seq id no:8或对应于其片段但具有相似的启动子活性(特别是在组织特异性和可选地有效性方面)的启动子序列也被覆盖在本发明内。
[0118]
可以使用显示上述限定的表达谱的任何启动子,有利地在心脏中非常低但在骨骼肌中足够强或甚至非常强。
[0119]
候选启动子序列可以来源于已报道的在骨骼肌中具有高活性并且可能具有所需
的表达谱的基因,例如:
[0120]-γ-肌聚糖基因的启动子;
[0121]-骨骼α-肌动蛋白(acta1)启动子或其衍生版本;
[0122]-肌肉杂合(mh)启动子,如piekarowicz等人(2017,european society of gene&cell therapy conference,poster p096;human gene therapy 28:a44(2017),doi:10.1089/hum.2017.29055.abstracts)公开的;
[0123]-肌肉肌酸激酶启动子的衍生物,尤其是具有双(dmck)或三(tmck)串联mck增强子的截短的mck启动子,或ck6和ck8启动子,如hauser等人(2000,molecular therapy,vol.2,no 1,pages 16-24)和wang等人(2008,gene therapy,vol.15,pages 1489-99)公开的;
[0124]-包含至少一个序列use(上游增强子)的启动子,例如在肌钙蛋白i启动子序列(corin等人,1995,proc.natl.acad.sci.,vol.92,pages 6185-89)或其100-bp缺失(δuse;blain等人,2010,human gene therapy,vol.21,pages 127-34)中鉴定的,可能有3(x3)或4(x4)个拷贝。特别感兴趣的是deltausex3(dusex3)启动子和deltausex4(dusex4)启动子。
[0125]
其他基因的启动子可以进一步提及:肌钙蛋白、肌原性因子5(myf5)、肌球蛋白轻链1/3快(mlc1/3f)、肌原性分化1(myod1)、肌细胞生成素(myog)、成对的盒基因7(pax7)、mef2。
[0126]
衍生自所述序列或对应于其片段但具有相似的启动子活性(特别是在组织特异性和可能的有效性方面)的启动子序列也被覆盖在本发明内。优选地,术语“衍生物”或“片段”是指与所述序列具有至少60%、优选70%、甚至更优选80%或甚至90%、95%或99%的同一性的序列。特别感兴趣的是如上文所限定的允许在骨骼肌和心脏中适当表达fkrp的启动子序列。
[0127]
根据一个实施方案,本发明的表达系统包含:
[0128]-编码fkrp蛋白的序列,和
[0129]-允许在骨骼肌中以治疗上可接受的水平表达fkrp并且在心脏中以毒性上可接受的水平呈现启动子活性或甚至没有活性的启动子序列,可能是上文列出的这些之一。
[0130]
如果该启动子序列不允许fkrp蛋白在所有组织中(尤其是在心脏中)以毒性上可接受的水平表达,则它有利地与具有降低fkrp蛋白在所述组织中的表达水平的功能的序列相关联,在所述组织中蛋白质表达是有毒的。
[0131]
因此,本技术报道了使用结蛋白启动子来表达fkrp导致心脏毒性。相比之下,根据本发明,使用与至少一个mirna-208a靶序列(优选为序列seq id no:2)相关联的结蛋白启动子(优选为序列seq id no:6)允许以下两者:
[0132]-骨骼肌中治疗上可接受的水平的蛋白质表达;
[0133]-心脏中毒性上可接受的水平的蛋白质表达。
[0134]
如已经陈述的,所述序列能够阻止fkrp蛋白在蛋白质表达具有毒性的组织中(尤其是在心脏中)的表达或降低其表达水平。该行为可以根据各种机制发生,特别是:
[0135]-根据编码蛋白质的序列的转录水平;
[0136]-根据由编码蛋白质的序列转录产生的转录物,例如通过它们的降解;
[0137]-根据转录物向蛋白质的翻译。
[0138]
这样的序列优选是例如选自以下组中的小rna分子的靶标:
[0139]-microrna;
[0140]-内源性小干扰rna或sirna;
[0141]-转移rna(trna)的小片段;
[0142]-基因间区域的rna;
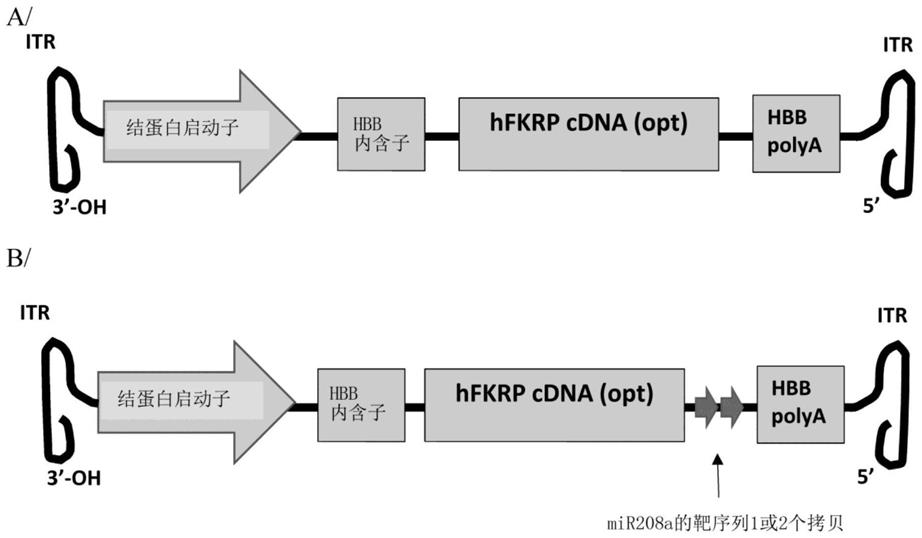
[0143]-核糖体rna(rrna);
[0144]-小核rna(snrna);
[0145]-小核仁rna(snorna);
[0146]-与piwi蛋白相互作用的rna(pirna)。
[0147]
有利地,该序列有助于维持fkrp蛋白在靶组织中(优选在骨骼肌中)的表达,甚至提高其表达水平。
[0148]
优选地,根据它在蛋白质表达具有毒性的组织中的有效性选择这样的序列。由于该序列的有效性可能因组织而异,因此可能需要组合这些序列中的几个,根据它们在所有已证明毒性的靶组织中的有效性选择。
[0149]
根据优选实施方案,该序列是microrna(mirna)的靶序列。众所周知,这种明智选择的序列有助于特异性抑制选定组织中的基因表达。
[0150]
因此,根据特定实施方案,本发明的表达系统包含在蛋白质表达具有毒性的组织中(尤其是在心脏中)表达或存在的microrna(mirna)的靶序列。适当地,在靶组织(优选骨骼肌)中存在的该mirna的量少于在其中fkrp有毒的组织中存在的量,或者该mirna甚至可能不在靶组织中表达。根据特定实施方案,靶标mirna不在骨骼肌中表达。根据另一个特定实施方案,它在心脏中特异性或甚至排他性地表达。
[0151]
如本领域技术人员已知的,mirna的存在或表达水平(特别是在给定组织中)可以通过pcr(优选通过rt-pcr)或通过northern印迹来评估。
[0152]
不同的mirna以及它们的靶序列和它们的组织特异性是本领域技术人员已知的,并且例如在文件wo 2007/000668中进行了描述。在心脏中表达的mirna是例如mir-1、mir133a、mir-206、mir-499和mir-208a。特别感兴趣的是在心脏中排他性地表达的mirna,例如序列seq id no:21的mir208a。
[0153]
根据特定实施方案,本发明的表达系统包含mirna-208a(也称为mir208a;seq id no:21)的靶序列。因此,在本发明的框架内已经表明,使用这种与fkrp相关的靶序列可以解决其心脏毒性问题。优选地,在人、狗和小鼠中相同的该靶序列具有22pb的序列seq id no:2。当然,任何被mirna-208a识别的衍生或截短序列都可以作为本发明的一部分来实施。特别地,可以使用与seq id no:2在一个或几个核苷酸上不同的序列,例如与seq id no:2具有至少60%、70%、80%、90%或甚至95%的同一性,只要它能够结合mir208a,即它是mir208a的靶序列,考虑优选与其种子序列同源。
[0154]
如已经陈述的,microrna的靶序列可以单独使用或与其他序列(有利地microrna的靶序列,其可以相同或不同)组合使用。这些序列可以串联或在相反方向上使用。关于fkrp,已经建议使用在肝脏中表达的mir122的靶序列。
[0155]
根据优选实施方案,特别是对于mirna208a的靶序列,可以实施一个(1)或多个(特别是两个(2)或四个(4))序列。优选地,它们串联使用,也就是说,都在相同方向上。在实施
多个靶序列的情况下,它们可以以本领域技术人员已知的方式被随机序列的dna间隔区分开。
[0156]
优选地,在mirna(特别是mir208a)的靶序列的情况下,它位于编码蛋白质的序列的3’,更有利地插入表达系统的3’utr(“非翻译区”)区域。甚至更优选地,当表达系统在编码蛋白质的cdna的3’处包含多聚腺苷酸化信号时,该序列被插入在开放阅读框的终止密码子和多聚腺苷酸化信号之间。
[0157]
在本发明的背景中,已经证明,mirna-208a的至少一个靶序列适于至少在心脏中获得毒性上可接受的水平的fkrp蛋白。
[0158]
根据一个实施方案,本发明的表达系统包含:
[0159]-编码fkrp蛋白的序列;和
[0160]-在心脏中表达的mirna的靶序列。
[0161]
此外,优选地,它进一步包含控制fkrp表达的启动子序列。所述启动子优选是允许fkrp在骨骼肌中以治疗上可接受的水平表达的启动子序列,例如结蛋白启动子,优选人结蛋白的启动子(seq id no:6)。
[0162]
根据特定实施方案,表达系统包含:
[0163]-编码fkrp的序列,置于允许肌肉表达的启动子(例如结蛋白的启动子,优选人结蛋白的启动子,例如为序列seq id no:6)的控制下;
[0164]-在心脏中表达的至少一个mirna的靶序列,优选mirna-208a的靶序列,优选靶序列seq id no:2。
[0165]
根据具体实施方案,根据本发明的表达系统包含以下或由以下组成:
[0166]-seq id no:3的核苷酸146至3946;或
[0167]-seq id no:4的核苷酸146至3974。
[0168]
在另一个特定形式的实施方案中,表达系统可以包含:
[0169]-编码fkrp的序列,置于启动子的控制下,例如结蛋白的启动子,优选人结蛋白的启动子,例如为序列seq id no:6,或钙蛋白酶3的启动子,优选人钙蛋白酶3的启动子,例如为序列seq id no:7,或mirna206的启动子,优选人mirna206的启动子,例如为seq id no:8;
[0170]-在心脏中表达的至少一个mirna的靶序列,优选mirna-208a的靶序列,例如序列seq id no:2,可能两个靶序列有利地串联。
[0171]
因此,上文详述的不同类型的序列可以组合在相同的表达系统中。
[0172]
根据本发明,表达系统或表达盒包含表达存在的转基因所必需的元件。除了如上文定义以确保和调节转基因表达的那些序列外,这样的系统可以包括其他序列,例如:
[0173]-多聚腺苷酸化信号,例如sv40或人血红蛋白的polya,优选插入编码序列的3’或mirna的靶序列的3’;
[0174]-稳定转录本的序列,例如人血红蛋白的内含子1;
[0175]-增强子序列。
[0176]
可以将根据本发明的表达系统引入细胞、组织或身体中,特别是人类中。以本领域技术人员已知的方式,可以离体或体内进行引入,例如通过转染或转导。根据另一方面,本发明因此包含优选人类来源的细胞或组织,其包含本发明的表达系统。
[0177]
根据本发明的表达系统(在该情况下是分离的核酸)可以在受试者中施用,即以裸dna的形式。为了促进这种核酸向细胞中的引入,它可以与不同的化学方法相结合,例如胶体分散系统(大分子复合物、纳米胶囊、微球、珠粒)或基于脂质的系统(水包油乳液、胶束、脂质体)。
[0178]
或者,根据另一个优选实施方案,本发明的表达系统包含质粒或载体。有利地,这样的载体是病毒载体。通常用于哺乳动物(包括人类)基因治疗的病毒载体是本领域技术人员已知的。这样的病毒载体优选选自以下列表:源自疱疹病毒的载体、杆状病毒载体、慢病毒载体、逆转录病毒载体、腺病毒载体和腺相关病毒载体(aav)。
[0179]
根据本发明的具体实施方案,包含表达系统的病毒载体是腺相关病毒(aav)载体。
[0180]
腺相关病毒(aav)载体已成为治疗各种病症的强大的基因递送工具。aav载体具有许多使其理想地适合基因治疗的特征,包括致病性的缺乏、中等免疫原性以及以稳定和有效的方式转导有丝分裂后的细胞和组织的能力。通过选择aav血清型、启动子和递送方法的适当组合,可以将aav载体中包含的特定基因的表达特异性靶向至一种或多种类型的细胞。
[0181]
在一个实施方案中,编码序列包含在aav载体中。已知有100多种天然存在的aav血清型。aav衣壳中存在许多天然变体,允许鉴定和使用具有特别适合营养不良病理的特性的aav。可以使用传统的分子生物学技术对aav病毒进行工程化,从而可以优化这些颗粒以用于核酸序列的细胞特异性递送、最小化免疫原性、调节稳定性和颗粒寿命、有效降解、准确递送至细胞核。
[0182]
如上所述,aav载体的使用是dna外源递送的常见模式,因为它相对无毒,可提供有效的基因转移,并且可以轻松针对特定目的进行优化。在从人类或非人类灵长类动物(nhp)分离并良好表征的aav血清型中,人类血清型2是第一个被开发为基因转移载体的aav。目前使用的其他aav血清型包括aav1、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aavrh10、aavrh74、aav11和aav12。此外,非天然的工程化的变体和嵌合aav也可以有用。
[0183]
用于组装成载体的理想aav片段包括cap蛋白(包括vp1、vp2、vp3和高变区)、rep蛋白(包括rep 78、rep 68、rep 52和rep 40)以及编码这些蛋白质的序列。这些片段可以很容易地用于各种载体系统和宿主细胞。
[0184]
这样的片段可以单独使用,与其他aav血清型序列或片段组合使用,或与来自其他aav或非aav病毒序列的元件组合使用。如本文所用,人工aav血清型包括但不限于具有非天然存在的衣壳蛋白的aav。这样的人工衣壳可以通过任何合适的技术产生,使用所选的aav序列(例如,vp1衣壳蛋白的片段)与异源序列相结合,所述异源序列可以从所选的不同aav血清型、相同aav血清型的非连续部分、非aav病毒来源或非病毒来源获得。人工aav血清型可以是但不限于嵌合aav衣壳、重组aav衣壳或“人源化”aav衣壳。因此,示例性aav或人工aav包括aav2/8(us 7,282,199)、aav2/5(可从美国国立卫生研究院获得)、aav2/9(wo2005/033321)、aav2/6(us 6,156,303)、aavrh10(wo2003/042397)、aavrh74(wo2003/123503)、aav9-rh74杂合体或aav9-rh74-p1杂合体(wo2019/193119)、pct/ep2020/061380中公开的aav变体等。在一个实施方案中,可用于本文所述的组合物和方法的载体至少包含编码所选aav血清型衣壳(例如aav8衣壳)的序列或其片段。在另一个实施方案中,有用的载体至少包含编码所选aav血清型rep蛋白(例如aav8 rep蛋白)的序列或其片段。任选地,这样的载体可以同时包含aav cap和rep蛋白。在同时提供aav rep和cap的载体中,aav rep和aav cap
序列都可以是一种血清型来源,例如,所有aav8来源。或者,可以使用其中rep序列来自aav血清型的载体,其不同于提供cap序列的载体。在一个实施方案中,rep和cap序列从不同的来源(例如,不同的载体,或宿主细胞和载体)表达。在另一个实施方案中,这些rep序列在框内融合至不同aav血清型的cap序列以形成嵌合aav载体,例如aav2/8(us 7,282,199)。
[0185]
根据一个实施方案,组合物包含血清型2、5、8或9的aav,或aavrh74。有利地,要求保护的载体是aav8或aav9载体,尤其是aav2/8或aav2/9载体。更有利地,要求保护的载体是aav9载体或aav2/9载体。
[0186]
在本发明使用的aav载体中,aav基因组可以是单链(ss)核酸或双链(ds)/自互补(sc)核酸分子。
[0187]
有利地,将编码fkrp蛋白的多核苷酸插入aav载体的itr(“反向末端重复”)序列之间。典型的itr序列对应于seq id no:1的核苷酸1至145(5’itr序列)和seq id no:1的核苷酸3913至4057(3’itr序列)。
[0188]
重组病毒颗粒可以通过本领域技术人员已知的任何方法获得,例如通过单纯疱疹病毒系统和杆状病毒系统共转染293hek细胞。载体滴度通常表示为每毫升病毒基因组(vg/ml)。
[0189]
在一个实施方案中,载体包含调控序列,尤其是启动子序列,有利地如上所述。
[0190]
其他可能的调控序列的非详尽列表是:
[0191]-用于转录稳定的序列,例如血红蛋白(hbb2)的内含子1,例如对应于seq id no:1的核苷酸1207至1652。如在序列seq id no:1中所示,所述hbb2内含子有利地随后是在mrna内的aug起始密码子之前包括的共有kozak序列(gccacc),以改进翻译的起始;
[0192]-多聚腺苷酸化信号,例如目的基因的polya、sv40或β血红蛋白(hbb2)的polya,有利地位于编码人fkrp的序列的3’。作为优选的实例,hbb2的poly a对应于seq id no:1的核苷酸3147至3912;
[0193]-增强子序列;
[0194]-mirna靶序列,其可以抑制编码人fkrp的序列在非靶组织中的表达,其中所述表达是不期望的,例如在它可能有毒的情况下。作为实例,它可以是mir122的靶序列以避免肝毒性。优选地,相应的mirna不存在于骨骼肌中。
[0195]
关于编码序列seq id no:5和例如与seq id no:1的核苷酸1659至3146相对应的多核苷酸,本发明的载体可以分别包含seq id no:1、seq id no:3和seq id no:4中所示的序列。
[0196]
根据优选实施方案,本发明的表达系统包括具有合适趋向性的载体,在这种情况下对靶组织(有利地是骨骼肌)的趋向性比对蛋白质表达出现毒性的组织的趋向性更高。有利地,本发明的表达系统包括对骨骼肌的趋向性高于对心脏的趋向性的载体。它可以是含有衣壳的aav载体,该衣壳被选择用于最小化或不靶向/转导心脏或优先或甚至排他性地靶向/转导骨骼肌。
[0197]
本发明的进一步的方面涉及:
[0198]-如上所公开的包含本发明的表达系统的细胞或包含所述表达系统的载体。
[0199]
细胞可以是任何类型的细胞,即原核细胞或真核细胞。细胞可用于载体的增殖或可以进一步引入(例如移植)到宿主或受试者中。可以通过本领域已知的任何方式将表达系
统或载体引入细胞中,例如通过转化、电穿孔或转染。也可以使用源自细胞的囊泡。
[0200]-如上所公开的包含本发明的表达系统的转基因动物(有利地是非人类)、包含所述表达系统的载体、或包含所述表达系统或所述载体的细胞。
[0201]
本发明的另一方面涉及包含如上所公开的表达系统、载体或细胞的组合物用作药物。
[0202]
根据实施方案,组合物至少包含所述基因治疗产物(表达系统、载体或细胞),以及可能的其他专门用于治疗同一种疾病或另一种疾病的活性分子(其他基因治疗产物、化学分子、肽、蛋白质
……
)。
[0203]
根据具体实施方案,根据本发明的表达系统的使用与抗炎药或核糖醇的使用相结合。
[0204]
本发明然后提供包含本发明的表达系统、载体或细胞的药物组合物。这样的组合物包含治疗有效量的治疗剂(本发明的表达系统或载体或细胞)以及药学上可接受的载体。在具体实施方案中,术语“药学上可接受的”是指由联邦或州政府的监管机构批准或在美国或欧洲药典或其他公认的用于动物和人类的药典中列出。术语“载体”是指与治疗剂一起施用的稀释剂、佐剂、赋形剂或载体。这样的药物载体可以是无菌液体,例如水和油,包括石油、动物、植物或合成来源的那些,例如花生油、大豆油、矿物油、芝麻油等。当药物组合物被静脉内施用时,水是优选的载体。盐水溶液和右旋糖和甘油水溶液也可以用作液体载体,特别是用于可注射溶液。合适的药物赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、硬脂酸钠、单硬脂酸甘油酯、滑石粉、氯化钠、脱脂奶粉、甘油、丙二醇、水、乙醇等。
[0205]
如果需要,组合物还可以含有少量的润湿剂或乳化剂或ph缓冲剂。这些组合物可以采取溶液、悬浮液、乳液、缓释制剂等形式。合适的药物载体的实例在e.w.martin的“remington’s pharmaceutical sciences”中进行了描述。这样的组合物将包含治疗有效量的治疗剂,优选以纯化形式,以及合适量的载体,以便为受试者提供适当施用的形式。
[0206]
在优选实施方案中,根据常规程序将组合物配制为适合于向人静脉内施用的药物组合物。通常,用于静脉内施用的组合物是无菌等渗水性缓冲液中的溶液。必要时,组合物还可以包括增溶剂和局部麻醉剂,例如利多卡因,以缓解注射部位的疼痛。
[0207]
在一个实施方案中,根据本发明的组合物适用于在人类中施用。组合物优选为液体形式,有利地为盐水组合物,更有利地为磷酸盐缓冲盐水(pbs)组合物或ringer-乳酸溶液。
[0208]
可以通过标准临床技术确定将有效治疗靶标疾病的本发明治疗剂(即表达系统或载体或细胞)的量。此外,可任选地采用体内和/或体外测定来帮助预测最佳剂量范围。制剂中使用的精确剂量还取决于施用途径、体重以及疾病的严重程度,应根据从业者的判断和每位患者的情况来决定。
[0209]
合适的施用应该允许将治疗有效量的基因治疗产物递送至靶组织,尤其是骨骼肌和可能的心脏。在本发明的背景中,当基因治疗产物是包含编码人fkrp的多核苷酸的病毒载体时,治疗剂量被定义为向每千克(kg)受试者施用的含有fkrp序列的病毒颗粒的数量(对于病毒基因组是vg)。
[0210]
可用的施用途径是局部、肠内(全系统作用,但通过胃肠道(gi)递送)或肠胃外(全身作用,但通过胃肠道以外的途径递送)。本文公开的组合物的优选施用途径是肠胃外,包
括肌内施用(即进入肌肉)和全身施用(即进入循环系统)。在该背景中,术语“注射”(或“灌注”或“输注”)涵盖血管内,特别是静脉内(iv)、肌内(im)、眼内、鞘内或脑内施用。通常使用注射器或导管进行注射。
[0211]
在一个实施方案中,组合物的全身递送包括在局部治疗部位附近施用组合物,即在虚弱的肌肉附近的静脉或动脉中。在某些实施方案中,本发明包括组合物的局部递送,其产生全身作用。这种施用途径(通常称为“局部(限于局部)输注”、“通过孤立(isolated)肢体灌注施用”或“高压经静脉肢体灌注”)已成功用作肌营养不良症的基因递送方法。
[0212]
根据一方面,通过输注或灌注将组合物施用于孤立肢体(限于局部)。换言之,本发明包括在压力下通过血管内施用途径(即静脉(经静脉)或动脉)在腿和/或手臂中局部递送组合物。这通常通过使用止血带暂时阻止血液循环同时允许注入产物的局部扩散来实现,例如toromanoff等人(2008)披露的。
[0213]
在一个实施方案中,将组合物注射到受试者的肢体中。当受试者是人时,肢体可以是手臂或腿。根据一个实施方案,组合物在受试者身体的下部(例如膝盖以下)或在受试者身体的上部(例如肘部以下)施用。
[0214]
根据本发明的优选施用方法是全身施用。全身注射开辟了注射整个身体以到达受试者身体的整个肌肉(包括心脏和膈肌)以及然后真正治疗这些全身性的且仍然无法治愈的疾病的途径。在某些实施方案中,全身递送包括将组合物递送至受试者,使得组合物可遍及受试者的身体。
[0215]
根据优选实施方案,全身施用通过在血管中注射组合物(即血管内(静脉内或动脉内)施用)进行。根据一个实施方案,组合物通过外周静脉通过静脉注射施用。
[0216]
全身施用通常在以下条件下进行:
[0217]-1至10ml/min之间的流速,有利地1至5ml/min之间的流速,例如3ml/min;
[0218]-总注射量可以在1至20ml之间变化,优选为每kg受试者5ml的载体制剂。注射量不应超过总血量的10%,优选约为6%。
[0219]
当全身递送时,组合物优选以小于或等于10
15
vg/kg或甚至10
14
vg/kg、有利地高于或等于10
10
、10
11
或甚至10
12
vg/kg的剂量施用。具体而言,剂量可以在5.10
12
vg/kg和10
14
vg/kg之间,例如1、2、3、4、5、6、7、8或9.10
13
vg/kg。也可以考虑例如1、2、3、4、5、6、7、8或9.10
12
vg/kg的较低剂量以避免潜在的毒性和/或免疫反应。如本领域技术人员所知,在效率方面给出令人满意的结果的尽可能低的剂量是优选的。
[0220]
在具体实施方案中,治疗包括组合物的单次施用。
[0221]“肌营养不良蛋白聚糖病”是指与α-肌营养不良蛋白聚糖(αdg)的异常糖基化有关的疾病或病理。该缺陷可能是由fkrp缺陷引起的。根据具体实施方案,病理选自由以下组成的组:肢带型肌营养不良症2i型或r9型(lgmd2i或lgmd2 r9)、先天性肌营养不良症1c型(mdc1c)、walker-warburg综合征(wws)和肌肉-眼-脑病(meb),有利地是lgmd2i。
[0222]
可以从本发明的组合物受益的受试者包括所有被诊断患有此类疾病或有发展此类疾病的风险的患者。然后可以通过本领域技术人员已知的任何方法(包括例如fkrp基因测序)基于fkrp基因中的突变或缺失的鉴定,和/或通过本领域技术人员已知的任何方法评估fkrp表达水平或活性,来选择待治疗的受试者。因此,所述受试者包括已经表现出这种疾病的症状的受试者和有患上所述疾病的风险的受试者。在一个实施方案中,所述受试者包
括已经表现出此类疾病的症状的受试者和有发展此类疾病的风险的受试者。在另一个实施方案中,所述受试者是能走动的患者和早期不能走动的患者。
[0223]
此类组合物尤其旨在用于基因治疗,特别是用于治疗肢带型肌营养不良症2i型(lgmd2i)、先天性肌营养不良症1c型(mdc1c)、walker-warburg综合征(wws)和肌肉-眼-脑病(meb),有利地是lgmd2i。
[0224]
根据一个实施方案,本发明涉及治疗肌营养不良蛋白聚糖病的方法,包括向受试者施用如上所述的基因治疗产物(表达系统、载体或细胞)。
[0225]
有利地,肌营养不良蛋白聚糖病是与α-肌营养不良蛋白聚糖(αdg)的异常糖基化和/或fkrp缺陷相关的病理。更有利地,病理是肢带型肌营养不良症2i型(lgmd2i)、先天性肌营养不良症1c型(mdc1c)、walker-warburg综合征(wws)或肌肉-眼-脑病(meb)。
[0226]
在另外的方面,本发明提供了增加细胞中α-肌营养不良蛋白聚糖(αdg)的糖基化的方法,包括将本发明的表达系统或载体递送至所述细胞,其中fkrp多核苷酸在所述细胞中表达,从而产生fkrp并增加αdg的糖基化。
[0227]
有利地,表达系统在体内全身施用,特别是在动物中,有利地在哺乳动物中并且更优选在人类中。
[0228]
除非另有说明,本发明的实践采用分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学的常规技术,这些技术完全在本领域技术人员的视界内。此类技术在文献中得到了充分解释,例如“molecular cloning:a laboratory manual”,fourth edition(sambrook,2012);“oligonucleotide synthesis”(gait,1984);“culture of animal cells”(freshney,2010);“methods in enzymology”“handbook of experimental immunology”(weir,1997);“gene transfer vectors for mammalian cells”(miller and calos,1987);“short protocols in molecular biology”(ausubel,2002);“polymerase chain reaction:principles,applications and troubleshooting”,(babar,2011);“current protocols in immunology”(coligan,2002)。这些技术适用于本发明的多核苷酸和多肽的生产,因此可以在制备和实践本发明时被考虑。用于特定实施方案的特别有用的技术将在以下部分中讨论。
[0229]
本文引用的每篇专利、专利申请和出版物的公开内容均通过引用整体并入本文。
[0230]
在没有进一步描述的情况下,相信本领域的普通技术人员可以使用前面的描述和下面的说明性实施例来制备和利用本发明的化合物并实施要求保护的方法。
[0231]
实验性实施例
[0232]
参考下面的实验性实施例和附图对本发明作进一步详细描述。提供这些实施例仅用于说明目的,并不旨在进行限制。
[0233]
在申请中,本发明关于aav9载体进行了说明,该aav9载体包含置于结蛋白启动子控制下的编码fkrp的序列和一个或两个mir208a的靶序列。
[0234]
材料和方法:
[0235]
1)重组aav载体的产生:
[0236]
载体aav-fkrp中包含的表达盒(seq id no:1;参见图1a)对应于wo2019/008157中公开的序列seq id no:11的核苷酸496至4550。22pb的mirna-208a的靶序列(seq id no:2)(分别为1或2个序列),每个由dna间隔区隔开,已被添加到fkrp cdna的3’utr区域。相应的
表达盒(图1b)分别具有序列seq id no:3和seq id no:4,分别产生载体aav-fkrp-单个和aav-fkrp-串联。
[0237]
详细地,seq id no:1的表达盒包含:
[0238]-对应于seq id no:1的核苷酸1至145的5’itr序列;随后是
[0239]-对应于seq id no:1的核苷酸146至1206的人结蛋白启动子(seq id no:6);随后是
[0240]-对应于seq id no:1的核苷酸1207至1652的hbb2内含子;随后是之前插入的共有kozak序列(gccacc)
[0241]-对应于seq id no:1的核苷酸1659至3146的编码人fkrp的多核苷酸(seq id no:5);随后是
[0242]-对应于seq id no:1的核苷酸3147至3912的hbb2 polya序列;随后是
[0243]-对应于seq id no:1的核苷酸3913至4057的3’itr序列。
[0244]
详细地,seq id no:3的表达盒包含:
[0245]-对应于seq id no:3的核苷酸1至145的5’itr序列;随后是
[0246]-对应于seq id no:3的核苷酸146至1206的人结蛋白启动子(seq id no:6);随后是
[0247]-对应于seq id no:3的核苷酸1207至1652的hbb2内含子;随后是之前插入的共有kozak序列(gccacc)
[0248]-对应于seq id no:3的核苷酸1659至3146的编码人fkrp的多核苷酸(seq id no:5);随后是
[0249]-对应于seq id no:3的核苷酸3153至3174的mir208a的靶序列(seq id no:2);随后是
[0250]-对应于seq id no:3的核苷酸3181至3946的hbb2 polya序列;随后是
[0251]-对应于seq id no:3的核苷酸3947至4091的3’itr序列。
[0252]
详细地,seq id no:4的表达盒包含:
[0253]-对应于seq id no:4的核苷酸1至145的5’itr序列;随后是
[0254]-对应于seq id no:4的核苷酸146至1206的人结蛋白启动子(seq id no:6);随后是
[0255]-对应于seq id no:4的核苷酸1207至1652的hbb2内含子;随后是之前插入的共有kozak序列(gccacc)
[0256]-对应于seq id no:4的核苷酸1659至3146的编码人fkrp的多核苷酸(seq id no:5);随后是
[0257]-对应于seq id no:4的核苷酸3153至3174和核苷酸3181至3202的两个串联的mir208a的靶序列(seq id no:2);随后是
[0258]-对应于seq id no:4的核苷酸3209至3974的hbb2 polya序列;其次是
[0259]-对应于seq id no:4的核苷酸3975至4119的3’itr序列。
[0260]
使用如前所述的三质粒转染方案(bartoli等人,2006),通过将aav2-itr重组基因组包装在aav9衣壳中来产生无腺病毒的raav2/9病毒制剂。简而言之,将hek293细胞与paav-h结蛋白-hfkrp、repcap质粒(paav2.9,dr j.wilson,upenn)和腺病毒辅助质粒
(pxx6;apparailly等人,2005)以1:1:2的比例共转染。在转染后60小时收获粗病毒裂解物,并通过冻融循环进行裂解。通过两轮cscl超速离心随后透析来纯化病毒裂解物。使用aav载体基因组中包含的fkrp编码序列特异性的引物和探针,通过taqman实时pcr分析对病毒基因组进行定量。用于扩增的引物对和taqman探针是:
[0261]
fkrpopt正向:gcccttctaccccaggaatg(seq id no:9)
[0262]
fkrpopt反向:aaacttcagctccaggaacctc(seq id no:10);和
[0263]
fkrpopt探针:tgccctttgctggctttgtggcccaggc(seq id no:11)。
[0264]
载体滴度以每毫升病毒基因组(vg/ml)表示。
[0265]
2)体内实验:
[0266]
根据法国和欧洲有关动物试验的立法对大鼠和小鼠进行处理。在这项研究中,使用10-12周龄的sprague-dawley雄性大鼠和4周龄的雄性fkrp缺陷小鼠(gicquel等人,p094,conf
é
rence european society of gene&cell therapy 2017,doi:10.1089/hum.2017.29055.abstracts)。
[0267]
按照所示剂量,将重组载体注射到如所示的大鼠和小鼠的尾静脉中。施用等体积的盐水缓冲液(pbs)作为对照。定期监测临床状态和动物体重。在指定时间处死动物(大鼠为2周或11周;小鼠为6周)。
[0268]
3)蛋白质印迹:
[0269]
心脏和肌肉组织在补充有不含edta的完全蛋白酶抑制剂混合物(roche,switzerland)的ripa裂解缓冲液(thermo fisher scientific,waltham,ma,usa)中进行机械匀浆。样品中所含的核酸通过在37℃下与benzonase(sigma,st.louis,mo,usa)一起孵育15分钟而降解。
[0270]
使用预制的聚丙烯酰胺凝胶(4-15%,biorad,hercules,ca,usa)分离蛋白质,然后将蛋白质转移到硝酸纤维素膜上。
[0271]
先前已经描述了针对fkrp的兔多克隆抗体(gicquel等人,2017)。用针对fkrp(1:100)和gapdh(santa cruz biotechnologies,dallas,tx,usa,1:5000)的抗体在室温下探测(probed)硝酸纤维素膜2小时以进行标准化。
[0272]
最后,将膜与一起孵育以通过odyssey红外扫描仪(li-cor biosciences,lincoln,ne,usa)进行检测。
[0273]
4)pcr:
[0274]
通过对包含在载体基因组中的hbb2 polya序列进行定量rt-pcr,对ta肌肉中的载体拷贝数(vcn)进行定量,并使用肌联蛋白基因(ttn)进行标准化。
[0275]
hbb2pa正向:cttgactccactcagttctcttgct(seq id no:12);
[0276]
hbb2pa反向:ccaggcgaggagaaacca(seq id no:13);和
[0277]
hbb2pa探针:ctcgccgtaaaacatggaaggaacacttc(seq id no:14)。
[0278]
ttn正向:gtcccctgcgtatctgctatg(seq id no:15);
[0279]
ttn反向:cgctcgttttcaatactacctctct(seq id no:16);和
[0280]
ttn探针:tccgcagctctagtggaagaaccacc(seq id no:17)。
[0281]
使用trizol方法从ta肌肉和心脏中提取fkrp mrna,然后使用在密码子优化的fkrp序列上设计的寡核苷酸和探针通过定量rt-pcr进行定量,并通过p0基因的表达进行标
准化。
[0282]
p0正向:ctccaagcagatgcagcaga(seq id no:18);
[0283]
p0反向:atagccttgcgcatcatggt(seq id no:19);和
[0284]
p0探针:ccgtggtgctgatgggcaagaa(seq id no:20)。
[0285]
fkrpopt正向(seq id no:9)、fkrpopt反向(seq id no:10)和fkrpopt探针(seq id no:11)如上所述。
[0286]
5)组织学:
[0287]
使用标准方案用苏木精-伊红-藏红花(hes)、天狼星红或苏木精-根皮红-藏红花(hfs)对心肌的截面冷冻切片(8μm厚)进行染色。
[0288]
切片用pertex介质(leica)固定。使用axio scan z1幻灯片扫描仪(zeiss)捕获数字图像。
[0289]
结果:
[0290]
1/fkrp基因转移诱导心脏毒性
[0291]
1-1/在大鼠中
[0292]
在5只10-12周龄的雄性大鼠(sprague-dawley)中以以下3种不同剂量进行了aav-fkrp(图1a;含有seq id no:1)的全身施用:1e12、5e12和7.5e13 vg/kg。注射后两周,对大鼠实施安乐死并取样。心脏切片用苏木精-伊红-藏红花(hes)和天狼星红染色。
[0293]
施用aav-fkrp后大鼠心脏组织学显示心脏损伤:如图2所示,大鼠在以7.5e13 vg/kg的剂量注射后第15天明显观察到炎症和纤维化。此外,在这些条件下,一只大鼠死亡。
[0294]
1-2/在小鼠中
[0295]
由于小鼠是唯一开发了fkrp缺陷动物模型的哺乳动物物种,因此是唯一可以探索表达系统的治疗效果的物种,还研究了该模型中aav-fkrp载体的潜在心脏毒性。
[0296]
在6只4周龄的雄性fkrp缺陷小鼠中以以下4种剂量进行了aav-fkrp的全身施用:5e12、1.5e13、4.5e13和1e14 vg/kg。注射后六周,对小鼠实施安乐死并取样。心脏切片用苏木精-根皮红-藏红花(hps)和天狼星红染色。
[0297]
即使是最高剂量(1e14 vg/kg),所有小鼠都在研究中存活下来。相反(见下文),1只大鼠在以7.5e13 vg/kg的剂量施用后2周死亡。这揭示了小鼠受aav-fkrp全身施用的影响小于大鼠。
[0298]
然而,aav-fkrp施用后小鼠心脏组织学揭示了心脏损伤:如图3所示,在以剂量1e14 vg/kg注射后6周,在小鼠中观察到炎症和纤维化。
[0299]
总体而言,所展示的数据揭示了aav-fkrp的心脏毒性作用,这在2个物种(大鼠和小鼠)中得到证实,这是完全出乎意料的。
[0300]
2/降低心脏中的fkrp转基因表达可减轻心脏毒性而不影响肌肉表达
[0301]
作为预防fkrp心脏毒性的概念证明,在aav-fkrp载体中引入了心脏特异性micro-rna的靶序列(即mir-208a的靶序列)的一个或两个拷贝。如此获得的载体(图1b)被命名为aav-fkrp-单个(包含一个mir-208a的靶序列并含有seq id no:3)和aav-fkrp-串联(包含相同方向的两个mir-208a的靶序列并含有seq id no:4)。
[0302]
2-1/大鼠短期(2周)试验
[0303]
根据之前的数据,选择大鼠模型进行进一步的实验,因为该动物模型以快速和明
确的方式揭示了心脏毒性,尤其是在剂量7.5e13 vg/kg时。
[0304]
在5只10-12周龄的雄性大鼠(sprague-dawley)中以7.5e13 vg/kg的剂量进行了含有0、1或2个mir-208a的靶标(seq id no:2)拷贝的aav-fkrp的全身施用。注射后两周,对大鼠实施安乐死并取样。
[0305]
a)存活和体重随访:
[0306]
存活数据如下表所示:
[0307]
注射的(i.v.)存活缓冲液5/5aav-fkrp4/5aav-fkrp-单个5/5aav-fkrp-串联5/5
[0308]
数据显示,唯一的死亡发生在施用aav-fkrp的队列中,可能是因为该构建体的心脏毒性。
[0309]
此外,图4显示注射aav-fkrp的大鼠不随时间增加体重,而注射aav-fkrp-单个或注射aav-fkrp-串联的大鼠随时间增加体重。
[0310]
作为结论,在2周后,看起来施用aav-fkrp-单个或aav-fkrp-串联的大鼠比施用aav-fkrp的大鼠更健康。
[0311]
b)ta肌肉中的载体拷贝数定量:
[0312]
使用肌联蛋白基因(ttn)对图5中显示的基于每个载体基因组中包含的hbb2 polya序列的定量的数据进一步标准化,揭示了骨骼肌组织(即ta肌肉)与3个载体的相似感染水平。
[0313]
重要的是,这证实了mir208a的靶序列的引入对肌肉中载体转移的效率没有任何负面影响,其中所述蛋白质应该以治疗水平产生以治愈与fkrp缺陷相关的肌肉异常。
[0314]
c)基因转移后心脏中的fkrp表达:
[0315]
如图6所示,在mrna水平(a)以及蛋白质水平(b)上,与aav-fkrp相比,使用构建体aav-fkrp-单个和aav-fkrp-串联观察到fkrp转基因表达显著降低。
[0316]
值得注意的是,一个mir208a的靶序列足以观察到这种降低。
[0317]
d)基因转移后的心脏损伤:
[0318]
图7中显示的数据揭示了,与aav-fkrp相比,构建体aav-fkrp-单个和aav-fkrp-串联的心脏损伤大大降低。换言之,当心脏中fkrp转基因表达降低时(即使通过足够的micro-rna进行调控),毒性作用就会消失。
[0319]
e)基因转移后骨骼肌中的fkrp表达:
[0320]
如图8所示,与ta肌肉有关,在mrna水平(a)以及蛋白质水平(b)上,与aav-fkrp相比,构建体aav-fkrp-单个和aav-fkrp-串联没有观察到fkrp转基因表达的降低。
[0321]
这证实了使用mir208a可以特异性地去靶向(detarget)心脏。重要的是,引入mir208a的靶序列不会对骨骼肌中fkrp表达的效率产生任何负面影响,其中所述蛋白质应以治疗水平产生以治愈与其缺陷相关的肌肉异常。
[0322]
2-2/大鼠长期(11周)试验
[0323]
已在大鼠上进行了与上述报道相同的实验,但在注射后11周进行。
protein mutation.neuromuscul.disord.,15,372-376.
[0341]
petri et al.(2015),international journal of cardiology,182(2015)403
–
411.
[0342]
rosales et al.(2011),journal of cardiovascular magnetic resonance,13:39.
[0343]
sveen,m.l.,schwartz,m.and vissing,j.(2006)high prevalence and phenotype-genotype correlations of limb girdle muscular dystrophy type 2i in denmark.ann.neurol.,59,808-815.
[0344]
toromanoff et al.(2008),molecular therapy 16(7):1291-99.
[0345]
wahbi,k.,meune,c.,hamouda el,h.,stojkovic,t.,laforet,p.,becane,h.m.,eymard,b.and duboc,d.(2008)cardiac assessment of limb-girdle muscular dystrophy 2i patients:an echography,holter ecg and magnetic resonance imaging study.neuromuscul.disord.,18,650-655.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1