KLF诱导心肌细胞生成的制作方法
klf诱导心肌细胞生成
技术领域
1.本技术涉及促进心肌细胞生成(即,由于细胞分裂而生成新的心肌细胞)的方法,其通过向心肌细胞施用klfl或klf2b中的至少一种或者klfl或klf2b核酸中的至少一种来实施。该技术进一步涉及通过向受试者施用klf1或klf2b蛋白或者核酸中的至少一种来促进受试者的心肌细胞生成。
2.相关申请的交叉引用
3.本技术要求澳大利亚临时专利申请号2019902703的优先权,通过引用将其全部内容并入本文。
背景技术:
4.成年哺乳动物心脏中的心肌细胞是终末分化的细胞,其已经退出细胞周期并且具有有限的增殖能力。因此,在病理性心脏病中成熟心肌细胞的死亡导致高死亡率和发病率。例如,与心肌梗塞相关的高死亡率和发病率在很大程度上是由于人类心脏具有极为有限的通过新的心肌细胞再生(心肌细胞生成)进行修复的能力。结果,梗塞的心肌被纤维化瘢痕组织所取代,其无法接触(contact),导致心脏泵血活性降低、心力衰竭和/或心律失常引起的猝死。
5.与哺乳动物不同,某些脊椎动物,包括硬骨斑马鱼,在心肌梗塞后表现出完全的、无瘢痕的心脏再生。从命运图谱研究中得知,心肌细胞,而非干细胞,是斑马鱼心脏再生中新心肌的主要来源。重要的是,类似的再生能力在新生小鼠中被发现。然而,哺乳动物心肌细胞的自我更新能力在出生后迅速降低。
6.由于数十亿心肌细胞(cm)的死亡,心血管疾病会引起收缩性心肌组织的严重的进行性损失。由于哺乳动物心脏的再生能力低,其可能最终导致心力衰竭,目前没有可用的治疗选择来强有力地恢复已损失的cm。
7.klf1是kr
ü
ppel样转录因子的成员,已知在红细胞发育中具有重要作用,并且klf1基因的突变会导致先天性贫血。本发明人发现了klf1在心肌细胞生成中之前未发现的作用。本发明人进一步证明,在成年心肌细胞中过表达的klf1可以在成年哺乳动物心脏中诱导心肌细胞生成并且引起心脏再生。
技术实现要素:
8.在第一方面,提供了一种诱导心肌细胞生成的方法,其包括向心肌细胞施用治疗有效量的klf,或在心肌细胞中诱导klf的表达,例如增加心肌细胞中klf1和/或klf2b的水平从而诱导心肌细胞生成。
9.在一实施方案中,心肌细胞群是婴儿、儿童或成人心肌细胞。心肌细胞群可从受试者中分离或存在于受试者中。
10.在一实施方案中,心肌细胞生成促进受试者的心脏再生。心脏再生的特征可以是射血分数、缩短分数或两者的增加。
11.心脏再生的特征可以是血管内皮细胞、心外膜细胞或两者的增加。
12.klf可以诱导心肌细胞去分化以产生增殖性心肌细胞,优选地,增殖性心肌细胞是有丝分裂的。
13.所述方法可以进一步包括在klf存在的情况下允许增殖性心肌细胞增殖以产生增殖性心肌细胞群。
14.增殖性心肌细胞使用磷酸戊糖途径、丝氨酸合成途径,或两者优先代谢葡萄糖。
15.所述方法可以进一步包括允许增殖性心肌细胞群分化以产生心肌细胞群。分化可以在klf基本不存在的情况下,或在klf诱导停止之后发生。
16.在一些实施方案中,klf诱导染色质重构以促进去分化。
17.klf诱导的染色质重构可以降低mef2c、gata4、mef2a和nkx2.5中的一个或任意组合的结合位点的可及性。klf可以是klf1、klf2b或两者、klf1和/或klf2b核酸或者包含所述核酸的至少一种的载体。所述载体可以包含与启动子可操作地偶联的核酸。所述启动子可以是心脏特异性启动子。在实施方案中,心肌细胞群存在于受试者中,并将klf施用于受试者。例如,可以将klf施用于受试者的心脏。
18.klfl蛋白可以是seq id no:1、11,或与seq id no:1或11具有至少80%相同性的蛋白。klfl核酸可以包含以下或由以下组成:seq id no:2、3、4、5、9、10中的任一个,或者与seq id no:2、3、4、5、9或10中的任一个具有至少80%相同性的核酸。
19.klf2b蛋白可以是seq id no:6,或与seq id no:6具有至少80%相同性的蛋白。klf2b核酸可以包含seq id no:7或8,或者与seq id no:7或8中的任一个具有至少80%相同性的核酸,或由seq id no:7或8,或者与seq id no:7或8中的任一个具有至少80%相同性的核酸组成。
20.所述启动子可以是α-肌球蛋白重链(α-mhc)启动子、肌球蛋白轻链2(mlc-2)启动子、心肌肌钙蛋白c(ctnc)启动子、ncx1启动子或tnnt2启动子。所述启动子可用于提供编码klf1或klf2b载体的cm表达。
21.所述启动子可以是诱导型启动子,例如四环素诱导型启动子、类固醇激素(例如孕酮或蜕皮激素)诱导型启动子、缺氧诱导型启动子、对心脏损伤部位附近区域具有特异性的启动子,或对缺血和再灌注引起的胁迫有响应的启动子。
22.增殖性心肌细胞可以是心肌祖细胞、未成熟心肌细胞、具有胚胎表型的心肌细胞,或其任意组合。
23.在一些实施方案中,心肌细胞生成不涉及重编程心肌细胞的细胞谱系。
24.在一些实施方案中,所述增殖性心肌细胞重新进入细胞周期。
25.在一些实施方案中,与心肌细胞相比,所述增殖性心肌细胞的特征为对戊糖磷酸途径(ppp)、丝氨酸合成途径或两者的依赖增加。
26.在一实施方案中,心肌细胞生成包括心外膜细胞和内皮细胞的扩增。
27.在一实施方案中,心肌细胞生成的特征为心外膜细胞、血管内皮细胞或两者的数量增加。
28.受试者可能患有以心肌细胞损失为特征的心脏病,如心肌梗塞、缺血性心肌病、扩张型心肌病或心力衰竭。
29.在第二方面,提供了通过第一方面的方法产生的心肌细胞群或增殖性心肌细胞
群。
30.在第三方面,提供了一种组合物,其包含通过第一方面的方法产生的心肌细胞或增殖性心肌细胞。
31.在第四方面,提供了一种治疗受试者心脏病的方法,其包括向受试者施用第二方面的心肌细胞群或增殖性心肌细胞群,或者第三方面的组合物。
32.在第五方面,提供了第二方面的心肌细胞群或增殖性心肌细胞群或者第三方面的组合物在制备用于治疗心脏病的药物中的用途。
33.定义
34.如本文所用,除非上下文另有明确要求,否则术语“klf”是指klf1和klf2b之一或两者。
35.在本说明书全文中,除非上下文另有明确要求,否则词语“包含”或如“包含”或“包含”的词尾变化变体词,将理解成意味着包括所说明的要素、整体(integer)或步骤,或要素组、整体组或步骤组,但不排除任何其他要素、整体或步骤,或要素组、整体组或步骤组。
36.在本说明书全文中,术语“由
……
组成”是指仅由
……
组成。
37.对已包括在本说明书中的文件、行为、材料、设备、物品等等的任何讨论仅仅是为本发明技术提供背景。其不应被视为承认任何或所有这些事项构成现有技术基础的一部分,或者被视为与本说明书每项权利要求的优先权日期之前存在的与本技术相关领域中的公知常识。
38.除非上下文另有要求,或有相反的明确说明,本文记载的技术的整体、步骤或要素以单数形式的整体、步骤或要素进行陈述,其清楚地涵盖了所引用的整体、步骤或要素的单数和复数形式。
39.在本说明书的上下文中,术语“一个(a和an)”用于表示物件的语法对象中的一个或多于一个(即,至少一个)。举例来说,提及“一个元件”时是指一个元件,或多于一个元件。
40.在本说明书的上下文中,术语“约”是指对数字或值的引用不应被视为绝对数字或值,而是包括符合技术人员根据本领域知识应理解的高于或低于该数字或值的变化幅度,包括在典型的误差范围内或仪器限制范围内。换而言之,术语“约”的使用被理解为本领域技术人员在实现相同功能或结果的情况下认为与列举的值等价的范围或近似值。
41.如本文所用,术语“治疗(treatment、treating等)”指获得期望的药理学和/或生理学效果。就完全或部分预防疾病或其症状而言,所述效果可以是预防性的,和/或就疾病的部分或完全治愈和/或由所述疾病产生的副作用而言,所述效果可以是治疗性的。如本文所用,“治疗”涵盖对哺乳动物,特别是人类疾病的任何治疗,并且包括:(a)预防疾病在可能易患所述疾病但尚未被诊断出所述疾病的受试者中发生;(b)抑制疾病,即,阻止其发展;和(c)缓解疾病,即,使疾病消退。
42.术语“个体”、“受试者”和“患者”在本文中可互换使用,是指动物,包括,但不限于鱼(例如斑马鱼)、啮齿动物(大鼠、小鼠)、非人灵长类动物、人类、犬科动物、猫科动物和有蹄类动物(例如,马、牛、绵羊、猪、山羊)。在一些实施方案中,受试者是人。
[0043]“治疗有效量”或“有效量”是指当向哺乳动物或其他受试者施用时,化合物的量足以实现对疾病的有效治疗。“治疗有效量”将根据化合物或细胞、疾病及其严重程度以及待治疗的受试者的年龄、体重等而变化。
[0044]
本领域技术人员会了解,本文所述的技术易于进行不同于具体描述的内容的变型和修改。应理解,所述技术包括所有这样的变型和修改。为避免疑义,所述技术还包括本说明书中单个或整体涉及或指明的所有步骤、特征和化合物,以及任何两个或多个所述步骤、特征和化合物的任何和所有组合。
附图说明
[0045]
图1:斑马鱼心脏再生过程中的klf1表达。(a)未损伤(无伤)和损伤(7dpi)心室的qpcr分析。(b)半-qpcr。使用荧光活化细胞分选技术(facs)分别从tg(cmlc2:egfp)、tg(fli1a:egfp)和tgbac(tcf21:dsred2)鱼的未损伤和损伤后(dpi)7天的心室中纯化心肌细胞(cm)、心内膜细胞(end)、心外膜细胞(epi)。(c)rnascope分析。三角(arrowhead),心肌中的klf1 mrna。箭头(arrow),血细胞祖细胞样细胞中的klf1 mrna。***p《0.005。
[0046]
图2:斑马鱼心脏再生中的klf1功能。(a)对照(klfdn-off)或表达显性阴性klf1(klfdn-on)的转基因斑马鱼心室的picro-mallory染色。虚线,切开面(resection plane)。dpi,损伤后的天数。表达klfdn的转基因系的详细信息描述于图11a。(b)通过对心肌细胞核标记物、心肌细胞增强因子2(mef2)和增殖细胞核抗原(pcna)进行免疫荧光检测的增殖的cm定量。*p《0.05。
[0047]
图3:klf1在再生斑马鱼心脏中的表达和功能分析。(a)损伤心室中klf1的定量逆转录pcr(rt-qpcr)分析(平均值
±
sem,n=5-6)。基因表达相对于未损伤对照的水平显示,所述对照表示为0dpi(损伤后天数)。(b)纯化的心脏细胞中klf1的rt-qpcr分析(平均值
±
sem)。采用荧光活化细胞分选技术(facs)分别从tg(cmlc2:egfp),tg(fli1a:egfp)和tgbac(tcf21:dsred2)鱼的未损伤和7dpi心室中纯化心肌细胞(cm)、心内膜细胞(end)和心外膜细胞(epi)。基因表达相对于未损伤心肌细胞的水平显示。在再生心脏中,采用rnascope的klf1 mrna的原位杂交和针对tnc的免疫荧光(未显示)表明在造血细胞和心肌中检测到klf1 mrna。(c)从非诱变方向到klf1
ct
诱变方向的cre依赖性转变。有关klf1
ct
的构建和表征的详细信息参见图9。(d)对对照组(klf1-ct)和klf1耗尽的心脏(klf1-mt)的心室切片进行picro-mallory染色并进行再生定量(n=20-22)。(e,f)肌球蛋白重链(mhc)或心肌肌钙蛋白c(tnc)与平滑肌蛋白22α(sm22)或alcam的免疫荧光,并且做箱线图显示sm22
+
mhc
+
(e)或alcam
+
tnc
+
(f)面积的定量(n=5
–
6)。(g)心肌细胞核标记物、心肌细胞增强因子2(mef2)和增殖细胞核抗原(pcna)的免疫荧光。做箱线图显示mef2
+
pcna
+
细胞的定量(n=7-9)。*p《0.05,**p《0.01,****p《0.001,通过非配对t检验获得(e,f,g)。
[0048]
图4:斑马鱼klf1诱导的cm去分化。用klf1过表达诱导的去分化标记物(runx1;a)的表达和分化的肌肉标记物(vmhc,actc1a,myom2a;b)的抑制。在klf1过表达(on)后7天klf1-on和off心室的qpcr分析。用于klf1过表达的转基因系的详细信息参见图12a。*p《0.05;**p《0.01;***p《0.005。
[0049]
图5:在cm增殖中的斑马鱼klf1功能。(a)on后9到11天每天注射一次edu,on后12天用edu
+
cm对s期cm进行定量。(b)有丝分裂cm在on后12天用磷酸组蛋白h3(phh3)
+
cm进行定量。(c)细胞增殖标记物的qpcr分析。用于klf1过表达的转基因系的详细信息参见图12a。*p《0.05;**p《0.01;***p《0.005;****p《0.001。nd,检测不到。
[0050]
图6:小鼠klf1功能。(a)半-qpcr分析。新生小鼠心脏在出生后第3天进行损伤并在
第6天收集。(b)通过心肌肌钙蛋白t(tnt)与ki67的共标记对cm增殖进行评估,并在注射了对照(gfp)或klf1腺病毒(klf1)的未损伤成年小鼠心脏中队cm增殖进行定量。共标记在xz和yz平面中进行确定。(c)s-期cm分析。对被wga包围的edu
+
细胞核进行定量。*p《0.05;**p《0.01。dpt,转染后天数;lv,左心室。
[0051]
图7:小鼠klf1在心肌修复中的功能。(a)在心肌梗塞(mi)后14天通过tnt与ki67共标记对cm增殖进行评估,并进行定量。(b)在mi后14天通过tnt与phh3共标记对cm有丝分裂进行评估,并进行定量。(c)在mi后28天对对照(ad-gfp)或klf1腺病毒(ad-klf1)处理的心脏进行gomori-trichrome染色分析。(d)用ad-gfp或ad-klf1处理的心脏的echo分析。
[0052]
图8:(a)zwitch2基因捕获盒。(b)cre介导的klf1基因失活示意图。(c)心肌特异性klf1基因表达失活。(d)通过心肌特异性klf1基因表达失活减弱cm增殖。(e,f)通过心肌特异性klf1基因表达失活降低cm去分化标志物。
[0053]
图9:斑马鱼klf1条件等位基因的产生和表征。zwitch2由以下组成:一个剪接受体位点,然后是三联poly-a序列(3xbghpa)和侧翼为翻转酶识别靶(frt)的可移动盒(lg-tag),其中在晶状体特异性αa-晶状体蛋白(cryaa)启动子控制下的增强型绿色荧光蛋白(egfp)的表达用于筛选。含有剪接受体位点、p2a肽序列和3xbghpa的区段侧翼是在每一个末端方向相反的串联的loxp和lox5171位点。cre介导所述cre靶位点排列的重组永久地翻转所述盒,并且剪接受体干扰正常的剪接模式。(a)斑马鱼klf1野生型(+)等位基因,用于诱导内含子1中dna双链断裂的转录激活因子样效应核酸酶(talen),以及由此产生的条件klf1
ct
等位基因的示意图。外显子由带数字的实心框表示。talen对的结合位点以蓝色突出显示,talen靶向位点由虚线箭头指示。(b)使用(a)中所示的引物对zwitch2的正确插入进行基因组pcr分析。la内的引物用作对照。(c)zwitch2修饰的klf1等位基因的southern印迹分析。hpai识别位点在(a)中指出。(d)具有正确插入zwitch2的胚胎的代表图,显示晶状体中的egfp表达(箭头)。(e)胚胎中zwitch2翻转的基因组pcr分析。klf1
ct/+
鱼与tg(ubb:cre-gfp)杂交,使用pcr分析来自每种基因型的4-7dpf胚胎的基因组dna,引物如(a)所示。对照引物与(b)中使用的相同。cre-f和cre-r引物用于确认cre-gfp。(f)对每种基因型的7dpf胚胎进行rt-qpcr分析(平均值
±
sem,n=3-4)。每个样本的单个胚胎用于rt-qpcr分析。(g)成年心脏中4-羟基他莫昔芬(4-ht)依赖性zwitch2翻转的基因组pcr分析。klf1-ct和klf1-mt表示斑马鱼分别含有klf1
ct/ct
和cmlc2:creer;klf1
ct/ct
转基因。使用与(b)中相同的对照引物。(h)对4-ht处理、未损伤和7dpi的klf1-ct和klf1-mt鱼的心室进行rt-qpcr分析(平均值
±
sem,n=4)。bghp(a),牛生长激素多腺苷酸化信号;cryaa,αa-晶状体蛋白;dpf,受精后天数;dpi,损伤后天数;klf1
+/+
,同批次孵化的对照(clutch-mate control);la,左臂;ns,不显著;ra,右臂。*p《0.05,非配对t检验。
[0054]
图10:斑马鱼发育过程中的klf1功能。(a)7dpf时ubb:cre-gfp;klf1
ct/ct
胚胎中观察到严重的心脏水肿,但在ubb:cre-gfp;klf1
+/+
胚胎中未观察到(同批次孵化的对照)。n=3(+/+),4(ct/+),或4(ct/ct)。(b)7dpf时在ubb:cre-gfp;actb2-bs-dn-klf1的胚胎中观察到严重的心脏水肿(三角),但在ubb:cre-gfp胚胎(同批次孵化的卵作为的对照)(n=7)中未观察到。actb2-bs-dn-klf1的详细信息请参见图11a。(c)使用klf1-ct和klf1-mt胚胎的心室切片进行的心肌细胞增强因子2(mef2)和肌球蛋白重链(mhc)的免疫荧光。从1到3dpf,用4-羟基他莫昔芬(4-ht)处理胚胎,并在7dpf进行分析。对单个光学平面中mef
2+
核进行定
量分析(平均值
±
sem,n=7
–
9)。(d)使用actb2:bs-dn-klf1(同批次孵化的对照)和cmlc2:creer;actb2:bs-dn-klf1胚胎的心室切片对mef2和mhc进行免疫荧光。从1到3dpf,用4-ht处理胚胎,并在7dpf进行分析。对单个光学平面中mef
2+
核进行定量分析(平均值
±
sem,n=6
–
8)。(e)4dpf时使用klf1
ct/ct
(同批次孵化的卵作为的对照)和ubb:cre-gfp;klf1
ct/ct
胚胎的心室切片对mef2和mhc进行免疫荧光分析。对单个光学平面中mef
2+
核进行定量(平均值
±
sem,n=5
–
7)。(f)4dpf时使用actb2:bs-dn-klf1(同批次孵化的对照)和ubb:cre-gfp;actb2:bs-dn-klf1胚胎的心室切片对mef2和mhc进行免疫荧光。对单个光学平面中mef
2+
核进行定量(平均值
±
sem,n=8-9)。请注意,心脏水肿从5dpf开始明显,但在4dpf时不明显。dpf,受精后天数。*p《0.05,****p《0.001通过χ2检验(a)、fisher精确检验(b)或非配对t检验(c-f)。
[0055]
图11:斑马鱼中显性-阴性klf1的表达使心脏再生受损。(a)建立tg(actb2:loxp-tagbfp-stop-loxp-dn-klf1)
vcc22
斑马鱼品系(以下简称actb2:bs-dn-klf1)并与cmlc2:creer杂交,用于4-羟基他莫昔芬(4-ht)处理的dn-klf1心肌细胞特异性表达。enr,engrailed阻遏结构域。(b)进行picro-mallory染色并定量再生(n=5-7)。(c)对平滑肌蛋白22α(sm22)和肌球蛋白重链(mhc)进行免疫荧光,以及做箱线图显示sm22
+
mhc
+
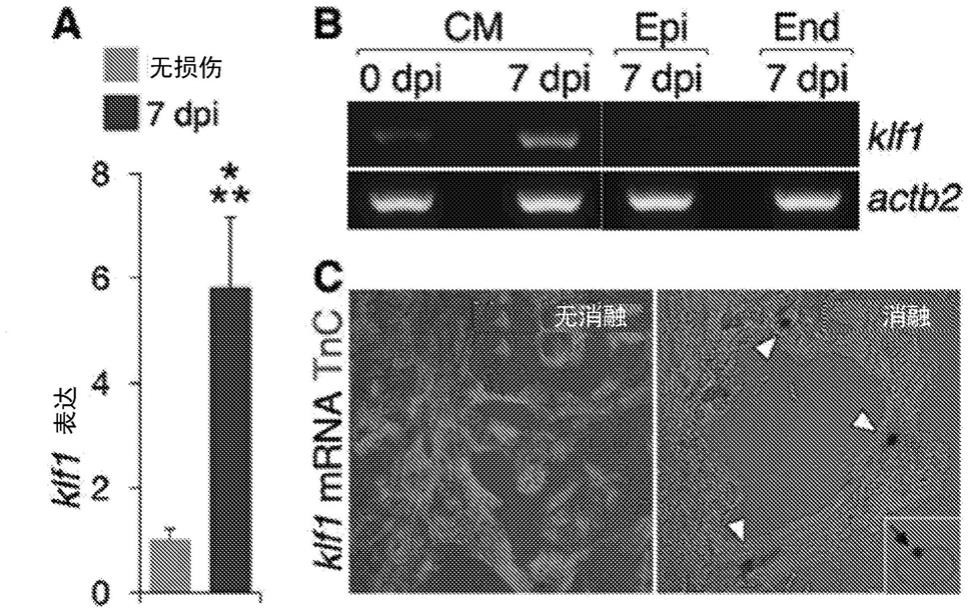
面积(n=4
–
5)的定量。(d)对肌核标记物mef2和增殖细胞核抗原(pcna)进行免疫荧光,以及做箱线图显示mef2
+
pcna
+
细胞(n=9-10)的定量。***p《0.005,****p《0.001,通过fisher精确检验(b)或非配对t检验(c,d)获得。比例尺,50μm。
[0056]
图12:斑马鱼心肌klf1的功能获得分析。(a)tg(actb2:loxp-tagbfp-stop-loxp-3xha-klf1)
vcc29
鱼与cmlc2:creer鱼杂交,双转基因鱼和cre阴性同批次孵化的对照分别被称为klf1-on和klf1-off。(b)用于klf1-on和klf1-off鱼的4-羟基他莫昔芬(4-ht)处理方案。对肌球蛋白重链(mhc)和平滑肌蛋白22α(sm22)、肌钙蛋白c(tnc)或alcam进行免疫荧光。从第7天开始,通过肌动蛋白的免疫荧光和tem检测肌节分解。(c)对心肌细胞核标记物心肌细胞增强因子2(mef2)和增殖细胞核抗原(pcna)进行免疫荧光和定量(平均值
±
sem,n=7)。(d)edu掺入实验。在放大、划定区域的xz和yz平面上收集图像并进行定量(平均值
±
sem,n=8)。只有当edu
+
细胞核为z平面中的cmlc2:gfp
+
心肌时,才对edu
+
心肌细胞进行计数。(e)对磷酸组蛋白h3(phh3)进行免疫荧光和定量(平均值
±
sem,n=6)。只有当phh3
+
细胞核在z平面中的cmlc2:gfp
+
心肌中时,才对phh3
+
心肌细胞进行计数。(f)tg(cmlc2:3xha-klf1-er;cryaa:tagbfp)
vcc32
(以下称为klf1-er),允许klf1在心肌细胞中瞬时核转位的转基因系统。(g),用于klf1-er鱼的4-ht处理方案。klf1-er鱼用运载体或4-ht o/n处理7天,然后是在正常水族箱条件下30天的恢复期。(h)用运载体或4-ht处理7天后对klf1-er心脏的总体形态进行30天分析。(i)对(h)的心脏切片进行picro-mallory染色。(j)是(i)的定量。(k,l)细胞大小定量分析(k)[n=332(运载体)、326(4-ht)],以及(h)的解离cm细胞数计数(l)(平均值
±
sem,n=3)。两个独立分析的代表性数据显示在(k)和(l)中。at,心房;ba,动脉球;dapi,4’,6-二脒基-2-苯基吲哚;dpt,处理后天数;edu,5-乙炔基-2
’‑
脱氧尿苷;o/n,过夜;tem,透射电子显微镜;veh,运载体;vt,心室。*p《0.05,**p《0.01,****p《0.001,通过mann-whitney u检验(c,d,e)或非配对t检验(k,l)获得。比例尺500μm in(h,i)。
[0057]
图13:klf1相关家族成员的功能分析和klf1表达的非心肌作用。使用klf1-on或klf1-off的心脏组织切片对血管(a)(平均值
±
sem,n=4)和心外膜细胞面积(b)(平均值
±
sem,n=3-4)进行定量。(c)表达klf1、klf2a、klf2b和klf4的心脏切片中phh3
+
actinin
+
心肌细胞的定量(平均值
±
sem,n=4)。klf2a、klf2b和klf4在心肌细胞中以如klf1-on所述(图12a)的诱导方式进行表达。z平面中actinin
+
心肌内的phh3
+
细胞核被计为有丝分裂的心肌细胞。phh3,磷酸组蛋白h3。*p《0.05,****p《0.001通过非配对t检验获得。
[0058]
图14:klf1-on斑马鱼的心脏功能障碍。(a)klf1-on鱼在12dpt时出现心力衰竭样表型,如竖鳞(括号)、充血(箭头)和腹部水肿(三角)。(b),kaplan-meier生存曲线表明klf1-on鱼的存活显著降低(n=10;p《0.0001,时序检验法)。
[0059]
图15:klf1诱导的斑马鱼心脏再生长的表观遗传学分析。(a,b)生成来自7dpt的klf1-off和on心室的3xha-klf1 chip-seq读取密度的热图(a),并在klf1峰的顶点的
±
100bp范围内富集基序(b)。(c)使用great的klf1峰的功能注释。(d)7dpt时klf1-off和on心室中5-甲基胞嘧啶(5mc)水平的分类热图(sorted heatmap)和位于klf1 chip-seq峰值处的h3k27ac、h3k4me1或h3k4me3的归一化的chip-seq读取密度。根据h3k27ac/h3k4me1(增强子)和h3k4me3谱(启动子)将klf1 chip-seq峰分为两类,并呈现相应的热图。(e)7dpt时从klf1-off和on心室获得的atac-seq读取热图。(f)h3k27ac chip-seq峰的热图,以(e)中区别富集的atac-seq峰为中心。(g)箱线图显示所有基因的mrna表达和与来自(e)的klf1-on心脏中减少的atac-seq峰最近的基因的mrna表达。(h)使用great对klf1-on心脏中减少的atac-seq峰进行的功能注释。(i)gsea图证明7dpt(fdr《1.0
×
10-6)时klf1-off和on心脏的rna-seq数据中心肌收缩转录物的kegg基因集的富集得分。bp,碱基对;chip,染色质免疫沉淀;dpt,处理后天数;fc,倍数变化;fdr,错误发现率;great,基因组区域富集注释工具;gsea,基因集富集分析;kegg,京都基因与基因组百科全书。
[0060]
图16:klf1诱导的斑马鱼心脏再生的转录组学和代谢组学分析。(a,b)7dpt时对klf1-off和on心脏的rna-seq数据的富集分析显示来自go生物过程(a)和kegg通路(b)的上调和下调的基因集。(c-e),来自7dpt时klf1-off和on心脏的rna-seq数据的分析的gsea图显示基因签名的富集得分,如细胞分裂(c)、dna复制(d)和生成代谢物前体和能量(e)。(f)7dpt时采用tem分析klf1-off和on心室心肌中线粒体的超微结构,并对嵴数进行定量(平均值
±
sem,n=30-32)。(g)7dpt时采用qpcr对klf1-off和on心室的线粒体dna含量(mtdna)进行的定量(平均值
±
sem,n=3)。用核dna(ndna;actb2)的表达对mtdna(mt-co1,mt-nd1)的表达进行归一化,并相对于klf1-off对照的水平显示。(h-k)7dpt时对klf1-off和on心室中的nadh(h)、nad
+
(i)、nadh/nad
+
比率(j)和atp(k)进行的定量(平均值
±
sem,n=3-4)。(l)7dpt时从klf1-off和on心室的rna-seq数据获得的调节线粒体生物形成和功能的基因的表达值(以fpkm为单位)(平均值
±
sem,n=4)。(m-p)7dpt时对klf1-off和on心室中葡萄糖6-磷酸(m)、核糖5-磷酸(n)、景天庚酮糖7-磷酸(o)和丝氨酸(p)进行基于质谱的定量(平均值
±
sem,n=5)。定量值相对于klf1-off对照的水平显示。(q-s)7dpt时klf1-off和on心室中nadph(q)、nadp
+
(r)和nadph/nadp
+
比率(s)的定量(平均值
±
sem,n=3)。fdr,错误发现率;fpkm,每千个碱基的外显子每百万映射的读取的片段;go,基因本体;gsea,基因集富集分析;kegg,京都基因与基因组百科全书。*p《0.05、**p《0.01、***p《0.005和****p《0.001,通过非配对t检验获得。
[0061]
图17:小鼠心脏中klf1功能的广泛分析。(a)心肌梗塞后新生和成年小鼠心脏中小鼠klf1(mklf1)表达的时程qrt-pcr分析(平均值
±
sem,n=3-4)。基因表达相对于未损伤对
照(0dpi)的水平显示。mi由永久结扎成年小鼠和出生后第2天新生小鼠的左前降支(lad)冠状动脉诱发产生。(b)研究中使用的腺病毒载体。(c)研究中进行的实验和分析。echo,超声心动图。(d)来自ad-mklf1的增强绿色荧光蛋白(egfp)报告基因表达的免疫组织化学。虚线勾勒出梗塞区域。(e-g)ad-gfp(对照)和ad-mklf1注射心脏的时程超声心动图(平均值
±
sem,n=7-11)。显示了射血分数(e)和缩短分数(f),以及代表性的b模式和m模式图像(g)。在mi之前测量心功能基线并表示为0dpi(e,f)。(h)ad-gfp处理或ad-mklf1处理的心脏组织切片的gomori-trichrome染色。每个处理组显示两个独立的心脏。(i,j)(h)中心脏修复(i)和瘢痕组织大小(j)的定量(平均值=sem,n=8)。(k)对横截面损伤边界区心肌中的tnt和wga进行免疫荧光和定量(平均值=sem,n=5)。(l
–
n)ad-gfp(对照)和ad-mklf1注射的心脏中的ki67
+
tnt
+
心肌细胞(l;平均值
±
sem,n=5),edu
+
tnt
+
心肌细胞(m;平均值
±
sem,n=3
–
4),phh3
+
tnt
+
心肌细胞(n;平均值
±
sem,n=5)的定量。dpi,损伤后天数;edu,5-乙炔基-2
’‑
脱氧尿苷;phh3,磷酸组蛋白h3;wga,小麦胚芽凝集素。*p《0.05,***p《0.005,(i)之外的所有幅通过非配对t检验,(i)通过x2检验进行分析。
[0062]
图18:mklf1过表达对小鼠存活和非心肌组织的影响。(a)对静脉注射ad-gfp或ad-mklf1的小鼠肝组织切片中的ki67进行免疫荧光,显示了验证mklf1表达的egfp免疫染色。ki67
+
肝细胞通过自发荧光进行可视化,并在图像中进行形态学鉴定和定量(平均值
±
sem,n=10)。(b)对注射ad-gfp和ad-mklf1的mi后小鼠心室切片中的cd31进行免疫荧光,并对毛细血管进行定量(平均值
±
sem,n=5)。ad-gfp,含有绿色荧光蛋白构建体的腺病毒载体(对照);ad-mklf1,含有mklf1构建体的腺病毒载体;***p《0.005通过非配对t检验(a,b)获得。
[0063]
图19:hippo和erbb信号通路在klf1诱导的心肌细胞生成中的作用。(a,b)gsea图显示了7dpt时klf1-off和on心脏的rna-seq数据中与hippo信号(a)和erbb信号(b)通路相关的kegg基因集的富集得分。(c,d)在7dpt的klf1-on心脏(yap或erbb药理学抑制)中的心肌细胞增强因子2(mef2)和增殖细胞核抗原(pcna)的免疫荧光表明mef2和pcna共标记增殖性心肌细胞。对yap(c;平均值
±
sem,n=4)或erbb(d;平均值
±
sem,n=4)抑制的心脏中mef2
+
pcna
+
细胞进行定量。dpt,处理后天数;fdr,错误发现率;gsea,基因集富集分析;kegg,京都基因与基因组百科全书;yap,yes相关蛋白。
具体实施方案
[0064]
许多心脏疾病涉及心肌细胞损失,所述心肌细胞没有被替换,因为成体心肌细胞是增殖能力有限的终末分化细胞。如本发明所证明的,klf或klf核酸的施用可用于促进心肌细胞生成。如本文所证明的,klf1和klf2b中的每一个都可用于促进心肌细胞生成。所述过程涉及成年心肌细胞的去分化,其之后增殖并随后分化成心肌细胞。也就是说,至少一种klf的施用可用于促进或诱导成年心脏中的心肌细胞生成。
[0065]
在一实施方案中,klf诱导的心肌细胞生成不是通过重编程细胞谱系而是通过将成年心肌细胞的状态重编程为增殖状态。上述过程可能伴随着重编程的心肌细胞促进邻近组织的生长。
[0066]
在一些实施方案中,心肌细胞生成包括心外膜细胞和内皮细胞的扩增。
[0067]
方法
[0068]
增加klf的水平或活性,例如通过将至少一种klf核酸向心脏组织施用增加可用于
促进或诱导体外或体内心肌细胞生成。因此,提供了用于促进或诱导心肌细胞生成的方法,其包括向受试者施用至少一种klf,或至少一种klf核酸,或至少一种包含klf核酸的表达载体。在一实施方案中,心肌细胞生成与心肌细胞去分化有关,例如成体心肌细胞的去分化。
[0069]
适用的受试者包括患有心脏病的个体(例如哺乳动物受试者,如人类;非人灵长类动物;实验性非人哺乳动物受试者,如小鼠、大鼠等)。心脏病可能导致缺血性心脏组织,例如患有冠状动脉疾病的个体等等。适用的受试者包括患有心力衰竭或退行性心脏疾病如家族性心肌病、扩张型心肌病、肥厚型心肌病、限制性心肌病或冠状动脉疾病导致的缺血性心肌病。
[0070]
所述受试者可以是婴儿、儿童或成人。
[0071]
在一实施方案中,所述方法包括向受试者的心肌细胞或心脏组织klf、klf核酸或包含klf核酸的表达载体施用。或者或另外地,所述方法可涉及在受试者的心肌细胞中诱导klf的表达。心肌细胞中活性klf的添加或表达使心肌细胞去分化。所得细胞(增殖性心肌细胞)随后可以增殖以替换由于例如缺血事件而损失的至少一部分心肌细胞。增殖后,去分化的细胞重新分化为功能性心肌细胞。
[0072]
在一些实施方案中,向心肌细胞或心脏组织施用klf、klf核酸或包含klf核酸的表达载体。对心肌细胞和/或心脏组织的施用可以在体外或体内进行。klf、klf核酸或包含klf核酸的表达载体可以与细胞直接接触,即直接应用于细胞,或者或者可以与细胞间接结合,例如通过将klf、klf核酸或表达载体注射到受试者的血流中,其随后将所述分子携带到细胞。或者或另外地,可以直接向心脏施用klf、klf核酸或包含klf核酸的表达载体,例如通过注射到心肌中施用。
[0073]
在这些方法中,向受试者施用治疗有效量的klf、klf核酸或表达载体。在一些实施方案中,施用涉及将klf、klf核酸或表达载体递送至心脏组织或直接递送至心肌细胞。
[0074]
施用klf、klf核酸或表达载体可以通过本领域已知的任何方法实现。在一些实施方案中,细胞与klf或klf核酸的接触发生在体外或体内。klf或klf核酸可以直接与细胞接触,即直接应用于心肌细胞,或者或者可以与细胞间接结合,例如,通过将klf1或klf1核酸注射到受试者的心脏组织中。
[0075]
在一些实施方案中,与内源性klf水平相比,klf、klf核酸或表达载体的施用提高了心肌细胞或心脏组织中的klf水平。在上下文中使用的术语“内源性”是指在klf、klf核酸或表达载体的施用之前klf“天然存在的”表达水平和/或活性。
[0076]
心肌细胞生成
[0077]
心肌细胞生成是一个复杂的过程,其中形成心脏肌肉组织(心肌)的心肌细胞(cm)分裂并产生新细胞。如本文所公开,klf诱导的心肌细胞生成是通过cm重编程和所述细胞的扩增(增殖),随后再分化成成熟的可收缩cm介导的。
[0078]
klf诱导心肌细胞去分化,产生增殖性心肌细胞。也就是说,心肌细胞是终末分化细胞,在正常成年人中无法分化形成其他细胞类型或再生。人们普遍认为,出生后心肌细胞会经历终末分化,其特征是双核化和中心体解体,导致心脏无法再生。然而,如本文所证明的,klf施用诱导cm去分化为增殖性cm。在一些实施方案中,增殖性cm是有丝分裂的。
[0079]
在一些实施方案中,所述方法涉及允许增殖性心肌细胞在klf存在下增殖。这可以在合适的细胞或组织培养条件下发生在体外,也可以发生在体内。增殖的结果是每个cm产
生一个增殖性心肌细胞群。
[0080]
一旦klf被去除,或者一旦klf被代谢或降解,增殖性心肌细胞群自发分化,产生心肌细胞群。这样,klf可用于体外或体内增加心肌细胞的数量。
[0081]
在一些实施方案中,klf诱导染色质重构以促进去分化。
[0082]
在一实施方案中,表达klf的cm具有旁分泌作用。例如,如本文所示例的,klf的表达增加了心外膜细胞和血管内皮细胞的数量。
[0083]
在一实施方案中,在肌球蛋白重链(mhc)启动子控制下的cm中klf的表达不会导致心外膜和内皮细胞标记物raldh2(视黄醛脱氢酶2;也称为aldh1a2)的表达。因此,cm中klf的表达不会改变细胞谱系。即使在增殖1、2、3、4、5、6、7、8、9、10、11或12天后,细胞谱系也不会改变。在一些实施方案中,与正常cm相比,通过mhc启动子的klf表达处于降低的水平。
[0084]
也就是说,klf在成年心脏中诱导的心肌细胞生成不涉及重编程细胞谱系。而是,klf诱导的心肌细胞生成的特征在于将成年cm的状态重编程为极度增殖状态,同时具有促进邻近组织生长的能力。
[0085]
在一些实施方案中,klf诱导的心肌细胞生成的特征在于能量产生从氧化磷酸化(oxphos)转换到戊糖磷酸途径(ppp)和/或丝氨酸合成途径(spp)。
[0086]
klf1
[0087]
如本文所用,“kr
ü
ppel样因子”或“klf”是指来源于任何物种(例如,小鼠、人、非人灵长类动物)的klf1或klf2b的任何蛋白质变体,及其保留klf活性的任何突变体和片段。类似地,“klf核酸”是指编码klf的任何核酸序列,例如,其来源于任何物种,例如小鼠、人或非人灵长类动物。人klf1氨基酸序列如seq id no:1所示,人klf1核苷酸序列如seq id no:2中下划线部分和seq id no:3中的编码序列所示。小鼠klf1核苷酸序列如seq id no:4所示,编码序列如seq id no:5所示。klf1也称为类红细胞kr
ü
ppel样转录因子(eklf)、kr
ü
ppel样因子1、inlu或hbfqtl6。斑马鱼klf2b的氨基酸序列如seq id no:6所示,斑马鱼klf2b的核苷酸序列如seq id no:7和seq id no:8编码序列所示。此外,斑马鱼klf1的氨基酸序列如seq id no:11所示,斑马鱼klf1的核苷酸序列如seq id no:9所示和seq id no:10的编码序列所示。
[0088]
在一些实施方案中,klf可以来源于非人或非哺乳动物物种。例如,klf可能来源于斑马鱼或可再生物种,如蝾螈或蛇。
[0089]
如本文所述,klf或编码klf的核酸(klf核酸)可用于在体外或体内诱导心肌细胞生成。因此,klf和klf核酸可用于治疗病症,其中心肌细胞去分化、增殖或两者是想要的,如缺血性损伤,例如心肌梗塞(mi)后;例如由心脏毒性药物(例如,蒽环类抗生素,如阿霉素、可卡因、甲基苯丙胺、环状抗抑郁药、钙通道阻滞剂、β-受体阻滞剂和地高辛)或外伤(意外的或故意导致的手术结果)引起的心脏损伤后;心力衰竭;或与衰老相关的心脏功能下降。
[0090]
本文所公开的方法可用于心脏再生。在上下文中,“心脏再生”是指受损心脏的结构和/或功能再生或改善。例如,在klf的施用后,心脏中心肌细胞数量增加的结构改善。功能改善的一个例子是在klf的施用后,心脏收缩力或射血分数的增加。
[0091]
例如,与flk施用前的射血分数或缩短分数相比,射血分数、缩短分数或两者可以增加1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%或更多。
[0092]
在一些实施例中,心脏再生发生在klf施用后的2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28天。
[0093]
本文所公开的方法可以采用klf变体或klf功能片段。变体或功能片段能够以与野生型klf相同的特异性结合dna,并保留野生型klf的至少一种功能。例如,在一实施方案中,变体或功能片段是保留dna结合活性的任何klf变体。
[0094]
在一些实施方案中,klf可以是缀合物或融合蛋白。例如,klf融合蛋白。融合蛋白包含klf的至少一部分,其通过肽键连接另一种蛋白质、肽或多肽的至少一部分,例如核定位序列或额外的klf或其结构域,例如反式激活结构域。在一些实施方案中,klf可以融合到另一种蛋白质的反式激活结构域,例如反式激活结构域p53或vp16。融合蛋白还可以包含标记蛋白(例如荧光蛋白,如gfp),或有助于分离和/或纯化的蛋白(例如,flag或his标签)。非klf序列可以在klf序列的氨基端或羧基端。
[0095]
在一些实施方案中,klf与一种或多种核定位序列融合。
[0096]
在一些实施方案中,klf核酸编码klf融合蛋白。
[0097]
在一些实施方案中,所述方法要求施用的klf包含成熟的klf氨基酸序列。或者,klf可以与成熟的klf氨基酸序列具有至少80%的相同性。通常,可用于本发明所述方法的klf与野生型klf氨基酸序列具有至少80%的相同性,例如与野生型氨基酸序列具有80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98或99%的序列相同性。适用的kfl蛋白可以通过常规实验鉴定。通常,把klf蛋白起野生型klf的作用。
[0098]
所述方法可以包括施用包含成熟klf编码序列的klf核酸。或者,klf核酸可以与成熟的klf编码序列具有至少80%的相同性。通常,可用于本发明所述方法的klf核酸与野生型klf核酸具有至少80%的相同性,例如与野生型核酸具有80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98或99%的序列相同性。适用的核酸可以通过常规实验鉴定。通常,核酸必须编码起野生型klf作用的蛋白质。
[0099]
在一些实施方案中,klf核酸可以是ssrna、dsrna、dsdna或表达载体,例如,包含klf核酸质粒表达载体的病毒表达载体。klf核酸可以包括一种或多种修饰。
[0100]
在一些实施方案中,klf核酸包含至少一种在糖的2’位置进行修饰的核苷酸,例如2
’‑
o-烷基、2
’‑
o-烷基-o-烷基或2
’‑
氟修饰的核苷酸。在其他实施方案中,rna修饰包括嘧啶核糖上的2
’‑
氟、2
’‑
氨基和2’o-甲基修饰,rna的3’末端的碱性残基或反向碱基。
[0101]
许多对核苷酸和核苷的修饰使得其所掺入的核酸对核酸酶消化更具抵抗性。修饰的klf核酸的具体实例包括包含修饰骨架的那些,例如硫代磷酸酯、磷酸三酯、膦酸甲酯、短链烷基或环烷基糖间键或短链杂原子或杂环糖间键。在一些实施方案中,klf核酸的修饰是硫代磷酸酯骨架或杂原子骨架,特别是ch
2-nh-o-ch2,ch,-n(ch3)-o-ch2(称为亚甲基(methylimino)或mmi骨架)、ch
2-o-n(ch3)-ch2,ch
2-n(ch3)-n(ch3)-ch2或o-n(ch3)-ch
2-ch2骨架,其中天然磷酸二酯骨架表示为o-p-o-ch;酰胺骨架;吗啉代骨架结构;肽核酸(pna)骨架(其中寡核苷酸的磷酸二酯骨架被聚酰胺骨架取代,核苷酸直接或间接与聚酰胺骨架的氮杂氮原子结合)。含磷键包括但不限于硫代磷酸酯、手性硫代磷酸酯、二硫代磷酸酯、磷酸三酯、氨基烷基磷酸三酯、甲基和其他烷基膦酸酯(包含3’亚烷基膦酸酯和手性膦酸酯)、次膦酸酯、氨基磷酸酯(包含3
’‑
氨基磷酸酰胺和氨基烷基磷酸酰胺)、硫代氨基磷酸酯、硫代烷基膦酸酯、硫代烷基磷酸三酯或硼代磷酸酯(boranophosphate)。
[0102]
其中不包括磷原子的修饰的核酸骨架具有由短链烷基或环烷基核苷间键、混合杂原子和烷基或环烷基核苷间键、或一个或多个短链杂原子或杂环核苷间键形成的骨架。这些包含具有吗啉代键(部分由核苷的糖部分形成)的骨架;硅氧烷骨架;硫化物、亚砜和砜骨架;甲乙酰基和硫代甲乙酰基骨架;亚甲基甲乙酰和硫代甲乙酰骨架;含有烯烃的骨架;氨基磺酸盐骨架;亚甲基亚氨基和亚甲基肼基骨架;磺酸酯和磺胺骨架;酰胺骨架;和其他混合了n、o、s和ch2成分的骨架类。
[0103]
也可以包括一个或多个取代的糖部分,例如,在2’位置的以下之一:oh、sh、sch3、f、ocn、och3och3、och3o(ch2)n ch3、o(ch2)n nh2或o(ch2)n ch3,其中n为1至约10;c1至c10低级烷基、烷氧基烷氧基、取代的低级烷基、烷芳基或芳烷基;cl;br;cn;cf3;ocf3;o-、s-或n-烷基;o-、s-或n-烯基;soch3;so2;ch3;ono2;no2;n3;nh2;杂环烷基;杂环烷芳基;氨基烷基氨基;聚烷基氨基;取代的甲硅烷基;用于改善核酸药代动力学特性的基团;或用于改善核酸和其他具有相似性质的取代基的药效学性质的基团。在另一实施例中,核酸序列可以包括2
’‑
修饰的核苷酸,例如,2
’‑
脱氧、2
’‑
脱氧-2
’‑
氟、2
’‑
o-甲基、2
’‑
o-甲氧基乙基(2
’‑
o-moe)、2
’‑
o-氨基丙基(2
’‑
o-ap)、2
’‑
o-二甲基氨基乙基(2
’‑
o-dmaoe)、2
’‑
o-二甲基氨基丙基(2
’‑
o-dmap)、2
’‑
o-二甲基氨基乙氧基乙基(2
’‑
o-dmaeoe)或2
’‑
o-n-甲基乙酰胺(2
’‑
o-nma)。
[0104]
在另一实例中,klf核酸序列可以包括至少一个2
’‑
o-甲基修饰的核苷酸,并且在一些实施方案中,所有的核苷酸都包括2
’‑
o-甲基修饰。在另一实施方案中,修饰是2
’‑
甲氧基乙氧基[2
’‑
o-ch2ch2och3,也称为2
’‑
o-(2-甲氧基乙基)]。其他修饰包括2
’‑
甲氧基(2
’‑
o-ch3)、2
’‑
丙氧基(2
’‑
och2ch2ch3)或2
’‑
氟(2
’‑
f)。类似的修饰也可以在核酸上的其他位置进行,特别是3’末端核苷酸上糖的3’位置和5’末端核苷酸的5’位置。核酸还可以具有糖模拟物,如环丁基取代呋喃戊糖基。
[0105]
klf核酸还可以包括,附加地或或者,碱基修饰或取代。如本发明所述,“未修饰”或“天然”核碱基包括腺嘌呤(a)、鸟嘌呤(g)、胸腺嘧啶(t)、胞嘧啶(c)和尿嘧啶(u)。修饰的核碱基包括在天然核酸中仅不经常或短暂发现的核碱基,例如,次黄嘌呤、6-甲基腺嘌呤、5-甲基嘧啶,特别是5-甲基胞嘧啶(也称为5-甲基-2’脱氧胞嘧啶并且在本领域中经常称为5-me-c)、5-羟甲基胞嘧啶(hmc)、糖基hmc或龙胆二糖基hmc,以及合成的核碱基,例如,2-氨基腺嘌呤、2-(甲基氨基)腺嘌呤、2-(咪唑烷基)腺嘌呤、2-(氨基烷基氨基)腺嘌呤或其他杂取代的烷基腺嘌呤、2-硫尿嘧啶、2-硫胸腺嘧啶、5-溴尿嘧啶、5-羟甲基尿嘧啶、8-氮鸟嘌呤、7-脱氮鸟嘌呤、n6(6-氨基己基)腺嘌呤或2,6-二氨基嘌呤。也可以包括肌苷。其他修饰包括其他合成和天然核碱基,如5-甲基胞嘧啶(5-me-c)、5-羟甲基胞嘧啶、黄嘌呤、次黄嘌呤、2-氨基腺嘌呤、腺嘌呤和鸟嘌呤的6-甲基以及其他烷基衍生物、腺嘌呤和鸟嘌呤的2-丙基和其他烷基衍生物、2-硫尿嘧啶、2-硫胸腺嘧啶和2-硫胞嘧啶、5-卤尿嘧啶和胞嘧啶、5-丙炔基尿嘧啶和胞嘧啶、6-偶氮尿嘧啶、胞嘧啶和胸腺嘧啶、5-尿嘧啶(假尿嘧啶)、4-硫脲嘧啶、8-卤代、8-氨基、8-硫代、8-硫代烷基、8-羟基或其他8-取代的腺嘌呤和鸟嘌呤、5-卤代特别是5-溴、5-三氟甲基或其他5-取代的尿嘧啶和胞嘧啶、7-甲基鸟嘌呤和7-甲基腺嘌呤、8-氮杂鸟嘌呤和8-氮杂腺嘌呤、7-脱氮鸟嘌呤和7-脱氮腺嘌呤以及3-脱氮鸟嘌呤和3-脱氮腺嘌呤。
[0106]
没有必要对给定核酸中的所有位置进行统一修饰,并且可以将超过一种的上述修
饰掺入单个寡核苷酸中或甚至掺入寡核苷酸内的单个核苷中。
[0107]
在一些实施方案中,核酸与一个或多个部分或缀合物化学连接,其增强寡核苷酸的活性、细胞分布或细胞摄取。这样的部分包括但不限于脂质部分如胆固醇部分、硫醚(例如己基-s-三苯甲基硫醇)、脂肪链(例如十二烷二醇或十一烷基残基)、磷脂(例如二-十六烷基-外消旋甘油或三乙基铵1,2-二-o-十六烷基-外消旋-甘油-3-h-膦酸酯)、聚胺或聚乙二醇链或金刚烷乙酸、棕榈基部分或十八烷基胺或己氨基-羰基-叔氧基胆固醇部分。
[0108]
在一些实施方案中,klf核酸与启动子序列可操作地偶联。启动子序列可以具有组成型活性或可以具有组成活性(compositionally active)。在一些实施方案中,启动子序列是心脏特异性的,例如心脏特异性启动子序列可以是α-肌球蛋白重链(α-mhc)启动子、肌球蛋白轻链2(mlc-2)启动子、心肌肌钙蛋白c(ctnc)启动子、ncx1启动子或tnnt2启动子。
[0109]
在一些实施方案中,klf核酸与诱导型启动子可操作地偶联,例如四环素诱导型启动子、类固醇激素(例如孕酮或蜕皮激素)诱导型启动子或缺氧响应性启动子。
[0110]
在其他实施方案中,klf核酸与受损区域相邻的心脏区域有活性或选择性有活性的启动子可操作地偶联。这样的启动子包括,例如,gata-4启动子。
[0111]
在其他实施方案中,klf核酸与基因的启动子可操作地偶联,所述基因响应于由缺血和再灌注引起的胁迫在心脏组织中过表达。这样的基因包括氨基己二酸-半醛合酶、载脂蛋白e、含黄素的单氧酶2、nadph氧化酶4、前列腺素内过氧化物合酶2、重组激活基因2、硬脂酰辅酶a去饱和酶1或溶质载体家族38(成员1)。
[0112]
klf施用
[0113]
在本文所述的方法中,将klf或klf核酸施用于受试者。特别地,将klf或klf核酸施用于靶细胞、组织或器官。在一些实施方案中,将klf或klf核酸施用于靶细胞、组织或器官,或者将编码klf核酸的表达载体施用于表达klf核酸的靶细胞、组织或器官。在一些实施方案中,施用是全身性的并且表达载体被摄取到靶细胞、组织或器官中。在一些实施方案中,表达载体可以被非靶细胞、组织或器官摄取,但优选地对非靶细胞或组织或对整个受试者没有显著的负作用。
[0114]
用于向靶细胞施用或递送核酸和表达构建体的方法是本领域已知的并包括以下简要描述的方法。靶细胞可以是,例如,心肌细胞。在一些实施方案中,将klf、klf核酸或表达载体在体内递送至靶细胞、组织或器官。在一些实施方案中,将klf、klf核酸或表达载体离体施用于靶细胞。在一些实施方案中,将klf、klf核酸或表达载体在体外递送至靶细胞。
[0115]
在一些实施方案中,靶细胞是心肌细胞。心肌细胞可存在于受试者中或可存在于受试者外的培养物中。在一些实施方案中,将klf、klf核酸或表达载体施用于心脏或心脏组织。
[0116]
在其他实施方案中,靶细胞是增殖性心肌细胞。也就是说,可以将klf、klf核酸或表达载体施用于已经经历klf诱导的去分化的心肌细胞。
[0117]
在一些实施方案中,可以将klf核酸或表达载体离体转染或转导到受试者的细胞中。随后可以扩增能够表达klf的转染或转导细胞并将其施用于受试者。在一些实施方案中,细胞对于受试者是自体的。适用的细胞包括从血液或骨髓中分离的细胞,如成体造血干细胞/祖细胞。
[0118]
在一些实施方案中,klf、klf核酸或表达载体进行全身性递送,如通过静脉注射。
其他施用途径可以包括,例如,口服、局部、心内和肌肉内注射。在一些实施方案中,可将klf、klf核酸或表达载体离体递送至从受试者收集的细胞中,随后将含有klf、klf核酸或表达载体的细胞重新引入至受试者。
[0119]
在一些实施方案中,klf、klf核酸或表达载体通过心脏导管插入术进行施用。
[0120]
许多用于递送核酸(如klf核酸)的方法是本领域已知。这些方法包括腺相关病毒(aav)或慢病毒介导的递送、纳米颗粒介导的递送、凝胶泡沫介导的心包内递送;以及将核酸直接肌肉内施用到心脏中。
[0121]
klf核酸施用的优选方法是使用腺相关病毒(aav)。在一些实施方案中,klf核酸可以连续地或有条件地表达。此外,使用心脏局部(cardiotropic)aav血清型或突变体可提高组织特异性。因此,例如,所述方法包括以心脏局部aav递送klf核酸。适用的aav包括心脏特异性aav,如pacak and byrne,mol ther,2011,19(9),pp1582-1590中所述的那些aav。
[0122]
也可以使用其他病毒,例如逆转录病毒、慢病毒、hsv或腺病毒。
[0123]
除aav血清型外,使用心脏组织特异性启动子(例如ncx1、tnnt2)进行表达允许进一步的特异性。
[0124]
在一些实施方案中,klf、klf核酸或表达载体通过使用转染剂或递送运载体的转染进行施用。如本文所用,术语“递送运载体”是指增加klf核酸进入细胞的一种或多种化合物。递送运载体的实例包括蛋白质和聚合物复合物(polyplex)、聚合物和脂质的组合(lipopolyplex)、多层和再带电颗粒、脂质和脂质体(lipoplex,例如阳离子脂质体和脂质)、聚胺、磷酸钙沉淀物、聚阳离子、组蛋白、聚乙烯亚胺、聚赖氨酸和聚两性电解质复合物。在一些实施方案中,递送运载体包含转染剂。转染剂可用于压缩核酸。转染剂也可用于将官能团与多核苷酸关联。官能团的非限制性实例包括细胞靶向部分、细胞受体配体、核定位信号、增强从内含体或其他细胞内囊泡释放内容物的化合物(如膜活性化合物),以及其他能改变与之相连接的化合物或复合物的性能或反应性(相互作用修饰剂)的化合物。对于体内递送,可以使用由亚中和量的阳离子转染剂制成的复合物。
[0125]
在一些实施方案中,klf核酸或表达载体可以使用外泌体或外泌体样囊泡进行递送。例如,可以将klf核酸引入到产生外泌体的细胞中,并且可以从这些细胞分离含有klf核酸的外泌体。或者,可以根据本领域已知的任何方法分离或制备外泌体和引入外泌体的klf核酸。
[0126]
在一些实施方案中,klf核酸或表达载体可以使用脂聚合物、脂质体、明胶复合物、泊洛沙胺(poloxamine)纳米球或脂蛋白进行递送。
[0127]
实现klf核酸或表达载体的心脏特异性递送的替代技术是超声靶向微泡破坏技术(utmd)。此技术基于超声造影剂的物理特性,所述造影剂是充气微泡,当被超声仪超声处理时振荡造成微泡破坏。微泡中可以荷载klf核酸或表达载体,静脉输注,通过超声破坏心脏中的微泡,从而转染心脏。
[0128]
在一些实施方案中,可以全身递送klf核酸或表达载体。在一些实施方案中,klf核酸或表达载体可以与一种或多种药学上可接受的载剂组合递送。用于递送klf核酸或表达载体的聚合物试剂可掺入增加其效用的化合物。这些基团可以在聚合物形成之前掺入到单体中,或者在其形成之后连接到聚合物上。载体转移增强部分是修饰核酸复合物的分子,其可以被引导至培养物或整个生物体中的细胞位置(如组织细胞)或细胞中的位置(如细胞
核)。通过修饰复合物的细胞或组织位置,可以增强所需的klf核酸或表达载体的定位和活性。转移增强部分可以是,例如,蛋白质、肽、脂质、类固醇、糖、碳水化合物、核酸、细胞受体配体或合成化合物。在一些实施方案中,转移增强部分可以增强细胞与受体的结合、从细胞质向细胞核的转运以及核的进入或从内含体或其他细胞内囊泡的释放。
[0129]
核定位信号(nls)也可用于增强mir-1核酸或表达载体到细胞核附近的靶向和/或其进入细胞核。这样的核转运信号可以是蛋白质或肽,如sv40大标签nls或核质蛋白nls。这样的核定位信号与多种核转运因子相互作用,如nls受体(核转运蛋白α),其随后与核转运蛋白β相互作用。在一些实施方案中,核转运蛋白本身也可以起nls的作用,因其靶向核孔和细胞核。
[0130]
本领域技术人员将能够选择和使用合适的系统,用于在体外、离体或体内将klf核酸或表达载体递送至心脏或心脏组织或心肌细胞或其他靶细胞,不需要过多的实验。
[0131]
在一些实施方案中,需要klf核酸或表达载体的局部递送。特别地,需要将klf核酸或表达载体递送至心脏。
[0132]
将klf、klf核酸或表达载体局部递送至心脏的策略有多种。例如,渗透微型泵,如渗透泵,可用于以可持续的治疗浓度有效地局部递送klf、klf核酸或表达载体。带有储液罐的泵通常被植入皮下组织,并通过硅胶管或套管将klf、klf核酸或表达载体输送到目标组织。渗透微型泵依靠渗透压进行稳态药物递送,并已应用于临床。
[0133]
klf、klf核酸或表达载体的局部递送可以通过细胞移植来实现。除了细胞替代疗法之外,也可以将含有klf、klf核酸或表达载体的细胞移植到心肌。
[0134]
klf剂量
[0135]
klf、klf核酸或表达载体的施用有效剂量水平将取决于多种因素,包括:正在治疗的病症类型和病症阶段;所用klf、klf核酸或采用的表达载体的活性和性质;采用的组合物;受试者的年龄、体重、一般健康状况、性别和饮食;施用时间;施用途径;治疗的持续时间;与治疗联合或同时使用的药物,以及医学上众所周知的其他相关因素。
[0136]
本领域技术人员将能够通过常规实验确定治疗适用病症所需的有效、无毒剂量。这些通常是根据具体情况确定的。
[0137]
一般地,预期有效剂量在每公斤体重每24小时约0.0001mg至约1000mg的范围内;典型地,每公斤体重每24小时约0.001mg至约750mg;每公斤体重每24小时约0.01mg至约500mg;每公斤体重每24小时约0.1mg至约500mg;每公斤体重每24小时约0.1mg至约250mg;或每公斤体重每24小时约1.0mg至约250mg。更典型地,预期有效剂量在每公斤体重每24小时约10mg至约200mg范围内。
[0138]
或者,有效剂量可高达约5000mg/m2。一般地,预期有效剂量为约10至约5000mg/m2、典型地约10至约2500mg/m2、约25至约2000mg/m2、约50至约1500mg/m2、约50至约1000mg/m2,或约75至约600mg/m2。
[0139]
进一步,对于本领域的普通技术人员来说,显然各个剂量的最佳量和间隔将由所治疗病症的性质和程度、施用的形式、途径和部位,以及被治疗的特定个体的性质来确定。而且,所述的最佳条件可以通过常规技术确定。
[0140]
对于本领域普通技术人员来说,显然最佳治疗过程,如在限定的天数内每天给予的组合物的剂量数,可以由本领域技术人员通过常规疗程测定试验确定。
[0141]
治疗的功效还可以通过用klf、klf核酸或表达载体处理受试者,测定受试者样品中klf的表达水平来评估。一段时间后,对受试者进一步的样品中klf核酸的表达水平进行测定,并且klf核酸表达水平的变化可以指示治疗方案的功效。样品可以包含血浆或血清。
[0142]
或者或另外地,治疗的功效可以通过测定增殖性心肌细胞的水平来评估,例如测定经klf、klf核酸或表达载体处理的受试者的样品。
[0143]
心肌细胞群/心脏祖细胞群
[0144]
klf、klf核酸或表达载体的施用产生增殖性心肌细胞群。增殖性心肌细胞可以是未成熟心肌细胞群、具有胚胎表型的心肌细胞或心脏祖细胞群,及其任意组合。所述增殖性心肌细胞群可掺入药物组合物中以施用于受试者。在一些实施方案中,可以允许增殖性心肌细胞群在掺入药物组合物之前分化成心肌细胞。
[0145]
klf、klf核酸或表达载体可以施用于受试者(或其他地方)的成年心肌细胞以诱导心肌细胞生成。所得细胞,无论其是心肌细胞群还是增殖性心脏祖细胞群,都可以制备为药物组合物,例如无菌水性溶液或非水性溶液、悬浮液或乳液,其另外包含生理学上可接受的载剂(即,不干扰心肌细胞活性的无毒材料)。本领域普通技术人员已知的任何适用的载剂都可以用于药物组合物中。载剂的选择将部分取决于所施用物质(即细胞或化学化合物)的性质。
[0146]
适用的载剂包括生理盐水溶液、明胶、水、醇、天然或合成油、糖溶液、二醇、可注射的有机酯如油酸乙酯或这些材料的组合。药物组合物可以另外包含防腐剂和/或其他添加剂,例如抗微生物剂、抗氧化剂、螯合剂和/或惰性气体,和/或其他活性成分。在一些实施方案中,根据已知的封装技术封装心肌细胞群或心脏祖细胞群。
[0147]
在一些实施方案中,心肌细胞群或心脏祖细胞群存在于基质中。
[0148]
心肌细胞群或心脏祖细胞群的单位剂型可以含有约103个细胞至约109个细胞,例如,约103个细胞至约104个细胞,约104个细胞至约105个细胞,约105个细胞约106个细胞,约106个细胞至约107个细胞,约107个细胞至约108个细胞,或约108个细胞至约109个细胞。
[0149]
在一些实施方案中,提供了一种体外诱导心肌细胞群中的心肌细胞生成并将心肌细胞群植入受试者心脏中的方法。心肌细胞群可用于异体或自体移植到有需要的个体中。
[0150]
联合疗法
[0151]
在定义klf、klf核酸或载体与一种或多种其他药剂一起使用时,术语“联合疗法”或“辅助疗法”旨在包括在方案中以顺序方式施用每种药剂,其将提供药物联合的有益效果,以及旨在包括以基本同时的方式共同施用所述药剂,如在单一制剂中具有固定比例所述活性药剂中,或在每种制剂的多个单独制剂中。
[0152]
根据本发明的各种实施方案,klf、klf核酸或载体中的一种或多种可以与一种或多种额外的治疗剂联合配制或施用。因此,根据本发明的各种实施方案,klf、klf核酸或载体中的至少一种可以包括在与手术和/或其他已知治疗或治疗剂和/或辅助剂或预防剂的联合治疗方案中。
[0153]
许多药剂(agent)可用于商业用途、临床评价和临床前开发,其可以被选择用于治疗上述列出的作为部分联合药物疗法的疾病和病症。本领域技术人员会分辨出可用于联合治疗的适用药剂。适用的药剂列于,例如merck index,an encyclopaedia of chemicals,drugs and biologicals,12th ed.,1996和后续版本,其全部内容通过引用并入本文。
[0154]
联合方案可涉及在每种情况下酌情将活性剂同时施用、顺序施用或间隔施用。包括klf、klf核酸或载体中的至少一种的活性剂的组合可以是协同的。
[0155]
klf、klf核酸或载体中的至少一种与其他试剂的共同施用可以通过以下实现:试剂作为另一种活性剂采用相同的剂量,或一种或多种其他活性剂作为单剂或分散试剂采用相同的剂量,或类似的时间,或根据给药方案或安排采用不同的时间施用。顺序施用可以根据需要以任何顺序进行,并且可能需要第一种或初始化合物的持续生理效应起效后再施用第二种或后续的化合物,尤其是在需要累积或协同效应的情况下。
[0156]
本领域技术人员会了解,在不背离广泛描述的本发明实质或范围的情况下,可以对具体实施例中所示的本发明进行多种变化和/或修改。因此,所述实施例在所有方面都被认为是说明性的而不是限制性的。
[0157]
为了使本发明技术可易于理解,优选的实施方案将参考以下附图和实施例进行描述。
[0158]
实施例
[0159]
实施例1:损伤诱导斑马鱼心脏再生过程中klf1的心肌细胞表达。
[0160]
在研究斑马鱼心脏再生的分子机制时,本发明人发现了损伤诱导的kr
ü
ppel样因子1(klfl)的心肌细胞表达(图1a),所述基因编码锌指转录因子klf1/eklf的斑马鱼直系同源物。在哺乳动物中,klf1在造血组织中表达,且对红细胞发育至关重要,但在本研究之前,klf1在非造血器官中的作用尚不清楚。
[0161]
定量逆转录酶聚合酶链反应(rt-qpcr)分析表明在损伤后7天(dpi)时klfl表达瞬时达到峰值(图1b),对应于心肌细胞(cm)再生增殖的最大反应。当采用荧光活化细胞分选技术(facs)从7dpi的特定细胞报告系的心室中提取纯化的心脏细胞进行rt-qpcr时,klf1转录物在cm中检测到,但未在心外膜和心内膜细胞中检测到(图1b)。还采用遗传cm消融模型评估了klf1表达,其中4-羟基他莫昔芬(4-ht)处理可以特异性地损伤心肌而不引起出血。使用cm耗尽的心脏的切片,本发明人对肌钙蛋白c(tnc)(一种胞内肌肉标志物)进行了高灵敏度的原位杂交和免疫荧光分析,并检测到再生心肌中klf1 mrna信号与tnc的共定位(图1c,三角)。这些数据表明损伤诱导斑马鱼心脏再生过程中klf1的心肌细胞表达。
[0162]
实施例2:klf1对斑马鱼的心脏再生至关重要。
[0163]
为了研究klfl在心脏再生中的作用,本发明人建立了斑马鱼系tg(actb2:loxp-tagbfp-stop-loxp-dn-klf1)
vcc22
(以下称为actb2:bs-dn-klf1),其中klf1的显性-阴性形式(dn-klf1)在cm中被诱导,与心肌特异性cre驱动系tg(cmlc2:creer)(以下称为cmlc2:creer)结合。我们用4-ht处理了cmlc2:creer;actb2:bs-dn-klf1(klfdn-on)和对照actb2:bs-dn-klf1鱼(klfdn-off)并在30dpi分析再生。令人惊讶的是,所有klfdn-on心脏在创伤区域都显示出极其严重的瘢痕(7颗中有7颗;图2a),而这样的表型在任何对照klfdn-off心脏均未观察到(7颗中有0颗;图2a)。dn-klf1的心肌表达显著地降低了cm增殖,其可以通过肌核标志物mef2与pcna的共标记减少进行检测(图2b)。这些数据表明,klf1是斑马鱼心脏再生必需的转录因子。
[0164]
使用定量转录分析,观察到损伤后7天(dpi)时klfl的表达达到表达峰值(图3a),与心肌细胞中最大再生诱导增殖的时期同时出现。这一瞬时的klf1表达仅限于纯化的心肌细胞,在心外膜(epi)或心内膜细胞(end)中未检测到(图3b)。使用条件性4-羟基他莫昔芬
(4-ht)诱导的心肌细胞消融模型,所述模型损伤心肌而不引起心脏出血,观察到klf1mrna与胞内肌肉标志物肌钙蛋白c的共定位。这表明再生心肌细胞在斑马鱼心脏再生过程中表达klf1。
[0165]
实施例3:klf1表达在斑马鱼心脏中诱导cm去分化。
[0166]
建立转基因斑马鱼系tg(actb2:loxp-tagbfp-stop-loxp-3xha-klf1)
vcc29
以在具有cmlc2:creer的cm中过表达3xha标记的klf1。双转基因鱼和cre-阴性的同批次孵化的对照分别称为klf1-on和klf1-off。klf1-on;cmlc2:gfp和klf1-off对照;cmlc2:gfp鱼用4-ht处理并评估去分化标记物sm22α(sm22)在cmlc2:gfp标记的cm中的表达。令人惊讶的是,与对照心脏(12d klf1-off)相比,sm22表达水平在klf1过表达的心脏中显著增加,其中所述表达最初在4-ht处理后7天(dpt)的心室最外层心肌中检测到,随后在12dpt时的内小梁心肌中也观察到。斑马鱼cm中的另一种去分化标记物tg(gata4:egfp)(以下称为gata4:gfp)的分析也显示了gata4:gfp的空间和时间模式与sm22的相似。与klf1-off心肌相比,z线的主要成分α-辅肌动蛋白的免疫荧光分析显示klf1-on心肌中有高度无组织性的肌节结构。此外,与cm去分化的组织学证据一致,klf1-on心脏显著增加了runx1(一种小鼠中干细胞和cm去分化的标志物)的表达(图4a),伴随着收缩基因的表达减少,如肌球蛋白重链(vmhc)、心肌肌动蛋白(actc1a)和肌间蛋白(myom2a)(图4b)。这些数据表明,klf1表达足以使斑马鱼心脏中的cm去分化成较不成熟的状态。
[0167]
实施例4:klf1表达诱导斑马鱼心脏中的cm增殖。
[0168]
由于通过cm去分化获得的减少的收缩状态已经被认为会促进细胞分裂,本发明人接下来采用edu掺入实验解决klf1过表达是否增强cm增殖。令人惊讶的是,与klf1-off心脏中的增殖背景水平(edu
+
cm)相比(图5a),klf1-on心脏中的增殖增加了近200倍(图5a)。我们接下来使用针对磷酸组蛋白h3(phh3)的抗体通过免疫荧光分析评估cm有丝分裂。即使在再生斑马鱼心脏中,识别有丝分裂cm也非常困难,这可能是由于细胞周期中的有丝分裂期很短。然而,本发明人在klf1-on心脏中总是观察到每个切片有~6个phh3
+
cm,而在对照心脏中未检测到有丝分裂cm(图5b),这强烈表明klf1在cm中过表达对重新进入细胞周期的有力作用。与cm增殖水平的显著升高一致,klf1-on心脏显著增加了广泛的细胞周期调节因子的表达,如foxm1、pcna、e2f2、cdc25b、细胞周期蛋白依赖性激酶(cdk1/2)和g1/s(cyclind1)和g2/m细胞周期蛋白(cyclinb2/a2)(图5c)。总之,这些数据表明klf1表达足以迫使成年斑马鱼心脏中静止期cm重新进入细胞周期。
[0169]
实施例5:成年小鼠心脏中的klf1功能。
[0170]
与斑马鱼心脏相似,在梗塞后再生的新生心脏中,小鼠klfl(mklfl)mrna从基线水平上调(新生小鼠;图6a)。然而,有趣的是,在梗塞成年心脏中mklf1的表达未被诱导(成年;图6a),表明其表达水平与小鼠心脏的再生能力相关。
[0171]
为了研究成年小鼠心脏中的klf功能,本发明人生成了一种重组腺病毒载体,其中mklf1 cdna通过p2a肽序列与egfp cdna连接以使受感染的细胞(ad-klf1)可视化。还生成了仅含有egfp cdna(ad-gfp)的对照载体。将纯化的ad-gfp或ad-klf1病毒注射到成年c57bl/6小鼠未损伤心脏的心肌中,并通过ki67免疫荧光分析评估cm增殖。发现与注射对照病毒(gfp;图6b)相比,注射ad-klf1病毒显著增加了ki67和肌钙蛋白-t(tnt)的共标记(klf1;图6b)。gfp的免疫荧光检测表明mklf1在增殖cm中表达。
[0172]
为了证实上述结果,本发明人使用渗透微型泵递送edu并评估cm增殖,用膜标记物小麦胚芽凝集素(wga)结合tnt的免疫荧光识别cm。这是一种更灵敏的识别成年小鼠心脏切片中正在增殖的cm的方法。与ki67和tnt的免疫标记结果一致,采用wga染色分析还检测到注射ad-klf1病毒的心脏中edu
+
cm显著增加(klf1;图6c)。总之,上述数据表明mklf1在小鼠cm增殖中具有保守功能,即使在没有损伤的情况下也可以在体内诱导cm重新进入细胞周期。
[0173]
klf1也被递送至心肌梗塞(mi)之后的成年小鼠心脏中。ad-klf1转导也观察到显著增加的cm增殖(图7a)和有丝分裂(图7b),表明mklf1在小鼠中具有保守的再生功能。与增加的cm更新一致,我们发现在ad-klf1转导的心脏中,心脏瘢痕显著减少,受损区域的心肌形成增加(图7c)和心脏功能显著恢复(图7d)。总之,这些数据表明mklf1在小鼠cm增殖和再生中具有保守功能。
[0174]
实施例6:条件基因捕获系
[0175]
为了研究klfl在心脏再生中的作用,本发明人创建了条件基因捕获系tg(klfl:zwitch2)
vcc33gt
(以下称为klfl-ct或klfl
ct
),其方法是采用之前所述的方法,通过同源重组将称为zwitch2的cre-依赖性基因捕获盒插入klf1基因的第一个内含子(图8a,b)。zwitch2由以下组成:一个剪接受体位点,然后是三联poly-a序列(3xbghpa)和一个具有用于筛选的增强型绿色荧光蛋白(egfp)表达的可移除晶状体特异性标签。含有sa和3xbghpa的区段侧翼是方向相反的串联loxp和lox5171位点,可以通过cre介导的重组永久翻转并通过异常剪接使klf1表达失活(诱变;图8b)。
[0176]
在已建立的品系中,zwitch2的精确插入通过基因组pcr、southern印迹和dna序列分析来验证(图9a-d)。本发明人还通过将klf1-ct/+与tg(ubb:icre-p2a-egfp)杂交来表征已建立的等位基因,其中cre由强、普遍表达的泛素b(ubb)启动子表达。通过育种,我们获得了携带wt和/或诱变klf1等位基因的胚胎(图9e,f)并分析了上述胚胎的表型,证实了klf1在斑马鱼红细胞发育中的进化保守作用(图10a)。
[0177]
本发明人将klf1-ct/+鱼与tg(cmlc2:creer)(cmlc2:creer)进行杂交,tg(cmlc2:creer)(cmlc2:creer)品系中4-羟基他莫昔芬(4-ht)-诱导型cre通过收缩基因心肌肌球蛋白轻链2(cmlc2/myl7)的调节序列表达,使心肌中的klf1表达失活。本发明人获得了klf1-ct/ct和cmlc2:creer;klf1-ct/ct鱼,连续3天用4-ht处理鱼过夜,最后一次处理后2天进行切除损伤。4-ht处理方案在7dpi cmlc2:creer;klf1-ct/ct心室中成功地将心肌klf1表达降低至未损伤的对照水平(图8c、9h)。通过针对肌核标记物mef2和增殖细胞核抗原(pcna)的免疫荧光分析cm增殖,以鉴定心肌表达klf1失活时增殖的mef2
+
、pcna
+
cm的数量显著减少,(图8d)。针对胚胎cm标记物进行免疫荧光分析,如平滑肌蛋白22α(sm22a;也称为转胶蛋白)(图8e)和活化的白细胞粘附分子a(alcama;也称为dm-grasp)(图8f)。这显著降低了在缺乏klf1表达的心脏中所述标志物的表达(图8f)。总之,这些数据表明klf1在红细胞生成和先天性贫血中具有重要作用的同时,也驱动了斑马鱼心脏再生过程中cm去分化和增殖的新机制。
[0178]
对klf1
ct
的产生和表征详细信息进行了描述(图9a-d)。用普遍表达的cre-诱导的klf1
ct
激活能全面激活klf1
ct
(图9e)也就是指klf1的表达显著降低(图9f),其能导致由于严重贫血引发的心脏水肿(图10a)。klf1
ct
的组织特异性激活是在心肌细胞受限的cre品系
tg(cmlc2:creer)的成年心肌中实现。这一心肌捕获系和cmlc2:creer-阴性对照品系,分别称为klf1-mt和klf1-ct(图3c),在4-ht处理后进行心室切除,其验证了cre-依赖性诱导,心脏klf1-ct翻转(图9g)和7dpi时klf1的心室表达降低至与未损伤对照相同的水平(图9h)。心肌klf1表达的失活显著增加了表现出持续纤维蛋白和胶原性瘢痕的再生心脏的比例(图3d),表明心肌klf1是斑马鱼心脏再生所必需的。
[0179]
已知的心肌细胞去分化标志物,如平滑肌蛋白22α/转胶蛋白(sm22;图3e)和活化的白细胞粘附分子(alcam;图3f),在klfl-mt心脏中显著减少。上述伴随着肌细胞增强因子2(mef2)和增殖细胞核抗原(pcna)双阳性的增殖性心肌细胞数量的显著减少(图3g)。类似地,我们观察到在klf1显性阴性形式(dn-klf1;图11a-d)的条件表达下,心脏再生严重受损,心肌细胞去分化和增殖显著减少,为klf1在心脏再生中的重要作用提供了进一步的证据。总之,上述数据确定了klf1在心肌再生中的一种新的、非造血功能,由此klf1在成功诱导心肌细胞去分化和增殖中起重要作用。
[0180]
心脏发育过程中几乎检测不到klf1(每81个心室心肌切片检测到一个mrna点)。对klf1在心肌发育中是否具有功能性作用进行了测试。令人惊讶的是,与klf1整体抑制下观察到贫血表型(图10a、b)相比,心肌klf1
ct
激活(图10c)和心肌dn-klf1过表达(图10d)均不影响发育过程中的心脏形态发生和心肌细胞增殖。当在心脏水肿发生之前进行分析时,采用普遍表达的cre驱动,在klf1
ct
激活或dn-klf1表达被持续性诱导的心脏中也观察到类似的表型(图10e,f)。总之,这些数据表明在心肌中klf1的再生特异性作用。
[0181]
实施例8:klf1触发与损伤无关的再生响应
[0182]
为了研究强制性klfl表达是否诱导未损伤心脏中的再生表型,本发明人使用条件策略驱动心肌中的3xha标记的klfl(klfl-on;图12a)。我们用4-ht过夜处理(图12b)klf1-on鱼或cr-阴性对照(klf1-off;图12a),并通过免疫荧光检测心肌中3xha-klf1的核定位。在klf1-on心脏中,sm22和alcam的心肌表达在处理后7天(dpt)增加,在4-ht处理后12天(dpt)增加更多。在心肌再生过程中,心肌细胞分裂可能通过收缩性降低促进,并伴有与未成熟增殖状态相关的基因表达。与7dpt时klf1-on心脏中的部分心肌细胞去分化一致,12dpt时观察到皮质层心肌中的α-辅肌动蛋白(z线的主要成分)失调的肌节,并且在小梁心肌中更广泛地存在。7和12dpt时通过透射电子显微镜(tem)观察上述结构异常可看到弥漫性z盘。
[0183]
为确定klf1诱导的心肌细胞去分化是否伴随心肌细胞增殖增加,对增殖标志物pcna进行检测并观察到klf1-on心室中pcna
+
mef2
+
心肌细胞数量的大量增加(图12c)。klf1-on心肌细胞中5-乙炔基-2
’‑
脱氧尿苷(edu)掺入的显著增加证实许多心肌细胞经历了dna合成(图12d)。即使在再生强烈的斑马鱼心脏中,观察到有丝分裂的磷酸组蛋白h3
+
(phh3
+
)心肌细胞也极为罕见。然而,在klf1-on心室中检测到许多phh3
+
心肌细胞(图12e),清楚地显示心肌细胞成功地通过有丝分裂进入后期。总之,这些数据表明klf1过表达足以引发强烈的心肌细胞去分化反应,并强烈促进未损伤斑马鱼心脏中心肌重新进入细胞周期和增殖。
[0184]
在klf1-on心脏中观察到的大量增殖反应过程中,用egfp遗传标记的心肌细胞仅限于心肌谱系的细胞,并且其他心脏细胞谱系未观察到,如心内膜或心外膜细胞。上述数据表明,klf1诱导心肌细胞扩增不是通过将成熟心肌细胞重编程为增殖的多能祖细胞进行,
而是通过心肌细胞自我更新的大量上调而不影响谱系塑性。在klf1-on心脏中,观察到血管内皮细胞和心外膜细胞数量增加(图13a、b),表明心肌klf1表达间接刺激其他心脏细胞内的再生程序。
[0185]
klf1亚家族成员klf2和klf4调节心血管发育和功能。如对于klf1-on所述(图12a、b),我们通过以诱导方式表达斑马鱼klf2和klf4直系同源物,klf2a、klf2b和klf4来比较klf1亚家族的心肌形成能力。值得注意的是,心肌细胞有丝分裂的最强诱导是在klf1过表达期间(图13c)。而在klf2b过表达期间心肌细胞有丝分裂以中等水平被诱导(图13c),这样的诱导在klf2a和klf4过表达时可忽略不计(图13c)。与其家族成员klf2和klf4相比,klf1的效果相对高,表明klf1在调节成年特异性心肌细胞生成靶点方面具有独特的作用。
[0186]
哺乳动物klf1具有与klf2和klf4相似的结构域结构,其在将体细胞重编程为多能干细胞方面具有显著的功能。虽然效率比klf2和4低得多,但klf1也可以和其他重编程因子产生诱导的多能干细胞,表明klf1诱导心肌细胞生成的机制是通过cm重编程和祖细胞扩增后再分化为心肌进行介导的。有趣的是,本发明人在klf1-on心室中观察到明显更多的心外膜细胞和血管内皮细胞,表明klf1
+
cm的旁分泌作用,但也可以通过重编程的klf1
+
cm从头分化进行解释。为了解决细胞重编程的问题,本发明人对携带他莫昔芬依赖性指示转基因的klf1-on鱼进行了遗传命运图谱分析,其使我们能够在klf1诱导开始时永久标记cm。结果发现,12dpt时遗传标记的细胞虽然水平降低,但仍表达肌球蛋白重链(mhc),并且不表达心外膜和内皮细胞的标记物raldh2(视黄醛脱氢酶2;也称为aldh1a2),表明klf1
+
cm在大量增殖期没有改变细胞谱系。因此,klf1过表达在成年心脏中实现了心肌细胞生成的广泛水平,其不是通过将成年cm重编程为增殖性多功能心脏祖细胞,而是通过将成年cm去分化为增殖性未成熟状态,同时具有促进邻近组织生长的能力。
[0187]
实施例9:klf1诱导的心肌细胞增生驱动心脏再生
[0188]
klf1-on斑马鱼渐进地表现出心力衰竭的迹象,包括竖鳞(图14a)、无精打采,以及呼吸急促,其影响至9dpt时的存活(图14b)。为了模拟klf1的瞬时治疗递送,建立了tg(cmlc2:3xha-klf1-er;cryaa:tagbfp)
vcc32
(以下简称klf1-er)。在klf1-erklf1对4-ht作出响应而可逆地转位到细胞核(图12f)。
[0189]
用4-ht处理7天,每天一次,在心室诱导核klf1-er定位和再生响应(图12g)。与klf1-on不同,停止4-ht处理后klf1-er鱼的存活没有影响,因此,本发明人在30天后对心脏进行分析(图12g),此时klf1诱导的响应是静止的。有趣的是,对实验心脏的总体分析显示从4-ht处理的klf1-er鱼中收集的心脏大大增大(图12h)。增大心脏的切片没有表现出病理性扩张或纤维化(图12i),而心肌面积明显更大(~两倍;图12j)。klf1-er心室中mef2
+
核的数量显著增加,其中α-辅肌动蛋白染色清楚地显示出明显的有组织性的z带条纹图案。此外,增大心室中单个心肌细胞的尺寸小(图12k),因此,没有肥大,但是与对照心室中的心肌细胞相比,其数量显著增加了约5倍(图12l)。因此,在klf1激活的短短7天内,未损伤的斑马鱼心脏中心肌细胞几乎增殖了5倍,突显了klf1在刺激成年心脏心肌细胞生成方面的极端促增殖能力。
[0190]
实施例10:klf1诱导染色质重构以抑制心肌基因程序
[0191]
为了深入了解klfl的心肌功能,本发明人在7dpt时使用抗ha-标签抗体对klfl-off和klfl-on心室进行染色质免疫沉淀(chip),然后测序(chip-seq)。在klf1-on心室中检
测到特异性3xha-klf1 chip峰(图15a)。这些峰最显著地富集klf1基序(图15b),其验证了使用抗-ha抗体纯化klf1的特异性。基因组区域富集注释工具(great)分析klf1峰下的潜在靶基因,并识别参与器官发生途径包括心肌发育的基因(图15c)。
[0192]
为了表征klfl结合位点,对活性启动子标记(组蛋白h3k4me3)进行chip-seq,对活性增强子标记(组蛋白h3k4me1和h3k27ac)进行chip-seq,并相对于klfl峰对获得的组蛋白峰作图(图15d)。出乎意料的是,在活性启动子处仅发现小部分(98个峰;8.6%)的klf1峰,其余大部分(1,039个峰;91.4%)位于活性增强子处,其被h3k27ac和h3k4me1(图15d),以及dna甲基化减少(5-甲基胞嘧啶,5mc;图15d)组成型标记,不管klf1表达或心肌细胞生成反应。此外,将本发明人的数据与之前发表的数据集进行交叉参考,发现klf1靶向增强子早在受精后48小时(hpf)就获得了激活的表观遗传图谱,并且一些klf1靶点与vista增强子浏览器中经功能验证、具有发育活性的增强子的基因组位置相对应。上述数据表明,klf1优先靶向成年心肌细胞中发育活性和组成活性的增强子。
[0193]
本发明人接着通过转座酶可及性测序法(atac-seq)评估klf1-on心脏中染色质可及性的整体变化。令人惊讶的是,大多数分化富集的atac峰被注释在klf1-on心脏中染色质可及性降低的区域(图15e),伴随着h3k27ac的减少(图15f)和附近基因的转录(图15g)。值得注意的是,可及性降低区域富集mef2c、gata4、mef2a和nkx2.5的结合位点(图15h),其包含控制心脏细胞命运、结构和形态发生的核心心脏调节网络以及收缩基因表达。与此结果一致,调节心脏组织发育的途径与降低的可及性区域相关最显著(图15i)。此外,klf1-on心室的rna-seq分析表明,虽然心肌细胞去分化标记物基因上调,但心肌结构和调节基因显著下调(图15i)。总之,这些数据证明了心肌细胞去分化的模型:klf1与成年心脏中预先存在的心肌增强子结合,并降低核心心脏转录因子结合位点的染色质可及性,从而抑制控制心肌发育和功能的遗传程序。
[0194]
实施例11:klf1上调多种细胞周期基因以促进心肌细胞增殖和分化
[0195]
与klf1-on心脏中心肌细胞增殖增加的组织学证据一致(图12d,e),本发明人发现大多数klf1过表达的上调基因签名与细胞周期机制相关(图16a,b)。在klf1-on心脏中,观察到编码dna复制、细胞周期和胞质分裂的基本调节因子的基因表达显著增强(图16c、d)。值得注意的是,本发明人鉴定了编码许多细胞周期蛋白类型的基因显著上调,如细胞周期蛋白d(ccnd1、ccnd2a、ccnd2b)、细胞周期蛋白e(ccne1、ccne2)、细胞周期蛋白a(ccna2)和细胞周期蛋白b(ccnb1、ccnb2),以及细胞周期蛋白依赖性激酶(cdk1,cdk2),而cdk抑制基因(cdkn1ca)的表达呈现下调。在这些细胞周期蛋白基因中,本发明人检测到ccnd1和ccnd2a基因的klf1结合调控区,证明klf1直接调控d型细胞周期蛋白的表达。
[0196]
本发明人还分析了klfl与成年心肌细胞生成的已知遗传途径的相互作用,如hippo-yes-相关蛋白(yap)通路和neuregulin-erbb2通路。使用klf1-on和klf-off心脏的rna-seq数据进行基因集富集分析,并在klf1过表达的情况下检测到hippo通路的基因签名显著富集(图19a),但erbb通路的基因签名未显著富集(图19b)。本发明人评估了抑制上述通路是否影响klf1-on心脏中心肌细胞增殖,发现药理学抑制yap(图19c)而非erbb(图19d)能显著降低klf1-on心脏中心肌细胞增殖。这些发现表明,klf1部分通过hippo-yap通路介导心肌细胞增殖。虽然许多yap靶基因在klf1-on心脏中的表达增加,但编码核心hippo通路成分的基因表达没有显著变化,并且在上述核心成分基因中未发现klf1峰(数据未显示),
证明klf1通过间接机制激活hippo-yap通路。
[0197]
实施例12:klf1诱导代谢程序重编程以支持强劲的心肌细胞增殖
[0198]
klf1-on心脏中的大多数下调基因签名与线粒体代谢和生物能量产生有关(图16a、b、e)。klf1-on心肌的tem分析显示线粒体具有减少的嵴和扩大的基质(图16f),类似于胚胎和新生小鼠心脏中功能不成熟线粒体的形态表型。klf1-on心脏中的线粒体dna(mtdna)含量也显著降低(图16g),调节线粒体能量代谢的基因整体下调,如三羧酸(tca)循环和氧化磷酸化。这些途径的主要代谢产物,如nadh、nad+和atp,在klf1-on心脏中也显著减少(图16h-k),为klf1过表达期间线粒体能量代谢的减少提供了进一步的证据。这些数据表明,与其他心源性途径相似,klf1途径通过减弱oxphos促进心肌细胞增殖,oxphos是出生后心肌细胞中细胞周期停滞的主要机制。
[0199]
已知klf4通过调节线粒体生物发生和自噬清除来控制心脏线粒体稳态。我们没有检测到自噬基因的显著富集,也没有检测到klf1-on心脏中自噬潮的增加。相反,在klf1-on心脏中,我们发现调节线粒体稳态和功能的核基因表达显著降低(图16l)。值得注意的是,我们发现编码pparγcoactivator-1α(pgc-1α/ppargc1a)的基因下调,pparγcoactivator-1α(pgc-1α/ppargc1a)是一种控制线粒体生物发生和氧化功能的主要调节转录因子(图16l)。我们还发现ppargc1a基因增强子中的klf1 chip峰和klf1-on心脏中h3k27ac水平降低,表明klf1通过直接降低ppargc1a的表达来调节线粒体功能的机制。
[0200]
从oxphos到有氧糖酵解的能量产生转换,称为warburg效应,支持高度增殖的细胞如癌细胞,并且最近显示支持心肌再生。然而,在klf1-on心脏中糖酵解酶基因的表达下调,表明kfl1-on心肌细胞利用不同的代谢机制来支持增殖。为了进一步了解klf1的代谢作用,我们分析了7dpt时klf1-on和off心室的代谢组。我们发现葡萄糖6-磷酸(图16m)和乳酸显著减少,证实了klf1-on心脏中糖酵解的下调。相比之下,klf1-on心脏中磷酸戊糖途径(ppp;图16n、o、q、s)和丝氨酸合成途径(ssp;图16p)的关键代谢物以及它们的调节酶基因上调,证明klf1过表达导致葡萄糖代谢背离糖酵解途径到ppp和ssp。在癌细胞中,ppp和ssp在大分子(例如核酸、氨基酸)和抗氧化剂(例如nadph)的合成中起着至关重要的作用,以支持细胞增殖和生长。因此,我们的数据表明,klf1诱导氧化呼吸途径代谢重塑,以提供心肌细胞大量增殖所需的生物量和抗氧化防御。
[0201]
实施例13:小鼠心脏中klf1的保守再生功能
[0202]
对klfl在小鼠心脏中的功能进行研究。rt-qpcr检测发现心肌梗塞(mi)后新生小鼠心脏中小鼠klf1(mklf1)基因表达显著上调(图17a)。高分辨原位杂交检测发现与梗死区域相邻的心肌mklf1 mrna与心肌肌钙蛋白t(tnt)共定位染色。上述发现表明,与斑马鱼心脏相似,损伤诱导新生小鼠心脏中的mklf1表达。然而,mi后成年小鼠心脏中的mklf1基因表达没有显著上调(图17a),导致再生能力随着年龄的增长而丧失。
[0203]
为了解决mklfl表达是否解锁成年小鼠心脏中的再生能力,我们在通过超声心动图测量心脏功能基线后诱导mi,并将携带对照报告基因(ad-gfp;图17b)或mklfl构建体(ad-mklf1;图17b)的腺病毒载体注射进入mi心脏的梗塞周围心肌(图17c,d)。采用超声心动图,我们观察到两组在3dpi时左心室射血分数(图17e)和缩短分数(图17f)显著降低,证明了在所述区域中mi的诱导。在时程超声心动图分析中,28dpi时对照心脏的心脏功能进一步下降(图17e,f),表明缺血性心力衰竭的发展。相比之下,ad-mklf1处理的心脏,其心脏功
能在7dpi时显著改善,到14dpi时恢复到基线水平的近50%(图17e-g),与28dpi时的对照组相比改善显著(图17g,h)。
[0204]
与这些结果一致,组织学分析表明,28dpi时,虽然对照心脏发生了严重的心脏重构,但ad-mklfl处理的心脏保持明显更好的心脏形态(图17h,i),瘢痕明显减少(图17h,j)。我们测量了心肌细胞大小,其由麦胚凝集素(wga)包裹的tnt
+
面积定义,发现沿ad-mklf1处理的心脏心肌细胞边界区心肌细胞显著变小(图17k),表明mklf1转导诱导心肌细胞增生。与此观察结果一致,我们还发现与细胞增殖标志物ki67(图17l)、s期标志物edu(图17m)和有丝分裂标志物phh3共同标记的tnt
+
心肌细胞数量显著增加(图17n)。对成年小鼠中的高度再生器官肝脏中ad-mklf1转导作用进行评估。没有观察到细胞增殖的显著变化(图18a),表明klf1的促再生功能对心脏是特异性的。总之,这些数据表明,与斑马鱼klf1相似,小鼠klf1在成年心脏中具有促再生功能,并诱导mi后心脏的修复。
[0205]
这些数据表明注射ad-mklf1后,促生存通路在mi后的心脏恢复中不太可能起主要作用。与观察到的斑马鱼klf1-on心脏中血管增加相似(图13a),在小鼠中观察到ad-mklf1处理的心脏创伤区域附近冠状血管显著增多(图18b)。这些数据表明,与斑马鱼心脏相似,小鼠心脏中klf1通路的激活会刺激再生程序,所述程序也涉及冠状动脉血管,并且血管的增加至少部分有助于klf1过表达的更好修复。总之,我们的数据表明klf1的心肌作用在成年哺乳动物中受到抑制,但外源性klf1的施用重新启动心脏再生,因此klf1是一种适用的治疗策略,可以从受损人类心脏的剩下心肌恢复心肌。
[0206]
实施例14:方法
[0207]
14.1动物
[0208]
在本研究中使用年龄范围为4至12个月的远交ekkwill(ek)背景品系的野生型和基因修饰的斑马鱼。除klf1
ct
系外,所有转基因品系均以杂合子进行分析。本研究中使用的已发表转基因品系如下:
[0209]
tg(cmlc2:egfp)-burns,c.g.et al.nat chem biol 1,263-264(2005),
[0210]
tgbac(tcf21:dsred2)-kikuchi,k.et al.development 138,2895-2902(2011),
[0211]
tg(fli1a:egfp)-lawson,n.d.&weinstein,b.m.dev biol 248,307-318(2002),
[0212]
tg(cmlc2:creer)-kikuchi,k.et al.,et al.nature 464,601-605(2010),
[0213]
tg(bactin2:loxp-mcherry-stop-loxp-dta176)-wang,j.et al.development 138,3421-3430(2011),
[0214]
tg(gata4:egfp)-heicklen-klein&evans.dev biol 267,490-504(2004),and
[0215]
tg(ubb:icre-gfp)-sugimoto,k.et al elife 6,e24635(2017).
[0216]
生成新转基因品系的详细信息描述如下。鱼以约为每升5条鱼饲养,每天喂食3次。水温保持在28℃。三卡因麻醉的斑马鱼的切除损伤如之前所述进行(poss,k.d.,wilson,l.g.&keating,m.t.science 298,2188-2190(2002))。遗传性心肌细胞耗尽采用之前所述的方法进行(wang,j.et al.development 138,3421-3430(2011))。
[0217]
本研究使用8至12周龄的雄性c57bl/6j小鼠。小鼠以每只笼子最多饲养5只小鼠饲养,饲养架置于12:12小时的明暗循环中,并可自由获取食物和水。所有动物实验均按照机构和国家动物伦理准则进行,并经由garvan医学研究所/圣文森特医院动物伦理委员会批准。
[0218]
14.2心肌梗死
[0219]
通过腹膜内注射甲苯噻嗪(13mg/kg)和氯胺酮(100mg/kg)对麻醉小鼠进行mi,如之前所述进行(naqvi,n.et al.cell 157,795-807(2014))。采用微型通气呼吸机(harvard apparatus,hollistion,ma,usa)对麻醉小鼠进行通气,通气的氧气中含有1.5%
–
2%的异氟烷(每分钟120次脉冲,每脉冲输出量为0.5ml)。打开第四肋间隙,使用锥形针上的8-0聚丙烯缝合线永久结扎左前降支(lad)动脉,并用6-0聚丙烯缝合线封闭胸部。
[0220]
14.3 actb2:bs-klf1,klf2a,klf2b,and klf4的生成
[0221]
使用ptagbfp-c(evrogen,moscow,russia)进行pcr扩增得到tagbfp cdna,并使用ultramer oligo synthesis(idt technologies,coralville,ia,usa)合成3xha-tag。actb2:loxp-dsred-stop-loxp-egfp构建体(kikuchi,k.et al.,et al.nature 464,601-605(2010))的dsred和egfp分别替换为tagbfp和3xha-tag。使用野生型(ekkwill)斑马鱼cdna库和下游克隆对klf1、klf2a、klf2b和klf4cdna进行pcr扩增,并加上3xha标签。在每个构建体中,采用大范围核酸酶方法使整个盒的侧翼是i-scel位点以便用于转基因(thermes,v.et al.mech dev 118,91-98(2002).)。所述转基因品系的全称如下:
[0222]
tg(actb2:loxp-tagbfp-stop-loxp-3xha-klf1)
vcc29
;
[0223]
tg(actb2:loxp-tagbfp-stop-loxp-3xha-klf2a)
vcc36
;
[0224]
tg(actb2:loxp-tagbfp-stop-loxp-3xha-klf2b)
vcc38
;
[0225]
和tg(actb2:loxp-tagbfp-stop-loxp-3xha-klf4)
vcc35
。
[0226]
每一种品系至少分离出两个创建的品系,并与cmlc2:creer杂交,通过3xha-标签的免疫荧光染色检测成年心脏中klf1、klf2a、klf2b和klf4蛋白的表达。本研究使用的表达3xha-klf2a、klf2b或klf4的品系,其表达水平与3xha-klf1相似或更高。
[0227]
14.4 actb2:bs-dn-klf1的生成
[0228]
基于构建klf5的显性阴性形式的策略(oishi,y.et al.cell metab 1,27-39(2005)),采用锯齿状阻遏结构域(enr)生成klf1的显性阴性形式。
[0229]
所述enr从pcs2-enr进行pcr扩增,并与klf1 cdna的5’末端融合。p026pcs2-enr自获赠ramesh shivdasani博士(addgene质粒#11028;http://n2t.net/addgene:11028;rrid:addgene_11028)。将得到的enr-klf1嵌合基因克隆到actb2:loxp-tagbfp-stop-loxp骨架结构的loxp双侧stop盒的下游。整个盒的双侧具有i-scel位点,用于使用大范围核酸酶方法进行转基因。所述转基因系的全称是tg(actb2:loxp-tagbfp-stop-loxp-dn-klf1)
vcc22
。
[0230]
14.5 ubb:loxp-tagbfp-stop-loxp-egfp的生成
[0231]
此转基因构建体是通过使用red/et重组工程(genebridges,heidelberg,germany)在ubb翻译起始密码子之后将loxp-tagbfp-stop-loxp-egfp盒插入ch211-202a12bac中生成。最终的构建体被纯化,用sfil线性化,并注射到单细胞阶段的胚胎中。上述转基因系的全称是tgbac(ubb:loxp-tagbfp-stop-loxp-egfp)
vcc18
。
[0232]
14.6 klf1-er的生成
[0233]
从actb2:bs-klf1构建体pcr扩增3xha-klf1 cdna并亚克隆5.1kb cmlc2启动子下游。从pbabepuro-myc-er对人雌激素受体(er)cdna进行pcr扩增,并亚克隆下游并加入3xha-klf1。pbabepuro-myc-er是源自wafik el-deiry的礼物(addgene质粒#19128;
http://n2t.net/addgene:19128;rrid:addgene_19128)。由晶状体特异性αa-晶状体蛋白启动子控制的tagbfp盒,可以通过晶状体荧光对转基因动物进行视觉识别,也以相反的方向插入cmlc2启动子的上游。整个盒的两侧具有i-scel位点,用于使用大范围核酸酶方法进行转基因。该转基因系的全称是tg(cmlc2:3xha-klf1-er;cryaa:tagbfp)
vcc32
。
[0234]
14.7条件klf1等位基因的生成
[0235]
已发表的质粒pzwitch通过去除tagrfp序列和两个重复的5x bghpa进行修改以减小其大小。所得质粒称为pzwitch2。使用la扩增引物klf1-la-f和klf1-la-r和ra扩增引物klf1-ra-f和klf1-ra-r,从成年野生型斑马鱼(ek)分离的基因组dna中扩增同源序列的la和ra。通过限制酶消化将la和ra pcr产物克隆到pzwitch2中相应的限制酶位点。如之前所述,将所得产物pzwitch2-klf1-int1与转录激活因子样效应核酸酶(talen)共同注射到单细胞阶段胚胎中,并筛选注射的胚胎以识别创建的鱼(sugimoto,k.et al elife 6,e24635(2017))。该转基因系的全称是tg(klf1:zwitch2)vcc33gt。
[0236]
用于构建铂talen的talen试剂盒获赠自takashi yamamoto博士(addgene试剂盒#1000000043)。使用prime-a-gene标记系统(promega,madison,wi,usa)和放射性标记的探针进行southern印迹。使用野生型基因组dna和扩增引物klf1-probe-f和klf1-probe-r(附录表1)进行pcr,生成检测探针。dna条带采用fla-5100生物成像分析仪(fujifilm,tokyo,japan)进行成像。
[0237]
14.8 rt-pcr
[0238]
使用trizol试剂提取总rna,随后使用transcriptor第一链cdna合成试剂盒(roche,basel,switzerland)或sensifast cdna合成试剂盒(bioline,eveleigh,australia)合成cdna。rt-qpcr采用lightcycler 480系统(roche)或cfx384touch实时pcr检测系统(bio-rad,hercules,ca,usa)进行。在rt-qpcr实验中,用actb2或rpl13a扩增量对cdna的总量进行归一化。所有rt-qpcr实验均采用sybr select master mix(thermo fisher scientific,waltham,ma,usa)或taqman universal master mix(thermo fisher scientific)进行。有关引物的详细信息,请参见附录表1。
[0239]
14.9细胞分选
[0240]
采用荧光活化细胞分选技术(facs)将心肌细胞、心内膜细胞和心外膜细胞分别从携带cmlc2:egfp,tcf21:dsred2,或fli1a:egfp的转基因报告子斑马鱼的心室中纯化提取参见(hui,s.p.et al.dev cell 43,659-672.e5(2017))。
[0241]
14.10原位杂交
[0242]
使用rnascope探针(advanced cell diagnostics,hayward,ca,usa)检测斑马鱼klf1和小鼠klf1 mrna。斑马鱼klf1和小鼠klf1rnascope探针由advanced cell diagnostics设计和合成。使用rnascope 2.5hd detection kit-red(advanced cell diagnostics)的制造商方案进行信号检测,然后使用抗肌钙蛋白c或抗肌钙蛋白t抗体进行免疫荧光。采用zeiss lsm 710共聚焦显微镜进行成像,参见(hecksher-j.&sharpe,j.mech dev 100,59-63(2001))。
[0243]
14.11组织学实验
[0244]
使用标准方案进行picro-mallor染色、3,3
’‑
二氨基联苯胺(dab)染色和gomori-trichrome染色。采用前人所述方法在多聚甲醛固定的10μm冷冻切片中进行免疫荧光(hui,
s.p.et al.dev cell 43,659-672.e5(2017))。附录表2显示了本研究中使用的一抗和二抗的详细信息。采用detrich et al.proc natl acad sci u s a 92,10713-10717(1995)文中所述方法在胚胎中使用o-danisidine(sigma aldrich,st.louis,mo,usa)进行血红蛋白染色。
[0245]
14.12显微镜
[0246]
采用leica dm4000 b显微镜(leica camera ag,wetzlar,germany)对通过picro-mallory、dab或gomori-trichrome方法染色的切片进行成像。采用zeiss axio成像仪m1显微镜(carl zeiss ag,oberkochen,germany)对免疫荧光切片进行成像,并采用zeiss lsm 710共聚焦显微镜(carl zeiss ag)拍摄共聚焦图像。采用mvx10显微镜(olympus,tokyo,japan)拍摄斑马鱼胚胎的整体图像。
[0247]
14.13透射电子显微术
[0248]
用含有2.5%戊二醛的0.1m二甲胂酸钠缓冲液固定斑马鱼心室,并在pelco biowave微波处理器(ted pella inc.,redding,ca,usa)中用新鲜的固定液重新固定。用含有1%oso4的二甲胂酸盐缓冲液进行后固定。组织用procure 812树脂(proscitech,kirwan,australia)包埋,并使用leica ultracut em uc6(leica camera ag)切片。将超薄切片收集到铜网上,并在fei tecnai g
2 20透射电子显微镜(fei公司,hillsboro,or,usa)上使用200kv的电压进行成像。
[0249]
14.14 4-ht施用
[0250]
将斑马鱼放入补充有5μm 4-ht的水族箱水的小烧杯中,过夜10-12小时,参见(kikuchi,k.et al.development 138,2895-2902(2011))。斑马鱼用新鲜的水族箱水冲洗并放回循环水系统进行喂养。重复该循环进行多次处理。斑马鱼胚胎的处理方式类似,只是没有喂食。
[0251]
14.15 edu实验
[0252]
在4-ht处理后的第5、6和7天,用50μl,8mm edu对klf1-off和on鱼进行每天一次腹膜内注射。对于小鼠,在mi手术后一周皮下植入渗透性微型泵(alzet,charles river,ma,usa),并以每天10mg/kg的剂量输注edu,持续7天。
[0253]
14.16心肌细胞去分化的定量
[0254]
通过imagej(nih,bethesda,md,usa)对肌球蛋白重链(mhc)和sm22共标记的斑马鱼心室组织进行像素化定量。对总mhc
+
面积也进行像素化定量,并确定sm22
+
mhc
+
面积占总mhc
+
面积的百分比。每个心脏选取三个切片进行分析。alcam心肌细胞表达的定量类似,除了肌钙蛋白c被用作心肌的标记物。
[0255]
14.17斑马鱼心脏心肌细胞增殖的定量
[0256]
损伤心脏中的pcna
+
心肌细胞采用前人所述方法进行定量(hui,s.p.et al.dev cell 43,659-672.e5(2017))。简而言之,使用zeiss axio成像仪m1显微镜(垂直距离约185μm)对损伤边界区域的进行图像拍摄,并使用imagej软件(nih)对mef2
+
和mef2
+
pcna
+
细胞数量进行手动计数。每个心脏选取三个切片进行分析。未损伤心室的定量类似,除了用于定量的图像换为心室中部心肌细胞的图像(垂直距离490μm
×
水平距离420μm)。
[0257]
为了对未损伤斑马鱼心室中的edu
+
心肌细胞进行定量,用贯穿整个心肌厚度的z-stacks对心室中部心肌进行共聚焦成像(垂直距离490μm
×
水平距离420μm)。手动计数嵌入
cmlc2:egfp
+
心肌内的edu
+
细胞核数量,并使用imagej软件(nih)定量的总cmlc2:egfp
+
区域对数据进行归一化的。每个心脏选取三个切片进行分析。phh3
+
心肌细胞的定量类似,除了换成对整个心室中的phh3
+
细胞核进行计数。
[0258]
14.18小鼠心脏心肌细胞增殖的定量
[0259]
为了对ki67
+
心肌细胞进行定量,在乳头肌水平上获取与瘢痕组织相邻区域的横截面图像。手动计数损伤边界区心肌中ki67
+
细胞核的数量,其定义为距离瘢痕约700μm范围内的健康心肌。被wga染色包围的ki67
+
细胞核被定义为非心肌细胞并被排除在计数之外(ang,k.l.et al.am j physiol cell physiol 298,c1603-9(2010))。使用imagej软件(nih)定量总肌钙蛋白t
+
面积并以此对计数结果进行归一化。edu
+
心肌细胞或phh3
+
心肌细胞的定量类似。
[0260]
14.19心肌细胞数量和大小测量
[0261]
斑马鱼胚胎中的心肌细胞数量采用前人所述方法进行定量(sugimoto,k.et al elife 6,e24635(2017))。成年心脏中的心肌细胞数量测量如下。将心室在3%pfa中短暂固定5分钟,然后在具有1mg/ml 4型胶原酶(worthington biochemical,lakewood,nj,usa)的pbs中4℃下孵育过夜。将解离的细胞重新悬浮在pbs中,使用血细胞计数器将具有明确边缘和清晰条纹的棒状细胞手动计数为心肌细胞。
[0262]
为了测量心肌细胞大小,斑马鱼心室在3%pfa中固定5分钟,并在补充有1mg/ml4型胶原酶(worthington biochemical)的pbs中4℃下孵育过夜。通过温和的移液管研磨解离心肌细胞后,将细胞重新悬浮在pbs中并使用cyto-tek细胞离心机(sakura finetek,tokyo,japan)使其沉积在载玻片上,然后使用抗-α-辅肌动蛋白抗体进行免疫荧光分析(附录表2)。使用imagej软件(nih)通过α-actinin
+
细胞的共聚焦图像对每个心肌细胞的大小进行测量。
[0263]
14.20心室面积测量
[0264]
成年斑马鱼心室切片进行picro-mallory染色,并使用imagej软件(nih)对心室肌肉面积进行定量。每个心脏选取三个切片进行分析。
[0265]
实施例15:总结
[0266]
本公开提供了klfl在成年心肌细胞的再生可塑性中的功能。尽管其结构域结构与klf4相似,但klf1调节心肌细胞可塑性的机制与klf4在细胞重编程中的已知功能完全不同。klf4具有结合甲基化dna的能力并靶向沉默染色质作为先驱因子诱导多功能性基因表达。相比之下,klf1与低甲基化、组成活性心肌增强子相关,并降低了调节心肌发育和功能的核心转录因子结合位点的染色质可及性。最近,已证明在斑马鱼的心肌细胞更新过程中会发生全基因组活性染色质的减少。本发明提供的数据支持上述发现,并进一步证明klf1在整体抑制引发心肌细胞去分化的心肌基因程序中起关键作用。
[0267]
本发明提供的数据表明klfl诱导心肌细胞增殖部分是通过yap进行(图19a,c)。yap的心肌激活通过细胞骨架和肌节变化产生的机械信号进行调节。由于控制心肌收缩和肌动蛋白细胞骨架组织的基因下调诱导的肌节减少,klf1可能激活hippo信号(图15h,i)。klf1 chip-seq的基序分析证实了yap辅因子,tea结构域转录因子4(tead4)结合位点的富集(图15b),表明上述作用的一种机制涉及klf1通过与细胞核中的yap-tead4相关复合物调节hippo通路。
[0268]
klf诱导成年心肌细胞从细胞呼吸途径到磷酸戊糖途径(ppp)和丝氨酸合成途径(ssp)的代谢重编程。上述大分子和抗氧化剂的合成上调,有助于klf1-on心肌细胞进行大量增殖,表明在心肌细胞更新疗法中靶向上述途径的可能。然而,ppp和ssp不产生atp,上述途径的持续激活可能导致能量缺乏(图16k)和致命的心脏功能障碍(图14a、b)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1