用于银屑病的维持治疗的无水药物组合物的制作方法
用于银屑病的维持治疗的无水药物组合物
发明领域
1.寻常型银屑病是一种慢性炎症性疾病,通常通过局部干预进行治疗,对很多患者来说是终生的负担。银屑病的特点是多次发作,确实需要一种有效且良好耐受的长期局部用治疗来减少发作次数。
2.本发明涉及一种无水药物组合物,其包含二丙酸倍他米松和卡泊三醇,用于每周两次施用,用于在治疗银屑病后缓解的银屑病患者中预防发作和延长无发作间隔。
背景技术:
3.银屑病是一种慢性炎症性皮肤病,表现为由角化过度引起的发红、干燥、鳞屑状斑块。所述斑块最常见于肘部、膝部和头皮,尽管更广泛的病灶可出现在身体的其它部位,特别是腰骶部或头皮。轻度至中度银屑病的常见治疗包括局部应用含有皮质类固醇作为活性成分的组合物。虽然有效,但皮质类固醇的应用具有诸多副作用的缺点,例如皮肤萎缩、皮纹、痤疮样皮疹、口周皮炎、皮肤真菌和细菌过度生长、色素沉着皮肤的色素减退和玫瑰痤疮。
4.银屑病也可以用抗体治疗,例如阿达木单抗(adalimumab)、阿达木单抗-adbm、布罗达单抗(brodalumab)、赛妥珠单抗(certolizumab pegol)、依那西普(etanercept)、依那西普-szzs、古塞库单抗(guselkumab)、英夫利昔单抗(infliximab)、伊西贝单抗(ixekizumab)、瑞莎珠单抗(risankizumab-rza)、苏金单抗(secukinumab)和优特克单抗(ustekinumab),或口服制剂,例如含有阿普斯特(apremilast)的制剂。
5.用于治疗银屑病的局部用组合产品已经由leo pharma以商标名软膏和凝胶销售。该产品包含配制在包含聚氧丙烯硬脂醚作为溶剂的组合物中的卡泊三醇一水合物和二丙酸倍他米松作为活性成分。
6.另一种用于治疗银屑病的组合产品由leo pharma以商标名皮肤泡沫销售。该产品包含配制在基于白凡士林的组合物中的卡泊三醇一水合物和二丙酸倍他米松作为活性成分,所述组合物包含聚氧丙烯硬脂醚,其中活性成分溶解在抛射剂中。
7.已经发现,与软膏和凝胶相比,皮肤泡沫将更多的活性物质递送到皮肤中,在治疗银屑病中产生更高的功效,参见lind等人,dermatol ther(heidelb)(2016)6:413-25和queille-roussel等人,clin drug investig(2015)35:239-45。
8.皮肤泡沫是治疗寻常型银屑病的有效方法,被批准每天一次治疗寻常型银屑病长达四周,皮肤泡沫的产品特性概述。
9.现在已经出人意料地发现,用这种泡沫组合物进行长期每周两次维持治疗在银屑病患者中是安全的。
10.还已经发现,与在缓解中未用这种组合物治疗的患者相比,在缓解中用这种泡沫组合物每周两次治疗的患者的一年内复发次数、首次复发时间和缓解天数被显著地改善。
11.因此,本发明涉及用于银屑病患者的维持疗法的泡沫组合物,其中所述组合物在
患者处于缓解中时每周两次施用。
12.发明简述
13.本发明提供了一种无水局部用药物组合物,包含:
14.可药用脂质载体,其包含:
15.约0.005%w/w卡泊三醇或约0.00522%w/w卡泊三醇一水合物,
16.约0.064%w/w的二丙酸倍他米松,和
17.凡士林;
18.和除了所述可药用脂质载体之外,还包含可药用抛射剂;用于银屑病患者的维持治疗,其中当银屑病患者处于缓解中时,每周两次施用所述药物组合物,和其中与在缓解时未施用所述药物组合物的患者相比,实现了改善的治疗结果。
19.在一个特定实施方案中,本发明涉及一种无水局部用药物组合物,其包含:可药用脂质载体,包含:
20.约0.005%w/w卡泊三醇或约0.00522%w/w卡泊三醇一水合物,
21.约0.064%w/w的二丙酸倍他米松,和
22.凡士林;
23.和除了所述可药用脂质载体之外,还包含可药用抛射剂;用于银屑病患者的维持治疗,其中
24.(i)当银屑病患者在用所述组合物每天一次治疗发作长达4周后处于缓解中时,每周两次施用所述药物组合物,和
25.(ii)当出现发作时,恢复每天一次施用所述组合物长达4周,
26.其中与在缓解时未施用所述药物组合物的患者相比,实现了改善的治疗结果。
27.根据本发明,与仅在患者经历银屑病发作时施用所述药物组合物的患者相比,使用较低累积量的所述药物组合物实现了改善的治疗结果。
28.根据本发明的一个实施方案,改善的治疗结果是发作次数/速率减少高达37-54%。
29.根据本发明的一个实施方案,改善的治疗结果是直至首次复发的天数增加80-90%。
30.根据本发明的一个实施方案,改善的治疗结果是每年缓解天数多5-15%。
31.根据本发明的一个实施方案,改善的治疗结果是发作次数减少高达46%。
32.根据本发明的一个实施方案,改善的治疗结果是直至首次复发的天数增加87%。
33.根据本发明的一个实施方案,改善的治疗结果是每年缓解天数多11%。
34.发明详述
35.在一项3期随机双盲试验中,比较了如本文所述的组合物g与安慰剂用于处于缓解中的银屑病患者的每周两次维持治疗的功效和安全性,显示出以下益处:
36.组合物g和赋形剂的首次复发中位时间分别为56天对比于30天。
37.与赋形剂相比,组合物g的首次复发风险降低了43%(hr,0.57;95%ci,0.47-0.69;p《0.0001)。
38.与赋形剂相比,组合物g组的一年内复发率降低了46%(95%ci,37-54%;p《0.001);组合物g和赋形剂的预期一年内复发平均数分别为4.0对比于7.5。
39.组合物g组患者的缓解天数比赋形剂组患者多11%(p《0.0001)。历经一年,这相当于额外缓解41天(95%ci,29-51天)。
40.组合物g历经52周研究期是良好耐受的。组合物g组的反弹发生率低于赋形剂。两个处置组均未报告新的皮纹、皮肤萎缩或临床显著的hpa轴抑制病例。
41.因此,本发明涉及当用一种或多种已知有效治疗银屑病的活性物质或组合物治疗后处于缓解中的患者的治疗。所述活性物质或组合物可以是任意可用于治疗银屑病的已知活性物质或组合物,例如凝胶或软膏、daivonex乳膏或软膏、含皮质类固醇的局部用产品或其它局部用产品、抗体如阿达木单抗、阿达木单抗-adbm、布罗达单抗、赛妥珠单抗、依那西普、依那西普-szzs、古塞库单抗、英夫利昔单抗、伊西贝单抗、瑞莎珠单抗、苏金单抗和优特克单抗,或口服制剂,例如含有阿普斯特的制剂。
42.根据本发明使用的组合物包含可药用脂质载体,所述载体包含
43.约0.005%w/w卡泊三醇或约0.00522%w/w卡泊三醇一水合物,
44.约0.064%w/w的二丙酸倍他米松,
45.和凡士林;
46.和除了所述可药用脂质载体之外,还包含可药用抛射剂。
47.每当在本文中提及“所述组合物”时,该称谓指这样的组合物,其包含可药用脂质载体,所述脂质载体包含
48.约0.005%w/w卡泊三醇或约0.00522%w/w卡泊三醇一水合物,
49.约0.064%w/w的二丙酸倍他米松,
50.和凡士林;
51.和除了所述可药用脂质载体之外,还包含可药用抛射剂。
52.如有关以%w/w表示的量的内容中所用的术语“约”指加/减该量的10%。
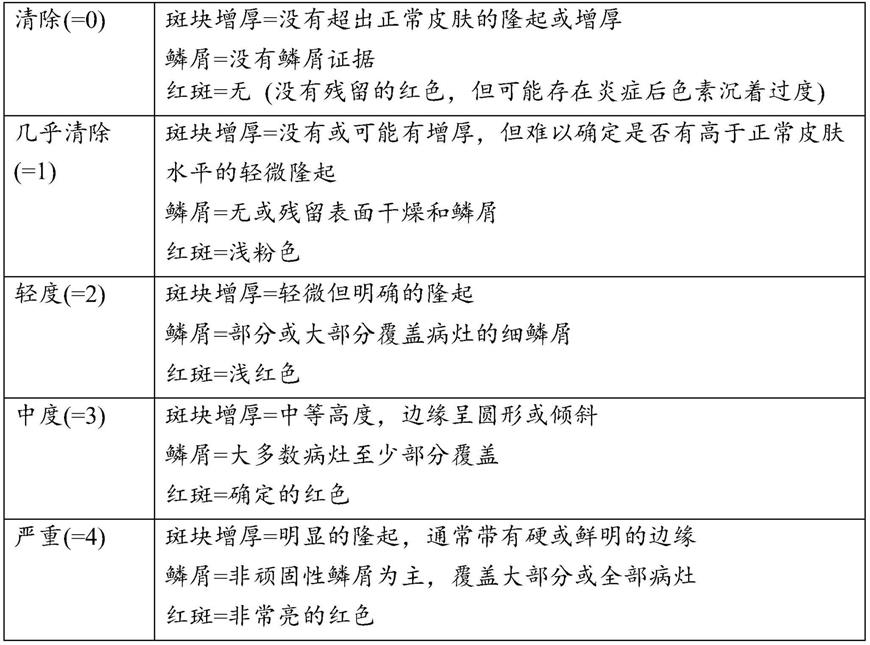
53.如本文所用,无水药物组合物是未向其中添加水作为赋形剂或药物非活性成分的组合物。添加到组合物中的非活性成分可以含有少量的水作为杂质,但是没有一种非活性成分含有任何较大量的水,例如超过1%的水。
54.银屑病是一种慢性疾病,银屑病患者每年都会经历多次该疾病发作。
55.如本文所用,处于缓解中的患者指在用对治疗银屑病有效的药物治疗后取得治疗成功的个体。
56.发作意味着银屑病症状的加剧,例如达到定义为至少“轻度”的pga的水平)。如本文所用的发作和复发具有相同含义。
57.pga指对改善的医师全面评估(physicians global assessment),这是公认的银屑病症状度量,emea要求制药公司使用临床试验。pga根据下表1进行评估。
58.表1:疾病严重程度分级—医师评估
[0059][0060]
维持治疗是指为防止发作和延长无发作期而进行的长期治疗。如本文所用的维持治疗、长期维持治疗和主动管理(proactive management)具有相同的含义。
[0061]
如本文所用,每周两次是指一周施用两次,施用之间间隔2至3天。
[0062]
根据本发明使用的可药用脂质载体包含活性成分卡泊三醇和倍他米松以及凡士林。
[0063]
凡士林、白凡士林或白软石蜡是常用的脂质载体,由不同链长、峰值为约c
40-44
的烃组成。白软石蜡或白凡士林可封闭经处理的皮肤表面,减少透皮水分流失和增强组合物中活性成分的治疗效果,它倾向于具有油腻或发粘的感觉,并在使用后持续相当长的一段时间。
[0064]
可以将液体石蜡加入到凡士林中以使其更柔软。液体石蜡由不同链长、峰值为c
28-40
的烃组成。
[0065]
可以优选使用由链长稍低的烃组成的石蜡,例如由链长峰值为c
14-16
、c
18-22
、c
20-22
、c
20-26
的烃或其混合物组成的石蜡。已经发现,这类石蜡在美容化妆上是更可接受的,因为它们在应用时不那么油腻或发粘。因此,预期在本发明的组合物中包含这类石蜡可导致患者依从性改善。被称为凡士林胶冻(petrolatum jelly)的这种类型的适宜的石蜡由sonneborn制造并以商标名sonnecone销售,例如sonnecone cm、sonnecone dm1、sonnecone dm2和sonnecone hv。这些石蜡在wo2008/141078中进一步公开和表征,该文献通过引用并入本文。除了它们有利的美容化妆性质外,还令人惊奇地发现,含有这些石蜡作为载体的组合物比含有常规石蜡的组合物更容易耐受。(石蜡的烃组成已通过气相色谱法确定)。
[0066]
脂质载体通常包含凡士林、特别是白凡士林或白软石蜡作为主要重量成分,并含有液体石蜡以软化凡士林。
[0067]
适宜地,脂质载体包含多于80%w/w的凡士林、多于85%w/w的凡士林或多于90%w/w的凡士林,所述凡士林适宜地是白软石蜡或白凡士林。
[0068]
根据本发明使用的组合物可以含有抗氧化剂,例如α-生育酚或丁羟甲苯。
[0069]
可药用抛射剂可以选自二甲醚、甲乙醚或c
3-5
烷烃、卤化c
3-5
烯烃。适宜的c
3-5
烷烃是丙烷、正丁烷、异丁烷或丙烷、戊烷或它们的混合物。适宜的卤化c
3-5
烯烃是hfo-1234ze(e)(反式-1,3,3,3-四氟丙-1-烯)。
[0070]
在一些实施方案中,卡泊三醇、卡泊三醇一水合物和/或二丙酸倍他米松溶解在抛射剂中。
[0071]
根据本发明的一个实施方案,可药用抛射剂包含c
3-5
烷烃或卤化c
3-5
烯烃,例如正丁烷。
[0072]
在本发明的一个特定实施方案中,可药用抛射剂包括二甲醚。
[0073]
在本发明的另一个实施方案中,在组合物中,可药用抛射剂以足以完全溶解卡泊三醇或卡泊三醇一水合物和二丙酸倍他米松的量存在。
[0074]
根据本发明的一个这类实施方案,可药用抛射剂包含二甲醚,并且卡泊三醇或卡泊三醇一水合物和二丙酸倍他米松溶解在二甲醚中。
[0075]
根据另一个这类实施方案,可药用抛射剂包含二甲醚,并且卡泊三醇或卡泊三醇一水合物和二丙酸倍他米松溶解在二甲醚和第二种抛射剂的混合物中。第二种抛射剂适宜地是c
3-5
烷烃或卤化c
3-5
烯烃,例如正丁烷。
[0076]
适宜地,c
3-5
烷烃或卤化c
3-5
烯烃与二甲醚的比例范围为约6:1-0.5:1w/w、约5:1-1:2w/w、约4:1-1:1w/w、约4:2-1:1w/w、4:2-4:3w/w或4:3-1:1w/w。
[0077]
根据本发明使用的制剂中的脂质载体溶解或混悬在抛射剂中。
[0078]
可药用脂质载体可以含有油性共溶剂。共溶剂可以选自:
[0079]
(a)通式i:h(och2c(ch3)h)
x
or1的化合物,其中r1是直链或支链c
1-20
烷基,且x是2至60的整数,包括端值;
[0080]
(b)直链或支链c
10-18
链烷酸或链烯酸的异丙基酯;
[0081]
(c)c
8-14
链烷酸或链烯酸的丙二醇二酯;
[0082]
(d)直链或支链c
8-24
链烷醇或链烯醇;
[0083]
(e)植物油;和
[0084]
(f)n-烷基吡咯烷酮或n-烷基哌啶酮。
[0085]
在一个实施方案中,可药用的共溶剂是聚氧丙烯-15-硬脂醚、聚氧丙烯-11-硬脂醚、聚氧丙烯-14-丁基醚、聚氧丙烯-10-鲸蜡基醚或聚氧丙烯-3-肉豆蔻基醚。
[0086]
在一个实施方案中,可药用的共溶剂是肉豆蔻酸异丙酯、棕榈酸异丙酯、异硬脂酸异丙酯、亚油酸异丙酯(isopropyl linolate)或单油酸异丙酯。
[0087]
在一个实施方案中,可药用的共溶剂是丙二醇二壬酸酯。
[0088]
在一个实施方案中,可药用的共溶剂是辛醇、月桂醇、鲸蜡醇、硬脂醇或肉豆蔻醇,c
8-24
链烯醇是油醇或亚油醇,或其中支链c
8-24
链烷醇是支链c
18-24
链烷醇。
[0089]
在一个实施方案中,可药用的共溶剂是肉豆蔻醇或油醇。
[0090]
在一个实施方案中,可药用的共溶剂是n-甲基吡咯烷酮。
[0091]
在一个实施方案中,可药用的共溶剂是精制植物油,例如精制椰子油或中链甘油
三酯。
[0092]
在一个实施方案中,可药用的共溶剂是聚氧丙烯-11-硬脂醚。
[0093]
所用共溶剂的量取决于共溶剂溶解活性成分的能力,但是范围通常为可药用脂质载体的0.5-25%w/w、0.5-10%w/w、1-5%w/w或3-5%w/w。共溶剂的量适宜地低于足以溶解制剂中的活性物质的量。
[0094]
在一个实施方案中,抛射剂以完全溶解活性物质的量存在,并且共溶剂的量低于足以溶解脂质载体中的活性物质的量。
[0095]
根据本发明使用的局部用组合物经皮肤或经皮施用。将该组合物喷洒到受银屑病发作影响的皮肤区域上,然后用手摩擦进去。
[0096]
根据本发明使用的组合物可以如wo2011154004中所述或通过类似方法制备。wo2011154004通过引用并入本文。
[0097]
实施方案:
[0098]
实施方案1:处于缓解中的银屑病患者的维持治疗方法,其中所述方法包括用药物组合物每周两次治疗患者,所述药物组合物包含:
[0099]
可药用脂质载体,包含:
[0100]
约0.005%w/w卡泊三醇或约0.00522%w/w卡泊三醇一水合物,
[0101]
约0.064%w/w的二丙酸倍他米松,
[0102]
和凡士林,和
[0103]
和除了所述可药用脂质载体之外,还包含可药用抛射剂;
[0104]
其中与在缓解时未施用所述药物组合物的患者相比,实现了改善的治疗结果。
[0105]
实施方案2:用于在使用无水药物组合物每天一次治疗发作长达4周后处于缓解中的银屑病患者的维持治疗的方法,所述无水药物组合物包含:
[0106]
可药用脂质载体,包含:
[0107]
约0.005%w/w卡泊三醇或约0.00522%w/w卡泊三醇一水合物,
[0108]
约0.064%w/w的二丙酸倍他米松,
[0109]
和凡士林,和
[0110]
和除了所述可药用脂质载体之外,还包含可药用抛射剂;
[0111]
其中所述方法包括每周两次用所述药物组合物治疗患者,和其中与在缓解时未施用所述药物组合物的患者相比,使用较低量的所述药物组合物实现了改善的治疗结果。
[0112]
实施方案3:二丙酸倍他米松和卡泊三醇或卡泊三醇一水合物在制备无水药物组合物中的用途,所述无水药物组合物包含:
[0113]
可药用脂质载体,包含
[0114]
约0.005%w/w卡泊三醇或约0.00522%w/w卡泊三醇一水合物,
[0115]
约0.064%w/w的二丙酸倍他米松,
[0116]
和凡士林,和
[0117]
和除了所述可药用脂质载体之外,还包含可药用抛射剂;
[0118]
用于处于缓解中的银屑病患者的维持治疗,其中给患者每周两次施用所述无水药物组合物,和其中与在缓解时未施用所述药物组合物的患者相比,实现了改善的治疗结果。
[0119]
实施方案4:二丙酸倍他米松和卡泊三醇或卡泊三醇一水合物在制备药物组合物
中的用途,所述药物组合物用于在用无水药物组合物每天一次治疗发作长达4周后处于缓解中的银屑病患者的维持治疗,所述无水药物组合物包含:可药用脂质载体,包含
[0120]
约0.005%w/w卡泊三醇或约0.00522%w/w卡泊三醇一水合物,
[0121]
约0.064%w/w的二丙酸倍他米松,
[0122]
和凡士林,和
[0123]
和除了所述脂质载体之外,还包含可药用抛射剂;
[0124]
其中所述药物组合物每周两次施用于患者,和其中与在缓解时未施用所述药物组合物的患者相比,使用较低量的所述组合物实现了改善的治疗结果。
[0125]
实施例1
[0126]
组合物a至e和g
[0127]
为了制备组合物a至e和g,将白软石蜡在80℃熔化,然后冷却至70℃并保持该温度。将卡泊三醇一水合物溶解在聚氧丙烯-15-硬脂醚中以形成溶液,将所述溶液在搅拌下添加到熔融石蜡中。将bdp分散在液体石蜡中,并在搅拌下将分散物添加到含卡泊三醇的石蜡混合物中,然后将混合物冷却至低于30℃。将30g份的混合物转移到配有聚酰胺-聚酰亚胺内漆(hoba 8460)的铝喷雾容器中,然后通过卷边将阀杯固定到容器主体上。通过管加入所需量的抛射剂混合物,然后将容器振摇5分钟以使卡泊三醇和bdp完全溶解。
[0128]
组合物a
[0129][0130]
组合物b
[0131][0132]
组合物c
[0133][0134]
组合物d
[0135][0136]
组合物e
[0137][0138]
组合物f
[0139]
为了制备组合物f,将氢化蓖麻油与液体石蜡一起于85-90℃熔化,通过均质化冷却至约60℃。然后将混合物在搅拌下冷却至25-30℃。将bdp混悬在液体石蜡中,加入到均质化混合物中。将卡泊三醇一水合物溶解在聚丙烯-15-硬脂醚中,加入到其它成分的混合物中,将制剂均质化以确保活性成分均匀分布。将30g份的混合物转移到配有聚酰胺-聚酰亚胺内漆(hoba 8460)的铝制喷雾容器中,然后通过卷边将阀杯固定到容器主体上。通过管加入所需量的抛射剂混合物,然后将容器振摇5分钟以使卡泊三醇和bdp完全溶解。
[0140]
组合物f
[0141][0142]
组合物g
[0143][0144]
(*)ppg-1-硬脂醚包含丁羟甲苯作为抗氧化剂。
[0145]
组合物h至n
[0146]
为了制备组合物h至n,将白软石蜡和α-生育酚通过在搅拌下加热至约80℃进行混合。将混合物冷却至约60℃。将微粉化卡泊三醇水合物和bdp分散在液体石蜡中,在搅拌下加入熔融石蜡中。然后将混合物在搅拌下冷却至低于30℃。将30g份的混合物转移到配有聚酰胺-聚酰亚胺内漆(hoba 8460)的铝制喷雾容器中,然后通过卷边将阀杯固定到容器主体上。通过管加入所需量的抛射剂混合物,然后将容器振摇5分钟以使卡泊三醇和bdp完全溶解。
[0147]
为了制备组合物s-w,将白软石蜡和α-生育酚通过在搅拌下加热至约80℃进行混合。将混合物冷却至约70℃。通过加热至约60℃,将卡泊三醇一水合物分别溶解在共溶剂中链甘油三酯、油醇和肉豆蔻酸异丙酯中以形成溶液,将溶液在搅拌下加入到熔融石蜡α-生育酚混合物中。然后将该混合物冷却至约60℃并保持该温度。将bdp分散在液体石蜡中,在搅拌下将分散物加入到含有卡泊三醇的石蜡混合物中,然后在搅拌下将混合物冷却至30℃以下。将30g份的混合物转移到配有聚酰胺-聚酰亚胺内漆(hoba 8460)的铝制喷雾容器中,然后通过卷边将阀杯固定到容器主体上。通过管加入所需量的抛射剂混合物,然后将容器振摇5分钟以使卡泊三醇和bdp完全溶解。
[0148][0149]
表2:不含抛射剂重量贡献的制剂h-n含有0.005%w/w卡泊三醇、0.064%w/w二丙酸倍他米松。
[0150]
实施例2
[0151]
功效的临床测试
[0152]
在iii期、多中心、随机、赋形剂对照试验中测试了实施例1的组合物g,所述试验由开放标签的积极治疗期(4周)、随机双盲主动管理期(52周)和八周随访期。
[0153]
在筛选期后,被认为符合试验条件的受试者(躯干和/或四肢上有根据pga评定为至少“轻度”、bsa 2-30%和m-pasi至少2的寻常型银屑病的成人)被招募到初始开放标签期,他们每天一次在躯干和/或四肢的银屑病病灶上应用组合物g长达4周。
[0154]
·
在第4周实现治疗成功(pga评分为“清除”或“几乎清除”,与基线相比至少改善2级)的受试者以1:1的比例随机分配到每周两次使用组合物g或赋形剂的52周维持期(维持ip)。
[0155]
·
在每天一次治疗长达4周后未实现治疗成功的受试者(即无响应者)中止试验。
[0156]
在随机维持期,受试者每隔3或4天(固定天数)对躯干和四肢上在初始开放标签期或复发治疗后病灶已清除或几乎清除的所有区域上每周两次应用维持ip。在临床就诊中定期评估受试者(最多每4周)。此外,如果受试者认为在两个定期每月就诊之间发生了复发(银屑病恶化),则由研究者在计划外就诊中评估受试者。
[0157]
在确认复发后,给受试者提供组合物g并要求将其应用于躯干和/或四肢的活动区域,无论这些区域在基线时是活跃的还是新的病灶。将组合物g每天一次应用于活跃区域长达4周。如果其它区域在救援治疗期间变得活跃,则这些区域用组合物g每天一次治疗。在复发期间,不活跃的区域继续每周两次的维持治疗。
[0158]
·
如果在长达4周后达到根据pga的“清除”/“几乎清除”评分,则根据随机方案在现在是“清除”/“几乎清除”的区域重新开始每周两次维持方案。
[0159]
·
如果在每天一次施用组合物g长达4周后没有达到根据pga的“清除”/“几乎清除”评分,则受试者离开试验。
[0160]
入选标准:≥18周岁;躯干和/或四肢上有寻常型银屑病,累及体表面积的2-30%;在第1次就诊时,pga至少“轻度”,改良的银屑病面积和严重程度指数评分≥2。
[0161]
主要终点是首次复发时间(pga至少“轻度”)。次要终点:主动管理期期间的复发次数和缓解天数比例(pga“清除”或“几乎清除”)。还评估了安全性,包括类固醇相关不良事件,例如皮纹、皮肤萎缩和下丘脑垂体肾上腺(hpa)轴抑制(hpa轴测试在第0、4、28和56周在患者亚组中进行)(完整结果单独报告)。
[0162]
对于每名受试者,通过计算分配的一组满罐的重量与返回的罐的重量之间的差异确定了每个就诊间隔所用的药物重量。
[0163]
结果
[0164]
总共545名患者随机分配接受组合物g或赋形剂,其中521人在开放标签期取得了治疗成功,包括完整的分析组(组合物g)n=256;赋形剂n=265);545名随机患者中的251名(46.1%)完成了研究。随机分组时的疾病特征在治疗组之间相似。82%的随机患者在基线时pga评分为“中度”。
[0165]
组合物g和赋形剂的首次复发中位时间分别为56天对比于30天。
[0166]
与赋形剂相比,组合物g的首次复发风险降低了43%(hr,0.57;95%ci,0.47-0.69;p《0.0001)。
[0167]
与赋形剂相比,组合物g组的一年内复发率降低了46%(95%ci,37-54%;p《0.001);组合物g和赋形剂的预期一年内复发平均数分别为4.0对比于7.5。
[0168]
组合物g组患者的缓解天数比赋形剂组患者多11%(p《0.0001)。历经一年,这相当于额外缓解41天(95%ci,29-51天)。组合物g历经52周研究期是良好耐受的。组合物g组的反弹发生率低于赋形剂。两个处置组均未报告新的皮纹、皮肤萎缩或临床显著的hpa轴抑制病例。
[0169]
在寻常型银屑病成人中,与赋形剂相比,用组合物g进行历经52周的长期主动管理在延长首次复发时间、减少复发次数和增加缓解天数方面是优越的。
[0170]
此外,历经52周治疗期,以每天药物克数测量,在复发之间每周两次接受治疗的患者使用的组合物g减少了6%重量。
[0171]
实施例3
[0172]
临床试验安全性
[0173]
在每天一次组合物g长达4周后获得治疗成功(医生对疾病严重程度的总体评估[pga]评分为“清除”/“几乎清除”,从基线改善≥2级)的患者以1:1随机分配为每周两次组合物g或赋形剂达52周。入选标准:≥18周岁;躯干和/或四肢银屑病的pga至少为“轻度”;累及2-30%的体表面积(bsa);改良的银屑病面积和严重程度指数评分(mpasi)≥2。hpa轴亚组的附加标准:躯干和/或四肢银屑病pga至少为“中度”;累及10
–
30%bsa;正常的hpa轴功能。
[0174]
545名患者随机分配为组合物g(n=272)或赋形剂(n=273)。组间的随机化特征相似。每100患者每年aes发生率对于组合物g和赋形剂组而言分别为165.1和156.1。每100患者每年严重aes发生率较低且相当(8.2,组合物g;7.8,赋形剂),治疗相关ae发生率也是如此(2.7,组合物g;4.5,赋形剂)。两种ae(脉络膜视网膜病变和皮肤疼痛)被判定为与长期使用皮质类固醇有关。三名患者(2名组合物g[0.7%];1名赋形剂[0.4%])经历了导致停药的
aes。进入主动管理期两个月内出现反弹对于组合物g和赋形剂而言分别发生在6名和7名患者中。在复发后,与组合物g(n=4)相比,使用赋形剂的反弹(n=17)可能是四倍。亚组分析未观察到对钙代谢或hpa轴的临床相关影响。
[0175]
hrqol(健康相关生活质量)(使用euroqol-5d银屑病(eq-5d-5l-pso)工具(0-1;0=最差健康状态,1=最佳健康状态)和皮肤科生活质量指数(dlqi)(0-30;0=生活质量无损害,30=最大损害)进行了评估。患者感知的症状严重程度使用银屑病症状量表(psi)进行了评估(0-32;0=无严重性,32=高严重性)。
[0176]
在开放标签期间,在所有用于发作治疗的pro(专利报告结果)测量中都观察到了统计学和临床上显著的改善。具体而言,从基线到第4周的平均差异(标准差[sd])对于psi评分为-8.97(6.18),对于dlqi评分为-6.02(5.46),对于eq-5d评分为0.11(0.15)。在三个pro评估工具中,主动和反应管理组在接下来的52周随机治疗中均保持了pro改善。在4周发作治疗期间的初步改善后,与在维持期间接受主动管理的患者相比,接受反应性管理的患者在dlqi(15%[p=0.007])和psi(银屑病症状量表)(15%[p=0.0128])方面均具有统计学上显著较高的平均曲线下面积(auc)评分。另外,与在维持期间接受主动管理的患者相比,接受反应性管理的患者还具有较低的eq-5d平均auc评分(1%[p=0.0842])。
[0177]
表1:从基线到第4周发作治疗中psi、dlqi和eq-5d评分的变化
[0178][0179]
表2:主动组和反应组的平均psi、dlqi和eq-5d auc评分以及维持期间的差异
[0180] 主动反应性差异统计学显著性psi4.995.74-0.75p=0.0128dlqi2.953.40-0.45p=0.007eq-5d0.890.880.01p=0.0842
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1