苯并硫杂(二)氮杂环庚三烯化合物及其作为胆汁酸调节剂的用途的制作方法
苯并硫杂(二)氮杂环庚三烯化合物及其作为胆汁酸调节剂的用途
1.相关申请的交叉引用
2.本技术主张2019年12月4日申请的印度申请第201911049983号的优先权,其公开内容以全文引用的方式并入本文中。
技术领域
3.本发明涉及式(i)的1,5-苯并硫杂氮杂环庚三烯及1,2,5-苯并硫杂二氮杂环庚三烯衍生物。这些化合物为具有顶端钠依赖性胆汁酸转运蛋白(asbt)及/或肝脏胆汁酸转运蛋白(lbat)抑制活性的胆汁酸调节剂。本发明还涉及包含这些化合物的药物组合物,以及这些化合物在治疗心血管疾病、脂肪酸代谢及葡萄糖利用障碍、胃肠道疾病及肝病中的用途。
背景技术:
4.胆汁酸为生理清洁剂,其在肠道吸收及脂质、营养物及维生素的运输中起重要作用。其亦为信号传导分子,活化核受体及调节脂质、葡萄糖及能量代谢的细胞信号传导路径。胆汁酸为类固醇酸,其由肝脏中的胆固醇合成且以混合微胶粒形式储存于胆囊中。在消化期间,十二指肠触发引起胆囊收缩的激素的释放,从而在小肠中释放胆汁酸,其使得能够在小肠中吸收脂溶性维生素及胆固醇。当其到达回肠时,胆汁酸自肠道再吸收且分泌至门静脉血液中,经由门静脉循环返回肝脏。因此,超过90%的胆汁酸再循环且返回肝脏。这些胆汁酸随后转运穿过肝细胞的窦状隙膜且穿过小管膜再分泌至胆汁中。在此首过(first pass)中,75-90%的胆汁酸由肝细胞吸收,完成一轮肠肝循环。逃脱肝脏清除的胆汁酸部分进入全身循环,其中游离胆汁酸由肾小球过滤,在近端小管中有效回收且输出回全身循环。有趣的是,大多数穿过小管膜分泌至胆汁中的胆汁酸来源于再循环池,而少于10%来自新的重新肝脏合成。在回肠中未被再吸收的小部分胆汁酸到达结肠。在肠腔内,初级胆汁酸在肠道细菌的作用下转化成次级胆汁酸,主要经由类固醇核的单或双脱羟基反应。逃脱肠道吸收的胆汁酸此后排泄至粪便中。
5.总体而言,有效的转运系统有助于维持恒定的胆汁酸池,确保肠道中足够高水平的缀合胆汁酸,以促进脂质吸收以及减少小肠细菌负荷。该系统亦经由消除潜在的细胞毒性清洁剂而使粪便及尿胆汁酸损失降至最低且保护肠道及肝胆区室(如由kosters及karpen(xenobiotica 2008,第38卷,第1043-1071页);chiang(j.lipid res.2009,第50卷,第1955-1966页);及dawson(handb.exp.pharmacol.2011,第201卷,第169-203页)所综述)。
6.已发现胆汁酸池大小的调节经由肝脏将胆固醇转化为胆汁酸而在胆固醇稳态中起关键作用,其代表自身体消除胆固醇的主要途径。肝脏在自身体移除内源性及外源性化合物中起至关重要的作用。正常的肝胆分泌及肠肝循环为自身体消除内源性化合物诸如胆固醇及胆红素及其代谢物所必需的,从而维持脂质及胆汁酸稳态。(kosters及karpen,xenobiotica 2008,第38卷,第1043-1071页)。
7.回肠中胆汁酸的再吸收可经由顶端钠依赖性胆汁酸转运蛋白(asbt)抑制剂化合物来抑制。已报导抑制胆汁酸再吸收用于治疗数种疾病,包括血脂异常、糖尿病、肥胖症、便秘、胆汁淤积性肝病、非酒精性脂肪性肝炎及其他肝病。在过去数十年中已公开多种asbt抑制剂化合物,参见例如wo 93/16055、wo 94/18183、wo 94/18184、wo 96/05188、wo 96/08484、wo 96/16051、wo 97/33882、wo 98/03818、wo 98/07449、wo 98/40375、wo 99/35135、wo 99/64409、wo 99/64410、wo 00/47568、wo 00/61568、wo 00/38725、wo 00/38726、wo 00/38727、wo 00/38728、wo 00/38729、wo 01/66533、wo 01/68096、wo 02/32428、wo 02/50051、wo 03/020710、wo 03/022286、wo 03/022825、wo 03/022830、wo 03/061663、wo 03/091232、wo 03/106482、wo 2004/006899、wo 2004/076430、wo 2007/009655、wo 2007/009656、wo 2011/137135、wo 2019/234077、wo 2020/161216、wo 2020/161217、de 19825804、ep 864582、ep 489423、ep 549967、ep 573848、ep 624593、ep 624594、ep 624595、ep 624596、ep 0864582、ep 1173205、ep 1535913及ep 3210977。
8.尽管先前已报导许多asbt抑制剂化合物,但仍需要额外的胆汁酸调节化合物,其在效力、选择性及生物利用度方面具有优化特征。
附图说明
9.图1显示用实施例2的化合物处理之后,各犬中的胆汁酸的尿排出量。
具体实施方式
10.已发现某些1,5-苯并硫杂氮杂环庚三烯及1,2,5-苯并硫杂二氮杂环庚三烯衍生物为顶端钠依赖性胆汁酸转运蛋白(asbt)及/或肝脏胆汁酸转运蛋白(lbat)的有效抑制剂,且可适用于治疗需要抑制胆汁酸循环的疾病。
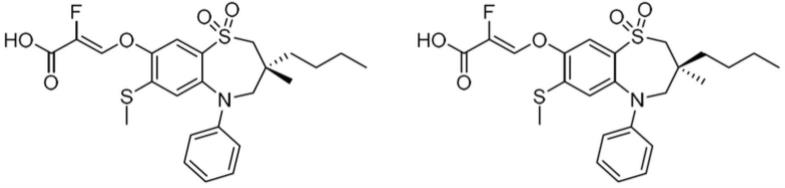
11.在第一方面中,本发明涉及一种式(i)化合物
[0012][0013]
其中
[0014]
m选自-ch
2-及-nr
7-;
[0015]
r1为c
1-4
烷基;
[0016]
r2独立地选自:氢、卤素、羟基、c
1-4
烷基、c
1-4
卤代烷基、c
1-4
烷氧基、氰基、硝基、氨基、n-(c
1-4
烷基)氨基、n,n-二(c
1-4
烷基)氨基、n-(芳基-c
1-4
烷基)氨基、c
1-6
烷基羰基氨基、c
3-6
环烷基羰基氨基、n-(c
1-4
烷基)氨基羰基、n,n-二(c
1-4
烷基)氨基羰基、c
1-4
烷氧基羰基氨基、c
3-6
环烷基氧基羰基氨基、c
1-4
烷基磺酰氨基及c
3-6
环烷基磺酰氨基;
[0017]
n为整数1、2或3;
[0018]
r3选自:氢、卤素、氰基、c
1-4
烷基、c
3-6
环烷基、c
1-4
烷氧基、c
3-6
环烷基氧基、c
1-4
烷硫
基、c
3-6
环烷基硫基、氨基、n-(c
1-4
烷基)氨基及n,n-二(c
1-4
烷基)氨基;
[0019]
r4及r5中的一者为羧基,且r4及r5的另一者选自:氢、氟、c
1-4
烷基及c
1-4
卤代烷基;
[0020]
r6选自氢及c
1-4
烷基;及
[0021]
r7选自氢及c
1-4
烷基;
[0022]
或其药学上可接受的盐。
[0023]
在一些实施方案中,r1为c
2-4
烷基。在一优选实施方案中,r1为正丙基。在另一优选实施方案中,r1为正丁基。
[0024]
在一些实施方案中,r2独立地选自:氢、卤素、羟基、c
1-4
烷基、c
1-4
卤代烷基、c
1-4
烷氧基、氨基、n-(c
1-4
烷基)氨基、n,n-二(c
1-4
烷基)氨基、c
1-6
烷基羰基氨基、c
3-6
环烷基羰基氨基、n-(c
1-4
烷基)氨基羰基、n,n-二(c
1-4
烷基)氨基羰基、c
1-4
烷氧基羰基氨基、c
1-4
烷基磺酰氨基及c
3-6
环烷基磺酰氨基。在一优选实施方案中,r2独立地选自:氢、氟、氯、溴、羟基、甲氧基、氨基、甲基氨基、二甲基氨基、异丙基羰基氨基、叔丁基羰基氨基、叔丁基氨基羰基、叔丁氧基羰基氨基、甲基磺酰氨基及环丙基磺酰氨基。在另一优选实施方案中,r2独立地选自:氢、氟、氯、溴、羟基及甲氧基。
[0025]
在一优选实施方案中,n为1,亦即苯基环仅经一个取代基r2取代。在另一优选实施方案中,r2在对位。
[0026]
在一些实施方案中,r3选自:氢、氟、氯、溴、甲基、环丙基、甲氧基、乙氧基、甲硫基、乙硫基、氨基、甲基氨基及二甲基氨基。
[0027]
在一些实施方案中,r4为氢或氟。
[0028]
在一些实施方案中,r5为羧基。
[0029]
在一些实施方案中,r6为氢。
[0030]
在一些实施方案中,r7为氢或甲基。
[0031]
在一优选实施方案中,式(i)化合物为式(i-a)化合物
[0032][0033]
其中
[0034]
m选自:-ch
2-、-nh-及-nch
3-;
[0035]
r1为c
2-4
烷基;
[0036]
r2独立地选自:氢、卤素、羟基、c
1-4
烷基、c
1-4
卤代烷基、c
1-4
烷氧基、氨基、n-(c
1-4
烷基)氨基、n,n-二(c
1-4
烷基)氨基、c
1-6
烷基羰基氨基、c
3-6
环烷基羰基氨基、n-(c
1-4
烷基)氨基羰基、n,n-二(c
1-4
烷基)氨基羰基、c
1-4
烷氧基羰基氨基、c
1-4
烷基磺酰氨基及c
3-6
环烷基磺酰氨基;
[0037]
n为整数1或2;
[0038]
r3选自:氢、卤素、c
1-4
烷基、c
3-6
环烷基、c
1-4
烷氧基、c
1-4
烷硫基、氨基、n-(c
1-4
烷基)
氨基及n,n-二(c
1-4
烷基)氨基;
[0039]
r4为氢或氟;
[0040]
或其药学上可接受的盐。
[0041]
在另一优选实施方案中,式(i)化合物为式(i-b)化合物:
[0042][0043]
其中
[0044]
m选自:-ch
2-、-nh-及-nch
3-;
[0045]
r1为正丙基或正丁基;
[0046]
r2选自:氢、氟、氯、溴、羟基、甲氧基、氨基、甲基氨基、二甲基氨基、异丙基羰基氨基、叔丁基羰基氨基、叔丁基氨基羰基、叔丁氧基羰基氨基、甲基磺酰氨基及环丙基磺酰氨基;
[0047]
r3选自:氟、氯、溴、甲基、环丙基、甲氧基、乙氧基、甲硫基、乙硫基、氨基、甲基氨基及二甲基氨基;
[0048]
r4为氢或氟;
[0049]
或其药学上可接受的盐。
[0050]
在另一优选实施方案中,式(i)化合物为如上文所定义的式(i-b)化合物,又其中r2选自:氢、氟、氯、溴、羟基及甲氧基。
[0051]
本发明的优选化合物为如上文所定义的式(i-b)化合物,其中m及r1至r4如下表1中所指示,或其药学上可接受的盐:
[0052]
表1
[0053]
[0054]
[0055]
[0056]
[0057]
[0058][0059]
在一具体实施方案中,式(i)化合物选自:
[0060]
(z)-3-((3-丁基-3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)-2-氟丙烯酸;
[0061]
(r)-(z)-3-((3-丁基-3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)-2-氟丙烯酸;
[0062]
(s)-(z)-3-((3-丁基-3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)-2-氟丙烯酸;
[0063]
(e)-3-((3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)丙烯酸;
[0064]
(s)-(e)-3-((3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)丙烯酸;
[0065]
(r)-(e)-3-((3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)丙烯酸;
[0066]
(z)-2-氟-3-((3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)丙烯酸;
[0067]
(r)-(z)-2-氟-3-((3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)丙烯酸;
[0068]
(s)-(z)-2-氟-3-((3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)丙烯酸;及
[0069]
(z)-3-((3-乙基-3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)-2-氟丙烯酸;
[0070]
或其药学上可接受的盐。
[0071]
如本文所用,术语“卤素”是指氟、氯、溴及碘。
[0072]
如本文所用,术语“c
1-6
烷基”是指具有1至6个碳原子的直链或支链烷基,且术语“c
1-4
烷基”是指具有1至4个碳原子的直链或支链烷基。c
1-4
烷基的实例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基及叔丁基。
[0073]
如本文所用,术语“c
1-4
卤代烷基”是指如本文所定义的直链或支链c
1-4
烷基,其中一或多个氢原子已经卤素置换。c
1-4
卤代烷基的实例包括氯甲基、氟乙基及三氟甲基。
[0074]
如本文所用,术语“c
1-4
烷氧基”及“c
1-4
烷硫基”是指分别经由氧或硫原子与分子的其余部分连接的直链或支链c
1-4
烷基。
[0075]
如本文所用,术语“c
3-6
环烷基”是指具有3至6个碳原子的单环饱和烃环。c
3-6
环烷基的实例包括环丙基、环丁基、环戊基及环己基。
[0076]
术语“芳基”表示由6个碳原子构成的芳族单环或由10个碳原子构成的芳族双环系统。芳基的实例包括苯基、萘基及薁基。
[0077]
术语“氨基”是指-nh2基团。如本文所用,术语“n-(c
1-4
烷基)氨基”及“n,n-二(c
1-4
烷基)氨基”是指一个或两个氢原子分别经直链或支链c
1-4
烷基置换的氨基。n-(c
1-4
烷基)氨基的实例包括甲基氨基、乙基氨基及叔丁基氨基,且n,n-二(c
1-4
烷基)氨基的实例包括二甲基氨基及二乙基氨基。
[0078]
如本文所用,术语“n-(芳基-c
1-4
烷基)氨基”是指氢原子经芳基-c
1-4
烷基置换的氨基。n-(芳基-c
1-4
烷基)氨基的实例包括苯甲基氨基及苯乙基氨基。术语“c
1-6
烷基羰基氨基”是指氢原子经c
1-6
烷羰基置换的氨基。c
1-6
烷酰基氨基的实例包括乙酰氨基及叔丁基羰基氨基。术语“c
1-4
烷氧基羰基氨基”是指氢原子经c
1-4
烷氧基羰基置换的氨基。c
1-4
烷氧基羰基氨基的实例为叔丁氧基羰基氨基。术语“c
1-4
烷基磺酰氨基”及“c
3-6
环烷基磺酰氨基”是指氢原子分别经c
1-4
烷基磺酰基或c
3-6
环烷基磺酰基置换的氨基。
[0079]
如本文所用,术语“药学上可接受”是指用于人类医药用途且一般为安全、无毒、既非生物学上亦非其他方面不合需要的那些化合物、物质、组合物及/或剂型。
[0080]
如本文所用,术语“约”是指本文中的值或参数,包括(及描述)针对该值或参数本身的实施方案。举例而言,提及“约20”的描述包括“20”的描述。数值范围包括界定该范围的数值在内。一般而言,术语“约”是指变量的指定值及变量在指定值的实验误差内(例如,在平均值的95%信赖区间内)或在指定值的10%内的所有值,以较大者为准。
[0081]
式(i)的1,5-苯并硫杂氮杂环庚三烯及1,2,5-苯并硫杂二氮杂环庚三烯化合物或其药学上可接受的盐为顶端钠依赖性胆汁酸转运蛋白的抑制剂(asbt抑制剂)、肝脏胆汁酸转运蛋白的抑制剂(lbat抑制剂)或顶端钠依赖性胆汁酸及肝脏胆汁酸转运蛋白两者的抑制剂(双重asbt/lbat抑制剂)。因此,其用于治疗或预防需要抑制胆汁酸循环的病症、障碍及疾病,诸如心血管疾病、脂肪酸代谢及葡萄糖利用障碍、胃肠道疾病及肝病。
[0082]
心血管疾病以及脂肪酸代谢及葡萄糖利用障碍包括但不限于高胆固醇血症;脂肪酸代谢障碍;1型及2型糖尿病;糖尿病的并发症,包括白内障、微血管疾病及大血管疾病、视网膜病变、神经病变、肾病变及伤口愈合延迟、组织缺血、糖尿病足、动脉硬化、心肌梗塞、急性冠状动脉综合征、不稳定型心绞痛、稳定型心绞痛、中风、外周动脉阻塞疾病、心肌病、心力衰竭、心律失常及血管再狭窄;糖尿病相关疾病,诸如胰岛素抗性(葡萄糖稳态受损)、高血糖症、高胰岛素血症、脂肪酸或甘油的血液水平升高、肥胖症、血脂异常、包括高三酸甘油酯血症的高脂质血症、代谢综合征(综合征x)、动脉粥样硬化及高血压;及用于增加高密度脂蛋白含量。
[0083]
胃肠道疾病及障碍包括便秘(包括慢性便秘、功能性便秘、慢性特发性便秘(cic)、间歇性/偶发性便秘、因糖尿病继发的便秘、因中风继发的便秘、因慢性肾病继发的便秘、因多发性硬化症继发的便秘、因帕金森氏病(parkinson's disease)继发的便秘、因全身性硬化症继发的便秘、药物诱发的便秘、伴有便秘的肠易激综合征(ibs-c)、混合型肠易激综合征(ibs-m)、小儿功能性便秘及阿片样物质诱发的便秘);克罗恩氏病(crohn's disease);原发性胆汁酸吸收障碍;肠易激综合征(ibs);炎性肠病(ibd);回肠炎症;及反流性疾病及
其并发症,诸如巴雷特氏食道(barrett's esophagus)、胆汁反流性食道炎及胆汁反流性胃炎。
[0084]
如本文所定义的肝病为肝脏及与其连接的器官(诸如胰脏、门静脉、肝实质、肝内胆管树、肝外胆管树及胆囊)中的任何疾病。在一些情况下,肝病为胆汁酸依赖性肝病。肝脏疾病及障碍包括但不限于遗传性肝脏代谢障碍;胆汁酸合成的先天性错误;先天性胆管异常;胆道闭锁;葛西术后胆道闭锁(post-kasai biliary atresia);肝移植术后胆道闭锁;新生儿肝炎;新生儿胆汁淤积;遗传形式的胆汁淤积;脑腱性黄瘤病;次级ba合成缺陷;齐薇格氏综合征(zellweger
′
s syndrome);囊肿性纤维化相关肝病;α1-抗胰蛋白酶缺乏症;阿拉杰里综合征(alagilles syndrome,algs);拜勒综合征(byler syndrome);初级胆汁酸(ba)合成缺陷;进行性家族性肝内胆汁淤积(pfic),包括pfic-1、pfic-2、pfic-3及非特异性pfic、胆汁分流术后pfic及肝移植术后pfic;良性复发性肝内胆汁淤积(bric),包括bric1、bric2及非特异性bric、胆汁分流术后bric及肝移植术后bric;自身免疫性肝炎;原发性胆汁性肝硬化(pbc);肝纤维化;非酒精性脂肪肝病(nafld);非酒精性脂肪性肝炎(nash);门静脉高血压;胆汁淤积;唐氏综合征胆汁淤积(down syndrome cholestasis);药物诱发性胆汁淤积;妊娠肝内胆汁淤积(妊娠期黄疸);肝内胆汁淤积;肝外胆汁淤积;肠胃外营养相关胆汁淤积(pnac);低磷脂相关胆汁淤积;淋巴水肿胆汁淤积综合征1(lsc1);原发性硬化性胆管炎(psc);免疫球蛋白g4相关胆管炎;原发性胆汁性胆管炎;胆石症(胆结石);胆道结石;胆总管结石;胆石性胰腺炎;卡罗利病(caroli disease);胆管恶性肿瘤;导致胆管树梗阻的恶性肿瘤;胆道狭窄;aids胆管病;缺血性胆管病;胆汁淤积或黄疸引起的瘙痒症;胰腺炎;导致进行性胆汁淤积的慢性自身免疫肝病;肝脏脂肪变性;酒精性肝炎;急性脂肪肝;妊娠脂肪肝;药物诱发性肝炎;铁过载症;先天性胆汁酸合成缺陷1型(bas 1型);药物诱发性肝损伤(dili);肝纤维化;先天性肝纤维化;肝硬化;朗格汉斯细胞组织细胞增生症(langerhans cell histiocytosis,lch);新生儿鱼鳞癣硬化性胆管炎(nisch);红血球生成性原卟啉症(epp);特发性成人期胆管缺失症(iad);特发性新生儿肝炎(inh);非症候型小叶间胆管缺乏(ns pilbd);北美印第安儿童期肝硬化(naic);肝结节病;淀粉样变性;坏死性小肠结肠炎;血清胆汁酸引起的毒性,包括血清胆汁酸分布型态异常的心律不整(例如心房纤颤)、与肝硬化相关的心肌病(“cholecardia”)及与胆汁淤积性肝病相关的骨骼肌萎缩;多囊性肝病;病毒性肝炎(包括甲型肝炎、乙型肝炎、丙型肝炎、丁型肝炎和戊型肝炎);肝细胞癌(肝癌);胆管癌;胆汁酸相关的胃肠道癌症;及由肝脏、胆道及胰脏肿瘤及赘生物引起的胆汁淤积。式(i)化合物或其药学上可接受的盐亦用于增强肝脏疾病的皮质类固醇疗法。
[0085]
可经由式(i)化合物或其药学上可接受的盐治疗或预防的其他疾病包括超吸收综合征(包括无β脂蛋白血症、家族性低β脂蛋白血症(fhbl)、乳糜微粒滞留病(crd)及谷固醇血症);维生素过多症及骨硬化病;高血压;肾小球高滤过;多囊性肾病(pkd)(包括常染色体显性多囊性肾病(adpkd)及常染色体隐性多囊性肾病(arpkd));及肾衰竭的瘙痒症。化合物亦用于对肝脏疾病或代谢疾病相关肾损伤的保护中。
[0086]
人体内胆汁酸的转运受slc10溶质载体蛋白家族成员的作用控制,尤其na
+-牛磺胆酸盐协同转运多肽(ntcp,亦称为肝脏胆汁酸转运蛋白(lbat);基因符号slc10a1),其在肝细胞的窦状隙膜中表达;及顶端钠依赖性胆汁酸转运蛋白(asbt,亦称为回肠胆汁酸转运
蛋白(ibat)、isbt、abat或ntcp2;基因符号slc10a2),其在回肠上皮细胞、近端肾小管细胞、胆道上皮细胞、大胆管细胞及胆囊上皮细胞的顶端膜中表达。在肝脏中,胆汁酸经由肝脏胆汁酸转运蛋白(lbat)自门静脉血中有效提取,且经由胆盐输出泵(bsep;基因符号abcb11)再分泌穿过小管膜。回肠中胆汁酸的再吸收是由顶端钠依赖性胆汁酸转运蛋白(asbt)处理,其通常称为回肠胆汁酸转运蛋白(ibat)。lbat及asbt均充当起电钠-溶质协同转运蛋白,每分子溶质移动两个或更多个na
+
离子。
[0087]
外源性物质及内源性物质,包括胆汁酸,是由肝脏自门静脉血吸收且经由具有个体化底物特异性的不同转运蛋白分泌于胆汁中。甘氨酸缀合的胆汁酸及牛磺酸缀合的胆汁酸以阴离子形式存在且不能经由扩散穿过膜,因此完全依赖于膜转运蛋白进入或离开肝细胞(kosters及karpen,xenobiotica 2008,第38卷,第1043-1071页)。asbt及lbat偏好甘氨酸缀合的胆盐及牛磺酸缀合的胆盐超过其未缀合的对应物,且表现出对二羟基胆盐的亲和力高于对三羟基胆盐的亲和力。尚未鉴别出asbt的非胆汁酸底物,然而,亦发现lbat转运多种类固醇硫酸盐、激素及外源性物质。
[0088]
就药物抑制要求而言,lbat未如asbt一般彻底表征。dong等人已鉴别出fda核准的抑制人类lbat的药物,且比较lbat及asbt抑制要求。使用fda核准的药物,配合迭代计算模型开发进行一系列lbat抑制研究。筛选研究鉴别出27种药物作为新颖的lbat抑制剂,包括厄贝沙坦(irbesartan,ki=11.9μm)及依泽替米贝(ezetimibe,ki=25.0μm)。共同特征药效团表明两个疏水物及一个氢键受体对于抑制lbat为重要的。自活体外筛选的72种药物中,共有31种药物抑制lbat,而51种药物(亦即超过一半)抑制asbt。因此,虽然存在抑制剂重叠,但asbt出乎意料地比lbat更容许药物抑制,且此可能与lbat具有较少的药效团特征相关(dong等人,mol.pharm.2013,第10卷,第1008-1019页)。
[0089]
vaz等人将lbat缺乏症的鉴别描述为具有相对轻微临床表型的新的先天性代谢错误。lbat缺乏症的鉴别证实,此转运蛋白为缀合胆盐进入肝脏的主要输入系统,且亦表明辅助转运蛋白能够在其不存在时维持肠肝循环(vaz等人,hepatology 2015,第61卷,第260-267页)。这些发现支持lbat抑制为安全作用机制的假设,因为肝细胞仍有可能吸收必需量的胆汁酸。
[0090]
liu等人描述与slc10a1(lbat)中p.ser267phe突变的纯合性相关的新型高胆烷血症的鉴别。基因slc10a1中此突变的等位基因频率在不同群体中有所不同,其中最高的发病率出现在中国南方(中国汉族及傣族分别为8%及12%)及越南(11%)。据信此“隐藏的”高胆烷血症影响南方汉族的0.64%、中国傣族人口的1.44%及越南人口的1.21%。亦观测到纯合个体中缀合及未缀合的血清ba含量的增加。liu等人提出,此发现最可能归因于自门静脉循环至肝细胞中的ba转运减少。这支持以下假设:肠肝循环的生理功能不仅使胆汁酸再循环,且亦自循环清除胆汁酸以达成稳态(karpen及dawson,hepatology 2015,第61卷,第24-27页)。或者,肝脏可合成增加含量的胆汁酸以补偿纯合载体中减少的肠肝再循环。由于lbat亦转运未缀合的胆汁酸,故在此研究中未缀合的胆汁酸增加并不出人意料(liu等人,scientific reports2017,7:9214,第1-7页)。
[0091]
已发现lbat在数种形式的胆汁淤积性肝损伤及胆汁淤积中被下调,而发现asbt在多种胃肠道障碍中被下调,诸如克罗恩氏病、原发性胆汁酸吸收障碍、炎性肠病及回肠炎症,但在胆汁淤积中被上调。lbat亦充当b型肝炎病毒(hbv)及d型肝炎病毒(hdv)的病毒进
入的细胞受体,b型肝炎病毒及d型肝炎病毒又为肝病及肝细胞癌的主要原因。
[0092]
已研究asbt抑制用于降低血浆胆固醇含量及改善胰岛素抗性,以及减轻胆汁淤积性肝病中的肝胆汁酸负荷。另外,已发现asbt抑制恢复胰岛素含量及血糖量正常,从而确立asbt抑制为2型糖尿病的有前景的治疗。asbt抑制剂亦用于治疗功能性便秘。
[0093]
由于asbt主要在回肠中表达(在此其通常称为ibat),因此asbt抑制剂不必全身可用。另一方面,asbt亦在肾脏的近端小管细胞中表达。因此,全身可用的asbt抑制剂亦可抑制肾脏中胆汁酸的再吸收。据信,此将导致尿液中胆汁酸含量增加,及经由尿液增加自身体移除胆汁酸。因此,预期不仅在回肠中且亦在肾脏中发挥作用的全身可用的asbt抑制剂比仅在回肠中发挥作用的非全身可用的asbt抑制剂导致胆汁酸含量的更大降低。
[0094]
具有高asbt抑制效力的化合物特别用于治疗引起胆汁淤积的肝病,诸如进行性家族性肝内胆汁淤积(pfic)、阿拉杰里综合征、胆道闭锁及非酒精性脂肪性肝炎(nash)。
[0095]
胆道闭锁为一种罕见的小儿肝病,其涉及大胆管的部分或完全阻塞(或甚至缺失)。此阻塞或缺失造成胆汁淤积,导致胆汁酸积聚,从而损害肝脏。在一些实施方案中,胆汁酸的积聚发生在肝外胆管树中。在一些实施方案中,胆汁酸的积聚发生在肝内胆管树中。目前的护理标准为葛西手术,其为移除阻塞的胆管且将一部分小肠直接连接至肝脏的手术。目前没有针对此障碍的核准药物疗法。
[0096]
本文提供用于治疗有需要的个体的胆道闭锁的方法,所述方法包含给药治疗有效量的式(i)化合物或其药学上可接受的盐。在一些实施方案中,受试者在给药式(i)化合物或其药学上可接受的盐之前已进行葛西手术。在一些实施方案中,在进行葛西手术之前,向受试者给药式(i)化合物或其药学上可接受的盐。在一些实施方案中,胆道闭锁的治疗降低受试者的血清胆汁酸水平。在一些实施方案中,血清胆汁酸含量经由例如elisa酶分析或测量总胆汁酸的分析来测定,如danese等人,plos one.2017,第12(6)卷:e0179200中所述,其以全文引用的方式并入本文中。在一些实施方案中,血清胆汁酸含量可降低例如在给药式(i)化合物或其药学上可接受的盐之前的血清胆汁酸含量的10%至40%、20%至50%、30%至60%、40%至70%、50%至80%或大于90%。在一些实施方案中,胆道闭锁的治疗包括瘙痒症的治疗。
[0097]
pfic为一种罕见的遗传障碍,据估计影响全球出生的每50,000至100,000名儿童中的一名且造成进行性、危及生命的肝病。
[0098]
pfic的一种表现形式为瘙痒症,其通常导致生活质量严重下降。在一些情况下,pfic导致肝硬化及肝衰竭。目前的疗法包括部分胆汁外分流术(pebd)及肝移植,然而,这些选项可能带来相当大的手术后并发症风险,以及心理及社会问题。
[0099]
已鉴别三种可选基因缺陷,其与称为1型、2型及3型的三种单独的pfic亚型相关:
[0100]
·
pfic 1型,其有时称为“拜勒病”,是由因atp8b1基因突变所致的胆汁分泌受损引起,该基因编码的蛋白质有助于维持称为磷脂的脂肪在胆管细胞膜中的适当平衡。这些磷脂的失衡与胆汁淤积及肝脏中的胆汁酸升高相关联。受pfic 1型影响的受试者通常在出生后之前几个月发生胆汁淤积,且在没有手术治疗的情况下,在生命的第一个十年结束之前进展为肝硬化及末期肝病。
[0101]
·
pfic 2型,其有时称为“拜勒综合征”,是由因abcb11基因突变所致的胆盐分泌受损引起,该基因编码一种称为胆盐输出泵的蛋白质,其将胆汁酸自肝脏移出。患有pfic 2
型的受试者通常在出生后之前几年内罹患肝衰竭,且罹患一类称为肝细胞癌的肝癌的风险增加。
[0102]
·
pfic 3型,其通常在儿童期的最初几年伴随进行性胆汁淤积出现,是由abcb4基因突变引起,该基因编码将磷脂移动穿过细胞膜的转运蛋白。
[0103]
另外,已提出tjp2基因、nr1h4基因或myo5b基因突变为pfic的原因。另外,一些患有pfic的受试者在atp8b1、abcb11、abcb4、tjp2、nr1h4或myo5b基因中的任一者中均没有突变。在这些情况下,病症的原因为未知的。
[0104]
atp8b1基因或所得蛋白质的示例性突变列于表2及表3中,其中编号基于人类野生型atp8b1蛋白(例如seq id no:1)或基因(例如seq id no:2)。abcb11基因或所得蛋白质的示例性突变列于表4及表5中,其中编号基于人类野生型abcb11蛋白(例如seq id no:3)或基因(例如seq id no:4)。
[0105]
如本领域技术人员可了解,参考蛋白质序列中对应于seq id no:1或3的特定氨基酸位置的氨基酸位置可经由将参考蛋白质序列与seq id no:1或3比对来确定(例如,使用软件程序,诸如clustalw2)。这些残基的变化(在本文中称为“突变”)可包括单个或多个氨基酸取代、序列内或侧翼的插入以及序列内或侧翼的缺失。如本领域技术人员可了解,参考基因序列中对应于seq id no:2或4的特定核苷酸位置的核苷酸位置可经由将参考基因序列与seq id no:2或4比对来确定(例如,使用软件程序,诸如clustalw2)。这些残基的变化(在本文中称为“突变”)可包括单个或多个核苷酸取代、序列内或侧翼的插入以及序列内或侧翼的缺失。亦参见kooistra等人,“klifs:a structural kinase-ligand interaction database”,nucleic acids res.2016,第44卷,第d1期,第d365-d371页,其以全文引用的方式并入本文中。
[0106]
atp8b1的典型蛋白质序列(seq id no:1)-uniprot id o43520
[0107][0108]
atp8b1的典型dna序列(seq id no:2)
[0109]
[0110][0111]
表2.示例性atp8b1突变
[0112]
[0113]
[0114]
[0115]
[0116]
[0117]
[0118][0119]
[0120]
表3.与pfic-1相关的所选atp8b1突变
[0121]
[0122]
[0123][0124]a突变为“x”表示早期终止密码子
[0125]
表2及3的参考文献
[0126]1folmer等人,hepatology.2009,第50(5)卷,第1597-1605页
[0127]2hsu等人,hepatol res.2009,第39(6)卷,第625-631页
[0128]3alvarez等人,hum mol genet.2004,第13(20)卷,第2451-2460页
[0129]4davit-spraul等人,hepatology 2010,第51(5)卷,第1645-1655页
[0130]5vitale等人,j gastroenterol.2018,第53(8)卷,第945-958页
[0131]6klomp等人,hepatology 2004,第40(1)卷,第27-38页
[0132]7zarenezhad等人,hepatitis monthly:2017,第17(2)卷;e43500.
[0133]8dixon等人,scientific reports 2017,第7卷,11823.
[0134]9painter等人,eur j hum genet.2005,第13(4)卷,第435-439页
[0135]
10
deng等人,world j gastroenterol.2012,第18(44)卷,第6504-6509页
[0136]
11
giovannoni等人,plos one.2015,第10(12)卷:e0145021.
[0137]
12
li等人,hepatology international 2017,第11卷,第1期,supp.增刊1,pp.s180.文摘号op284.
[0138]
13
togawa等人,journal of pediatric gastroenterology and nutrition 2018,第67卷,supp.增刊1,pp.s363.文摘号615.
[0139]
14
miloh等人,gastroenterology 2006,第130卷,第4期,suppl.2,pp.a759-a760.会议信息:digestive disease week meeting/107th annual meeting of the american-gastroenterological-association.美国,加利福尼亚州,洛杉矶,5月19日
[0140]
15
等人,zeitschrift fur gastroenterologie 2015,第53卷,第12期.文
摘号a3-27.会议信息:32.jahrestagung der deutschen arbeitsgemeinschaft zum studium der leber,德国,杜塞尔多夫,2016年1月22日至2016年1月23日
[0141]
16
mizuochi等人,clin chim acta.2012,第413(15-16)卷,第1301-1304页
[0142]
17
liu等人,hepatology international 2009,第3卷,第1期,第184-185页。文摘号pe405.会议信息:19th conference of the asian pacific association for the study of the liver.中国香港,2009年2月13日至2009年2月16日
[0143]
18
mckay等人,version 2.f1000res.2013;2:32.doi:10.12688/f1000research.2-32.v2
[0144]
19
hasegawa等人,orphanet j rare dis.2014,第9:89卷
[0145]
20
stone等人,j biol chem.2012,第287(49)卷,第41139-51页
[0146]
21
kang等人,j pathol transl med.2019年5月16日.doi:10.4132/jptm.2019.05.03.[早于印刷前电子公开]
[0147]
22
sharma等人,bmc gastroenterol.2018,第18(1)卷,第107页
[0148]
23
uegaki等人,intern med.2008,第47(7)卷,第599-602页
[0149]
24
goldschmidt等人,hepatol res.2016,第46(4)卷,第306-311页
[0150]
25
liu等人,j pediatr gastroenterol nutr.2010,第50(2)卷,第179-183页
[0151]
26
jung等人,j pediatr gastroenterol nutr.2007,第44(4)卷,第453-458页
[0152]
27
bounford.university of birmingham.dissertation abstracts international,(2016)第75卷,第1c期,订阅号:aai10588329.proquest dissertations&theses.
[0153]
28
stolz等人,aliment pharmacol ther.2019,第49(9)卷,第1195-1204页
[0154]
29
ivashkin等人,hepatology international 2016,第10卷,第1期,supp.suppl.1,pp.s461.文摘号lbo-38.会议信息:25th annual conference of the asian pacific association for the study of the liver,apasl 2016.日本,东京,2016年2月20日至2016年2月24日
[0155]
30
blackmore等人,j clin exp hepatol.2013,第3(2)卷,第159-161页
[0156]
31
matte等人,j pediatr gastroenterol nutr.2010,第51(4)卷,第488-493页
[0157]
32
squires等人,j pediatr gastroenterol nutr.2017,第64(3)卷,第425-430页
[0158]
33
hayshi等人,ebiomedicine.2018,第27卷,第187-199页
[0159]
34
nagasaka等人,j pediatr gastroenterol nutr.2007,第45(1)卷,第96-105页
[0160]
35
wang等人,plos one.2016;第11(4)卷:e0153114.
[0161]
36
narchi等人,saudi j gastroenterol.2017,第23(5)卷,第303-305页
[0162]
37
alashkar等人,blood 2015,第126卷,第23.会议信息:57th annual meeting of the american-society-of-hematology.美国,佛罗里达州,奥兰多,2015年12月5日至8日,amer soc hematol.
[0163]
38
ferreira等人,pediatric transplantation 2013,第17卷,supp.suppl.1,pp.99.文摘号239.会议信息:ipta 7th congress on pediatric transplantation.波兰,华沙,2013年7月13日至2013年7月16日.
[0164]
39
pauli-magnus等人,j hepatol.2005,第43(2)卷,第342-357页
[0165]
40
jericho等人,journal of pediatric gastroenterology and nutrition 2015,第60(3)卷,第368-374页
[0166]
41
van der woerd等人,plos one.2013,第8(11)卷:e80553.
[0167]
42
copeland等人,j gastroenterol hepatol.2013,第28(3)卷,第560-564页
[0168]
43
等人,j hepatol.2017,第67(6)卷,第1253-1264页
[0169]
44
chen等人,journal of pediatrics 2002,第140(1)卷,第119-124页
[0170]
45
jirsa等人,hepatol res.2004,第30(1)卷,第1-3页
[0171]
46
van der woerd等人,hepatology 2015,第61(4)卷,第1382-1391页
[0172]
在一些实施方案中,atp8b1中的突变选自l127p、g308v、t456m、d554n、f529del、i661t、e665x、r930x、r952x、r1014x及g1040r。
[0173]
abcb11的典型蛋白质序列(seq id no:3)-uniprot id o95342
[0174][0175]
abcb11的典型dna序列(seq id no:4)
[0176]
[0177]
[0178][0179]
表4.示例性abcb11突变
[0180]
[0181]
[0182]
[0183]
[0184]
[0185]
[0186]
[0187]
[0188]
[0189]
[0190][0191]
表5.与pfic-2相关的所选abcb11突变
[0192]
[0193]
[0194]
[0195]
[0196]
[0197]
[0198][0199]a突变为“x”表示早期终止密码子
[0200]
表4及表5的参考文献
[0201]1noe等人,j hepatol.2005,第43(3)卷,第536-543页
[0202]2lam等人,am j physiol cell physiol.2007,第293(5)卷,第c1709-16页
[0203]3stindt等人,liver int.2013,第33(10)卷,第1527-1735页
[0204]4gao等人,shandong yiyao 2012,第52(10)卷,第14-16页
[0205]5strautnieks等人,gastroenterology.2008,第134(4)卷,第1203-1214页
[0206]6kagawa等人,am j physiol gastrointest liver physiol.2008,第294(1)卷,第g58-67页
[0207]7byrne等人,hepatology.2009,第49(2)卷,第553-567页
[0208]8chen等人,j pediatr.2008,第153(6)卷,第825-832页
[0209]9davit-spraul等人,hepatology 2010,第51(5)卷,第1645-1655页
[0210]
10
等人,sci rep.2016,第6卷:24827.
[0211]
11
lang等人,pharmacogenet genomics.2007,第17(1)卷,第47-60页
[0212]
12
ellinger等人,world j gastroenterol.2017,第23(29)卷,第:5295-5303页
[0213]
13
vitale等人,j gastroenterol.2018,第53(8)卷,第945-958页
[0214]
14
knisely等人,hepatology.2006,第44(2)卷,第478-86页
[0215]
15
ellis等人,hepatology.2018,第67(4)卷,第1531-1545页
[0216]
16
lam等人,j hepatol.2006,第44(1)卷,第240-242页
[0217]
17
varma等人,hepatology 2015,第62(1)卷,第198-206页
[0218]
18
treepongkaruna等人,world j gastroenterol.2009,第15(34)卷,第4339-4342页
[0219]
19
zarenezhad等人,hepatitis monthly:2017,第17(2)卷;e43500.
[0220]
20
hayashi等人,hepatol res.2016,第46(2)卷,第192-200页
[0221]
21
guorui等人,linchuang erke zazhi 2013,第31(10)卷,905-909页
[0222]
22
van mil等人,gastroenterology.2004,第127(2)卷,第379-384页
[0223]
23
anzivino等人,dig liver dis.2013,第45(3)卷,第226-232页
[0224]
24
park等人,world j gastroenterol.2016,第22(20)卷,第4901-4907页
[0225]
25
imagawa等人,j hum genet.2018,第63(5)卷,第569-577页
[0226]
26
giovannoni等人,plos one.2015,第10(12)卷:e0145021.
[0227]
27
hu等人,mol med rep.2014,第10(3)卷,第1264-1274页
[0228]
28
lang et al,.drug metab dispos.2006,第34(9)卷,第1582-1599页
[0229]
29
masahata等人,transplant proc.2016,第48(9)卷,第3156-3162页
[0230]
30
holz等人,hepatol commun.2018,第2(2)卷,第152-154页
[0231]
31
li等人,hepatology international 2017,第11卷,第1期,supp.增刊1,pp.s180.文摘号op284.
[0232]
32
francalanci等人,laboratory investigation 2011,第91卷,supp.suppl.1,pp.360a.文摘号1526.
[0233]
33
francalanci等人,digestive and liver disease 2010,第42卷,supp.suppl.1,pp.s16.文摘号t.n.5.
[0234]
34
shah等人,j pediatr genet.2017,第6(2)卷,第126-127页
[0235]
35
gao等人,hepatitis monthly 2017,第17(10)卷,e55087/1-e55087/6.
[0236]
36
evason等人,am j surg pathol.2011,第35(5)卷,第687-696页
[0237]
37
davit-spraul等人,mol genet metab.2014,第113(3)卷,第225-229页
[0238]
38
maggiore等人,j hepatol.2010,第53(5)卷,第981-6页
[0239]
39
mckay等人,version 2.f1000res.2013;2:32.doi:10.12688/f1000research.2-32.v2
[0240]
40
liu等人,pediatr int.2013,第55(2)卷,第138-144页
[0241]
41
waisbourd-zinman等人,ann hepatol.2017,第16(3)卷,第465-468页
[0242]
42
griffin,等人,canadian journal of gastroenterology and hepatology 2016,第2016卷,文摘号a200.会议信息:2016canadian digestive diseases week,cddw 2016.montreal,qc,美国,2016年2月26日至2016年2月29日
[0243]
43
qiu等人,hepatology 2017,第65(5)卷,第1655-1669页
[0244]
44
imagawa等人,sci rep.2017,7:41806.
[0245]
45
kang等人,j pathol transl med.2019may 16.doi:10.4132/jptm.2019.05.03.[早于印刷前电子公开]
[0246]
46
takahashi等人,eur j gastroenterol hepatol.2007,第19(11)卷,第942-6页
[0247]
47
shimizu等人,am j transplant.2011,第11(2)卷,第394-398页
[0248]
48
krawczyk等人,ann hepatol.2012,第11(5)卷,第710-744页
[0249]
49
sharma等人,bmc gastroenterol.2018,第18(1)卷,第107页
[0250]
50
sattler等人,journal of hepatology 2017,第66卷,第1期,suppl.s,pp.s177.会议信息:international liver congress/52nd annual meeting of the european-association-for-the-study-of-the-liver.荷兰阿姆斯特丹,2017年4月19日至23日,european assoc study liver.
[0251]
51
jung等人,j pediatr gastroenterol nutr.2007,第44(4)卷,第453-458页
[0252]
52
sciveres.digestive and liver disease 2010,第42卷,supp.suppl.5,pp.s329.文摘号co18.会议信息:17th national congress sigenp.意大利,佩斯卡拉(pescara),2010年10月7日至2010年10月9日
[0253]
53
sohn等人,pediatr gastroenterol hepatol nutr.2019,第22(2)卷,第201-206页
[0254]
54
ho等人,pharmacogenet genomics.2010,第20(1)卷,第45-57页
[0255]
55
wang等人,hepatol res.2018,第48(7)卷,第574-584页
[0256]
56
shaprio等人,j hum genet.2010,第55(5)卷,第308-313页
[0257]
57
bounford.university of birmingham.dissertation abstracts international,(2016)第75卷,第1c期,订阅号:aai10588329.proquest dissertations&theses.
[0258]
58
stolz等人,aliment pharmacol ther.2019,第49(9)卷,第1195-1204页
[0259]
59
jankowska等人,j pediatr gastroenterol nutr.2014,第58(1)卷,第92-95页
[0260]
60
kim.journal of pediatric gastroenterology and nutrition 2016,第62卷,supp.suppl.1,pp.620.文摘号h-p-045.会议信息:49th annual meeting of the european society for paediatric gastroenterology,hepatology and nutrition,espghan 2016.希腊雅典,2016年5月25日至2016年5月28日
[0261]
61
pauli-magnus等人,hepatology 2003,第38卷,第4期,suppl.1,pp.518a.print.会议信息:54th annual meeting of the american association for the study of liver diseases.美国,马萨诸塞州,波士顿,2003年10月24日至28日,american association for the study of liver diseases.
[0262]
62
li等人,hepatology international 2017,第11卷,第1期,supp.增刊1,pp.s362.文摘号pp0347.会议信息:26th annual conference of the asian pacific association for the study of the liver,apasl 2017.中国,上海,2017年2月15日至2017年2月19日.
[0263]
63
rumbo等人,transplantation 2018,第102卷,第7期,supp.增刊1,pp.s848.文摘号p.752.会议信息:27th international congress of the transplantation society,tts 2018.西班牙,马德里,2018年6月30日至2018年7月5日
[0264]
64
lee等人,pediatr gastroenterol hepatol nutr.2017,第20(2)卷,第114-123页
[0265]
65
sherrif等人,liver international:official journal of the international association for the study of the liver 2013,第33卷,第8期,第
1266-1270页
[0266]
66
blackmore等人,j clin exp hepatol.2013,第3(2)卷,第159-161页
[0267]
67
matte等人,j pediatr gastroenterol nutr.2010,第51(4)卷,第488-493页
[0268]
68
lin等人,zhongguo dang dai er ke za zhi.2018,第20(9)卷,第758-764页
[0269]
69
harmanci等人,experimental and clinical transplantation 2015,第13卷,supp.suppl.2,pp.76.文摘号p62.会议信息:1st congress of the turkic world transplantation society.哈萨克斯坦,阿斯塔纳,2015年5月20日至2015年5月22日
[0270]
70
herbst等人,mol cell probes.2015,第29(5)卷,第291-298页
[0271]
71
moghadamrad等人,hepatology.2013,第57(6)卷,第2539-2541页
[0272]
72
holz等人,zeitschrift fur gastroenterologie 2016,第54卷,第8.文摘号kv275.会议信息:viszeralmedizin 2016,71.jahrestagung der deutschen gesellschaft fur gastroenterologie,verdauungs-und stoffwechselkrankheiten mit sektion endoskopie-10.herbsttagung der deutschen gesellschaft fur allgemein-und viszeralchirurgie.德国,汉堡,2016年9月21日至2016年9月24日
[0273]
73
wang等人,plos one.2016;第11(4)卷:e0153114.
[0274]
74
hao等人,international journal of clinical and experimental pathology2017,第10(3)卷,第3480-3487.
[0275]
75
arnell等人,j pediatr gastroenterol nutr.2010,第51(4)卷,第494-499页
[0276]
76
sharma等人,indian journal of gastroenterology 2017,第36卷,第1期,supp.增刊1,pp.a99.文摘号m-20.会议信息:58th annual conference of the indian society of gastroenterology,isgcon 2017.印度,布巴内斯瓦尔,2017年12月14日至2017年12月17日
[0277]
77
beaus
é
jour等人,can j gastroenterol.2011,第25(6)卷,第311-314页
[0278]
78
imagawa等人,journal of pediatric gastroenterology and nutrition 2016,第63卷,supp.增刊2,pp.s51.文摘号166.会议信息:world congress of pediatric gastroenterology,hepatology and nutrition 2016.加拿大,蒙特利尔,2016年10月5日至2016年10月8日
[0279]
79
peng等人,zhonghua er ke za zhi(chinese journal of pediatrics)2018,第56卷,第6,pp.440-444页
[0280]
80
tibesar等人,case rep pediatr.2014,第2014卷:185923.
[0281]
81
ng等人,journal of pediatric gastroenterology and nutrition 2018,第66卷,supp.增刊2,pp.860.文摘号h-p-127.会议信息:51st annual meeting european society for paediatric gastroenterology,hepatology and nutrition,espghan 2018.瑞士,日内瓦,2018年5月9日至2018年5月12日
[0282]
82
wong等人,clin chem.2008,第54(7)卷,第1141-1148页
[0283]
83
pauli-magnus等人,j hepatol.2005,第43(2)卷,第342-357页
[0284]
84
jericho等人,journal of pediatric gastroenterology and nutrition.60,第3卷,第368-374页
[0285]
85
scheimann等人,gastroenterology 2007,第132卷,第4期,suppl.2,pp.a452.会
议信息:digestive disease week meeting/108th annual meeting of the american-gastroenterological-association.美国华盛顿特区,2007年5月19日至24日,amer gastroenterol assoc;amer assoc study liver dis;amer soc gastrointestinal endoscopy;soc surg alimentary tract.
[0286]
86
jaquotot-haerranz等人,rev esp enferm dig.2013,第105(1)卷,第52-54页
[0287]
87
khosla等人,american journal of gastroenterology 2015,第110卷,第suppl.1,pp.s397.会议信息:80th annual scientific meeting of the american-college-of-gastroenterology.美国,夏威夷,檀香山,2015年10月16日至21日
[0288]
88
等人,j hepatol.2017,第67(6)卷,第1253-1264页
[0289]
89
liu等人,liver international 2010,第30(6)卷,第809-815页
[0290]
90
chen等人,journal of pediatrics 2002,第140(1)卷,第119-124页
[0291]
91
美国专利9,295,677
[0292]
在一些实施方案中,abcb11中的突变选自a167t、g238v、v284l、e297g、r470q、r470x、d482g、r487h、a570t、n591s、a865v、g982r、r1153c及r1268q。
[0293]
提供治疗受试者的pfic(例如pfic-1及pfic-2)的方法,其包括对自受试者获得的样品进行分析以确定受试者是否具有与pfic相关的突变(例如atp8b1、abcb11、abcb4、tjp2、nr1h4或myo5b突变),及向确定具有与pfic相关的突变的受试者给药(例如特异性或选择性给药)治疗有效量的式(i)化合物或其药学上可接受的盐。在一些实施方案中,突变为atp8b1或abcb11突变。举例而言,如表2至表5中的任一者所提供的突变。在一些实施方案中,atp8b1中的突变选自l127p、g308v、t456m、d554n、f529del、i661t、e665x、r930x、r952x、r1014x及g1040r。在一些实施方案中,abcb11中的突变选自a167t、g238v、v284l、e297g、r470q、r470x、d482g、r487h、a570t、n591s、a865v、g982r、r1153c及r1268q。
[0294]
亦提供治疗有需要的受试者的pfic(例如pfic-1及pfic-2)的方法,该方法包含:(a)检测受试者的与pfic相关的突变(例如atp8b1、abcb11、abcb4、tjp2、nr1h4或myo5b突变);及(b)向受试者给药治疗有效量的式(i)化合物或其药学上可接受的盐。在一些实施方案中,用于治疗pfic的方法可包括向具有与pfic相关的突变(例如atp8b1、abcb11、abcb4、tjp2、nr1h4或myo5b突变)的受试者给药治疗有效量的式(i)化合物或其药学上可接受的盐。在一些实施方案中,突变为atp8b1或abcb11突变。举例而言,如表2至表5中的任一者所提供的突变。在一些实施方案中,atp8b1中的突变选自l127p、g308v、t456m、d554n、f529del、i661t、e665x、r930x、r952x、r1014x及g1040r。在一些实施方案中,abcb11中的突变选自a167t、g238v、v284l、e297g、r470q、r470x、d482g、r487h、a570t、n591s、a865v、g982r、r1153c及r1268q。
[0295]
在一些实施方案中,经由使用任何本领域公认的测试,包括下一代测序(ngs),在受试者体内或来自受试者的活组织检查样品中确定受试者具有与pfic相关的突变。在一些实施方案中,使用管理机构核准(例如fda核准)的用于鉴别受试者或来自受试者的活组织检查样品中与pfic相关的突变的测试或分析,或经由进行本文所述分析的非限制性实例中的任一者来确定受试者具有与pfic相关的突变。诊断pfic的额外方法描述于gunaydin,m.等人,hepat med.2018,第10卷,第95-104页中,其以全文引用的方式并入本文中。
[0296]
在一些实施方案中,pfic(例如pfic-1或pfic-2)的治疗降低受试者的血清胆汁酸
含量。在一些实施方案中,血清胆汁酸含量经由例如elisa酶分析或测量总胆汁酸的分析来测定,如danese等人,plos one.2017,第12(6)卷:e0179200中所述,其以全文引用的方式并入本文中。在一些实施方案中,血清胆汁酸含量可降低例如在给药式(i)化合物或其药学上可接受的盐之前的血清胆汁酸含量的10%至40%、20%至50%、30%至60%、40%至70%、50%至80%或大于90%。在一些实施方案中,pfic的治疗包括瘙痒症的治疗。
[0297]
由于lbat在肝细胞上表达,故lbat及双重asbt/lbat抑制剂物质需要在血液中具有至少一定生物利用度及游离分数。因为lbat抑制剂化合物仅需要自肠道存活至肝脏,所以预期此类化合物的相对低的全身暴露将为足够的,从而使身体其余部分中任何副作用的潜在风险降至最低。预期lbat及asbt的抑制将至少在降低肝内胆汁酸浓度方面具有累加效应。亦预期双重asbt/lbat抑制剂可能够降低胆汁酸含量而不诱发腹泻,有时亦在asbt抑制剂下观测到。
[0298]
预期具有高lbat抑制效力及足够生物利用度的化合物特别用于治疗肝炎。预期具有双重asbt/lbat抑制效力及足够生物利用度的化合物特别用于治疗非酒精性脂肪性肝炎(nash)。
[0299]
nash为一种常见且严重的慢性肝病,类似于酒精性肝病,但发生在少喝酒或不喝酒的人中。在nash患者中,肝脏中的脂肪堆积,称为非酒精性脂肪肝病(nafld)或脂肪变性,及诸如高ldl胆固醇及胰岛素抗性的其他因素诱发肝脏中的慢性炎症,且可能导致组织进行性瘢痕形成,称为纤维化及肝硬化,最终导致肝衰竭及死亡。已发现nash患者在空腹条件(nash增加2.2至2.4倍)及所有餐后时间点(nash增加1.7至2.2倍)下的总血清胆汁酸浓度显著高于健康受试者。这些为牛磺酸缀合及甘氨酸缀合的初级及次级胆汁酸增加所驱动的。nash患者在其空腹及餐后胆汁酸概况中表现出较大的可变性。这些结果表明,nash患者在空腹及餐后更高地暴露于胆汁酸,包括更多疏水性及细胞毒性次级种类。增加的胆汁酸暴露可能涉及肝损伤以及nafld及nash的发病机制(ferslew等人,dig dis sci.2015,第60卷,第3318-3328页)。因此,asbt及/或lbat抑制可能有益于nash的治疗。
[0300]
nafld的特征在于肝脏脂肪变性而没有肝脏脂肪变性的继发性原因,包括过量饮酒、其他已知肝病或长期使用致脂(steatogenic)药物(chalasani等人,hepatology 2018,第67(1)卷,第328-357页)。nafld可分类为非酒精性脂肪肝(nafl)及非酒精性脂肪性肝炎(nash)。根据chalasani等人,nafl定义为存在≥5%肝脏脂肪变性而没有呈肝细胞膨胀形式的肝细胞损伤的证据。nash定义为存在≥5%肝脏脂肪变性及肝细胞损伤(例如膨胀)的炎症,伴有或不伴有任何肝纤维化。nash亦通常与肝脏炎症及肝纤维化相关,其可进展为肝硬化、末期肝病及肝细胞癌。虽然肝纤维化并非总是存在于nash中,但纤维化(当存在时)的严重程度可能与长期结果有关。
[0301]
存在许多方法用于评定及评估受试者是否患有nafld,若如此,则评定及评估疾病的严重程度,包括区分nafld为nafl或nash。在一些实施方案中,可使用nas评定nafld的严重程度。在一些实施方案中,可使用nas评定nafld的治疗。在一些实施方案中,可如kleiner等人,hepatology.2005,41(6):1313-1321中所述确定nas,其以全文引用的方式并入本文中。关于改编自kleiner的简化nas方案,参见例如表6。
[0302]
表6.具有纤维化分期的nafld活动评分(nas)的实例
[0303][0304]
在一些实施方案中,nas是非侵入性地确定的,例如,如美国申请公开号2018/0140219中所述,其以全文引用的方式并入本文中。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐之前,确定来自受试者的样品的nas。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐的时间段期间或之后确定nas。在一些实施方案中,与给药式(i)化合物或其药学上可接受的盐之前相比,在给药式(i)化合物或其药学上可接受的盐的时间段期间或之后的nas评分较低指示nafld(例如nash)的治疗。举例而言,nas降低1、2、3、4、5、6或7指示nafld(例如nash)的治疗。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐后,nas为7或更小。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐的时间段期间,nas为5或更小、4或更小、3或更小或2或更小。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐的时间段期间,nas为7或更小。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐的时间段期间,nas为5或更小、4或更小、3或更小或2或更小。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐的时间段之后,nas为7或更小。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐的时间段之后,nas为5或更小、4或更小、3或更小或2或更小。
[0305]
评定及评估受试者的nash的其他方法包括确定肝脏脂肪变性(例如肝脏中的脂肪堆积);肝脏炎症;指示肝损伤、肝脏炎症、肝纤维化及/或肝硬化中的一或多者的生物标志物(例如血清标志物及组)中的一或多者。nash的生理指标的其他实例可包括肝脏形态、肝脏硬度及受试者肝脏的大小或重量。
[0306]
在一些实施方案中,受试者的nash经由肝脏脂肪的堆积及指示肝损伤的生物标志物的检测来证明。举例而言,升高的血清铁蛋白及低效价的血清自体抗体可为nash的常见
特性。
[0307]
在一些实施方案中,评定nash的方法包括磁共振成像、经由光谱分析或经由质子密度脂肪分数(mri-pdff)来量化脂肪变性、瞬时弹性成像肝静脉压力梯度(hpvg)、使用mre的肝脏硬度测量诊断显著肝纤维化及/或肝硬化,以及评定肝脏活组织检查的组织学特征。在一些实施方案中,磁共振成像用于检测脂肪变性肝炎(nash-mri)、肝纤维化(fibro-mri)及脂肪变性中的一或多者。参见例如美国申请公开号2016/146715及2005/0215882,其各自以全文引用的方式并入本文中。
[0308]
在一些实施方案中,nash的治疗可包括在给药一或多次剂量的式(i)化合物或其药学上可接受的盐后,受试者的与nash相关的一或多个症状减少;肝脏脂肪变性的量减少;nas降低;肝脏炎症减少;指示肝损伤、炎症、肝纤维化及/或肝硬化中的一或多者的生物标志物含量降低;及纤维化及/或肝硬化减少、纤维化及/或肝硬化没有进一步进展或纤维化及/或肝硬化进展减缓。
[0309]
在一些实施方案中,nash的治疗包含受试者的与nash相关的一或多个症状减少。示例性症状可包括肝脏扩大、疲劳、右上腹疼痛、腹部肿胀、皮肤表面正下方血管扩大、男性乳房增大、脾脏增大、红掌、黄疸及瘙痒症中的一或多者。在一些实施方案中,受试者无症状。在一些实施方案中,受试者的总体重不增加。在一些实施方案中,受试者的总体重降低。在一些实施方案中,受试者的身体质量指数(bmi)不增加。在一些实施方案中,受试者的身体质量指数(bmi)降低。在一些实施方案中,受试者的腰臀(wth)比不增加。在一些实施方案中,受试者的腰臀(wth)比降低。
[0310]
在一些实施方案中,nash的治疗可经由测量肝脏脂肪变性来评定。在一些实施方案中,nash的治疗包含在给药如本文所述的式(i)化合物或其药学上可接受的盐后肝脏脂肪变性减少。在一些实施方案中,肝脏脂肪变性经由选自以下的一或多种方法来确定:超声波检查术、计算机断层扫描(ct)、磁共振成像、磁共振光谱分析(mrs)、磁共振弹性成像(mre)、瞬时弹性成像(te)(例如)、测量肝脏大小或重量或经由肝脏活组织检查(参见例如di lascio等人,ultrasound med biol.2018,第44(8)卷,第1585-1596页;lv等人,j clin transl hepatol.2018,第6(2)卷,第217-221页;reeder等人,j magn reson imaging.2011,第34(4)卷,spcone;及de l
é
dinghen v等人,j gastroenterol hepatol.2016,第31(4)卷,第848-855页,其各自以全文引用的方式并入本文中)。经诊断患有nash的受试者可具有大于约5%肝脏脂肪变性,例如大于约5%至约25%、约25%至约45%、约45%至约65%或大于约65%肝脏脂肪变性。在一些实施方案中,具有大于约5%至约33%肝脏脂肪变性的受试者具有1期肝脏脂肪变性,具有约33%至约66%肝脏脂肪变性的受试者具有2期肝脏脂肪变性,且具有大于约66%肝脏脂肪变性的受试者具有3期肝脏脂肪变性。
[0311]
在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐之前测定肝脏脂肪变性的量。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐的时间段期间或之后测定肝脏脂肪变性的量。在一些实施方案中,与在给药式(i)化合物或其药学上可接受的盐之前相比,在给药式(i)化合物或其药学上可接受的盐的时间段期间或之后,肝脏脂肪变性的量减少指示nash的治疗。举例而言,肝脏脂肪变性的量减少约1%至约50%、约25%至约75%或约50%至约100%指示nash的治疗。在一些实施方案中,肝脏脂肪变性的量
减少约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%或约95%指示nash的治疗。
[0312]
在一些实施方案中,肝脏炎症的存在经由选自以下的一或多种方法来确定:指示肝脏炎症的生物标志物及来自受试者的肝脏活组织检查样品。在一些实施方案中,肝脏炎症的严重程度是由来自受试者的肝脏活组织检查样品来确定。举例而言,肝脏活组织检查样品中的肝脏炎症可如kleiner等人,hepatology 2005,第41(6)卷,第1313-1321页及brunt等人,am jgastroenterol 1999,第94卷,第2467-2474页中所述来评定,其各自特此以全文引用的方式并入。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐之前确定肝脏炎症的严重程度。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐的时间段期间或之后确定肝脏炎症的严重程度。在一些实施方案中,与在给药式(i)化合物或其药学上可接受的盐之前相比,在给药式(i)化合物或其药学上可接受的盐的时间段期间或之后,肝脏炎症的严重程度降低指示nash的治疗。举例而言,肝脏炎症的严重程度降低约1%至约50%、约25%至约75%或约50%至约100%指示nash的治疗。在一些实施方案中,肝脏炎症的严重程度降低约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%或约95%指示nash的治疗。
[0313]
在一些实施方案中,nash的治疗包含纤维化及/或肝硬化的治疗,例如纤维化的严重程度降低、纤维化及/或肝硬化没有进一步进展或纤维化及/或肝硬化的进展减缓。在一些实施方案中,纤维化及/或肝硬化的存在经由选自以下的一或多种方法来确定:瞬时弹性成像(例如)、肝脏纤维化的非侵入性标志物及肝脏活组织检查的组织学特征。在一些实施方案中,纤维化的严重程度(例如分期)经由选自以下的一或多种方法来确定:瞬时弹性成像(例如)、纤维化评分系统、肝脏纤维化的生物标志物(例如非侵入性生物标志物)及肝静脉压力梯度(hvpg)。纤维化评分系统的非限制性实例包括nafld纤维化评分系统(参见例如angulo等人,hepatology2007,第45(4)卷,第846-54页),brunt等人,am.j.gastroenterol.1999,第94卷,第2467-2474页中的纤维化评分系统,kleiner等人,hepatology 2005,第41(6)卷,第1313-1321页中的纤维化评分系统及ishak纤维化评分系统(参见ishak等人,j.hepatol.1995,第22卷,第696-699页),其各自的内容以全文引用的方式并入本文中。
[0314]
在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐之前确定纤维化的严重程度。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐的时间段期间或之后确定纤维化的严重程度。在一些实施方案中,与在给药式(i)化合物或其药学上可接受的盐之前相比,在给药式(i)化合物或其药学上可接受的盐的时间段期间或之后,纤维化的严重程度降低指示nash的治疗。在一些实施方案中,纤维化的严重程度降低、纤维化及/或肝硬化没有进一步进展或纤维化及/或肝硬化的进展减缓指示nash的治疗。在一些实施方案中,使用评分系统,诸如本文所述的纤维化评分系统中的任一者来确定纤维化的严重程度,例如,评分可指示纤维化的分期,例如0期(无纤维化)、1期、2期、3期及4期(肝硬化)(参见例如kleiner等人)。在一些实施方案中,纤维化分期的降低为纤维化严重程度的降低。举例而言,1、2、3或4期的降低为纤维化严重程度的降低。在一些实施方案中,分期的降
低,例如自4期至3期、自4期至2期、自4期至1期、自4期至0期、自3期至2期、自3期至1期、自3期至0期、自2期至1期、自2期至0期或自1期至0期指示nash的治疗。在一些实施方案中,与在给药式(i)化合物或其药学上可接受的盐之前相比,在给药式(i)化合物或其药学上可接受的盐后,纤维化的分期自4期至3期、自4期至2期、自4期至1期、自4期至0期、自3期至2期、自3期至1期、自3期至0期、自2期至1期、自2期至0期或自1期至0期降低。在一些实施方案中,与在给药式(i)化合物或其药学上可接受的盐之前相比,在给药式(i)化合物或其药学上可接受的盐的时间段期间,纤维化的分期自4期至3期、自4期至2期、自4期至1期、自4期至0期、自3期至2期、自3期至1期、自3期至0期、自2期至1期、自2期至0期或自1期至0期降低。在一些实施方案中,与在给药式(i)化合物或其药学上可接受的盐之前相比,在给药式(i)化合物或其药学上可接受的盐的时间段之后,纤维化的分期自4期至3期、自4期至2期、自4期至1期、自4期至0期、自3期至2期、自3期至1期、自3期至0期、自2期至1期、自2期至0期或自1期至0期降低。
[0315]
在一些实施方案中,nash的存在经由指示肝损伤、炎症、肝纤维化及/或肝硬化中的一或多者的一或多种生物标志物或其评分系统来确定。在一些实施方案中,nash的严重程度经由指示肝损伤、炎症、肝纤维化及/或肝硬化中的一或多者的一或多种生物标志物或其评分系统来确定。生物标志物的含量可经由例如测量、定量及监测编码生物标志物的基因或mrna的表达量及/或生物标志物的肽或蛋白质来测定。指示肝损伤、炎症、肝纤维化及/或肝硬化中的一或多者的生物标志物及/或其评分系统的非限制性实例包括天冬氨酸转氨酶(ast)与血小板比率指数(apri);天冬氨酸转氨酶(ast)与,.丙氨酸转氨酶(alt)比率(aar);fib-4评分,其基于apri、丙氨酸转氨酶(alt)含量及受试者年龄(参见例如mcpherson等人,gut 2010,第59(9)卷,第1265-9页,其以全文引用的方式并入本文中);透明质酸;促炎细胞因子;与受试者的年龄及性别相结合的一组由α2-巨球蛋白、结合珠蛋白、载脂蛋白a1、胆红素、γ谷氨酰基转肽酶(ggt)组成的生物标志物,以产生肝脏中纤维化及坏死性炎症活动的量度(例如),与受试者的年龄及性别相结合的一组由胆红素、γ-谷氨酰基转移酶、透明质酸、α2-巨球蛋白组成的生物标志物(例如参见例如adams等人,clin.chem.2005,第51(10)卷,第1867-1873页),及一组由金属蛋白酶-1的组织抑制剂、透明质酸及α2-巨球蛋白组成的生物标志物(例如);一组由金属蛋白酶1的组织抑制剂(timp-1)、iii型原胶原的氨基端前肽(piiinp)及透明质酸(ha)组成的生物标志物(例如增强型肝纤维化(elf)评分,参见例如lichtinghagen r等人,j hepatol.2013年8月;59(2):236-42,其以全文引用的方式并入本文中)。在一些实施方案中,纤维化的存在经由fib-4评分,与受试者的年龄及性别相结合的一组由α2-巨球蛋白、结合珠蛋白、载脂蛋白a1、胆红素、γ谷氨酰基转肽酶(ggt)组成的生物标志物,以产生肝脏中纤维化及坏死性炎症活动的量度(例如),与受试者的年龄及性别相结合的一组由胆红素、γ-谷氨酰基转移酶、透明质酸、α2-巨球蛋白组成的生物标志物(例如参见例如adams等人,clin.chem.2005,第51(10)卷,第1867-1873页),及一组由金属蛋白酶-1的组织抑制剂、透明质酸及α2-巨球蛋白组成的生物标志物(例如);及一组由金属蛋白酶1的组织抑制剂(timp-1)、iii型原胶原的氨基端前肽(piiinp)及透明质酸
(ha)组成的生物标志物(例如增强型肝纤维化(elf)评分)中的一或多者来确定。
[0316]
在一些实施方案中,天冬氨酸转氨酶(ast)的含量不升高。在一些实施方案中,天冬氨酸转氨酶(ast)的含量降低。在一些实施方案中,丙氨酸转氨酶(alt)的含量不升高。在一些实施方案中,丙氨酸转氨酶(alt)的含量降低。在一些实施方案中,酶的“含量”是指酶的浓度,例如在血液中。举例而言,ast或alt的含量可表示为u/l。
[0317]
在一些实施方案中,纤维化的严重程度经由fib-4评分,与受试者的年龄及性别相结合的一组由α2-巨球蛋白、结合珠蛋白、载脂蛋白a1、胆红素、γ谷氨酰基转肽酶(ggt)组成的生物标志物,以产生肝脏中纤维化及坏死性炎症活动的量度(例如),与受试者的年龄及性别相结合的一组由胆红素、γ-谷氨酰基转移酶、透明质酸、α2-巨球蛋白组成的生物标志物(例如参见例如adams等人,clin.chem.2005,第51(10)卷,第1867-1873页,其以全文引用的方式并入本文中),及一组由金属蛋白酶-1的组织抑制剂、透明质酸及α2-巨球蛋白组成的生物标志物(例如);及一组由金属蛋白酶1的组织抑制剂(timp-1)、iii型原胶原的氨基端前肽(piiinp)及透明质酸(ha)组成的生物标志物(例如增强型肝纤维化(elf)评分)中的一或多者来确定。
[0318]
在一些实施方案中,肝脏炎症经由肝脏炎症生物标志物(例如促炎细胞因子)的含量来确定。指示肝脏炎症的生物标志物的非限制性实例包括白介素-(il)6、白介素-(il)1β、肿瘤坏死因子(tnf)-α、转化生长因子(tgf)-β、单核细胞趋化蛋白(mcp)-1、c反应蛋白(crp)、pai-1及胶原蛋白亚型诸如col1a1、col1a2及col4a1(参见例如neuman等人,can.j.gastroenterol.hepatol.2014,第28(11)卷,第607-618页及美国专利第9,872,844号,其各自以全文引用的方式并入本文中)。肝脏炎症亦可经由巨噬细胞浸润的变化,例如测量cd68表达量的变化来评定。在一些实施方案中,肝脏炎症可经由测量或监测白介素-(il)6、白介素-(il)1β、肿瘤坏死因子(tnf)-α、转化生长因子(tgf)-β、单核细胞趋化蛋白(mcp)-1及c反应蛋白(crp)中的一或多者的血清含量或循环含量来确定。
[0319]
在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐之前,测定来自受试者的样品的指示肝损伤、炎症、肝纤维化及/或肝硬化中的一或多者的一或多种生物标志物的含量。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐的时间段期间或之后,测定指示肝损伤、炎症、肝纤维化及/或肝硬化中的一或多者的一或多种生物标志物的含量。在一些实施方案中,与在给药式(i)化合物或其药学上可接受的盐之前相比,在给药式(i)化合物或其药学上可接受的盐的时间段期间或之后,指示肝损伤、炎症、肝纤维化及/或肝硬化中的一或多者的一或多种生物标志物的含量降低指示nash的治疗。举例而言,指示肝损伤、炎症、肝纤维化及/或肝硬化中的一或多者的一或多种生物标志物的含量降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或至少约99%指示nash的治疗。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐后,指示肝损伤、炎症、肝纤维化及/或肝硬化中的一或多者的一或多种生物标志物的含量降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至
少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或至少约99%。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐的时间段期间,指示肝损伤、炎症、肝纤维化及/或肝硬化中的一或多者的一或多种生物标志物的含量降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或至少约99%。在一些实施方案中,在给药式(i)化合物或其药学上可接受的盐的时间段之后,指示肝损伤、炎症、肝纤维化及/或肝硬化中的一或多者的一或多种生物标志物的含量降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或至少约99%。
[0320]
在一些实施方案中,nash的治疗降低受试者的血清胆汁酸含量。在一些实施方案中,血清胆汁酸含量经由例如elisa酶分析或测量总胆汁酸的分析来测定,如danese等人,plos one.2017,第12(6)卷:e0179200中所述,其以全文引用的方式并入本文中。在一些实施方案中,血清胆汁酸含量可降低例如在给药式(i)化合物或其药学上可接受的盐之前的血清胆汁酸含量的10%至40%、20%至50%、30%至60%、40%至70%、50%至80%或大于90%。在一些实施方案中,nash为伴随胆汁淤积的nash。在胆汁淤积中,胆汁(包括胆汁酸)自肝脏的释放被阻塞。胆汁酸会导致肝细胞损伤(参见例如perez mj,briz o.world j.gastroenterol.2009,第15(14)卷,第1677-1689页),从而可能导致或增加纤维化(例如肝硬化)的进展及增加肝细胞癌的风险(参见例如sorrentino p等人,dig.dis.sci.2005,第50(6)卷,第1130-1135页及satapathy sk及sanyal aj.semin.liver dis.2015,第35(3)卷,第221-235页,其各自以全文引用的方式并入本文中)。在一些实施方案中,nash的治疗包括瘙痒症的治疗。在一些实施方案中,伴随胆汁淤积的nash的治疗包括瘙痒症的治疗。在一些实施方案中,患有伴随胆汁淤积的nash的受试者患有瘙痒症。
[0321]
nash的示例性生物标志物提供于表7中。
[0322]
表7.示例性nash生物标志物
[0323]
肝纤维化生物标志物
[0324]
天冬氨酸转氨酶(ast)与血小板比率指数(apri)
[0325]
天冬氨酸转氨酶(ast)与丙氨酸转氨酶(alt)比率(aar)
[0326]
fib-4评分1[0327]
透明质酸
[0328]
促炎细胞因子
[0329]
与受试者的年龄及性别相结合的一组,包括α2-巨球蛋白、结合珠蛋白、载脂蛋白a1、胆红素、γ谷氨酰基转肽酶(ggt),以产生肝脏中纤维化及坏死性炎症活动的量度(例如以产生肝脏中纤维化及坏死性炎症活动的量度(例如)
[0330]
与受试者的年龄及性别相结合的一组,包括胆红素、γ-谷氨酰基转移酶、透明质酸、α2-巨球蛋白(例如)
[0331]
包括金属蛋白酶-1的组织抑制剂、透明质酸及α2-巨球蛋白(例如)的一组
[0332]
包括金属蛋白酶1的组织抑制剂(timp-1)、iii型原胶原的氨基端前肽(piiinp)及透明质酸(ha)(例如增强型肝纤维化(elf)评分3)的一组
[0333]
肝脏炎症生物标志物
4,5
[0334]
白介素-(il)6
[0335]
白介素-(il)1β
[0336]
肿瘤坏死因子(tnf)-α
[0337]
转化生长因子(tgf)-β
[0338]
单核细胞趋化蛋白(mcp)-1
[0339]
c反应蛋白(crp)
[0340]
pai-1
[0341]
胶原蛋白亚型(例如col1a1、col1a2及col4a1)
[0342]
巨噬细胞浸润的变化(例如cd68表达量的变化)
[0343]
表7的参考文献
[0344]1mcpherson等人,gut.2010,第59(9)卷,第1265-1269页.
[0345]2adams等人,clin chem.2005,第51(10)卷,第1867-1873页.
[0346]3lichtinghagen等人,j hepatol.2013,第59(2)卷,第236-242页.
[0347]4neuman等人,can j gastroenterol hepatol.2014,第28(11)卷,第607-618页.
[0348]5美国专利号9,872,844
[0349]
一些式(i)化合物或其药学上可接受的盐可在血浆中显示出较高游离分数。在一些实施方案中,游离分数大于约0.2%,诸如大于约0.4%,诸如大于约0.6%,诸如大于约0.8%,诸如大于约1.0%,诸如大于约1.25%,诸如大于约1.5%,诸如大于约1.75%,诸如大于约2.0%,诸如大于约2.5%,诸如大于约3%,诸如大于约4%,诸如大于约5%,诸如大于约7.5%,诸如大于约10%或诸如大于约20%。
[0350]
一些式(i)化合物或其药学上可接受的盐可在尿液中被排出。在一些实施方案中,尿液中排出的化合物的分数大于约0.2%,诸如大于约0.4%,诸如大于约0.6%,诸如大于约0.8%,诸如大于约1.0%,诸如大于约2%,诸如大于约3%,诸如大于约5%,诸如大于约7.5%,诸如大于约10%,诸如大于约15%,诸如大于约20%,诸如大于约30%或诸如大于约50%。
[0351]
由肠道吸收之后,一些式(i)化合物或其药学上可接受的盐可经由肠肝循环进行循环。在一些实施方案中,经由肠肝循环进行循环的化合物的分数大于约0.1%,诸如大于约0.2%,诸如大于约0.3%,诸如大于约0.5%,诸如大于约1.0%,诸如大于约1.5%,诸如大于约2%,诸如大于约3%,诸如大于约5%,诸如大于约7%,诸如大于约10%,诸如大于约15%,诸如大于约20%,诸如大于约30%或诸如大于约50%。
[0352]
一些式(i)化合物或其药学上可接受的盐可引起肾脏分泌胆盐。在一些实施方案中,肾脏途径所分泌的循环胆汁酸的分数大于约1%,诸如大于约2%,诸如大于约5%,诸如大于约7%,诸如大于约10%,诸如大于约15%,诸如大于约20%或诸如大于约25%。
[0353]
一些式(i)化合物或其药学上可接受的盐可显示出经改善或最佳渗透率。渗透率
可在caco2细胞中测量,且值是以表观渗透率(papp)值给出,单位为cm/秒。在一些实施方案中,渗透率大于至少约0.1
×
10-6
cm/秒,诸如大于约0.2
×
10-6
cm/秒,诸如大于约0.4
×
10-6
cm/秒,诸如大于约0.7
×
10-6
cm/秒,诸如大于约1.0
×
10-6
cm/秒,诸如大于约2
×
10-6
cm/秒,诸如大于约3
×
10-6
cm/秒,诸如大于约5
×
10-6
cm/秒,诸如大于约7
×
10-6
cm/秒,诸如大于约10
×
10-6
cm/秒,诸如大于约15
×
10-6
cm/秒。
[0354]
一些式(i)化合物或其药学上可接受的盐可显示出经改善或最佳生物利用度。在一些实施方案中,口服生物利用度大于约5%,诸如大于约7%,诸如大于约10%,诸如大于约15%,诸如大于约20%,诸如大于约30%,诸如大于约40%,诸如大于约50%,诸如大于约60%,诸如大于约70%或诸如大于约80%。在其他实施方案中,口服生物利用度在约10%与约90%之间,诸如在约20%与约80%之间,诸如在约30%与约70%之间或诸如在约40%与约60%之间。
[0355]
一些式(i)化合物或其药学上可接受的盐可为肾脏中相关转运蛋白的底物。
[0356]
一些式(i)化合物或其药学上可接受的盐可在肠道、肝脏及血清中产生不会引起不利胃肠道作用的胆汁酸浓度。
[0357]
一些式(i)化合物或其药学上可接受的盐可降低肝脏中的胆汁酸浓度而不会引起诸如腹泻的胃肠道疾病。
[0358]
如本文所用,术语“治疗(treatment/treat/treating)”是指逆转、缓解如本文所述的疾病或障碍或其一或多种症状,延迟其发作或抑制其进展。在一些实施方案中,可在已出现一或多种症状之后给药治疗。在其他实施方案中,可在不存在症状的情况下给药治疗。举例而言,可在症状发作之前向易感受试者给药治疗(例如,根据症状病史及/或根据遗传性或其他易感性因素)。亦可在症状已消退之后继续治疗,例如以预防或延迟其复发。
[0359]
本发明化合物的适合的药学上可接受的盐为例如本发明化合物的碱加成盐,其具有足够的酸性,诸如碱金属盐(例如钠或钾盐)、碱土金属盐(例如钙或镁盐)、铵盐或与提供生理学上可接受的阳离子的有机碱的盐,例如与甲胺、二甲胺、三甲胺、哌啶、吗啉或三-(2-羟乙基)胺的盐。
[0360]
一些式(i)化合物或其药学上可接受的盐可具有手性中心及/或几何异构中心(e-及z-异构体)。应理解,本发明涵盖具有asbt及/或lbat抑制活性的所有此类光学异构体、非对映异构体及几何异构体。本发明亦涵盖具有asbt及/或lbat抑制活性的式(i)化合物或其药学上可接受的盐的任何及所有互变异构形式。某些式(i)化合物或其药学上可接受的盐可以非溶剂化以及溶剂化形式存在,诸如水合形式。应理解,本发明涵盖具有asbt及/或lbat抑制活性的所有此类溶剂化形式。
[0361]
在另一方面中,本发明涉及一种药物组合物,其包含治疗有效量的式(i)化合物或其药学上可接受的盐及一或多种药学上可接受的赋形剂。赋形剂可例如包括填充剂、粘合剂、崩解剂、助流剂及润滑剂。一般而言,药物组合物可使用常规赋形剂以常规方式制备。
[0362]
适合的填充剂的实例包括但不限于二水合磷酸二钙、硫酸钙、乳糖(诸如单水合乳糖)、蔗糖、甘露糖醇、山梨糖醇、纤维素、微晶纤维素、干淀粉、水解淀粉及预胶化淀粉。在某些实施方案中,填充剂为甘露糖醇及/或微晶纤维素。
[0363]
适合的粘合剂的实例包括但不限于淀粉、预胶化淀粉、明胶、糖(诸如蔗糖、葡萄糖、右旋糖、乳糖及山梨糖醇)、聚乙二醇、蜡、天然及合成胶(诸如阿拉伯胶及黄蓍胶)、海藻
酸钠、纤维素衍生物(诸如羟丙基甲基纤维素(或羟丙甲纤维素)、羟丙基纤维素及乙基纤维素)及合成聚合物(诸如丙烯酸及甲基丙烯酸共聚物、甲基丙烯酸共聚物、甲基丙烯酸甲酯共聚物、甲基丙烯酸氨基烷基酯共聚物、聚丙烯酸/聚甲基丙烯酸共聚物及聚乙烯吡咯烷酮(聚维酮))。在某些实施方案中,粘合剂为羟丙基甲基纤维素(羟丙甲纤维素)。
[0364]
适合的崩解剂的实例包括但不限于干淀粉、改性淀粉(诸如(部分)预胶化淀粉、羟基乙酸淀粉钠及羧甲基淀粉钠)、海藻酸、纤维素衍生物(诸如羧甲基纤维素钠、羟丙基纤维素及低取代的羟丙基纤维素(l-hpc))及交联聚合物(诸如羧甲基纤维素、交联羧甲基纤维素钠、羧甲基纤维素钙及交联pvp(交联聚维酮))。在某些实施方案中,崩解剂为交联羧甲基纤维素钠。
[0365]
适合的助流剂及润滑剂的实例包括但不限于滑石、硬脂酸镁、硬脂酸钙、硬脂酸、山嵛酸甘油酯、胶体二氧化硅、水性二氧化硅、合成硅酸镁、细粒二氧化硅、淀粉、月桂基硫酸钠、硼酸、氧化镁、蜡(诸如巴西棕榈蜡)、氢化油、聚乙二醇、苯甲酸钠、聚乙二醇及矿物油。在某些实施方案中,助流剂或润滑剂为硬脂酸镁或胶体二氧化硅。
[0366]
药物组合物可常规地包覆有一或多个包衣层。亦涵盖用于延迟或靶向释放式(i)化合物或其药学上可接受的盐的肠溶包衣层或包衣层。包衣层可包含一或多种包衣剂,且可视情况包含增塑剂及/或颜料(或着色剂)。
[0367]
适合的包衣剂的实例包括但不限于基于纤维素的聚合物(诸如乙基纤维素、羟丙基甲基纤维素(或羟丙甲纤维素)、羟丙基纤维素、邻苯二甲酸乙酸纤维素、丁二酸乙酸纤维素、丁二酸乙酸羟丙基甲基纤维素及邻苯二甲酸羟丙基甲基纤维素)、基于乙烯基的聚合物(诸如聚乙烯醇)及基于丙烯酸及其衍生物的聚合物(诸如丙烯酸及甲基丙烯酸共聚物、甲基丙烯酸共聚物、甲基丙烯酸甲酯共聚物、甲基丙烯酸氨基烷基酯共聚物、聚丙烯酸/聚甲基丙烯酸共聚物)。在某些实施方案中,包衣剂为羟丙基甲基纤维素。在其他实施方案中,包衣剂为聚乙烯醇。
[0368]
适合的增塑剂的实例包括但不限于柠檬酸三乙酯、三乙酸甘油酯、柠檬酸三丁酯、邻苯二甲酸二乙酯、柠檬酸乙酰基三丁酯、邻苯二甲酸二丁酯、癸二酸二丁酯及聚乙二醇。在某些实施方案中,增塑剂为聚乙二醇。
[0369]
适合的颜料的实例包括但不限于二氧化钛、氧化铁(诸如黄色、棕色、红色或黑色氧化铁)及硫酸钡。
[0370]
药物组合物可呈适用于口服给药、肠胃外注射(包括静脉内、皮下、肌肉内及血管内注射)、局部给药或直肠给药的形式。在一优选实施方案中,药物组合物呈适用于口服给药的形式,诸如片剂或胶囊。
[0371]
治疗性或预防性治疗所需的剂量将取决于给药途径、疾病的严重程度、患者的年龄及体重以及当确定适于特定患者的方案及剂量水平时主治医师通常考虑的其他因素。
[0372]
待给药的化合物的量对于所治疗的患者为不同的,且可在每天每千克体重约1μg至约50mg之间变化。诸如片剂或胶囊的单位剂型将通常含有约1至约250mg活性成分,诸如约1至约100mg,或诸如约1至约50mg,或诸如约1至约20mg,例如约2.5mg,或约5mg,或约10mg,或约15mg。日剂量可以单次剂量形式给药或分成一个、两个、三个或更多个单位剂量。口服给药的胆汁酸调节剂的日剂量优选在约0.1至约250mg内,更优选在约1至约100mg内,诸如在约1至约5mg内,诸如在约1至约10mg内,诸如在约1至约15mg内,或诸如在约1至约
20mg内。
[0373]
在另一方面中,本发明涉及一种用作药物的式(i)化合物或其药学上可接受的盐。本发明还涉及式(i)化合物或其药学上可接受的盐作为药物的用途。
[0374]
在另一方面中,本发明涉及式(i)化合物或其药学上可接受的盐,其用于治疗或预防本文中所列举的任何疾病。本发明还涉及式(i)化合物或其药学上可接受的盐在制造用于治疗或预防本文中所列举的任何疾病的药物中的用途。本发明还涉及治疗或预防受试者(诸如人类)的本文中所列举的任何疾病的方法,其包含向需要此类治疗或预防的受试者给药治疗有效量的式(i)化合物或其药学上可接受的盐。
[0375]
组合疗法
[0376]
在本发明的一个方面中,式(i)化合物或其药学上可接受的盐与至少一种其他治疗活性剂,诸如与一种、两种、三种或更多种其他治疗活性剂组合给药。式(i)化合物或其药学上可接受的盐及至少一种其他治疗活性剂可同时、依次或分开给药。适合与式(i)化合物组合的治疗活性剂包括但不限于用于治疗任何前述病症、障碍及疾病的已知活性剂。
[0377]
在一个实施方案中,式(i)化合物或其药学上可接受的盐与另一种asbt抑制剂组合给药。适合asbt抑制剂公开于wo 93/16055、wo 94/18183、wo 94/18184、wo 96/05188、wo 96/08484、wo 96/16051、wo 97/33882、wo 98/03818、wo 98/07449、wo 98/40375、wo 99/35135、wo 99/64409、wo 99/64410、wo 00/47568、wo 00/61568、wo 00/38725、wo 00/38726、wo 00/38727、wo 00/38728、wo 00/38729、wo 01/66533、wo 01/68096、wo 02/32428、wo 02/50051、wo 03/020710、wo 03/022286、wo 03/022825、wo 03/022830、wo 03/061663、wo 03/091232、wo 03/106482、wo 2004/006899、wo 2004/076430、wo 2007/009655、wo 2007/009656、wo 2011/137135、wo 2019/234077、wo 2020/161216、wo 2020/161217、de 19825804、ep 864582、ep 489423、ep 549967、ep 573848、ep 624593、ep 624594、ep 624595、ep 624596、ep 0864582、ep 1173205、ep 1535913及ep 3210977中,其皆以全文引用的方式并入本文中。
[0378]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与胆汁酸结合剂(亦称为胆汁酸螯合剂或树脂),诸如考来维仑(colesevelam)、消胆胺(cholestyramine)或降胆宁(cholestipol)组合给药。在此类组合的一优选实施方案中,胆汁酸结合剂经配制用于结肠释放。此类制剂的实例公开于例如wo 2017/138877、wo 2017/138878、wo 2019/032026及wo 2019/032027中,其均以全文引用的方式并入本文中。
[0379]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与dpp-iv抑制剂,包括列汀类(gliptins),诸如西他列汀(sitagliptin)、维格列汀(vildagliptin)、沙格列汀(saxagliptin)、利格列汀(linagliptin)、吉格列汀(gemigliptin)、阿拉格列汀(anagliptin)、替格列汀(teneligliptin)、阿格列汀(alogliptin)、曲格列汀(trelagliptin)、奥格列汀(omarigliptin)、依格列汀(evogliptin)、戈塞列汀(gosogliptin)及多格列汀(dutogliptin)或其药学上可接受的盐组合给药。
[0380]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与hmg coa还原酶抑制剂,诸如氟伐他汀(fluvastatin)、洛伐他汀(lovastatin)、普伐他汀(pravastatin)、辛伐他汀(simvastatin)、阿托伐他汀(atorvastatin)、匹伐他汀(pitavastatin)、西立伐他汀(cerivastatin)、美伐他汀(mevastatin)、罗苏伐他汀(rosuvastatin)、贝伐他汀
(bervastatin)或达伐他汀(dalvastatin)或其药学上可接受的盐组合给药。
[0381]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与胆固醇吸收抑制剂,诸如依泽替米贝(ezetimibe)或其药学上可接受的盐组合给药。
[0382]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与pparα激动剂,包括贝特类(fibrates),诸如氯贝特(clofibrate)、苯扎贝特(bezafibrate)、环丙贝特(ciprofibrate)、可琳贝特(clinofribrate)、氯贝胺(clofibride)、非诺贝特(fenofibrate)、吉非罗齐(gemfibrozil)、氯烟贝特(ronifibrate)及双贝特(simfribrate)或其药学上可接受的盐组合给药。
[0383]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与pparγ激动剂,包括噻唑烷二酮类(thiazolidinediones),诸如吡格列酮(pioglitazone)、罗格列酮(rosiglitazone)及洛贝格列酮(lobeglitazone)或其药学上可接受的盐组合给药。
[0384]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与双重pparα/γ激动剂,包括格列扎类(glitazars),诸如沙格列扎(saroglitazar)、阿格列扎(aleglitazar)、莫格列扎(muraglitazar)或替格列扎(tesaglitazar)或其药学上可接受的盐组合给药。
[0385]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与双重pparα/δ激动剂诸如埃拉贝诺(elafibranor)组合给药。
[0386]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与泛ppar激动剂(亦即对以下所有亚型具有活性的ppar激动剂:α、γ及δ),诸如iva337组合给药。
[0387]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与法尼醇x受体(fxr)调节剂,包括fxr激动剂,诸如咖啡醇(cafestol)、鹅去氧胆酸、6α-乙基-鹅去氧胆酸(奥贝胆酸(obeticholic acid;int-747)、非色拉明(fexaramine)、曲匹氟索(tropifexor)、希罗氟索(cilofexor)及met409组合给药。
[0388]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与tgr5受体调节剂,包括tgr5激动剂,诸如6α-乙基-23(s)-甲基胆酸(int-777)组合给药。
[0389]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与双重fxr/tgr5激动剂诸如int-767组合给药。
[0390]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与熊去氧胆酸(udca)组合给药。在另一个实施方案中,式(i)化合物或其药学上可接受的盐与去甲熊去氧胆酸(nor-udca)组合给药。
[0391]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与fgf19调节剂,诸如ngm282组合给药。
[0392]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与fgf21激动剂,诸如bms-986036组合给药。
[0393]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与整合素抑制剂,诸如pln-74809及pln-1474组合给药。
[0394]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与ccr2/ccr5抑制剂,诸如森尼韦若(cenicriviroc)组合给药。
[0395]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与胱天蛋白酶抑制剂,诸如恩利卡生(emricasan)组合给药。
[0396]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与半乳糖凝集素-3抑制剂,诸如gr-md-02组合给药。
[0397]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与硬脂酰基-coa去饱和酶(scd)抑制剂,诸如阿雷美罗(aramchol)(二十烷基酰氨基胆酸)组合给药。
[0398]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与细胞凋亡信号调节激酶1(ask1)抑制剂,诸如司隆色替(selonsertib)组合给药。
[0399]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与loxl2抑制剂,诸如simtuzumab组合给药。
[0400]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与acc抑制剂,诸如gs-0976组合给药。
[0401]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与甲状腺激素受体-β激动剂,诸如mgl3196组合给药。
[0402]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与glp-1激动剂诸如利拉鲁肽(liraglutide)组合给药。
[0403]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与双重胰高血糖素样肽及胰高血糖素受体激动剂,诸如sar425899组合给药。
[0404]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与线粒体丙酮酸载体抑制剂,诸如msdc-0602k组合给药。
[0405]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与抗氧化剂,诸如维生素e组合给药。
[0406]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与sglt1抑制剂、sglt2抑制剂或双重sglt1及sglt2抑制剂组合给药。此类化合物的实例为达格列净(dapagliflozin)、索格列净(sotagliflozin)、卡格列净(canagliflozin)、恩格列净(empagliflozin)、lik066及sgl5213。
[0407]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与二酰基甘油o-酰基转移酶2(dgat2)抑制剂,诸如dgat2rx及pf-06865571组合给药。
[0408]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与脂肪酸合酶(fasn)抑制剂,诸如tvb-2640组合给药。
[0409]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与amp活化蛋白激酶(ampk)活化剂,诸如pxl-770组合给药。
[0410]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与糖皮质激素受体拮抗剂(gr)、盐皮质激素受体拮抗剂(mr)或双重gr/mr拮抗剂组合给药。此类化合物的实例为mt-3995及cort-118335。
[0411]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与大麻素受体1(cb1)拮抗剂,诸如im102组合给药。
[0412]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与klothoβ(klb)及纤维母细胞生长因子受体(fgfr)活化剂,诸如mk-3655(先前称为ngm-313)组合给药。
[0413]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与趋化因子(c-c基序)配体24(ccl24)抑制剂,诸如cm101组合给药。
[0414]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与a3拮抗剂,诸如pbf-1650组合给药。
[0415]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与p2x7受体拮抗剂,诸如sgm 1019组合给药。
[0416]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与p2y13受体激动剂,诸如cer-209组合给药。
[0417]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与硫酸化氧甾醇,诸如dur-928组合给药。
[0418]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与白三烯d4(ltd4)受体拮抗剂,诸如mn-001组合给药。
[0419]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与1型自然杀伤t细胞(nkt1)抑制剂,诸如gri-0621组合给药。
[0420]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与抗脂多醣(lps)化合物,诸如imm-124e组合给药。
[0421]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与vap1抑制剂,诸如bi1467335组合给药。
[0422]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与a3腺苷受体激动剂,诸如cf-102组合给药。
[0423]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与sirt-1活化剂,诸如ns-20组合给药。
[0424]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与烟酸受体1激动剂,诸如ari-3037mo组合给药。
[0425]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与tlr4拮抗剂,诸如jkb-121组合给药。
[0426]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与己酮糖激酶抑制剂,诸如pf-06835919组合给药。
[0427]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与脂联素受体激动剂,诸如adp-335组合给药。
[0428]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与自分泌运动因子抑制剂,诸如pat-505及pf8380组合给药。
[0429]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与趋化因子(c-c基序)受体3(ccr3)拮抗剂,诸如柏替木单抗(bertilimumab)组合给药。
[0430]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与氯通道刺激剂,诸如科普斯酮(cobiprostone)及鲁比前列酮(lubiprostone)组合给药。
[0431]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与热休克蛋白47(hsp47)抑制剂,诸如nd-l02-s0201组合给药。
[0432]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与固醇调节元件结合蛋白(srebp)转录因子抑制剂,诸如cat-2003及mdv-4463组合给药。
[0433]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与双胍,诸如二甲双胍
(metformin)组合给药。
[0434]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与胰岛素组合给药。
[0435]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与糖原磷酸化酶抑制剂及/或葡萄糖-6-磷酸酶抑制剂组合给药。
[0436]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与磺酰脲,诸如格列吡嗪(glipizid)、格列本脲(glibenklamid)及格列美脲(glimepirid)组合给药。
[0437]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与美格列奈(meglitinide),诸如瑞格列奈(repaglinide)、那格列奈(nateglinide)及奥格替耐(ormiglitinide)组合给药。
[0438]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与葡糖苷酶抑制剂,诸如阿卡波糖(acarbose)或米格列醇(miglitol)组合给药。
[0439]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与角鲨烯合酶抑制剂,诸如tak-475组合给药。
[0440]
在另一个实施方案中,式(i)化合物或其药学上可接受的盐与ptpb1抑制剂,诸如特罗杜明(trodusquemine)、埃替他非(ertiprotafib)、jtt-551及克拉若明(claramine)组合给药。
[0441]
化合物的制备
[0442]
本发明的化合物可经由下文所述的方法制备为游离酸或其药学上可接受的盐。在整个以下对此类方法的描述中,应理解,在适当的情况下,将以有机合成领域的技术人员容易理解的方式将适合的保护基添加至各种反应物及中间体中,且随后自各种反应物及中间体移除。使用此类保护基的常规程序以及适合的保护基的实例例如描述于p.g.m wutz及t.w.greene的greene's protective groups in organic synthesis,第4版,john wiley&sons,hoboken,2006中。
[0443]
通用方法
[0444]
所用的所有溶剂均为分析级。常规使用市售无水溶剂进行反应。起始物质可购自商业来源或根据文献程序制备。室温是指20-25℃。溶剂混合物组成是以体积百分比或体积比给出。
[0445]
lcms:
[0446]
仪器名称:agilent 1290infinity ii。
[0447]
方法a:流动相:a:0.1%hcooh水溶液:acn(95:5),b:acn;流速:1.5ml/分钟;柱:zorbax xdb c-18(50
×
4.6mm,3.5μm)。
[0448]
方法b:流动相:a:10mm nh4hco3水溶液,b:acn;流速:1.2ml/分钟;柱:xbridge c8(50
×
4.6mm,3.5μm)。
[0449]
方法c:流动相:a:0.1%hcooh水溶液:acn(95:5),b:acn;流速:1.5ml/分钟;柱:atlantis dc18(50
×
4.6mm,5μm)。
[0450]
方法d:流动相:a:10mm nh4oac水溶液,b:acn;流速:1.2ml/分钟;柱:zorbax extend c18(50
×
4.6mm,5μm)。
[0451]
方法e:流动相:a:0.1%tfa水溶液:acn(95:5),b:0.1%tfa的acn溶液;流速:1.5ml/分钟;柱:xbridge c8(50
×
4.6mm,3.5μm)。
[0452]
uplc:
[0453]
仪器名称:waters acquity i class
[0454]
方法a:流动相:a:0.1%hcooh水溶液,b:0.1%hcooh的acn溶液;流速:0.8ml/分钟;柱:acquity uplc hss t3(2.1
×
50)mm;1.8μm。
[0455]
hplc:
[0456]
仪器名称:agilent 1260infinity ii系列仪器,如下,使用%与uv检测(maxplot)。
[0457]
方法a:流动相:a:10mm nh4hco3水溶液,b:acn;流速:1.0ml/分钟;柱:xbridge c8(50
×
4.6mm,3.5μm)。
[0458]
方法b:流动相:a:0.1%tfa水溶液,b:0.1%tfa的acn溶液;流速:2.0ml/分钟;柱:xbridge c8(50
×
4.6mm,3.5μm)。
[0459]
方法c:流动相:a:10mm nh4oac的milli-q水溶液,b:acn;流速:1.0ml/分钟;柱:phenomenex gemini c18(150
×
4.6mm,3.0μm)。
[0460]
方法d:流动相:a:0.1%tfa水溶液,b:acn;流速:1.0ml/分钟;柱:atlantis dc18(250
×
4.6mm,5.0μm)。
[0461]
手性hplc:
[0462]
仪器名称:agilent 1260infinity ii
[0463]
方法a:流动相:a:0.1%tfa/正己烷;b:乙醇,流速:1.0ml/分钟;柱:chiralpak ia(250
×
4.6mm,5.0μm)。
[0464]
手性sfc:
[0465]
仪器名称:pic sfc 10(分析型)
[0466]
co2与共溶剂之间的比率介于60:40与80:20之间
[0467]
方法a:流动相:0.5%异丙胺/ipa;流速:3ml/分钟;柱:ymc直链淀粉-sa(250
×
4.6mm,5μm)。
[0468]
方法b:流动相:0.5%异丙胺/ipa;流速:3ml/分钟;柱:chiralpak ad-h(250
×
4.6mm,5μm)。
[0469]
方法c:流动相:20mm氨/甲醇;流速:3ml/分钟;柱:ymc纤维素-sc(250
×
4.6mm,5μm)。
[0470]
方法d:流动相:甲醇;流速:3ml/分钟;柱:lux a1(250
×
4.6mm,5μm)。
[0471]
方法e:流动相:0.5%异丙胺/甲醇;流速:5ml/分钟;柱:lux c4。
[0472]
方法f:流动相:0.5%异丙胺/甲醇;流速:3ml/分钟;柱:ymc纤维素-sc。
[0473]
方法g:流动相:0.5%异丙胺/甲醇;流速:3ml/分钟;柱:lux a1。
[0474]
方法h:流动相:0.5%异丙胺/ipa;流速:3ml/分钟;柱:lux a1(250
×
4.6mm,5μm)。
[0475]
方法i:流动相:0.5%异丙胺/甲醇;流速:3ml/分钟;柱:手性ccs(250
×
4.6mm,5μm)。
[0476]
方法j:流动相:0.5%异丙胺/ipa;流速:5ml/分钟;柱:ymc纤维素-sc ad-h(250
×
4.6mm,5μm)。
[0477]
方法k:流动相:ipa;流速:3ml/分钟;柱:ymc纤维素-sc(250
×
4.6mm,5μm)。
[0478]
方法l:流动相:0.5%异丙胺/甲醇;流速:4ml/分钟;柱:ymc纤维素-sc(250
×
4.6mm,5μm)。
[0479]
方法m:流动相:甲醇;流速:3ml分钟;柱:ymc纤维素-sc ad-h(250
×
4.6mm,5μm)。
[0480]
制备型hplc:
[0481]
仪器名称:agilent 1290infinity ii
[0482]
方法a:流动相:a:0.1%tfa水溶液;流动相;b:0.1%tfa的acn溶液;流速:2.0ml/分钟;柱:x-bridge c8(50
×
4.6mm,3.5μm)。
[0483]
方法b:流动相:a:10mm nh4oac水溶液;b:acn;流速:35ml/分钟;柱:x select c18(30
×
150mm,5μm)。
[0484]
方法c:流动相:a:10mm nh4hco3水溶液;b:acn;流速:1.0ml/分钟;柱:xbridge c8(50
×
4.6mm,3.5μm)。
[0485]
方法d:流动相:a:0.1%hcooh水溶液;b:acn;流速:1.0ml/分钟;柱:x-select c18(30
×
150mm,5μm)。
[0486]
手性制备型sfc:
[0487]
仪器名称:pic sfc 100及psc sfc 400
[0488]
co2与共溶剂之间的比率介于60:40与80:20之间
[0489]
方法a:流动相:0.5%异丙胺/ipa;流速:3ml/分钟;柱:ymc直链淀粉-sa(250
×
30mm,5μm)。
[0490]
方法b:流动相:0.5%异丙胺/ipa;流速:3ml/分钟;柱:chiralpak ad-h(250
×
30mm,5μm)。
[0491]
方法c:流动相:20mm氨/甲醇;流速:3ml/分钟;柱:ymc纤维素-sc(250
×
30mm,5μm)。
[0492]
方法d:流动相:甲醇;流速:3ml/分钟;柱:手性ccs(250
×
30mm,5μm)。
[0493]
方法e:流动相:甲醇;流速:3ml/分钟;柱:lux a1(250
×
30mm,5μm)。
[0494]
方法f:流动相:0.5%异丙胺/ipa;流速:3ml/分钟;柱:lux a1(250
×
30mm,5μm)。
[0495]
方法g:流动相:0.5%异丙胺/甲醇;流速:3ml/分钟;柱:手性ccs(250
×
30mm,5μm)。
[0496]
方法h:流动相:0.5%异丙胺/ipa,流速:5ml/分钟;柱:ymc直链淀粉-sc(250
×
30mm,5μm)。
[0497]
手性制备型hplc:
[0498]
仪器名称:agilent 1260infinity ii
[0499]
方法a:流动相:a:0.1%tfa/正己烷;b:乙醇;流速:15ml/分钟;柱:chiralpak ia(250
×
19mm,5.0μm)。
[0500]
缩写
[0501]
acn
ꢀꢀꢀꢀ
乙腈
[0502]
dabco
ꢀꢀ
1,4-二氮杂双环[2.2.2]辛烷
[0503]
dcm
ꢀꢀꢀꢀ
二氯甲烷
[0504]
dma
ꢀꢀꢀꢀ
二甲基乙酰胺
[0505]
dmf
ꢀꢀꢀꢀ
二甲基甲酰胺
[0506]
ipa
ꢀꢀꢀꢀ
异丙醇
[0507]
lcms
ꢀꢀꢀ
液相色谱-质谱
[0508]
hplc
ꢀꢀꢀ
高效液相色谱
[0509]
pe
ꢀꢀꢀꢀꢀ
石油醚
[0510]
sfc
ꢀꢀꢀꢀ
超临界流体色谱
[0511]
tfa
ꢀꢀꢀꢀ
三氟乙酸
[0512]
thf
ꢀꢀꢀꢀ
四氢呋喃
[0513]
tlc
ꢀꢀꢀ
薄层色谱
[0514]
uplc
ꢀꢀ
超高效液相色谱
[0515]
现将经由以下实施例描述本发明,所述实施例不在任何方面限制本发明。全部列举文献及参考文献均以引用的方式并入。
[0516]
实施例
[0517]
中间体1
[0518]
2-(((2-氨基-4-溴-5-甲氧苯基)硫基)甲基)-2-甲基己酸
[0519][0520]
向5-溴-6-甲氧基苯并[d]噻唑-2-胺(63g,0.243mol)于水(630ml)中的搅拌溶液中添加氢氧化钾(218.2g,3.89mol),且将反应混合物在120℃下搅拌16小时。反应完成(经由lcms监测)后,将反应混合物冷却至室温。逐滴添加2-(溴甲基)-2-甲基己酸(70.5g,6.31mol)于thf(210ml)中的溶液,且将反应混合物在室温下搅拌16小时。反应完成(经由lcms监测)后,将反应混合物冷却至0℃且用浓hcl(ph~2)酸化。将反应混合物用etoac(2
×
350ml)萃取,且将合并的有机层用水(150ml)及盐水(150ml)洗涤。有机部分经无水na2so4干燥且真空浓缩。将所得粗物质原样转移至下一步骤而不经任何进一步纯化。产率:75g(粗物质,棕色胶)。
[0521]
lcms:(方法a)376.1(m
+
),378.0(m
+
+2),rt.2.44min,92.97%(max)。
[0522]
中间体2
[0523]
7-溴-3-丁基-8-甲氧基-3-甲基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮
[0524][0525]
在0℃下,向2-(((2-氨基-4-溴-5-甲氧苯基)硫基)甲基)-2-甲基己酸(中间体1;75.0g,0.199mol)于etoac(750ml)中的搅拌溶液中逐滴添加三乙胺(60.4g,0.59mol)及1-丙烷膦酸酐溶液(50%于etoac中,95.1g,0.29mol)。将反应混合物在室温下搅拌16小时。反应完成(经由uplc监测)后,将反应混合物用水(150ml)淬灭且将水层用etoac(2
×
200ml)萃取。将合并的有机层用盐水(150ml)洗涤且经无水na2so4干燥。真空浓缩有机部分且经由isolera柱色谱(洗脱剂:10-12%etoac/pe;硅胶:230-400目)纯化所得粗物质,得到标题化
合物。产率:63%(45g,灰白色固体)。
[0526]1h nmr(400mhz,dmso-d6):δ9.62(s,1h),7.33(s,1h),7.13(s,1h),3.83(s,3h),3.17(s,2h),1.46-1.44(m,2h),1.22(s,3h),1.17-1.14(m,4h),0.79(t,j=6.8hz,3h)。lcms:(方法a)360.0(m
+
+2),rt.2.64min,97.14%(max)。
[0527]
中间体3
[0528]
7-溴-3-丁基-8-甲氧基-3-甲基-5-苯基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮及3-丁基-7-碘-8-甲氧基-3-甲基-5-苯基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮
[0529][0530]
向7-溴-3-丁基-8-甲氧基-3-甲基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮(中间体2;45g,0.12mol)于碘苯(225ml)中的搅拌溶液中添加碘化亚铜(i)(2.4g,0.012mol)及k2co3(34.6g,0.251mol),且将混合物用氮气吹扫20分钟以脱气。随后在氮气气氛下添加三[2-(2-甲氧基乙氧基)乙基]胺(8.11g,0.025mol),且将所得反应混合物在135℃下加热40小时。反应完成(经由uplc监测)后,经由硅藻土过滤反应混合物,且用etoac(200ml)洗涤硅藻土垫。真空浓缩滤液且经由用meoh重结晶纯化所得粗物质,得到标题化合物。产率:88%(47.5g,灰白色固体)。
[0531]
lcms:(方法e)434.1(m
+
),对于7-溴取代的化合物,及482.1(m
+
+h),对于7-碘取代的化合物,rt.3.23min,99.31%(溴取代及碘取代化合物的组合)(max)。
[0532]
中间体4
[0533]
7-溴-3-丁基-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯及3-丁基-7-碘-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯
[0534][0535]
在0℃下,向7-溴-3-丁基-8-甲氧基-3-甲基-5-苯基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮及3-丁基-7-碘-8-甲氧基-3-甲基-5-苯基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮的混合物(中间体3;47.5g,0.109mol)于thf(475ml)中的搅拌溶液中逐滴添加硼烷二甲基硫醚(1m于thf中,82ml,0.16mol),且将反应混合物在75℃下回流40小时。反应完成(经由uplc监测)后,将反应混合物冷却至0℃且用甲醇(475ml)淬灭。将所得溶液在65℃下加热2小时,且随后冷却至室温且真空浓缩。经由isolera柱色谱(洗脱剂:8-10%etoac/pe;硅胶:230-400目)纯化所得粗物质,得到标题化合物。产率:46g(粗物质,无色液体)。
[0536]
lcms:(方法e)421.8(m
+
+2h),467.8(m
+
+h)rt.3.62min,54.71%(max)。
[0537]
中间体5
[0538]
7-溴-3-丁基-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物及3-丁基-7-碘-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物
[0539][0540]
向7-溴-3-丁基-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯及3-丁基-7-碘-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯的混合物(中间体4;23g,0.05mol)于乙酸(230ml)中的搅拌溶液中添加钨酸钠(2.3g,10%重量/重量)及h2o2(30%于水中,18.6ml,0.16mol),且将反应混合物在室温下搅拌5小时。反应完成(经由tlc监测)后,将反应混合物用水(200ml)淬灭且将水层用etoac(2
×
200ml)萃取。将合并的有机层用水(150ml)及盐水(150ml)洗涤,经无水na2so4干燥且真空浓缩。经由isolera柱色谱(洗脱剂:10-12%etoac/pe;硅胶:230-400目)纯化所得粗物质,得到标题化合物。产率:72%(18g,黄色固体)。
[0541]1h nmr(400mhz,dmso-d6):δ7.47(s,1h),7.34(s,1h),7.27-7.20(m,2h),6.99-6.94(m,2h),6.89-6.85(m,1h),3.94(s,3h),3.40-3.33(m,2h),2.53(s,2h),1.46-1.30(m,2h),1.27-1.20(m,4h),1.10-1.06(m,3h),0.78(t,j=6.80hz,3h)。lcms:(方法e)454.1(m
+
+2h),对于7-溴取代的化合物,及500.1(m
+
+h),对于7-碘取代的化合物,rt.3.25min,92.56%(max)。
[0542]
中间体6
[0543]
3-丁基-8-羟基-3-甲基-7-(甲硫基)-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物
[0544][0545]
在室温下,向7-溴-3-丁基-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物及3-丁基-7-碘-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物的混合物(中间体5;31g,0.07mol)于dmf(310ml)中的搅拌溶液中添加甲硫醇钠(24.01g,0.34mol),且将所得混合物在65℃下搅拌过夜。反应完成(经由tlc监测)后,将反应混合物用水(150ml)淬灭且将水层用etoac(2
×
300ml)萃取。将合并的有机层用盐水(150ml)洗涤,经无水na2so4干燥且真空浓缩。经由用meoh重结晶纯化所得粗物质,得到标题化合物。产率:83%(23g,灰白色固体)。
2,2-二氟丙酸乙酯(0.401g,1.84mmol)于dma(1ml)中的溶液,且将反应混合物在70℃下加热3小时。反应完成(经由tlc监测)后,将反应混合物冷却至0℃,用稀hcl(1.5n,ph~4)淬灭且用水(20ml)稀释。用etoac(2
×
15ml)萃取水层。将合并的有机层用盐水(10ml)洗涤且经无水na2so4干燥。真空浓缩有机部分且经由isolera柱色谱(洗脱剂:15-20%etoac/pe;硅胶:230-400目)纯化所得粗物质,得到标题化合物。产率:39%(0.15g,白色固体)。
[0557]
lcms:(方法a)522.0(m
+
+h),rt.3.32min,97.84%(max)。
[0558]
中间体9
[0559]
(r)-(z)-3-((3-丁基-3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)-2-氟丙烯酸乙酯及(s)-(z)-3-((3-丁基-3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)-2-氟丙烯酸乙酯
[0560][0561]
在0℃下,向3-丁基-8-羟基-3-甲基-7-(甲硫基)-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物的对映异构体1(中间体7;9g,22.2mmol)于dma(75ml)中的搅拌溶液中分批添加60%nah(2.88g,72.17mmol),且将反应混合物在0℃下搅拌30分钟。随后添加3-溴-2,2-二氟丙酸乙酯(11.26g,55.5mmol)于dma(15ml)中的溶液,且将反应混合物在65℃下加热3小时。反应完成(经由tlc监测)后,将反应物质冷却至0℃,用1.5n hcl(ph~4)淬灭且用水(100ml)稀释。用etoac(2
×
75ml)萃取水层。将合并的有机层用盐水(50ml)洗涤且经无水na2so4干燥。真空浓缩有机部分且经由isolera柱色谱(洗脱剂:15-20%etoac pe;硅胶:230-400目)纯化所得粗物质,得到标题化合物的对映异构体1。
[0562]
遵循相同程序,以1.10g的中间体7的对映异构体2为起始物质获得标题化合物的对映异构体2。两种对映异构体的绝对构型为未知的。
[0563]
对映异构体1:产率:73%(8.4g,白色固体)。1h nmr(400mhz,dmso-d6):δ7.68-7.62(m,2h),7.26(t,j=8.4hz,2h),7.06(d,j=7.6hz,2h),6.91(t,j=7.2hz,1h),6.82(s,1h),4.27(q,j=7.2hz,2h),3.61(bs,2h),3.49(s,2h),2.24(s,3h),1.47-1.35(m,2h),1.32-1.27(m,3h),1.26-1.12(m,4h),1.10-1.02(m,3h),0.80-0.77(m,3h)。lcms:(方法e)522.2(m
+
+h),rt.3.26min,97.33%(max)。
[0564]
对映异构体2:产率:46%(0.65g,白色固体)。lcms:(方法e)522.2(m
+
+h),rt.3.27min,97.63%(max)。
[0565]
中间体10
[0566]
2-(((2-氨基-4-溴-5-甲氧苯基)硫基)甲基)-2-甲基戊酸
[0567][0568]
向5-溴-6-甲氧基苯并[d]噻唑-2-胺(19.0g,0.07mol)于水(190ml)中的搅拌溶液添加氢氧化钾(65.81g,1.173mol),且随后将反应混合物在120℃下搅拌16小时。反应完成(经由lcms监测)后,将反应混合物冷却至室温。在0℃下逐滴添加2-(溴甲基)-2-甲基戊酸(19.93g,0.09mol)于thf(60ml)中的溶液,且将反应混合物在室温下搅拌16小时。随后在65℃下将反应混合物加热16小时。起始物质消耗(经由lcms监测)之后,将反应混合物倒入冰冷的水(50ml)中且用浓hcl(ph~2)酸化。用etoac(2
×
200ml)萃取水层。将合并的有机层用水(100ml)及盐水(100ml)洗涤且经无水na2so4干燥。真空浓缩有机部分,且将所得粗物质原样转移至下一步骤而不经任何进一步纯化。产率:25g(粗物质,棕色胶)。
[0569]
lcms:(方法e)361.8(m
+
+h),rt.2.36min,97.93%(max)。
[0570]
中间体11
[0571]
7-溴-8-甲氧基-3-甲基-3-丙基-2,3-二氢-1,5-苯并-1,5-硫杂氮杂环庚三烯-4(5h)-酮
[0572][0573]
在0℃下,向2-(((2-氨基-4-溴-5-甲氧苯基)硫基)甲基)-2-甲基戊酸(中间体10;25g,0.069mol)于etoac(250ml)中的搅拌溶液中逐滴添加三乙胺(28.8ml,0.207mol)及1-丙烷膦酸酐溶液(50%于etoac中;32.91g,0.103mol),且将反应混合物在室温下搅拌16小时。反应完成(经由lcms监测)后,将反应混合物用水(100ml)淬灭且将水层用etoac(2
×
200ml)萃取。将合并的有机层用盐水(100ml)洗涤,经无水na2so4干燥且真空浓缩。经由isolera柱色谱(洗脱剂:13%-100%etoac/pe;硅胶:230-400目)纯化所得粗物质,得到标题化合物。产率:49.6%(11.8g,棕色固体)。
[0574]1h nmr(400mhz,dmso-d6):δ9.63(s,1h),7.33(s,1h),7.13(s,1h),3.83(s,3h),2.99-2.95(m,2h),1.50-1.40(m,2h),1.24-1.16(m,5h),0.77(t,j=7.2hz,3h)。lcms:(方法e)344.1(m
+
),rt.2.71min,99.73%(max)。
[0575]
中间体12
[0576]
7-溴-8-甲氧基-3-甲基-5-苯基-3-丙基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮及7-碘-8-甲氧基-3-甲基-5-苯基-3-丙基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮
[0577]
[0578]
向7-溴-8-甲氧基-3-甲基-3-丙基-2,3-二氢-1,5-苯并-1,5-硫杂氮杂环庚三烯-4(5h)-酮(中间体11;11.8g,34.27mmol)于碘苯(118ml)中的搅拌溶液中添加碘化亚铜(i)(0.65g,3.40mmol)及k2co3(9.47g,68.5mmol),且将反应混合物用氮气吹扫20分钟以脱气。随后在氮气气氛下添加三[2-(2-甲氧基乙氧基)乙基]胺(2.21g,6.85mmol),且将所得反应混合物在135℃下加热16小时。反应完成(经由lcms监测)后,经由硅藻土过滤反应混合物,且用etoac(100ml)洗涤硅藻土垫。将滤液用水(50ml)及盐水(50ml)洗涤且经无水na2so4干燥。真空浓缩有机部分且经由isolera柱色谱(洗脱剂:10-12%etoac/pe;硅胶:230-400目)纯化所得粗物质,得到标题化合物。产率:92%(13.2g,灰白色固体)。
[0579]1h nmr(400mhz,dmso-d6):δ7.42-7.38(m,3h),7.28-7.25(m,2h),7.13-7.10(m,2h),3.82(s,3h),3.29-3.25(m,1h),3.16-3.13(m,1h),1.34-1.26(m,2h),1.20-1.13(m,5h),0.73-0.72(m,3h)。lcms:(方法e)420.1(m
+
+h),对于7-溴取代的化合物,及468.1(m
+
+h),对于7-碘取代的化合物,rt.3.13min,97.05%(max)。
[0580]
中间体13
[0581]
7-溴-8-甲氧基-3-甲基-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯及7-碘-8-甲氧基-3-甲基-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯
[0582][0583]
在0℃下,向7-溴-8-甲氧基-3-甲基-5-苯基-3-丙基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮及7-碘-8-甲氧基-3-甲基-5-苯基-3-丙基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮的混合物(中间体12;13.2g,31.4mmol)于thf(132ml)中的搅拌溶液中逐滴添加硼烷二甲基硫醚(2m于thf中;47.1ml,94.2mmol),且将反应混合物在65℃下回流16小时。反应完成(经由uplc监测)后,将反应混合物冷却至0℃,用甲醇(15ml)淬灭且在65℃下加热2小时。随后将所得反应混合物冷却至室温且真空浓缩。将残余物用水(100ml)稀释且将水层用dcm(2
×
200ml)萃取。将合并的有机层用水(100ml)及盐水(100ml)洗涤且经无水na2so4干燥。真空浓缩有机部分,且将所得粗物质原样转移至下一步骤而不经任何进一步纯化。产率:12.4g(97%,白色胶)。
[0584]1h nmr(400mhz,dmso-d6):δ7.25-7.13(m,3h),7.06-7.02(m,1h),6.83-6.77(m,2h),6.75-6.72(m,1h),3.84(s,3h),2.81-2.70(m,2h),2.64-2.60(m,2h),1.23-1.16(m,4h),0.89(s,3h),0.74(s,3h)。lcms:(方法e)406.1(m
+
+h),对于7-溴取代的化合物,及454.1(m
+
+h),对于7-碘取代的化合物;rt.3.55min,97.03%(max)。
[0585]
中间体14
[0586]
7-溴-8-甲氧基-3-甲基-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物及7-碘-8-甲氧基-3-甲基-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物
[0587][0588]
在0℃下,向7-溴-8-甲氧基-3-甲基-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯及7-碘-8-甲氧基-3-甲基-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯的混合物(中间体13;12.4g,30.51mmol)于thf(87ml)及水(37ml)的混合物中的搅拌溶液中添加单过硫酸氢钾(oxone)(93.79g,30.5mmol)。将所得反应混合物在室温下搅拌16小时。反应完成(经由uplc监测)后,经由布赫纳漏斗(b
ü
chner funnel)滤出反应混合物,且用etoac(2
×
200ml)萃取滤液。将合并的有机层用水(100ml)及盐水(100ml)洗涤,经无水na2so4干燥且真空浓缩。经由isolera柱色谱(洗脱剂:7%etoac/pe;硅胶:230-400目)纯化粗物质,得到标题化合物。产率:90%(7.0g,灰白色胶)。
[0589]1h nmr(400 400mhz,dmso-d6):δ7.47(s,1h),7.34(s,1h),7.28-7.20(m,2h),6.98-6.94(m,2h),6.89-6.85(m,1h),3.85(s,3h),3.52-3.48(m,2h),3.39-3.36(m,2h),1.52-1.41(m,1h),1.29-1.25(m,3h),1.00(s,3h),0.74-0.73(m,3h)。lcms:(方法e)438.0(m
+
+h),对于7-溴化合物,及485.7(m
+
+h),对于7-碘化合物,rt.3.13min,95.69%(max)。
[0590]
中间体15
[0591]
8-羟基-3-甲基-7-(甲硫基)-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物
[0592][0593]
在室温下,向7-溴-8-甲氧基-3-甲基-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物及7-碘-8-甲氧基-3-甲基-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物的混合物(中间体14;5.0g,11.4mmol)于dmf(50ml)中的搅拌溶液中添加甲硫醇钠(3.99g,57mmol),且随后将反应混合物在65℃下搅拌16小时。反应完成(经由tlc监测)后,将反应混合物冷却至室温且用水(100ml)淬灭。用etoac(2
×
100ml)萃取水层。将合并的有机层用盐水(50ml)洗涤,经无水na2so4干燥且真空浓缩。经由isolera柱色谱(洗脱剂:20%etoac/pe;硅胶:230-400目)纯化所得粗物质,得到标题化合物。产率:89%(4.0g,灰白色固体)。
[0594]1h nmr(400mhz,dmso-d6):δ10.60(s,1h),7.32(s,1h),7.18-7.14(m,2h),6.86-6.84(m,2h),6.78-6.73(m,2h),3.23-3.16(m,4h),2.21(s,3h),1.52-1.48(m,1h),1.27-1.26(m,3h),1.02(s,3h),0.77-0.73(m,3h)。lcms:(方法e)392.2(m
+
+h),rt.2.83min,97.89%(max)。
[0595]
中间体16
[0596]
(e)-3-((3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)丙烯酸叔丁酯
[0597][0598]
在室温下,向8-羟基-3-甲基-7-(甲硫基)-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物(中间体15;300mg,0.76mmol)于thf(5ml)中的搅拌溶液中添加dabco(0.008g,0.076mmol)及丙炔酸叔丁酯(0.144g,1.149mmol),且随后将反应混合物在室温下搅拌3小时。反应完成(经由tlc监测)后,将反应混合物用水(20ml)稀释且用etoac(2
×
20ml)萃取水层。将合并的有机层用水(2
×
10ml)洗涤,经无水na2so4干燥且真空浓缩有机部分。经由isolera柱色谱(洗脱剂:16%etoac/pe;硅胶:230-400目)纯化所得粗物质,得到标题化合物。产率:83%(0.33g,白色固体)。
[0599]1h nmr(400mhz,dmso-d6):δ7.67(d,j=12.0hz,1h),7.51(s,1h),7.27(t,j=8.4hz,2h),7.09(d,j=8.0hz,2h),6.93(t,j=7.2hz,1h),6.81(s,1h),5.39(d,j=12.4hz,1h),3.70(s,2h),3.41(s,1h),3.36-3.33(m,1h),2.22(s,3h),1.44(s,9h),1.26-1.16(m,4h),1.02(s,3h),0.73(t,j=6.8hz,3h)。lcms:(方法e)462.1(m
+-tbu+h),rt.3.34min,97.13%(max)。
[0600]
中间体17
[0601]
(z)-2-氟-3-((3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)丙烯酸乙酯
[0602][0603]
在0℃下,向8-羟基-3-甲基-7-(甲硫基)-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物(中间体15;0.3g,0.76mmol)于dma(4ml)中的搅拌溶液中分批添加60%nah(0.1g,2.49mmol),且将反应混合物在0℃下搅拌30分钟。随后添加3-溴-2,2-二氟丙酸乙酯(0.42g,1.91mmol)于dma(1ml)中的溶液,且将反应混合物在70℃下加热3小时。反应完成(经由tlc监测)后,将反应物质冷却至0℃,用稀hcl(1.5n,ph~4)淬灭且用水(10ml)稀释。将水层用etoac(2
×
10ml)萃取,将合并的有机层用盐水(10ml)洗涤且经无水na2so4干燥。真空浓缩有机部分。经由isolera柱色谱(洗脱剂:15%-20%etoac/pe;硅胶:230-400目)纯化所得粗物质,得到标题化合物。产率:36%(0.14g,灰白色固体)。
[0604]1h nmr(400mhz,dmso-d6):δ7.69(s,1h),7.63(d,j=9.6hz,1h),7.25(t,j=8.4hz,2h),7.05(d,j=7.2hz,2h),6.91(t,j=7.2hz,1h),6.83(s,1h),4.26(q,j=6.8hz,2h),3.74(s,2h),3.35(s,2h),2.24(s,3h),1.45-1.29(m,4h),1.27-1.16(m,3h),1.02(s,
3h),0.75-0.73(m,3h)。lcms:(方法e)508.2(m
+
+h),rt.3.16min,96.26%(max)。
[0605]
中间体18
[0606]
2-(((2-氨基-4-溴-5-甲氧苯基)硫基)甲基)-2-甲基丁酸
[0607][0608]
向5-溴-6-甲氧基苯并[d]噻唑-2-胺(9g,34.7mmol)于水(90ml)中的搅拌溶液添加氢氧化钾(31.2g,555.9mmol)及na2so3(4.3g,34.7mmol),且将反应混合物在120℃下搅拌16小时。反应完成(经由lcms监测)后,将反应混合物冷却至室温。在0℃下逐滴添加2-(溴甲基)-2-甲基丁酸(11.6g,52.0mmol)于thf(20ml)中的溶液,且将反应混合物在室温下搅拌16小时。随后将反应混合物在65℃下加热16小时。反应完成(经由lcms监测)后,将反应混合物倒入冰冷的水中且用浓hcl(ph~2)酸化。用etoac(2
×
100ml)萃取水层。将合并的有机层用水(50ml)及盐水(50ml)洗涤且经无水na2so4干燥。真空浓缩有机部分,且将所得粗物质原样转移至下一步骤而不经任何进一步纯化。产率:10.5g(粗物质,黑色液体)。
[0609]
lcms:(方法e)348.1(m
+
+h),rt.2.21min,97.14%(max)。
[0610]
中间体19
[0611]
7-溴-3-乙基-8-甲氧基-3-甲基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮
[0612][0613]
在0℃下,向2-(((2-氨基-4-溴-5-甲氧苯基)硫基)甲基)-2-甲基丁酸(中间体18;10.1g,29mmol)于dcm(100ml)中的搅拌溶液中逐滴添加三乙胺(7.81ml,58mmol)及1-丙烷膦酸酐溶液(50%于etoac中,18.4g,58mmol),且将反应混合物在室温下搅拌16小时。反应完成(经由tlc监测)后,将反应混合物用水(50ml)淬灭且将水层用etoac(2
×
100ml)萃取。将合并的有机层用盐水(50ml)洗涤,经无水na2so4干燥且真空浓缩。用冷甲醇研磨所得粗物质,得到标题化合物。产率:54%(12g,棕色固体)。
[0614]1h nmr(400mhz,dmso-d6):δ9.64(s,1h),7.34(s,1h),7.13(s,1h),3.83(s,3h),3.06-2.94(m,2h),1.57-1.46(m,2h),1.21(s,3h),0.76(t,j=7.2hz,3h)。lcms:(方法e)332.1(m
+
+2),rt.2.56min,90.58%(max)。
[0615]
中间体20
[0616]
7-溴-3-乙基-8-甲氧基-3-甲基-5-苯基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮及3-乙基-7-碘-8-甲氧基-3-甲基-5-苯基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮
[0617][0618]
向7-溴-3-乙基-8-甲氧基-3-甲基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮(中间体19;5.8g,17.5mmol)于碘苯(58ml)中的搅拌溶液中添加碘化亚铜(i)(0.33g,1.75mmol)及k2co3(4.83g,35mmol),且将反应混合物用氮气吹扫20分钟以脱气。随后在氮气气氛下添加三[2-(2-甲氧基乙氧基)乙基]胺(1.13g,3.50mmol),且将所得反应混合物在135℃下加热16小时。反应完成(经由tlc监测)后,经由硅藻土过滤反应混合物,且用etoac(50ml)洗涤硅藻土垫。将滤液用水(25ml)及盐水(25ml)洗涤且经无水na2so4干燥。真空浓缩有机部分且用石油醚研磨所得粗物质,得到标题化合物。产率:98%(7g,灰色固体)。
[0619]
lcms:(方法e)406.1(m
+
),对于7-溴取代的化合物,及454.0(m
+
+h),对于7-碘取代的化合物,rt.3.00min,95.16%(max)。
[0620]
中间体21
[0621]
7-溴-3-乙基-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯及3-乙基-7-碘-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯
[0622][0623]
在0℃下,向7-溴-3-乙基-8-甲氧基-3-甲基-5-苯基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮及3-乙基-7-碘-8-甲氧基-3-甲基-5-苯基-2,3-二氢-1,5-苯并硫杂氮杂环庚三烯-4(5h)-酮的混合物(中间体20;7g,17.2mmol)于thf(70ml)中的搅拌溶液中逐滴添加硼烷二甲基硫醚(2m于thf中;26ml,51.6mmol),且将反应混合物在65℃下回流16小时。反应完成(经由tlc监测)后,将反应混合物冷却至0℃,用甲醇(15ml)淬灭且随后在65℃下加热2小时。将所得反应混合物冷却至室温且真空浓缩。将所获得的残余物用水(50ml)稀释,且将水层用dcm(2
×
100ml)萃取。将合并的有机层用水(50ml)及盐水(50ml)洗涤且经无水na2so4干燥。真空浓缩有机部分,且将所得粗物质原样转移至下一步骤而不经任何进一步纯化。产率:6.5g(粗物质,无色油)。
[0624]
lcms:(方法e)391.8(m
+
+h),对于7-溴取代的化合物,及439.7(m
+
+h),对于7-碘取代的化合物,rt.3.52min,95.99%(max)。
[0625]
中间体22
[0626]
7-溴-3-乙基-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物及3-乙基-7-碘-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物
[0627][0628]
在0℃下,向7-溴-3-乙基-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯及3-乙基-7-碘-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯的混合物(中间体21;6.5g,16.5mmol)于thf(46ml)及水(20ml)中的搅拌溶液中添加单过硫酸氢钾(50.9g,16.56mmol)。将所得反应混合物在室温下搅拌16小时。反应完成(经由tlc监测)后,经由布赫纳漏斗滤出反应混合物。用etoac(2
×
100ml)萃取滤液且将合并的有机层用水(50ml)及盐水(50ml)洗涤。有机部分经无水na2so4干燥且真空浓缩。经由isolera柱色谱(洗脱剂:13%etoac/pe;硅胶:230-400目)纯化所得粗物质,得到标题化合物。产率:79%(5.5g,白色固体)。
[0629]
lcms:((方法e)424.1(m
+
+h),对于7-溴取代的化合物,及473.1(m
+
+2),对于7-碘取代的化合物,rt.3.03min,96.73%(max)。
[0630]
中间体23
[0631]
3-乙基-8-羟基-3-甲基-7-(甲硫基)-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物
[0632][0633]
在室温下,向7-溴-3-乙基-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物及3-乙基-7-碘-8-甲氧基-3-甲基-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯1,1-二氧化物的混合物(中间体22;5.5g,12.9mmol)于dmf(55ml)中的搅拌溶液中添加甲硫醇钠(4.54g,64.8mmol),且随后将反应混合物在65℃下搅拌16小时。反应完成后(经由tlc监测),将反应混合物冷却至室温且用水(15ml)淬灭。将水层用etoac(2
×
50ml)萃取,且将合并的有机层用盐水(15ml)洗涤,且经无水na2so4干燥。真空浓缩有机部分。经由isolera柱色谱(洗脱剂:30%etoac/pe;硅胶:230-400目)纯化所得粗物质,得到标题化合物。产率:83%(4g,灰白色固体)。
[0634]1h nmr(400mhz,dmso-d6:δ10.60(d,j=4.8hz,1h),7.32(d,j=4.8hz,1h),7.15-7.14(m,2h),6.84-6.71(m,4h),3.83-3.72(m,2h),3.18-3.13(m,2h),2.22(s,3h),1.56-1.49(m,1h),1.31-1.28(m,1h),0.99(s,3h),0.81-0.80(m,3h)。lcms:(方法e)378.2(m
+
+h),rt.2.71min,97.90%(max)。
[0635]
中间体24
[0636]
(z)-3-((3-乙基-3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)-2-氟丙烯酸乙酯
(甲硫基)-1,1-二氧化-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)-2-氟丙烯酸
[0647][0648]
向(z)-3-((3-丁基-3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)-2-氟丙烯酸乙酯的对映异构体1(中间体9;8.4g,16.1mmol)于1,4-二噁烷及水(7:3,84ml)的混合物中的搅拌溶液中添加氢氧化锂(1.15g,48.3mmol),且将反应混合物在室温下搅拌2小时。反应完成(经由tlc监测)后,将反应混合物用稀hcl(1.5n,ph~4)酸化且用冰冷的水(25ml)稀释。将水层用etoac(2
×
30ml)萃取,且将合并的有机层用水(15ml)及盐水(15ml)洗涤。将有机部分经无水na2so4干燥且真空浓缩,得到标题化合物。
[0649]
遵循相同程序,以0.65g的中间体9的对映异构体2为起始物质获得标题化合物的对映异构体2。两种对映异构体的绝对构型为未知的。
[0650]
对映异构体1:产率:96%(7.6g,灰白色固体)。1h nmr(400mhz,dmso-d6):δ13.56(s,1h),7.61-7.57(m,2h),7.25(t,j=8.4hz,2h),7.05(d,j=7.2hz,2h),6.90(t,j=7.6hz,1h),6.82(s,1h),3.62(bs,2h),3.40(s,2h),2.24(s,3h),2.24(bs,1h),1.32(t,j=11.2hz,1h),1.28-1.05(m,4h),1.01(s,3h),0.78(t,j=6.8hz,3h)。分析数据:lcms:(方法e)493.8(m
+
+h),rt.3.23min,98.22%(max)。hplc:(方法b)rt.5.69min,99.32%(max)。分析数据:sfc:(方法h)rt.3.76min,100%(max)。
[0651]
对映异构体2:产率:88%(0.54g,灰白色固体)。1h nmr(400mhz,dmso-d6):δ13.56(s,1h),7.54-7.50(m,2h),7.18(t,j=7.6hz,2h),6.97(d,j=7.6hz,2h),6.83(t,j=7.2hz,1h),6.75(s,1h),3.63(bs,2h),3.33(s,2h),2.17(s,3h),1.39(m,1h),1.24(m,1h),1.16-1.02(m,4h),0.94(s,3h),0.70(t,j=7.2hz,3h)。lcms:(方法e)493.8(m
+
+h),rt.2.96min,95.48%(max)。hplc:(方法b)rt.5.70min,98.38%(max)。sfc:(方法h)rt.3.02min,98.36%(max)。
[0652]
实施例4
[0653]
(e)-3-((3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)丙烯酸
[0654][0655]
在0℃下,向(e)-3-((3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)丙烯酸叔丁酯(中间体16;0.33g,0.63mmol)
1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)丙烯酸
[0665][0666]
向(z)-2-氟-3-((3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)丙烯酸乙酯(中间体17;0.14g,0.27mmol)于1,4-二噁烷及水的混合物(4:1,3ml)中的搅拌溶液中添加氢氧化锂(0.023g,0.55mmol),且将反应混合物在室温下搅拌2小时。反应完成(经由tlc监测)后,将反应混合物用稀hcl(1.5n,ph~4)酸化且用冰冷的水(5ml)稀释。将水层用etoac(2
×
10ml)萃取,且将合并的有机层用水(10ml)及盐水(10ml)洗涤。将有机部分经无水na2so4干燥且真空浓缩,得到标题化合物。产率:84%(0.11g,灰白色固体)。
[0667]1h nmr(400mhz,dmso-d6):δ13.59(s,1h),7.58-7.56(m,1h),7.53(s,1h),7.25(t,j=8.4hz,2h),7.04(d,j=7.6hz,2h),6.90(t,j=7.2hz,1h),6.83(s,1h),3.69(bs,2h),3.40(s,2h),2.25(s,3h),1.45(bs,1h),1.31-1.24(m,3h),1.02(s,3h),0.75-0.73(m,3h)。lcms:(方法e)480.2(m
+
+h),rt.2.85min,97.16%(max)。hplc:(方法b)rt.5.43min,95.69%(max)。
[0668]
实施例8及9
[0669]
(r)-(z)-2-氟-3-((3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)丙烯酸及(s)-(z)-2-氟-3-((3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)丙烯酸
[0670][0671]
经由手性sfc(方法h)分离外消旋(z)-2-氟-3-((3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-3-丙基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)丙烯酸(实施例7;100mg,0.11mmol)的两种对映异构体。在40℃下真空浓缩物质。第一洗脱级份对应于对映异构体1且第二洗脱级份对应于对映异构体2。两种对映异构体的绝对构型为未知的。
[0672]
对映异构体1:产率:38%(38mg,白色固体)。1h nmr(400mhz,dmso-d6):δ13.55(s,1h),7.61-7.57(m,2h),7.25(t,j=8.0hz,2h),7.05(d,j=7.6hz,2h),6.90(t,j=7.6hz,1h),6.84(s,1h),3.99-3.71(m,2h),3.45-3.35(m,2h),2.25(s,3h),1.55-1.43(m,1h),1.35-1.24(m,3h),1.02(s,3h),0.77-0.65(m,3h)。lcms:(方法e)479.8(m
+
),rt.2.45min,98.61%(max)。hplc:(方法b)rt.5.43min,97.96%(max)。手性sfc:(方法e)rt.5.08min,100%(max)。
[0673]
对映异构体2:产率:30%(30mg,白色固体)。1h nmr(400mhz,dmso-d6):δ13.57(s,1h),7.62(m,2h),7.25(t,j=8.0hz,2h),7.05(d,j=7.2hz,2h),6.90(t,j=7.6hz,1h),6.84(s,1h),4.01-3.72(m,2h),3.45-3.35(m,2h),2.25(s,3h),1.54-1.44(m,1h),1.31-1.23(m,3h),1.02(s,3h),0.76-0.69(m,3h)。lcms:(方法e)479.8(m
+
),rt.2.45min,98.49%(max)。hplc:(方法b)rt.5.43min,96.61%(max)。手性sfc:(方法e)rt.6.66min,100%(max)。
[0674]
实施例10
[0675]
(z)-3-((3-乙基-3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)-2-氟丙烯酸
[0676][0677]
向(z)-3-((3-乙基-3-甲基-7-(甲硫基)-1,1-二氧化-5-苯基-2,3,4,5-四氢-1,5-苯并硫杂氮杂环庚三烯-8-基)氧基)-2-氟丙烯酸乙酯(中间体24;220mg,0.58mmol)于1,4-二噁烷及水的混合物(4:1,5ml)中的搅拌溶液中添加氢氧化锂(50mg,1.17mmol),且将反应混合物在室温下搅拌1小时。反应完成(经由tlc监测)后,将反应混合物用稀hcl(1.5n,2ml,ph~4)淬灭且真空浓缩。将所获得的残余物分配于冰冷的水(5ml)与etoac(5ml)之间。用etoac(2
×
5ml)萃取水层且用冰冷的水(5ml)及盐水(5ml)洗涤合并的有机层。有机部分经无水na2so4干燥且真空浓缩。用己烷研磨所得粗物质,得到标题化合物。产率:22%(60mg,淡黄色固体)。
[0678]1h nmr(400mhz,dmso-d6):δ13.59(s,1h),7.63-7.58(m,2h),7.24(t,j=8.4hz,2h),7.02(d,j=7.6hz,2h),6.90-6.86(m,2h),3.75(s,2h),3.17(s,2h),2.26(s,3h),1.65-1.48(m,1h),1.34-1.29(m,1h),1.00(s,3h),0.79(t,j=7.6hz,3h)。lcms:(方法e)466.1(m
+
+h),rt.2.36min,99.05%(max)。hplc:(方法b)rt.5.15min,96.39%(max)。
[0679]
生物分析
[0680]
ibat(h/m)分析方案
[0681]
将10,000个细胞(人类或小鼠ibat过表达细胞)接种于96孔板(corning cls3809)中的200μl mem-α培养基(gibco 12571-063)中,该培养基补充有10%fbs(gibco 10438026)且含有嘌呤霉素(gibco a1113803)(10μg/ml),且将所述细胞在37℃下5%co2中孵育48小时。孵育后,自孔中倾析出培养基且用300μl基础mem-α培养基(不含fbs)洗涤细胞两次。每次倾析基础mem-α培养基后,将板对着纸巾轻拍以确保最大程度地移除残余培养基。
[0682]
在dmso(sigma d2650)中制备的测试抑制剂稀释液(最高测试浓度为10μm,3倍连续稀释,10个点)添加于含有0.25μm 3h-牛磺胆酸(arc art-1368)及5μm冷牛磺胆酸(sigma t4009)的孵育混合物(维持0.2%最终dmso浓度)中。随后将50μl含有测试抑制剂的孵育混合物添加至孔中(一式两份),且将板在co2培养箱中在37℃下孵育20分钟。孵育后,经由将板保持在冰水混合物上2-3分钟来停止反应,且随后自孔中完全吸出孵育混合物。用溶解于
hepes(gibco 15630080)缓冲的(10mm)hbss(gibco 14175079)(ph 7.4)中的250μl冷却的未经标记的1mm牛磺胆酸洗涤孔两次。每次洗涤后,将板对着纸巾轻拍以确保最大程度地移除阻断缓冲液。
[0683]
将100μl microscint-20(perkinelmer 6013621)添加至孔中且在室温下保持过夜,随后在来自perkinelmer的topcount nxt
tm
微板闪烁及发光计数器中根据3h测试方案(设定为每孔120秒读取时间)读取板。
[0684]
lbat(h/m)分析方案
[0685]
将20,000个细胞(人类或小鼠lbat过表达细胞)接种于96孔板(corning cls3809)中的100μl mem-α培养基(gibco 12571-063)中,该培养基补充有10%fbs(gibco 10438026)且含有遗传霉素(gibco 10131-027)(1mg/ml),且将所述细胞在37℃下5%co2中孵育24小时。孵育后,自孔中倾析出培养基且用300μl基础mem-α培养基(不含fbs)洗涤细胞两次。每次倾析基础mem-α培养基后,将板对着纸巾轻拍以确保最大程度地移除残余培养基。
[0686]
对于人类lbat,经由将测试抑制剂稀释液(在dmso(sigma d2650)中的3倍连续稀释液,10个点)添加于含有0.3μm 3h-牛磺胆酸(arc art-1368)及7.5μm冷牛磺胆酸(sigma t4009)的mem-α(无fbs)(维持0.2%最终dmso浓度)中来制备孵育混合物。对于小鼠lbat,经由将测试抑制剂稀释液(在dmso中的3倍连续稀释液,10个点)添加于含有0.3μm 3h-牛磺胆酸及25μm冷牛磺胆酸的mem-α(无fbs)(维持0.2%最终dmso浓度)中来制备孵育混合物。
[0687]
随后将50μl含有测试抑制剂的孵育混合物添加至孔中(一式两份),且将板在co2培养箱中在37℃下孵育20分钟。孵育后,经由将板保持在冰水混合物上2-3分钟来停止反应,且随后自孔中完全吸出孵育混合物。用溶解于hepes(gibco 15630080)缓冲的(10mm)hbss(gibco 14175079)(ph 7.4)中的250μl冷却的未经标记的1mm牛磺胆酸洗涤孔两次。每次洗涤后,将板对着纸巾轻拍以确保最大程度地移除阻断缓冲液。
[0688]
将100μl microscint-20(perkinelmer 6013621)添加至孔中且在室温下保持过夜,随后在来自perkinelmer的topcount nxt
tm
微板闪烁及发光计数器中根据3h测试方案(设定为每孔120秒读取时间,正常板朝向)读取板。
[0689]
双向渗透率分析(caco-2细胞)
[0690]
将caco-2细胞(evotec)以70,000个细胞/孔的密度接种于24孔插入式细胞培养板中,且维持于培养箱(37℃,5%co2,95%rh)中持续21天,伴随隔天更换一次培养基。
[0691]
在二甲亚砜(dmso)中制备测试化合物阿替洛尔(atenolol)(低渗透率标志物)、普萘洛尔(propranolol)(高渗透率标志物)及地高辛(digoxin)(p-gp转运通路的底物)的储备溶液(10mm)。经由用90μl纯dmso稀释10μl的10mm母储备溶液来制备中间储备溶液(1mm)。经由用4950μl的fassif缓冲液稀释50μl的1mm中间储备溶液来制备工作储备溶液(10μm)。向fassif后添加化合物,对样品进行声处理持续2小时,且在37℃下以4000rpm离心30分钟。将4ml上清液直接用于分析中。转运实验中的最终dmso浓度为1%。
[0692]
分析当天,用转运缓冲液(hbss,ph 7.4)洗涤caco-2单细胞层两次,且在培养箱中预孵育30分钟(37℃,5%co2,95%rh)。用系统测量单细胞层的电阻。将跨上皮电阻(teer)值超过350ohm.cm2的单细胞层选用于分析。
[0693]
沿吸收方向(a2b)及分泌方向(b2a)进行分析。经由在孔(一式两份(n=2))中向供体室(顶部室a-b;基侧室b-a)添加由化合物组成的转运分析缓冲液(在hbss中制备的fassif缓冲液)来启动转运实验。将含有1%牛血清白蛋白(bsa)的不含药物的hbss缓冲液(ph 7.4)引入至接受者室(a-b-基侧室;b-a-顶部室)。顶部室与基侧室的体积分别为0.4ml与0.8ml。添加投配溶液之后,将培养板在培养箱中在37℃下孵育120分钟。120分钟之后,收集供体与接受者样品,用相反的缓冲液进行基质匹配(1:1,30μl研究样品+30μl空白缓冲液)。投配样品基质与相反的缓冲液匹配(1:1,30μl研究样品+30μl空白缓冲液)。经由添加含有内标物的乙腈来处理样品(60μl研究样品+200μl含有内标物甲苯磺丁脲的乙腈,500ng/ml)。对样品进行涡旋且以4000rpm离心10分钟。用100μl水稀释所获得的上清液(100μl)且转移至新制96孔板。若适用,使用发现级生物分析方法经由液相色谱串联质谱分析(lc-ms/ms)法来分析化合物在样品中的浓度。
[0694]
测试化合物阿替洛尔、普萘洛尔及地高辛的平均表观渗透率(p
app
,
×
10-6
cm/秒)计算如下:
[0695][0696]
其中dq/dt=转运速率(接受者室中化合物的转运速率),c0=供体室中的初始浓度,a=有效滤膜的表面积。
[0697]
基于heparg的分析方案
[0698]
按照biopredic international提供的方案,在补充有200mm谷氨酰胺(gibco 35050061)的heparg解冻/接种/通用培养基(biopredic international add670c)解冻分化heparg细胞的冷冻保存的小瓶(biopredic international hpr116080)。将每孔70,000个细胞接种于96孔板(corning cls3809)中的100μl补充有200mm glutamax的heparg解冻/接种/通用培养基中,且在37℃下5%co2中孵育24小时。孵育后,将接种培养基替换为heparg维持/代谢培养基(biopredic international add620c)且孵育6天,每48小时补充新鲜的heparg维持/代谢培养基。接种后孵育7天后,自孔中倾析出孵育培养基,且用250μl威廉姆斯氏e基础培养基(william's e basal media)(gibco12551032)洗涤细胞两次。每次倾析威廉姆斯氏e基础培养基后,将板对着纸巾轻拍以确保最大程度地移除残余培养基。
[0699]
孵育混合物经由将测试抑制剂稀释液(在dmso(sigma d2650)中的3倍连续稀释液)添加于含有0.3μm 3h-牛磺胆酸(arc art-1368)及7.5μm冷牛磺胆酸(sigma t4009)的威廉姆斯氏e培养基(基础)(维持0.2%最终dmso浓度)中来制备。随后将50μl含有测试抑制剂的孵育混合物添加至孔中(一式两份),且将板在5%co2培养箱中在37℃下孵育30分钟。孵育后,经由将板保持在冰水混合物上2-3分钟来停止反应,且随后自孔中完全吸出孵育混合物。用溶解于hepes(gibco 15630080)缓冲的(10mm)hbss(gibco14175079)(ph 7.4)中的250μl冷却的未经标记的1mm牛磺胆酸洗涤孔两次。每次洗涤后,将板对着纸巾轻拍以确保最大程度地移除阻断缓冲液。
[0700]
将100μl microscint-20(perkinelmer 6013621)添加至孔中且在室温下保持过夜,随后在来自perkinelmer的topcount nxt
tm
微板闪烁及发光计数器中根据3h测试方案(设定为每孔120秒读取时间,正常板朝向)读取板。
[0701]
测试化合物稀释液的制备
[0702]
所有测试化合物在室温下以粉末形式提供。制备测试化合物的10mm dmso储备液,等分且储存于-20℃下。由化合物的10mm dmso储备液制备在dmso中的3倍连续稀释液,得到总共10个测试化合物稀释液。将0.5μl此dmso中的稀释液添加至含有3h-牛磺胆酸及冷牛磺胆酸的250μl不含fbs的基础培养基中以制备孵育混合物。
[0703]
生物利用度研究
[0704]
使用8至10周龄的雄性小鼠(c57bl/6或cd1)或威斯塔大鼠(wistar rat)。对于每种测试化合物,使用两组,每组3只动物。一组经由尾部静脉给药1mg/kg(媒介物100%dmso)的单次静脉内剂量,另一组经由管饲针给药10mg/kg的单次口服剂量。给药口服剂量的组禁食过夜。静脉内给药后0.083、0.25、0.5、1、2、4、6、8及24小时后以及口服给药后0.25、0.5、1、2、4、6、8及24小时后收集血液样品。血液样品取自于隐静脉。使用0.2%edta作为抗凝血剂。经由开发用于估计血浆中的测试化合物的发现级生物分析方法,使用lc-ms/ms系统分析样品。
[0705]
结果
[0706]
实施例化合物的生物学数据显示于下表8中。
[0707]
表8
[0708][0709]
各犬中的尿液胆汁酸排出量
[0710]
研究中使用雄性比格(beagle)犬。分别以10及50mg/kg用实施例2的化合物每日一次给予动物持续三天。研究开始之前经由膀胱穿刺收集基线尿液样品。随后在第1天及第3天在给药后2小时及8小时时收集尿液样品。在临床化学实验室进行尿液胆汁酸及尿液肌酐分析。
[0711]
结果示于图1中。发现用实施例2的化合物处理后,尿液总胆汁酸相对于基线增加约5-10倍。
[0712]
pd模型:测试化合物对雄性c57bl6小鼠的总胆汁酸含量的评估。
[0713]
使用8至9周龄的c57bl/6n tac小鼠来研究胆汁酸调节剂对胆汁酸含量的影响。在检疫及适应期结束后,将动物基于体重随机分成x个实验组:(i)媒介物对照,及(ii)每日口服给药y mg/kg测试化合物一次。用测试化合物处理动物7天。在研究的第5天,将动物单独圈养于新笼中。在第7天,自各笼收集粪便,随后经由眼眶后途径自各动物抽取血液。对动物
实施安乐死以自各动物收集肝脏及末端回肠用于进一步分析。每周两次测量体重及食物消耗。在第7天的血清样品中分析血清脂质概况。在第7天的血清样品中测量血清中的总胆汁酸。在第7天的粪便样品中测量粪便胆汁排泄。在第7天的肝脏样品中量化cyp7a1及shp的肝脏表达。在第7天的肝脏样品中分析肝脏甘油三酯及总胆固醇。
[0714]
尿胆汁酸模型:测试化合物对雄性c57bl/6n小鼠的尿胆汁酸含量的评估。
[0715]
使用8至9周龄的c57bl/6n tac小鼠来研究胆汁酸调节剂对胆汁酸含量的影响。在检疫及适应期结束后,将动物基于体重随机分成x个实验组:(i)媒介物对照,及(ii)每日口服给药y mg/kg测试化合物一次。用测试化合物处理动物7天。在研究的第6天,将动物转移至代谢笼中。在第7天,自各代谢笼收集粪便及尿液,随后经由眼眶后途径自各动物抽取血液。对动物实施安乐死以自各动物收集肾脏用于进一步分析。每周测量体重两次。在第7天的血清样品中测量血清中的总胆汁酸。在第7天的粪便样品中测量粪便胆汁酸排泄。在第7天的样品中测量胆汁酸的尿排泄。在第7天的样品中量化asbt、osta、ostab及mrp2的肾脏表达。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1