钾通道开放剂埃佐加滨的儿科即释制剂的制作方法
钾通道开放剂埃佐加滨的儿科即释制剂
发明领域
1.本公开涉及用于向哺乳动物,优选人,更优选儿童经口施用的即释药物制剂,其包含一种或多种药学上可接受的赋形剂和治疗有效量的钾通道开放剂埃佐加滨(ezogabine)。特别地,本公开涉及这类即释口服药物制剂,其用于治疗儿童癫痫和/或癫痫发作病症,特别用于治疗kcnq2相关新生儿发育性和癫痫性脑病(kcnq2-dee)。
2.发明背景
3.kcnq2相关新生儿发育性和癫痫性脑病(kcnq2-dee),另称作eiee7,为一种罕见且严重的婴儿和儿童神经发育障碍,其具有严重的癫痫发作负担和严重的发育障碍。kcnq2-dee的独特特征在于在生命的第一周内出现多次每日难治性癫痫发作,并伴有明显的强直成分和自主神经症状。癫痫发作通常伴有阵挛性抽搐或复杂的运动行为。该疾病发作时的脑电图(eeg)显示爆发性抑制模式,后来演变为多灶性癫痫样活动。患有kcnq2-dee的婴儿通常会出现严重的智力残疾,伴有轴向张力减退,并伴有肢体痉挛状态。癫痫发作癫痫地会随着年龄的增长而减少,患者通常在3至5岁时不再癫痫发作或经历更轻微的癫痫发作负担;然而,此后癫痫发作可能会再次成簇发作。智力残疾和其他并发病不会随着年龄的增长而逆转或改善,且患者通常需要终身护理。患者通常不会说话,并且一些儿童也可能有自闭症特征。已经观察到与癫痫发作相关的心动过缓和氧饱和度降低伴发绀,并被认为它们是促成这些儿童发生癫痫意外猝死或sudep的显著风险的原因。kcnq2-dee非常罕见,约占出生后的前三个月内发病的癫痫性脑病患者的10%;然而,kcnq2-dee的发病率为约2.8/100,000活新生儿,这大约是早期婴儿癫痫性脑病最常见的遗传类型dravet综合征的新生儿的一半。
4.埃佐加滨(也称作瑞替加滨)为已知的神经元kcnq(kv7)钾通道开放剂并且具有如下结构:
[0005][0006]
且具有2-氨基-4-(4-氟苄氨基)-1-乙氧基羰基氨基苯的化学名。埃佐加滨、其制备及其作为抗癫痫药的应用公开在美国专利no.5,384,330中。
[0007]
埃佐加滨在1980年代后期首次被鉴定为镇痛化合物氟吡汀的类似物。埃佐加滨在设计使用一组啮齿动物癫痫模型鉴定新型抗惊厥药物的研究中展示了广谱活性(参见kupferberg,h.,epilepsia(1989),30(增刊1):s51-s56)。埃佐加滨于2011年被批准用于不完全性癫痫发作,并由glaxosmithkline作为包衣即释片(/trobalt
tm
)上市销售,用于辅助治疗18岁及更大年龄患者的病灶性癫痫发作,但在与皮肤褪色、唇、指甲和视网膜色素改变有关的黑框警告之后,出于商业原因,该产品在2017年从市场上撤出。这些变色情况似乎与长期使用后形成发色埃佐加滨二聚体有关(prescott,j.s.和evans,c.a.,"
pigmentary abnormalities(discoloration)associated with ezogabine/retigabine treatment:nonclinical aspects",poster 2.324presented at the 68th annual meeting of the american epilepsy society(aes),seattle,washington,u.s.a.,2014年12月5-9日)。
[0008]
尽管上述片剂超说明书用于kcnq2-dee儿科人群中(参见millichap,j.j.等人,neurol.genet.,2016年10月,2:1-5),但是没有上市销售儿科制剂。
[0009]
尽管在治疗儿童kcnq2-dee方面取得了重大进展,但对用于治疗儿童kcnq2-dee的埃佐加滨的改进制剂仍存在重大需求。
[0010]
发明概述
[0011]
在一些实施方案中,本公开涉及用于向哺乳动物,优选人,更优选儿童经口施用的即释药物制剂,其包含一种或多种药学上可接受的赋形剂和治疗有效量的钾通道开放剂埃佐加滨。在一个实施方案中,本公开涉及这类即释制剂,其用于治疗儿童的癫痫和/或癫痫发作病症,特别用于治疗kcnq2相关新生儿发育性和癫痫性脑病(kcnq2-dee)。
[0012]
在一个实施方案中,本公开涉及即释口服药物制剂,其包含一种或多种药学上可接受的赋形剂和治疗有效量的埃佐加滨,其中该制剂能够灵活的基于体重给药,而不需要在口服用于哺乳动物,优选人,更优选儿童之前临时混合制剂。
[0013]
在另一个实施方案中,本公开涉及治疗哺乳动物,优选人,更优选儿童的癫痫和/或癫痫发作病症的方法,特别涉及治疗儿童的kcnq2相关新生儿发育性和癫痫性脑病(kcnq2-dee)的方法,其中该方法包括向有此需要的儿童施用治疗有效量的本技术中公开的即释口服药物制剂。
[0014]
在另一个实施方案中,本公开涉及制备即释口服药物制剂的方法,该药物制剂包含一种或多种药学上可接受的赋形剂和治疗有效量的埃佐加滨。
[0015]
附图简述
[0016]
下列附图构成本说明书的一部分并被包括在内以进一步说明本发明的某些实施方案。通过参考这些附图中的一个或多个并结合本技术中提供的具体实施方案的详细描述,可以更好地理解本发明。
[0017]
图1提供了本发明的即释口服药物制剂(实施例#12)的溶出曲线。
[0018]
图2提供了大鼠口服本发明的即释口服药物制剂(实施例#12)和粉碎的potiga(粉末状埃佐加滨片剂)后埃佐加滨的血浆浓度。
[0019]
图3提供了在禁食或进食条件下口服单次400mg剂量的埃佐加滨(作为2.0g本发明的即释口服药物制剂(实施例#12))后作为时间函数的埃佐加滨血浆浓度。
[0020]
发明详述
[0021]
本公开涉及即释口服药物制剂,其包含一种或多种药学上可接受的赋形剂和治疗有效量的埃佐加滨,其中该即释口服药物制剂能够灵活的基于体重给药,而不需要在口服用于哺乳动物,优选人,更优选儿童之前临时混合制剂。
[0022]
在以下公开中,阐述了某些特定细节以便提供对不同实施方案的全面理解。然而,本领域技术人员会理解,可以在没有这些细节的情况下实施本技术中所述的方法和用途。在其他情况下,没有详细示出或描述众所周知的结构以避免不必要地使所述实施方案的描述模糊。除非上下文另有要求,否则在随后的说明书和权利要求书中,“包含”一词及其变化
形式,例如“含有”和“包括”应以开放式、包含式的意义解释,即“包括,但不限于”。此外,本技术中提供的标题仅为方便起见,并不解释要求保护的发明的范围或含义。
[0023]
在整个本说明书中对“一个实施方案”或“一种实施方案”的提及意指所描述的与该实施方案有关的特定特征、结构或特性被包括在至少一个实施方案中。因此,在整个本说明书的不同位置方出现的短语“在一种实施方案中”或“在一个实施方案中”不一定都指同一实施方案。此外,特定特征、结构或特性可以在一个或多个实施方案中以任意适合的方式组合。此外,如在本说明书和所附权利要求中使用的,单数形式“一个(a)”、“一种(an)”和“该(the)”包括复数指示物,另有明确规定的除外。还应注意,除非内容另有明确规定,否则术语“或”通常以其包括“和/或”的含义使用。此外,本技术中使用的术语“约”是指所述值的
±
20%,并且在更具体的实施方案中是指所述值的
±
10%、
±
5%、
±
2%和
±
1%。
[0024]
定义
[0025]
除非在说明书中另有定义,否则下列术语和短语应具有以下含义:
[0026]
本技术中所用的“api”或“活性药物成分”是指埃佐加滨。
[0027]
本技术中所用的“即释”是指向有此需要的患者经口施用时迅速崩解并溶解以释放活性药物成分(api)的药物制剂。经由适当的药学上可接受的赋形剂,该赋形剂不在适当程度延长api释放和/或吸收的速率,可以提供即释。
[0028]
表述“%w/w”是指与考量的组合物的总重相比的重量百分比。
[0029]
表述“%w/v”是指溶质在指定体积的溶剂中的重量。例如,50%w/v的hpmc为在100ml溶剂中50克的hpmc。
[0030]“哺乳动物”包括人和驯养动物,例如实验室动物和家庭宠物(例如猫、狗、猪、牛、绵羊、山羊、马和家兔)和非驯养动物,例如野生动物等。在一些实施方案中,哺乳动物为人,优选是儿童。
[0031]
本技术中所用的“儿童”是指出生到约12岁年龄的具有约2kg至约20kg体重的人类儿童,并且包括小于1个月的人类儿童(“新生儿”)、1个月到24个月的人类儿童(“婴儿”)以及2岁至12岁的人类儿童(“儿童”)。
[0032]
药学上可接受的赋形剂
[0033]
在一些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂。
[0034]
在某些实施方案中,术语“药学上可接受的赋形剂”或“赋形剂”包括,但不限于任何与本技术中公开的埃佐加滨组合的非活性材料以产生经口施用于有此需要的哺乳动物,优选人,更优选婴儿或儿童的即释口服药物制剂。预期术语“药学上可接受的赋形剂”包括,但不限于粘合剂、填充剂、抗氧化剂、淀粉、吸附剂、悬浮剂、溶出促进剂、稀释剂、防粘剂、包衣剂和崩解剂,它们已被监管机构例如,但不限于美国食品与药品监督管理局(united states food and drug administration)、欧洲药品局(european medicines agency)或加拿大健康管理局(health canada)批准用于口服药理学活性成分的制剂中是可以接受的,和/或被认为是公认为安全的材料(gras材料),和/或被列示在美国食品与药品监督管理局公布的非活性成分指南(inactive ingredients guide)中。“药学上可接受的赋形剂”还可以包含remington:the science and practice of pharmacy,fox,第21版,2005中列出的可接受的赋形剂。
[0035]
在某些实施方案中,本公开涉及在最终制剂中适用作粘合剂的药学上可接受的赋形剂。作为用于本技术中公开的即释口服药物制剂的药学上可接受的赋形剂的示例性粘合剂包括,但不限于阿拉伯树胶、琼脂、藻酸、碳酸钙、乳酸钙、卡波姆、羧甲基纤维素钠、角叉菜胶、醋酸邻苯二甲酸纤维素、角豆胶(ceratonia)、脱乙酰壳多糖、共聚维酮、棉籽油、葡萄糖结合剂、糊精、右旋糖、乙基纤维素、明胶、山萮酸甘油酯、瓜尔豆胶、i型氢化植物油、羟乙基纤维素、羟乙基甲基纤维素、羟丙基纤维素、羟丙基淀粉、羟丙甲纤维素、菊粉、乳糖、液体葡萄糖、硅酸镁铝、麦芽糖糊精、麦芽糖、甲基纤维素、微晶纤维素、果胶、泊洛沙姆、聚卡波非、聚葡萄糖、聚环氧乙烷、聚甲基丙烯酸酯、聚维酮、藻酸钠、淀粉、预凝胶化淀粉、硬脂酸、蔗糖、向日葵油、三辛精、维生素e聚乙二醇琥珀酸酯和玉米醇溶蛋白。
[0036]
在某些实施方案中,本公开涉及在最终制剂中适用作填充剂的药学上可接受的赋形剂。作为用于本技术中公开的即释口服药物制剂的药学上可接受的赋形剂的示例性填充剂包括,但不限于藻酸铵、碳酸钙、乳酸钙、磷酸钙、硅酸钙、硫酸钙、纤维素、纤维素-硅化微晶、醋酸纤维素、可压缩糖、糖果糖、玉米淀粉和预凝胶化淀粉、葡萄糖结合剂、糊精、右旋糖、赤藓醇、乙基纤维素、果糖、富马酸、棕榈硬脂酸甘油酯、吸入乳糖、异麦芽酮糖醇、高岭土、拉替克醇、乳糖、碳酸镁、氧化镁、麦芽糖糊精、麦芽糖、甘露糖醇、中链甘油三酯、微晶纤维素、聚葡萄糖、聚甲基丙烯酸酯、西甲硅油、藻酸钠、氯化钠、山梨醇、淀粉、预凝胶化淀粉、淀粉-灭菌玉米、蔗糖、糖球、磺丁基醚β-环糊精、滑石粉、黄蓍胶、海藻糖和木糖醇。
[0037]
在某些实施方案中,本公开涉及在最终制剂中适用作抗氧化剂的药学上可接受的赋形剂。作为用于本技术中公开的即释口服药物制剂的药学上可接受的赋形剂的示例性抗氧化剂包括,但不限于α生育酚、抗坏血酸、抗坏血酸棕榈酸酯、丁羟茴醚、丁羟甲苯、二氧化碳、螯合剂、柠檬酸一水合物、异抗坏血酸、油酸乙酯、富马酸、苹果酸、甲硫氨酸、单硫代甘油、磷酸、焦亚硫酸钾、丙酸、没食子酸丙酯、抗坏血酸钠、亚硫酸氢钠、甲醛合次硫酸氢钠、焦亚硫酸钠、亚硫酸钠、硫代硫酸钠、二氧化硫、酒石酸、麝香草酚、生育酚、维生素e和维生素e聚乙二醇琥珀酸酯。
[0038]
在某些实施方案中,本公开涉及在最终制剂中适用作崩解剂的药学上可接受的赋形剂。作为用于本技术中公开的即释口服药物制剂的药学上可接受的赋形剂的示例性崩解剂包括,但不限于藻酸、藻酸钙、羧甲基纤维素钙、羧甲基纤维素钠、纤维素、脱乙酰壳多糖、胶体二氧化硅、玉米淀粉和预凝胶化淀粉、交联羧甲基纤维素钠、交聚维酮、多库酯钠、甘氨酸、瓜尔胶、羟丙基纤维素、硅酸镁铝、甲基纤维素、微晶纤维素、聚克立林钾、聚维酮、藻酸钠、羟基乙酸淀粉钠、淀粉和预凝胶化淀粉。
[0039]
在本发明的一些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和如下所述的下列药学上可接受的赋形剂的一种或多种:
[0040]
在一个实施方案中,本公开涉及即释口服药物制剂,其包含埃佐加滨和作为药学上可接受的赋形剂的淀粉,优选地,其中淀粉为starch其为部分预凝胶化的玉米淀粉。starch在单一产品中组合了几种特性:粘合剂、崩解剂、填充剂和助流剂,同时具有润滑剂特性,并且可用于固体口服和剂剂量形式的多种加工方法,包括直接压制、湿法制粒、干法制粒/滚压和包封。
[0041]
众所周知,淀粉,优选starch为用于下列应用的药学上可接受的赋形剂
(使用典型重量(%w/w)):
[0042]
片剂和胶囊稀释剂(至多90%);
[0043]
片剂和胶囊崩解剂(3
–
25%(典型地15%));
[0044]
片剂粘合剂(3
–
20%(典型地15%));以及
[0045]
防粘剂(3
–
10%)。
[0046]
在另一个实施方案中,本公开涉及即释口服药物制剂,其包含埃佐加滨和作为药学上可接受的赋形剂的微晶纤维素。微晶纤维素(mcc)是指精制木浆,并且在食品生产中用作组织形成剂、抗结块剂、脂肪替代品、乳化剂、增量剂和膨胀剂。最常见的形式用于维生素补充剂或片剂。mcc还用于噬菌斑测定法以计数病毒,作为羧甲基纤维素的替代品。
[0047]
众所周知,微晶纤维素为用于下列应用的药学上可接受的赋形剂(使用典型重量(%w/w)):
[0048]
吸附剂(20
–
90%);
[0049]
防粘剂(5
–
20%);
[0050]
胶囊粘合剂/稀释剂(20
–
90%);
[0051]
片剂崩解剂(5
–
15%);以及
[0052]
片剂粘合剂/稀释剂(20
–
90%).
[0053]
在另一个实施方案中,本公开涉及即释口服药物制剂,其包含埃佐加滨和作为药学上可接受的赋形剂的聚乙烯吡咯烷酮。聚乙烯吡咯烷酮(pvp),也称作聚维酮(polyvidone)或聚维酮(povidone),为由单体n-乙烯吡咯烷酮制成的水溶性聚合物。其在许多药物片剂中用作粘合剂;口服摄取时它简单地通过身体。
[0054]
众所周知,聚乙烯吡咯胺酮为用于下列应用的药学上可接受的赋形剂(使用典型重量(%w/w)):
[0055]
载体(10
–
25%);
[0056]
包衣剂(0.5
–
5%);
[0057]
崩解剂(5
–
15%)
[0058]
溶出促进剂(5%);
[0059]
悬浮剂(《5%);以及
[0060]
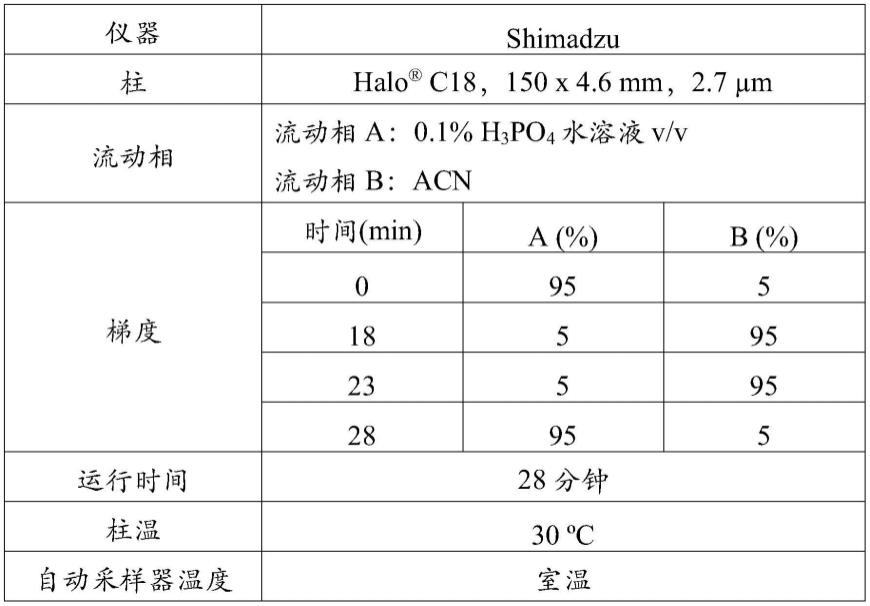
片剂粘合剂(0.5
–
5%),
[0061]
在另一个实施方案中,本公开涉及即释口服药物制剂,其包含埃佐加滨和作为药学上可接受的赋形剂的羟丙基甲基纤维素。羟丙基甲基纤维素(hpmc),也称作羟丙甲纤维素,为半合成的惰性粘弹性聚合物,其例如,用作滴眼液以及口服药物制剂以及其他商业产品中的赋形剂和受控递送的成分。
[0062]
众所周知,羟丙基甲基纤维素为用于下列应用的药学上可接受的赋形剂(使用典型重量(%w/w)):
[0063]
生物黏附材料(《5%);
[0064]
包衣剂(《5%);
[0065]
控释剂(10
–
80%);
[0066]
分散剂(0.25
–
5%);
[0067]
延长释放剂(10
–
80%);
[0068]
成膜剂(2
–
20%);
[0069]
起泡剂(《1%);
[0070]
制粒助剂(2
–
5%);
[0071]
黏膜黏附剂(0.1%);
[0072]
释放调节剂(10
–
80%);
[0073]
增溶剂(《1%);
[0074]
稳定剂(《5%);
[0075]
悬浮剂(《5%);
[0076]
持续释放剂(10
–
80%);
[0077]
片剂粘合剂(2
–
5%);以及
[0078]
增粘剂(0.45
–
1%)。
[0079]
在一个实施方案中,本公开涉及即释口服药物制剂,其包含埃佐加滨和作为药学上可接受的赋形剂的丁羟甲苯。丁羟甲苯(bht),也称作二丁基羟基甲苯或2,6-二叔丁基-4-甲基苯酚,为亲脂性有机化合物,化学上为苯酚的衍生物,因其抗氧化特性而适用。
[0080]
在一个实施方案中,本公开涉及即释口服药物制剂,其包含埃佐加滨和作为药学上可接受的赋形剂的交聚维酮。交聚维酮,优选polyplasdone用作药物中的固体口服剂型的崩解剂和溶出剂,且甚至有效有用难溶性剂型。崩解剂为片剂制备中使用的药学上可接受的赋形剂,其使得片剂在与湿气接触时崩解并且释放其活性药物成分。
[0081]
众所周知,polyplasdone为药学上可接受的赋形剂,作为片剂崩解剂,其浓度为约0.1%w/w至约10%w/w,优选约2%w/w至约5%w/w。
[0082]
在某些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其选自淀粉、微晶纤维素、聚乙烯吡咯烷酮、羟丙基甲基纤维素、丁羟甲苯和交聚维酮。
[0083]
在某些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和两种或更多种药学上可接受的赋形剂,其选自淀粉、微晶纤维素、聚乙烯吡咯烷酮、羟丙基甲基纤维素、丁羟甲苯和交聚维酮。
[0084]
在某些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和三种或更多种药学上可接受的赋形剂,其选自淀粉、微晶纤维素、聚乙烯吡咯烷酮、羟丙基甲基纤维素、丁羟甲苯和交聚维酮。
[0085]
在某些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和四种或更多种药学上可接受的赋形剂,其选自淀粉、微晶纤维素、聚乙烯吡咯烷酮、羟丙基甲基纤维素、丁羟甲苯和交聚维酮。
[0086]
在某些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和药学上可接受的赋形剂,其选自淀粉、微晶纤维素、羟丙基甲基纤维素、丁羟甲苯和/或交聚维酮。
[0087]
在某些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中每种药学上可接受的赋形剂的存在浓度为约0.01%w/w至约99%w/w。
[0088]
在某些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其选自淀粉、微晶纤维素、羟丙基甲基纤维素、聚乙烯吡咯烷酮、丁羟甲苯和/或交聚维酮,其中每种药学上可接受的赋形剂的存在浓度为约0.01%w/w至约99%w/w。
[0089]
在某些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其选自淀粉、微晶纤维素、羟丙基甲基纤维素、聚乙烯吡咯烷酮、丁羟甲苯和/或交聚维酮,其中淀粉的存在浓度为约5.0%w/w至约90%w/w;微晶纤维素的存在浓度为约5.0%w/w至约90%w/w;羟丙基甲基纤维素的存在浓度为约0.1%w/w至约80%w/w;丁羟甲苯的存在浓度为约0.001%w/w至约2.0%w/w;聚乙烯吡咯烷酮的存在浓度为约0.1%w/w至约25%w/w;且交聚维酮的存在浓度为约1.0%w/w至约10%w/w。
[0090]
在某些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其选自淀粉、微晶纤维素、羟丙基甲基纤维素、丁羟甲苯和交聚维酮,其中淀粉的存在浓度为约5.0%w/w至约90%w/w;微晶纤维素的存在浓度为约5.0%w/w至约90%w/w;羟丙基甲基纤维素的存在浓度为约0.1%w/w至约80%w/w;丁羟甲苯的存在浓度为约0.001%w/w至约2.0%w/w;且交聚维酮的存在浓度为约1.0%w/w至约10%w/w。
[0091]
在本发明的一些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其选自淀粉、微晶纤维素、羟丙基甲基纤维素、丁羟甲苯和交聚维酮,其中淀粉的存在浓度为约20.0%w/w至约90%w/w;微晶纤维素的存在浓度为约15.0%w/w至约45%w/w;羟丙基甲基纤维素的存在浓度为约5.0%w/w至约20%w/w;丁羟甲苯的存在浓度为约0.01%w/w至约0.10%w/w;且交聚维酮的存在浓度为约1.0%w/w至约10%w/w。
[0092]
在本发明的一些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其选自淀粉、微晶纤维素、羟丙基甲基纤维素、丁羟甲苯和交聚维酮,其中淀粉的存在浓度为约20.0%w/w;微晶纤维素的存在浓度为约45%w/w;羟丙基甲基纤维素的存在浓度为约5.0%w/w;丁羟甲苯的存在浓度为约0.01%w/w;且交聚维酮的存在浓度为约10%w/w。
[0093]
本发明药物制剂的给药范围
[0094]
在一些实施方案中,本公开涉及即释口服药物制剂,其包含有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,用于治疗儿童癫痫和/或癫痫发作病症,特别用于治疗kcnq2相关新生儿发育性和癫痫性脑病(kcnq2-dee),其中该即释口服药物制剂能够灵活地基于体重给药,而不需要临时混合活性药剂。
[0095]“基于体重给药”是指用与受试者体重成正比的药物剂量对受试者给药的实践。这与相反,固定强度给药中对受试者以不依赖于其体重的方式给药。基于体重给药方案的一个实例为“每天两次每千克体重服用3毫克药物”,而固定强度给药的一个实例为“每天两次服用250毫克药物”。基于体重给药在儿科环境中特别常见,因为与成人相比时,儿科受试者(即,儿童)的体重范围通常更大。
[0096]
在一些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加
滨和一种或多种药学上可接受的赋形剂,其中将该即释口服药物制剂经口施用于哺乳动物,优选人,更优选儿童,每日1次(qd),即每24小时1次剂量。
[0097]
在一些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中将该即释口服药物制剂经口施用于哺乳动物,优选人,更优选儿童,每日2次(bid),即每24小时2次剂量。
[0098]
在一些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中将该即释口服药物制剂经口施用于哺乳动物,优选人,更优选儿童,每日3次(tid),即每24小时3次剂量。
[0099]
在一些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中将该即释口服药物制剂经口施用于哺乳动物,优选人,更优选儿童,每日4次(qid),即每24小时4次剂量。
[0100]
在一些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中埃佐加滨的治疗有效量为约1毫克/千克/剂量和7毫克/千克/剂量。
[0101]
在某些实施方案中,作为每24小时1次剂量经口施用于哺乳动物,优选人,更优选儿童的本技术中公开的即释口服药物制剂中埃佐加滨的治疗有效量为约1毫克/千克/天至约7毫克/千克/天。
[0102]
在某些实施方案中,作为每24小时2次剂量经口施用于哺乳动物,优选人,更优选儿童的本技术中公开的即释口服药物制剂中埃佐加滨的治疗有效量为约2毫克/千克/天至约14毫克/千克/天。
[0103]
在某些实施方案中,作为每24小时3次剂量经口施用于哺乳动物,优选人,更优选儿童的本技术中公开的即释口服药物制剂中埃佐加滨的治疗有效量为约3毫克/千克/天至约21毫克/千克/天。
[0104]
在某些实施方案中,作为每24小时4次剂量经口施用于哺乳动物,优选人,更优选儿童的本技术中公开的即释口服药物制剂中埃佐加滨的治疗有效量为约4毫克/千克/天至约28毫克/千克/天。
[0105]
在一些实施方案中,本公开涉及如本技术中公开的个体即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中该个体即释口服药物制剂提供了期望的每日剂量的治疗有效量的埃佐加滨。
[0106]
在一些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中埃佐加滨的存在浓度为约1%w/w至约30%w/w。
[0107]
在一些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中埃佐加滨的存在浓度为约5%w/w至约20%w/w。
[0108]
在一些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中埃佐加滨的存在浓度为约10%w/w至约20%w/w。
[0109]
在一些实施方案中,本公开涉及即释口服药物制剂,其包含治疗有效量的埃佐加
滨和一种或多种药学上可接受的赋形剂,其中埃佐加滨的存在浓度为约20%w/w。
[0110]
为了涵盖本技术中公开的即释口服药物制剂的所有个体剂量,其中埃佐加滨的存在浓度为约20%w/w,在约4mg(针对4kg婴儿1mg/kg剂量的即释口服药物制剂)至约140mg(针对20千克儿童17mg/kg剂量的即释口服药物制剂)的范围内,制备了本技术中公开的即释口服药物制剂的个体剂量的以下实施方案并将其填充到适当的容器,例如hpmc粉末胶囊或小药囊中:
[0111]
15mg的本发明的即释口服药物制剂(包含3mg埃佐加滨(20%w/w));
[0112]
60mg的本发明的即释口服药物制剂(包含12mg埃佐加滨(20%w/w));以及
[0113]
160mg的本发明的即释口服药物制剂(包含32mg埃佐加滨(20%w/w))。
[0114]
本发明的即释口服药物制剂的这些剂量在单独服用(例如15mg剂量的本发明的即释口服药物制剂,其包含3mg的埃佐加滨,每日1次、2次、3次或4次)或组合服用(例如作为一天第一次剂量的15mg剂量的本发明的即释口服药物制剂和作为一天第二次剂量的60mg的本发明的即释口服药物制剂等)时,可以有效地提供治疗有效量的埃佐加滨,其范围在1毫克/千克/剂量至7毫克/千克/剂量。例如,且不想限制于本公开的范围,如果以3毫克/千克/天3次剂量对10千克儿童给予治疗有效量的埃佐加滨,该儿童每24小时将接受30mg的埃佐加滨(以10毫克/千克/剂量)。如果本发明的即释口服药物制剂的每个剂量包含20%w/w的埃佐加滨,则该儿童每天将需要接受150mg的本发明的即释口服药物制剂(每个剂量为50mg的即释口服药物制剂),以便接受3毫克/千克/天的埃佐加滨。
[0115]
在一些实施方案中,本公开涉及通过将必要数量的个体剂量移入婴儿/儿童食品,例如但不限于母乳、婴儿配方食品、牛奶、豆奶、杏仁奶、坚果奶、果汁或软食(例如,苹果酱、布丁、酸奶、泥状食品),搅拌均匀,并且将该婴儿食品经口施用于有此需要的儿童,将个体剂量的本发明的即释口服药物制剂经口施用于儿童。
[0116]
本发明药物制剂的实用性
[0117]
在一些实施方案中,本公开涉及即释口服药物制剂,其包含有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,该药物制剂用于治疗哺乳动物,优选人,更优选儿童的癫痫和/或癫痫发作病症,其中癫痫和/或癫痫发作病症为kcnq2相关新生儿发育性和癫痫性脑病(kcnq2-dee)。
[0118]
存在强有力的人类基因验证和药理学证据,包括已出版的病例研究,这些研究支持使用本技术中公开的即释口服药物制剂作为kcnq2-dee的潜在治疗方法。kcnq2基因编码kv7.2电压门控钾通道。kcnq2中的功能缺失性错义突变可导致kcnq2-dee,其特征一般在于在出生后第一周内经常出现的每日多次治疗耐受性癫痫发作。本技术中公开的即释口服药物制剂可以具有更大的潜力来改善kcnq2-dee治疗的长期结果,因为埃佐加滨增强了由kv7.2/7.3通道介导的跨膜钾电流,从而可能逆转kcnq2-dee的潜在遗传异常。通过激活kv7.2/7.3通道,预期本技术中公开的即释口服药物制剂应稳定静息膜电位并降低脑兴奋性,并且除了减少癫痫发作外,还可能具有改善脑功能和认知发育的潜能。在先前出版的一份包含11名患者的病例报告中(millichap,j.j.等人,neurol.genet.,october 2016,2:1-5),埃佐加滨与6个月龄前接受治疗的4名婴儿中的3名和后来接受治疗的7名婴儿中的2名中的癫痫发作和/或发育改善有关。在该项研究中没有观察到严重的不良反应。包括对医疗记录的审查和对8名患有kcnq2-dee的儿童的家庭进行结构化访谈的另一项研究,这些儿童
以前曾被开具过埃佐加滨的处方(olson,h.等人,annual meeting of the american epilepsy society 2017:摘要3.176),也表明埃佐加滨有效且可耐受。在至少每周癫痫发作的6名患者中,有5名观察到癫痫发作频率持续改善,以及所有8名患者的发育或认知都有改善。
[0119]
在其它实施方案中,本技术中公开的即释口服药物制剂可用于治疗kcnq2相关新生儿发育性和癫痫性脑病(kcnq2-dee)、部分癫痫发作(例如单纯、复杂、继发性泛发性和局灶性发作)、泛发性癫痫发作(例如失神、肌阵挛、失张力、强直和强直阵挛性)和病症,其包括:光敏性癫痫、自我导致的晕厥、难治性癫痫、angelman综合征、良性运动性癫痫、cdkl5障碍、儿童和青少年失神癫痫、dravet综合征、额叶癫痫、glut1缺乏综合征、下丘脑错构瘤、婴儿痉挛症/west综合征、青少年肌阵挛癫痫、landau-kleffner综合征、lennox-gastaut综合征(lgs)、伴有肌阵挛失神的癫痫、大田原(ohtahara)综合征、panayiotopoulos综合征、pcdh19癫痫、进行性肌阵挛性癫痫、rasmussen综合征、20号环状染色体综合征、反射性癫痫、颞叶癫痫、lafora进行性肌阵挛性癫痫、神经皮肤综合征、复合型结节性硬化症、早期婴儿癫痫性脑病、早发性癫痫性脑病、泛化性癫痫伴热性惊厥+(gefs+)、rett综合征、多发性硬化症、阿尔茨海默病、孤独症、共济失调、张力减退和发作性运动障碍。
[0120]
在一些实施方案中,本公开涉及治疗哺乳动物的癫痫和/或癫痫发作病症,特别是kcnq2相关新生儿发育性和癫痫性脑病(kcnq2-dee)的方法,其中该方法包括向有此需要的哺乳动物经口施用本技术中公开的即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂。
[0121]
在一些实施方案中,本公开涉及治疗人的癫痫和/或癫痫发作病症,特别是kcnq2相关新生儿发育性和癫痫性脑病(kcnq2-dee)的方法,其中该方法包括向有此需要的哺乳动物经口施用本技术中公开的即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂。
[0122]
在一些实施方案中,本公开涉及治疗儿童的癫痫和/或癫痫发作病症的方法,其中该方法包括向有此需要的哺乳动物经口施用本技术中公开的即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂。
[0123]
在一些实施方案中,本公开涉及治疗儿童的癫痫和/或癫痫发作病症的方法,其中该方法包括向有此需要的哺乳动物经口施用本技术中公开的即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中该即释口服药物制剂包含两种或更多种药学上可接受的赋形剂。
[0124]
在一些实施方案中,本公开涉及治疗儿童的癫痫和/或癫痫发作病症的方法,其中该方法包括向有此需要的哺乳动物经口施用本技术中公开的即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中该即释口服药物制剂包含两种或更多种药学上可接受的赋形剂,其中每种药学上可接受的赋形剂的存在浓度为约0.01%w/w至约99%w/w。
[0125]
在一些实施方案中,本公开涉及治疗哺乳动物的癫痫和/或癫痫发作病症,特别是kcnq2相关新生儿发育性和癫痫性脑病(kcnq2-dee)的方法,其中该方法包括向有此需要的哺乳动物经口施用本技术中公开的即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中埃佐加滨的存在浓度为约1%w/w至约30%w/w。
[0126]
在一些实施方案中,本公开涉及治疗哺乳动物的癫痫和/或癫痫发作病症,特别是kcnq2相关新生儿发育性和癫痫性脑病(kcnq2-dee)的方法,其中该方法包括向有此需要的哺乳动物经口施用本技术中公开的即释口服药物制剂,其包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中该即释口服药物制剂包含该即释口服药物制剂的约20%w/w浓度的埃佐加滨;该即释口服药物制剂的约5.0%w/w浓度的hpmc;该即释口服药物制剂的约20%w/w浓度的淀粉;该即释口服药物制剂的约45%w/w浓度的mcc;该即释口服药物制剂的约0.01%w/w浓度的丁羟甲苯;以及该即释口服药物制剂的约10.0%w/w浓度的交聚维酮。
[0127]
本发明药物制剂的制备及其稳定性和溶出研究
[0128]
本技术中公开的即释口服药物制剂的开发和制备使用了改进的质量源于设计的方法。埃佐加滨表现出低水溶性和高渗透性,因此在生物药剂学分类系统中被归类为第2类化合物。因此,通过埃佐加滨和不同赋形剂的不同制剂的加速条件(40℃,75%相对湿度)稳定性研究确定了埃佐加滨的赋形剂相容性。还测定了先导制剂的体外溶出特性。
[0129]
然后通过滚压对具有最富有希望的溶出特性的制剂进行干法制粒,并在稳定性评估之前重新测试溶出度。
[0130]
还测定了埃佐加滨载量对溶出性能的影响,以及本发明的即释口服药物制剂与常规塑料,例如用于进食瓶和鼻胃进食管中的塑料的非特异性结合的可能性。
[0131]
然后将本发明的优选即释口服药物制剂推进到大鼠药代动力学(pk)研究,以便证实其体内生物药剂性能,并进行长期稳定性研究。
[0132]
应当理解,本领域技术人员将能够通过本领域技术人员已知的方法制备本技术中公开的即释口服药物制剂,如下文实施例1-20具体示例的。还应理解,本领域技术人员将能够以类似的方式通过使用适当的成分并根据需要修改制剂的参数来制备下文未具体示例的本发明的其他即释口服药物制剂。
[0133]
因此,在一些实施方案中,本公开涉及制备本技术中公开的即释口服药物制剂的方法,该即释口服药物制剂包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂。
[0134]
在一些实施方案中,本公开涉及制备本技术中公开的即释口服药物制剂的方法,该即释口服药物制剂包含治疗有效量的埃佐加滨和两种或更多种药学上可接受的赋形剂。
[0135]
在一些实施方案中,本公开涉及制备本技术中公开的即释口服药物制剂的方法,该即释口服药物制剂包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中每种药学上可接受的赋形剂的存在浓度为约0.01%w/w至约99%w/w。
[0136]
在一些实施方案中,本公开涉及制备如本技术中公开的即释口服药物制剂的方法,该即释口服药物制剂包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中埃佐加滨的存在浓度为约1%w/w至约30%w/w。
[0137]
在一些实施方案中,本公开涉及制备本技术中公开的即释口服药物制剂的方法,该即释口服药物制剂包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中即释口服药物制剂如本技术中实施例1、实施例2、实施例3、实施例4、实施例5、实施例6、实施例7、实施例8、实施例9、实施例10、实施例11、实施例12、实施例13、实施例14、实施例15、实施例16、实施例17、实施例18、实施例19或实施例20中所公开。
[0138]
在一些实施方案中,本公开涉及制备本技术中公开的即释口服药物制剂的方法,该即释口服药物制剂包含治疗有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,其中该即释制剂包含该即释口服药物制剂的约20%w/w浓度的埃佐加滨;该即释口服药物制剂的约5.0%w/w浓度的hpmc;该即释口服药物制剂的约20%w/w浓度的淀粉;该即释口服药物制剂的约45%w/w浓度的mcc;该即释口服药物制剂的约0.01%w/w浓度的丁羟甲苯;以及该即释口服药物制剂的约10.0%w/w浓度的交聚维酮。
[0139]
在一些实施方案中,本公开涉及制备如本技术中公开的即释口服药物制剂的方法,其中该制备包括将所属的成分混合在一起,随后制粒。
[0140]
在一些实施方案中,将本技术中制备的粒化即释口服药物制剂封装在容器中,该容器可以为安瓿、胶囊、小药囊、纸或其他容器的形式。在一些实施方案中,本技术中公开的粒化制剂的容器为胶囊(明胶或hpmc)、粉末胶囊(明胶或hpmc)、小药囊、棒状包装或预填充的经口注射器(其中可将颗粒悬浮在适合的载体中)。在一些实施方案中,用于本技术中公开的粒化制剂的容器为小瓶、安瓿或泡罩包装。
[0141]
在一些实施方案中,将本技术中公开的粒化即释口服药物制剂封装在小药囊内。小药囊典型地为箔袋或塑料袋,其中填充有本技术中公开的粒化即释口服药物制剂,且然后密封。小药囊优选包含单剂量。
[0142]
在一些实施方案中,将本技术中公开的粒化即释口服药物制剂封装在粉末胶囊中。粉末胶囊类似于标准2-部分明胶胶囊或hpmc胶囊,不同之处在于它们被设计以更容易打开(将帽与底座分离是通过四分之一圈的扭转完成的,并且两个部分很容易分离)。相反,标准2-部分明胶胶囊或hpmc胶囊必须被拉开,这可能导致其中所含的粒状制剂因溢出而损耗。
[0143]
本发明代表性药物制剂的稳定性研究的实验方法
[0144]
通过充分混合活性药物成分(埃佐加滨)和如下表2中所示的相关的药学上口服的赋形剂,制备了约200mg的每种本发明的代表性即释口服药物制剂。将实施例1-8的代表性制剂在储存前以及在设置维持40
±
2℃和75
±
5%相对湿度的稳定性隔室中的开口玻璃瓶中储存4周后进行分析。使用以下方法对代表性制剂进行稳定性分析,且如下表1中所述测定了总相关物质(即,降解物)的总和,其中“acn”为乙腈:
[0145]
表1
[0146][0147][0148]
在一些实施方案中,正如实施例1-8中所示的,在生产如下表2中所示的稳定即释制剂的过程中,与使用作为粘合剂的hpmc组合的本发明即释口服药物制剂中的微晶纤维素(mcc)/淀粉系统看起来与埃佐加滨最相容,其中pvp为聚(乙烯吡咯烷酮),hpmc为(羟丙基)甲基纤维素,且bht为丁羟甲苯:
[0149]
表2
[0150][0151]
*在40℃/75%相对湿度下开放储存4周后,通过hplc/uv分析的总相关物质(trs)(即,降解物)的百分比增加。
[0152]
本发明代表性药物制剂的溶出评价的实验方法
[0153]
使用下表3中列出的参数进行本发明的代表性即释口服药物制剂、即如下表5中所示的实施例9-20的溶出度评估:
[0154]
表3
[0155][0156]
使用如下表4中所示的下列方法,通过hplc测定了每个时间点时释放的埃佐加滨的百分比:
[0157]
表4
[0158]
[0159][0160]
在一些实施方案中,向包含治疗有效量的20%w/w的埃佐加滨的本发明的即释口服药物制剂中添加崩解剂,发现埃佐加滨的优良释放,如下表5中所示(其中"ex."是指实施例):
[0161]
表5
[0162]
[0163][0164]
*ph 1(0.1n hcl),37℃,n=6
[0165]
正如上述结果所证实的,将崩解剂,例如polyplasdone xl掺入本发明的即释口服药物制剂导致溶出特性显著改善(参见实施例#12对实施例#9)。此外,使用20%w/w浓度的埃佐加滨得到了优良结果(参见实施例#12对实施例#16)。
[0166]
在一个实施方案中,将上述实施例#12制粒(通过滚压干法制粒),得到本发明的即释口服药物制剂。制粒后,在usp ph 1.2缓冲液中在37℃下测定了埃佐加滨(纯)和粒状即释口服药物制剂的溶出特性。如图1种所示,该即释制剂的溶出曲线与即释药物产品一致。
[0167]
在一个实施方案中,当在约5℃至约50℃的温度下保持时,本发明的即释口服药物制剂将稳定约1个月至约5年的时间期限。更优选地,当在约5℃至约45℃的温度下保持时,本发明的即释口服药物制剂将稳定约6个月至约4年的时间期限。甚至更优选地,当在约25℃至约40℃的温度下保持时,本发明的即释口服药物制剂将稳定约6个月至约3年的时间期限。在一个更优选的实施方案中,当在约25℃至约40℃的温度下保持一定时间期限,例如1年,优选2年时,所述即释口服药物制剂稳定。更优选地,所述即释口服药物制剂稳定3年。
[0168]
本发明药物制剂的儿科给药相容性研究
[0169]
在一个实施方案中,本公开涉及即释口服药物制剂,其包含有效量的埃佐加滨和一种或多种药学上可接受的赋形剂,该即释口服药物制剂可用于治疗儿童的癫痫和/或癫痫发作病症。因此,期望本发明的即释口服药物制剂与儿科给药的身体参数相容,并且活性药物成分与婴儿奶瓶和儿科鼻胃饲管中常用材料的非特异性结合可忽略不计。因此,对本发明的代表性即释口服药物制剂进行了以下研究。
[0170]
本发明代表性药物制剂的粒径分布
[0171]
为了本发明的即释口服药物制剂与对儿童的口服相容,即释口服药物制剂的粒径分布在直径上通常必须小于典型婴儿奶瓶奶嘴孔的直径(即,》500μm)并且直径小于典型儿科鼻胃(ng)饲管的内径(例如,size 4french(fr)ng儿科饲管中的1330μm)。
[0172]
因此,使用mastersizer 3000(malvern panalytical ltd.,westborough,ma,usa)通过激光散射,测定了本发明的代表性即释口服药物制剂(即实施例#12)的粒径分布。本研究中采用了10秒的背景测量时间、30秒的样品测量时间、0.5barg的气压和60%的进料速率。本研究的结果公开在下表6中:
[0173]
表6
[0174]
实施例#12的粒径分布大小(微米)d
10
13.4
±
0.4d
50
41.6
±
1.6d
90
153
±
31
[0175]
正如结果表明的,实施例#12样品中10%的颗粒小于13微米;同一样品中50%的颗粒小于42微米(即,中值粒径);并且同一样品中90%的颗粒小于153微米。因此,实施例#12的颗粒总体上小到足以通过典型婴儿奶瓶奶嘴的孔或通过儿科鼻胃饲管。
[0176]
本发明代表性药物制剂的非特异性结合
[0177]
为了评估本发明代表性即释口服药物制剂的非特异性结合,进行了以下评估。
[0178]
用纯水(1000ml)稀释本发明的代表性即释药物组合物,即实施例#12,超声处理15分钟并通过0.45μm过滤器过滤。将滤液转移到由相关材料(玻璃、聚醚砜、聚苯砜或聚丙烯)制成的瓶子中并手摇1分钟。然后取出1ml的等分试样,并使用下表7中的如下hplc方法分析浓度(对照校准曲线):
[0179]
表7
[0180]
[0181][0182]
上述评估表明,活性药物成分(即,埃佐加滨)与婴儿奶瓶和儿科鼻胃饲管中常用材料仅有可忽略不计的非特异性结合,如下表8中所示:
[0183]
表8
[0184]
材料api的收率(%)玻璃100.0聚醚砜96.9聚苯砜96.7聚丙烯96.5
[0185]
本发明代表性即释口服药物制剂和的药代动力学比较
[0186]
一种埃佐加滨的片剂,适应于并且上市销售用于成人群体。然而,儿科神经科医生在可获得期间在儿科群体中在其批准的适应证之外使用它(例如,参见,millichap等人)。应当理解,儿童,尤其是年少儿童,通常不能吞咽成人固体口服剂型,例如片剂或胶囊。典型地,因此将拿到配药药房,在那里将其压碎(例如,在研钵中用研杵)并以固定浓度(例如,5mg/ml)悬浮在适合的液体载体中。然后,将这种配合形式的埃佐加滨基于体积施用于儿科患者(例如,对于50mg剂量,将施用10ml的5mg/ml混悬液)。因此,设计了如下所述的大鼠交叉药代动力学研究以纳入一个给药组,该给药组施用一种类似于悬浮、粉碎的的制剂。
[0187]
测试制品:
[0188]
实施例#12的即释制剂。
[0189]
粉碎的片剂(以模拟在此前儿科临床实践中的配合)。
[0190]
测试动物:
[0191]
雄性sprague-dawley大鼠,n=6
[0192]
给药
[0193]
将10mg/kg测试制品混悬(1mg/ml)于0.02%w/v(羧甲基)纤维素(cmc)水溶液(粘度-与婴儿配方奶匹配)中并且通过经口管饲法对测试动物给药。
[0194]
该药代动力学研究的结果如图2中所示,其具有以下生物利用度参数,其中“c
max”是指观察到的最大血浆浓度,“auc”是指血浆浓度与时间曲线下面积,“auc
0-last”是指从零时间到最后一次可检测血浆浓度的auc,且“auc
0-inf”是指从零时间到无穷大的auc:
[0195]
参数c
max
auc
0-last
auc
0-inf
95%置信区间的下限105.494.994.9几何平均比的点估计值115.1108.0108.095%置信区间的上限125.7122.9122.9
[0196]
结果表明,当对大鼠经口施用时,本发明的代表性即释口服药物制剂表现出与配合的相似的生物利用度。
[0197]
本发明药物制剂的体内药代动力学研究
[0198]
如下文更详细描述的,在本发明的另一个实施方案中,进行了1期临床研究以确定本发明的即释口服药物制剂中埃佐加滨的药代动力学特征。具体而言,在进食或禁食状态下给予健康成人志愿者包含400mg埃佐加滨的单剂量(2.0克)的本发明的即释口服药物制剂,并且测定埃佐加滨的血浆药代动力学。7天间歇期后,再次给予相同志愿者包含400mg埃佐加滨的单剂量(2.0克)的本发明的即释口服药物制剂;然而,那些以前在进食状态下接受过即释口服药物制剂的志愿者现在在禁食状态下接受它,反之亦然。再次测定埃佐加滨的血浆药代动力学。将2.0克剂量的本发明即释口服药物制剂包装在一次性小药囊中用于本研究。
[0199]
1期临床研究方案
[0200]
进行了1期、单中心、公开标签、随机化、单剂量、2因素交叉临床研究,以评估口服本发明的即释制剂,特别是实施例#12的即释制剂后,食物对埃佐加滨药代动力学(pk)的影响。还评估了该制剂的安全性和耐受性。
[0201]
设计本研究以包括总计约24名健康男性和女性受试者。符合所有入选标准且没有任何排出标准的受试者有资格进入本研究。
[0202]
每个受试者在禁食条件下接受单剂量的实施例#12的即释制剂(下文称作“处理a”),其被认为是参比处理,以及在进食条件下单剂量的实施例#12的即释制剂(下文称作“处理b”),其被认为是测试处理。受试者被随机同等分配到2个处理序列中的1个:处理序列1,即处理a,然后是处理b,或处理序列2,即处理b,然后是处理a,其中每个处理序列有12名受试者。
[0203]
在筛查访问之后,有资格的受试者返回诊所进行2个诊所内处理期(第1天和第6天),每个处理期在两次剂量之间间隔7天间歇期。
[0204]
对于每个受试者,研究由如下各项组成:
[0205]
1.长达28天的资格筛查期。
[0206]
2.两个处理期,每个处理期包括处理a或处理b。
[0207]
3.在每个处理期中从剂量前直到研究药物施用后48小时为pk目的的安全性评估、血液和唾液采样。
[0208]
4.在每个处理期中收集48小时pk样本后出院。
[0209]
5.从第2期出院后随访7天(+/-3天)。
[0210]
对于每个研究期间,受试者接受以下2种处理中的1种:
[0211]
处理a:在禁食条件下单剂量的400mg埃佐加滨(作为实施例#12的制剂的一个2.0g小药囊)。
[0212]
处理b:在进食条件下单剂量的400mg埃佐加滨(作为实施例#12的制剂的一个2.0g小药囊)。
[0213]
通过打开2.0g小药囊并将内容物分散在8盎司水中,然后由受试者在进食状态(恰在早餐后)或禁食状态(早餐前2小时)喝掉它,口服单剂量的400mg埃佐加滨。
[0214]
如下所示,将总计24名受试者随机分配到2个处理序列中的1个(序列1或序列2)中,其中n为受试者的数量,且pk为药代动力学:
[0215][0216]
在每次施用实施例#12的制剂之前和之后0.25、0.5、1、1.5、2、3、4、8、12、24和48小时从受试者收集用于埃佐加滨的pk评估的静脉血样。使用经过验证的液相色谱/串联质谱(lc/ms-ms)方法对埃佐加滨进行血浆生物分析。
[0217]
pk数据集包括21个可评估受试者。
[0218]
1期临床研究的结果
[0219]
1期临床研究的结果如下表9中所示,其中h为小时,l为升,f为生物利用度(施用剂量的系统利用度),cv为变异系数,n为受试者的数量,sd为标准偏差,c
max
为最大观察浓度,t
max
为最大观察浓度的时间,如果它发生在超过一个时间点,则将t
max
定义为具有该值的第一个时间点),auc
0-t
为从时间0到最后观察到的可量化浓度的时间的浓度-时间曲线下面积,auc
0-inf
为外推至无穷大的浓度-时间曲线下面积,t1/2为末端消除半衰期,vz/f为末端消除阶段中的表观分布容积,cl/f为表观总血浆清除率,其被计算为剂量/auc
0-inf
。
[0220]
表9
[0221][0222][0223]
药代动力学结论
[0224]
与禁食状态相比,在进食条件下(即,使用具有来自脂肪的膳食总热量的约50%的高脂肪膳食)施用400mg单剂量的埃佐加滨(作为2.0g实施例#12的制剂)略微降低并且延迟了埃佐加滨的峰值血浆浓度,但对系统暴露程度没有显著影响。因此,尽管因为在单剂量施用实施例#12的制剂后食物的施用对埃佐加滨的吸收速率显示出统计学上显著的影响而没
有完全证实不存在食物效应,但如图3中所示,如果在禁食或进食状态下口服本发明的即释制剂,特别是实施例#12的即释制剂,则不会显著影响埃佐加滨的系统暴露。
[0225]
此外,上述结果表明,在口服400mg单剂量埃佐加滨(2.0g实施例#12的制剂)后,相对于在禁食状态下施用时,当与高脂肪餐一起施用时埃佐加滨的中位t
max
延迟了1小时。然而,当在任一状态下口服时,实施例#12制剂中的埃佐加滨可充分生物利用(埃佐加滨在体内广泛分布,在进食和禁食状态下vz/f分别为658l和754l,埃佐加滨的消除半衰期(t
1/2
)为7小时至9小时)。
[0226]
因此,本发明的即释制剂,特别是实施例#12的即释制剂,当在禁食或进食状态下口服时将在治疗受试者(优选儿童)的癫痫和/或癫痫发作病症,特别是kcnq2相关新生儿发育性和癫痫性脑病(kcnq2-dee)中提供治疗效果。
[0227]
*****
[0228]
本说明书中涉及的所有美国专利、美国专利申请公布号、美国专利申请、外国专利、外国专利申请和非专利出版物通过引用以其全部内容在不与本说明书不一致的程度上被并入本技术。2019年12月2日提交的美国临时申请号no.62/942,579通过引用以其全部内容并入本技术。
[0229]
尽管为了便于理解,已经对前述发明进行了一些详细的描述,但显然可以在所附权利要求的范围内实施某些改变和变型。因此,所述的实施方案被视为示例性的而不是限制性的,并且本发明不限于本技术中给出的细节,而是可以在所附权利要求的范围和等效方案内进行变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1