作为Kv1.3钾SHAKER通道阻滞剂的芳基杂二环化合物的制作方法
作为kv1.3钾shaker通道阻滞剂的芳基杂二环化合物
1.本技术要求2019年10月7日提交的美国临时专利申请号的权益和优先权,其内容经此通过引用以其全文并入本文。
2.本专利公开含有受版权保护的材料。版权所有者不反对对美国专利商标局专利文件或记录中出现的专利文件或专利公开内容进行副本复制,但在其它方面保留任何和所有版权权利。
3.通过引用并入本文中引用的所有文献通过引用以其全文并入本文。
技术领域
4.本发明大体上涉及药物科学领域。更特别地,本发明涉及可用作作为钾通道阻滞剂的药物的化合物和组合物。
5.发明背景电压门控的kv1.3钾(k
+
)通道在淋巴细胞(t和b淋巴细胞)、中枢神经系统和其它组织中表达,并调节大量生理过程,如神经递质释放、心率、胰岛素分泌和神经元兴奋性。kv1.3通道可以调节膜电位,并由此间接影响人效应记忆性t细胞(“tem”)中的钙信号传导。tems是几种病症的介质,所述病症包括多发性硬化(“ms”)、i型糖尿病、银屑病、脊椎炎、牙周炎和类风湿性关节炎。在激活后,tem提高kv1.3通道的表达。在人b细胞中,当初始和早期记忆性b细胞静止时,其表达少量的kv1.3通道。相反,类别转换的记忆性b细胞表达高数量的kv1.3通道。此外,kv1.3通道促进t细胞受体介导的细胞活化、基因转录和增殖所需的钙稳态(panyi,g.等人,2004,trends immunol.,565-569)。效应记忆性t细胞中kv1.3通道的阻断抑制了如钙信号传导、细胞因子产生(例如干扰素γ、白介素2)和细胞增殖的活性。
6.自身免疫性疾病是一类由机体的自身免疫系统攻击引起的组织损伤所导致的病症。此类疾病可影响单个器官,如在ms和i型糖尿病中,或者可涉及多个器官,如在类风湿性关节炎和系统性红斑狼疮的情况下。治疗通常是姑息性的,使用抗炎和免疫抑制药物,其可以具有严重的副作用。对更有效的疗法的需求导致了对可以选择性抑制已知参与自身免疫性疾病病因的tem的功能的药物的研究。这些抑制剂被认为能够改善自身免疫疾病症状而不折衷保护性免疫反应。tem表达大量kv1.3通道,并且它们的功能依赖于这些通道。在体内,kv1.3通道阻滞剂在炎症部位麻痹tem并防止它们在发炎组织中再活化。kv1.3通道阻滞剂不影响初始和中央记忆型忆t细胞的淋巴结内运动性。通过选择性阻断kv1.3通道来抑制这些细胞的功能提供了以最小副作用有效治疗自身免疫性疾病的潜力。
7.ms是由对中枢神经系统(“cns”)的自身免疫性损伤引起的。症状包括肌无力和瘫痪,其严重影响患者的生活质量。ms快速且不可预知地进展,并最终导致死亡。kv1.3通道也在来自ms患者的自身反应性tem中高度表达(wulff h.等人,2003,j.clin.invest.,1703-1713;rus h.等人,2005,pnas,11094-11099)。已经成功地用kv1.3通道的阻滞剂治疗了ms的动物模型。
8.作为选择性kv1.3通道阻滞剂的化合物由此是作为免疫抑制剂或免疫系统调节剂
的潜在治疗剂。kv1.3通道也被认为是治疗肥胖和增强2型糖尿病患者中外周胰岛素敏感性的治疗靶标。这些化合物也可以用于预防移植排斥和治疗免疫(例如自身免疫)和炎症性病症。
9.肾小管间质纤维化是在肾实质上的进行性结缔组织沉积,导致肾功能退化,并涉及慢性肾病、慢性肾衰竭、肾炎和肾小球炎症的病理,并且是终末期肾衰竭的常见原因。淋巴细胞中kv1.3通道的过度表达可以促进其增殖,导致慢性炎症和细胞免疫的过度刺激,其参与这些肾病的基础病理学,并且是肾小管间质纤维化进展的促成因素。抑制淋巴细胞kv1.3通道电流抑制了肾淋巴细胞的增殖,并改善了肾纤维化的进展(kazama i.等人,2015,mediators inflamm.,1-12)。
10.kv1.3通道还在胃肠病中起作用,包括炎症性肠病(“ibd”)如溃疡性结肠炎(“uc”)和克罗恩病。uc是一种慢性ibd,其特征在于过度的t细胞浸润和细胞因子产生。uc可以损害生活质量,并可以导致危及生命的并发症。uc患者发炎粘膜中cd4和cd8阳性t细胞中kv1.3通道的高水平与活性uc中促炎化合物的产生相关。kv1.3通道被认为充当疾病活性的标志物,并且药理学阻断可能构成uc中新的免疫抑制策略。目前uc的治疗方案,包括皮质类固醇、水杨酸盐和抗tnf-α试剂,对许多患者来说是不够的(hansen l.k.等人,2014,j.crohns colitis,1378-1391)。克罗恩病是一类ibd,其可能影响胃肠道的任何部分。克罗恩病被认为是由于正常安全的细菌引发的t细胞驱动的过程导致的肠道炎症的结果。由此,kv1.3通道抑制可以用于治疗克罗恩病。
11.除t细胞外,kv1.3通道也在小神经胶质细胞中表达,其中该通道涉及炎症性细胞因子和一氧化氮产生以及小神经胶质细胞介导的神经元杀伤。在人类中,已经发现kv1.3通道在阿尔茨海默病患者的额皮质中的小神经胶质细胞中和在多发性硬化脑损伤的cd68
+
细胞上强烈表达。已经表明kv1.3通道阻滞剂可能能够优先靶向有害的促炎症性小胶质细胞功能。kv1.3通道在梗塞的啮齿动物和人脑中的活化的小神经胶质细胞上表达。在中风小鼠模型的梗塞半球急性分离的小神经胶质细胞中观察到比在对侧半球分离的小神经胶质细胞中更高的kv1.3通道电流密度(chen y.j.等人,2017,ann.clin.transl.neurol.,147-161)。
12.kv1.3通道的表达在人阿尔茨海默氏病大脑的小神经胶质细胞中升高,表明kv1.3通道是阿尔茨海默氏病中病理学相关的小神经胶质细胞靶标(rangaraju s.等人,2015,j.alzheimers dis.,797-808)。可溶性aβo增强小神经胶质细胞kv1.3通道活性。kv1.3通道是aβo诱导的小神经胶质细胞促炎激活和神经毒性所需的。kv1.3通道表达/活性在转基因阿尔茨海默氏病动物和人阿尔茨海默氏病大脑中上调。小神经胶质细胞kv1.3通道的药理学靶向可以影响海马突触可塑性并减少app/ps1小鼠中的淀粉样蛋白沉积。由此,kv1.3通道可能是阿尔茨海默病的治疗目标。
13.kv1.3通道阻滞剂也可以用于改善心血管病症如缺血性中风的病理,其中活化的小神经胶质细胞显著促进梗塞的继发性扩张。
14.kv1.3通道表达与多种细胞类型中的增殖、细胞凋亡和细胞存活的控制相关。这些过程对于癌症进展是至关重要的。在这种情况下,位于线粒体内膜中的kv1.3通道可以与细胞凋亡调节剂bax相互作用(serrano-albarras,a.等人,2018,expert opin.ther.targets,101-105)。由此,kv1.3通道的抑制剂可用作抗癌剂。
15.已知来自蜘蛛、蝎子和海葵的多种具有多个二硫键的肽类毒素阻断kv1.3通道。已经开发了一些选择性的、有效的kv1.3通道的肽抑制剂。具有非天然氨基酸的地毯海葵毒素(stichodactyla toxin)(“shk”)的合成衍生物(shk-186)是最先进的肽类毒素。shk已经证明在临床前模型中有效,并且目前处于银屑病治疗的i期临床试验。shk可以抑制tem的增殖,导致ms动物模型的改善状况。不幸的是,shk还结合到cns和心脏中发现的密切相关的kvi通道亚型上。需要kv1.3通道选择性抑制剂以避免潜在的心脏和神经毒性。此外,在施用后,小的肽如shk-186迅速从体内被清除,导致短的循环半衰期和频繁的给药事件。由此,需要开发用于治疗慢性炎症性病症的长效选择性kv1.3通道抑制剂。
16.由此,仍然需要开发新的kv1.3通道阻滞剂作为药物。
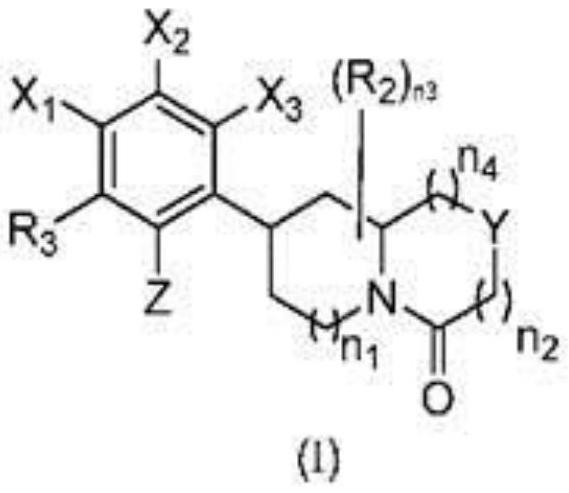
17.发明概述在一方面,描述了具有式i的结构的可用作钾通道阻滞剂的化合物,其中在本文中定义了各种取代基。本文中描述的式i的化合物可以阻断kv1.3钾(k
+
)通道,并可以用于治疗多种病症。在本文中还描述了合成这些化合物的方法。本文中描述的药物组合物和使用这些组合物的方法可用于在体外和体内治疗病症。此类化合物、药物组合物和治疗方法具有许多临床应用,包括作为用于治疗癌症、免疫学病症、中枢神经系统(cns)病症、炎症性病症、胃肠病、代谢病症、心血管病症、肾脏疾病或其组合的药物活性剂和方法。
18.在一方面,描述了式i的化合物或其可药用盐,其中y是c(r2)2、nr1或o;z是ora;x1是h、卤素或烷基;x2是h、卤素、cn、烷基、环烷基、卤代环烷基或卤代烷基;x3是h、卤素、卤代烷基或烷基;或者x1和x2与它们所连接的碳原子一起形成任选取代的5或6元芳基;或者x2和x3与它们所连接的碳原子一起形成任选取代的5或6元芳基;r1的每次出现独立地为h、烷基、链烯基、环烷基、杂烷基、环杂烷基、芳基、杂芳基、
(cr6r7)
n6
ora、(cr6r7)
n6
n(ra)2、(c=o)ra、(c=o)ora、(cr6r7)
n6
(c=o)nrarb、so2ra或(cr6r7)
n6-杂环;r2的每次出现独立地为h、卤素、cn、烷基、环烷基、杂烷基、环杂烷基、(cr6r7)
n6
ora、(cr6r7)
n6-杂环、(c=o)ora、(cr6r7)
n6
nra(c=o)ra、(cr6r7)
n6
n(ra)2、nra(cr6r7)
n6
ora、(c=o)nra(cr6r7)
n6
ora、(c=o)ra、(cr6r7)
n6
(c=o)nrarb、芳基或杂芳基,其中每个r2可连接到的碳环原子的任一个上;r3是h、烷基或卤素;r6和r7的每次出现独立地为h、烷基、环烷基、任选取代的芳基或任选取代的杂芳基;ra和rb的每次出现独立地为h、烷基、链烯基、环烷基、饱和杂环、芳基或杂芳基;或者ra和rb与它们所连接的氮原子一起形成任选取代的杂环;杂环包含1-3个各自选自n、o和s的杂原子;x1、x2、x3、r1、r2、r3、r6、r7、ra和rb中的烷基、环烷基、杂烷基、环杂烷基、杂环、芳基和杂芳基在适用的情况下各自独立和任选地被1-4个取代基取代,所述取代基各自独立地选自烷基、环烷基、卤代烷基,卤代环烷基、卤素、cn、r8、or8、-(ch2)
1-2
or8、n(r8)2、(c=o)r8、(c=o)n(r8)2、nr8(c=o)r8和氧代(在价态允许的情况下);r8的每次出现独立地为h、烷基、环烷基或任选被烷基取代的杂环;或者两个r8基团与它们所连接的氮原子一起形成任选被烷基取代并包含所述氮原子和0-3个各自选自n、o和s的附加杂原子的杂环;n1是0-1的整数;n2是0-2的整数;n3是0-3的整数;n4是1至2的整数;和n6是0-3的整数。
19.在任一个本文中所述的实施方案中,结构部分具有
的结构。
20.在任一个本文中所述的实施方案中,结构部分具有的结构。
21.在任一个本文中所述的实施方案中,该结构部分具有具有的结构。
22.在任一个本文中所述的实施方案中,结构部分具有
的结构。
23.在任一个本文中所述的实施方案中,结构部分具有的结构。
24.在任一个本文中所述的实施方案中,其中结构部分具有的结构。
25.在任一个本文中所述的实施方案中,结构部分具有的结构。
26.在任一个本文中所述的实施方案中,r1是h、烷基、链烯基、环烷基、杂烷基或环杂烷基。
27.在任一个本文中所述的实施方案中,r1是芳基或杂芳基。
28.在任一个本文中所述的实施方案中,r1是(c=o)ra、(c=o)ora、so2ra、(cr6r7)
n6
ora、(cr6r7)
n6
n(ra)2、(cr6r7)
n6
(c=o)nrarb或(cr6r7)
n6-杂环。
29.在任一个本文中所述的实施方案中,r1是(c=o)ra。
30.在任一个本文中所述的实施方案中,ra和rb各自独立地是h、烷基或被一个或多个
or8取代的烷基。
31.在任一个本文中所述的实施方案中,r8是h或烷基。
32.在任一个本文中所述的实施方案中,r1选自h、-ch3、-(ch2)2oh、-(ch2)2nh2、-conh2、-conhme、-conme2、-conet2、so2me和so2et。
33.在任一个本文中所述的实施方案中,r1选自
34.在任一个本文中所述的实施方案中,r1选自
35.在任一个本文中所述的实施方案中,r2的至少一次出现是h、卤素、cn、烷基、杂烷基、环烷基、环杂烷基、ora、n(r1)2、(c=o)ra、(c=o)nrarb、芳基或杂芳基。
36.在任一个本文中所述的实施方案中,r2的至少一次出现是(cr6r7)
n6
ora、(cr6r7)
n6-杂环、(c=o)ra、(c=o)ora、(cr6r7)
n6
nra(c=o)ra、(cr6r7)
n6
n(ra)2、nra(cr6r7)
n6
ora、(c=o)nra(cr6r7)
n6
ora或(cr6r7)
n6
(c=o)nrarb。
37.在任一个本文中所述的实施方案中,r2的至少一次出现是
bu、o-sec-bu或obu。
46.在任一个本文中所述的实施方案中,z是oh、ome或oet。
47.在任一个本文中所述的实施方案中,z是oh。
48.在任一个本文中所述的实施方案中,x1是h、卤素、me或et。
49.在任一个本文中所述的实施方案中,x1是h、f、cl、br或me。
50.在任一个本文中所述的实施方案中,x1是h或cl。
51.在任一个本文中所述的实施方案中,x2是h、卤素、氟代烷基或烷基。
52.在任一个本文中所述的实施方案中,x2是h、f、cl、br、me、cf2h、cf2cl或cf3。
53.在任一个本文中所述的实施方案中,x2是h或cl。
54.在任一个本文中所述的实施方案中,x3是h、f、cl、br、me、cf2h、cf2cl或cf3。
55.在任一个本文中所述的实施方案中,x3是h或cl。
56.在任一个本文中所述的实施方案中,r3是h。
57.在任一个本文中所述的实施方案中,r3是烷基。
58.在任一个本文中所述的实施方案中,r3是卤素。
59.在任一个本文中所述的实施方案中,r3是h、f、cl或me。
60.在任一个本文中所述的实施方案中,结构部分具有具有的结构。
61.在任一个本文中所述的实施方案中,化合物具有式ii’或ii的结构:
其中r3’
独立地为h、卤素或烷基;和n5是0-3的整数。
62.在任一个本文中所述的实施方案中,n5是0、1或2。
63.在任一个本文中所述的实施方案中,n5是0。
64.在任一个本文中所述的实施方案中,r3’
是h或烷基。
65.在任一个本文中所述的实施方案中,r3’
是卤素。
66.在任一个本文中所述的实施方案中,z是oh、ome、oet、opr、o-i-pr、o-t-bu、o-iso-bu、o-sec-bu或obu。
67.在任一个本文中所述的实施方案中,z是oh、ome或oet。
68.在任一个本文中所述的实施方案中,z是oh。
69.在任一个本文中所述的实施方案中,ra或rb的至少一次出现独立地为h、烷基、环烷基、饱和杂环、芳基或杂芳基。
70.在任一个本文中所述的实施方案中,ra或rb的至少一次出现独立地为h、me、et、pr或选自或选自或选自的杂环;其中当价态允许时,杂环任选被烷基、oh、氧代或(c=o)c1-4
烷基取代。
71.在任一个本文中所述的实施方案中,ra和rb与它们所连接的氮原子一起形成包含所述氮原子和0-3个各自选自n、o和s的附加杂原子的任选被取代的杂环。
72.在任一个本文中所述的实施方案中,杂环选自
73.在任一个本文中所述的实施方案中,化合物选自表4中所示的化合物1-62。
74.在任一个本文中所述的实施方案中,化合物选自表5中所示的化合物63-78、83-85、87-88、90-94、96-97、99-104、109-176、180-208、213-220、223-293。
75.在另一方面,描述了药物组合物,包括至少一种根据任一个本文中所述的实施方案的化合物或其可药用盐,以及可药用载体或稀释剂。
76.在再一方面,描述了在有此需要的哺乳动物物种中治疗病症的方法,包括对哺乳动物物种施用治疗有效量的根据任一个本文中所述实施方案的至少一种化合物或其可药用盐,其中病症选自癌症、免疫学病症、中枢神经系统(cns)病症、炎症性病症、胃肠病、代谢病症、心血管病症和肾脏疾病。
77.在任一个本文中所述的实施方案中,免疫学病症是移植排斥或自身免疫性疾病。
78.在任一个本文中所述的实施方案中,自身免疫性疾病是类风湿性关节炎、多发性硬化、系统性红斑狼疮或i型糖尿病。
79.在任一个本文中所述的实施方案中,中枢神经系统病症是阿尔茨海默氏病。
80.在任一个本文中所述的实施方案中,炎症性病症是炎症性皮肤病症、关节炎、银屑病、脊椎炎、牙周炎或炎症性神经疾病。
81.在任一个本文中所述的实施方案中,胃肠病是炎症性肠病。
82.在任一个本文中所述的实施方案中,代谢病症是肥胖或ii型糖尿病。
83.在任一个本文中所述的实施方案中,心血管病症是缺血性中风。
84.在任一个本文中所述的实施方案中,肾脏疾病是慢性肾病、肾炎或慢性肾衰竭。
85.在任一个本文中所述的实施方案中,病症选自癌症、移植排斥、类风湿性关节炎、多发性硬化、系统性红斑狼疮、i型糖尿病、阿尔茨海默氏病、炎症性皮肤病症、炎症性神经疾病、银屑病、脊椎炎、牙周炎、克罗恩病、溃疡性结肠炎、肥胖、ii型糖尿病、缺血性中风、慢性肾病、肾炎、慢性肾衰竭及其组合。
86.在任一个本文中所述的实施方案中,哺乳动物物种是人类。
87.在再一方面,描述了在有此需要的哺乳动物物种中阻断kv1.3钾通道的方法,包括对哺乳动物物种施用治疗有效量的根据任一个本文中所述实施方案的至少一种化合物或
其可药用盐。
88.在任一个本文中所述的实施方案中,哺乳动物物种是人类。
89.本文中公开的任一实施方案可与本文中公开的任何其它实施方案适当地组合。明确预期本文中公开的任一实施方案与本文中公开的任何其它实施方案的组合。具体而言,对于一个取代基的一个或多个实施方案的选择可以适当地与对任何其它取代基的一个或多个特定实施方案的选择组合。此类组合可以在本文中描述的应用的任何一个或多个实施方案中或本文中描述的任何式中进行。
90.发明详述定义下面是本说明书中使用的术语的定义。除非另行说明,本文中为基团或术语提供的初始定义单独或作为另一基团的一部分在本说明书通篇中适用于该基团或术语。除非另行定义,本文中使用的所有技术和科学术语具有与本领域普通技术人员通常理解的相同含义。
91.术语“烷基”和“alk”是指含有1至12个碳原子、优选1至6个碳原子的直链或支链烷烃(烃)基团。示例性“烷基”包括甲基、乙基、丙基、异丙基、正丁基、叔丁基、异丁基、戊基、己基、异己基、庚基、4,4-二甲基戊基、辛基、2,2,4-三甲基戊基、壬基、癸基、十一烷基、十二烷基等。术语“(c
1-c4)烷基”是指含有1至4个碳原子的直链或支链烷烃(烃)基团,如甲基、乙基、丙基、异丙基、正丁基、叔丁基和异丁基。“取代的烷基”是指在任何可用的连接点处被一个或多个取代基、优选1至4个取代基取代的烷基。示例性的取代基包括但不限于以下基团的一个或多个:氢、卤素(例如单个卤素取代基,或多卤素取代基,在后一种情况下,形成诸如cf3或带有ccl3的烷基的基团)、氰基、硝基、氧代(即=o)、cf3、ocf3、环烷基、链烯基、环烯基、炔基、杂环、芳基、ora、sra、s(=o)re、s(=o)2re、p(=o)2re、s(=o)2ore、p(=o)2ore、nrbrc、nrbs(=o)2re、nrbp(=o)2re、s(=o)2nrbrc、p(=o)2nrbrc、c(=o)ord、c(=o)ra、c(=o)nrbrc、oc(=o)ra、oc(=o)nrbrc、nrbc(=o)ore、nrdc(=o)nrbrc、nrds(=o)2nrbrc、nrdp(=o)2nrbrc、nrbc(=o)ra或nrbp(=o)2re,其中ra的每次出现独立地为氢、烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基;rb、rc和rd的每次出现独立地为氢、烷基、环烷基、杂环、芳基,或所述rb和rc与它们键合的n一起任选形成杂环,并且re的每次出现独立地为烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基。在一些实施方案中,诸如烷基、环烷基、链烯基、炔基、环烯基、杂环和芳基的基团本身可以任选被取代。
92.术语“杂烷基”是指优选在链中具有2至12个碳、更优选2至10个碳,其中一个或多个碳已经被选自s、o、p和n的杂原子替代的直链或支链烷基。示例性的杂烷基包括但不限于烷基醚、仲和叔烷基胺、烷基硫化物等。基团可以是末端基团或桥接基团。
93.术语“链烯基”是指含有2至12个碳原子和至少一个碳-碳双键的直链或支链烃基团。示例性的此类基团包括乙烯基或烯丙基。术语“c
2-c6链烯基”是指含有2至6个碳原子和至少一个碳-碳双键的直链或支链烃基团,如乙烯基、丙烯基、2-丙烯基、(e)-丁-2-烯基、(z)-丁-2-烯基、2-甲基-(e)-丁-2-烯基、2-甲基-(z)-丁-2-烯基、2,3-二甲基丁-2-烯基、(z)-戊-2-烯基、(e)-戊-1-烯基、(z)-己-1-烯基、(e)-戊-2-烯基、(z)-己-2-烯基、(e)-己-2-烯基、(z)-己-1-烯基、(e)-己-1-烯基、(z)-己-3-烯基、(e)-己-3-烯基和(e)-己-1,3-二烯基。“取代的链烯基”是指在任何可用的连接点处被一个或多个取代基、优选1至4个取代
基取代的链烯基。示例性的取代基包括但不限于以下基团中的一个或多个:氢、卤素、烷基、卤代烷基(即带有单个卤素取代基或多个卤素取代基的烷基,如cf3或ccl3)、氰基、硝基、氧代(即=o)、cf3、ocf3、环烷基、链烯基、环烯基、炔基、杂环、芳基、ora、sra、s(=o)re、s(=o)2re、p(=o)2re、s(=o)2ore、p(=o)2ore、nrbrc、nrbs(=o)2re、nrbp(=o)2re、s(=o)2nrbrc、p(=o)2nrbrc、c(=o)ord、c(=o)ra、c(=o)nrbrc、oc(=o)ra、oc(=o)nrbrc、nrbc(=o)ore、nrdc(=o)nrbrc、nrds(=o)2nrbrc、nrdp(=o)2nrbrc、nrbc(=o)ra或nrbp(=o)2re,其中ra的每次出现独立地为氢、烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基;rb、rc和rd的每次出现独立地为氢、烷基、环烷基、杂环、芳基,或所述rb和rc与它们键合的n一起任选形成杂环;并且re的每次出现独立地为烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基。示例性取代基本身可以任选被取代。
94.术语“炔基”是指含有2至12个碳原子和至少一个碳-碳三键的直链或支链烃基团。示例性基团包括乙炔基。术语“c
2-c6炔基”是指含有2至6个碳原子和至少一个碳-碳三键的直链或支链烃基团,如乙炔基、丙-1-炔基、丙-2-炔基、丁-1-炔基、丁-2-炔基、戊-1-炔基、戊-2-炔基、己-1-炔基、己-2-炔基或己-3-炔基。“取代的炔基”是指在任何可用的连接点处被一个或多个取代基、优选1至4个取代基取代的炔基。示例性的取代基包括但不限于以下基团中的一个或多个:氢、卤素(例如单个卤素取代基,或多卤素取代基,在后一种情况下形成诸如cf3或带有ccl3的烷基的基团)、氰基、硝基、氧代(即=o)、cf3、ocf3、环烷基、链烯基、环烯基、炔基、杂环、芳基、ora、sra、s(=o)re、s(=o)2re、p(=o)2re、s(=o)2ore、p(=o)2ore、nrbrc、nrbs(=o)2re、nrbp(=o)2re、s(=o)2nrbrc、p(=o)2nrbrc、c(=o)ord、c(=o)ra、c(=o)nrbrc、oc(=o)ra、oc(=o)nrbrc、nrbc(=o)ore、nrdc(=o)nrbrc、nrds(=o)2nrbrc、nrdp(=o)2nrbrc、nrbc(=o)ra或nrbp(=o)2re,其中ra的每次出现独立地为氢、烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基;rb、rc和rd的每次出现独立地为氢、烷基、环烷基、杂环、芳基,或所述rb和rc与它们键合的n一起任选形成杂环;并且re的每次出现独立地为烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基。示例性取代基本身可以任选被取代。
95.术语“环烷基”是指含有1至4个环和每个环3至8个碳的完全饱和的环状烃基团。“c
3-c7环烷基”是指环丙基、环丁基、环戊基、环己基或环庚基。“取代的环烷基”是指在任何可用的连接点处被一个或多个取代基、优选1至4个取代基取代的环烷基。示例性的取代基包括但不限于以下基团中的一个或多个:氢、卤素(例如单个卤素取代基,或多卤素取代基,在后一种情况下,形成诸如cf3或带有ccl3的烷基的基团)、氰基、硝基、氧代(即=o)、cf3、ocf3、环烷基、链烯基、环烯基、炔基、杂环、芳基、ora、sra、s(=o)re、s(=o)2re、p(=o)2re、s(=o)2ore、p(=o)2ore、nrbrc、nrbs(=o)2re、nrbp(=o)2re、s(=o)2nrbrc、p(=o)2nrbrc、c(=o)ord、c(=o)ra、c(=o)nrbrc、oc(=o)ra、oc(=o)nrbrc、nrbc(=o)ore、nrdc(=o)nrbrc、nrds(=o)2nrbrc、nrdp(=o)2nrbrc、nrbc(=o)ra或nrbp(=o)2re,其中ra的每次出现独立地为氢、烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基;rb、rc和rd的每次出现独立地为氢、烷基、环烷基、杂环、芳基,或所述rb和rc与它们键合的n一起任选形成杂环;并且re的每次出现独立地为烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基。示例性取代基本身可以任选被取代。示例性的取代基还包括螺接或稠合的环状取代基,尤其是螺接环烷基、螺接环烯基、螺接杂环(不包括杂芳基)、稠合环烷基、稠合环烯基、稠合杂环或稠合芳基,其中前述环烷基、环烯基、杂环和芳基取代基本身可以任选被取代。
96.术语“杂环烷基”或“环杂烷基”是指在至少一个环中含有至少一个选自氮、硫和氧的杂原子、优选1至3个杂原子的饱和或部分饱和的单环、二环或多环环。每个环优选为3至10元、更优选4至7元。合适的杂环烷基取代基的实例包括但不限于吡咯烷基、四氢呋喃基、四氢噻吩基(tetrahydrothiofuranyl)、哌啶基、哌嗪基(piperazyl)、四氢吡喃基、吗啉基、1,3-二氮杂环庚烷、1,4-二氮杂环庚烷、1,4-氧杂氮杂环庚烷和1,4-氧硫杂环庚烷。基团可以是末端基团或桥接基团。
97.术语“环烯基”是指含有1至4个环和每个环3至8个碳的部分不饱和的环状烃基团。示例性的此类基团包括环丁烯基、环戊烯基、环己烯基等。“取代的环烯基”是指在任何可用的连接点处被一个或多个取代基、优选1至4个取代基取代的环烯基。示例性的取代基包括但不限于以下基团中的一个或多个:氢、卤素(例如单个卤素取代基,或多卤素取代基,在后一种情况下,形成诸如cf3或带有ccl3的烷基的基团)、氰基、硝基、氧代(即=o)、cf3、ocf3、环烷基、链烯基、环烯基、炔基、杂环、芳基、ora、sra、s(=o)re、s(=o)2re、p(=o)2re、s(=o)2ore、p(=o)2ore、nrbrc、nrbs(=o)2re、nrbp(=o)2re、s(=o)2nrbrc、p(=o)2nrbrc、c(=o)ord、c(=o)ra、c(=o)nrbrc、oc(=o)ra、oc(=o)nrbrc、nrbc(=o)ore、nrdc(=o)nrbrc、nrds(=o)2nrbrc、nrdp(=o)2nrbrc、nrbc(=o)ra或nrbp(=o)2re,其中ra的每次出现独立地为氢、烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基;rb、rc和rd的每次出现独立地为氢、烷基、环烷基、杂环、芳基,或所述rb和rc与它们键合的n一起任选形成杂环;并且re的每次出现独立地为烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基。示例性取代基本身可以任选被取代。示例性的取代基还包括螺接或稠合的环状取代基,尤其是螺接环烷基、螺接环烯基、螺接杂环(不包括杂芳基)、稠合环烷基、稠合环烯基、稠合杂环或稠合芳基,其中前述环烷基、环烯基、杂环和芳基取代基本身可以任选被取代。
98.术语“芳基”是指具有1至5个芳环的环状芳族烃基团,尤其是单环或二环基团,如苯基、联苯基或萘基。当含有两个或更多个芳环(二环等)时,芳基的芳环可在单个点处接合(例如联苯基),或是稠合的(例如萘基、菲基等)。术语“稠合芳环”是指具有两个或更多个芳族环的分子结构,其中两个相邻的芳环具有两个共有的碳原子。“取代的芳基”是指在任何可用的连接点处被一个或多个取代基、优选1至3个取代基取代的芳基。示例性的取代基包括但不限于以下基团中的一个或多个:氢、卤素(例如单个卤素取代基,或多卤素取代基,在后一种情况下,形成诸如cf3或带有ccl3的烷基的基团)、氰基、硝基、氧代(即=o)、cf3、ocf3、环烷基、链烯基、环烯基、炔基、杂环、芳基、ora、sra、s(=o)re、s(=o)2re、p(=o)2re、s(=o)2ore、p(=o)2ore、nrbrc、nrbs(=o)2re、nrbp(=o)2re、s(=o)2nrbrc、p(=o)2nrbrc、c(=o)ord、c(=o)ra、c(=o)nrbrc、oc(=o)ra、oc(=o)nrbrc、nrbc(=o)ore、nrdc(=o)nrbrc、nrds(=o)2nrbrc、nrdp(=o)2nrbrc、nrbc(=o)ra或nrbp(=o)2re,其中ra的每次出现独立地为氢、烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基;rb、rc和rd的每次出现独立地为氢、烷基、环烷基、杂环、芳基,或所述rb和rc与它们键合的n一起任选形成杂环;并且re的每次出现独立地为烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基。示例性取代基本身可以任选被取代。示例性的取代基还包括稠合的环状基团,尤其是稠合环烷基、稠合环烯基、稠合杂环或稠合芳基,其中前述环烷基、环烯基、杂环和芳基取代基本身可以任选被取代。
99.术语“联芳基”是指通过单键连接的两个芳基。术语“联杂芳基”是指通过单键连接的两个杂芳基。类似地,术语“杂芳基-芳基”是指通过单键连接的杂芳基和芳基,且术语“芳
基-杂芳基”是指通过单键连接的芳基和杂芳基。在某些实施方案中,杂芳基和/或芳基环中环原子的数量用于指定取代基中芳基或杂芳基环的大小。例如,5,6-杂芳基-芳基是指其中5元杂芳基连接到6元芳基上的取代基。可以类似地规定其它组合和环大小。
100.术语“碳环(carbocycle)”或“碳环(carbon cycle)”是指含有1至4个环和每个环3至8个碳的完全饱和或部分饱和的环状烃基团,或具有1至5个芳环的环状芳族烃基团,尤其是单环或二环基团,如苯基、联苯基或萘基。术语“碳环”涵盖了如上文定义的环烷基、环烯基、环炔基和芳基。术语“取代的碳环”是指在任何可用的连接点处被一个或多个取代基、优选1至4个取代基取代的碳环或碳环基团。示例性的取代基包括但不限于上文对取代的环烷基、取代的环烯基、取代的环炔基和取代的芳基所描述的那些。示例性的取代基还包括在任何可用的一个或多个连接点处的螺接或稠合的环状取代基,尤其是螺接环烷基、螺接环烯基、螺接杂环(不包括杂芳基)、稠合环烷基、稠合环烯基、稠合杂环或稠合芳基,其中前述环烷基、环烯基、杂环和芳基取代基本身可以任选被取代。
101.术语“杂环”和“杂环”是指完全饱和的、或部分或完全不饱和的,包括芳族(即“杂芳基”)的环状基团(例如3至7元单环、7至11元二环、或8至16元三环的环体系),其在至少一个含碳原子的环中具有至少一个杂原子。杂环基的每个环可独立地为饱和的、或部分或完全不饱和的。含有杂原子的杂环基的每个环可具有1、2、3或4个选自氮原子、氧原子和硫原子的杂原子,其中氮和硫的杂原子可任选被氧化,且氮杂原子可任选被季铵化。术语“杂芳基鎓(heteroarylium)”是指带有季氮原子并由此带有正电荷的杂芳基。杂环基团可在环或环体系的任何杂原子或碳原子处连接到分子的剩余部分上。示例性的单环杂环基团包括氮杂环丁基、吡咯烷基、吡咯基、吡唑基、氧杂环丁基、吡唑啉基、咪唑基、咪唑啉基、咪唑烷基、噁唑基、噁唑烷基、异噁唑啉基、异噁唑基、噻唑基、噻二唑基、噻唑烷基、异噻唑基、异噻唑烷基、呋喃基、四氢呋喃基、噻吩基、噁二唑基、哌啶基、哌嗪基、2-氧代哌嗪基、2-氧代哌啶基、2-氧代吡咯烷酮基(oxopyrrolodinyl)、2-氧代氮杂基、氮杂基、六氢二氮杂基、4-哌啶酮基、吡啶基、吡嗪基、嘧啶基、哒嗪基、三嗪基、三唑基、四唑基、四氢吡喃基、吗啉基、硫吗啉基、硫吗啉基亚砜、硫吗啉基砜、1,3-二氧杂环戊烷、四氢-1,1-二氧代噻吩基等。示例性的二环杂环基团包括吲哚基、吲哚啉基、异吲哚基、苯并噻唑基、苯并噁唑基、苯并噁二唑基、苯并噻吩基、苯并[d][1,3]二氧杂环戊烯基、二氢-2h-苯并[b][1,4]噁嗪、2,3-二氢苯并[b][1,4]二氧杂环己烯基、奎宁环基、喹啉基、四氢异喹啉基、异喹啉基、苯并咪唑基、苯并吡喃基、吲哚嗪基、苯并呋喃基、苯并呋咱基、二氢苯并[d]噁唑、色酮基、香豆素基、苯并吡喃基、噌啉基、喹喔啉基、吲唑基、吡咯并吡啶基、呋喃并吡啶基(诸如呋喃并[2,3-c]吡啶基、呋喃并[3,2-b]吡啶基]或呋喃并[2,3-b]吡啶基)、二氢异吲哚基、二氢喹唑啉基(诸如3,4-二氢-4-氧代-喹唑啉基)、三嗪基氮杂基、四氢喹啉基等。示例性的三环杂环基团包括咔唑基、苯并吲哚基(benzidolyl)、菲咯啉基、吖啶基、菲啶基、呫吨基等。
[0102]“取代的杂环”和“取代杂环”(如“取代的杂芳基”)是指在任何可用的连接点处被一个或多个取代基、优选1至4个取代基取代的杂环或杂环基团。示例性的取代基包括但不限于以下基团中的一个或多个:氢、卤素(例如单个卤素取代基,或多卤素取代基,在后一种情况下,形成诸如cf3或带有ccl3的烷基的基团)、氰基、硝基、氧代(即=o)、cf3、ocf3、环烷基、链烯基、环烯基、炔基、杂环、芳基、ora、sra、s(=o)re、s(=o)2re、p(=o)2re、s(=o)2ore、p(=o)2ore、nrbrc、nrbs(=o)2re、nrbp(=o)2re、s(=o)2nrbrc、p(=o)2nrbrc、c(=o)ord、c(=
o)ra、c(=o)nrbrc、oc(=o)ra、oc(=o)nrbrc、nrbc(=o)ore、nrdc(=o)nrbrc、nrds(=o)2nrbrc、nrdp(=o)2nrbrc、nrbc(=o)ra或nrbp(=o)2re,其中ra的每次出现独立地为氢、烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基;rb、rc和rd的每次出现独立地为氢、烷基、环烷基、杂环、芳基,或所述rb和rc与它们键合的n一起任选形成杂环;并且re的每次出现独立地为烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基。示例性取代基本身可以任选被取代。示例性的取代基还包括在任何可用的一个或多个连接点处的螺接或稠合的环状取代基,尤其是螺接环烷基、螺接环烯基、螺接杂环(不包括杂芳基)、稠合环烷基、稠合环烯基、稠合杂环或稠合芳基,其中前述环烷基、环烯基、杂环和芳基取代基本身可以任选被取代。
[0103]
术语“氧代”是指取代基,其可连接到碳环或杂环上的碳环原子。当氧代取代基连接到芳族基团(例如芳基或杂芳基)上的碳环原子时,在芳族环上的键可重新排列以满足价态要求。例如,具有2-氧代取代基的吡啶可具有的结构,其还包括其互变异构形式
[0104]
术语“烷基氨基”是指具有结构-nhr’的基团,其中如本文中所定义,r’是氢、烷基或取代烷基、或环烷基或取代环烷基。烷基氨基的实例包括但不限于甲基氨基、乙基氨基、正丙基氨基、异丙基氨基、环丙基氨基、正丁基氨基、叔丁基氨基、新戊基氨基、正戊基氨基、己基氨基、环己基氨基等。
[0105]
术语“二烷基氨基”是指具有结构-nrr’的基团,其中如本文中所定义,r和r’各自独立地是烷基或取代烷基、环烷基或取代环烷基、环烯基或取代环烯基、芳基或取代芳基、或杂环或取代杂环。r和r’在二烷基氨基部分中可相同或不同。二烷基氨基的实例包括但不限于二甲基氨基、甲基乙基氨基、二乙基氨基、甲基丙基氨基、二正丙基氨基、二异丙基氨基、二环丙基氨基、二正丁基氨基、二叔丁基氨基、二新戊基氨基、二正戊基氨基、二己基氨基、二环己基氨基等。在某些实施方案中,r和r’连接以形成环状结构。所得环状结构可以是芳族或非芳族的。所得环状结构的实例包括但不限于吖丙啶基、吡咯烷基、哌啶基、吗啉基、吡咯基、咪唑基、1,2,4-三唑基和四唑基。
[0106]
术语“卤素”或“卤代”是指氯、溴、氟或碘。
[0107]
术语“取代的”是指其中分子、分子部分或取代基(例如烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基,或本文中公开的任何其它基团)在任何可用的连接点处被一个或多个取代基、在价态允许时优选被1至6个取代基取代的实施方案。示例性的取代基包括但不限于以下基团中的一个或多个:氢、卤素(例如单个卤素取代基,或多卤素取代基,在后一种情况下,形成诸如cf3或带有ccl3的烷基的基团)、氰基、硝基、氧代(即=o)、cf3、ocf3、烷基、卤素取代的烷基、环烷基、链烯基、环烯基、炔基、杂环、芳基、ora、sra、s(=o)re、s(=o)2re、p(=o)2re、s(=o)2ore、p(=o)2ore、nrbrc、nrbs(=o)2re、nrbp(=o)2re、s(=o)2nrbrc、p(=o)2nrbrc、c(=o)ord、c(=o)ra、c(=o)nrbrc、oc(=o)ra、oc(=o)nrbrc、nrbc(=o)ore、nrdc(=o)nrbrc、nrds(=o)2nrbrc、nrdp(=o)2nrbrc、nrbc(=o)ra或nrbp(=o)2re,其中ra的每次出现
独立地为氢、烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基;rb、rc和rd的每次出现独立地为氢、烷基、环烷基、杂环、芳基,或所述rb和rc与它们键合的n一起任选形成杂环;并且re的每次出现独立地为烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基。在前述的示例性取代基中,诸如烷基、环烷基、链烯基、炔基、环烯基、杂环和芳基的基团本身可以任选被取代。术语“任选被取代”是指其中分子、分子部分或取代基(例如烷基、环烷基、链烯基、环烯基、炔基、杂环或芳基,或本文中公开的任何其它基团)可以或可以不被前述的一个或多个取代基取代的实施方案。
[0108]
除非另行说明,假定具有未满足的化合价的任何杂原子具有足以满足化合价的氢原子。
[0109]
本发明的化合物可形成盐,其也在本发明的范围内。除非另行说明,提及本发明的化合物应理解为包括提及其盐。本文中所用的术语“一种或多种盐”表示与无机和/或有机酸和碱形成的酸性和/或碱性盐。此外,当本发明的化合物含有碱性部分(例如但不限于吡啶或咪唑)和酸性部分(例如但不限于羧酸或酚)时,可形成两性离子(“内盐”)并包括在本文中所用的术语“一种或多种盐”中。可药用(即无毒的、生理学可接受的)盐是优选的,尽管其它盐也是有用的,例如,可用于制备过程中可使用的分离或提纯步骤。本发明的化合物的盐可例如通过以下形成:使本文中描述的化合物与一定量的酸或碱(如一当量)在介质(例如盐在其中沉淀的介质)中或在水性介质中反应随后冻干。
[0110]
含有碱性部分,例如但不限于胺或吡啶或咪唑环的本发明的化合物可与多种有机和无机酸形成盐。示例性的酸加成盐包括乙酸盐(如与乙酸或三卤代乙酸,例如三氟乙酸形成的那些)、己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、硫酸氢盐、硼酸盐、丁酸盐、柠檬酸盐、樟脑酸盐、樟脑磺酸盐、环戊烷丙酸盐、二葡萄糖酸盐、十二烷基硫酸盐、乙磺酸盐、富马酸盐、葡庚糖酸盐(glucoheptanoate)、甘油磷酸盐、半硫酸盐、庚酸盐、己酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、羟基乙磺酸盐(例如2-羟基乙磺酸盐)、乳酸盐、马来酸盐、甲磺酸盐、萘磺酸盐(例如2-萘磺酸盐)、烟酸盐、硝酸盐、草酸盐、果胶酸盐、过硫酸盐、苯基丙酸盐(例如3-苯基丙酸盐)、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、水杨酸盐、琥珀酸盐、硫酸盐(如与硫酸形成的那些)、磺酸盐、酒石酸盐、硫氰酸盐、甲苯磺酸盐(如甲苯磺酸盐)、十一烷酸盐等。
[0111]
含有酸性部分,例如但不限于酚或羧酸的本发明的化合物可与多种有机和无机碱形成盐。示例性的碱性盐包括铵盐、碱金属盐如钠盐、锂盐和钾盐,碱土金属盐如钙盐和镁盐,与有机碱(例如有机胺)如苄星、二环己胺、哈胺(hydrabamine)(由n,n-双(脱氢枞基)乙二胺形成)、n-甲基-d-葡糖胺、n-甲基-d-葡糖酰胺(n-methyl-d-glycamide)和叔丁胺的盐,以及与氨基酸如精氨酸、赖氨酸等的盐。碱性含氮基团可用诸如低级烷基卤化物(例如甲基、乙基、丙基和丁基氯化物、溴化物和碘化物)、硫酸二烷基酯(例如硫酸二甲酯、硫酸二乙酯、硫酸二丁酯和硫酸二戊酯)、长链卤化物(例如癸基、月桂基、肉豆蔻基和硬脂基的氯化物、溴化物和碘化物)、芳烷基卤化物(例如苄基溴和苯乙基溴)等等的试剂季铵化。
[0112]
在本文中还设想了本发明的化合物的前药和溶剂合物。本文中所用的术语“前药”表示在施用于受试者后通过代谢或化学过程发生化学转化以产生本发明的化合物或其盐和/或溶剂合物的化合物。本发明的化合物的溶剂合物包括例如水合物。
[0113]
本发明的化合物,以及其盐或溶剂合物可以其互变异构形式(例如作为酰胺或亚
氨基醚)存在。所有此类互变异构形式在本文中被认为是本发明的一部分。如本文所用中,化合物的任何描绘的结构包括其互变异构形式。
[0114]
本发明的化合物的所有立体异构体(例如由于各种取代基上的不对称碳而可存在的那些),包括对映异构体形式和非对映异构体形式,均视为在本发明的范围内。本发明的化合物的单个立体异构体例如可基本不含其它异构体(例如作为具有特定活性的纯或基本纯的旋光异构体),或者可混合,例如作为外消旋体或与所有其它、或其它选定的立体异构体。本发明的手性中心可具有由international union of pure and applied chemistry(iupac)1974建议所定义的s或r构型。外消旋形式可以通过物理方法拆分,例如分级结晶、非对映异构体衍生物的分离或结晶,或通过手性柱色谱法分离。单个的旋光异构体可以通过任何合适的方法获自外消旋体,所述方法包括但不限于常规方法,如用光学活性酸形成盐随后结晶。
[0115]
本发明的化合物在其制备之后优选分离和提纯以获得含有按重量计等于或大于90%、例如等于或大于95%、等于或大于99%的化合物(“基本纯”的化合物),其随后如本文中所述使用或配制。本发明的此类“基本纯”化合物在本文中也被视为是本发明的一部分。
[0116]
考虑了本发明的化合物的所有构型异构体,无论是混合物还是纯或基本纯的形式。本发明的化合物的定义包括顺式(z)和反式(e)烯烃异构体,以及环状烃或杂环环的顺式和反式异构体。
[0117]
在本说明书通篇中,可选择基团及其取代基以提供稳定的部分和化合物。
[0118]
在本文中更详细地描述了特定官能团的定义和化学术语。对本发明而言,化学元素根据元素周期表,cas版本,handbook of chemistry and physics,第75版,内封面来确定,并且特定官能团通常如其中所述来定义。此外,有机化学的一般原理以及特定的官能部分和反应性描述在“organic chemistry”,thomas sorrell,university science books,sausalito(1999)中。
[0119]
本发明的某些化合物可特定的几何或立体异构形式存在。本发明涵盖了所有此类化合物,包括顺式和反式异构体、r-和s-对映异构体、非对映异构体、(d)-异构体、(l)-异构体、其外消旋混合物及其其它混合物,如落在本发明的范围中。附加的不对称碳原子可存在于取代基例如烷基中。所有此类异构体及其混合物均意在包括在本发明中。
[0120]
可根据本发明使用含有任何多种异构体比率的异构体混合物。例如,当仅混合两种异构体时,含有50:50、60:40、70:30、80:20、90:10、95:5、96:4、97:3、98:2、99:1或100:0异构体比率的混合物均在本发明考虑之内。本领域普通技术人员将容易理解,对更复杂的异构体混合物考虑类似的比率。
[0121]
本发明还包括同位素标记的化合物,其与本文中公开的化合物相同,但存在事实:一个或多个原子被原子质量或质量数不同于通常在自然界中发现的原子质量或质量数的原子取代。可以混入本发明的化合物的同位素的实例包括氢、碳、氮、氧、磷、硫、氟和氯的同位素,分别如2h、3h、
13
c、
11
c、
14
c、
15
n、
18
o、
17
o、
31
p、
32
p、
35
s、
18
f和
36
cl。本发明的化合物、或对映异构体、非对映异构体、互变异构体、或其可药用的盐或溶剂合物,其含有前述同位素和/或其它原子的其它同位素,在本发明的范围内。某些同位素标记的本发明的化合物,例如并入放射性同位素如3h和
14
c的那些,可用于药物和/或底物组织分布测定。氚代(即3h)和碳-14(即
14
c)同位素是特别优选的,因为它们的易于制备和可检测性。此外,用较重的同位素如氘
(即2h)取代可以提供某些治疗优势,其来自于更高的代谢稳定性,例如延长的体内半衰期或降低的剂量要求,并且因此在某些情况下可能是优选的。同位素标记的化合物通常可以通过实施以下的方案和/或实施例中公开的程序,通过用易于获得的同位素标记的试剂代替非同位素标记的试剂来制备。
[0122]
例如,如果需要本发明的化合物的特定对映异构体,其可通过不对称合成、或通过用手性助剂衍生来制备,其中分离所得非对映异构体混合物并裂解辅助基团以提供纯的所需对映异构体。或者,当分子含有碱性官能团(如氨基)或酸性官能团(如羧基)时,用适当的光学活性酸或碱形成非对映异构体盐,随后通过分级结晶或本领域中公知的色谱方法拆分由此形成的非对映体,并随后回收纯对映异构体。
[0123]
应当理解的是,如本文中所述的化合物可用任意数量的取代基或官能部分取代。通常,术语“取代的”无论是否前缀术语“任选地”,以及本发明的式中所含的取代基,是指用指定取代基的基团取代给定结构中的氢基团。当任何给定结构中超过一个位置可被超过一个选自指定组的取代基取代时,取代基在每个位置处可相同或不同。本文中所用的术语“取代的”预期包括有机化合物的所有允许的取代基。在广泛的方面,允许的取代基包括有机化合物的无环和环状、支链和非支链、碳环和杂环、以及芳族和非芳族的取代基。对本发明的目的而言,杂原子如氮可具有氢取代基和/或本文中所述的有机化合物的任何允许的取代基(其满足杂原子的价态)。此外,本发明并非意在以任何方式受有机化合物的允许取代基的限制。本发明设想的取代基和变量的组合优选是导致形成可用于治疗例如增殖性病症治疗的稳定化合物的那些。本文中所用的术语“稳定的”优选是指具有足以允许制造的稳定性并在足以被检测的时间段内并优选在足以用于本文中详述的目的的时间段内保持化合物完整性的化合物。
[0124]
本文中所用的术语“癌症”和等价的“肿瘤”是指宿主来源的异常复制细胞以可检测的量存在于受试者中的病症。癌症可以是恶性或非恶性癌症。癌症或肿瘤包括但不限于:胆道癌;脑癌;乳腺癌;宫颈癌;绒毛膜癌;结肠癌;子宫内膜癌;食道癌;胃部(胃)癌;上皮内肿瘤;白血病;淋巴瘤;肝癌;肺癌(例如小细胞和非小细胞肺癌);黑色素瘤;神经母细胞瘤;口腔癌;卵巢癌;胰腺癌;前列腺癌;直肠癌;肾(肾脏)癌;肉瘤;皮肤癌;睾丸癌;和甲状腺癌;以及其它癌和肉瘤。癌症可以是原发性或转移性的。癌症外的疾病可能与ras信号传导通路的组分的突变改变相关,并且本文中公开的化合物可用于治疗这些非癌症疾病。此类非癌症疾病可包括:神经纤维瘤病;豹斑综合征;努南综合征;莱克斯综合征(legius syndrome);costello综合征;心面皮肤综合征;1型遗传性牙龈纤维瘤病;自身免疫性淋巴细胞增生综合征;和毛细血管畸形-动静脉畸形。
[0125]
本文中所用的“有效量”是指实现或促进期望结果所需或足够的任何量。在一些情况下,有效量是治疗有效量。治疗有效量是在受试者中促进或实现所需生物反应所需或足够的任何量。对任何特定应用的有效量可以根据诸如治疗的疾病或病症、施用的特定药剂、受试者的大小、或疾病或病症的严重程度等因素而变化。本领域普通技术人员可以凭经验确定特定试剂的有效量而无需进行过度实验。
[0126]
本文中所用的术语“受试者”是指脊椎动物。在一个实施方案中,受试者是哺乳类或哺乳动物物种。在一个实施方案中,受试者是人类。在另一些实施方案中,受试者是非人类脊椎动物,包括但不限于非人类灵长类动物、实验动物、家畜、赛马、驯养动物和非驯养动
物。
[0127]
化合物描述了作为kv1.3钾通道阻滞剂的新颖的化合物。申请人已经令人惊讶地发现,本文中公开的化合物表现出有效的kv1.3钾通道抑制性质。此外,申请人已经令人惊讶地发现,本文中公开的化合物选择性阻断kv1.3钾通道,而不阻断herg通道,并由此具有合意的心血管安全性。
[0128]
在一方面,描述了式i的化合物或其可药用盐,其中y是c(r2)2、nr1或o;z是ora;x1是h、卤素或烷基;x2是h、卤素、cn、烷基、环烷基、卤代环烷基或卤代烷基;x3是h、卤素、卤代烷基或烷基;或者x1和x2与它们所连接的碳原子一起形成任选取代的5或6元芳基;或者x2和x3与它们所连接的碳原子一起形成任选取代的5或6元芳基;r1的每次出现独立地为h、烷基、链烯基、环烷基、杂烷基、环杂烷基、芳基、杂芳基、(cr6r7)
n6
ora、(cr6r7)
n6
n(ra)2、(c=o)ra、(c=o)ora、(cr6r7)
n6
(c=o)nrarb,so2ra或(cr6r7)
n6-杂环;r2的每次出现独立地为h、卤素、cn、烷基、环烷基、杂烷基、环杂烷基、(cr6r7)
n6
ora、(cr6r7)
n6-杂环、(c=o)ra、(c=o)ora、(cr6r7)
n6
nra(c=o)ra、(cr6r7)
n6
n(ra)2、nra(cr6r7)
n6
ora、(c=o)nra(cr6r7)
n6
ora、(c=o)ra、(cr6r7)
n6
(c=o)nrarb、芳基或杂芳基,其中每个r2可连接到的碳环原子的任一个上;r3是h、烷基或卤素;r6和r7的每次出现独立地为h、烷基、环烷基、任选取代的芳基或任选取代的杂芳基;ra和rb的每次出现独立地为h、烷基、链烯基、环烷基、饱和杂环、芳基或杂芳基;或者ra和rb与它们所连接的氮原子一起形成任选取代的杂环;杂环包括1-3个各自选自n、o和s的杂原子;
x1、x2、x3、r1、r2、r3、r6、r7、ra和rb中的烷基、环烷基、杂烷基、环杂烷基、杂环、芳基和杂芳基在适用的情况下各自独立和任选地被1-4个各自独立地选自烷基、环烷基、卤代烷基、卤代环烷基、卤素、cn、r8、or8、-(ch2)
1-2
or8、n(r8)2、(c=o)r8、(c=o)n(r8)2、nr8(c=o)r8和氧代(在价态允许的情况下)的取代基取代;r8的每次出现独立地为h、烷基、环烷基或任选被烷基取代的杂环;或者两个r8基团与它们所连接的氮原子一起形成任选被烷基取代并包括所述氮原子和0-3个各自选自n、o和s的附加杂原子的杂环;n1是0-1的整数;n2是0-2的整数;n3是0-3的整数;n4是1-2的整数;和n6是0-3的整数。
[0129]
在一些实施方案中,结构部分具有的结构。在一些具体实施方案中,结构部分具有的结构。
[0130]
在一些实施方案中,结构部分具有的结构。在一些具体实施方案中,结构部分具有的结构。
[0131]
在一些实施方案中,n1是1。在一些实施方案中,n1是0。在一些实施方案中,n2是0-2的整数。在一些实施方案中,n2是1-2的整数。在一些实施方案中,n2是0。在一些实施方案中,n2是1或2。在一些实施方案中,n2是1。
[0132]
在一些实施方案中,结构部分具有具有的结构。在一些实施方案中,结构部分具有的结构。
[0133]
在一些实施方案中,结构部分具有的结构。在一些实施方案中,结构部分具有的结构。
[0134]
在一些实施方案中,y是c(r2)2。在另一些实施方案中,y是nr1。在又一些实施方案中,y是o。
[0135]
在一些实施方案中,结构部分具有的结构。在一些具体实施方案中,结构部分具有的结构。在一些具体实施方案中,结构部分具有的结构。在一些具体实施方案中,结构部分具有的结构。在一些具体实施方案中,结构部分具有的结构。
[0136]
在一些具体实施方案中,结构部分具有的结构。
在一些具体实施方案中,该结构部分具有的结构。在一些实施方案中,该结构部分具有的结构。在一些实施方案中,该结构部分具有的结构。在一些实施方案中,该结构部分具有的结构。
[0137]
在一些实施方案中,r1是h、烷基、链烯基、环烷基、杂烷基或环杂烷基。
[0138]
在一些实施方案中,r1是h。在一些实施方案中,r1是烷基,如me、et、丙基、异丙基、正丁基、异丁基或仲丁基。在另一些实施方案中,r1是环烷基,如环丙基、环丁基、环戊基或环己基。
[0139]
在一些实施方案中,r1是杂烷基。在一些具体实施方案中,r1是烷基醚、仲和叔烷基胺、或烷基硫化物,如-ch
2-ch
2-ome、-ch
2-ch
2-oet、-ch
2-ch
2-opr、-ch
2-ch
2-sme、-ch
2-ch
2-set、-ch
2-ch
2-spr、-ch
2-ch
2-nhme、-ch
2-ch
2-nme2、-ch
2-ch
2-netme或-ch
2-ch
2-net2。在一些实施方案中,r1是环杂烷基。环杂烷基的非限制性实例包括吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、哌嗪基、四氢吡喃基、吗啉基、1,3-二氮杂环庚烷、1,4-二氮杂环庚烷、1,4-氧杂氮杂环庚烷和1,4-氧硫杂环庚烷。
[0140]
在一些实施方案中,r1是芳基或杂芳基。在一些实施方案中,r1是(c=o)ra、(c=o)ora、(c=o)nrarb、so2ra、(cr6r7)
n6
ora或(cr6r7)
n6
n(ra)2。在一些实施方案中,r1是(cr6r7)
n6
(c=o)nrarb、so2ra或(cr6r7)
n6-杂环。在一些具体实施方案中,r1是(c=o)ra。在一些具体实施方案中,ra和rb各自独立地是h、烷基或被一个或多个or8取代的烷基。在一些具体实施方案中,r8是h或烷基。
[0141]
在一些实施方案中,r1选自h、-ch3、-(ch2)2oh、-(ch2)2nh2、-conh2、-conhme、-conme2、-conet2、so2me或so2et。在另一些实施方案中,r1选自
在又一些实施方案中,r1选自
[0142]
在一些实施方案中,r2的至少一次出现是h、cn、烷基、杂烷基、环烷基或环杂烷基。在一些实施方案中,r2的至少一次出现是h。在一些实施方案中,r2的至少一次出现是烷基,如me、et、丙基、异丙基、正丁基、异丁基或仲丁基。在另一些实施方案中,r2的至少一次出现是环烷基,如环丙基、环丁基、环戊基或环己基。在一些实施方案中,r2的至少一次出现是芳基或杂芳基。
[0143]
在一些实施方案中,r2的至少一次出现是(cr6r7)
n6
ora、(cr6r7)
n6-杂环、(c=o)ra、(c=o)ora、(cr6r7)
n6
nra(c=o)ra、(cr6r7)
n6
n(ra)2、nra(cr6r7)
n6
ora、(c=o)nra(cr6r7)
n6
ora或(cr6r7)
n6
(c=o)nrarb。在一些实施方案中,每个r2可连接到的碳环原子的任一个上。在一些具体实施方案中,r2的至少一次出现是-ch3,-ch
2-oh,-ch
2-ch
2-oh,-ch(oh)-ch3,-ch
2-nh2,
[0144]
在一些实施方案中,r2的至少一次出现是ora。在一些实施方案中,r2的至少一次出现是n(r1)2。在一些实施方案中,r2的至少一次出现是(c=o)ra。在一些实施方案中,r2的至少一次出现是(c=o)nrarb。在一些实施方案中,r2的至少一次出现是芳基。在一些实施方案中,r2是杂芳基。在一些实施方案中,r2的至少一次出现是杂烷基或环杂烷基。在一些实施方案中,r2是杂烷基。在一些具体实施方案中,r2是烷基醚、仲和叔烷基胺、或烷基硫化物,如-ch
2-ch
2-ome、-ch
2-ch
2-oet、-ch
2-ch
2-opr、-ch
2-ch
2-sme、-ch
2-ch
2-set、-ch
2-ch
2-spr、-ch
2-ch
2-nhme、-ch
2-ch
2-nme2、-ch
2-ch
2-netme或-ch
2-ch
2-net2。在一些实施方案中,r2是环杂烷基。环杂烷基的非限制性实例包括吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、哌嗪基、四氢吡喃基、吗啉基、1,3-二氮杂环庚烷、1,4-二氮杂环庚烷、1,4-氧杂氮杂环庚烷和1,4-氧硫杂环庚烷。在一些实施方案中,r2的至少一次出现是
[0145]
在一些实施方案中,n1是0。在一些实施方案中,n1是1。在一些实施方案中,n2是0。在一些实施方案中,n2是1。在一些实施方案中,n3是0、1、2或3。在一些实施方案中,n3是0。在一些实施方案中,n3是1。在一些实施方案中,n3是2。在一些实施方案中,n4是1。在一些实施方案中,n4是2。在一些实施方案中,n6是0。在一些实施方案中,n6是1。在一些实施方案中,n6是2。在一些实施方案中,n6是3。
[0146]
在一些实施方案中,r8是h或烷基。在另一些实施方案中,r8是任选被取代的杂环。在又一些实施方案中,两个r8基团与它们所连接的氮原子一起形成包括所述氮原子和0-3个各自选自n、o和s的附加杂原子的任选被取代的杂环。
[0147]
在一些实施方案中,z是ora。在一些实施方案中,z是oh、ome、oet、opr、o-i-pr、o-t-bu、o-iso-bu、o-sec-bu或obu。在一些实施方案中,z是oh。
[0148]
在一些实施方案中,x1是h、卤素或烷基。在任一个本文中所述的实施方案中,x1可以是h或烷基。在一些实施方案中,x1是me、et、pr、i-pr或bu。在一些实施方案中,x1是h或卤素。在另一些实施方案中,x1是烷基。在一些实施方案中,x1是h、f、cl、br或me。在一些实施方案中,x1是h、f或cl。在一些实施方案中,x1是f或cl。在一些实施方案中,x1是h或cl。在一些实施方案中,x1是f。在一些实施方案中,x1是h。
[0149]
在一些实施方案中,x2是h、卤素、cn、烷基、卤代烷基、环烷基或卤代环烷基。在任一个本文中所述的实施方案中,x2可以是h、卤素、氟代烷基或烷基。在一些实施方案中,x2是h或卤素。在另一些实施方案中,x2是氟代烷基或烷基。在另一些实施方案中,x2是环烷基。在一些实施方案中,x2是h、f、cl、br、me、cf2h、cf2cl或cf3。在一些实施方案中,x2是h、f或cl。在一些实施方案中,x2是f或cl。在一些实施方案中,x2是h或cl。在一些实施方案中,x2是f。在一些实施方案中,x2是cf3。在一些实施方案中,x2是cf2cl。在一些实施方案中,x2是cl。
[0150]
在一些实施方案中,x3是h、卤素、烷基或卤代烷基。在任一个本文中所述的实施方案中,x3可以是h、卤素、氟代烷基或烷基。在一些实施方案中,x3是h或卤素。在另一些实施方案中,x3是氟代烷基或烷基。在一些实施方案中,x3是h、f、cl、br、me、cf2h、cf2cl或cf3。在一些实施方案中,x3是h、f或cl。在一些实施方案中,x3是f或cl。在一些实施方案中,x3是h或cl。在一些实施方案中,x3是f。在一些实施方案中,x3是cf3。在一些实施方案中,x3是cf2cl。在一些实施方案中,x3是cl。
[0151]
在一些实施方案中,结构部分具有
的结构。
[0152]
在任一个本文中所述的实施方案中,r3是h、烷基或卤素。在一些实施方案中,r3是卤素。在一些实施方案中,r3是h、卤素或烷基。烷基的非限制性实例包括me、et、丙基、异丙基、正丁基、异丁基、叔丁基和仲丁基。在一些实施方案中,r3是h。
[0153]
在一些实施方案中,式i的化合物具有式ii’或ii的结构,其中r3的每次出现独立地为h、卤素或烷基,n5是0-3的整数,且其它取代基如本文中所定义。
[0154]
在一些实施方案中,z是ora。在一些实施方案中,z是oh、ome、oet、opr、o-i-pr、o-t-bu、o-iso-bu、o-sec-bu或obu。在一些实施方案中,z是oh。
[0155]
在一些实施方案中,n5是0-3的整数。在一些实施方案中,n5是1-3的整数。在一些实施方案中,n5是0。在一些实施方案中,n5是1或2。在一些实施方案中,n5是1。在一些实施方案中,r3’
是h或烷基。在一些实施方案中,r3’
是h。在一些实施方案中,r3’
是烷基。在一些实施方案中,r3’
是卤素。
[0156]
在任一个本文中所述的实施方案中,ra或rb的至少一次出现独立地为h、烷基、环烷基、饱和杂环、芳基或杂芳基。在一些实施方案中,ra或rb的至少一次出现独立地为h、me、et、pr或bu。在一些实施方案中,ra或rb的至少一次出现独立地为选自
的杂环;其中杂环任选被烷基、oh、氧代或(c=o)c
1-4
烷基(在价态允许的情况下)取代。
[0157]
在一些实施方案中,ra和rb与它们所连接的氮原子一起形成包括所述氮原子和0-3个各自选自n、o和s的附加杂原子的任选被取代的杂环。
[0158]
在一些实施方案中,杂环选自
[0159]
在一些实施方案中,式i的化合物选自下表4中所示的化合物1-62。
[0160]
在一些实施方案中,式i的化合物选自下表5中所示的化合物63-78、83-85、87-88、90-94、96-97、99-104、109-176、180-208、213-220、223-293。
[0161]
缩写acn
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙腈alloc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
烯丙氧基羰基boc或boc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
叔丁氧基羰基dcm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二氯甲烷diea
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n,n-二异丙基乙胺dipa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二异丙胺dmf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4-二甲基氨基吡啶ea
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙酸乙酯edci或edc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1-乙基-3-(3-二甲基氨基丙基)碳二亚胺fmoc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
芴甲氧羰酰胺hatu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n-[(二甲基氨基)(3h-1,2,3-三唑并(4,4-b)吡啶-3-基氧基)亚甲基]-n-甲基甲烷六氟磷酸铵lihmds
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
六甲基二硅杂氮化锂hobt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1-羟基苯并三唑pe
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
石油醚tbtu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基四氟硼酸铵tea
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三乙胺tfa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三氟乙酸thf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
四氢呋喃
troc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2,2,2-三氯乙氧羰基tsoh
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
对甲苯磺酸。
[0162]
制备方法以下是用于制造本发明的化合物的一般合成方案。这些方案是说明性的,且并不意味着限制本领域技术人员可用于制造本文中公开的化合物的可能技术。不同的方法对本领域技术人员将是显而易见的。此外,合成中的各个步骤可以以交替的顺序或次序进行,以获得所需的一种或多种化合物。本文引用的所有文献经此引用以其全文并入本文。例如,以下反应是对本文公开的一些原材料和化合物的制备的说明而非限制。
[0163]
下面的方案1-8描述了可用于合成本发明的化合物,例如具有式i的结构的化合物或其前体的合成路线。本领域技术人员可设想对这些方法的各种修改以实现与下文给出的本发明的结果类似的结果。在以下实施方案中,使用具有式i的结构的化合物或其前体作为实施例来描述合成路线。方案1-8中描述的一般合成路线和以下实施例部分中描述的实施例阐述了用于制备本文中描述的化合物的方法。
[0164]
下文就在方案1中显示的化合物i-1a和i-2可以通过本领域中已知的任何方法制备和/或可购得。如方案1中所示,pg是指保护基团。保护基团的非限制性实例包括me、烯丙基、ac、boc、其它烷氧基羰基、二烷基氨基羰基、或本领域中已知适于用作oh和胺基团的保护基团的另一保护基团。在本文中定义了其它取代基。如方案1中所示,式i的化合物的核可以由合适的取代溴苯或碘苯i-1a来合成,所述取代溴苯或碘苯i-1a通过用例如正丁基锂的金属化和与硼酸三烷基酯如硼酸三甲酯的反应来转化为相应的硼酸i-1b。酮酯i-2与碱如lihmds和n-苯基三氟甲磺酰亚胺反应以形成烯醇三氟甲磺酸酯i-3。烯醇三氟甲磺酸酯i-3与硼酸i-1b在催化剂如1,1
′‑
双(二苯基膦基)-二茂铁二氯化钯(ii)(pd(dppf)cl2)的存在下偶联获得了环状胺i-4。i-4在催化剂如氧化铂上的氢化得到饱和的环状胺酯i-5a。选择性除去化合物i-5a的氮上的保护基团提供了相应的环状胺酯i-5c。可以随后除去化合物i-5c中的保护基团,并且所得具有游离酚oh基团的化合物可以任选使用本领域中已知的方法转化为式i的化合物。
[0165]
下文就在方案2中显示的化合物i-1a可以通过本领域中已知的任何方法制备和/或可购得。如方案2中所示,pg是指保护基团。保护基团的非限制性实例包括me、烯丙基、ac、boc、其它烷氧基羰基、二烷基氨基羰基、或本领域中已知适于用作oh的保护基团的另一保护基团。在本文中定义了其它取代基。如方案2中所示,其中n1=1的式i的化合物可以通过本文中显示的替代路线来制备。碘苯或溴苯i-1a与吡啶硼酸酯i-6在钯催化剂如pd(dppf)cl2的存在下偶联以形成4-芳基吡啶酯i-8,或与氰基吡啶硼酸酯i-7偶联以形成4-芳基吡啶腈i-9。酯i-8在催化剂如氧化铂上的氢化提供了4-芳基哌啶i-5b。可以随后除去化合物i-5b中的保护基团,并且所得具有游离酚oh基团的化合物可以任选使用本领域中已知的方法转化为式i的化合物。
[0166]
如方案3中所示,pg是指保护基团。保护基团的非限制性实例包括me、烯丙基、ac、boc、其它烷氧基羰基、二烷基氨基羰基、或本领域中已知适于用作oh的保护基团的另一保护基团。在本文中限定了其它取代基。中间体,氨基甲基杂环i-12a和i-12b可以通过就以下方案3中所示的几种途径获得。对其中n1=1的式i的化合物而言,吡啶腈i-9(如方案2中所示)可以通过用碱性过氧化物水解来转化为伯酰胺i-10,或用硼烷-四氢呋喃复合物还原为氨基甲基吡啶i-11。i-10或i-11的吡啶环在催化剂如氧化铂上在酸如盐酸或乙酸的存在下的氢化分别生成了相应的哌啶i-13或i-12a。或者,i-9在类似条件下的氢化直接得到了i-12a。在适用于所有环尺寸的方法中,酯i-5c(如方案1中所示)通过在密封容器中与氨一起在甲醇中加热来转化为伯酰胺i-13。用硼烷-甲基硫化物还原酰胺i-13提供了二胺i-12b。可以任选除去化合物i-12a、i-12b和i-13中的保护基团以使用本领域中已知的方法提供式i的化合物。
[0167]
如方案4中所示,pg是指保护基团。保护基团的非限制性实例包括me、烯丙基、ac、boc、其它烷氧基羰基、二烷基氨基羰基、或本领域中已知适于用作oh的保护基团的另一保护基团。在本文中定义了其它取代基。二胺i-12b可以用于通过就下文方案4中所示的两种途径之一制备二环酰胺i-17。使用肽偶联剂如edci/hobt、tbtu或hatu的用羧酸raco2h酰化i-12b在伯胺上选择性进行以获得i-14。用氯乙酰氯在环胺上酰化i-14得到氯乙酰胺i-15,其在极性溶剂如dmf中用碱如碳酸铯处理来环化以形成哌嗪酮i-16。如果保护基是甲基,例如用三溴化硼脱保护酚上的保护基团,得到i-17。或者,选择性保护i-12b的伯胺(例如用boc基团)以获得i-18。用氯乙酰氯酰化为i-19和用碱环化随后同时将胺和酚脱保护的类似序列得到i-20,其可以在标准条件下用羧酸raco2h酰化以提供i-17。化合物i-20可以用于通过标准方法提供在氮上具有其它r4基团的化合物。
[0168]
如方案5中所示,pg是指保护基团。保护基团的非限制性实例包括me、烯丙基、ac、boc、其它烷氧基羰基、二烷基氨基羰基、或本领域中已知适于用作oh的保护基团的另一保护基团。在本文中定义了其它取代基。如就以下方案5中所示,合成了其中y是氧的式i的化合物。在加热下用例如硼烷-四氢呋喃将环状胺酯i-5c(如方案1中所示)还原为醇i-21。使用诸如hatu、tbtu或edc/hobt的试剂使i-21与2-环氧乙烷甲酸的钾盐偶联以形成环氧酰胺i-22。用碱(如氢化钠)在惰性溶剂(如thf)中处理环氧化物i-22导致环化为i-23。i-23中的羟甲基可以通过标准方法转化为其它取代基。除去保护基团提供了游离酚。
[0169]
如方案6中所示,pg是指保护基团。保护基团的非限制性实例包括me、烯丙基、ac、boc、其它烷氧基羰基、二烷基氨基羰基、或本领域中已知适于用作oh的保护基团的另一保护基团。在本文中定义了其它取代基。通过就以下方案6所示的两种途径之一由氨基醇i-21获得具有其中y为n的环体系的式i的化合物(例如在c3位置处被r2取代的8-苯基-八氢-4h-吡啶并[1,2-a]吡嗪-4-酮(i-27))。使用偶联剂如hatu、tbtu或edc/hobt用适当保护的氨基酸酰化i-21(如方案5中所示)得到了酰胺i-24。通常,氨基用boc保护,但其它保护基团如alloc、troc或fmoc也可以使用。使用dess-martin试剂或swern氧化条件将伯醇氧化为醛i-25。用tfa除去胺保护基团导致环化为i-26,并通过氢化或用硼氢化钠来还原亚胺双键。在一个替代程序中,首先用boc基团保护i-21的胺以形成i-28,用dess-martin试剂将所述i-28氧化为醛i-29。该醛i-29在还原剂如三乙酰氧基硼氢化钠或氰基硼氢化钠的存在下与氨基酸酯发生还原性胺化以获得i-30。除去氮上的boc保护基团随后与碱(如三乙胺)一起在溶剂(如乙醇)中加热导致环化为i-27。i-27可以通过胺用标准方法的衍生化和去除保护基团以获得游离酚来进一步修饰,以形成(afform)附加的式i的化合物。
[0170]
如方案7中所示,pg是指保护基团。保护基团的非限制性实例包括me、烯丙基、ac、boc、其它烷氧基羰基、二烷基氨基羰基、或本领域中已知适于用作oh和胺基团的保护基团的另一保护基团。在本文中定义了其它取代基。通过就以下方案7所示的途径由受保护的氨基酯i-5a(如方案1中所示)制备具有其中y为n的环体系的式i的化合物(例如在c1处被r2取代的8-苯基-八氢-4h-吡啶并[1,2-a]吡嗪-4-酮(i-35))。酯i-5a首先水解为羧酸,并通过用n,o-二甲基羟胺和偶联剂如羰基二咪唑或edc/hobt处理转化为weinreb酰胺i-31。i-31与格氏试剂r2mgbr反应形成酮i-32。随后选择性除去氮上的保护基团。当pg是boc时,可以通过使用tfa来实现boc基团的去除。环状胺用受保护的氨基酸如boc甘氨酸酰化以获得酰胺i-33。用tfa除去boc基团并同时将胺环化到酮上形成了环状亚胺i-34。用硼氢化钠还原亚胺获得环状胺i-35,其可以通过例如由标准方法进行的酰化或烷基化而在胺氮上进一步修饰。去除酚上的保护基团以获得游离酚可在胺的衍生化之前或之后进行。
[0171]
如方案8中所示,pg是指保护基团。保护基团的非限制性实例包括me、烯丙基、ac、boc、其它烷氧基羰基、二烷基氨基羰基、或本领域中已知适于用作oh的保护基团的另一保护基团。在本文中定义了其它取代基。中间体i-5d的立体选择性合成就如以下方案8所示。对映体纯的哌啶酮i-36由受保护的l-天冬氨酸和米氏酸通过org.syn.,2008,85,147中描述的方法来合成,并随后根据syn.lett.2009,71-74中描述的程序通过用三氟甲磺酸酐和碱处理转化为烯醇三氟甲磺酸酯i-37。该烯醇三氟甲磺酸酯i-37使用钯催化剂(如pd(dppf)cl2)与硼酸i-1b偶联以获得i-39。在催化剂(如氧化铂)上氢化i-17获得了主要作为2s,4s对映异构体的哌啶酮i-40,并使用硼烷甲硫醚络合物还原酰胺以提供对映体纯的i-5d,其可以用于方案3、4、5、6和7中概述的合成。
[0172]
上述方案1-8中描述的反应可以在合适的溶剂中进行。合适的溶剂包括但不限于acn、甲醇、乙醇、dcm、dmf、thf、mtbe或甲苯。方案1-8中描述的反应可在惰性气氛下,例如在氮气或氩气下进行,或反应可在密封管中进行。反应混合物可在微波中加热或加热至提高的温度。合适的提高的温度包括但不限于40、50、60、80、90、100、110、120℃或更高,或所用溶剂的回流/沸腾温度。或者可在冷浴中在低于室温的温度下冷却反应混合物,例如0、-10、-20、-30、-40、-50、-78或-90℃。反应可通过除去溶剂或将有机溶剂相分配到一个或多个水相中来进行,每个水相任选地含有nacl、nahco3或nh4cl。有机相中的溶剂可以通过真空蒸发除去,并且所得残余物可使用硅胶柱或hplc提纯。
[0173]
药物组合物本发明还提供了包括如本文中所述的化合物中的至少一种或其可药用盐或溶剂合物,以及可药用载体的药物组合物。
[0174]
在再一方面,本发明提供了包括至少一种选自本文中所述的式i的化合物的化合物以及可药用载体或稀释剂的药物组合物。
[0175]
在某些实施方案中,组合物为水合物、溶剂合物或可药用盐的形式。组合物可以通过任何合适的施用途径施用给受试者,包括但不限于口服和肠胃外施用。
[0176]
本文中所用的短语“可药用载体”是指可药用材料、组合物或媒介物,如液体或固体填料、稀释剂、赋形剂、溶剂或包封材料,涉及将主题药剂从一个器官或身体的一部分携带或运输至另一器官或身体的另一部分。每种载体必须是“可接受的”,即与该制剂的其它成分相容并且对患者无害。可以充当可药用载体的材料的一些实例包括:糖,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,如羧甲基纤维素钠、乙基纤维素和醋酸纤维素;粉末状黄蓍胶;麦芽;明胶;滑石;赋形剂,如可可脂和栓剂蜡;油,如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和大豆油;二醇,如丁二醇;多元醇,如甘油、山梨醇、甘露醇和聚乙二醇;酯类,如油酸乙酯和月桂酸乙酯;琼脂;缓冲剂,如氢氧化镁和氢氧化铝;海藻酸;无热原水;等渗盐水;林格氏溶液;乙醇;磷酸盐缓冲溶液;和其它用于药
物制剂的无毒相容性物质。术语“载体”表示天然或合成的有机或无机成分,活性成分与其组合以促进应用。药物组合物的组分也能够以不存在将显著损害期望的药物效率的相互作用的方式与本发明的化合物混合和彼此混合。
[0177]
如上所述,本发明的药剂的特定实施方案可以以可药用盐形式提供。术语“可药用盐”在这方面是指本发明的化合物的相对无毒、无机和有机酸盐。这些盐可以在本发明的化合物的最终分离和提纯过程中原位制备,或通过其游离碱形式的本发明的纯化化合物与合适的有机或无机酸分别反应,并分离由此形成的盐来制备。代表性的盐包括氢溴酸盐、盐酸盐、硫酸盐、硫酸氢盐、磷酸盐、硝酸盐、乙酸盐、戊酸盐、油酸盐、棕榈酸盐、硬脂酸盐、月桂酸盐、苯甲酸盐、乳酸盐、磷酸盐、甲苯磺酸盐、柠檬酸盐、马来酸盐、富马酸盐、琥珀酸盐、酒石酸盐、萘酸盐(napthylate)、甲磺酸盐、葡庚糖酸盐、乳糖酸盐和月桂基磺酸盐等。参见例如berge等人,(1977)“pharmaceutical salts”,j.pharm.sci.66:1-19。
[0178]
主题化合物的可药用盐包括化合物的常规无毒盐或季铵盐,例如来自无毒的有机或无机酸。例如,此类常规无毒盐包括衍生自无机酸的那些,所述无机酸如盐酸盐、氢溴酸盐、硫酸盐、氨基磺酸盐、磷酸盐、硝酸盐等;和由有机酸如乙酸、丁酸、琥珀酸、乙醇酸、硬脂酸、乳酸、苹果酸、酒石酸、柠檬酸、抗坏血酸、棕榈酸、马来酸、羟基马来酸、苯乙酸、谷氨酸、苯甲酸、水杨酸、对氨基苯磺酸、2-乙酰氧基苯甲酸、富马酸、甲苯磺酸、甲磺酸、乙烷二磺酸、草酸、2-羟乙磺酸等制备的盐。
[0179]
在其它方面,本发明的化合物可含有一个或多个酸性官能团,并由此能够与可药用碱形成可药用盐。术语“可药用盐”在这些情况下是指本发明的化合物的相对无毒的无机和有机碱加成盐。这些盐同样可以在化合物的最终分离和提纯过程中原位制备,或者通过将提纯化合物以其游离酸形式与合适的碱,如可药用金属阳离子的氢氧化物、碳酸盐或碳酸氢盐,与氨,或与可药用有机伯胺、仲胺或叔胺单独反应来制备。代表性碱或碱土金属盐包括锂、钠、钾、钙、镁、铝盐等。可用于形成碱加成盐的代表性有机胺包括乙胺、二乙胺、乙二胺、乙醇胺、二乙醇胺、哌嗪等。参见例如berge等人,见上。
[0180]
润湿剂、乳化剂和润滑剂,如十二烷基硫酸钠、硬脂酸镁和聚环氧乙烷-聚环氧丁烷共聚物,以及着色剂、释放剂、包衣剂、甜味剂、调味剂和芳香剂、防腐剂和抗氧化剂也可以存在于组合物中。
[0181]
本发明的制剂包括适于口服、经鼻、局部(包括口腔和舌下)、直肠、阴道和/或肠胃外施用的那些。制剂可方便地以单位剂型存在,并可通过药学领域公知的任何方法制备。可以与载体材料组合以产生单一剂型的活性成分的量将根据治疗的宿主和特定的施用方式而变化。可以与载体材料组合以产生单一剂型的活性成分的量将通常是产生治疗效果的化合物的量。通常,在100%中,该量将为大约1%至大约99%的活性成分、优选大约5%至大约70%、和最优选大约10%至大约30%。
[0182]
制备这些制剂或组合物的方法包括将本发明的化合物与载体和任选的一种或多种辅助成分结合的步骤。通常,通过将本发明的化合物与液体载体或细散固体载体或二者均匀且紧密地结合,并随后在需要的情况下将产品成形来制备制剂。
[0183]
适于口服施用的本发明的制剂可以为胶囊、扁囊剂、丸剂、片剂、锭剂(使用调味基质,通常为蔗糖和阿拉伯胶或黄蓍胶)、粉剂、颗粒剂、或作为在水性或非水性液体中的溶液剂或混悬剂、或作为水包油或油包水液体乳剂、或作为酏剂或糖浆剂、或作为软锭剂(使用
惰性基质,如明胶和甘油、或蔗糖和阿拉伯胶)和/或作为漱口剂等等的形式,各自含有预定量的本发明的化合物作为活性成分。本发明的化合物也可以以大丸剂、药糖剂或糊剂形式施用。
[0184]
在本发明的用于口服施用的固体剂型(胶囊、片剂、丸剂、糖衣丸剂、粉剂、颗粒剂等)中,将活性成分与一种或多种可药用载体混合,如柠檬酸钠或磷酸二钙,和/或以下的任意一种:填料或增量剂,如淀粉、乳糖、蔗糖、葡萄糖、甘露醇和/或硅酸;粘合剂,如羧甲基纤维素、藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和/或阿拉伯胶;保湿剂,如甘油;崩解剂,如琼脂、碳酸钙、马铃薯或木薯淀粉、海藻酸、某些硅酸盐、碳酸钠和淀粉羟乙酸钠;溶液缓凝剂,如石蜡;吸收促进剂,如季铵化合物;润湿剂,如鲸蜡醇、单硬脂酸甘油酯和聚环氧乙烷-聚环氧丁烷共聚物;吸收剂,如高岭土和膨润土;润滑剂,如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、月桂基硫酸钠及其混合物;和着色剂。在胶囊、片剂和丸剂的情况下,药物组合物还可包括缓冲剂。类似类型的固体组合物也可用作软和硬填充明胶胶囊中的填充剂,所述胶囊使用诸如乳糖或牛奶糖以及高分子量聚乙二醇等的赋形剂。
[0185]
片剂可任选与一种或多种辅助成分一起通过压制或模塑制得。压制片剂可使用粘合剂(例如明胶或羟丁基甲基纤维素)、润滑剂、惰性稀释剂、防腐剂、崩解剂(例如淀粉羟乙酸钠或交联羧甲基纤维素钠)、表面活性剂或分散剂来制备。模塑片剂可通过在合适的机器中模塑用惰性液体稀释剂润湿的粉末化合物的混合物来制造。
[0186]
本发明的药物组合物的片剂和其它固体剂型,如糖衣丸剂、胶囊、丸剂和颗粒剂,可任选刻痕或用包衣和壳,如肠溶衣和药物配制领域公知的其它包衣来制备。其也可采用例如提供所需释放曲线的不同比例的羟丁基甲基纤维素、其它聚合物基质、脂质体和/或微球配制以提供其中的活性成分的缓慢或受控释放。它们可通过例如经细菌截留滤器过滤或通过以无菌固体组合物形式并入灭菌剂来灭菌,所述无菌固体组合物可以在临使用前溶解在无菌水或某些其它无菌可注射介质中。这些组合物还可任选含有遮光剂,并且可以是其仅仅或优选在胃肠道的特定部分中任选以延迟方式释放一种或多种活性成分的组合物。可以使用的包埋组合物的实例包括聚合物质和蜡。活性成分也可以是微胶囊化形式,(如果合适的话)与一种或多种上述赋形剂一起。
[0187]
用于口服施用本发明的化合物的液体剂型包括可药用乳剂、微乳剂、溶液、混悬剂、糖浆剂和酏剂。除活性成分外,液体剂型可含有本领域中通常使用的惰性稀释剂,例如水或其它溶剂、增溶剂和乳化剂,如乙醇、异丁醇、碳酸乙酯、ea、苄醇、苯甲酸苄酯、丁二醇、1,3-丁二醇、油(特别是棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢呋喃醇、聚乙二醇和脱水山梨醇的脂肪酸酯,及其混合物。此外,环糊精,例如羟丁基-β-环糊精,可用于溶解化合物。
[0188]
除惰性稀释剂外,口服组合物还可以包括佐剂,如润湿剂、乳化剂和悬浮剂、甜味剂、调味剂、着色剂、芳香剂和防腐剂。
[0189]
除活性化合物外,混悬剂可含有悬浮剂,如乙氧基化异硬脂醇、聚氧乙烯山梨糖醇和脱水山梨糖醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂和黄蓍胶,及其混合物。
[0190]
用于本发明的化合物的局部或透皮施用的剂型包括粉剂、喷雾剂、软膏剂、糊剂、霜剂、洗剂、凝胶剂、溶液剂、贴剂和吸入剂。活性化合物可在无菌条件下与可药用载体以及与可需要的任何防腐剂、缓冲剂或推进剂混合。
[0191]
除本发明的活性化合物外,软膏剂、糊剂、霜剂和凝胶剂可含有赋形剂,如动物和植物脂肪、油、蜡、石蜡、淀粉、黄蓍胶、纤维素衍生物、聚乙二醇、硅酮、膨润土、硅酸、滑石和氧化锌,或其混合物。
[0192]
除本发明的化合物外,粉剂和喷雾剂可以含有赋形剂,如乳糖、滑石、硅酸、氢氧化铝、硅酸钙和聚酰胺粉末,或这些物质的混合物。喷雾剂可以附加地含有常规推进剂,如氯氟烃和挥发性的未取代烃类,如丁烷。
[0193]
透皮贴剂具有向身体受控递送本发明的化合物的附加优点。此类剂型可以通过将药剂溶解或分散在适当的介质中来制造。吸收促进剂也可以用于提高本发明的药剂穿过皮肤的通量。此类通量的速率可以通过提供速率控制膜或将化合物分散在聚合物基质或凝胶中来控制。
[0194]
眼用制剂、眼膏、粉剂、溶液等也被认为在本发明的范围内。
[0195]
适于肠胃外给药的本发明的药物组合物包括与以下组合的一种或多种本发明的化合物:一种或多种可药用无菌等渗水性或非水性溶液、分散液、悬浮液或乳液;或无菌粉末,其可在临用前重构为无菌可注射溶液或分散液,其可含有抗氧化剂、缓冲剂、抑菌剂或使制剂与预期接受者的血液等渗的溶质,或悬浮剂或增稠剂。
[0196]
在一些情况下,为了延长药物的效果,合意的是减慢来自皮下或肌内注射的药物的吸收。这可通过使用水溶性差的结晶或非晶材料的液体悬浮液来实现。药物的吸收速率随之取决于其溶解速率,而所述溶解速率转而可取决于晶体尺寸和晶形。或者,通过将药物溶解或悬浮在油媒介物中来实现胃肠外给药的药物形式的延迟吸收。贮库注射的一种策略包括使用聚环氧乙烷-聚环氧丙烷共聚物,其中媒介物在室温下为流体,并在体温下凝固。
[0197]
通过在生物可降解聚合物如聚丙交酯-聚乙交酯中形成主题化合物的微胶囊基质来制造可注射的贮库形式(depot form)。根据药物对聚合物的比以及所用特定聚合物的性质,可以控制药物释放速率。其它可生物降解的聚合物的实例包括聚(原酸酯)和聚(酸酐)。贮库型注射制剂也可以通过将药物包埋在与身体组织相容的脂质体或微乳剂中来制备。
[0198]
当本发明的化合物作为药物给予人和动物时,它们可以原样(纯净的)提供或作为药物组合物提供,所述药物组合物含有例如0.1%至99.5%(更优选0.5%至90%)的活性成分以及可药用载体。
[0199]
本发明的化合物和药物组合物可以用于联合疗法,即化合物和药物组合物可以与一种或多种其它所需治疗或医疗程序同时、在此之前或之后施用。在组合方案中使用的疗法的特定组合(疗法或程序)将考虑所需疗法和/或程序的相容性和要实现的所需治疗效果。还应理解,所用的疗法可对相同病症实现所需效果(例如,本发明的化合物可与另一抗癌剂同时施用)。
[0200]
本发明的化合物可以以静脉内、肌内、腹膜内、皮下、局部、口服或通过其它可接受的方式施用。化合物可用于治疗哺乳动物(例如人、家畜和驯养动物)、赛马、鸟类、蜥蜴和任何其它可以耐受化合物的生物体的关节炎病症。
[0201]
本发明还提供了一种药物包或试剂盒,其包括一个或多个填充有一种或多种本发明药物组合物的成分的容器。任选地,与此类一种或多种容器结合的可以是管理药物或生物制品的制造、使用或销售的政府机构所规定的形式的通知,该通知反映了制造、使用或销售机构批准用于人类施用。
[0202]
施用于受试者在再一方面,本发明提供了在有此需要的哺乳动物物种中治疗病症的方法,该方法包括对哺乳动物物种施用治疗有效量的至少一种选自式i的化合物的化合物或其可药用盐,其中病症选自癌症、免疫学病症、中枢神经系统病症、炎症性病症、胃肠病、代谢病症、心血管病症和肾脏疾病。
[0203]
在一些实施方案中,癌症选自胆道癌、脑癌、乳腺癌、宫颈癌、绒毛膜癌、结肠癌、子宫内膜癌、食道癌、胃部(胃)癌、上皮内肿瘤、白血病、淋巴瘤、肝癌、肺癌、黑色素瘤、神经母细胞瘤、口腔癌、卵巢癌、胰腺癌、前列腺癌、直肠癌、肾(肾脏)癌、肉瘤、皮肤癌、睾丸癌和甲状腺癌。
[0204]
在一些实施方案中,炎症性病症是炎症性皮肤病症、关节炎、银屑病、脊椎炎、牙周炎或炎症性神经疾病。在一些实施方案中,胃肠病是炎症性肠病如克罗恩病或溃疡性结肠炎。
[0205]
在一些实施方案中,免疫学病症是移植排斥或自身免疫性疾病(例如类风湿性关节炎、多发性硬化、系统性红斑狼疮或i型糖尿病)。在一些实施方案中,中枢神经系统(cns)病症是阿尔茨海默氏病。
[0206]
在一些实施方案中,代谢病症是肥胖或ii型糖尿病。在一些实施方案中,心血管病症是缺血性中风。在一些实施方案中,肾脏疾病是慢性肾病、肾炎或慢性肾衰竭。
[0207]
在一些实施方案中,哺乳动物物种是人类。
[0208]
在一些实施方案中,病症选自癌症、移植排斥、类风湿性关节炎、多发性硬化、系统性红斑狼疮、i型糖尿病、阿尔茨海默氏病、炎症性皮肤病症、炎症性神经疾病、银屑病、脊椎炎、牙周炎、炎症性肠病、肥胖、ii型糖尿病、缺血性中风、慢性肾病、肾炎、慢性肾衰竭及其组合。
[0209]
在再一方面,描述了在有此需要的哺乳动物物种中阻断kv1.3钾通道的方法,包括向哺乳动物物种施用治疗有效量的至少一种式i的化合物、或其可药用盐。
[0210]
在一些实施方案中,本文中描述的化合物选择性阻断kv 1.3钾通道,而对其它钾通道或对钙或钠通道具有最小的脱靶抑制活性或没有脱靶抑制活性。在一些实施方案中,本文中描述的化合物不阻断herg通道,并因此具有合意的心血管安全性。
[0211]
本发明的一些方面涉及向受试者施用有效量的组合物以实现特定结果。根据本发明的方法有用的小分子组合物由此可以以任何适于药物用途的方式配制。
[0212]
本发明的制剂以可药用溶液形式施用,所述溶液可常规地含有药学可接受浓度的盐、缓冲剂、防腐剂、相容性载体、佐剂和任选的其它治疗成分。
[0213]
对于在治疗中的用途而言,可以通过任何允许化合物被适当的靶细胞吸收的方式将有效量的化合物施用于受试者。本发明的药物组合物的“施用”可以通过本领域技术人员已知的任何方法来实现。具体的施用途径包括但不限于口服、透皮(例如经由贴剂)、肠胃外注射(皮下、皮内、肌内、静脉内、腹膜内、鞘内等)或粘膜(鼻内、气管内、吸入、直肠内、阴道内等)。注射可以是弹丸式注射或连续输注。
[0214]
例如,根据本发明的药物组合物通常通过静脉内、肌内或其它肠胃外方式施用。它们也可以通过鼻内施用、吸入、局部、口服或作为植入物施用;甚至直肠或阴道使用也是可能的。合适的液体或固体药物制剂形式是例如用于注射或吸入的水溶液或盐水溶液、微囊
化的、螺卷化的(encochleated)、涂覆到微观金粒子上的、包含在脂质体中的、雾化的、气溶胶、用于植入皮肤的丸剂,或干燥到要擦入皮肤的尖锐物体上。药物组合物还包括颗粒剂、粉剂、片剂、包衣片剂、(微)胶囊、栓剂、糖浆剂、乳剂、混悬剂、霜剂、滴剂或延长释放活性化合物的制剂,在其制剂中,赋形剂和添加剂和/或助剂如崩解剂、粘合剂、包衣剂、溶胀剂、润滑剂、调味剂、甜味剂或增溶剂如上所述常规地使用。药物组合物适用于各种药物递送体系。为了简要回顾目前的药物递送方法,参见langer r(1990)science 249:1527-33,其经此引用并入本文。
[0215]
本发明的方法中使用的组合物中包含的化合物浓度可以为大约1nm至大约100μm。有效剂量据信为大约10皮摩/千克至大约100微摩/千克。
[0216]
药物组合物优选以剂量单位制备和施用。液体剂量单位是用于注射或其它肠胃外给药的小瓶或安瓿。固体剂量单位是片剂、胶囊剂、粉剂和栓剂。对于患者的治疗而言,根据化合物的活性、施用方式、施用目的(即预防或治疗)、疾病的性质和严重程度以及患者的年龄和体重,可能需要不同的剂量。给定剂量的施用可以通过以单独剂量单位形式的单次施用或几个更小的剂量单位进行。本发明还考虑了以数天、数周或数月的特定间隔重复和多次施用。
[0217]
组合物可以原样(纯的)施用,或以可药用盐的形式施用。当用于药物时,盐应当是可药用的,但非可药用盐可以方便地用于制备其可药用盐。此类盐包括但不限于由以下酸制备的那些:盐酸、氢溴酸、硫酸、硝酸、磷酸、马来酸、乙酸、水杨酸、tsoh(对甲苯磺酸)、酒石酸、柠檬酸、甲磺酸、甲酸、丙二酸、琥珀酸、萘-2-磺酸和苯磺酸。同样,此类盐可以制备为碱金属盐或碱土金属盐,如羧酸基团的钠、钾或钙盐。
[0218]
合适的缓冲剂包括:乙酸和盐(1-2%w/v);柠檬酸和盐(1-3%w/v);硼酸和盐(0.5-2.5%w/v);和磷酸和盐(0.8-2%w/v)。合适的防腐剂包括苯扎氯铵(0.003-0.03%w/v);氯丁醇(0.3-0.9%w/v);对羟基苯甲酸酯(0.01-0.25%w/v);和硫柳汞(0.004-0.02%w/v)。
[0219]
适于肠胃外施用的组合物方便地包括无菌水性制剂,其可以与接受者的血液等渗。可接受的媒介物和溶剂尤其是水、林格氏溶液、磷酸盐缓冲盐水和等渗氯化钠溶液。此外,无菌的不挥发性油常规用作溶剂或悬浮介质。为此,可使用任何温和的不挥发性的矿物油或非矿物油,包括合成的甘油单酯或甘油二酯。此外,脂肪酸如油酸可用于制备注射剂。适于皮下、肌内、腹膜内、静脉内等等施用的载体制剂可以见于remington’s pharmaceutical sciences,mack publishing company,easton,pa。
[0220]
可用于本发明的化合物可以以超过两种的此类化合物的混合物形式递送。除化合物的组合外,混合物可以进一步包括一种或多种佐剂。
[0221]
可用多种给药路线。当然,所选择的特定模式将取决于所选的特定化合物、受试者的年龄和一般健康状况、治疗的特定病症和治疗功效所需的剂量。一般而言,本发明的方法可以使用任何医学上可接受的施用方式来实施,即产生有效水平的应答而不引起临床上不可接受的副作用的任何方式。优选的施用方式如上所述。
[0222]
组合物可以方便地以单位剂型形式存在,并可以通过药学领域公知的任何方法来制备。所有方法包括将化合物与构成一种或多种辅助成分的载体结合的步骤。通常,通过将化合物与液体载体、细散固体载体或二者均匀且紧密地结合,并随后在需要的情况下使产
物成形来制备组合物。
[0223]
其它递送体系可以包括定时释放、延迟释放或持续释放递送体系。此类体系可以避免化合物的重复施用,提高了对受试者和医师的便利性。许多类型的释放递送体系是可用的,并且是本领域普通技术人员已知的。它们包括聚合物基体系如聚(丙交酯-乙交酯)、共聚草酸酯、聚己内酯、聚酯酰胺、聚原酸酯、聚羟基丁酸和聚酸酐。含有药物的前述聚合物的微胶囊描述在例如美国专利号5,075,109中。递送体系还包括非聚合物体系,其为:脂质,包括甾醇如胆固醇、胆固醇酯和脂肪酸,或中性脂肪如甘油单酯、二酯和三酯;水凝胶释放体系;硅橡胶体系;基于肽的体系;蜡涂层;使用常规粘合剂和赋形剂的压制片剂;部分融合的植入物;等等。具体的实例包括但不限于:(a)侵蚀体系(erosional system),其中本发明的试剂以基质内的形式包含,如美国专利号4,452,775、4,675,189和5,736,152中描述的那些,和(b)扩散体系,其中活性组分以受控速率从聚合物渗透,如美国专利号3,854,480、5,133,974和5,407,686中所述。此外,可以使用基于泵的硬件输送系统,其中一些适于植入。
[0224]
kv1.3钾通道阻滞剂的有效性的测定在一些实施方案中,对本文中所述的化合物测试其对kv1.3钾通道的活性。在一些实施方案中,对本文中所述的化合物测试其kv1.3钾通道电生理。在一些实施方案中,对本文中描述的化合物测试其herg电生理。
[0225]
等效方案下面的代表性实施例意在帮助说明本发明,而非意在也不应被解释为限制本发明的范围。实际上,除了本文中显示和描述的那些之外,本发明的各种修改和许多其它实施方案对于本领域技术人员而言将由本文的全部内容(包括以下实施例和对本文中引用的科学与专利文献的参考)变得显而易见。还应当理解的是,这些引用的参考文献的内容经此引用并入本文以帮助说明现有技术的状态。以下实施例含有重要的附加信息、例证和指导,其可以以其各种实施方案和其等效方案适于本发明的实践。
实施例
[0226]
实施例1-7描述了用于合成本文中公开的式i的代表性化合物的各种中间体。
[0227]
实施例1.中间体1(2-溴-3,4-二氯-1-甲氧基苯)和中间体2(1-溴-4,5-二氯-2-甲氧基苯)步骤a:在0℃下在氮气气氛下向3,4-二氯苯酚(100.00克,613.49毫摩尔)在dcm(1000毫
升)中的搅拌溶液中逐滴加入br2(98.04克,613.49毫摩尔)。反应溶液在室温下在氮气气氛下搅拌16小时。反应在0℃下用饱和na2s2o3水溶液(500毫升)猝灭。所得混合物用ea(6
×
400毫升)萃取。合并的有机层用盐水(2
×
400毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为黄色油的2-溴-4,5-二氯苯酚和2-溴-3,4-二氯苯酚的混合物(100克,粗)。粗产物不进行进一步提纯直接用于下一步骤。
[0228]
在0℃下向2-溴-4,5-二氯苯酚和2-溴-3,4-二氯苯酚(32克,125.04毫摩尔,1当量)和k2co3(54.9克,396.87毫摩尔,3当量)在acn(210毫升)中的粗混合物中逐滴加入mei(16.5毫升,116.05毫摩尔,2当量)。反应混合物在50℃下搅拌4小时。将反应混合物过滤并浓缩。残余物通过用pe洗脱的硅胶柱色谱法提纯,以提供作为白色固体的中间体1(2-溴-3,4-二氯-1-甲氧基苯)(8.7克,25.7%):1h nmr(300mhz,cdcl3)δ7.40(dd,j=9.0,1.1hz,1h),6.79(d,j=8.9hz,1h),3.92(s,3h);和作为白色固体的中间体2(1-溴-4,5-二氯-2-甲氧基苯)(24.3克,71.77%):1h nmr(300mhz,cdcl3)δ7.64(s,1h),6.99(s,1h),3.91(s,3h)。
[0229]
实施例2.中间体3((2,3-二氯-6-甲氧基苯基)硼酸)步骤a:在室温下在氮气气氛下向3,4-二氯苯酚(120克,0.74摩尔)在thf(400毫升)中的搅拌溶液中逐份加入naoh(75克,1.88摩尔),随后搅拌30分钟。经40分钟向其中加入n,n-二乙基氨甲酰氯(150克,1.11摩尔),随后搅拌15小时。将反应混合物倾入水(1.5升)中并用pe(2
×
800毫升)萃取。合并的有机相用盐水(500毫升)洗涤并在na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为黄色油的n,n-二乙基氨基甲酸3,4-二氯苯基酯(213克,粗):对c
11h13
cl2no2计算的lcms(esi)[m+h]
+
:262,264(3:2),实测262,264(3:2);1h nmr(400mhz,cdcl3)δ7.43(d,j=8.8hz,1h),7.30(d,j=2.7hz,1h),7.03(dd,j=8.8,2.7hz,1h),3.50-3.34(m,4h),1.32-1.17(m,6h)。
[0230]
步骤b:在-65℃下在氮气气氛下向dipa(32克,0.32摩尔)在thf(400毫升)中的溶液中逐滴加入n-buli(131毫升,0.33毫摩尔)。所得混合物搅拌1小时。向其中逐滴加入n,n-二乙基氨基甲酸3,4-二氯苯酯(77克,0.29摩尔)在thf(200毫升)中的溶液,随后搅拌1小时。经1小时向其中逐滴加入i2(82克,0.32摩尔)在thf(200毫升)中的溶液。所得混合物在-65℃下搅拌附加的30分钟。反应在室温下通过添加nh4cl水溶液(300毫升)来猝灭。所得混合物用ea(3
×
400毫升)萃取。合并的有机层用盐水(500毫升)洗涤并在无水na2so4上干燥。过滤后,滤
液在减压下浓缩。三个附加的批次(3
×
77克的n,n-二乙基氨基甲酸3,4-二氯苯酯)类似地反应和处理,随后与前一批次合并。所得残余物在pe(500毫升)中制浆,并且随后过滤以提供300克的n,n-二乙基氨基甲酸3,4-二氯-2-碘苯基酯。滤液通过用pe/ea(50/1)洗脱的硅胶柱色谱法提纯,以提供另一份75克的纯产物。获得作为灰白色固体的n,n-二乙基氨基甲酸3,4-二氯-2-碘苯酯(375克,经2个步骤为83%):对c
11h12
cl2ino3计算的lcms(esi)[m+h]
+
:388,390(3:2),实测388,390(3:2);1h nmr(400mhz,cdcl3)δ7.48(d,j=8.8hz,1h),7.08(d,j=8.8hz,1h),3.55(q,j=7.2hz,2h),3.42(q,j=7.1hz,2h),1.34(t,j=7.1hz,3h),1.25(t,j=7.1hz,3h)。
[0231]
步骤c:在室温下向n,n-二乙基氨基甲酸3,4-二氯-2-碘苯酯(200克,0.52摩尔)在etoh(1.50升)中的搅拌溶液中加入naoh(165克,4.1摩尔)。所得混合物在80℃下在氮气气氛下搅拌1小时。反应混合物在减压下浓缩。残余物用冰水(1.5升)稀释。混合物随后用hcl水溶液(6n)酸化至ph=3。所得混合物用ea(3
×
1升)萃取。合并的有机层用盐水(800毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为棕色油的3,4-二氯-2-碘苯酚(202克,粗):对c6h3cl2io计算的lcms(esi)[m-h]-:287,289(3:2),实测287,289(3:2)。
[0232]
步骤d:向3,4-二氯-2-碘苯酚(220克,0.76摩尔)在dmf(700毫升)中的搅拌溶液中加入k2co3(210克,1.52摩尔)和mei(119克,0.84摩尔)。所得混合物在室温下搅拌5小时。另一批次(100克的3,4-二氯-2-碘苯酚)类似地反应并与前一批次合并。所得混合物在室温下用水(5升)稀释。所得混合物随后用ea(3
×
1升)萃取。合并的有机层用盐水(4
×
400毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物在pe(300毫升)中制浆,并随后过滤以提供128克的所需产物。滤液通过用pe/ea(40/1)洗脱的硅胶柱色谱法提纯,以提供附加的64克的所需产物。作为浅黄色固体获得1,2-二氯-3-碘-4-甲氧基苯(192克,经2个步骤为78%):1h nmr(400mhz,cdcl3)δ7.44(d,j=8.9hz,1h),6.70(d,j=8.9hz,1h),3.91(s,3h)。
[0233]
步骤e:在0℃下在氮气气氛下向1,2-二氯-3-碘-4-甲氧基苯(100克,0.33摩尔)在thf(1.2升)中的溶液中逐滴加入i-prmgcl(182毫升,0.36摩尔)。反应混合物随后在0℃下搅拌1小时。在0℃下逐滴加入b(ome)3(86克,0.83摩尔)。随后,经1小时令反应混合物升温至室温并在室温下再搅拌1小时。随后,在0℃下逐滴加入h2so4水溶液(5%,500毫升)。反应混合物在室温下搅拌30分钟。混合物用ea(2
×
500毫升)萃取。将有机层合并,用盐水(500毫升)洗涤并在无水na2so4上干燥。在过滤后,将滤液浓缩。残余物在dcm(200毫升)中搅拌,并随后过滤以提供作为灰白色固体的中间体3((2,3-二氯-6-甲氧基苯基)硼酸)(55克,76%):对c
15h16
cl2n2o4计算的lcms(esi)[m-h]-:219,221(3:2),实测219,221(3:2);1h nmr(400mhz,cdcl3)δ7.48(d,j=8.8hz,1h),6.82(d,j=8.9hz,1h),5.65(s,2h),3.89(s,3h)。
[0234]
实施例3.中间体4((2s)-4-(三氟甲磺酰氧基)-2,3-二氢吡咯-1,2-二甲酸1-叔丁酯2-甲酯)
步骤a:在-65℃下在氮气气氛下经10分钟向(2s)-4-氧代吡咯烷-1,2-二甲酸1-叔丁酯2-甲酯(2.0克,8.22毫摩尔)在thf(15毫升)中的溶液中逐滴加入lihmds(9.87毫升,9.87毫摩尔,1m在thf中)。在搅拌0.5小时后,在-65℃下逐滴加入在thf(5毫升)中的1,1,1-三氟-n-苯基-n-三氟甲磺酰基甲磺酰胺(4.41克,12.35毫摩尔)。所得溶液在室温下在氮气气氛下搅拌1小时。反应在室温下用饱和nh4cl水溶液(50毫升)猝灭。所得混合物用ea(3
×
50毫升)萃取。合并的有机层用盐水(3
×
50毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为黄色油的中间体4((2s)-4-(三氟甲磺酰氧基)-2,3-二氢吡咯-1,2-二甲酸1-叔丁基酯2-甲酯)(3克,粗),其不经进一步提纯直接用于下一步骤:对c
12h16
f3no7s计算的lcms(esi)[m+h-56]
+
320,实测320。
[0235]
实施例4.中间体5(1-[4-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲胺双(三氟乙酸))步骤a:在氮气气氛下向中间体1(实施例1)(5.00克,16.51毫摩尔)和4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2-甲腈(3.80克,16.51毫摩尔)在1,4-二氧杂环已烷(80毫升)和h2o(20毫升)中的溶液中加入na2co3(5.25克,49.53毫摩尔)和pd(dppf)cl2·
ch2cl2(0.67克,0.83毫摩尔)。反应混合物在80℃下在氮气气氛下搅拌3小时。将反应混合物倾入水(50毫升)中并用ea(3
×
50毫升)萃取。合并的有机层用盐水(2
×
50毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(3/1)洗脱的硅胶柱色谱法提纯以提供作为灰白色固体的4-(2,3-二氯-6-甲氧基苯基)吡啶-2-甲腈(3.00克,65%):对c
13
h8cl2n2o计算的lcms(esi)[m+h]
+
:279,281(3:2),实测279,281(3:2);1h nmr(400mhz,cdcl3)δ8.80(dd,j=5.0,0.9hz,1h),7.64(s,1h),7.54(d,j=8.9hz,1h),7.46(dd,j=5.0,1.7hz,1h),6.92(d,j=9.0hz,1h),3.77(s,3h)。
[0236]
在室温下向4-(2,3-二氯-6-甲氧基苯基)吡啶-2-甲腈(3.00克,10.75毫摩尔)在meoh(400毫升)和浓hcl(12m,40.00毫升)中的搅拌混合物中逐份加入pto2(0.50克,2.16毫摩尔)。反应混合物在30℃下在氢气气氛(50atm)下脱气并搅拌48小时。过滤混合物并在减压下浓缩滤液。残余物通过用40%在水中的acn(加0.05%的tfa)洗脱的反相色谱法提纯以提供作为灰白色固体的中间体5(1-[4-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲胺双(三氟乙酸))(2.8克,50%):对c
13h18
cl2n2o计算的lcms(esi)[m+h]
+
:289,291(3:2),实测289,291(3:2);1h nmr(400mhz,cd3od)δ7.36(d,j=9.0hz,1h),6.95(d,j=9.0hz,1h),3.85(s,3h),3.66-3.52(m,1h),3.25-3.16(m,1h),2.83-2.73(m,1h),2.73-2.62(m,3h),2.48-2.33(m,
1h),2.16-1.98(m,1h),1.58(dd,j=31.4,12.8hz,2h)。
[0237]
实施例5.中间体6((8r,9as)-8-(2,3-二氯-6-羟苯基)-八氢吡啶并[1,2-a]吡嗪-4-酮)步骤a:在-50℃下在氮气气氛下向1-[4-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲胺三氟乙酸(中间体5,实施例4)(1.00克,2.59毫摩尔)和tea(0.75克,7.50毫摩尔)在dcm(15.00毫升)中的搅拌混合物中加入boc2o(0.43克,2.00毫摩尔)。所得混合物在-50℃下在氮气气氛下搅拌1小时并随后用nh3.h2o(2毫升)猝灭,用水(20毫升)稀释,并用ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用己烷/ea(1/1)洗脱的硅胶柱色谱法提纯以提供作为灰白色固体的n-[[4-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲基]氨基甲酸叔丁酯(0.6克,62%):对c
18h26
cl2n2o3计算的lcms(esi)[m+h]
+
:389,401(3:2),实测389,401(3:2)。
[0238]
步骤b:在0℃下向n-[[4-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲基]氨基甲酸叔丁酯(0.60克,1.54毫摩尔)和tea(0.47克,4.62毫摩尔)在dcm(10毫升)中的溶液中加入氯乙酰氯(0.19克,2.00毫摩尔),随后反应在室温下搅拌1小时。将所得反应混合物浓缩以提供作为黄色油的n-[[1-(2-氯乙酰基)-4-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲基]氨基甲酸叔丁酯(0.7克,粗):对c
20h27
cl3n2o4计算的lcms(esi)[m+h]
+
:465,467(1:1),实测465,467(1:1)。
[0239]
步骤c:在室温下向n-[[1-(2-氯乙酰基)-4-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲基]氨基甲酸叔丁酯(0.70克,1.50毫摩尔)在dmf(10毫升)中的溶液中加入cs2co3(0.98克,3.00毫摩尔)。反应混合物在50℃下搅拌16小时,用水(20毫升)稀释并随后用ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(1:1)洗脱的硅胶柱色谱法提纯以提供作为黄色油的8-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[1,2-a]吡嗪-2-甲酸叔丁酯(0.30克,46%)。通过制备手性hplc采用以下条件分离8-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[1,2-a]吡嗪-2-甲酸叔丁酯(0.30克,0.70毫摩尔):柱:chiralpak ie,2
×
25cm,5μm;流动相a:hex
‑‑
hplc,流动相b:etoh—hplc;流速:20ml/min;梯度:在13分钟内由30%b至30%b;
检测器:uv 254/210nm;保留时间:rt1:9.048min;rt2:11.244分钟。获得在9.048分钟处的作为黄色油的(8s,9ar)-8-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[1,2-a]吡嗪-2-甲酸叔丁酯的较快洗脱的对映异构体(0.12克,18%):对c
20h26
cl2n2o4计算的lcms(esi)[m+h]
+
:429,431(3:2),实测429,431(3:2)。获得在11.244分钟处的作为黄色油的(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[1,2-a]吡嗪-2-甲酸叔丁酯的较慢洗脱的对映异构体(0.12克,18%):对c
20h26
cl2n2o4计算的lcms(esi)[m+h]
+
:429,431(3:2),实测429,431(3:2)。1h nmr(400mhz,cdcl3)δ7.31(d,j=8.9hz,1h),6.75(d,j=8.9hz,1h),5.32(s,1h),4.92-4.80(m,1h),4.27(d,j=18.4hz,1h),4.17-3.88(m,2h),3.80(s,3h),3.77-3.59(m,1h),3.59-3.47(m,1h),2.73-2.62(m,1h),2.46-2.07(m,2h),1.71-1.64(m,2h),1.50(s,9h)。
[0240]
步骤d:在0℃下向(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[1,2-a]吡嗪-2-甲酸叔丁酯(0.12克,0.279毫摩尔)在dcm(3毫升)中的溶液中逐滴加入bbr3(0.13毫升,0.527毫摩尔)。反应混合物在室温下搅拌3小时,用水(1毫升)猝灭,用nahco3(饱和,10毫升)稀释并随后用ea(3
×
20毫升)萃取。合并的有机层在真空下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xbridge shield rp18 obd column,30
×
150mm,5μm;流动相a:水(10mm甲酸铵),流动相b:can;流速:60ml/min;梯度:在7分钟内由25%b至45%b;检测器:uv 254/210nm;保留时间:6.5分钟。将含有所需产物的级分合并并在减压下浓缩以提供作为灰白色固体的中间体6((8r,9as)-8-(2,3-二氯-6-羟苯基)-八氢吡啶并[1,2-a]吡嗪-4-酮)(65.1毫克,74%):对c
14h16
cl2n2o2计算的lcms(esi)[m+h]
+
:315,317(3:2),实测315,317(3:2)。1h nmr(400mhz,甲醇-d4)δ7.20(d,j=8.7hz,1h),6.71(d,j=8.8hz,1h),4.83-4.70(m,1h),3.79-3.63(m,1h),3.60-3.49(m,1h),3.43(s,2h),3.24(dd,j=13.4,5.1hz,1h),2.86-2.61(m,2h),2.56-2.32(m,2h),1.72-1.58(m,2h)。
[0241]
实施例6.中间体7((2s,4r)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-1,2-二甲酸1-叔丁酯2-甲酯)步骤a:在氮气气氛下向4-(三氟甲磺酰氧基)-2,3-二氢吡咯-1,2-二甲酸1-叔丁酯2-甲酯(中间体4,实施例3)(3.09克,8.23毫摩尔)、2,3-二氯-6-甲氧基苯基)硼酸(中间体3,实施例2)(1.40克,6.34毫摩尔)和na2co3(2.02克,19.06毫摩尔)在二氧杂环已烷(15毫升)和h2o(3毫升)中的搅拌溶液中加入pd(dppf)cl2·
ch2cl2(0.10克,0.12毫摩尔)。所得混合物在80℃下在氮气气氛下搅拌4小时。反应用ea(50毫升)和水(50毫升)稀释。水溶液用ea(3
×
50毫升)萃取。合并的有机层用盐水(3
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(4/1)洗脱的硅胶柱色谱法提纯以提供作为浅黄色油的(2s)-4-(2,3-二氯-6-甲氧基苯基)-2,3-二氢吡咯-1,2-二甲酸1-叔丁酯2-甲酯(1.30克,
3.63(m,4h),2.77-2.46(m,1h),2.28-2.11(m,1h),1.50(d,j=11.2hz,9h)。
[0245]
步骤c:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(羟甲基)吡咯烷-1-甲酸叔丁酯(1.90克,5.050毫摩尔)在dcm(10毫升)中的搅拌溶液中加入dess-martin氧化剂(dess-martin periodinane)(2.57克,6.06毫摩尔)。反应搅拌1小时并随后用na2s2o3饱和水溶液(30毫升)猝灭。混合物用ea(3
×
30毫升)萃取。合并的有机层用nahco3饱和水溶液(3
×
30毫升)和盐水(2
×
50毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基吡咯烷-1-甲酸叔丁酯(1.9克,粗),其不经进一步提纯直接用于下一步骤:对c
17h21
cl2no4计算的lcms(esi)[m+h]
+
374,376(3:2),实测374,376(3:2)。
[0246]
步骤d:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基吡咯烷-1-甲酸叔丁酯(1.90克,5.08毫摩尔)和2-氨基乙酸甲酯盐酸盐(0.96克,7.65毫摩尔)在dcm(20毫升)中的搅拌溶液中加入tea(1.28克,12.65毫摩尔)和nabh(aco)3(2.15克,10.14毫摩尔)。反应搅拌2小时并随后用水(50毫升)猝灭。混合物用ea(3
×
50毫升)萃取。合并的有机层用盐水(2
×
50毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用45%在水中的acn(0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色泡沫的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[(2-甲氧基-2-氧代乙基)氨基]甲基]吡咯烷-1-甲酸叔丁酯(1.80克,2个步骤总计为79%):对c
20h28
cl2n2o5计算的lcms(esi)[m+h]
+
447,449(3:2),实测447,449(3:2);1h nmr(400mhz,cd3od)δ7.46(d,j=8.7hz,1h),7.03(d,j=9.0hz,1h),4.28(s,1h),4.23-3.95(m,3h),3.90(d,j=9.3hz,6h),3.87-3.71(m,2h),3.41-3.35(m,2h),2.49-2.32(m,2h),1.53(s,9h)。
[0247]
步骤e:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[(2-甲氧基-2-氧代乙基)氨基]甲基]吡咯烷-1-甲酸叔丁酯(1.80克,4.02毫摩尔)在dcm(15毫升)中的搅拌溶液中加入tfa(3毫升)。反应在室温下搅拌1小时并随后在减压下浓缩。所得混合物溶解在etoh(10毫升)中并向其中加入tea(1.23克,12.16毫摩尔)。反应在70℃下搅拌1小时。反应用水(50毫升)稀释。混合物用ea(3
×
50毫升)萃取。合并的有机层用盐水(2
×
50毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为黄色油的(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-六氢-1h-吡咯并[1,2-a]吡嗪-4-酮(1.10克,87%):对c
14h16
cl2n2o2计算的lcms(esi)[m+h]
+
315,317(3:2),实测315,317(3:2);1h nmr(400mhz,cd3od)δ7.43(d,j=9.0hz,1h),7.00(d,j=9.0hz,1h),4.40-4.26(m,1h),4.15-4.05(m,1h),3.90-3.79(m,4h),3.59-3.46(m,2h),3.43-3.39(m,1h),3.39-3.36(m,1h),2.61(dd,j=13.0,10.3hz,1h),2.26-2.06(m,2h)。
[0248]
步骤f:在室温下向(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-六氢-1h-吡咯并[1,2-a]吡嗪-4-酮(1.10克,3.49毫摩尔)在dcm(10毫升)中的搅拌溶液中逐滴加入bbr3(3.50克,13.97毫摩尔)。反应搅拌2小时并随后用meoh(10毫升)猝灭。将混合物过滤,并且滤饼用ea(3
×
5毫升)洗涤,并在减压下干燥以提供作为灰白色固体的中间体8((7r,8as)-7-(2,3-二
氯-6-羟苯基)-六氢-1h-吡咯并[1,2-a]吡嗪-4-酮氢溴酸盐)(1.00克,63%):对c
13h14
cl2n2o2计算的lcms(esi)[m+h]
+
301,303(3:2),实测301,303(3:2);1h nmr(400mhz,cd3od)δ7.29(d,j=8.8hz,1h),6.79(d,j=8.8hz,1h),4.44-4.28(m,1h),4.28-4.18(m,1h),4.18-4.05(m,1h),3.98-3.84(m,3h),3.71-3.55(m,1h),3.19(t,j=11.9hz,1h),2.49(q,j=11.5hz,1h),2.37-2.24(m,1h)。
[0249]
实施例8.中间体9((2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(羟甲基)哌啶-1-甲酸叔丁酯)和中间体10((2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基哌啶-1-甲酸叔丁酯)步骤a:在-8℃下向(3s)-4-(叔丁氧基)-3-[(叔丁氧基羰基)氨基]-4-氧代丁酸(120克,415毫摩尔)在dcm(1.50升)中的搅拌溶液中加入edci(120克,622毫摩尔)、dmap(76.0克,622毫摩尔)和2,2-二甲基-1,3-二氧杂环已烷-4,6-二酮(米氏酸)(60.0克,414毫摩尔)。所得混合物在氮气气氛下在-8℃下搅拌3小时。所得混合物用khso4饱和水溶液(2
×
1升)和盐水(2
×
1升)洗涤。有机层在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物溶解在ea(3.70升)中以提供0.1m溶液,其回流16小时。在冷却至室温后,混合物用khso4饱和水溶液(2
×
1升)和盐水(2
×
1升)洗涤。有机层在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为灰白色固体的(2s)-4,6-二氧代哌啶-1,2-二甲酸1,2-二叔丁酯(123克,94%):对c
15h23
no6计算的lcms(esi)[m+h]
+
:314,实测314;1h nmr(400mhz,cdcl3)δ5.12-5.03(m,1h),3.63-3.32(m,2h),3.10-3.01(m,1h),2.89-2.79(m,1h),1.58(s,9h),1.49(s,9h)。
[0250]
步骤b:在0℃下向(2s)-4,6-二氧代哌啶-1,2-二甲酸1,2-二叔丁酯(50.0克,160毫摩尔)在dcm(500毫升)中的溶液中逐滴加入diea(83毫升,645毫摩尔)。所得反应在0℃下搅拌10分钟,并随后在0℃下逐滴加入三氟甲基磺酸酐(54.0克,191毫摩尔)。随后令反应升温至室温并搅拌附加的2小时。反应在10℃下用nahco3饱和水溶液(100毫升)猝灭。水相用dcm(3
×
100毫升)萃取。合并的有机相用盐水(2
×
100毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(5/1)洗脱的硅胶柱色谱法提纯以提供作为黄色固体的(2s)-6-氧代-4-(三氟甲磺酰氧基)-2,3-二氢吡啶-1,2-二甲酸1,2-二叔丁酯(39.0克,55%):对c
16h22
f3no8s计算的lcms(esi)[m+h]
+
:446,实测346[m+h-100]
+
;1h nmr(300mhz,cdcl3)δ6.03(d,j=2.2hz,1h),5.01(dd,j=6.3,2.6hz,1h),3.27-2.98(m,2h),1.57(s,9h),1.47(s,9h)。
[0251]
步骤c:在室温下在氮气气氛下向(2s)-6-氧代-4-(三氟甲磺酰氧基)-2,3-二氢吡啶-1,2-二甲酸1,2-二叔丁酯(39.0克,78.8毫摩尔)、2,3-二氯-6-甲氧基苯基硼酸(20.0克,81.5毫摩尔)和na2co3(17.0克,163毫摩尔)在二氧杂环已烷(400毫升)和h2o(100毫升)中的搅拌混合物中加入pd(dppf)cl2·
ch2cl2(2.66克,3.26毫摩尔)。悬浮液在真空下脱气并用氮气气氛吹扫三遍。反应随后在氮气气氛下在80℃下搅拌2小时。反应混合物在减压下浓缩。残余物在ea(500毫升)中稀释并用盐水(2
×
500毫升)洗涤。有机相在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(2/1)洗脱的硅胶柱色谱法提纯以提供作为浅黄色液体的(2s)-4-(2,3-二氯-6-甲氧基苯基)-6-氧代-2,3-二氢吡啶-1,2-二甲酸1,2-二叔丁酯(31.0克,72%):对c
22h27
cl2no6计算的lcms(esi)[m+h]
+
:472,474(3:2),实测372,374[m+h-100]
+
(3:2);1h nmr(300mhz,cdcl3)δ7.42(d,j=8.9hz,1h),6.80(d,j=9.0hz,1h),5.92(d,j=2.7hz,1h),4.95(dd,j=7.2,1.8hz,1h),3.78(s,3h),3.14(d,j=17.6hz,1h),2.90(d,j=18.2hz,1h),1.60(s,9h),1.50(s,9h)。
[0252]
步骤d:在室温下向(2s)-4-(2,3-二氯-6-甲氧基苯基)-6-氧代-2,3-二氢吡啶-1,2-二甲酸1,2-二叔丁酯(31.0克,65.6毫摩尔)在ea(400毫升)和acoh(100毫升)中的搅拌溶液中逐份加入pto2(6.26克,27.6毫摩尔)。所得混合物在氢气气氛(1.5atm)下在室温下搅拌16小时,过滤,并且滤饼随后用meoh(3
×
50毫升)洗涤。滤液在减压下浓缩。残余物通过用pe/ea(2/1)洗脱的硅胶柱色谱法提纯以提供作为浅黄色液体的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-6-氧代哌啶-2-甲酸叔丁酯(20.8克,76%):对c
17h21
cl2no4计算的lcms(esi)[m+h]
+
:374,376(3:2),实测374,376(3:2);1h nmr(300mhz,cdcl3)δ7.36(d,j=8.9hz,1h),6.79(d,j=8.9hz,1h),4.12-3.92(m,2h),3.85(s,3h),3.03(dd,j=17.7,11.2hz,1h),2.57-2.34(m,2h),2.28-2.09(m,1h),1.86-1.63(m,1h),1.51(d,j=2.1hz,9h)。
[0253]
步骤e:在室温下在氮气气氛下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-6-氧代哌啶-2-甲酸叔丁酯(20.8克,50.0毫摩尔)在thf(200毫升)中的搅拌溶液中加入bh3me2s(14.2毫升,187毫摩尔,10m在me2s溶液中)。反应在70℃下搅拌4小时。反应在0℃下用meoh(50毫升)猝灭。所得混合物在减压下浓缩。残余物溶解在meoh(100毫升)和hcl(6n,100毫升)中。所得溶液在70℃下搅拌1小时并随后在减压下浓缩以提供作为浅黄色液体的[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲醇,其不经进一步提纯直接用于下一步骤(20.0克,粗):对c
13h17
cl2no2计算的lcms(esi)[m+h]
+
:290,292(3:2),实测290,292(3:2)。
[0254]
步骤f:在室温下向[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲醇(20.0克,68.9毫摩尔)和tea(28.7毫升,284毫摩尔)在dcm(200毫升)中的搅拌溶液中加入boc2o(17.7毫升,81.1毫摩尔)。反应在室温下搅拌1小时并随后用水(100毫升)稀释。水溶液用dcm(2
×
200毫升)萃取。合并的有机层用盐水(2
×
100毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(1/1)洗脱的硅胶柱色谱法提纯以提供作为浅黄色液体的中间体9((2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(羟甲基)哌啶-1-甲酸叔丁酯)(13.0克,43%):对c
18h25
cl2no4计算的lcms(esi)[m+h]
+
:390,392(3:2),实测334,336
[m+h
–
56]
+
(3:2);1h nmr(400mhz,cdcl3)δ7.30(d,j=9.4hz,1h),6.75(d,j=8.9hz,1h),3.82(s,3h),3.80-3.56(m,5h),3.54-3.40(m,1h),2.40-2.24(m,1h),2.06-1.96(m,1h),1.87-1.74(m,1h),1.60-1.55(m,1h),1.53(s,9h)。
[0255]
步骤g:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(羟甲基)哌啶-1-甲酸叔丁酯(1.40克,3.58毫摩尔)在dcm(10毫升)中的搅拌溶液中加入dess-martin试剂(1.80克,4.31毫摩尔)。反应在室温下搅拌1小时。所得混合物用na2s2o4饱和水溶液(10毫升)和nahco3饱和水溶液(30毫升)猝灭。溶液用ea(2
×
50毫升)萃取。合并的有机层用盐水(2
×
50毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为黄色液体的中间体10((2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基哌啶-1-甲酸叔丁酯)(1.30克,粗):对c
18h23
cl2no4计算的lcms(esi)[m+h-56]
+
:332,334(3:2),实测332,334(3:2);1h nmr(400mhz,cd3od)δ9.52(d,j=1.4hz,1h),7.39(d,j=9.0hz,1h),6.97(d,j=9.0hz,1h),4.02-3.90(m,1h),3.90-3.64(m,5h),3.26-3.10(m,1h),2.45-2.22(m,2h),1.93-1.57(m,2h),1.51(d,j=5.8hz,9h)。
[0256]
实施例9.中间体11((8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-八氢吡啶并[1,2-a]吡嗪-4-酮)步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基哌啶-1-甲酸叔丁酯(1.30克,3.35毫摩尔)(中间体10,实施例8)和甘氨酸甲酯盐酸盐(0.640克,5.09毫摩尔)在dcm(10毫升)中的搅拌溶液中加入tea(0.510克,5.04毫摩尔)和nabh(oac)3(1.42克,6.70毫摩尔)。反应在室温下搅拌16小时。反应用ea(20毫升)和水(20毫升)稀释。水溶液用ea(2
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用35%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为无色液体的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[(2-甲氧基-2-氧代乙基)氨基]甲基]哌啶-1-甲酸叔丁酯三氟乙酸盐(1.00克,52%):对c
21h30
cl2n2o5计算的lcms(esi)[m+h]
+
:461,463(3:2),实测461,463(3:2);1h nmr(400mhz,cd3od)δ7.41(d,j=8.8hz,1h),6.99(d,j=8.9hz,1h),4.20(s,1h),4.12
–
3.96(m,2h),3.88(d,j=1.2hz,6h),3.76-3.54(m,2h),3.54-3.37(m,2h),3.22-3.10(m,1h),2.41(d,j=13.2hz,1h),2.00-1.87(m,2h),1.69(d,j=13.3hz,1h),1.57(s,9h);
19
f nmr(376mhz,cd3od)δ-77.31(s,3f)。
[0257]
步骤b:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[(2-甲氧基-2-氧代乙基)氨基]甲基]哌啶-1-甲酸叔丁酯三氟乙酸(1.00克,1.74毫摩尔)在dcm(10毫升)中的搅拌溶
液中加入tfa(4毫升)。反应在室温下搅拌1小时并随后在减压下浓缩。残余物溶解在etoh(10毫升)中并加入tea(0.530克,5.24毫摩尔)。反应在80℃下搅拌1小时并随后用ea(50毫升)和水(30毫升)稀释。水溶液用ea(2
×
30毫升)萃取。合并的有机层用盐水(2
×
30毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为灰白色泡沫的中间体11((8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-八氢吡啶并[1,2-a]吡嗪-4-酮)(0.550克,粗):对c
15h18
cl2n2o2计算的lcms(esi)[m+h]
+
:329,331(3:2),实测329,331(3:2)。1h nmr(400mhz,cd3od)δ7.39(d,j=9.0hz,1h),6.97(d,j=9.0hz,1h),4.78(ddd,j=13.3,4.4,2.2hz,1h),3.85(s,3h),3.80-3.68(m,1h),3.63-3.54(m,1h),3.52(d,j=2.0hz,2h),3.30(d,j=5.2hz,1h),2.86(dd,j=13.3,8.4hz,1h),2.71(td,j=13.2,3.0hz,1h),2.41-2.23(m,2h),1.72-1.62(m,2h)。
[0258]
实施例10.中间体12((8r,9as)-8-(2,3-二氯-6-羟苯基)-八氢吡啶并[1,2-a]吡嗪-4-酮)步骤a:在室温下向(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-八氢吡啶并[1,2-a]吡嗪-4-酮(中间体11,实施例9)(0.550克,1.67毫摩尔)在dcm(5毫升)中的搅拌溶液中加入bbr3(4.19克,16.7毫摩尔)。反应在室温下搅拌1小时。反应用meoh(2毫升)猝灭,并且所得溶液在减压下浓缩。残余物溶解在meoh(5毫升)中并用tea碱化至ph 8。在减压下浓缩后,残余物通过用36%在水中的acn(加10mm nh4hco3)洗脱的反相色谱法提纯以提供粗产物。将含有所需产物的级分合并,并在减压下浓缩以提供作为灰白色固体的中间体12((8r,9as)-8-(2,3-二氯-6-羟苯基)-八氢吡啶并[1,2-a]吡嗪-4-酮)(0.250克,47%):对c
14h16
cl2n2o2计算的lcms(esi)[m+h]
+
:315,317(3:2),实测315,317(3:2);1h nmr(400mhz,cd3od)δ7.20(d,j=8.8hz,1h),6.72(d,j=8.8hz,1h),4.81-4.73(m,1h),3.76-3.63(m,1h),3.60-3.49(m,1h),3.44(s,2h),3.24(dd,j=13.4,5.1hz,1h),2.81-2.61(m,2h),2.56-2.31(m,2h),1.70-1.59(m,2h)。
[0259]
实施例11.中间体13((7r,8as)-7-[2,3-二氯-6-(丙-2-烯-1-基氧基)苯基]-六氢-1h-吡咯并[1,2-a]吡嗪-4-酮)步骤a:在室温下向(7r,8as)-7-(2,3-二氯-6-羟苯基)-六氢-1h-吡咯并[1,2-a]吡嗪-4-酮氢溴酸盐(2.00克,5.24毫摩尔)和tea(1.59克,15.7毫摩尔)在dcm(20毫升)中的搅拌溶液中加入boc2o(1.14克,5.24毫摩尔)。所得混合物在室温下搅拌1小时,用水(50毫升)稀释
并用ea(3
×
40毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色固体的(7r,8as)-7-(2,3-二氯-6-羟苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-甲酸叔丁酯,其不经进一步提纯直接用于下一步骤(2.10克,粗):对c
18h22
cl2n2o4计算的lcms(esi)[m+h]
+
:401,403(3:2),实测401,403(3:2)。
[0260]
步骤b:在室温下向(7r,8as)-7-(2,3-二氯-6-羟苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-甲酸叔丁酯(2.10克,5.23毫摩尔)和k2co3(1.45克,10.5毫摩尔)在dmf(40毫升)中的搅拌溶液中加入烯丙基溴(0.760克,6.28毫摩尔)。所得混合物在室温下搅拌3小时,用水(100毫升)稀释并随后用ea(3
×
50毫升)萃取。合并的有机层用盐水(5
×
30毫升)洗涤,并且在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色固体的(7r,8as)-7-[2,3-二氯-6-(丙-2-烯-1-基氧基)苯基]-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-甲酸叔丁酯,其不经进一步提纯直接用于下一步骤(2.10克,粗):对c
21h26
cl2n2o4计算的lcms(esi)[m+h]
+
:441,443(3:2),实测441,443(3:2)。
[0261]
步骤c:在室温下向(7r,8as)-7-[2,3-二氯-6-(丙-2-烯-1-基氧基)苯基]-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-甲酸叔丁酯(2.00克,4.53毫摩尔)在dcm(20毫升)中的搅拌溶液中加入tfa(10毫升)。所得溶液在室温下搅拌1小时并在减压下浓缩。残余物通过用60%在水中的acn(加10mm nh4hco3)洗脱的反相快速色谱法提纯以提供作为浅黄色液体的中间体13((7r,8as)-7-[2,3-二氯-6-(丙-2-烯-1-基氧基)苯基]-六氢-1h-吡咯并[1,2-a]吡嗪-4-酮)(1.50克,经三个步骤为66%):对c
16h18
cl2n2o2计算的lcms(esi)[m+h]
+
:341,343(3:2),实测341,343(3:2);1h nmr(400mhz,cdcl3)δ7.32(d,j=8.9hz,1h),6.76(d,j=9.0hz,1h),6.09-5.95(m,1h),5.43-5.30(m,2h),4.59-4.44(m,2h),4.30-4.14(m,2h),3.83-3.72(m,1h),3.67-3.53(m,2h),3.50-3.38(m,2h),2.64(dd,j=12.7,10.2hz,1h),2.24-2.06(m,2h)。
[0262]
实施例12.中间体14(8-(2,3-二氯-6-羟苯基)-3-(羟甲基)-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-4-酮)步骤a:在室温下向缩水甘油酸(0.668克,7.58毫摩尔)和hatu(3.17克,8.34毫摩尔)在dmf(20.0毫升)中的搅拌溶液中加入[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲醇(中间体9,实施例8)(2.20克,7.58毫摩尔)和tea(2.30克,22.7毫摩尔)。所得反应混合物在室温下搅拌1小时,用水(100毫升)稀释并用ea(2
×
80毫升)萃取。合并的有机层用盐水(2
×
80毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。反应通过用33%在水中的acn(加10mm nh4hco3)洗脱的反相色谱法提纯以提供作为灰白色半固体的[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-1-(环氧乙烷-2-羰基)哌啶-2-基]甲醇(1.10克,40%):对c16h19
cl2no4计算的lcms(esi)[m+1]
+
360,362(3:2),实测360,362(3:2);1h nmr(400mhz,cd3od)δ7.39(d,j=8.9hz,1h),6.99(d,j=9.0hz,1h),4.49-3.93(m,3h),3.85(s,3h),3.83-3.57(m,3h),3.08-2.94(m,1h),2.94-2.79(m,1h),2.81-2.56(m,1h),2.18-1.89(m,2h),1.85-1.54(m,1h),1.39-1.28(m,1h)。
[0263]
步骤b:在0℃下在氮气气氛下向[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-1-(环氧乙烷-2-羰基)哌啶-2-基]甲醇(1.10克,3.05毫摩尔)在thf(10.0毫升)中的搅拌溶液中加入t-buok(0.516克,4.61毫摩尔)。反应在0℃下搅拌1小时。所得混合物用水(100毫升)猝灭并用ea(3
×
30毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用40%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色液体的中间体14((8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-3-(羟甲基)-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-4-酮)(0.450克,50%):对c
16h19
cl2no4计算的lcms(esi)[m+1]
+
360,362(3:2),实测360,362(3:2);1h nmr(400mhz,cd3od)δ7.38(d,j=9.0,1h),6.96(d,j=9.0,1h),4.78-4.65(m,1h),4.20-4.10(m,1h),4.05-3.94(m,2h),3.94-3.87(m,2h),3.84(d,j=6.7hz,3h),3.77-3.68(m,1h),3.53-3.44(m,1h),2.81-2.68(m,2h),2.40-2.28(m,1h),1.80-1.52(m,2h)。
[0264]
实施例13.中间体15((2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-六氢吲哚嗪-5,7-二酮)步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(羟甲基)吡咯烷-1-甲酸叔丁酯(实施例7,步骤b)(40.0克,95.7毫摩尔)、tscl(21.9克,115毫摩尔)和dmap(3.51克,28.7毫摩尔)在dcm(400毫升)中的搅拌溶液中逐滴加入tea(26.6克,263毫摩尔)。所得混合物在氮气下在室温下搅拌4小时并随后用水(300毫升)稀释。水溶液用dcm(3
×
200毫升)萃取。合并的有机层用盐水(2
×
100毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(3/1)洗脱的硅胶柱色谱法提纯以提供作为灰白色固体的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[(4-甲基苯磺酰基)氧基]甲基]吡咯烷-1-甲酸叔丁酯(42.5克,75%):对c
24h29
cl2no6s计算的lcms(esi)[m+h-100]
+
:430,432(3:2),实测430,432(3:2);1h nmr(300mhz,cd3od)δ7.82(d,j=7.9hz,2h),7.48(d,j=7.9hz,2h),7.42(d,j=9.0hz,1h),6.99(d,j=9.0hz,1h),4.47-4.28(m,1h),4.19-3.97(m,3h),3.89(s,3h),3.76-3.56(m,2h),2.69(q,j=11.1hz,1h),2.47(s,3h),2.26-2.07(m,1h),1.42(s,9h)。
[0265]
步骤b:
[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]-3-氧代丁酸乙酯(9.00克,粗),其不经进一步提纯直接用于下一步骤:对c
17h21
cl2no4计算的lcms(esi)[m+h]+:374,376(3:2),实测374,376(3:2)。
[0269]
步骤f:在室温下向4-[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]-3-氧代丁酸乙酯(9.00克,24.1毫摩尔)在meoh(50毫升)中的搅拌溶液中加入k2co3(16.7克,120毫摩尔)。所得混合物在室温下搅拌1小时,并随后用hcl水溶液(1m)中和至ph 7,并用ea(3
×
100毫升)萃取。合并的有机层用盐水(3
×
80毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用ea洗脱的硅胶柱色谱法提纯以提供作为浅黄色固体的中间体15((2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-六氢吲哚嗪-5,7-二酮)(5.00克,两个步骤总计80%):对c
15h15
cl2no3计算的lcms(esi)[m+h]
+
:328,330(3:2),实测328,330(3:2);1h nmr(300mhz,cdcl3)δ7.38(d,j=8.9,1h),6.81(d,j=9.0,1h),4.40-4.12(m,2h),4.12-3.98(m,1h),3.85(s,3h),3.83-3.71(m,1h),3.34(s,2h),2.96-2.76(m,1h),2.74-2.29(m,3h)。
[0270]
实施例14.中间体16((2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-2,3,6,8a-四氢-1h-吲哚嗪-5-酮)步骤a:在-10℃下在氮气气氛下向甲基三苯基溴化鏻(methyltriphenylphosphanium bromide)(48.7克,136毫摩尔)在thf(400毫升)中的溶液中逐滴加入t-buok(136毫升,136毫摩尔,1m在thf中)30分钟。随后在-10℃下向混合物中逐滴加入在thf(50毫升)中的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基吡咯烷-1-甲酸叔丁酯(实施例7,步骤c)(17.0克,45.4毫摩尔)。所得混合物在室温下在氮气下搅拌2小时,在0℃下用饱和nh4cl水溶液(200毫升)猝灭,并用ea(3
×
300毫升)萃取。合并的有机层用盐水(3
×
50毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(5/1)洗脱的硅胶柱色谱法提纯以提供作为无色液体的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-乙烯基吡咯烷-1-甲酸叔丁酯(8.50克,43%):对c
18h23
cl2no3计算的lcms(esi)[m+h-56]
+
:316,318(3:2),实测316,318(3:2);1h nmr(400mhz,cd3od)δ7.42(d,j=9.0hz,1h),7.00(d,j=9.0hz,1h),5.95-5.77(m,1h),5.25-5.05(m,2h),4.40-4.27(m,1h),4.18-4.02(m,1h),3.88(s,3h),3.83-3.80(m,1h),3.70-3.62(m,1h),2.52-2.39(m,1h),2.32-2.21(m,1h),1.47(s,9h)。
[0271]
步骤b:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-乙烯基吡咯烷-1-甲酸叔丁酯(3.60克,9.67毫摩尔)在dcm(36毫升)中的搅拌溶液中加入tfa(9毫升)。所得混合物在室温下搅拌1小时并在减压下浓缩以提供作为黄色液体的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-乙烯基吡咯烷(3.60克,粗),其不经提纯直接用于下一步骤:对c
13h15
cl2no计算的lcms(esi)[m+h]
+
:272,274(3:2),实测272,274(3:2)。
[0272]
步骤c:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-乙烯基吡咯烷(3.60克,13.2毫摩尔)和tea(4.02克,39.7毫摩尔)在dmf(30毫升)中的搅拌溶液中加入3-丁烯酸(1.37克,15.9毫摩尔)和氰基膦酸二乙酯(3.12克,17.2毫摩尔)。所得混合物在室温下搅拌16小时,在室温下用水(100毫升)猝灭,并用ea(3
×
60毫升)萃取。合并的有机层用盐水(5
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(4/1)洗脱的硅胶柱色谱法提纯以提供作为浅黄色液体的1-[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-乙烯基吡咯烷-1-基]丁-3-烯-1-酮(2.60克,经两个步骤为79%):对c
17h19
cl2no2计算的lcms(esi)[m+h]
+
:340,342(3:2),实测340,342(3:2);1h nmr(300mhz,cdcl3)δ7.35(d,j=8.8hz,1h),6.78(d,j=8.9hz,1h),6.11-5.82(m,2h),5.36-5.07(m,4h),4.73-4.34(m,1h),4.18-3.94(m,2h),3.92-3.59(m,4h),3.16(d,j=6.6hz,2h),2.59-2.23(m,2h)。
[0273]
步骤d:在室温下向1-[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-乙烯基吡咯烷-1-基]丁-3-烯-1-酮(2.60克,7.64毫摩尔)在dcm(26毫升)中的搅拌混合物中加入grubbs第二代催化剂(0.260克,0.30毫摩尔)。所得混合物在40℃下搅拌16小时并随后在减压下浓缩。残余物通过用ea洗脱的硅胶柱色谱法提纯以提供作为棕色固体的中间体16((2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-2,3,6,8a-四氢-1h-吲哚嗪-5-酮)(2.20克,74%):对c
15h15
cl2no2计算的lcms(esi)[m+h]
+
:312,314(3:2),实测312,314(3:2);1h nmr(400mhz,cdcl3)δ7.33(d,j=8.9hz,1h),6.75(d,j=8.9hz,1h),5.94-5.82(m,2h),4.33-4.20(m,3h),3.79(s,3h),3.55-3.50(m,1h),3.07-2.98(m,2h),2.27-2.13(m,2h)。
[0274]
实施例15.中间体17((2r,8ar)-2-(2,3-二氯-6-甲氧基苯基)-2,3,8,8a-四氢-1h-吲哚嗪-5-酮)步骤a:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-2,3,6,8a-四氢-1h-吲哚嗪-5-酮(中间体16,实施例14)(2.20克,7.05毫摩尔)在甲苯(15毫升)中的搅拌混合物中加入dbu(10毫升,66.9毫摩尔)。所得混合物在90℃下搅拌16小时,用水(100毫升)稀释并用ea(3
×
40毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用ea洗脱的硅胶柱色谱法提纯以提供作为灰白色固体的中间
体17((2r,8ar)-2-(2,3-二氯-6-甲氧基苯基)-2,3,8,8a-四氢-1h-吲哚嗪-5-酮)(1.50克,61%):对c
15h15
cl2no2计算的lcms(esi)[m+h]
+
:312,314(3:2),实测312,314(3:2);1h nmr(400mhz,cdcl3)δ7.35(d,j=8.9hz,1h),6.78(d,j=9.0hz,1h),6.61-6.55(m,1h),6.06-6.02(m,1h),4.28-4.11(m,1h),4.01-3.94(m,1h),3.94-3.87(m,1h),3.84(s,3h),3.80-3.71(m,1h),2.58-2.49(m,1h),2.45-2.40(m,1h),2.34-2.20(m,2h)。
[0275]
实施例16.中间体18((6r,7ar)-6-(2,3-二氯-6-甲氧基苯基)-六氢吡咯里嗪-3-酮)步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基吡咯烷-1-甲酸叔丁酯(实施例7,步骤c)(2.00克,5.34毫摩尔)在dcm(30毫升)中的溶液中加入2-(三苯基-λ5-膦烯)乙酸甲酯(methyl 2-(triphenyl-λ5-phosphanylidene)acetate)(1.79克,5.34毫摩尔)。反应在室温下在氮气气氛下搅拌16小时,并随后在减压下浓缩。残余物通过用pe/ea(2/1)洗脱的硅胶柱色谱法提纯以提供作为灰白色固体的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(3-甲氧基-3-氧代丙-1-烯-1-基)吡咯烷-1-甲酸叔丁酯(1.65克,72%):对c
20h25
cl2no5计算的lcms(esi)[m+na]
+
:452,454(3:2),实测452,454(3:2);1h nmr(300mhz,cdcl3)δ7.35(d,j=8.9hz,1h),6.99-6.95(m,1h),6.77(d,j=9.0hz,1h),6.00-5.92(m,1h),4.68-4.34(m,1h),4.26-4.03(m,1h),3.82(s,6h),3.80-3.70(m,2h),2.45-2.16(m,1h),2.32-2.29(m,1h),1.50(s,9h)。
[0276]
步骤b:向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(3-甲氧基-3-氧代丙-1-烯-1-基)吡咯烷-1-甲酸叔丁酯(0.450克,1.05毫摩尔)在meoh(6毫升)中的搅拌溶液中加入pto2(50.0毫克,0.220毫摩尔)。混合物在减压下脱气并用氢气吹扫三遍。混合物在氢气气氛(1.5atm)下在室温下搅拌4小时。随后将混合物过滤并在减压下浓缩以提供作为无色液体的(2r,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(3-甲氧基-3-氧代丙基)吡咯烷-1-甲酸叔丁酯(0.450克,粗),其不经提纯直接用于下一步骤:对c
20h27
cl2no5计算的lcms(esi)[m+h]
+
:432,434(3:2),实测432,434(3:2);1h nmr(300mhz,cdcl3)δ7.33(d,j=8.9hz,1h),6.77(d,j=8.9hz,1h),4.11-3.91(m,2h),3.86(s,3h),3.80-3.62(m,5h),2.46-2.14(m,5h),2.09-1.95(m,1h),1.50(d,j=7.7hz,9h)。
[0277]
步骤c:在室温下向(2r,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(3-甲氧基-3-氧代丙基)吡咯烷-1-甲酸叔丁酯(0.500克,1.16毫摩尔)在dcm(5毫升)中的溶液中加入tfa(1.50毫升)。反应在室温下搅拌1小时并随后在减压下浓缩。残余物溶解在etoh(15毫升)中并加入tea(3毫升,21.6毫摩尔)。所得混合物在80℃下搅拌48小时并随后在减压下浓缩。残余物通过用65%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色固体的中间体18((6r,7ar)-6-(2,3-二氯-6-甲氧基苯基)-六氢吡咯里嗪-3-酮)(0.250克,72%):对c
14h15
cl2no2计算的lcms(esi)[m+h]
+
:300,302(3:2),实测300,302(3:2);1h nmr(400mhz,cd3od)δ7.41(d,j=9.0hz,1h),6.99(d,j=9.0hz,1h),4.59-4.47(m,1h),4.21-4.13(m,1h),3.86-3.78(m,4h),3.30-3.22(m,1h),2.86-2.74(m,1h),2.62-2.52(m,1h),2.46-2.35(m,1h),2.24-2.15(m,1h),1.98-1.89(m,1h),1.89-1.79(m,1h)。
[0278]
实施例17.中间体19((6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-六氢吡咯里嗪-2-甲酸)步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基吡咯烷-1-甲酸叔丁酯(实施例7,步骤c)(1.00克,2.67毫摩尔)、2,2-二甲基-1,3-二氧杂环已烷-4,6-二酮(米氏酸)(0.380克,2.67毫摩尔)和2,6-二甲基-1,4-二氢-3,5-吡啶二羧酸二乙酯(etidin)(0.67克,2.67毫摩尔)在acn(10毫升)中的搅拌溶液中加入l-脯氨酸(31.0毫克,0.27毫摩尔)。反应混合物在氮气气氛下在室温下搅拌4小时并随后在减压下浓缩。残余物用meoh(10毫升)稀释,随后过滤,并且滤饼用meoh(2
×
10毫升)洗涤。滤液在减压下浓缩。残余物通过用50%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色液体的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[(2,2-二甲基-4,6-二氧代-1,3-二氧杂环己烷-5-基)甲基]吡咯烷-1-甲酸叔丁酯(1.20克,89%):对c
23h29
cl2no7计算的lcms(esi)[m+h]
+
:502、504(3:2),实测502、504(3:2);1h nmr(400mhz,cdcl3)δ7.35(d,j=8.9hz,1h),6.79(d,j=8.9hz,1h),4.94-4.76(m,1h),4.54-4.44(m,1h),4.08-3.96(m,1h),3.91(s,3h),3.85-3.73(m,2h),2.67-2.55(m,1h),2.55-2.44(m,1h),2.28-2.14(m,2h),1.89(s,3h),1.80(s,3h),1.46(s,9h)。
[0279]
步骤b:将(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[(2,2-二甲基-4,6-二氧代-1,3-二氧杂环己烷-5-基)甲基]吡咯烷-1-甲酸叔丁酯(1.20克,2.39毫摩尔)和tfa(1毫升)在dcm(5毫升)中的溶液在室温下搅拌1小时并在减压下浓缩。残余物用etoh(3毫升)溶解并用tea(1毫升)碱化至ph 8。所得混合物在80℃下搅拌1小时。所得溶液在减压下浓缩。残余物通过用35%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色液体的中间体19((6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-六氢吡咯里嗪-2-甲酸)(0.780克,
95%):对c
15h15
cl2no4计算的lcms(esi)[m+h]
+
:344,346(3:2),实测344,346(3:2);1h nmr(300mhz,cdcl3)δ7.34(d,j=8.8hz,1h),6.77(d,j=8.8hz,1h),4.88-4.62(m,1h),4.58-4.37(m,1h),4.18-4.01(m,1h),4.00-3.63(m,5h),3.41-3.24(m,1h),2.87-2.67(m,1h),2.40-2.09(m,2h),1.99-1.70(m,1h)。
[0280]
实施例18.中间体20((6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-1-(羟甲基)四氢-1h,3h-吡咯并[1,2-c]噁唑-3-酮)步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-乙烯基吡咯烷-1-甲酸叔丁酯(中间体16,步骤a)(3.30克,8.86毫摩尔)在dcm(25毫升)中的搅拌混合物中加入m-cpba(4.59克,26.6毫摩尔)。在2小时后,反应用饱和na2s2o3水溶液(50毫升)猝灭,并用ea(3
×
30毫升)萃取。合并的有机层用饱和nahco3水溶液(3
×
30毫升)和盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色液体的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(环氧乙烷-2-基)吡咯烷-1-甲酸叔丁酯(3.50克,粗),其不经进一步提纯直接用于下一步骤:对c
18h23
cl2no4计算的lcms(esi)[m+na]
+
:410,412(3:2),实测410,412(3:2)。
[0281]
步骤b:(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(环氧乙烷-2-基)吡咯烷-1-甲酸叔丁酯(3.30克,8.50毫摩尔)和tsoh(0.150克,0.850毫摩尔)在meoh(25毫升)中的混合物在氮气气氛下在室温下搅拌3小时。所得混合物在减压下浓缩。残余物通过用45%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色固体的中间体20((6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-1-(羟甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮)(1.70克,经两个步骤为57%):对c
14h15
cl2no4计算的lcms(esi)[m+h]
+
:332,334(3:2),实测332,334(3:2);1h nmr(400mhz,cdcl3)δ7.35(d,j=8.9hz,1h),6.78(d,j=8.9,1h),4.88-4.48(m,1h),4.42-4.27(m,1h),4.16-3.80(m,7h),3.49-3.36(m,1h),2.29-2.18(m,1h),2.11-1.87(m,1h)。
[0282]
实施例19-108描述了本文中公开的式i的代表性化合物的合成。
[0283]
实施例19.化合物1((8r,9as)-8-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮)
步骤a:在室温下向羟基乙酸(9毫克,0.12毫摩尔)在dmf(1.00毫升)中的搅拌溶液中加入edci(32毫克,0.17毫摩尔)和hobt(23毫克,0.17毫摩尔)。五分钟后,加入tea(34毫克,0.33毫摩尔)和(8r,9as)-8-(2,3-二氯-6-羟苯基)-八氢吡啶并[1,2-a]吡嗪-4-酮(中间体6,实施例5)(35毫克,0.11毫摩尔)。反应混合物在室温下搅拌16小时并随后在真空下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xselect csh obd,column 30
×
150mm,5μm;流动相a:水(0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在7分钟内由17%b至45%b;检测器:uv 220nm;保留时间:6.97分钟。将含有所需产物的级分合并并在减压下浓缩以提供作为灰白色固体的化合物1((8r,9ar)-8-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮)(15.6毫克,38%):对c
16h18
cl2n2o4计算的lcms(esi)[m+h]
+
:373,375(3:2),实测373,375(3:2)。1h nmr(400mhz,甲醇-d4)δ7.20(d,j=8.8hz,1h),6.71(d,j=8.8hz,1h),4.77-4.65(m,1h),4.45-3.87(m,5h),3.82-3.42(m,3h),2.82-2.70(m,1h),2.52-2.34(m,2h),1.80-1.58(m,2h);(400mhz,cd3od)δ7.20(d,j=8.8hz,1h),6.71(d,j=8.8hz,1h),4.74(d,j=13.3hz,1h),4.41-3.87(m,5h),3.86-3.39(m,3h),2.76(td,j=13.2,3.0hz,1h),2.54-2.32(m,2h),1.83-1.54(m,2h)。
[0284]
实施例20.化合物2((7r,8as)-7-(2,3-二氯-6-羟苯基)-2-(2-羟乙基)-六氢吡咯并[1,2-a]吡嗪-4-酮)步骤a:在0℃下向(7r,8as)-7-(2,3-二氯-6-羟苯基)-六氢-1h-吡咯并[1,2-a]吡嗪-4-酮氢溴酸盐(中间体8,实施例7)(30毫克,0.10毫摩尔)和2-溴乙醇(50毫克,0.39毫摩尔)在acn(1毫升)中的搅拌混合物中逐滴加入diea(38毫克,0.30毫摩尔)。反应混合物在80℃下搅拌12小时。反应在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xbridge shield rp18 obd column 30
×
150mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在7分钟内由15%b至40%b;检测器:uv 254/220nm;保留时间:6.92分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物2((7r,8as)-7-(2,3-二氯-6-羟苯基)-2-(2-羟乙基)-六氢吡咯并[1,2-a]吡嗪-4-酮)(15毫克,41%):对c
15h18
cl2n2o3计算的lcms(esi)[m+h]
+
:345,347(3:2),实测:345,347(3:2);1h nmr(400mhz,cdcl3)δ7.18(d,j=8.8hz,1h),6.89(d,j=8.8hz,1h),4.46-4.29(m,1h),4.24-4.09(m,1h),4.03-3.83(m,1h),3.78-3.62(m,3h),3.39(t,j=10.6hz,1h),3.35-3.25(m,1h),3.11(d,j=16.8hz,1h),2.85-2.67(m,2h),2.53-2.33(m,1h),2.22(q,j=11.5hz,1h),2.16-2.04(m,1h)。
[0285]
实施例21.化合物3-11、14-17、19-25、27-29、31-35、37-42、44-45、47-49、51、53-54、56和58-59以类似于化合物1(实施例19)或化合物2(实施例20)的方式和/或通过本领域中已
知的方法制造以下化合物。
[0286]
表1
[0287]
实施例22.化合物61((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-羟基六氢吲哚嗪-5
(1h)-酮异构体1)和化合物62((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-羟基六氢吲哚嗪-5(1h)-酮异构体2)步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(羟甲基)吡咯烷-1-甲酸叔丁酯(实施例7,步骤b)(6.6克,17.541毫摩尔,1.00当量)、tscl(3.68克,19.295毫摩尔,1.10当量)和dmap(214毫克,1.754毫摩尔,0.10当量)在dcm(60毫升)中的搅拌溶液中加入tea(3.55克,35.081毫摩尔,2.00当量)。所得混合物在室温下搅拌2小时。所得混合物用水(50毫升)稀释。所得混合物用ea(3
×
50毫升)萃取。合并的有机层用盐水(2
×
50毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(3:1)洗脱的硅胶柱色谱法提纯以提供(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[(4-甲基苯磺酰基)氧基]甲基]吡咯烷-1-甲酸叔丁酯(6.6克,64%):对c
24h29
cl2no6s计算的lcms(esi)[m+h]
+
:530,532(3:2),实测530,532(3:2);1h nmr(300mhz,氯仿-d)δ7.82(d,j=8.2hz,2h),7.38-7.33(m,3h),6.78(d,j=9.0hz,1h),4.43-4.42(m,1h),4.21-3.95(m,2h),3.90-3.85(m,2h),3.75-3.73(m,3h),2.70-2.66(m,1h),2.48-2.46(m,4h),2.20-2.17(m,1h),1.41(s,9h)。
[0288]
步骤b:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[(4-甲基苯磺酰基)氧基]甲基]吡咯烷-1-甲酸叔丁酯(1.0克,1.885毫摩尔,1.00当量)在dmso(10毫升)中的搅拌溶液中加入kcn(245毫克,3.770毫摩尔,2.00当量)。反应在80℃下搅拌1小时。所得混合物用nahco3(饱和,100毫升)稀释。所得混合物用ea(3
×
200毫升)萃取。合并的有机层用盐水(3
×
200毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(3:1)洗脱的硅胶色谱法提纯以提供作为灰白色固体的(2s,4r)-2-(氰甲基)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-1-甲酸叔丁酯(3.4克,47%):对c
18h22
cl2n2o3计算的lcms(esi)[m+h]
+
:385,387(3:2),实测385,387(3:2);1h nmr(400mhz,甲醇-d4)δ7.44(d,j=9.0hz,
1h),7.02(d,j=9.0hz,1h),4.17-4.04(m,2h),3.92-3.86(m,4h),3.71-3.63(m,1h),3.19-3.15(m,1h),2.88-.67(m,2h),2.33-2.31(m,1h),1.53(s,9h)。
[0289]
步骤c:在室温下向(2s,4r)-2-(氰甲基)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-1-甲酸叔丁酯(2克,5.191毫摩尔,1.00当量)在hcl(20毫升)中的搅拌溶液中加入acoh(4毫升)。反应在100℃下搅拌1小时。反应在减压下浓缩。向所得残余物中顺序加入dcm(20毫升)、tea(2.63克,25.991毫摩尔,5.01当量)和boc2o(2.27克,10.382毫摩尔,2.00当量)。反应混合物在室温下搅拌1小时。反应混合物在减压下浓缩。残余物通过用65%在水中的acn(加0.1%fa)洗脱的反相色谱法提纯以提供作为灰白色固体的[(2s,4r)-1-(叔丁氧基羰基)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]乙酸(1.8克,86%):对c
18h23
cl2no5计算的lcms(esi)[m+h]
+
:404,406(3:2),实测404,406(3:2);1h nmr(400mhz,甲醇-d4)δ7.42(d,j=9.0hz,1h),6.99(d,j=9.0hz,1h),4.29-4.02(m,2h),3.90(s,3h),3.84-3.59(m,2h),3.14-2.94(m,1h),2.67-2.30(m,3h),1.51(s,9h)。
[0290]
步骤d:在室温下向[(2s,4r)-1-(叔丁氧基羰基)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]乙酸(1.1克,2.721毫摩尔,1.00当量)在dcm(10毫升)和米氏酸(0.59克,4.081毫摩尔,1.50当量)中的搅拌溶液中加入dmap(0.66克,5.442毫摩尔,2.00当量)和edci(0.78克,4.081毫摩尔,1.50当量)。反应在室温下搅拌1小时。所得溶液在减压下浓缩。残余物溶解在etoh(10毫升)中,所得混合物在90℃下搅拌16小时。随后加入tsoh(243毫克,1.36毫摩尔,0.50当量)。反应混合物在100℃下搅拌16小时。所得混合物用水(40毫升)猝灭并用ea(3
×
50毫升)萃取。合并的有机层用盐水(3
×
50毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用65%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(4-乙氧基-2,4-二氧代丁基)吡咯烷-1-甲酸叔丁酯(1克,77%):对c
22h29
cl2no6计算的lcms(esi)[m+h]
+
:474,476(3:2),实测474,476(3:2);1h nmr(400mhz,氯仿-d)δ7.33(d,j=8.9hz,1h),6.75(d,j=9.0hz,1h),4.29-3.99(m,4h),3.85(s,3h),3.81-3.57(m,2h),3.51-3.41(m,3h),2.85-2.79(m,1h),2.49-2.15(m,2h),1.49(s,9h),1.31-1.28(m,3h)。
[0291]
步骤e:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(4-乙氧基-2,4-二氧代丁基)吡咯烷-1-甲酸叔丁酯(300毫克,0.632毫摩尔,1.00当量)在dcm(3毫升)中的搅拌溶液中加入tfa(1.5毫升)。所得混合物在室温下搅拌1小时。所得混合物在真空下浓缩以提供作为黄色油的4-[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]-3-氧代丁酸乙酯(300毫克,粗):对c
17h21
cl2no4计算的lcms(esi)[m+h]
+
:374,376(3:2),实测374,376(3:2)。
[0292]
步骤f:向4-[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]-3-氧代丁酸乙酯(300毫克,0.802毫摩尔,1.00当量)在meoh(3毫升)中的搅拌溶液中加入lioh.h2o(67毫克,1.603毫摩尔,2.00当量)和h2o(1.5毫升)。所得混合物在室温下搅拌1小时。所得混合物在真空下浓缩。残余物通过用50%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色油的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-六氢吲哚嗪-5,7-二酮(90毫克,
34%):对c
15h15
cl2no3计算的lcms(esi)[m+h]
+
:328,330(3:2),实测328,330(3:2);1h nmr(400mhz,氯仿-d)δ7.38(dd,j=8.9,2.4hz,1h),6.80(dd,j=9.0,3.4hz,1h),4.30-4.05(m,2h),3.85-3.83(m,4h),3.40-3.23(m,2h),2.90-2.61(m,2h),2.58-2.28(m,2h),2.13-2.10(m,1h)。
[0293]
步骤g:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-六氢吲哚嗪-5,7-二酮(300毫克,0.609毫摩尔,1.00当量)在dcm(1.00毫升)中的搅拌溶液中加入bbr3(0.9毫升,10当量)。所得混合物在室温下搅拌2小时。反应用水(2毫升)猝灭。所得混合物在真空下浓缩。残余物通过用20%在水中的acn(加10mmol/l nh4hco3)洗脱的反相色谱法提纯以提供作为灰白色固体的(2r,8as)-2-(2,3-二氯-6-羟苯基)-六氢吲哚嗪-5,7-二酮(180毫克,58%):对c
14h13
cl2no3计算的lcms(esi)[m+h]
+
:314,316(3:2),实测314,316(3:2);1h nmr(400mhz,甲醇-d4)δ7.29-7.24(m,1h),6.79-6.74(m,1h),4.61(s,2h),4.50-4.04(m,3h),3.91-3.71(m,1h),2.86-2.74(m,1h),2.63-2.30(m,2h),2.18-2.06(m,1h)。
[0294]
步骤h:在室温下向(2r,8as)-2-(2,3-二氯-6-羟苯基)-六氢吲哚嗪-5,7-二酮(180毫克,0.516毫摩尔,1.00当量,90%)在thf(2毫升)中的搅拌溶液中加入nabh4(39毫克,1.026毫摩尔,1.99当量)。所得混合物在室温下搅拌1小时。所得混合物用水(3毫升)稀释。所得混合物用ea(3
×
10毫升)萃取。合并的有机层用盐水(3
×
5毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过手性hplc采用以下条件提纯:柱:chiralpak ie,2*25cm,5μm;流动相a:hex(0.1%fa),流动相b:etoh;流速:20ml/min;梯度:在11分钟内由20b至20b;220/254nm.保留时间:6.98分钟和8.68分钟。获得作为灰白色固体的化合物61((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-羟基-六氢-1h-吲哚嗪-5-酮异构体1)的较快洗脱的异构体(10毫克,2%):对c
14h15
cl2no3计算的lcms(esi)[m+h]
+
:316,318(3:2),实测316,318(3:2);1h nmr(400mhz,甲醇-d4)δ7.25(d,j=8.8hz,1h),6.78(d,j=8.8hz,1h),4.20-4.05(m,4h),3.57-3.52(m,1h),2.76-2.70(m,1h),2.47-2.34(m,2h),2.28-2.21(m,1h),2.11-2.02(m,1h),1.52-1.43(m,1h)。
[0295]
获得作为灰白色固体的化合物62((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-羟基-六氢-1h-吲哚嗪-5-酮异构体2)的较慢洗脱的异构体(45毫克,43%):对c
14h15
cl2no3计算的lcms(esi)[m+h]
+
:316,318(3:2),实测316,318(3:2);1h nmr(400mhz,甲醇-d4)δ7.25(d,j=8.8hz,1h),6.75(d,j=8.8hz,1h),4.29-4.21(m,1h),4.13-4.06(m,2h),3.78-3.72(m,1h),3.52-3.46(m,1h),2.79-2.73(m,1h),2.44-2.35(m,2h),2.28-2.13(m,2h),1.53-1.44(m,1h)。
[0296]
实施例23.以类似于本文中公开的实施例的方式和/或类似于本领域中已知的方法制备化合物63-64。
[0297]
实施例24.以类似于本文中公开的实施例的方式和/或类似于本领域中已知的方法制备化合物65-78。
[0298]
实施例25.化合物57((3r,8r,9as)-8-(2,3-二氯-6-羟苯基)-3-(羟甲基)-八氢吡啶并[1,2-a]吡嗪-4-酮)和化合物36((3r,8s,9ar)-8-(2,3-二氯-6-羟苯基)-3-(羟甲基)-八氢吡啶并[1,2-a]吡嗪-4-酮)步骤a:在室温下向(4r)-3-(叔丁氧基羰基)-2,2-二甲基-1,3-噁唑烷-4-甲酸(0.180克,0.74毫摩尔)和hatu(0.280克,0.74毫摩尔)在dmf(2毫升)中的搅拌溶液中加入[4-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲醇(顺式,外消旋)(0.190克,0.67毫摩尔)和tea(0.140克,1.34毫摩尔)。反应搅拌0.5小时,并且所得混合物直接通过用55%在0.05%tfa水溶液中的acn洗脱的反相色谱法提纯以提供作为浅黄色固体的(4r)-4-[4-(2,3-二氯-6-甲氧基苯基)-2-(羟甲基)哌啶-1-羰基]-2,2-二甲基-1,3-噁唑烷-3-甲酸叔丁酯(顺式,两种非对映异构体的混合物)(0.230克,71%)。对c
15h18
cl2n2o3计算的lcms(esi)[m+h]
+
:517,519(3:2),实测517,519(3:2);1h nmr(400mhz,cdcl3)δ7.36-7.29(m,1h),6.80-6.72(m,1h),4.94-4.64(m,1h),4.56-4.12(m,3h),4.12-3.90(m,1h),3.90-3.72(m,4h),3.72-3.30(m,2h),3.10-2.97(m,1h),2.64-2.28(m,1h),2.24-1.95(m,3h),1.79-1.65(m,3h),1.65-1.53(m,3h),1.52-1.47(m,9h)。
[0299]
步骤b:在室温下向(4r)-4-[4-(2,3-二氯-6-甲氧基苯基)-2-(羟甲基)哌啶-1-羰基]-2,
2-二甲基-1,3-噁唑烷-3-甲酸叔丁酯(0.230克,0.44毫摩尔)在dcm(1.00毫升)中的搅拌溶液中加入dess-martin氧化剂(0.280克,0.67毫摩尔)。反应搅拌1小时,用na2so3水溶液(1毫升)猝灭,用水(20毫升)稀释并用ea(2
×
30毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用70%在0.05%tfa水溶液中的acn洗脱的反相色谱法提纯以提供作为黄色油的(4r)-4-[4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基哌啶-1-羰基]-2,2-二甲基-1,3-噁唑烷-3-甲酸叔丁酯(顺式,两种异构体的混合物)(0.150克,65%)。对c
24h32
cl2n2o6计算的lcms(esi)[m+1]
+
515,517(3:2),实测515,517(3:2);1h nmr(400mhz,cdcl3)δ9.55(d,j=25.0hz,1h),7.42-7.30(m,1h),6.82-6.73(m,1h),4.99-4.79(m,1h),4.58-4.41(m,1h),4.38-4.19(m,2h),4.19-3.93(m,1h),3.94-3.65(m,4h),3.63-3.26(m,1h),2.66-2.32(m,1h),2.35-1.76(m,3h),1.79-1.64(m,3h),1.63-1.40(m,12h)。
[0300]
步骤c:在室温下向(4r)-4-[4-(2,3-二氯-6-甲氧基苯基)-2-(二羟甲基)哌啶-1-羰基]-2,2-二甲基-1,3-噁唑烷-3-甲酸叔丁酯(0.150克,0.29毫摩尔)在dcm(2毫升)中的搅拌溶液中加入tfa(0.5毫升)。反应搅拌2小时并在减压下浓缩以提供作为黄色油的8-(2,3-二氯-6-甲氧基苯基)-3-(羟甲基)-1h,6h,7h,8h,9h,9ah-吡啶并[1,2-a]吡嗪-4-酮(顺式,两种异构体的混合物)(0.110克,粗),其不经提纯直接用于下一步骤:对c
16h18
cl2n2o3计算的lcms(esi)[m+1]
+
357,359(3:2),实测357,359(3:2)。
[0301]
步骤d:在室温下向8-(2,3-二氯-6-甲氧基苯基)-3-(羟甲基)-1h,6h,7h,8h,9h,9ah-吡啶并[1,2-a]吡嗪-4-酮(顺式,两种异构体的混合物)(0.110克,0.31毫摩尔)在meoh(2毫升)中的搅拌溶液中加入pto2(20毫克)。反应在h2(1.5atm)下搅拌1小时。过滤反应,并且滤液在减压下浓缩。残余物通过用26%在0.05%tfa水溶液中的acn洗脱的反相色谱法提纯以提供作为黄色油的(3r)-8-(2,3-二氯-6-甲氧基苯基)-3-(羟甲基)-八氢吡啶并[1,2-a]吡嗪-4-酮(顺式,两种异构体的混合物)(80.0毫克,72%):对c
16h20
cl2n2o3计算的lcms(esi)[m+1]
+
359,361(3:2),实测359,361(3:2)。
[0302]
步骤e:在室温下向(3r)-8-(2,3-二氯-6-甲氧基苯基)-3-(羟甲基)-八氢吡啶并[1,2-a]吡嗪-4-酮(顺式,两种异构体的混合物)(80.0毫克,0.22毫摩尔)在dcm(2毫升)中的搅拌溶液中加入bbr3(0.560克,2.23毫摩尔)。反应搅拌2小时,用meoh(2毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xbridge prep c18 obd column,5μm,19
×
150mm;流动相a:水(加0.05%tfa),流动相b:acn;流速:25ml/min;梯度:在7分钟内由28%b至40%b;检测器:uv:254/220nm;保留时间:6.30分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的(3r,8r,9as)-8-(2,3-二氯-6-羟苯基)-3-(羟甲基)-八氢吡啶并[1,2-a]吡嗪-4-酮(顺式,两种异构体的混合物)(18.0毫克,23%):对c
15h18
cl2n2o3计算的lcms(esi)[m+1]
+
345,347(3:2),实测345,347(3:2)。1h nmr(400mhz,cd3od)δ7.23(d,j=8.8hz,1h),6.73(d,j=8.8hz,1h),4.84-4.67(m,1h),4.21-3.96(m,3h),3.93-3.68(m,2h),3.68-3.47(m,1h),3.39-3.35(m,1h),2.90-2.72(m,1h),2.62-2.34(m,2h),1.91-1.61(m,2h)。
[0303]
步骤f:3r)-8-(2,3-二氯-6-羟苯基)-3-(羟甲基)-八氢吡啶并[1,2-a]吡嗪-4-酮(顺式,两种异构体的混合物)(12毫克,0.04毫摩尔)通过手性制备hplc采用以下条件分离:柱:chiralpak ig,2
×
25cm,5μm;流动相a:hex(加0.2%ipa)-hplc,流动相b:etoh-hplc;流速:20ml/min;梯度:在14分钟内由20%b至20%b;检测器:uv 220/254nm;保留时间1:7.51分钟;保留时间2:11.52分钟。获得在7.51分钟处的较快洗脱的异构体以提供作为灰白色固体的化合物57((3r,8r,9as)-8-(2,3-二氯-6-羟苯基)-3-(羟甲基)-八氢吡啶并[1,2-a]吡嗪-4-酮)(1.9毫克,16%):对c
15h18
cl2n2o3计算的lcms(esi)[m+h]
+
:345,347(3:2),实测345,347(3:2);1h nmr(400mhz,cd3od)δ7.19(d,j=8.7hz,1h),6.71(d,j=8.8hz,1h),4.82-4.73(m,1h),3.96-3.84(m,2h),3.72-3.54(m,2h),3.45(dd,j=5.7,3.9hz,1h),3.36-3.34(m,1h),2.82-2.62(m,2h),2.53-2.24(m,2h),1.66(t,j=11.9hz,2h)。获得在11.52分钟处的较慢洗脱的异构体以提供作为灰白色固体的化合物36((3r,8s,9ar)-8-(2,3-二氯-6-羟苯基)-3-(羟甲基)-八氢吡啶并[1,2-a]吡嗪-4-酮)(2.6毫克,21%):对c
15h18
cl2n2o3计算的lcms(esi)[m+h]
+
:345,347(3:2),实测345,347(3:2);1h nmr(400mhz,cd3od)δ7.19(d,j=8.7hz,1h),6.71(d,j=8.8hz,1h),4.79-4.71(m,1h),3.96(dd,j=11.0,6.6hz,1h),3.83(dd,j=11.0,3.8hz,1h),3.77-3.71(m,1h),3.55-3.47(m,1h),3.45(dd,j=6.6,3.7hz,1h),3.18(dd,j=13.4,5.0hz,1h),3.01(dd,j=13.5,5.2hz,1h),2.71(td,j=13.1,2.9hz,1h),2.62-2.58(m,1h),2.53-2.39(m,1h),1.60(dt,j=13.2,3.4hz,2h)。
[0304]
实施例26.化合物46((3s,8r,9as)-8-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-3-甲基八氢-4h-吡啶并[1,2-a]吡嗪-4-酮)步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基哌啶-1-甲酸叔丁酯(中间体10,实施例8)(200毫克,0.51毫摩尔)和l-丙氨酸甲酯(63.0毫克,0.620毫摩尔)在dcm(2毫升)中的搅拌溶液中加入tea(100毫克,1.03毫摩尔)和nabh(aco)3(330毫克,1.54毫摩尔)。所得混合物在室温下搅拌3小时。反应用饱和nh4cl水溶液(20毫升)猝灭,随后用ea(3
×
20毫升)萃取。合并的有机相用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用45%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-([[(2s)-1-甲氧基-1-氧代丙-2-基]氨基]甲基)哌啶-1-甲酸叔丁酯(180毫克,73%):对c
22h32
cl2n2o5计算的lcms
(esi)[m+h]
+
:475,477(3:2),实测475,477(3:2);1h nmr(400mhz,cdcl3)δ7.33(d,j=8.9hz,1h),6.77(d,j=8.9hz,1h),4.28-4.15(m,2h),3.87(s,3h),3.84(s,3h),3.72-3.59(m,1h),3.55-3.33(m,2h),3.09(d,j=12.4hz,1h),2.40-2.25(m,1h),2.01-1.83(m,2h),1.64(d,j=7.1hz,2h),1.53(s,9h),1.48(d,j=3.8hz,3h)。
[0305]
步骤b:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-([[(2s)-1-甲氧基-1-氧代丙-2-基]氨基]甲基)哌啶-1-甲酸叔丁酯(180毫克,0.39毫摩尔)在dcm(2毫升)中的搅拌溶液中加入tfa(1毫升)。反应溶液在室温下搅拌1小时。反应用饱和nahco3水溶液(5毫升)猝灭,用水(10毫升)稀释,并分别用ea(3
×
10毫升)萃取。合并的有机层用盐水(3
×
10毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为黄色油的(2s)-2-([[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲基]氨基)丙酸甲酯(0.20克,粗),其不经提纯直接用于下一步骤:对c
17h24
cl2n2o3计算的lcms(esi)[m+h]
+
:375,377(3:2),实测375,377(3:2)。
[0306]
步骤c:在室温下向(2s)-2-([[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲基]氨基)丙酸甲酯(200毫克,0.53毫摩尔)在etoh(2毫升)中的搅拌溶液中加入tea(160毫克,1.60毫摩尔)。反应溶液在80℃下搅拌1小时。所得混合物在减压下浓缩。残余物通过用55%在水中的acn(加10mm nh4hco3)洗脱的反相色谱法提纯以提供作为黄色油的(3s,8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-3-甲基-八氢吡啶并[1,2-a]吡嗪-4-酮(50.0毫克,经两个步骤为38%):对c
16h20
cl2n2o2计算的lcms(esi)[m+h]
+
:343,345(3:2),实测343,345(3:2);1h nmr(400mhz,cdcl3)δ7.31(d,j=8.9hz,1h),6.75(d,j=9.0hz,1h),4.90-4.79(m,1h),3.82(s,3h),3.77-3.64(m,1h),3.58(q,j=7.0hz,1h),3.45-3.37(m,1h),3.21(dd,j=13.3,5.1hz,1h),3.00-2.89(m,1h),2.61(td,j=12.8,2.8hz,1h),2.48-2.27(m,2h),1.72-1.54(m,2h),1.47(d,j=7.0hz,3h)。
[0307]
步骤d:在室温下向羟基乙酸(16.0毫克,0.22毫摩尔)、hobt(29.0毫克,0.22毫摩尔)和edci(42.0毫克,0.219毫摩尔)在dmf(1毫升)中的搅拌溶液中加入(3s,8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-3-甲基-八氢吡啶并[1,2-a]吡嗪-4-酮(50毫克,0.15毫摩尔)和tea(44.0毫克,0.44毫摩尔)。所得混合物在室温下搅拌2小时,用水(10毫升)稀释,并用ea(3
×
20毫升)萃取。合并的有机层用盐水(5
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为黄色油的(3s,8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-2-(2-羟乙酰基)-3-甲基-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮(90毫克,粗),其不经提纯直接用于下一步骤:对c
18h22
cl2n2o4计算的lcms(esi)[m+h]
+
:401,403(3:2),实测401,403(3:2)。
[0308]
步骤e:在室温下向(3s,8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-2-(2-羟乙酰基)-3-甲基-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮(90.0毫克,0.22毫摩尔)在dcm(1毫升)中的搅拌溶液中加入bbr3(0.25毫升)。所得混合物在室温下搅拌1小时,在室温下用meoh(2毫升)猝灭,并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xbridge shield rp18 obd column,30
×
150mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:
在8分钟内由20%至49%;检测器:uv 254/220nm;保留时间:6.58分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物46((3s,8r,9as)-8-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-3-甲基-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮)(8.7毫克,经两个步骤为15%):对c
17h20
cl2n2o4计算的lcms(esi)[m+h]
+
:387,389(3:2),实测387,389(3:2);1h nmr(400mhz,cd3od)δ7.21(d,j=8.8hz,1h),6.73(d,j=8.8hz,1h),5.00-4.94(m,1h),4.78-4.69(m,1h),4.65-4.40(m,1h),4.40-4.14(m,2h),3.95(dd,j=14.5,4.5hz,1h),3.75-3.52(m,2h),3.09-2.64(m,1h),2.57-2.38(m,1h),2.38-2.20(m,1h),1.83-1.52(m,3h),1.47(d,j=7.1hz,2h)。
[0309]
实施例27.化合物12((3r,8r,9as)-8-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-3-甲基八氢-4h-吡啶并[1,2-a]吡嗪-4-酮)使用d-丙氨酸甲酯通过与先前的实施例相同的方法制备(3r,8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-2-(2-羟乙酰基)-3-甲基-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮。
[0310]
在室温下向(3r,8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-2-(2-羟乙酰基)-3-甲基-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮(70.0毫克,0.17毫摩尔)在dcm(1毫升)中的搅拌溶液中加入bbr3(0.25毫升)。所得混合物在室温下搅拌1小时,在室温下用meoh(2毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xbridge shield rp18 obd column,30
×
150mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在8分钟内由20%至48%;检测器:uv 254/220nm;保留时间:7.13分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物12((3r,8r,9as)-8-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-3-甲基-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮)(6.6毫克,两个步骤总计15%):对c
17h20
cl2n2o4计算的lcms(esi)[m+h]
+
:387,389(3:2),实测387,389(3:2);1h nmr(400mhz,cd3od)δ7.20(d,j=8.8hz,1h),6.69(d,j=8.8hz,1h),5.02-4.92(m,1h),4.74-4.54(m,1h),4.50-4.30(m,1h),4.30-4.18(m,2h),3.94-3.66(m,2h),3.62(d,j=11.7hz,1h),2.86-2.73(m,1h),2.60-2.33(m,2h),1.74-1.51(m,3h),1.45(d,j=7.1hz,2h)。
[0311]
实施例28.化合物83((8r,9as)-8-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-1-甲基-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮异构体1)和化合物84((8r,9as)-8-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-1-甲基-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮异构体2)
步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)哌啶-1,2-二甲酸1-叔丁酯2-甲酯(2.00克,4.78毫摩尔)在meoh(20毫升)和h2o(1.00毫升)中的溶液中加入lioh
·
h2o(600毫克,14.3毫摩尔)。反应在室温下搅拌12小时。随后反应用柠檬酸饱和水溶液酸化至ph3,并且混合物用ea(3
×
30毫升)萃取。合并的有机相用盐水(3
×
50毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色固体的(2s,4r)-1-(叔丁氧基羰基)-4-(2,3-二氯-6-甲氧基苯基)哌啶-2-甲酸(1.90克,89%):对c
18h23
cl2no5计算的lcms(esi)[m+h]
+
:404,406(3:2),实测404,406(3:2);1h nmr(400mhz,cd3od)δ7.38(d,j=9.0hz,1h),6.97(d,j=8.9hz,1h),4.25-4.20(m,1h),3.86(s,3h),3.82-3.47(m,3h),2.60-2.56(m,1h),2.18-1.99(m,1h),1.99-1.81(m,2h),1.40(s,9h)。
[0312]
步骤b:在室温下将(2s,4r)-1-(叔丁氧基羰基)-4-(2,3-二氯-6-甲氧基苯基)哌啶-2-甲酸(1.00克,2.47毫摩尔)、edci(710毫克,3.71毫摩尔)和hobt(500毫克,3.71毫摩尔)在dmf(10毫升)中的溶液搅拌30分钟。在室温下向上述溶液中加入tea(1.03毫升,10.19毫摩尔)和n,o-二甲基羟胺盐酸盐(480毫克,4.95毫摩尔)。反应在室温下搅拌3小时。所得混合物用水(40毫升)稀释,随后用ea(3
×
30毫升)萃取。合并的有机层用盐水(3
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用ea/pe(1/1)洗脱的硅胶柱色谱法提纯以提供作为浅黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[甲氧基(甲基)氨甲酰基]哌啶-1-甲酸叔丁酯(400毫克,36%):对c
20h28
cl2n2o5计算的lcms(esi)[m+h]
+
:447,449(3:2),实测447,449(3:2);1h nmr(400mhz,cdcl3)δ7.30(d,j=8.8hz,1h),6.75(d,j=8.9hz,1h),4.86-4.52(m,1h),4.17-3.88(m,1h),3.82(s,3h),3.79(s,3h),3.66-3.62(m,2h),3.21(s,3h),2.66-2.36(m,1h),2.14-1.77(m,3h),1.49(s,9h)。
[0313]
步骤c:在0℃下在氮气气氛下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[甲氧基(甲基)氨甲酰基]哌啶-1-甲酸叔丁酯(400毫克,0.89毫摩尔)在thf(4毫升)中的溶液中加入
memgbr(3.58毫升,3.58毫摩尔,1m在thf中)。反应在氮气气氛下在室温下搅拌2小时。反应用饱和nh4cl水溶液(20毫升)猝灭,并用ea(2
×
20毫升)萃取。合并的有机相用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色油的(2s,4r)-2-乙酰基-4-(2,3-二氯-6-甲氧基苯基)哌啶-1-甲酸叔丁酯(0.36克,粗),其不经进一步提纯直接用于下一步骤:对c
19h25
cl2no4计算的lcms(esi)[m+h]
+
:402,404(3:2),实测402,404(3:2)。
[0314]
步骤d:在室温下向(2s,4r)-2-乙酰基-4-(2,3-二氯-6-甲氧基苯基)哌啶-1-甲酸叔丁酯(360毫克,0.90毫摩尔)在dcm(4毫升)中的搅拌溶液中逐滴加入tfa(1毫升)。反应在室温下搅拌1小时。所得溶液在减压下浓缩以提供作为浅黄色油的1-[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]乙酮(280毫克,粗),其不经进一步提纯直接用于下一步骤:对c
14h17
cl2no2计算的lcms(esi)[m+h]
+
:302,304(3:2),实测302,304(3:2);1h nmr(400mhz,cd3od)δ7.45(d,j=9.0hz,1h),7.02(d,j=9.0hz,1h),4.27(dd,j=12.8,3.4hz,1h),3.90-3.88(m,1h),3.87(s,3h),3.57-3.50(m,1h),3.16(td,j=13.1,3.3hz,1h),2.65-2.43(m,2h),2.41-2.32(m,1h),2.29(s,3h),1.82(d,j=14.3hz,1h)。
[0315]
步骤e:在室温下向[(叔丁氧基羰基)氨基]乙酸(240毫克,1.39毫摩尔)和hatu(530毫克,1.39毫摩尔)在dmf(3毫升)中的溶液中加入tea(0.39毫升,3.82毫摩尔)和1-[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]乙酮(280毫克,0.93毫摩尔)。反应在室温下搅拌2小时。所得混合物用水(20毫升)稀释并用ea(3
×
20毫升)萃取。合并的有机层用盐水(5
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为黄色油的n-[2-[(2s,4r)-2-乙酰基-4-(2,3-二氯-6-甲氧基苯基)哌啶-1-基]-2-氧代乙基]氨基甲酸叔丁酯(500毫克,粗),其不经进一步提纯直接用于下一步骤:对c
21h28
cl2n2o5计算的lcms(esi)[m+h]
+
:459,461(3:2),实测459,461(3:2);1h nmr(400mhz,cdcl3)δ7.33(d,j=8.9hz,1h),6.77(d,j=8.9hz,1h),4.44(s,1h),4.10-4.01(m,2h),3.83(s,3h),3.75-3.66(m,2h),3.60-3.47(m,1h),2.52-2.32(m,1h),2.23(s,3h),2.18-2.08(m,1h),2.01-1.89(m,2h),1.47(s,9h)。
[0316]
步骤f:在室温下向n-[2-[(2s,4r)-2-乙酰基-4-(2,3-二氯-6-甲氧基苯基)哌啶-1-基]-2-氧代乙基]氨基甲酸叔丁酯(500毫克,1.09毫摩尔)在dcm(4毫升)中的溶液中加入tfa(1毫升)。反应在室温下搅拌30分钟。反应混合物用nahco3水溶液碱化至ph 7。随后,所得混合物用dcm(2
×
20毫升)萃取。合并的有机相用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色油的(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-1-甲基-3h,6h,7h,8h,9h,9ah-吡啶并[1,2-a]吡嗪-4-酮(360毫克,粗):对c
16h18
cl2n2o2计算的lcms(esi)[m+h]
+
:341,343(3:2),实测341,343(3:2);1h nmr(400mhz,cd3od)δ7.41(d,j=9.0hz,1h),6.98(d,j=9.0hz,1h),4.81-4.72(m,1h),4.27-4.18(m,2h),3.84(s,3h),2.83(s,2h),2.74(td,j=13.1,3.0hz,1h),2.39-2.26(m,2h),2.16-2.08(m,1h),2.06(t,j=1.7hz,3h),1.64(d,j=13.3hz,1h)。
[0317]
步骤g:
在室温下向(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-1-甲基-3h,6h,7h,8h,9h,9ah-吡啶并[1,2-a]吡嗪-4-酮(360毫克,1.06毫摩尔)在meoh(2毫升)中的溶液中加入pto2(24.0毫克,0.11毫摩尔)。混合物在氢气气氛(1.5atm)下在室温下搅拌12小时。反应混合物经硅藻土垫(celite pad)过滤,并且滤液在减压下浓缩。残余物通过用32%在水中的mecn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-1-甲基-八氢吡啶并[1,2-a]吡嗪-4-酮;三氟乙酸(300毫克,73%):对c
16h20
cl2n2o2计算的lcms(esi)[m+h]
+
:343,345(3:2),实测343,345(3:2);1h nmr(400mhz,cd3od)δ7.41(d,j=8.9hz,1h),6.98(d,j=8.8hz,1h),4.65-4.51(m,1h),4.44-4.33(m,1h),3.86-3.81(m,4h),3.68-3.55(m,3h),3.26-3.11(m,1h),2.24-2.11(m,1h),1.99-1.90(m,1h),1.78-1.69(m,1h),1.53-1.43(m,1h),1.36(d,j=6.6hz,3h)。
[0318]
步骤h:在室温下向甲氧基乙酸(120毫克,1.33毫摩尔)在dmf(3毫升)和hatu(580毫克,1.53毫摩尔)的溶液中加入(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-1-甲基-八氢吡啶并[1,2-a]吡嗪-4-酮(350毫克,1.02毫摩尔)和tea(310毫克,3.06毫摩尔)。反应在室温下搅拌2小时,倾入水(40毫升)中,并用ea(2
×
30毫升)萃取。合并的有机相用盐水(4
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xbridge shield rp18 obd column,30
×
150mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在7分钟内由25%b至55%b;检测器:uv 220nm;保留时间1:6.35分钟;保留时间2:6.55min。获得在6.35分钟处的作为浅黄色泡沫的(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-2-(2-甲氧基乙酰基)-1-甲基-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮异构体1的较快洗脱的对映异构体(80.0毫克,25%):对c
19h24
cl2n2o4计算的lcms(esi)[m+h]
+
:415,417(3:2),实测415,417(3:2);1h nmr(400mhz,cdcl3)δ7.27(d,j=9.1hz,1h),6.71(d,j=9.2hz,1h),5.65-5.18(m,1h),5.03-4.60(m,2h),4.56-3.89(m,3h),3.86-3.61(m,4h),3.59-3.19(m,4h),2.67(t,j=12.8hz,1h),2.44-2.17(m,2h),1.62(dd,j=38.6,13.0hz,2h),1.50-1.23(m,3h)。获得在6.55分钟处的作为浅黄色泡沫的(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-2-(2-甲氧基乙酰基)-1-甲基-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮异构体2的较慢洗脱的对映异构体(80毫克,25%):对c
19h24
cl2n2o4计算的lcms(esi)[m+h]
+
:415,417(3:2),实测415,417(3:2);1h nmr(400mhz,cdcl3)δ7.29(d,j=8.9hz,1h),6.74(d,j=8.9hz,1h),5.67-5.19(m,1h),4.97-4.60(m,2h),4.41-3.93(m,3h),3.80(s,3h),3.74-3.47(m,2h),3.40(s,3h),2.76(t,j=12.7hz,1h),2.45-2.07(m,2h),1.63(dd,j=54.4,13.0hz,2h),1.39-1.16(m,3h)。
[0319]
步骤i:在室温下向(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-2-(2-甲氧基乙酰基)-1-甲基-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮异构体1或(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-2-(2-甲氧基乙酰基)-1-甲基-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮异构体2(80.0毫克,0.19毫摩尔)在dcm(2毫升)中的溶液中加入bbr3(0.15毫升,1.59毫摩尔)。反应在室温下搅拌2小时。反应用meoh(5毫升)猝灭。混合物在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xbridge shield rp18 obd column,30
×
150mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在7分钟内由23%b至50%b;检测器:uv 220nm;保留时
(2-羟乙酰基)-3-甲基-六氢吡咯并[1,2-a]吡嗪-4-酮)(14.5毫克,24%):对c
16h18
cl2n2o4计算的lcms(esi)[m+h]
+
373,375(3:2),实测373,375(3:2);1h nmr(400mhz,cd3od)δ7.26(d,j=8.7hz,1h),6.77(d,j=8.8hz,1h),4.45-4.21(m,4h),4.21-4.10(m,2h),4.01-3.70(m,1h),3.64-3.47(m,1h),3.26-3.17(m,1h),2.44-2.09(m,2h),1.51(d,j=7.0hz,3h)。
[0325]
实施例31.化合物87((7r,8as)-7-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-1-甲基六氢吡咯并[1,2-a]吡嗪-4(1h)-酮异构体1)和化合物88((7r,8as)-7-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-1-甲基六氢吡咯并[1,2-a]吡嗪-4(1h)-酮异构体2)步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-1,2-二甲酸1-叔丁酯2-甲酯(中间体7,实施例6)(2.00克,4.95毫摩尔)在meoh(20毫升)中的搅拌溶液中加入在h2o(1毫升)中的lioh
·
h2o(620毫克,14.84毫摩尔)。随后,反应在室温下搅拌12小时并用柠檬酸(30毫升)酸化至ph 3,随后用ea(3
×
20毫升)萃取。合并的有机相用盐水(2
×
20毫升)洗涤并在na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为灰白色泡沫的(2s,4r)-1-(叔丁氧基羰基)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-甲酸(1.60克,83%):对c
17h21
cl2no5计算的lcms(esi)[m+na]
+
:412,414(3:2),实测412,414(3:2);1h nmr(400mhz,cdcl3)δ7.35(d,j=8.9hz,1h),6.77(d,j=9.0hz,1h),4.58-4.39(m,1h),4.27-4.13(m,1h),3.92-3.73(m,5h),3.01-2.65(m,1h),2.57-2.35(m,1h),1.50(s,9h)。
[0326]
步骤b:在室温下向(2s,4r)-1-(叔丁氧基羰基)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-甲酸(1.40克,3.59毫摩尔)在dmf(15毫升)中的溶液中加入edci(1.03克,5.38毫摩尔)和hobt(720毫克,5.38毫摩尔)。30分钟后,在0℃下在氮气气氛下加入n,o-二甲基羟胺盐酸盐
4-酮异构体2)(55毫克,19.71%):对c
16h18
cl2n2o4计算的lcms(esi)[m+h]
+
:373,375(3:2),实测373,375(3:2);1h nmr(400mhz,cd3od)δ7.27(d,j=8.8hz,1h),6.76(d,j=8.8hz,1h),4.43-4.15(m,4h),4.14-4.02(m,1h),4.01-3.85(m,2h),3.83-3.66(m,2h),2.58-2.53(m,1h),2.40(dt,j=11.8,6.7hz,1h),1.35(d,j=6.2hz,3h)。
[0334]
实施例32.化合物18((8r,9as)-8-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-六氢-1h-吡咯并[1,2-a][1,4]二氮杂-5-酮)步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基吡咯烷-1-甲酸叔丁酯(实施例7,步骤c)(1.90克,5.08毫摩尔)和3-氨基丙酸甲酯盐酸盐(500毫克,1.39毫摩尔)在dcm(20毫升)中的搅拌溶液中加入tea(430毫克,4.25毫摩尔)和nabh(aco)3(600毫克,2.83毫摩尔)。反应搅拌2小时,用水(50毫升)猝灭并用ea(3
×
50毫升)萃取。合并的有机层用盐水(2
×
50毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用45%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色油的(2s,4r)-4-(2,3-二氯-6-羟苯基)-2-[[(3-甲氧基-3-氧代丙基)氨基]甲基]吡咯烷-1-甲酸叔丁酯(300毫克,48%):对c
21h30
cl2n2o5计算的lcms(esi)[m+h]
+
461,463(3:2),实测461,463(3:2);1h nmr(400mhz,cd3od)δ7.46(d,j=9.0hz,1h),7.03(d,j=9.0hz,1h),4.24-4.12(m,2h),3.91(s,3h),3.88-3.69(m,6h),3.46-3.36(m,3h),2.95-2.82(m,2h),2.51-2.36(m,1h),2.36-2.33(m,1h),1.53(s,9h)。
[0335]
步骤b:在室温下向(2s,4r)-4-(2,3-二氯-6-羟苯基)-2-[[(3-甲氧基-3-氧代丙基)氨基]甲基]吡咯烷-1-甲酸叔丁酯(120毫克,0.26毫摩尔)在dcm(2毫升)中的搅拌溶液中加入tfa(2毫升)。反应在室温下搅拌1小时。反应在减压下浓缩。残余物溶解在meoh(3毫升)中并加入lioh
·
h2o(33.0毫克,0.78毫摩尔)。反应在40℃下搅拌1小时并在减压下浓缩。粗产物溶解在dmf(3毫升)中并加入hatu(200毫克,0.52毫摩尔)。所得溶液在室温下搅拌1小时,用水(30毫升)稀释并用ea(3
×
30毫升)萃取。合并的有机层用盐水(2
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用50%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色油的(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-八氢
吡咯并[1,2-a][1,4]二氮杂-5-酮(30.0毫克,35%):对c
15h18
cl2n2o2计算的lcms(esi)[m+h]
+
329,331(3:2),实测329,331(3:2);1h nmr(400mhz,cd3od)δ7.45(d,j=9.0hz,1h),7.02(d,j=9.0hz,1h),4.44-4.34(m,1h),4.27-4.14(m,1h),3.92-3.86(m,5h),3.67-3.55(m,2h),3.31-3.16(m,2h),3.16-3.04(m,1h),2.80-2.70(m,1h),2.61-2.49(m,1h),2.46-2.36(m,1h)。
[0336]
步骤c:在室温下向(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-八氢吡咯并[1,2-a][1,4]二氮杂-5-酮(30.0毫克,0.09毫摩尔)在dcm(1毫升)中的搅拌溶液中加入bbr3(91.0毫克,0.37毫摩尔)。反应在室温下搅拌1小时。反应用meoh(10毫升)猝灭并在减压下浓缩。残余物通过用20%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为无色油的(8r,9as)-8-(2,3-二氯-6-羟苯基)-八氢吡咯并[1,2-a][1,4]二氮杂-5-酮三氟乙酸(30.0毫克,77%):对c
14h16
cl2n2o2计算的lcms(esi)[m+h]
+
315,317(3:2),实测315,317(3:2);1h nmr(400mhz,cd3od)δ7.32(d,j=8.8hz,1h),6.88(d,j=8.8hz,1h),4.55-4.42(m,1h),4.05-3.96(m,1h),3.80-3.70(m,1h),3.70-3.43(m,4h),3.31-3.18(m,2h),2.77-2.62(m,1h),2.56-2.41(m,1h),2.36-2.16(m,1h)。
[0337]
步骤d:在室温下向羟基乙酸(6毫克,0.08毫摩尔)、hobt(11.0毫克,0.08毫摩尔)和edci(16.0毫克,0.08毫摩尔)在dmf(1毫升)中的搅拌溶液中加入(8r,9as)-8-(2,3-二氯-6-羟苯基)-八氢吡咯并[1,2-a][1,4]二氮杂-5-酮三氟乙酸(30.0毫克,0.07毫摩尔)和tea(21.0毫克,0.21毫摩尔)。反应在室温下搅拌2小时。反应用meoh(0.5毫升)猝灭并通过制备hplc采用以下条件提纯:柱:xbridge shield rp18 obd column 30
×
150mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在8分钟内由15%b至45%b;检测器:uv 254/220nm;保留时间:6.98分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物18(8r,9as)-8-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-六氢-1h-吡咯并[1,2-a][1,4]二氮杂-5-酮)(8.7毫克,33%):对c
16h18
cl2n2o4计算的lcms(esi)[m+h]
+
373,375(3:2),实测373,375(3:2);1h nmr(400mhz,cd3od)δ7.27(d,j=8.8hz,1h),6.77(d,j=8.8hz,1h),4.77-4.58(m,1h),4.40-4.24(m,2h),4.17-3.75(m,5h),3.30-2.94(m,1h),2.92-2.78(m,1h),2.78-2.57(m,3h),2.43-2.26(m,1h)。
[0338]
实施例33.化合物90((8r,9as)-8-(2,3-二氯-6-羟苯基)-3-(2-羟乙酰基)-六氢-1h-吡咯并[1,2-d][1,4]二氮杂-5-酮)
步骤a:在0℃下在氮气气氛下向(甲氧基甲基)三苯基氯化鏻(770毫克,2.23毫摩尔)在thf中(5毫升)的搅拌混合物中逐滴加入t-buok(2.22毫升,2.22毫摩尔,1m在thf中)。反应在0℃下搅拌15分钟。随后加入在thf(1毫升)中的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基吡咯烷-1-甲酸叔丁酯(实施例7,步骤c)(420毫克,1.12毫摩尔)。反应在0℃下搅拌1小时,随后用ea(30毫升)和水(30毫升)稀释。水溶液用ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用70%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(2-甲氧基乙烯基)吡咯烷-1-甲酸叔丁酯(300毫克,59%):对c
19h25
cl2no4计算的lcms(esi)[m+h]
+
402,404(3:2),实测402,404(3:2);1h nmr(400mhz,cd3od)δ7.47-7.39(m,1h),7.03-6.95(m,1h),4.85-4.58(m,1h),4.58-4.20(m,1h),4.14-3.68(m,4h),3.66-3.46(m,4h),2.91-2.16(m,2h),1.87-1.61(m,2h),1.57-1.43(m,9h)。
[0339]
步骤b:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(2-甲氧基乙烯基)吡咯烷-1-甲酸叔丁酯(300毫克,0.75毫摩尔)在丙酮(5毫升)中的搅拌溶液中加入tsoh
·
h2o(71.0毫克,0.37毫摩尔)。反应在室温下搅拌0.5小时。反应用水(20毫升)稀释。水溶液用ea(2
×
30毫升)萃取。合并的有机层用盐水(2
×
30毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(2-氧代乙基)吡咯烷-1-甲酸叔丁酯(300毫克,粗),其不经进一步提纯直接用于下一步骤:对c
18h23
cl2no4计算的lcms(esi)[m+h]
+
388,340(3:2),实测388,340(3:2);步骤c:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(2-氧代乙基)吡咯烷-1-甲酸叔丁酯(210毫克,0.54毫摩尔)和2-氨基乙酸甲酯盐酸盐(140毫克,1.08毫摩尔)在dcm(2毫升)中的搅拌溶液中加入tea(160毫克,1.62毫摩尔)和nabh(aco)3(340毫克,1.62毫摩尔)。反应在室温下搅拌1小时,用水(20毫升)稀释并用ea(2
×
30毫升)萃取。合并的有机层用盐水(2
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用
35%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[2-[(2-甲氧基-2-氧代乙基)氨基]乙基]吡咯烷-1-甲酸叔丁酯(110毫克,经两个步骤为48%):对c
21h30
cl2n2o5计算的lcms(esi)[m+h]
+
461,463(3:2),实测461,463(3:2);步骤d:在室温下向甲氧基乙酸(43.0毫克,0.48毫摩尔)和hatu(180毫克,0.48毫摩尔)在dmf(2毫升)中的搅拌溶液中加入[2-[(2s,4r)-1-(叔丁氧基羰基)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]乙基](2-甲氧基-2-氧代乙基)胺基(aminyl)(110毫克,0.24毫摩尔)和tea(72.0毫克,0.72毫摩尔)。反应在室温下搅拌1小时。反应通过用40%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[2-[2-甲氧基-n-(2-甲氧基-2-氧代乙基)乙酰胺基]乙基]吡咯烷-1-甲酸叔丁酯(50.0毫克,39%):对c
24h34
cl2n2o7计算的lcms(esi)[m+h]
+
533,535(3:2),实测533,535(3:2);1h nmr(400mhz,cd3od)δ7.43(d,j=8.9hz,1h),7.00(d,j=9.1hz,1h),4.44-3.98(m,6h),3.95-3.70(m,8h),3.55-3.41(m,4h),2.69-2.57(m,1h),2.10-1.63(m,4h),1.58-1.46(m,9h)。
[0340]
步骤e:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[2-[2-甲氧基-n-(2-甲氧基-2-氧代乙基)乙酰胺基]乙基]吡咯烷-1-甲酸叔丁酯(50.0毫克,0.09毫摩尔)在dcm(2毫升)中的搅拌溶液中加入tfa(1毫升)。反应在室温下搅拌1小时。反应在减压下浓缩。残余物溶解在meoh(2毫升)中并加入在水(0.5毫升)中的lioh h2o(20.0毫克,0.47毫摩尔)。反应在40℃下搅拌1小时。反应在减压下浓缩以提供作为黄色固体的(n-[2-[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]乙基]-2-甲氧基乙酰胺基)乙酸(50.0毫克,粗),其不经进一步提纯直接用于下一步骤:对c
18h24
cl2n2o5计算的lcms(esi)[m+h]
+
419,421(3:2),实测419,421(3:2)。
[0341]
步骤f:将(n-[2-[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]乙基]-2-甲氧基乙酰胺基)乙酸(50.0毫克,0.12毫摩尔)和hatu(45.0毫克,0.12毫摩尔)在dmf(0.50毫升)中的溶液在室温下搅拌1小时。该反应用水(0.2毫升)猝灭。反应溶液通过用35%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-3-(2-甲氧基乙酰基)-六氢-1h-吡咯并[1,2-d][1,4]二氮杂-5-酮(25.0毫克,经两个步骤为65%):对c
18h22
cl2n2o4计算的lcms(esi)[m+h]
+
401,403(3:2),实测401,403(3:2);1h nmr(400mhz,cd3od)δ7.43(d,j=9.0hz,1h),7.00(d,j=9.0hz,1h),4.45-3.98(m,6h),3.97-3.67(m,7h),3.60-3.37(m,4h),2.10-1.86(m,2h),1.82-1.67(m,1h)。
[0342]
步骤g:在室温下向(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-3-(2-甲氧基乙酰基)-六氢-1h-吡咯并[1,2-d][1,4]二氮杂-5-酮(25.0毫克,0.06毫摩尔)在dcm(1毫升)中的搅拌溶液中加入bbr3(94.0毫克,0.37毫摩尔)。反应在室温下搅拌1小时。反应用meoh(1毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xselect csh obd column30
×
150mm 5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在7分钟内
由15%b至45%b;检测器:uv 220nm;保留时间:6.92分钟。将含有所需产物的级分合并,并在减压下浓缩以提供作为灰白色固体的化合物90((8r,9as)-8-(2,3-二氯-6-羟苯基)-3-(2-羟乙酰基)-六氢-1h-吡咯并[1,2-d][1,4]二氮杂-5-酮)(7.8毫克,34%):对c
16h18
cl2n2o4计算的lcms(esi)[m+h]
+
373,375(3:2),实测373,375(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.75(d,j=8.8hz,1h),4.47-3.97(m,8h),3.86-3.67(m,2h),3.10-2.65(m,1h),2.35-1.85(m,3h)。
[0343]
实施例34.化合物91((8r,9as)-8-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-4-甲基八氢-5h-吡咯并[1,2-a][1,4]二氮杂-5-酮异构体1)和化合物92((8r,9as)-8-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-4-甲基八氢-5h-吡咯并[1,2-a][1,4]二氮杂-5-酮异构体2)步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基吡咯烷-1-甲酸叔丁酯(实施例7,步骤c)(300毫克,0.80毫摩尔)和3-氨基-2-甲基丙酸甲酯(110毫克,0.96毫摩尔)在dcm(4毫升)中的搅拌溶液中加入naoac(130毫克,1.60毫摩尔)和nabh(oac)3(500毫克,2.40毫摩尔)。所得混合物在室温下搅拌1小时。所得混合物用饱和nh4cl水溶液(30毫升)猝灭,随后用ea(3
×
20毫升)萃取。合并的有机相用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用55%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[(3-甲氧基-2-甲基-3-氧代丙基)氨基]甲基]吡咯烷-1-甲酸叔丁酯(400毫克,80%):对c
22h32
cl2n2o5计算的lcms(esi)[m+h]
+
:475,477(3:2),实测475,477(3:2);1h nmr(400mhz,cdcl3)δ7.36(d,j=8.9hz,1h),6.78(d,j=9.0hz,1h),4.26-4.08(m,1h),3.86(s,3h),3.83-3.72(m,4h),3.67(t,j=9.6hz,1h),3.54-3.38(m,2h),3.25-3.00(m,4h),2.48-2.24
(m,2h),1.49(d,j=3.5hz,9h),1.38-1.29(m,3h)。
[0344]
步骤b:在室温下向甲氧基乙酸(110毫克,1.26毫摩尔)和hatu(480毫克,1.26毫摩尔)在dmf(4毫升)中的搅拌溶液中加入(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[(3-甲氧基-2-甲基-3-氧代丙基)氨基]甲基]吡咯烷-1-甲酸叔丁酯(400毫克,0.84毫摩尔)和tea(250毫克,2.52毫摩尔)。所得混合物在室温下搅拌2小时,用水(30毫升)稀释并用ea(3
×
20毫升)萃取。合并的有机相用盐水(2
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用60%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[2-甲氧基-n-(3-甲氧基-2-甲基-3-氧代丙基)乙酰胺基]甲基]吡咯烷-1-甲酸叔丁酯(300毫克,65%):对c
25h36
cl2n2o7计算的lcms(esi)[m+h]
+
:547,549(3:2),实测547,549(3:2);1h nmr(400mhz,cdcl3)δ7.34(d,j=8.9hz,1h),6.78(d,j=8.9hz,1h),4.31-4.12(m,4h),4.12-3.93(m,1h),3.90(d,j=4.1hz,3h),3.78-3.60(m,6h),3.43(s,3h),3.13-2.83(m,3h),2.39-2.15(m,2h),1.50(d,j=19.1hz,9h),1.25-1.10(m,3h)。
[0345]
步骤c:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[2-甲氧基-n-(3-甲氧基-2-甲基-3-氧代丙基)乙酰胺基]甲基]吡咯烷-1-甲酸叔丁酯(300毫克,0.55毫摩尔)在dcm(3毫升)中的搅拌溶液中加入tfa(1.5毫升)。所得混合物在室温下搅拌1小时。所得溶液在减压下浓缩以提供作为黄色油的3-(n-[[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]甲基]-2-甲氧基乙酰胺基)-2-甲基丙酸甲酯(0.30克,粗),其不经进一步提纯直接用于下一步骤:对c
20h28
cl2n2o5计算的lcms(esi)[m+h]
+
:447,449(3:2),实测447,449(3:2)。
[0346]
步骤d:在室温下向3-(n-[[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]甲基]-2-甲氧基乙酰胺基)-2-甲基丙酸甲酯(300毫克,0.67毫摩尔)在meoh中(3毫升)的搅拌溶液中加入在h2o(1毫升)中的lioh
·
h2o(56.0毫克,1.34毫摩尔)。所得混合物在40℃下搅拌1小时。所得混合物在减压下浓缩。粗产物用dmf(3毫升)溶解并加入hatu(380毫克,1.00毫摩尔)。反应混合物在室温下搅拌1小时,用水(30毫升)稀释并用ea(3
×
20毫升)萃取。合并的有机相用盐水(2
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用30%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色油的(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-2-(2-甲氧基乙酰基)-4-甲基-六氢-1h-吡咯并[1,2-a][1,4]二氮杂-5-酮(60.0毫克,经两个步骤为27%):对c
19h24
cl2n2o4计算lcms(esi)[m+h]
+
:415,417(3:2),实测415,417(3:2);1h nmr(400mhz,cdcl3)δ7.41-7.35(m,1h),6.83-6.77(m,1h),4.49-4.35(m,1h),4.34-4.03(m,3h),4.01-3.82(m,4h),3.82-3.50(m,4h),3.47(s,3h),3.33-2.95(m,2h),2.59-2.18(m,2h),1.39-1.27(m,3h)。
[0347]
步骤e:在室温下向(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-2-(2-甲氧基乙酰基)-4-甲基-六氢-1h-吡咯并[1,2-a][1,4]二氮杂-5-酮(60.0毫克,0.14毫摩尔)在dcm(1毫升)中的搅拌溶液中加入bbr3(0.5毫升)。所得混合物在室温下搅拌1小时。反应用meoh(2毫升)在室温下猝灭。所得混合物在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:
甲基-六氢-1h-吡咯并[1,2-a][1,4]二氮杂-5-酮)步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基吡咯烷-1-甲酸叔丁酯(实施例7,步骤c)(400毫克,1.07毫摩尔)和(3s)-3-氨基丁酸(170毫克,1.60毫摩尔)在dcm(5毫升)中的搅拌溶液中加入hoac(0.06毫升,1.02毫摩尔)和nabh(aco)3(680毫克,3.21毫摩尔)。反应在室温下搅拌1小时。反应用饱和nh4cl水溶液(20毫升)猝灭,随后用ea(3
×
30毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用50%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(3s)-3-([[(2s,4r)-1-(叔丁氧基羰基)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]甲基]氨基)丁酸(220毫克,40%):对c
21h30
cl2n2o5计算的lcms(esi)[m+h]
+
:461,463(3:2),实测461,463(3:2);1h nmr(400mhz,cdcl3)δ7.36(d,j=8.9hz,1h),6.78(d,j=9.0hz,1h),4.18-4.02(m,2h),3.87(s,3h),3.83-3.66(m,2h),3.18-2.93(m,2h),2.93-2.80(m,1h),2.62-2.51(m,2h),2.44-2.26(m,2h),1.48(s,9h),1.33(d,j=6.5hz,3h)。
[0353]
步骤b:在室温下向甲氧基乙酸(64.0毫克,0.72毫摩尔)和hatu(280毫克,0.72毫摩尔)在dmf(3毫升)中的搅拌溶液中加入(3s)-3-([[(2s,4r)-1-(叔丁氧基羰基)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]甲基]氨基)丁酸(220毫克,0.48毫摩尔)和tea(140毫克,1.43毫摩尔)。所得混合物在室温下搅拌1小时,用水(20毫升)稀释并用ea(3
×
30毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用50%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(3s)-3-(n-[[(2s,4r)-1-(叔丁氧基羰基)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]甲基]-2-甲氧基乙酰胺基)丁酸(140毫克,50%):对c
24h34
cl2n2o7计算的lcms(esi)[m+h]
+
:533,535(3:2),实测533,535(3:2);1h nmr(400mhz,cdcl3)δ7.39-7.31(m,1h),6.82-6.73(m,1h),4.38-4.28(m,1h),4.28-4.13(m,2h),4.00-3.86(m,4h),3.86-3.60(m,3h),3.58-3.37(m,4h),3.20-3.09(m,1h),2.63-2.16(m,4h),1.50(s,9h),1.35-1.26(m,3h)。
[0354]
步骤c:在室温下向(3s)-3-(n-[[(2s,4r)-1-(叔丁氧基羰基)-4-(2,3-二氯-6-甲氧基苯
计算的lcms(esi)[m+h]
+
:344,346(3:2),实测344,346(3:2);1h nmr(400mhz,cd3od)δ7.27(d,j=8.8hz,1h),6.77(d,j=8.8hz,1h),4.48-4.27(m,3h),4.21-4.13(m,1h),3.96-3.87(m,1h),3.82(d,j=17.7hz,1h),3.59(t,j=11.4,9.7hz,1h),2.88(dd,j=13.2,10.5hz,1h),2.45-2.42(m,1h),2.22-2.13(m,1h)。
[0357]
实施例38.以类似于对化合物55所描述的方式制备化合物96-97。
[0358]
实施例39.化合物30((7r,8as)-7-(2,3-二氯-6-羟苯基)-n,n-二甲基-4-氧代六氢吡咯并[1,2-a]吡嗪-2(1h)-甲酰胺)
步骤a:在0℃下向(7r,8as)-7-(2,3-二氯-6-羟苯基)-六氢-1h-吡咯并[1,2-a]吡嗪-4-酮氢溴酸盐(中间体8,实施例7)(200毫克,0.52毫摩尔)在dcm(2毫升)中的搅拌溶液中加入n,n-二异丙基乙胺(150毫克,1.15毫摩尔)和氯甲酸4-硝基苯酯(84.0毫克,0.42毫摩尔)。所得溶液在0℃下搅拌1小时。反应用水(20毫升)稀释,随后用ea(3
×
20毫升)萃取。合并的有机相用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用45%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色固体的(7r,8as)-7-(2,3-二氯-6-羟苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-甲酸4-硝基苯酯(110毫克,42%):对c
20h17
cl2n3o6计算的lcms(esi)[m+h]
+
:466,468(3:2),实测466,468(3:2);1h nmr(400mhz,dmso-d6)δ10.42(s,1h),8.34(d,j=8.5hz,2h),7.50(d,j=8.5hz,2h),7.36(d,j=8.8hz,1h),6.85(d,j=8.8hz,1h),4.57-4.09(m,3h),4.09-3.81(m,3h),3.49(t,j=10.4hz,1h),3.05(dt,j=72.4,11.8hz,1h),2.31-2.08(m,2h)。
[0359]
步骤b:在室温下向(7r,8as)-7-(2,3-二氯-6-羟苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-甲酸4-硝基苯酯(30.0毫克,0.06毫摩尔)和二甲胺(9毫克,0.19毫摩尔)在dmf(1毫升)中的搅拌溶液中加入k2co3(18毫克,0.13毫摩尔)。所得混合物在80℃下搅拌1小时。将反应过滤,并且滤液通过制备hplc采用以下条件提纯:柱:xbridge shield rp18 obd column,30
×
150mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在8分钟内由25%至50%;检测器:uv 254/220nm;保留时间:5.85分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物30((7r,8as)-7-(2,3-二氯-6-羟苯基)-n,n-二甲基-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-甲酰胺)(14.0毫克,55.53%):对c
16h19
cl2n3o3计算的lcms(esi)[m+h]
+
:372,374(3:2),实测372,374(3:2);1h nmr(400mhz,cd3od)δ7.26(d,j=8.8hz,1h),6.76(d,j=8.8hz,1h),4.37-4.25(m,1h),4.19(dd,j=11.4,9.2hz,1h),4.13-4.04(m,2h),4.03-3.94(m,1h),3.85(d,j=17.6hz,1h),3.60-3.52(m,1h),2.97-2.84(m,7h),2.39-2.36(m,1h),2.20-2.11(m,1h)。
[0360]
实施例40.以类似于对化合物30所描述的方式制备化合物99-104。
[0361]
实施例41.化合物105((7s,9ar)-7-(2,3-二氯-6-羟苯基)-八氢吡啶并[1,2-a]吡嗪-4-酮异构体1)和化合物106((7s,9as)-7-(2,3-二氯-6-羟苯基)-八氢吡啶并[1,2-a]吡嗪-4-酮异构体2)步骤a:在室温下在氮气气氛下向1,2-二氯-3-碘-4-甲氧基苯(2.00克,6.60毫摩尔)和5-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡啶-2-甲腈(1.52克,6.60毫摩尔)在二氧杂环已烷(20毫升)和h2o(5毫升)中的溶液中加入na2co3(2.10克,19.81毫摩尔)和pd(dppf)cl2·
ch2cl2(540毫克,0.66毫摩尔)。悬浮液在真空下脱气并用氮气气氛吹扫三遍。随后,反应在氮气气氛下在80℃下搅拌3小时。在冷却至室温后,混合物用水(50毫升)稀释。并用ea(3
×
50毫升)萃取。合并的有机层用盐水(2
×
50毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(3/1)洗脱的硅胶柱色谱法提纯以提供作为黄色固体的5-(2,3-二氯-6-甲氧基苯基)吡啶-2-甲腈(1.50克,81%):对c
13
h8cl2n2o计算的lcms(esi)[m+h]
+
:279,281(3:2),实测279,281(3:2);1h nmr(400mhz,cdcl3)δ8.63(dd,j=1.9,1.1hz,1h),7.83-7.75(m,2h),7.54(d,j=9.0hz,1h),6.92(d,j=9.0hz,1h),3.77(s,3h)。
[0362]
步骤b:在室温下向5-(2,3-二氯-6-甲氧基苯基)吡啶-2-甲腈(1.00克,3.58毫摩尔)在hcl(3.00毫升,6m)和meoh(30毫升)中的搅拌混合物中加入pto2(0.40克,1.76毫摩尔)。反
应混合物在真空下脱气并用氢气吹扫三遍。混合物在氢气气氛(1.5atm)下在室温下搅拌16小时。将反应过滤并在减压下浓缩以提供作为浅黄色油的1-[5-(2,3-二氯-6-甲氧基苯基)吡啶-2-基]甲胺(1.50克,粗),其不经进一步提纯直接用于下一步骤:对c
13h12
cl2n2o计算的lcms(esi)[m+h]
+
:283,285(3:2),实测283,285(3:2)。
[0363]
步骤c:在室温下向1-[5-(2,3-二氯-6-甲氧基苯基)吡啶-2-基]甲胺(1.50克,5.30毫摩尔)在dcm(15毫升)和tea(1.84毫升,18.2毫摩尔)中的溶液中加入boc2o(1.16克,5.30毫摩尔)。反应搅拌2小时,用水(50毫升)稀释并用ea(3
×
50毫升)萃取。合并的有机层用盐水(2
×
50毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(4/1)洗脱的硅胶柱色谱法提纯以提供作为无色油的n-[[5-(2,3-二氯-6-甲氧基苯基)吡啶-2-基]甲基]氨基甲酸叔丁酯(0.80克,两个步骤总计为58%):对c
18h20
cl2n2o3计算的lcms(esi)[m+h]
+
:383,385(3:2),实测383,385(3:2);1h nmr(400mhz,cdcl3)δ8.45(s,1h),7.61(dd,j=8.0,2.2hz,1h),7.48(d,j=8.9hz,1h),7.38(d,j=8.0hz,1h),6.89(d,j=9.0hz,1h),5.65-5.60(brs,1h),4.55(d,j=5.2hz,2h),3.75(s,3h),1.51(s,9h)。
[0364]
步骤d:在室温下向n-[[4-(2,3-二氯-6-甲氧基苯基)吡啶-2-基]甲基]氨基甲酸叔丁酯(0.60克,1.57毫摩尔)在mecn(15毫升)中的溶液中加入苄基溴(1.34克,7.85毫摩尔)。反应在80℃下搅拌12小时。随后,反应混合物在减压下浓缩以提供作为浅棕色油的1-苄基-2-[[(叔丁氧基羰基)氨基]甲基]-4-(2,3-二氯-6-甲氧基苯基)溴化吡啶-1-鎓(1.00克,粗),其不经提纯直接用于下一步骤:对c
25h27
brcl2n2o3计算的lcms(esi)[m]
+
:473,475(3:2),实测473,475(3:2)。
[0365]
步骤e:在室温下向1-苄基-2-[[(叔丁氧基羰基)氨基]甲基]-5-(2,3-二氯-6-甲氧基苯基)溴化吡啶-1-鎓(1.00克,1.81毫摩尔)在meoh中(10毫升)的溶液中逐份加入nabh4(200毫克,5.29毫摩尔)。反应在室温下搅拌2小时。所得混合物用饱和nh4cl水溶液(5毫升)猝灭,随后用ea(3
×
50毫升)萃取。合并的有机层用盐水(2
×
50毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(5/1)洗脱的硅胶柱色谱法提纯以提供作为浅黄色油的n-[[1-苄基-5-(2,3-二氯-6-甲氧基苯基)-3,6-二氢-2h-吡啶-2-基]甲基]氨基甲酸叔丁酯(300毫克,经两个步骤为40%):对c
25h30
cl2n2o3计算的lcms(esi)[m+h]
+
:477,479(3:2),实测477,479(3:2);1h nmr(400mhz,cdcl3)δ7.45-7.38(m,2h),7.37-7.26(m,4h),6.71(d,j=8.9hz,1h),5.70(s,1h),5.25-5.20(brs,1h),3.97-3.80(m,2h),3.76(s,3h),3.46-2.94(m,5h),2.52(d,j=18.1hz,1h),2.05(d,j=14.4hz,1h),1.49(s,9h)。
[0366]
步骤f:在室温下向n-[[1-苄基-5-(2,3-二氯-6-甲氧基苯基)-3,6-二氢-2h-吡啶-2-基]甲基]氨基甲酸叔丁酯(300毫克,0.63毫摩尔)在acoh(20毫升)中的溶液中加入pto2(100毫克,0.44毫摩尔)。反应混合物在真空下脱气并用氢气吹扫三遍。混合物在氢气气氛(1.5atm)下在室温下搅拌16小时。随后将反应过滤并在减压下浓缩。残余物通过用pe/ea(1/1)洗脱的硅胶柱色谱法提纯以提供作为浅黄色固体的n-[[5-(2,3-二氯-6-甲氧基苯
基)哌啶-2-基]甲基]氨基甲酸叔丁酯(180毫克,74%):对c
18h26
cl2n2o3计算的lcms(esi)[m+h]
+
:389,391(3:2),实测389,391(3:2);1h nmr(400mhz,cdcl3)δ7.31-7.27(m,1h),6.74(dd,j=8.9,3.0hz,1h),3.88-3.78(m,3h),3.59-3.42(m,2h),3.37-3.30(m,1h),3.16-2.88(m,2h),2.88-2.60(m,1h),2.29-2.06(m,2h),1.87-1.50(m,2h),1.47(s,9h)。
[0367]
步骤g:在0℃下向n-[[5-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲基]氨基甲酸叔丁酯(180毫克,0.46毫摩尔)和tea(94.0毫克,0.93毫摩尔)在dcm(3毫升)中的溶液中加入氯乙酰氯(57.0毫克,0.51毫摩尔)。反应在室温下搅拌1小时,用水(30毫升)稀释并用ea(3
×
30毫升)萃取。合并的有机层用盐水(2
×
30毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色油的n-[[1-(2-氯乙酰基)-5-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲基]氨基甲酸叔丁酯(250毫克,粗),其不经提纯直接用于下一步骤:对c
20h27
cl3n2o4计算的lcms(esi)[m+h]
+
:465,467(1:1),实测465,467(1:1)。
[0368]
步骤h:在0℃下在氮气气氛下向n-[[1-(2-氯乙酰基)-5-(2,3-二氯-6-甲氧基苯基)哌啶-2-基]甲基]氨基甲酸叔丁酯(100毫克,0.22毫摩尔)在dmf(2毫升)中的溶液中加入nah(17.0毫克,0.43毫摩尔,60%在油中)。反应在室温下搅拌2小时。反应用饱和nh4cl水溶液(5毫升)猝灭,用水(20毫升)稀释并用ea(2
×
20毫升)萃取。合并的有机相用盐水(3
×
10毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(3/1)洗脱的硅胶柱色谱法提纯以提供作为无色油的7-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[1,2-a]吡嗪-2-甲酸叔丁酯(160毫克,两个步骤总计为80%):对c
20h26
cl2n2o4计算的lcms(esi)[m+h]
+
:429,431(3:2),实测429,431(3:2)。
[0369]
步骤i:在0℃下向7-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[1,2-a]吡嗪-2-甲酸叔丁酯(160毫克,0.37毫摩尔)在dcm(2毫升)中的溶液中逐滴加入bbr3(0.32毫升,1.28毫摩尔)。反应混合物在室温下搅拌3小时。反应混合物用meoh(3毫升)猝灭。所得混合物在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xselect csh obd column,30
×
150mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在9分钟内由5%b至30%b;检测器:uv 220nm;保留时间1:9.07分钟,保留时间2:9.42分钟。获得在9.07分钟处的较快洗脱的对映异构体,呈现为作为灰白色泡沫的化合物105((7s,9ar)-rel
‑‑
7-(2,3-二氯-6-羟苯基)-八氢吡啶并[1,2-a]吡嗪-4-酮)(30.0毫克,26%):对c
14h16
cl2n2o2计算的lcms(esi)[m+h]
+
:315,317(3:2),实测315,317(3:2)。获得在9.42分钟处的较慢洗脱的对映异构体,呈现为作为灰白色泡沫的化合物106((7s,9as)-rel
‑‑
7-(2,3-二氯-6-羟苯基)-八氢吡啶并[1,2-a]吡嗪-4-酮)(30.0毫克,26%):对c
14h16
cl2n2o2计算的lcms(esi)[m+h]
+
:315,317(3:2),实测315,317(3:2)。
[0370]
实施例42.化合物26((7s,9ar)-rel
‑‑
7-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮)
在室温下向羟基乙酸(15.0毫克,0.19毫摩尔)、edci(46.0毫克,0.24毫摩尔)和hobt(32.0毫克,0.24毫摩尔)在dmf(2毫升)中的搅拌溶液中加入(7s,9ar)-rel-7-(2,3-二氯-6-羟苯基)-八氢吡啶并[1,2-a]吡嗪-4-酮(30.0毫克,0.10毫摩尔)和tea(39.0毫克,0.38毫摩尔)。反应在室温下搅拌1小时,用水(20毫升)稀释并用ea(3
×
20毫升)萃取。合并的有机相用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xselect csh obd column,30
×
150mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在7分钟内由20%b至43%b;检测器:uv 220nm;保留时间:6.68分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物26((7s,9ar)-rel-7-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮)(10.2毫克,29%):对c
16h18
cl2n2o4计算的lcms(esi)[m+h]
+
:373,375(3:2),实测373,375(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.7hz,1h),6.76(d,j=8.8hz,1h),4.50-4.20(m,4h),4.20-4.07(m,1h),4.07-3.82(m,3h),3.74-3.59(m,1h),3.31-3.08(m,1h),2.36-2.22(m,1h),1.98-1.81(m,3h)。
[0371]
实施例43.化合物13((7s,9as)-rel-7-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮)在室温下向羟基乙酸(15.0毫克,0.19毫摩尔)、edci(46.0毫克,0.24毫摩尔)和hobt(32.0毫克,0.24毫摩尔)在dmf(2毫升)中的搅拌溶液中加入(7s,9as)-rel-7-(2,3-二氯-6-羟苯基)-八氢吡啶并[1,2-a]吡嗪-4-酮(30.0毫克,0.10毫摩尔)和tea(39.0毫克,0.38毫摩尔)。反应在室温下搅拌1小时,用水(20毫升)稀释并用ea(3
×
10毫升)萃取。合并的有机相用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xselect csh obd column,30
×
150mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在7分钟内由20%b至40%b;检测器:uv 220nm;保留时间:6.30分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物13((7s,9as)-rel-7-(2,3-二氯-6-羟苯基)-2-(2-羟乙酰基)-六氢-1h-吡啶并[1,2-a]吡嗪-4-酮)(10.2毫克,29%):对c
16h18
cl2n2o4计算的lcms(esi)[m+h]
+
:373,375(3:2),实测373,375(3:2);1h nmr(400mhz,cd3od)δ7.23(d,j=8.8hz,1h),6.74(d,j=8.8hz,1h),4.51-4.40(m,1h),4.38-4.06(m,4h),4.06-3.88(m,1h),3.74-3.39(m,4h),2.66-2.52(m,1h),2.01-1.74(m,2h),1.64-1.47(m,1h)。
[0372]
实施例44.以类似于本文中公开的实施例的方式和/或类似于本领域中已知的方法制备化合物109-122。
[0373]
实施例45.化合物123((7r,8as)-7-(2,3-二氯-6-羟苯基)-2-(3-羟基环丁基)-六氢吡咯并[1,2-a]吡嗪-4-酮)步骤a:在室温下向(7r,8as)-7-(2,3-二氯-6-羟苯基)-六氢-1h-吡咯并[1,2-a]吡嗪-4-酮hbr盐(中间体8,实施例7)(40.0毫克,0.13毫摩尔)、naoac(43.0毫克,0.53毫摩尔)和乙酸3-氧代环丁酯(51毫克,0.40毫摩尔)在dcm(4毫升)中的搅拌混合物中加入nabh(oac)3(0.113克,0.53毫摩尔)。反应为4小时,用饱和nh4cl水溶液(30毫升)猝灭并用ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
30毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为灰白色固体的乙酸3-[(7ar,8as)-7-(2,3-二氯-6-羟苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-基]环丁酯(0.100克,粗),其不经提纯直接用于下一步骤:对c
19h22
cl2n2o4计算的lcms(esi)[m+h]
+
:413,415(3:2),实测413,415(3:2)。
[0374]
步骤b:在室温下将乙酸3-[(7r,8as)-7-(2,3-二氯-6-羟苯基)-4-氧代-六氢吡咯并[1,
2-a]吡嗪-2-基]环丁酯(80.0毫克,0.19毫摩尔)和k2co3(80.0毫克,0.58毫摩尔)在meoh中(2毫升)的混合物搅拌2小时。反应在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xbridge shield rp18 obd column,30
×
150mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在7分钟内由5%b至35%b;检测器:uv 220nm;保留时间:6.77分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物123((7r,8as)-7-(2,3-二氯-6-羟苯基)-2-(3-羟基环丁基)-六氢吡咯并[1,2-a]吡嗪-4-酮)(23.4毫克,33%)。对c
17h20
cl2n2o3计算的lcms(esi)[m+h]
+
:371,373(3:2),实测371,373(3:2);1h nmr(400mhz,cd3od)δ7.29(d,j=8.8hz,1h),6.78(d,j=8.8hz,1h),4.54-4.34(m,1h),4.27-4.15(m,1h),4.16-3.98(m,3h),3.93(d,j=11.5hz,1h),3.77-3.54(m,2h),3.45-3.36(m,1h),3.13-2.96(m,1h),2.87-2.54(m,2h),2.49-2.43(m,1h),2.38-2.06(m,3h)。
[0375]
实施例46.以类似于对化合物123所描述的方式制备化合物124-147。
[0376]
实施例47.化合物148((7r,8as)-7-(2,3-二氯-6-羟苯基)-2-(2-羟基-2-甲基丙
基)-六氢吡咯并[1,2-a]吡嗪-4-酮)在室温下在氮气下向(7r,8as)-7-(2,3-二氯-6-羟苯基)-六氢-1h-吡咯并[1,2-a]吡嗪-4-酮(中间体8游离碱游离碱,实施例7)(30.0毫克,0.10毫摩尔)在etoh(1毫升)中的搅拌溶液中加入2,2-二甲基环氧乙烷(11.0毫克,0.15毫摩尔)。所得溶液在80℃下搅拌36小时,随后在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x bridge shield rp18 obd column,30
×
150mm,5μm;流动相a:水(加10mm nh4hco3),流动相b:acn;流速:60ml/min;梯度:在7分钟内由25%b至45%b;检测器:uv 220nm;保留时间:7.12分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的(7r,8as)-7-(2,3-二氯-6-羟苯基)-2-(2-羟基-2-甲基丙基)-六氢吡咯并[1,2-a]吡嗪-4-酮(20毫克,53%)。对c
17h22
cl2n2o3计算的lcms(esi)[m+h]
+
:373,375(3:2),实测373,375(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.75(d,j=8.9hz,1h),4.38-4.24(m,1h),4.15(t,j=11.5hz,1h),4.06-3.92(m,1h),3.64(d,j=17.0hz,1h),3.52(t,j=10.7hz,1h),3.40(dd,j=11.8,3.8hz,1h),3.05(d,j=17.1hz,1h),2.57-2.40(m,2h),2.40-2.22(m,2h),2.14-2.02(m,1h),1.24(s,6h)。
[0377]
实施例48.以类似于对化合物148所述的方式制备化合物149-159。
3-基)氨基]甲基]吡咯烷-1-甲酸叔丁酯(0.450克,73%):对c
21h29
cl2n3o4计算的lcms(esi)[m+h]
+
:458,460(3:2),实测458,460(3:2);h nmr(400mhz,cd3od)δ7.42(d,j=8.9hz,1h),7.00(d,j=9.0hz,1h),4.15-3.97(m,2h),3.89(s,3h),3.85-3.53(m,3h),3.26-3.14(m,1h),3.14-3.03(m,1h),2.81-2.72(m,1h),2.72-2.56(m,1h),2.54-2.40(m,1h),2.39-2.11(m,2h),1.83-1.64(m,1h),1.51(s,9h)。
[0379]
步骤b:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[(5-氧代吡咯烷-3-基)氨基]甲基]吡咯烷-1-甲酸叔丁酯(0.150克,0.33毫摩尔)和溴乙酸乙酯(0.110克,0.65毫摩尔)在acn(5毫升)中的搅拌溶液中加入k2co3(90.5毫克,0.65毫摩尔)。反应在80℃下搅拌2小时。冷却的溶液用ea(20毫升)和水(30毫升)稀释并用ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用29%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为无色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[(2-乙氧基-2-氧代乙基)(5-氧代吡咯烷-3-基)氨基]甲基]吡咯烷-1-甲酸叔丁酯(0.120克,67%):对c
25h35
cl2n3o6计算的lcms(esi)[m+h]
+
:544,546(3:2),实测544,546(3:2);1h nmr(400mhz,cd3od)δ7.45(d,j=9.0hz,1h),7.02(d,j=9.0hz,1h),4.66(d,j=27.0hz,1h),4.46(t,j=8.2hz,1h),4.40-4.29(m,2h),4.29-4.04(m,3h),3.90(s,3h),3.85-3.57(m,3h),3.57-3.41(m,2h),3.03-2.57(m,2h),2.51-2.28(m,2h),1.83-1.61(m,1h),1.54(s,9h),1.36(t,j=6.9hz,3h)。
[0380]
步骤c:将(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[(2-乙氧基-2-氧代乙基)(5-氧代吡咯烷-3-基)氨基]甲基]吡咯烷-1-甲酸叔丁酯(0.120克,0.220毫摩尔)和tfa(1.50毫升,1.346毫摩尔)在dcm(3.00毫升)中的溶液在室温下搅拌1小时。反应在减压下浓缩。残余物溶解在etoh(3.00毫升)中并加入tea(1.00毫升)。溶液在80℃下搅拌2小时。冷却的溶液用ea(20毫升)和水(30毫升)稀释并用更多ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为黄色油的(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-2-(5-氧代吡咯烷-3-基)六氢吡咯并[1,2-a]吡嗪-4(1h)-酮(0.100克,粗),其不经提纯直接用于下一步骤:对c
18h21
cl2n3o3计算的lcms(esi)[m+h]
+
:398,400(3:2),实测398,400(3:2)。
[0381]
步骤d:在室温下向(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-2-(5-氧代吡咯烷-3-基)六氢吡咯并[1,2-a]吡嗪-4(1h)-酮(0.100克,0.25毫摩尔)在dcm(2.00毫升)中的搅拌溶液中加入bbr3(0.330克,1.32毫摩尔)。反应搅拌1小时。用meoh(5毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xbridge shield rp18 obd column,30
×
150mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在8分钟内由10%至40%;检测器:uv 254/220nm;保留时间:6.28分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的4-[(7r,8as)-7-(2,3-二氯-6-羟苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-基]吡咯烷-2-酮(31.0毫克,两个步骤总计为36.47%):对c
17h19
cl2n3o3计算的lcms(esi)[m+h]
+
:384,386(3:2),实测384,386(3:2);1h nmr(400mhz,dmso-d6)δ7.36(d,j=8.8hz,1h),6.85(d,j=8.8hz,1h),4.24-4.10(m,1h),4.07-3.85(m,4h),3.81-3.69
(m,1h),3.63-3.57(m,2h),3.51-3.38(m,2h),2.96(t,j=11.3hz,1h),2.65-2.54(m,2h),2.26-2.08(m,2h)。
[0382]
步骤e:4-[(7r,8as)-7-(2,3-二氯-6-羟苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-基]吡咯烷-2-酮(30.0毫克,0.08毫摩尔)通过制备手性hplc采用以下条件来分离:柱:chiralpak ig,2
×
25cm,5μm;流动相a:hex(加0.2%ipa)-hplc,流动相b:etoh-hplc;流速:20ml/min;梯度:在22分钟内由50%至50%;检测器:uv 254/220nm;保留时间1:10.99分钟;保留时间2:17.77分钟。获得在10.99分钟处的作为灰白色固体的化合物160(4-[(7r,8as)-7-(2,3-二氯-6-羟苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-基]吡咯烷-2-酮异构体1)的较快洗脱的异构体(6毫克,20%):对c
17h19
cl2n3o3计算的lcms(esi)[m+h]
+
:384,386(3:2),实测384,386(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.76(d,j=8.8hz,1h),4.40-4.25(m,1h),4.16(dd,j=11.6,8.9hz,1h),3.99-3.87(m,1h),3.60(dd,j=9.9,7.4hz,1h),3.55-3.41(m,4h),3.36-3.34(m,1h),2.99(d,j=16.5hz,1h),2.54(dd,j=16.8,8.1hz,1h),2.45-2.30(m,2h),2.27(dd,j=11.5,10.1hz,1h),2.18-2.09(m,1h);获得在17.77分钟处的作为灰白色固体的化合物161(4-[(7r,8as)-7-(2,3-二氯-6-羟苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-基]吡咯烷-2-酮异构体2)的较慢洗脱的异构体(4.7毫克,15.67%):对c
17h19
cl2n3o3计算的lcms(esi)[m+h]
+
:384,386(3:2),实测384,386(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.76(d,j=8.7hz,1h),4.37-4.24(m,1h),4.16(dd,j=11.4,8.9hz,1h),3.96-3.84(m,1h),3.61(dd,j=9.7,7.3hz,1h),3.57-3.41(m,3h),3.38-3.35(m,1h),3.28-3.21(m,1h),3.00(d,j=16.6hz,1h),2.54(dd,j=16.8,8.1hz,1h),2.44-2.22(m,3h),2.17-2.09(m,1h)。
[0383]
实施例50.以类似于对化合物160和161所述的方式制备化合物162-167。
[0384]
实施例51.化合物168((7r,8as)-7-(2,3-二氯-6-羟苯基)-2-[5-(羟甲基)吡啶-2-基]-六氢吡咯并[1,2-a]吡嗪-4-酮)
步骤a:将(7r,8as)-7-[2,3-二氯-6-(丙-2-烯-1-基氧基)苯基]-六氢-1h-吡咯并[1,2-a]吡嗪-4-酮(中间体13,实施例11)(0.150克,0.44毫摩尔)、6-氯吡啶-3-甲酸乙酯(0.250克,1.32毫摩尔)和cs2co3(0.720克,2.20毫摩尔)在dmso(1毫升)中的混合物在100℃下搅拌12小时。所得混合物用水(20毫升)和dcm(20毫升)稀释,并用更多dcm(3
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用ea/pe(1/1)洗脱的硅胶柱色谱法提纯以提供作为浅黄色油的6-[(7r,8as)-7-[2,3-二氯-6-(丙-2-烯-1-基氧基)苯基]-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-基]吡啶-3-甲酸乙酯(0.160克,74%):对c
24h25
cl2n3o4计算的lcms(esi)[m+h]
+
:490,492(3:2),实测490,492(3:2)。
[0385]
步骤b:将6-[(7r,8as)-7-[2,3-二氯-6-(丙-2-烯-1-基氧基)苯基]-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-基]吡啶-3-甲酸乙酯(0.170克,0.35毫摩尔)和lioh
·
h2o(15毫克,0.35毫摩尔)在thf(1毫升)、ch3oh(0.30毫升)和h2o(0.30毫升)中的溶液在室温下搅拌1小时。混合物用饱和柠檬酸水溶液(2毫升)酸化至ph 3并用ea(3
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色油的6-[(7r,8as)-7-[2,3-二氯-6-(丙-2-烯-1-基氧基)苯基]-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-基]吡啶-3-甲酸(0.160克,粗),其不经提纯直接用于下一步骤:对c
22h21
cl2n3o4计算的lcms(esi)[m+h]
+
:462,464(3:2),实测462,464(3:2)。
[0386]
步骤c:在0℃下向6-[(7r,8as)-7-[2,3-二氯-6-(丙-2-烯-1-基氧基)苯基]-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-基]吡啶-3-甲酸(0.160克,0.35毫摩尔)在dme(3毫升)中的搅拌溶液中加入氯甲酸2-甲基丙酯(95.0毫克,0.70毫摩尔)和4-甲基吗啉(70.0毫克,0.70毫摩尔)。反应在氮气气氛下在0℃下搅拌1小时。随后向上述混合物中加入nabh4(26毫克,0.70毫摩尔),并且混合物在0℃下搅拌附加的1小时。反应用饱和nh4cl水溶液(20毫升)猝灭并用ea(2
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用45%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(7r,8as)-7-[2,3-二氯-6-(丙-2-烯-1-基氧基)苯基]-2-[5-(羟甲基)吡啶-2-基]-六氢吡咯并[1,2-a]吡嗪-4-酮(0.130克,两个步骤总计为84%):对c
22h23
cl2n3o3计算的lcms(esi)[m+h]
+
:448,450(3:2),实测448,450(3:2)。
[0387]
步骤d:将(7r,8as)-7-[2,3-二氯-6-(丙-2-烯-1-基氧基)苯基]-2-[5-(羟甲基)吡啶-2-基]-六氢吡咯并[1,2-a]吡嗪-4-酮(0.130克,0.30毫摩尔)、pd(pph3)4(17毫克,0.01毫摩尔)和nabh4(22毫克,0.60毫摩尔)在thf(2毫升)中的混合物在室温下搅拌30分钟。所得混合物用饱和nh4cl水溶液(2毫升)猝灭并在减压下浓缩。残余物通过用30%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯。获得的材料通过制备hplc采用以下条件进一步提纯:柱:sunfire prep c18 obd column,5μm;19
×
150mm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在6分钟内由5%b至15%b;检测器:uv 210/254nm;保留时间:5.85分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物168
((7r,8as)-7-(2,3-二氯-6-羟苯基)-2-[5-(羟甲基)吡啶-2-基]-六氢吡咯并[1,2-a]吡嗪-4-酮)(32.0毫克,21%):对c
19h19
cl2n3o3计算的lcms(esi)[m+h]
+
:408,410(3:2),实测408,410(3:2);1h nmr(400mhz,dmso-d6)δ10.50-10.60(brs,1h),8.01(s,1h),7.82-7.77(m,1h),7.36(dd,j=8.9,5.8hz,1h),7.16(d,j=9.2hz,1h),6.86(d,j=8.8hz,1h),5.30-5.25(brs,1h),4.66(dd,j=12.7,3.6hz,1h),4.47-4.35(m,3h),4.23-4.06(m,1h),4.06-3.89(m,2h),3.85(d,j=17.1hz,1h),3.51(t,j=10.2hz,1h),3.01(t,j=11.6hz,1h),2.35-2.31(m,1h),2.21-2.10(m,1h)。
[0388]
实施例52.化合物169((7r,8as)-7-(2,3-二氯-6-羟苯基)-2-[2-(羟甲基)嘧啶-4-基]-六氢吡咯并[1,2-a]吡嗪-4-酮)步骤a:在室温下向(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-六氢-1h-吡咯并[1,2-a]吡嗪-4-酮(实施例7,步骤e)(0.180克,0.57毫摩尔)和4-氯嘧啶-2-甲腈(0.120克,0.86毫摩尔)在dmf(3毫升)中的溶液中加入cs2co3(0.370克,1.14毫摩尔)。反应在80℃下搅拌2小时。在冷却至室温后,将混合物倾入水(25毫升)中并用ea(3
×
15毫升)萃取。合并的有机层用盐水(5
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色固体的4-[(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-基]嘧啶-2-甲腈(0.230克,粗),其不经提纯用于下一步骤:对c
19h17
cl2n5o2计算的lcms(esi)[m+h]
+
:418,420(3:2),实测418,420(3:2);1h nmr(400mhz,cd3od)δ8.31(d,j=6.4hz,1h),7.46(d,j=9.0hz,1h),7.05-7.01(m,2h),4.68-4.51(m,1h),4.50-4.37(m,1h),4.11(dd,j=11.6,8.8hz,1h),4.07-3.93(m,2h),3.88(s,3h),3.64(dd,j=11.6,9.9hz,1h),3.20-3.03(m,2h),2.42-2.27(m,2h)。
[0389]
步骤b:在室温下向4-[(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-基]嘧啶-2-甲腈(0.180克,0.43毫摩尔)在meoh(4毫升)中的溶液中加入浓hcl(1毫升)。反应在70℃下搅拌4小时。在冷却至室温后,混合物在减压下浓缩以除去meoh。残余物用饱和nahco3水溶液碱化至ph 7并用ea(3
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色固体的4-[(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-基]嘧
啶-2-甲酸甲酯(0.180克,93%):对c
20h20
cl2n4o4计算的lcms(esi)[m+h]
+
:451,453(3:2),实测451,453(3:2);1h nmr(400mhz,cd3cl3)δ8.46(d,j=6.1hz,1h),7.38(d,j=8.9hz,1h),6.80(d,j=9.0hz,1h),6.60(d,j=6.1hz,1h),4.42-4.25(m,2h),4.19-4.09(m,2h),4.07-4.00(m,3h),4.00-3.90(m,2h),3.85(s,3h),3.69(dd,j=11.8,9.3hz,1h),3.03-2.92(m,1h),2.44-2.21(m,2h)。
[0390]
步骤c:在室温下向4-[(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-基]嘧啶-2-甲酸甲酯(0.180克,0.40毫摩尔)在meoh(10毫升)中的溶液中加入nabh4(91.0毫克,2.39毫摩尔)。反应搅拌1小时,用饱和nh4cl水溶液(20毫升)猝灭并用dcm(3
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色固体的(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-2-[2-(羟甲基)嘧啶-4-基]-六氢吡咯并[1,2-a]吡嗪-4-酮(0.130克,77%):对c
19h20
cl2n4o3计算的lcms(esi)[m+h]
+
:423,425(3:2),实测423,425(3:2);1h nmr(400mhz,cdcl3)δ8.33(d,j=9.0hz,1h),7.39(d,j=8.7hz,1h),6.81(d,j=8.7hz,1h),6.42(d,j=9.0hz,1h),5.12-4.97(m,1h),4.67(s,2h),4.47-4.30(m,2h),4.17(t,j=10.5hz,1h),4.06-3.90(m,2h),3.86(s,3h),3.74-3.65(m,1h),2.97(t,j=11.2hz,1h),2.42-2.21(m,2h)。
[0391]
步骤d:在室温下向(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-2-[2-(羟甲基)嘧啶-4-基]-六氢吡咯并[1,2-a]吡嗪-4-酮(0.130克,0.31毫摩尔)在dcm(4毫升)中的溶液中加入bbr3(0.50毫升,5.29毫摩尔)。反应在室温下搅拌2小时,随后在0℃下用meoh(5毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:sunfire prep c18 column,30
×
150,5μm;流动相a:水(含有10mmol/l nh4hco3),流动相b:acn;流速:20ml/min;梯度:在9分钟内由20%b至70%b;检测器:uv 210nm;保留时间:8.6分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物169((7r,8as)-7-(2,3-二氯-6-羟苯基)-2-[2-(羟甲基)嘧啶-4-基]-六氢吡咯并[1,2-a]吡嗪-4-酮)(36.6毫克,29%):对c
18h18
cl2n4o3计算的lcms(esi)[m+h]
+
:409,411(3:2),实测409,411(3:2);1h nmr(400mhz,dmso-d6)δ10.55-10.45(brs,1h),8.24(d,j=6.1hz,1h),7.36(d,j=8.8hz,1h),6.86(d,j=8.8hz,1h),6.75(d,j=6.2hz,1h),4.95-4.90(brs,2h),4.54(s,1h),4.40(s,2h),4.25-4.11(m,1h),4.06-4.01(m,1h),3.92-3.85(m,1h),3.82(d,j=17.5hz,1h),3.48(t,j=10.2hz,1h),2.96-2.90(m,1h),2.35-2.30(m,1h),2.22-2.11(m,1h)。
[0392]
实施例53.以类似对化合物169所述的方式制备化合物170-174。
[0393]
实施例54.化合物175((7r,8as)-7-(2,3-二氯-6-羟苯基)-2-(1h-1,2,4-三唑-5-基)六氢吡咯并[1,2-a]吡嗪-4(1h)-酮)步骤a:在室温下向3-溴-2h-1,2,4-三唑(0.500克,3.38毫摩尔)和dhp(0.310克,3.72毫摩尔)在thf(5毫升)中的搅拌溶液中加入tsoh(58.0毫克,0.34毫摩尔)。反应在50℃下搅拌2小时。所得混合物用ea(30毫升)和饱和na2co3水溶液(30毫升)稀释并用ea(3
×
30毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓
缩。残余物通过用50%在水中的acn(加10mm nh4hco3)洗脱的反相色谱法提纯以提供作为浅黄色油的5-溴-1-(四氢-2h-吡喃-2-基)-1,2,4-三唑(0.400克,51%):对c7h
10
brn3o计算的lcms(esi)[m+h]
+
:232实测:232;1h nmr(400mhz,cdcl3)δ8.18(s,1h),5.45(dd,j=8.7,3.0hz,1h),4.13-4.03(m,1h),3.77-3.65(m,1h),2.24-2.13(m,1h),2.13-1.97(m,2h),1.82-1.62(m,3h)。
[0394]
步骤b:在室温下在氮气气氛下向(7r,8as)-7-(2,3-二氯-6-羟苯基)-六氢-1h-吡咯并[1,2-a]吡嗪-4-酮(50.0毫克,0.17毫摩尔)和5-溴-1-(四氢-2h-吡喃-2-基)-1,2,4-三唑(58.0毫克,0.25毫摩尔)在二氧杂环已烷(1毫升)中的搅拌溶液中加入pd2(dba)3(15.0毫克,0.02毫摩尔)、4,5-双二苯基膦-9,9-二甲基氧杂蒽(xantphos)(10毫克,0.02毫摩尔)和cs2co3(0.160克,0.49毫摩尔)。所得混合物在100℃下搅拌16小时。在冷却至室温后,混合物用水(10毫升)稀释并用ea(3
×
10毫升)萃取。合并的有机层用盐水(3
×
10毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用45%在水中的acn(加0.05%tfa)洗脱的反相快速色谱法提纯以提供作为棕色油的(7r,8as)-7-(2,3-二氯-6-羟苯基)-2-[2-(四氢-2h-吡喃-2-基)-1,2,4-三唑-3-基]-六氢吡咯并[1,2-a]吡嗪-4-酮(60毫克,68%):对c
20h23
cl2n5o3计算的lcms(esi)[m+h]
+
:452,454(3:2),实测452,454(3:2);1h nmr(400mhz,cdcl3)δ8.21(s,1h),7.19(d,j=8.8hz,1h),6.86(d,j=8.8hz,1h),5.31(dd,j=9.0,2.9hz,1h),4.53(d,j=18.1hz,1h),4.48-4.33(m,2h),4.23-4.09(m,2h),3.94(d,j=18.3hz,2h),3.73(t,j=10.9hz,1h),3.52-3.41(m,1h),3.07(dd,j=12.9,10.3hz,1h),2.35-2.31(m,1h),2.25-2.16(m,1h),2.15-2.00(m,3h),1.77-1.62(m,3h)。
[0395]
步骤c:在室温下向(7r,8as)-7-(2,3-二氯-6-羟苯基)-2-[2-(四氢-2h-吡喃-2-基)-1,2,4-三唑-3-基]-六氢吡咯并[1,2-a]吡嗪-4-酮(30.0毫克,0.06毫摩尔)在二氧杂环已烷(0.5毫升)中的搅拌溶液中加入hcl(6n,0.25毫升)。所得混合物搅拌0.5小时并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xbridge shield rp18 obd column,30
×
150mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在7分钟内由15%至40%;检测器:uv 254/220nm;保留时间:7.32分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物175((7r,8as)-7-(2,3-二氯-6-羟苯基)-2-(2h-1,2,4-三唑-3-基)-六氢吡咯并[1,2-a]吡嗪-4-酮)(25.5毫克,37.87%):对c
15h15
cl2n5o2计算的lcms(esi)[m+h]
+
:368,370(3:2),实测368,370(3:2);1h nmr(400mhz,cd3od)δ8.15(s,1h),7.28(d,j=8.8hz,1h),6.78(d,j=8.8hz,1h),4.41-4.30(m,3h),4.26-4.15(m,1h),4.13-4.00(m,1h),3.91(d,j=17.3hz,1h),3.63(dd,j=11.5,9.6hz,1h),3.21-3.10(m,1h),2.50-2.47(m,1h),2.30-2.17(m,1h)。
[0396]
实施例55.化合物176((7r,8as)-7-(2,3-二氯-6-羟苯基)-2-(1h-咪唑-2-基)-六氢吡咯并[1,2-a]吡嗪-4-酮)
步骤a:在室温下向(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-六氢-1h-吡咯并[1,2-a]吡嗪-4-酮(实施例7,步骤e)(0.300克,0.95毫摩尔)在mecn(4毫升)中的搅拌溶液中加入苯甲酰基异硫氰酸酯(0.190克,1.14毫摩尔)。反应搅拌1小时,用水(30毫升)稀释并用ea(3
×
30毫升)萃取。合并的有机层用盐水(3
×
30毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色固体的n-[(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-硫代甲基]苯甲酰胺(0.500克,粗),其不经提纯用于下一步骤:对c
22h21
cl2n3o3s计算的lcms(esi)[m+h]
+
:478,480(3:2),实测478,480(3:2);1h nmr(300mhz,cdcl3)δ8.72-7.99(m,1h),7.93-7.78(m,2h),7.71-7.59(m,1h),7.59-7.45(m,2h),7.37(d,j=8.8hz,1h),6.79(d,j=9.0hz,1h),5.44-4.98(m,1h),4.54-4.21(m,3h),4.14(t,j=10.4hz,2h),3.85(s,3h),3.73-3.58(m,1h),3.32(dd,j=13.1,10.6hz,1h),2.41-2.08(m,1h),1.83-1.62(m,1h)。
[0397]
步骤b:将n-[(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-硫代甲基]苯甲酰胺(0.500克,1.05毫摩尔)在肼(5毫升)中的溶液在室温下搅拌1小时。沉淀的固体通过过滤收集并用meoh(3
×
5毫升)洗涤。固体在真空下干燥以提供作为灰色固体的(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-硫代甲酰胺(0.260克,经两个步骤为73%):对c
15h17
cl2n3o2s计算的lcms(esi)[m+h]
+
:374,376(3:2),实测374,376(3:2);1h nmr(300mhz,dmso-d6)δ7.63(s,2h),7.58-7.52(m,1h),7.09(d,j=9.1hz,1h),5.17-4.96(m,1h),4.70-4.52(m,1h),4.27-4.11(m,1h),4.02-3.86(m,3h),3.83(s,3h),3.52-3.41(m,1h),2.98(t,j=11.7hz,1h),2.22-2.03(m,2h)。
[0398]
步骤c:在室温下向(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢吡咯并[1,2-a]吡嗪-2-硫代甲酰胺(0.240克,0.64毫摩尔)在thf(4毫升)中的搅拌溶液中加入mei(0.270克,1.92毫摩尔)。反应在室温下搅拌整夜并在减压下浓缩。残余物通过用40%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-2-甲基甲硫基甲酰亚胺基-六氢吡咯并[1,2-a]吡嗪-4-酮(0.150克,51%):对c
16h19
cl2n3o2s计算的lcms(esi)[m+h]
+
:388,390(3:2),实测388,390(3:2);1h nmr(300mhz,cd3od)δ7.45(d,j=9.0hz,1h),7.02(d,j=9.1hz,1h),4.64-4.36(m,3h),4.25-3.99(m,3h),3.87(s,3h),3.73-3.61(m,1h),3.44-3.34(m,1h),2.75(s,3h),2.37-2.26(m,
2h)。
[0399]
步骤d:在室温下向(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-2-甲基甲硫基甲酰亚胺基-六氢吡咯并[1,2-a]吡嗪-4-酮(0.150克,0.39毫摩尔)在吡啶(3毫升)中的搅拌溶液中加入2,2-二甲氧基乙胺(81.0毫克,0.77毫摩尔)。反应在110℃下搅拌2小时。在冷却至室温后,混合物在减压下浓缩。在室温下经1分钟加入hcl(2n,2毫升),并且所得混合物在90℃下搅拌30分钟。所得混合物用水(10毫升)稀释,用饱和nahco3水溶液碱化至ph 8,并用ea(3
×
30毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用30%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色固体的(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-2-(1h-咪唑-2-基)-六氢吡咯并[1,2-a]吡嗪-4-酮(0.130克,75%);对c
17h18
cl2n4o2计算的lcms(esi)[m+h]
+
:381,383(3:2),实测381,383(3:2);1h nmr(300mhz,cd3od)δ7.45(d,j=9.0hz,1h),7.06-6.99(m,3h),4.47-4.35(m,1h),4.32-4.15(m,2h),4.15-4.02(m,3h),3.87(s,3h),3.71-3.60(m,1h),3.39-3.34(m,1h),2.39-2.26(m,2h)。
[0400]
步骤e:在室温下向(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-2-(1h-咪唑-2-基)-六氢吡咯并[1,2-a]吡嗪-4-酮(0.130克,0.34毫摩尔)在dcm(2毫升)中的搅拌溶液中逐滴加入bbr3(0.5毫升,5.29毫摩尔)。反应搅拌2小时,用水(5毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xselect csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在5.3分钟内由28%b至40%b;检测器:uv 254/210nm;保留时间:5.36分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物176((7r,8as)-7-(2,3-二氯-6-羟苯基)-2-(1h-咪唑-2-基)-六氢吡咯并[1,2-a]吡嗪-4-酮)(49.0毫克,29%);对c
16h16
cl2n4o2计算的lcms(esi)[m+h]
+
:367,369(3:2),实测367,369(3:2);1h nmr(400mhz,cd3od)δ7.28(d,j=8.8hz,1h),6.87(s,2h),6.78(d,j=8.8hz,1h),4.42-4.31(m,1h),4.29-4.15(m,3h),4.13-4.03(m,1h),3.91(d,j=16.8hz,1h),3.68-3.60(m,1h),3.20-3.12(m,1h),2.52-2.49(m,1h),2.27-2.20(m,1h)。
[0401]
实施例56.化合物43((3s,8r,9as)-8-(2,3-二氯-6-羟苯基)-3-(羟甲基)六氢吡啶并[2,1-c][1,4]噁嗪-4(3h)-酮)和化合物52((3r,8r,9as)-8-(2,3-二氯-6-羟苯基)-3-(羟甲基)六氢吡啶并[2,1-c][1,4]噁嗪-4(3h)-酮)步骤a:在室温下向(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-3-(羟甲基)-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-4-酮(66.0毫克,0.18毫摩尔)在dcm(2毫升)中的搅拌溶液中加入bbr3(0.25毫升,2.64毫摩尔)。反应在室温下搅拌1小时,用meoh(1毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xselect csh obd column 30
×
150mm 5μ
column,30
×
150mm,5μm;流动相a:水(加10mm nh4hco3),流动相b:acn;流速:60ml/min;梯度:在8分钟内由25%b至50%b;检测器:uv 220nm;保留时间:5.92分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物180((8r,9as)-3-(氨基甲基)-8-(2,3-二氯-6-羟苯基)-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-4-酮)(10.4毫克,36%):对c
15h18
cl2n2o3计算的lcms(esi)[m+h]
+
:345,347(3:2),实测345,347(3:2);1h nmr(400mhz,cd3od)δ7.20(d,j=8.8hz,1h),6.71(d,j=8.7hz,1h),4.71(t,j=15.5hz,1h),4.21-3.98(m,2h),3.88-3.47(m,3h),3.13-3.02(m,2h),2.88-2.19(m,3h),1.71-1.54(m,2h)。
[0408]
实施例59.化合物181(8r,9as)-8-(2,3-二氯-6-羟苯基)-3-(吡咯烷-1-基甲基)-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-4-酮步骤a:在室温下向甲磺酸[(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-3-基]甲酯(实施例58,步骤a)(40.0毫克,0.09毫摩尔)和吡咯烷(32.0毫克,0.46毫摩尔)在acn(1毫升)中的搅拌混合物中加入diea(35.0毫克,0.27毫摩尔)。反应混合物在80℃下搅拌3小时。将冷却的混合物用水(20毫升)猝灭并用ea(3
×
30毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用40%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色油的(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-3-(吡咯烷-1-基甲基)-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-4-酮(20毫克,48%):对c
20h26
cl2n2o3计算的lcms(esi)[m+h]
+
:413,415(3:2),实测413,415(3:2)。
[0409]
步骤b:在室温下向(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-3-(吡咯烷-1-基甲基)-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-4-酮(20.0毫克,0.05毫摩尔)在dcm(1毫升)中的搅拌混合物中加入bbr3(0.25毫升,2.6毫摩尔)。反应在室温下搅拌1小时,用meoh(2毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xselect csh obd column 30
×
150mm 5μm,n;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在7分钟内由15%b至40%b;检测器:uv 220nm;保留时间:6.32分钟。收集含有所需产物的级分并在减压下浓缩以提供作为白色固体的化合物182((8r,9as)-8-(2,3-二氯-6-羟苯基)-3-(吡咯烷-1-基甲基)-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-4-酮)(4.8毫克,24.35%):对c
19h24
cl2n2o3计算的lcms(esi)[m+h]
+
:399,401(3:2),实测399,401(3:2);1h nmr(400mhz,cd3od)δ7.22(d,j=8.8hz,1h),6.72(d,j=8.8hz,1h),4.75-4.67(m,1h),4.63-4.52(m,1h),4.27-4.12(m,1h),4.00-3.56(m,7h),3.24-3.13(m,2h),2.86-2.72(m,1h),2.58-2.41(m,1h),2.33-2.30(m,1h),2.24-2.13(m,2h),2.12-2.00(m,2h),1.73-1.63(m,2h)。
[0410]
实施例60.以类似于本文中的公开的实施例的方式和/或类似于本领域中已知方法制备化合物182-183。
[0411]
实施例61.化合物184(1-[[(8r,9as)-8-(2,3-二氯-6-羟苯基)-4-氧代-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-3-基]甲基]吡咯烷-2-酮)
步骤a:在0℃下向(8r,9as)-3-(氨基甲基)-8-(2,3-二氯-6-甲氧基苯基)-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-4-酮(实施例58,步骤c)(60.0毫克,0.17毫摩尔)和tea(34.0毫克,0.33毫摩尔)在dcm(1毫升)中的搅拌溶液中逐滴加入4-氯丁酰氯(28.0毫克,0.20毫摩尔)。反应在室温下搅拌1小时,用水(20毫升)稀释并用ea(3
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为黄色油的n-[[(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-3-基]甲基]-4-氯丁酰胺(0.100克,粗),其不经提纯用于下一步骤:对c
20h25
cl3n2o4计算的lcms(esi)[m+h]
+
:463,465,467(3:3:1),实测463,465,467(3:3:1)步骤b:在室温下向n-[[(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-3-基]甲基]-4-氯丁酰胺(90.0毫克,0.19毫摩尔)在dmf(1毫升)中的搅拌溶液中加入cs2co3(0.130毫克,0.39毫摩尔)。反应搅拌12小时,用水(20毫升)稀释并用ea(3
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用30%在水中的acn(加0.5%tfa)洗脱的反相色谱法提纯。收集含有所需产物的级分并在减压下浓缩以提供作为黄色油的1-[[(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-3-基]甲基]吡咯烷-2-酮(35.0毫克,38%):对c
20h24
cl2n2o4计算的lcms(esi)[m+h]
+
:427,429(3:2),实测427,429(3:2);1h nmr(400mhz,cdcl3)δ7.33(d,j=8.9hz,1h),6.77(d,j=8.9hz,1h),4.76(d,j=13.2hz,1h),4.55-4.44(m,1h),4.16-4.09(m,1h),3.91-3.78(m,5h),3.75-3.48(m,5h),2.85-2.68(m,1h),2.65-2.61(m,2h),2.44-2.27(m,2h),2.23-2.13(m,2h),1.80-1.58(m,2h)。
[0412]
步骤c:在0℃下向1-[[(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-3-基]甲基]吡咯烷-2-酮(35.0毫克,0.08毫摩尔)在dcm(1毫升)中的搅拌混合物中加入bbr3(0.25毫升,2.64毫摩尔)。反应在室温下搅拌1小时,随后在0℃下用meoh(2毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xbridge prep obd c18 column,30
×
150mm 5μm;流动相a:水(加10mm nh4hco3),流动相b:acn;流速:
60ml/min;梯度:在8分钟内由22%b至53%b;检测器:uv 254/220nm;保留时间:7.57分钟。收集含有所需产物的级分并在减压下浓缩以提供作为白色固体的化合物184(1-[[(8r,9as)-8-(2,3-二氯-6-羟苯基)-4-氧代-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-3-基]甲基]吡咯烷-2-酮)(10.3毫克,29.5%):对c
19h22
cl2n2o4计算的lcms(esi)[m+h]
+
:413,415(3:2),实测413,415(3:2);1h nmr(400mhz,cd3od)δ7.21(d,j=8.8hz,1h),6.73(d,j=8.8hz,1h),4.79-4.66(m,1h),4.40-4.27(m,1h),4.17-3.93(m,1h),3.91-3.81(m,2h),3.81-3.63(m,2h),3.62-3.48(m,3h),2.83-2.64(m,2h),2.52-2.27(m,3h),2.15-2.01(m,2h),1.68-1.58(m,2h)。
[0413]
实施例62.以类似于对化合物184描述的方式制备化合物182-183。183。
[0414]
实施例63.化合物187(2-[(8r,9as)-8-(2,3-二氯-6-羟苯基)-4-氧代-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-3-基]乙酰胺)
步骤a:在室温下向甲磺酸[(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-3-基]甲酯(实施例58,step a)(0.600克,1.37毫摩尔)在dmf(8毫升)中的搅拌混合物中加入nacn(0.200克,4.11毫摩尔)。反应混合物在氮气气氛下在80℃下搅拌16小时。所得混合物在室温下用饱和nahco3水溶液(20毫升)猝灭并用ea(3
×
50毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用40%在水中的can(含有10mm nh4hco3)洗脱的反相色谱法提纯以提供作为黄色固体的2-[(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-3-基]乙腈(0.150克,25%):对c
17h18
cl2n2o3计算的lcms(esi)[m+h]
+
:369,371(3:2),实测369,371(3:2);1h nmr(400mhz,cdcl3)δ7.34-7.30(m,1h),6.78-6.74(m,1h),4.85-4.73(m,1h),4.42-4.30(m,1h),4.19-4.02(m,1h),3.91-3.72(m,4h),3.72-3.53(m,1h),3.15-3.04(m,1h),2.96-2.86(m,1h),2.81-2.67(m,1h),2.47-2.29(m,1h),2.11-1.98(m,1h),1.74-1.59(m,3h)。
[0415]
步骤b:在室温下向2-[(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-3-基]乙腈(30.0毫克,0.08毫摩尔)和naoh(32.0毫克,0.81毫摩尔)在meoh(1毫升)中的搅拌混合物中加入h2o2(23.0毫克,0.81毫摩尔)。反应在室温下搅拌1小时,在0℃下用饱和na2s2o3水溶液(15毫升)猝灭并用ea(3
×
15毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为灰白色固体的2-[(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-3-基]乙酰胺(20.0毫克,51%):对c
17h20
cl2n2o4计算的lcms(esi)[m+h]
+
:387,389(3:2),实测387,389(3:2);1h nmr(400mhz,cd3od)δ7.39(d,j=9.0hz,1h),6.97(d,j=9.0hz,1h),4.75-4.56(m,1h),4.53-4.44(m,1h),4.31(t,j=6.6hz,1h),4.16-3.97(m,1h),3.86(d,j=8.4hz,3h),3.83-3.63(m,1h),3.63-3.49(m,1h),2.95-2.81(m,1h),2.80-2.61(m,2h),2.40-2.30(m,1h),2.22-2.10(m,1h),1.73-1.54(m,2h)。
[0416]
步骤c:在室温下向2-[(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-4-氧代-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-3-基]乙酰胺(30.0毫克,0.07毫摩尔)在dcm(1毫升)中的搅拌混合物中
加入bbr3(97.0毫克,0.38毫摩尔)。反应搅拌1小时,用饱和nahco3水溶液(2毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:xbridge shield rp18 obd column,30
×
150mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在7分钟内由20%b至50%b;检测器:uv 220nm;保留时间:6.4分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物187(2-[(8r,9as)-8-(2,3-二氯-6-羟苯基)-4-氧代-六氢-1h-吡啶并[2,1-c][1,4]噁嗪-3-基]乙酰胺)(7.3毫克,24%):对c
16h18
cl2n2o4计算的lcms(esi)[m+h]
+
:373,375(3:2),实测373,375(3:2);1h nmr(400mhz,cd3od)δ7.23(d,j=8.7hz,1h),6.72(d,j=8.7hz,1h),4.75-4.65(m,1h),4.55-4.46(m,1h),4.09(dd,j=11.9,4.5hz,1h),3.83-3.64(m,2h),3.59(dd,j=12.0,9.7hz,1h),2.87(dd,j=15.4,3.7hz,1h),2.78-2.61(m,2h),2.55-2.43(m,1h),2.30-2.28(m,1h),1.70-1.58(m,2h)。
[0417]
实施例64.以类似于对化合物187所描述的方式制备化合物188。实施例64.以类似于对化合物187所描述的方式制备化合物188。
[0418]
实施例65.化合物189((2r,8as)-7-氨基-2-(2,3-二氯-6-羟苯基)六氢吲哚嗪-5(1h)-酮异构体1)和化合物190((2r,8as)-7-氨基-2-(2,3-二氯-6-羟苯基)六氢吲哚嗪-5(1h)-酮异构体2)步骤a:
在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-六氢吲哚嗪-5,7-二酮(中间体15,实施例13)(80.0毫克,0.24毫摩尔)和4-甲氧基-苄胺(50.0毫克,0.37毫摩尔)在dcm(3毫升)中的搅拌混合物中逐份加入acoh(14.0毫克,0.24毫摩尔)和nabh(oac)3(0.150克,0.73毫摩尔)。反应搅拌1小时并随后加入nabh4(18.0毫克,0.49毫摩尔)。反应在室温下搅拌附加的2小时,并用饱和nh4cl水溶液(20毫升)猝灭,随后用ea(3
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用40%在水中的acn(加0.1%fa)洗脱的反相色谱法提纯以提供作为浅黄色半固体的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-[[(4-甲氧基苯基)甲基]氨基]-六氢-1h-吲哚嗪-5-酮(60.0毫克,55%):对c
23h26
cl2n2o3计算的lcms(esi)[m+h]
+
449,451(3:2),实测449,451(3:2);1h nmr(400mhz,cd3od)δ7.49-7.34(m,3h),7.06-6.98(m,3h),5.51(s,2h),4.41-4.30(m,1h),4.26-4.11(m,2h),4.07-3.96(m,1h),3.91-3.76(m,7h),3.76-3.61(m,1h),3.58-3.48(m,1h),2.98(dd,j=17.2,6.4hz,1h),2.72-2.62(m,1h),2.50-2.38(m,1h),2.34-2.19(m,1h),1.67-1.55(m,1h)。
[0419]
步骤b:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-[[(4-甲氧基苯基)甲基]氨基]-六氢-1h-吲哚嗪-5-酮(60.0毫克,0.13毫摩尔)在mecn(2毫升)和h2o(0.5毫升)中的搅拌溶液中加入ce(no3)4·
2nh4no3(0.150克,0.27毫摩尔)。反应搅拌16小时,并用饱和na2so3水溶液(20毫升)猝灭,随后用ea(3
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用45%在水中的acn(加0.1%fa)洗脱的反相色谱法提纯以提供作为黄色油的(2r,8as)-7-氨基-2-(2,3-二氯-6-甲氧基苯基)-六氢-1h-吲哚嗪-5-酮(40.0毫克,91%):对c
15h18
cl2n2o2计算的lcms(esi)[m+h]
+
329,331(3:2),实测329,331(3:2);1h nmr(400mhz,cd3od)δ7.44(d,j=9.0hz,1h),7.02(d,j=8.9hz,1h),4.42-4.31(m,1h),4.11-3.88(m,2h),3.85(s,3h),3.79-3.67(m,1h),3.54(t,j=11.0hz,1h),2.92-2.80(m,1h),2.57-2.36(m,2h),2.35-2.21(m,2h),1.71-1.57(m,1h)。
[0420]
步骤c:在室温下向(2r,8as)-7-氨基-2-(2,3-二氯-6-甲氧基苯基)-六氢-1h-吲哚嗪-5-酮(40.0毫克,0.12毫摩尔)在dcm(2毫升)中的搅拌溶液中加入bbr3(0.300克,1.22毫摩尔)。反应搅拌1小时,用meoh(1毫升)猝灭并在减压下浓缩。残余物通过用30%在水中的acn(加0.1%fa)洗脱的反相色谱法提纯以提供粗产物。粗产物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.1%fa),流动相b:acn;流速:20ml/min;梯度:在5.5分钟内由15%b至35%b;检测器:uv 210nm;保留时间:5.6分钟。收集含有所需产物的级分并在真空下浓缩以提供作为灰白色固体的(2r,8as)-7-氨基-2-(2,3-二氯-6-羟苯基)-六氢-1h-吲哚嗪-5-酮(12.2毫克,27.8%):对c
14h16
cl2n2o2计算的lcms(esi)[m+h]
+
315,317(3:2),实测315,317(3:2);1h nmr(400mhz,cd3od)δ8.51(s,1h),7.26(d,j=8.8hz,1h),6.77(d,j=8.8hz,1h),4.36-4.24(m,1h),4.12(dd,j=11.6,9.2hz,1h),3.88-3.77(m,1h),3.75-3.61(m,1h),3.54(dd,j=11.7,9.9hz,1h),2.89-2.80(m,1h),2.54-2.32(m,3h),2.27-2.17(m,1h),1.65-1.62(m,1h)。
[0421]
步骤d:
产物(2r,8as)-7-氨基-2-(2,3-二氯-6-羟苯基)-六氢-1h-吲哚嗪-5-酮(10.0毫克,0.03毫摩尔)通过制备手性hplc采用以下条件分离:柱:chiralpak ie,2
×
25cm,5μm;流动相a:hex/dcm=3/1(10mm nh
3-meoh)-hplc,流动相b:etoh-hplc;流速:20ml/min;梯度:在11分钟内由20%至20%;检测器:uv 220/254nm;保留时间1:7.49分钟;保留时间2:8.65分钟。在7.49分钟处的较快洗脱的异构体提供作为灰白色固体的化合物189((2r,8as)-7-氨基-2-(2,3-二氯-6-羟苯基)-六氢-1h-吲哚嗪-5-酮异构体1)(4.00毫克,47.6%):对c
14h16
cl2n2o2计算的lcms(esi)[m+h]
+
:315,317(3:2),实测315,317(3:2);1h nmr(400mhz,cd3od)δ7.26(d,j=8.8hz,1h),6.79(d,j=8.9hz,1h),4.30-4.09(m,2h),3.88-3.49(m,3h),2.89-2.74(m,1h),2.56-2.40(m,2h),2.36(dd,j=17.1,10.7hz,1h),2.27-2.02(m,1h),1.68-1.48(m,1h)。在8.65分钟处的较慢洗脱的异构体提供作为灰白色固体的化合物190((2r,8as)-7-氨基-2-(2,3-二氯-6-羟苯基)-六氢-1h-吲哚嗪-5-酮异构体2)(4.50毫克,53.6%):对c
14h16
cl2n2o2计算的lcms(esi)[m+h]
+
:315,317(3:2),实测315,317(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.75(d,j=8.7hz,1h),4.34-4.16(m,1h),4.16-4.03(m,1h),3.83-3.72(m,1h),3.50(dd,j=11.6,9.9hz,1h),3.31-3.23(m,1h),2.71(dd,j=17.5,6.0hz,1h),2.45-2.27(m,2h),2.23-2.09(m,2h),1.50-1.40(m,1h)。
[0422]
实施例66.化合物191((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-[(3r)-3-羟基吡咯烷-1-基]-六氢-1h-吲哚嗪-5-酮异构体1)和化合物192((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-[(3r)-3-羟基吡咯烷-1-基]-六氢-1h-吲哚嗪-5-酮异构体2)步骤a:将(2r,8as)-2-(2,3-二氯-6-羟苯基)-六氢吲哚嗪-5,7-二酮(27.0毫克,0.09毫摩尔)和(3r)-吡咯烷-3-醇盐酸盐(0.150克,1.20毫摩尔)在dcm(1毫升)中的混合物在室温下搅拌16小时。随后,在室温下向混合物中加入nabh4(20.0毫克,0.52毫摩尔)。所得反应搅拌附加的8小时,用饱和nh4cl水溶液(1毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在5.3分钟内由25%b至50%b;检测器:uv 254/210nm;保留时间:5.36分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的(2r,8as)-2-(2,3-二氯-6-羟苯基)-7-[(3r)-3-羟基吡咯烷-1-基]-六氢-1h-吲哚嗪-5-酮(12.9毫克,28%):对c
18h22
cl2n2o3计算的lcms(esi)[m+h]
+
:385,387(3:
2),实测385,387(3:2);1h nmr(400mhz,cd3od)δ7.27(d,j=8.8,1h),6.79(d,j=8.8hz,1h),4.38-4.22(m,1h),4.22-4.07(m,1h),3.88-3.71(m,3h),3.67-3.49(m,3h),3.49-3.37(m,1h),3.29-3.19(m,1h),3.02-2.90(m,1h),2.68(dd,j=23.8,11.8hz,1h),2.61-2.30(m,2h),2.27-2.20(m,1h),2.20-2.00(m,2h),1.82-1.64(m,1h)。
[0423]
步骤b:(2r,8as)-2-(2,3-二氯-6-羟苯基)-7-[(3r)-3-羟基吡咯烷-1-基]-六氢-1h-吲哚嗪-5-酮(12.9毫克,0.03毫摩尔)通过制备手性hplc采用以下条件分离:柱:chiralpak id,2
×
25cm,5μm;流动相a:hex(加0.2%fa)-hplc,流动相b:etoh-hplc;流速:20ml/min;梯度:在12分钟内由20%b至20%b;检测器:uv 220/254nm;保留时间1:6.66分钟;保留时间2:8.97min;注射体积:1毫升;运行数量:2。在6.66分钟处的较快洗脱的异构体,提供作为灰白色固体的化合物191((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-[(3r)-3-羟基吡咯烷-1-基]-六氢-1h-吲哚嗪-5-酮异构体1)(1.9毫克,16.20%):对c
18h22
cl2n2o3计算的lcms(esi)[m+h]
+
:385,387(3:2),实测385,387(3:2);1h nmr(400mhz,cd3od)δ8.50(s,1h),7.26(d,j=8.8hz,1h),6.76(d,j=8.8hz,1h),4.52-4.36(m,1h),4.36-4.19(m,1h),4.12(dd,j=11.6,9.2hz,1h),3.88-3.73(m,1h),3.58-3.42(m,1h),3.29-3.09(m,3h),3.09-2.91(m,2h),2.83(dd,j=17.3,6.1hz,1h),2.57(d,j=13.0hz,1h),2.50-2.30(m,2h),2.28-2.15(m,2h),1.97-1.88(m,1h),1.57(q,j=11.9hz,1h)。在8.97分钟处的较慢洗脱的异构体,提供作为白色固体的化合物192((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-[(3r)-3-羟基吡咯烷-1-基]-六氢-1h-吲哚嗪-5-酮异构体2)(1.5毫克,12.79%):对c
18h22
cl2n2o3计算的lcms(esi)[m+h]
+
:385,387(3:2),实测385,387(3:2);1h nmr(400mhz,cd3od)δ8.53(s,1h),7.26(d,j=8.8hz,1h),6.79(d,j=8.8hz,1h),4.54-4.48(m,1h),4.31-4.03(m,3h),3.63-3.57(m,2h),3.41-3.34(m,1h),3.25-3.05(m,3h),2.86(dd,j=17.1,5.9hz,1h),2.60-2.38(m,3h),2.30-2.17(m,1h),2.11(q,j=10.6hz,1h),2.01-1.89(m,1h),1.57(q,j=11.9hz,1h)。
[0424]
实施例67.以类似于对化合物191-192所述的方式制备化合物193-205。
[0425]
实施例68.化合物206(n-[(2r,8as)-2-(2,3-二氯-6-羟苯基)-5-氧代-六氢-1h-吲哚嗪-7-基]乙酰胺))
步骤a:在室温下向(2r,8as)-7-氨基-2-(2,3-二氯-6-羟苯基)-六氢-1h-吲哚嗪-5-酮(实施例65,步骤c)(50.0毫克,0.16毫摩尔)和tea(48.0毫克,0.47毫摩尔)在dcm(1毫升)中的搅拌溶液中加入乙酰氯(12毫克,0.16毫摩尔)。所得混合物搅拌2小时并随后在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.1%fa),流动相b:acn;流速:20ml/min;梯度:在5.5分钟内由30%b至50%b;检测器:uv 210nm;保留时间:5.5分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物206(n-[(2r,8as)-2-(2,3-二氯-6-羟苯基)-5-氧代-六氢-1h-吲哚嗪-7-基]乙酰胺)(23.0毫克,39%):对c
16h18
cl2n2o3计算的lcms(esi)[m+h]
+
:357,359(3:2),实测357,359(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.76(d,j=8.8hz,1h),4.39-4.32(m,1h),4.32-4.21(m,1h),4.16(dd,j=11.5,9.0hz,1h),3.91-3.80(m,1h),3.55(dd,j=11.5,9.8hz,1h),2.73(dd,j=18.3,6.3hz,1h),2.46-2.29(m,3h),2.20-2.12(m,1h),1.99(s,3h),1.71-1.61(m,1h)。
[0426]
实施例69.化合物207)((2r,7s,8as)-2-(2,3-二氯-6-羟苯基)-7-(哌嗪-1-基)六氢吲哚嗪-5(1h)-酮)和化合物208((2r,7r,8as)-2-(2,3-二氯-6-羟苯基)-7-(哌嗪-1-基)六氢吲哚嗪-5(1h)-酮)步骤a:在室温下向(2r,8ar)-2-(2,3-二氯-6-甲氧基苯基)-2,3,8,8a-四氢-1h-吲哚嗪-5-酮(中间体17,实施例15)(0.300克,0.96毫摩尔)在h2o(0.50毫升)中的搅拌混合物中加入哌嗪(0.830克,9.61毫摩尔)。所得混合物在90℃下搅拌16小时,冷却至室温并在减压下浓缩。残余物通过用30%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-(哌嗪-1-基)-六氢-1h-吲哚嗪-5-酮
(0.300克,60%):对c
19h25
cl2n3o2计算的lcms(esi)[m+h]
+
:398,400(3:2),实测398,400(3:2);1h nmr(300mhz,cdcl3)δ7.33(d,j=8.6hz,1h),6.76(d,j=8.9hz,1h),4.36-4.14(m,1h),4.08-3.85(m,1h),3.78(s,3h),3.76-3.61(m,8h),3.61-3.46(m,3h),3.12-2.53(m,3h),2.42-2.12(m,3h)。
[0427]
步骤b:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-(哌嗪-1-基)-六氢-1h-吲哚嗪-5-酮(0.300克,1.17毫摩尔)在dcm(5毫升)中的搅拌混合物中逐滴加入bbr3(1.00毫升)。所得反应在室温下搅拌1小时,在0℃下用meoh(5毫升)猝灭并在减压下浓缩。残余物通过用30%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供所需产物。产物通过制备手性hplc采用以下条件来分离:柱:chiralpak ig,2
×
25cm,5μm;流动相a:hex(加0.2%ipa)-hplc,流动相b:etoh-hplc;流速:20ml/min;梯度:在14分钟内由20%b至20%b;检测器uv 220/254nm;保留时间1:7.51分钟;保留时间2:11.52min;注射体积:1.2ml;运行数量:1.在7.51分钟处的较快洗脱的异构体是作为灰白色固体的化合物207((2r,7s,8as)-2-(2,3-二氯-6-羟苯基)-7-(哌嗪-1-基)-六氢-1h-吲哚嗪-5-酮)(76.5毫克,16%):对c
18h23
cl2n3o2计算的lcms(esi)[m+h]
+
:384,386(3:2),实测384,386(3:2):1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.75(d,j=8.8hz,1h),4.31-4.19(m,1h),4.12(dd,j=11.5,8.8hz,1h),3.96-3.83(m,1h),3.55-3.46(m,1h),2.91(t,j=5.0hz,4h),2.79-2.71(m,1h),2.68-2.54(m,5h),2.53-2.41(m,2h),2.37-2.30(m,1h),2.21-2.10(m,1h),1.73-1.62(m,1h)。在11.52分钟处的较慢洗脱的异构体是作为灰白色固体的化合物208((2r,7r,8as)-2-(2,3-二氯-6-羟苯基)-7-(哌嗪-1-基)-六氢-1h-吲哚嗪-5-酮)(72.3毫克,15%)。对c
18h23
cl2n3o2计算的lcms(esi)[m+h]
+
:384,386(3:2),实测384,386(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.75(d,j=8.8hz,1h),4.34-4.21(m,1h),4.16-4.05(m,1h),3.80-3.68(m,1h),3.51(dd,j=11.6,9.8hz,1h),2.97-2.87(m,5h),2.73-2.56(m,5h),2.49-2.29(m,3h),2.21-2.13(m,1h),1.46-1.39(m,1h)。
[0428]
实施例70.化合物213((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-(1h-吡唑-3-基)-六氢-1h-吲哚嗪-5-酮异构体1)和化合物214((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-(1h-吡唑-3-基)-六氢-1h-吲哚嗪-5-酮异构体2)步骤a:
在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-(2h-吡唑-3-基)-2,3,8,8a-四氢-1h-吲哚嗪-5-酮(70.0毫克,0.19毫摩尔)在meoh(2毫升)、ea(2毫升)和acoh(0.50毫升)中的搅拌溶液中加入pto2(42.0毫克,0.19毫摩尔)。反应在氢气气氛(1.5atm)下在室温下搅拌16小时。将所得混合物过滤,并且滤液在减压下浓缩。残余物通过用40%在水中的acn(加0.1%fa)洗脱的反相色谱法提纯以提供作为浅黄色固体的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-(2h-吡唑-3-基)-六氢-1h-吲哚嗪-5-酮(40毫克,57%):对c
18h19
cl2n3o2计算的lcms(esi)[m+h]
+
380,382(3:2),实测380,382(3:2)。
[0429]
步骤b:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-(2h-吡唑-3-基)-2,3,8,8a-四氢-1h-吲哚嗪-5-酮(35.0毫克,0.09毫摩尔)在dcm(2毫升)中的搅拌溶液中加入bbr3(0.140克,0.55毫摩尔)。反应搅拌1小时,用meoh(2毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:x bridge shield rp18 obd column,19
×
250mm,10μm;流动相a:水(加10mm nh4hco3),流动相b:acn;流速:20ml/min;梯度:在5.5分钟内由35%b至60%b;检测器:uv 224nm;保留时间:5.56分钟。收集含有所需产物的级分并在减压下浓缩以提供混合物产物。产物随后通过制备手性hplc采用以下条件分离:柱:chiralpak id-2,2
×
25cm,5μm;流动相a:hex(加0.1%fa)-hplc,流动相b:ipa-hplc;流速:15ml/min;梯度:在25分钟内由50%b至50%b;检测器:uv 224nm;保留时间1:9.91分钟;保留时间2:18.38min;注射体积:2ml;运行数量:2。获得在9.91分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物213((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-(1h-吡唑-3-基)-六氢-1h-吲哚嗪-5-酮异构体1)(3.8毫克,11%):对c
17h17
cl2n3o2计算的lcms(esi)[m+h]
+
366,368(3:2),实测366,368(3:2);1h nmr(400mhz,dmso-d6)δ7.52(d,j=2.2hz,1h),7.32(d,j=8.8hz,1h),6.84(d,j=8.8hz,1h),6.17(d,j=2.2hz,1h),4.14-3.91(m,3h),3.37(dd,j=10.9,7.7hz,1h),3.27-3.15(m,1h),2.64-2.54(m,1h),2.37-2.22(m,3h),2.02-1.88(m,1h),1.56-1.50(m,1h)。获得在18.38分钟处的作为灰白色固体的化合物214((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-(1h-吡唑-3-基)-六氢-1h-吲哚嗪-5-酮异构体2)的较慢洗脱的异构体(9.3毫克,28%):对c
17h17
cl2n3o2计算的lcms(esi)[m+h]
+
366,368(3:2),实测366,368(3:2);1h nmr(400mhz,dmso-d6)δ7.54(d,j=2.2hz,1h),7.33(d,j=8.8hz,1h),6.82(d,j=8.8hz,1h),6.17(d,j=2.2hz,1h),4.13-3.98(m,1h),3.98-3.88(m,1h),3.88-3.74(m,1h),3.40(dd,j=10.6,7.7hz,1h),3.32-3.16(m,1h),2.60(dd,j=17.8,5.8hz,1h),2.36-2.25(m,2h),2.23-2.15(m,1h),2.13-2.03(m,1h),1.55-1.46(m,1h)。
[0430]
实施例71.以类似于对化合物213-214所描述的方式制备化合物215-216。
[0431]
实施例72.化合物217((2r,8ar)-7-(氨基甲基)-2-(2,3-二氯-6-羟苯基)-六氢-1h-吲哚嗪-5-酮)步骤a:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-2,3,8,8a-四氢-1h-吲哚嗪-7-甲腈(70.0毫克,0.21毫摩尔)在meoh(3毫升)和acoh(3毫升)中的搅拌溶液中加入pto2(47.0毫克,0.21毫摩尔)。反应在氢气气氛(1.5atm)下搅拌1小时。将所得混合物过滤,并且滤液在减压下浓缩。残余物通过用35%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为无色油的(2r,8ar)-7-(氨基甲基)-2-(2,3-二氯-6-甲氧基苯基)-六氢-1h-吲哚嗪-5-酮(50.0毫克,53%):对c
16h20
cl2n2o2计算的lcms(esi)[m+h]
+
343,345(3:2),实测343,345(3:2);1h nmr(300mhz,cd3od)δ7.43(dd,j=9.0,1.5hz,1h),7.06-6.95(m,1h),4.42-4.13(m,1h),4.12-3.96(m,1h),3.92-3.76(m,4h),3.57-3.45(m,1h),3.12-2.92
(m,2h),2.68-2.49(m,1h),2.36-2.04(m,5h),1.37-1.26(m,1h)。
[0432]
步骤b:在室温下向(2r,8ar)-7-(氨基甲基)-2-(2,3-二氯-6-甲氧基苯基)-六氢-1h-吲哚嗪-5-酮(50.0毫克,0.11毫摩尔)在dcm(2毫升)中的搅拌溶液中加入bbr3(0.270克,1.09毫摩尔)。反应在室温下搅拌3小时,用meoh(1毫升)猝灭并在减压下浓缩。残余物通过用45%在水中的acn(加10mm nh4hco3)洗脱的反相色谱法提纯以提供粗产物。粗产物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.1%fa),流动相b:acn;流速:20ml/min;梯度:在5.5分钟内由20%b至21%b;检测器:uv 254/210nm;保留时间:5.58分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物217((2r,8ar)-7-(氨基甲基)-2-(2,3-二氯-6-羟苯基)-六氢-1h-吲哚嗪-5-酮甲酸)(10.0毫克,24.37%):对c
15h18
cl2n2o2计算的lcms(esi)[m+h]
+
329,331(3:2),实测329,331(3:2);1h nmr(400mhz,cd3od)δ8.54(s,1h),7.25(dd,j=8.8,5.7hz,1h),6.76(dd,j=8.8,4.9hz,1h),4.43-4.23(m,1h),4.23-4.03(m,1h),3.91-3.77(m,1h),3.63-3.45(m,1h),3.43-3.36(m,1h),2.98(d,j=6.7hz,1h),2.59(dd,j=17.3,5.6hz,1h),2.50-2.37(m,1h),2.32-2.01(m,4h),1.38-1.30(m,1h)。
[0433]
实施例73.化合物218((2r,8as)-7-(氨基甲基)-2-(2,3-二氯-6-羟苯基)-7-羟基-六氢吲哚嗪-5-酮异构体1)和化合物219((2r,8as)-7-(氨基甲基)-2-(2,3-二氯-6-羟苯基)-7-羟基-六氢吲哚嗪-5-酮异构体2)步骤a:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-六氢吲哚嗪-5,7-二酮(中间体15,实施例13)(0.500克,1.52毫摩尔)和zni2(0.150克,0.46毫摩尔)在dce(6毫升)中的搅拌溶液中加入tmscn(0.450克,4.57毫摩尔)。所得反应在80℃下搅拌2天,并在室温下用饱和nahco3水溶液(20毫升)猝灭,随后用ea(3
×
30毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用70%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色固体的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-羟基-5-氧代八氢吲哚嗪-7-甲腈(0.120克,22%):对c
16h16
cl2n2o3计算的lcms(esi)[m+h]
+
:355,357(3:2),实测355,357(3:2);1h nmr(400mhz,cdcl3)δ7.37(dd,j=8.9,2.6hz,1h),6.84-6.67(m,1h),4.29-4.08(m,2h),3.85(d,j=15.3hz,3h),3.66-3.55(m,1h),3.31-3.16(m,1h),2.72(dt,j=50.1,17.1hz,2h),2.46-2.06(m,2h),
1.95-1.80(m,1h),1.78-1.42(m,1h)。
[0434]
步骤b:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-羟基-5-氧代八氢吲哚嗪-7-甲腈(50.0毫克,0.14毫摩尔)在meoh(0.5毫升)中的搅拌溶液中加入acoh(0.5毫升)和pto2(6毫克)。所得混合物在氢气气氛下搅拌2小时。将混合物过滤,滤饼用meoh(3
×
5毫升)洗涤,并且滤液在减压下浓缩。残余物通过用35%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为灰白色固体的(2r,8as)-7-(氨基甲基)-2-(2,3-二氯-6-甲氧基苯基)-7-羟基-六氢吲哚嗪-5-酮(20.0毫克,35%):对c
16h20
cl2n2o3计算的lcms(esi)[m+h]
+
:359,361(3:2),实测359,361(3:2)。
[0435]
步骤c:在室温下向(2r,8as)-7-(氨基甲基)-2-(2,3-二氯-6-甲氧基苯基)-7-羟基-六氢吲哚嗪-5-酮(20.0毫克,0.06毫摩尔)在dcm(0.5毫升)中的搅拌溶液中加入bbr3(0.2毫升,2.12毫摩尔)。反应在室温下搅拌1小时,在0℃下用meoh(1毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在6.5分钟内由22%b至27%b;检测器:uv 210nm;保留时间1:6.54分钟;保留时间2:6.92分钟。获得在6.54分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物218((2r,8as)-7-(氨基甲基)-2-(2,3-二氯-6-羟苯基)-7-羟基-六氢吲哚嗪-5-酮异构体1)(5.7毫克,21%):对c
15h18
cl2n2o3计算的lcms(esi)[m+h]
+
:345,347(3:2),实测345,347(3:2);1h nmr(400mhz,cd3od)δ7.26(d,j=8.8hz,1h),6.77(d,j=8.8hz,1h),4.36-4.21(m,1h),4.14(dd,j=11.6,9.0hz,1h),3.81-3.67(m,1h),3.55-3.47(m,1h),3.20-3.02(m,2h),2.71-2.48(m,2h),2.44-2.30(m,2h),2.25-2.17(m,1h),1.80(dd,j=13.5,11.5hz,1h)。获得在6.92分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物219((2r,8as)-7-(氨基甲基)-2-(2,3-二氯-6-羟苯基)-7-羟基-六氢吲哚嗪-5-酮异构体1)(2毫克,7%):对c
15h18
cl2n2o3计算的lcms(esi)[m+h]
+
:345,347(3:2),实测345,347(3:2);1h nmr(400mhz,cd3od)δ7.26(d,j=8.8hz,1h),6.78(d,j=8.8hz,1h),4.27-4.17(m,1h),4.17-4.09(m,1h),4.09-3.97(m,1h),3.71-3.59(m,1h),3.16-3.01(m,2h),2.65-2.45(m,3h),2.33-2.24(m,1h),2.11-2.01(m,1h),1.80(dd,j=13.6,11.4hz,1h)。
[0436]
实施例74.化合物220((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-羟基-7-(羟甲基)-六氢吲哚嗪-5-酮)
步骤a:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-羟基-5-氧代八氢吲哚嗪-7-甲腈(实施例73,步骤a)(50.0毫克,0.14毫摩尔)在meoh(0.5毫升)中的搅拌溶液中加入socl2(0.25毫升,4.02毫摩尔)。所得混合物在室温下搅拌2小时并在减压下浓缩。残余物通过用50%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为灰白色固体的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-羟基-5-氧代-六氢吲哚嗪-7-甲酸甲酯(50毫克,90%):对c
17h19
cl2no5计算的lcms(esi)[m+h]
+
:388,390(3:2),实测388,390(3:2)。
[0437]
步骤b:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-羟基-5-氧代-六氢吲哚嗪-7-甲酸甲酯(50.0毫克,0.13毫摩尔)在meoh(1毫升)中的搅拌溶液中加入nabh4(15.0毫克,0.39毫摩尔)。所得混合物在室温下搅拌2小时,用饱和nh4cl水溶液(1毫升)猝灭并在减压下浓缩。残余物通过用50%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为灰白色固体的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-羟基-7-(羟甲基)-六氢吲哚嗪-5-酮(40.0毫克,73%):对c
16h19
cl2no4计算的lcms(esi)[m+h]
+
:360,362(3:2),实测360,362(3:2);1h nmr(400mhz,cdcl3)δ7.36(dd,j=8.9,3.9hz,1h),6.87-6.63(m,1h),4.49-4.03(m,4h),3.84(s,3h),3.73-3.43(m,3h),2.86-2.59(m,2h),2.50-2.16(m,2h),1.88-1.63(m,1h)。
[0438]
步骤c:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-羟基-7-(羟甲基)-六氢吲哚嗪-5-酮(40.0毫克,0.11毫摩尔)在dcm(1毫升)中的搅拌溶液中加入bbr3(0.30毫升,3.17毫摩尔)。所得混合物在室温下搅拌2小时,在0℃下用meoh(5毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在6.5分钟内由30%b至45%b;检测器:uv 254/210nm;保留时间:6.54分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物220((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-羟基-7-(羟甲基)-六氢吲哚嗪-5-酮)(13.0毫克,33%):对c
15h17
cl2no4计算的lcms(esi)[m+h]
+
:346,348(3:2),实测346,348(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.76(d,j=8.8hz,1h),4.32-4.15(m,1h),4.15-4.01(m,1h),3.81-3.61(m,1h),3.61-3.42
(m,3h),2.63-2.48(m,1h),2.48-2.29(m,3h),2.22-1.98(m,1h),1.68-1.53(m,1h)。
[0439]
实施例75.化合物223((2r,8ar)-2-(2,3-二氯-6-羟苯基)-六氢-1h-吲哚嗪-5-酮)步骤a:以类似于本文中公开的实施例的方式和/或类似于本领域中已知的方法制备化合物(2r,8ar)-2-(2,3-二氯-6-羟苯基)-2,3,8,8a-四氢-1h-吲哚嗪-5-酮。[m+h]
+
:298,300(3:2);1h nmr(400mhz,dmso-d6)δ10.34(s,1h),7.35(d,j=8.8hz,1h),6.84(d,j=8.9hz,1h),6.68-6.60(m,1h),5.81(d,j=9.8hz,1h),4.10-4.01(m,1h),3.91-3.78(m,2h),3.53(dd,j=11.1,9.7hz,1h),2.57(dd,j=11.6,5.8hz,1h),2.44-2.33(m,1h),2.21-2.09(m,2h)。
[0440]
步骤b:在室温下向(2r,8as)-2-(2,3-二氯-6-羟苯基)-2,3,6,8a-四氢-1h-吲哚嗪-5-酮(50.0毫克,0.17毫摩尔)在meoh(2毫升)中的搅拌混合物中加入pto2(10.0毫克,0.04毫摩尔)。反应在氢气气氛(1.5atm)下搅拌2小时。将所得混合物过滤,滤饼用meoh(3
×
5毫升)洗涤。滤液在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在5.5分钟内由35%b至65%b;检测器:uv 210nm;保留时间:5.56分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物223((2r,8ar)-2-(2,3-二氯-6-羟苯基)-六氢-1h-吲哚嗪-5-酮)(41.0毫克,82%):对c
14h15
cl2no2计算的lcms(esi)[m+h]
+
:300,302(3:2),实测300,302(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.75(d,j=8.8hz,1h),4.29-4.17(m,1h),4.17-4.09(m,1h),3.77-3.65(m,1h),3.56-3.52(m,1h),2.48-2.26(m,3h),2.23-2.09(m,2h),2.05-1.94(m,1h),1.88-1.72(m,1h),1.52-1.37(m,1h)。
[0441]
实施例76.化合物224((7r,8s)-rel-(2r,8as)-2-(2,3-二氯-6-羟苯基)-7,8-二羟基-六氢-1h-吲哚嗪-5-酮)和化合物225((7s,8r)-rel-(2r,8as)-2-(2,3-二氯-6-羟苯基)-7,8-二羟基-六氢-1h-吲哚嗪-5-酮)
1h-吲哚嗪-5-酮)(31.9毫克,14.32%):对c
14h15
cl2no4计算的lcms(esi)[m+h]
+
:332,334(3:2),实测332,334(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.75(d,j=8.8hz,1h),4.32-4.17(m,1h),4.11-4.00(m,3h),3.86-3.74(m,1h),3.48(dd,j=11.3,9.5hz,1h),3.03-2.97(m,1h),2.64-2.44(m,2h),1.91-1.82(m,1h)。
[0443]
实施例77.以类似于对化合物224和225所描述的方式制备化合物226。
[0444]
实施例78.化合物227((2r,8as)-2-(2,3-二氯-6-羟苯基)-8-羟基-六氢-1h-吲哚嗪-5-酮异构体1)步骤a:在室温下向(2r,8as)-2-(2,3-二氯-6-羟苯基)-7,8-二羟基-六氢-1h-吲哚嗪-5-酮(0.100克,0.30毫摩尔)和tsoh(5.00毫克,0.03毫摩尔)在丙酮(3毫升)中的搅拌混合物中加入2,2-二甲氧基丙烷(63.0毫克,0.60毫摩尔)。反应在室温下搅拌2小时,并用饱和nahco3水溶液(5毫升)猝灭,随后用ea(3
×
10毫升)萃取。合并的有机层用盐水(3
×
10毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为灰白色固体的(8r,9as)-8-(2,3-二氯-6-羟苯基)-2,2-二甲基-六氢-3ah-[1,3]二氧戊环并[4,5-g]吲哚嗪-5-酮(0.100克,粗),其不经提纯直接用于下一步骤:对c
17h19
cl2no4计算的lcms(esi)[m+h]
+
:372,374(3:2),实测372,374(3:2);1h nmr(400mhz,cdcl3)δ9.00(s,1h),7.19(d,j=8.8hz,1h),6.86(d,j=8.8hz,1h),4.79-4.71(m,1h),4.49(dd,j=7.5,2.7hz,1h),4.36-4.24(m,1h),4.10-3.96(m,1h),3.77-3.63(m,1h),3.58-3.46(m,1h),2.92-2.81(m,1h),2.77(dd,j=15.5,2.2hz,1h),2.41(dd,j=15.4,3.7hz,1h),2.22-2.09(m,1h),1.38(d,j
=15.5hz,6h)。
[0445]
步骤b:在室温下向(8r,9as)-8-(2,3-二氯-6-羟苯基)-2,2-二甲基-六氢-3ah-[1,3]二氧戊环并[4,5-g]吲哚嗪-5-酮(60.0毫克,0.16毫摩尔)在dmf(1毫升)中的搅拌溶液中加入cs2co3(0.160克,0.48毫摩尔)。反应在80℃下搅拌3小时。在过滤后,滤液在减压下浓缩,残余物通过用30%在水中的acn(加10mm nh4hco3)洗脱的反相色谱法提纯以提供作为黄色固体的(2r,8as)-2-(2,3-二氯-6-羟苯基)-8-羟基-2,3,8,8a-四氢-1h-吲哚嗪-5-酮(20.0毫克,33%):对c
14h13
cl2no3计算的lcms(esi)[m+h]
+
:314,316(3:2),实测314,316(3:2);1h nmr(400mhz,cdcl3)δ7.23(d,j=8.6hz,1h),6.91(d,j=7.8hz,1h),6.77(d,j=8.9hz,1h),6.22(d,j=9.6hz,1h),4.31-4.19(m,2h),4.17-4.10(m,1h),3.97-3.89(m,1h),3.79-3.70(m,1h),3.05-3.00(m,1h),2.22-2.09(m,1h)。
[0446]
步骤c:在室温下向(2r,8as)-2-(2,3-二氯-6-羟苯基)-8-羟基-2,3,8,8a-四氢-1h-吲哚嗪-5-酮(20.0毫克,0.06毫摩尔)在meoh(1.00毫升)中的搅拌溶液中加入pto2(3.00毫克,0.01毫摩尔)。所得混合物在氢气气氛(1.5atm)下在室温下搅拌1小时。将所得混合物过滤,并且滤饼用meoh(3
×
3毫升)洗涤。滤液在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在6.5分钟内由35%b至40%b;检测器:uv 254/210nm;保留时间:6.54分钟。收集含有所需产物的级分并在减压下浓缩以提供作为暗黄色固体的化合物227((2r,8as)-2-(2,3-二氯-6-羟苯基)-8-羟基-六氢-1h-吲哚嗪-5-酮异构体1)(5.00毫克,24%):对c
14h15
cl2no3计算的lcms(esi)[m+h]
+
:316,318(3:2),实测316,318(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.75(d,j=8.8hz,1h),4.28-4.16(m,1h),4.16-4.07(m,2h),3.81(dd,j=12.1,5.2hz,1h),3.56-3.48(m,1h),2.96-2.90(m,1h),2.62-2.48(m,1h),2.34(dd,j=18.0,7.1hz,1h),2.14-2.04(m,1h),2.04-1.93(m,1h),1.93-1.84(m,1h)。
[0447]
实施例79.化合物228((2r,8as)-2-(2,3-二氯-6-羟苯基)-5-氧代-八氢吲哚嗪-7-甲腈异构体1)步骤a:在室温下向(2r,8ar)-2-(2,3-二氯-6-甲氧基苯基)-2,3,8,8a-四氢-1h-吲哚嗪-5-酮(中间体17,实施例15)(0.600克,1.92毫摩尔)和zni2(61.0毫克,0.19毫摩尔)在dce(6毫升)中的搅拌溶液中加入tmscn(0.570克,5.77毫摩尔)。所得混合物在80℃下搅拌16小时并用饱和nahco3水溶液(20毫升)猝灭,随后用ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用ea洗脱的硅胶柱色谱法提纯以提供作为灰白色固体的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧
代-六氢-1h-吲哚嗪-7-甲腈(0.450克,62%):对c
16h16
cl2n2o2计算的lcms(esi)[m+mecn+h]
+
:380,382(3:2),实测380,382(3:2);1h nmr(400mhz,cd3cl)δ7.36(d,j=8.9hz,1h),6.77(d,j=9.0hz,1h),4.33-4.29(m,1h),4.16-4.02(m,2h),3.82(s,3h),3.68-3.59(m,1h),3.36-3.30(m,1h),2.82(d,j=17.9hz,1h),2.69(dd,j=18.1,7.4hz,1h),2.50-2.42(m,1h),2.29-2.21(m,2h),1.78-1.68(m,1h)。
[0448]
步骤b:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲腈(60.0毫克,0.18毫摩尔)在dcm(2毫升)中的搅拌溶液/混合物中加入bbr3(0.130克,0.53毫摩尔)。反应在室温下搅拌4小时,在0℃下用水(3毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在5.5分钟内由20%b至50%b;检测器:uv 210nm;保留时间:5.65分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物228((2r,8as)-2-(2,3-二氯-6-羟苯基)-5-氧代-八氢吲哚嗪-7-甲腈异构体1)(9.00毫克,16%):对c
15h14
cl2n2o2计算的lcms(esi)[m+h]
+
:325,327(3:2),实测325,327(3:2);1h nmr(400mhz,cd3od)δ7.26(d,j=8.8hz,1h),6.76(d,j=8.8hz,1h),4.39-4.26(m,1h),4.17(dd,j=11.7,9.0hz,1h),4.10-3.99(m,1h),3.65-3.54(m,1h),3.54-3.47(m,1h),2.76(dd,j=18.2,7.1hz,1h),2.66(d,j=18.1hz,1h),2.50-2.36(m,2h),2.30-2.21(m,1h),1.85-1.75(m,1h)。
[0449]
实施例80.化合物229((2r,8as)-2-(2,3-二氯-6-羟苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酰胺)步骤a:在0℃下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲腈(实施例79,步骤a)(0.500克,1.47毫摩尔)在meoh(5毫升)中的搅拌溶液中逐滴加入socl2(5毫升)。反应在室温下搅拌1小时并用水(1毫升)和饱和nahco3水溶液(1毫升)猝灭,随后用ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用45%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色固体的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酸甲酯(0.250克,46%):对c
17h19
cl2no4计算的lcms(esi)[m+h]
+
372,374(3:2),实测372,374(3:2);1h nmr(400mhz,cdcl3)δ7.34(dd,j=8.9,1.2hz,1h),6.77(dd,j
=8.9,1.5hz,1h),4.26-4.05(m,2h),3.82(d,j=1.0hz,3h),3.77(d,j=3.7hz,3h),3.75-3.64(m,1h),3.62-3.53(m,1h),3.15-3.06(m,1h),2.94(d,j=17.9hz,1h),2.68-2.46(m,2h),2.24-2.14(m,2h),1.79-1.67(m,1h)。
[0450]
步骤b:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酸甲酯(90.0毫克,0.24毫摩尔)在meoh(2毫升)和h2o(1毫升)中的搅拌溶液中加入lioh
·
h2o(51.0毫克,1.21毫摩尔)。反应在40℃下搅拌1小时,用hcl水溶液(10%)酸化至ph4,随后用dcm(3
×
30毫升)萃取。合并的有机层在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色固体的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酸(70.0毫克,粗),其不经提纯直接用于下一步骤:对c
16h17
cl2no4计算的lcms(esi)[m+h]
+
358,360(3:2),实测358,360(3:2);1h nmr(400mhz,cd3od)δ7.42(dd,j=8.9,2.3hz,1h),7.00(dd,j=9.0,2.2hz,1h),4.36-4.22(m,1h),4.03(dd,j=11.9,8.2hz,1h),3.85(d,j=2.5hz,3h),3.78-3.67(m,1h),3.55-3.44(m,1h),3.16-3.08(m,1h),2.83-2.74(m,1h),2.59-2.47(m,2h),2.29-2.10(m,2h),1.85-1.71(m,1h)。
[0451]
步骤c:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酸(40.0毫克,0.11毫摩尔)在dcm(2毫升)中的搅拌溶液中加入bbr3(0.280克,1.12毫摩尔)。反应在室温下搅拌1小时,用h2o(2毫升)猝灭并在减压下蒸发。残余物通过用35%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供粗产物,其随后通过制备hplc采用以下条件来提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.1%fa),流动相b:acn;流速:20ml/min;梯度:在6.5分钟内由35%b至60%b;检测器:uv 210nm;保留时间:6.54分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物229(2r,8as)-2-(2,3-二氯-6-羟苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酸(20.0毫克,52%):对c
15h15
cl2no4计算的lcms(esi)[m+h]
+
344,346(3:2),实测344,346(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.77(d,j=8.7hz,1h),4.35-4.02(m,2h),3.88-3.72(m,1h),3.62-3.45(m,1h),3.03-2.88(m,1h),2.74-2.58(m,1h),2.58-2.33(m,3h),2.23-2.00(m,1h),1.58-1.50(m,1h)。
[0452]
实施例81.化合物230((2r,8as)-2-(2,3-二氯-6-羟苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酰胺异构体1)和化合物231((2r,8as)-2-(2,3-二氯-6-羟苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酰胺异构体2)
步骤a:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酸(实施例80,步骤b)(50.0毫克,0.14毫摩尔)和hatu(0.110克,0.28毫摩尔)在dmf(3毫升)中的搅拌溶液中加入nh4cl(37.0毫克,0.70毫摩尔)。反应在室温下搅拌1小时,并用水(20毫升)稀释,随后用ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用43%在水中的acn(加0.1%fa)洗脱的反相色谱法提纯以提供作为灰白色固体的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酰胺(30.0毫克,60%):对c
16h18
cl2n2o3计算的lcms(esi)[m+h]
+
357,359(3:2),实测357,359(3:2);步骤b:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酰胺(35.0毫克,0.10毫摩尔)在dcm(2毫升)中的搅拌溶液中加入bbr3(0.150克,0.59毫摩尔)。反应在室温下搅拌1小时,用meoh(2毫升)猝灭,并在减压下浓缩。残余物通过用40%在水中的acn(加0.1%fa)洗脱的反相色谱法提纯以提供粗产物,其随后通过制备hplc采用以下条件来提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.1%fa),流动相b:acn;流速:20ml/min;梯度:在5.5分钟内由15%b至35%b;检测器:uv 210nm;保留时间:5.6分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的(2r,8as)-2-(2,3-二氯-6-羟苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酰胺(17.5毫克,52%):对c
15h16
cl2n2o3计算的lcms(esi)[m+h]
+
343,345(3:2),实测343,345(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.77(d,j=8.7hz,1h),4.34-4.05(m,2h),3.89-3.74(m,1h),3.59-3.47(m,1h),2.98-2.79(m,1h),2.60-2.51(m,2h),2.46-2.12(m,3h),1.68-1.52(m,1h)。
[0453]
步骤c:(2r,8as)-2-(2,3-二氯-6-羟苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酰胺(15.0毫克,0.04毫摩尔)通过制备手性hplc采用以下条件分离:柱:chiralpak ig,20
×
250mm,5μm;流动相a:hex(加0.1%fa)-hplc,流动相b:etoh-hplc;流速:20ml/min;梯度:在16分钟内由50%b至50%b;检测器:uv 224nm;保留时间1:5.00分钟;保留时间2:11.91分钟。获得在5.00分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物230((2r,8as)-2-(2,3-二氯-6-羟苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酰胺异构体1)(6.00毫克,40.00%):对c
15h16
cl2n2o3计算的lcms(esi)[m+h]
+
343,345(3:2),实测343,345(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.78(d,j=8.8hz,1h),4.26-4.05(m,3h),3.68-3.52(m,1h),2.92-2.81(m,1h),2.55(d,j=8.7hz,2h),2.48-2.38(m,1h),2.32-2.24(m,1h),2.14-2.03(m,1h),1.63-1.55(m,1h)。获得在11.91分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物231((2r,8as)-2-(2,3-二氯-6-羟苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酰胺异构体1)(1.40毫克,9.33%):对c
15h16
cl2n2o3计算的lcms(esi)[m+h]
+
343,345(3:2),实测343,345(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.75(d,j=8.8hz,1h),4.33-4.16(m,1h),4.16-4.07(m,1h),3.86-3.72(m,1h),3.56-3.45(m,1h),2.94-2.80(m,1h),2.56(d,j=8.3hz,2h),2.44-2.28(m,2h),2.24-2.12(m,1h),1.65-1.55(m,1h)。
[0454]
实施例81.以类似于对化合物230-231所描述的方式制备化合物232-236。
[0455]
实施例82.化合物237((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-(羟甲基)六氢吲哚嗪-5(1h)-酮异构体1)和化合物238((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-(羟甲基)六氢吲哚嗪-5(1h)-酮异构体2)步骤a:在室温下在氮气气氛下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-2,3,8,8a-四氢-1h-吲哚嗪-7-基三氟甲磺酸酯(0.260克,0.565毫摩尔)和zn(cn)2(66.0毫克,0.57毫摩尔)在dmf(4毫升)中的搅拌溶液中加入pd(pph3)4(65.0毫克,0.06毫摩尔)。反应在90℃下搅拌16小时,冷却至室温并用nahco3(20毫升)稀释,随后用ea(3
×
30毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(2/1)洗脱的硅胶柱色谱法提纯以提供作为灰白色固体的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-2,3,8,8a-四氢-1h-吲哚嗪-7-甲腈(0.150克,79%):对c
16h14
cl2n2o2计算的lcms(esi)[m+h]
+
337,339(3:2),实测337,339(3:2);1h nmr(400mhz,cd3od)δ7.38(dd,j=8.9,4.0hz,1h),6.80(d,j=9.0hz,1h),6.62(dd,j=8.6,3.0hz,1h),4.42-4.18(m,1h),4.12-3.95(m,2h),3.84(d,j=5.1hz,3h),3.81-3.67(m,1h),2.79-2.65(m,1h),2.60-2.39(m,2h),2.36-2.07(m,1h)。
[0456]
步骤b:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-2,3,8,8a-四氢-1h-吲哚嗪-7-甲腈(65.0毫克,0.19毫摩尔)在meoh(2毫升)中的搅拌溶液中加入socl2(2毫升)。反应在室温下搅拌16小时,用饱和nahco3水溶液(20毫升)猝灭,并用ea(3
×
30毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(1/1)洗脱的硅胶柱色谱法提纯以提供作为浅黄色半固体的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-2,3,8,8a-四氢-1h-吲哚嗪-7-甲酸甲酯(50.0毫克,70%):对c
17h17
cl2no4计算的lcms(esi)[m+h]
+
370,372(3:2),实测370,372(3:2);1h nmr(400mhz,cd3od)δ7.48-7.41(m,1h),7.02(d,j=9.0hz,1h),6.71(d,j=3.0hz,1h),4.48-4.24(m,1h),4.15-3.91(m,2h),3.91-3.82(m,6h),3.76-3.64(m,1h),3.06(dd,j=17.4,5.0hz,1h),2.56-2.18(m,3h)。
[0457]
步骤c:
在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-2,3,8,8a-四氢-1h-吲哚嗪-7-甲酸甲酯(50.0毫克,0.14毫摩尔)在meoh(1毫升)中的搅拌溶液中加入pto2(31.0毫克,0.14毫摩尔)。反应在氢气气氛(1.5atm)下搅拌1小时。将所得混合物过滤,并且滤液在减压下浓缩以提供作为无色油的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酸甲酯(50.0毫克,99%):对c
17h19
cl2no4计算的lcms(esi)[m+h]
+
372,374(3:2),实测372,374(3:2);1h nmr(400mhz,cdcl3)δ7.35(dd,j=8.9,2.6hz,1h),6.76(d,j=9.0hz,1h),4.21(q,j=9.2hz,1h),4.14-4.05(m,1h),3.82(s,3h),3.76(d,j=1.7hz,3h),3.73-3.66(m,1h),3.61-3.51(m,1h),2.96-2.83(m,1h),2.82-2.72(m,1h),2.67-2.54(m,1h),2.50-2.39(m,1h),2.26-2.15(m,2h),1.68-1.61(m,1h)。
[0458]
步骤d:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酸甲酯(60.0毫克,0.16毫摩尔)在meoh(3毫升)中的搅拌溶液中逐份加入nabh4(0.180克,4.84毫摩尔)。反应搅拌16小时,用饱和nh4cl水溶液(20毫升)猝灭,并用ea(3
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用34%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色半固体的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-(羟甲基)-六氢-1h-吲哚嗪-5-酮(40.0毫克,72%):对c
16h19
cl2no3计算的lcms(esi)[m+h]
+
344,346(3:2),实测344,346(3:2);1h nmr(400mhz,cd3od)δ7.40(d,j=9.0hz,1h),6.97(d,j=9.1hz,1h),4.44-4.15(m,1h),4.07-3.94(m,1h),3.94-3.68(m,5h),3.57-3.37(m,2h),2.60-2.29(m,1h),2.29-1.91(m,5h),1.29-1.15(m,1h)。
[0459]
步骤e:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-(羟甲基)-六氢-1h-吲哚嗪-5-酮(35.0毫克,0.10毫摩尔)在dcm(2毫升)中的搅拌溶液中加入bbr3(0.250克,1.02毫摩尔)。反应在室温下搅拌2小时,用meoh(1毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.1%fa),流动相b:acn;流速:20ml/min;梯度:在5.5分钟内由38%b至50%b;检测器:uv 210nm;保留时间:5.56分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的(2r,8as)-2-(2,3-二氯-6-羟苯基)-7-(羟甲基)-六氢-1h-吲哚嗪-5-酮(15.7毫克,46%):对c
15h17
cl2no3计算的lcms(esi)[m+h]
+
330,332(3:2),实测330,332(3:2);1h nmr(400mhz,cd3od)δ7.25(dd,j=8.6,1.8hz,1h),6.75(dd,j=8.7,1.9hz,1h),4.32-4.20(m,1h),4.20-4.07(m,1h),3.84-3.70(m,1h),3.60-3.45(m,3h),2.55-2.31(m,2h),2.28-2.04(m,4h),1.35-1.18(m,1h)。
[0460]
步骤f:产物(2r,8as)-2-(2,3-二氯-6-羟苯基)-7-(羟甲基)-六氢-1h-吲哚嗪-5-酮(15.0毫克,0.05毫摩尔)通过制备手性hplc采用以下条件来分离:柱:chiralpak id-2,2
×
25cm,5μm;流动相a:hex(加0.1%fa)-hplc,流动相b:ipa-hplc;流速:20ml/min;梯度:在24分钟内由20%至20%;检测器:uv 220/254nm;保留时间1:8.61分钟;保留时间2:14.51分钟。获得在8.61分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物238((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-(羟甲基)-六氢-1h-吲哚嗪-5-酮异构体1)(1毫克,6.67%):对c15
h17cl2no3计算的lcms(esi)[m+h]
+
:330,332(3:2),实测330,332(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.7hz,1h),6.76(d,j=8.8hz,1h),4.35-4.01(m,3h),3.73-3.42(m,3h),2.56-2.30(m,2h),2.30-1.97(m,4h),1.25-1.10(m,1h)。获得在14.51分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物238((2r,8as)-2-(2,3-二氯-6-羟苯基)-7-(羟甲基)-六氢-1h-吲哚嗪-5-酮异构体2)(5.6毫克,37.33%):对c
15h17
cl2no3计算的lcms(esi)[m+h]
+
:330,332(3:2),实测330,332(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.7hz,1h),6.75(d,j=8.8hz,1h),4.33-4.20(m,1h),4.17-4.08(m,1h),3.84-3.70(m,1h),3.59-3.45(m,3h),2.56-2.31(m,2h),2.28-2.05(m,4h),1.38-1.19(m,1h)。
[0461]
实施例83.化合物239((2r,8ar)-2-(2,3-二氯-6-羟苯基)-7-[(甲基氨基)甲基]-六氢-1h-吲哚嗪-5-酮异构体1)步骤a:在0℃下在空气气氛下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲腈异构体1(0.400克,1.179毫摩尔)在meoh(8毫升)中的搅拌溶液中逐滴加入socl2(4.00毫升,13.785毫摩尔)。所得混合物搅拌1小时,用水(1毫升)和nahco3(1毫升)猝灭,并用etoac(3
×
10毫升)萃取。合并的有机层用盐水(3
×
5毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用45%在0.05%tfa水溶液中的can洗脱的反相色谱法提纯以提供作为黄色固体的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酸甲酯异构体1(250毫克,56.96%)。对c
17h19
cl2no4计算的lcms(esi)[m+h]
+
372,374(3:2),实测372,374(3:2);1h nmr(300mhz,cdcl3)δ7.34(d,j=8.9hz,1h),6.76(d,j=8.9hz,1h),4.27-3.97(m,2h),3.81(s,3h),3.77(s,3h),3.74-3.63(m,1h),3.63-3.53(m,1h),3.14-3.05(m,1h),2.93(d,j=17.7hz,1h),2.65-2.45(m,2h),2.26-2.13(m,2h),1.79-1.64(m,1h)。
[0462]
步骤b:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲酸甲酯异构体1(0.200克,0.54毫摩尔)在meoh(3毫升)中的搅拌溶液中加入nabh4(41.0毫克,1.07毫摩尔)。反应在室温下搅拌6小时,用饱和nh4cl水溶液(20毫升)猝灭,随后用ea(2
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用40%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为灰白色固体的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-(羟甲基)-六氢-1h-吲哚嗪-5-酮异构体1(0.150克,48%):对c
16h19
cl2no3计算的lcms(esi)[m+h]
+
:344,346(3:
2),实测344,346(3:2);1h nmr(300mhz,cdcl3)δ7.35(d,j=8.9hz,1h),6.77(d,j=9.0hz,1h),4.30-4.08(m,3h),3.82(s,3h),3.70(d,j=6.7hz,2h),3.63-3.51(m,1h),2.65(dd,j=17.6,6.5hz,1h),2.43(d,j=19.0hz,1h),2.38-2.10(m,4h),1.74-1.59(m,1h)。
[0463]
步骤c:在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-7-(羟甲基)-六氢-1h-吲哚嗪-5-酮异构体1(0.150克,0.20毫摩尔)在dcm(1毫升)中的搅拌溶液中加入dess-martin氧化剂(0.350克,0.42毫摩尔)。反应在室温下搅拌2小时,用饱和na2s2o3水溶液(20毫升)猝灭,随后用ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为黄色油的(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲醛异构体1(0.130克,粗),其不经进一步提纯直接用于下一步骤:对c
16h17
cl2no3计算的lcms(esi)[m+h]
+
:342,344(3:2),实测342,344(3:2)。
[0464]
步骤d:
1.在室温下向(2r,8as)-2-(2,3-二氯-6-甲氧基苯基)-5-氧代-六氢-1h-吲哚嗪-7-甲醛异构体1(0.130克,0.21毫摩尔)和甲胺(25.0毫克,0.41毫摩尔)在dcm(1毫升)中的搅拌溶液中加入acoh(24.0毫克,0.20毫摩尔)和nabh(aco)3(0.260克,0.61毫摩尔)。反应搅拌2小时,并用饱和na2s2o3水溶液(20毫升)猝灭,随后用ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用40%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色油的(2r,8ar)-2-(2,3-二氯-6-甲氧基苯基)-7-[(甲基氨基)甲基]-六氢-1h-吲哚嗪-5-酮异构体1(20.0毫克,16%):对c
17h22
cl2n2o2计算的lcms(esi)[m+h]
+
:357,359(3:2),实测357,359(3:2):1h nmr(400mhz,cdcl3)δ7.35(d,j=8.9hz,1h),6.77(d,j=8.9hz,1h),4.31-4.17(m,1h),4.17-4.03(m,1h),3.86-3.71(m,4h),3.62-3.50(m,1h),3.24-2.91(m,2h),2.82(s,3h),2.76-2.47(m,1h),2.41-2.11(m,5h),1.38-1.24(m,1h)。
[0465]
步骤e:在室温下向(2r,8ar)-2-(2,3-二氯-6-甲氧基苯基)-7-[(甲基氨基)甲基]-六氢-1h-吲哚嗪-5-酮异构体1(20.0毫克,0.06毫摩尔)在dcm(1毫升)中的搅拌溶液中加入bbr3(0.05毫升,0.53毫摩尔)。反应在室温下搅拌1小时并用meoh(1毫升)猝灭。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在6.5分钟内由20%至40%;检测器:uv 254/220nm;保留时间:6.54分钟。收集含有所需产物的级分并在减压下浓缩以提供作为浅黄色固体的化合物239((2r,8ar)-2-(2,3-二氯-6-羟苯基)-7-[(甲基氨基)甲基]-六氢-1h-吲哚嗪-5-酮异构体1)(6.10毫克,32%):对c
16h20
cl2n2o2计算的lcms(esi)[m+h]
+
:343,345(3:2),实测343,345(3:2);1h nmr(400mhz,cd3od)δ7.26(d,j=9.0hz,1h),6.76(d,j=9.0hz,1h),4.35-4.22(m,1h),4.22-4.07(m,1h),3.90-3.73(m,1h),3.60-3.45(m,1h),3.22-3.11(m,1h),3.06(d,j=6.8hz,1h),2.78(d,j=2.7hz,3h),2.68-2.47(m,1h),2.46-1.95(m,5h),1.89-1.26(m,1h)。
[0466]
实施例84.以类似于对化合物239所描述的方式制备化合物240-243。
[0467]
实施例85.化合物244((6r,7ar)-6-(2,3-二氯-6-羟苯基)-六氢吡咯里嗪-3-酮)在室温下向(6r,7ar)-6-(2,3-二氯-6-甲氧基苯基)-六氢吡咯里嗪-3-酮(中间体18,实施例16)(50.0毫克,0.17毫摩尔)在dcm(2毫升)中的溶液中加入bbr3(0.10毫升,1.06毫摩尔)。反应随后在室温下搅拌1小时,在0℃下用meoh(2毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.1%fa),流动相b:acn;流速:20ml/min;梯度:在5.5分钟内由40%b至90%b;检测器:uv 254/210nm;保留时间:5.50分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物244((6r,7ar)-6-(2,3-二氯-6-羟苯基)-六氢吡咯里嗪-3-酮)(12.8毫克,27%):对c
13h13
cl2no2计算的lcms(esi)[m+h]
+
:286,288(3:2),实测286,288(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.75(d,j=8.7hz,1h),4.56-4.41(m,1h),4.25-4.09(m,1h),3.94(dd,j=11.1,7.7hz,1h),3.31-3.21(m,1h),2.87-2.71(m,1h),2.58-2.47(m,1h),2.45-2.34(m,1h),2.20-2.02(m,2h),1.98-1.85(m,1h)。
[0468]
实施例86.化合物245((6r7as)-6-(2,3-二氯-6-羟苯基)-2-羟基-六氢吡咯里嗪-3-酮异构体1)和化合物246((6r,7as)-6-(2,3-二氯-6-羟苯基)-2-羟基-六氢吡咯里嗪-3-酮异构体2)
羟基-六氢吡咯里嗪-3-酮异构体1)(9.30毫克,29%):对c
13h13
cl2no3计算的lcms(esi)[m+h]
+
:302,304(3:2),实测302,304(3:2);1h nmr(300mhz,cd3od)δ7.24(d,j=8.7hz,1h),6.74(d,j=8.8hz,1h),4.60-4.35(m,2h),4.31-4.12(m,1h),3.92(dd,j=11.4,7.4hz,1h),3.42-3.35(m,1h),2.30-2.09(m,3h),2.00-1.95(m,1h)。获得在6.74分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物246((6r,7as)-6-(2,3-二氯-6-羟苯基)-2-羟基-六氢吡咯里嗪-3-酮异构体2)(9.40毫克,30%):对c
13h13
cl2no3计算的lcms(esi)[m+h]
+
:302,304(3:2),实测302,304(3:2);1h nmr(300mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.76(d,j=8.8hz,1h),4.74-4.59(m,1h),4.58-4.40(m,1h),4.09-3.84(m,2h),3.31-3.20(m,1h),2.87-2.73(m,1h),2.28-2.03(m,2h),1.83-1.67(m,1h)。
[0471]
实施例87.化合物247((6r,7as)-6-(2,3-二氯-6-羟苯基)-2-(羟甲基)-六氢吡咯里嗪-3-酮)步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基吡咯烷-1-甲酸叔丁酯(1.00克,2.67毫摩尔)、米氏酸(0.390克,2.67毫摩尔)和2,6-二甲基-1,4-二氢-3,5-吡啶二羧酸二乙酯(etidin)(0.680克,2.67毫摩尔)在mecn(10毫升)中的搅拌溶液中加入l-脯氨酸(31.0毫克,0.27毫摩尔)。反应在室温下搅拌4小时,在减压下浓缩,用meoh(10毫升)稀释并过滤。滤饼用meoh(2
×
10毫升)洗涤。滤液在减压下浓缩。残余物通过用60%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[(2,2-二甲基-4,6-二氧代-1,3-二氧杂环己烷-5-基)甲基]吡咯烷-1-甲酸叔丁酯(1.20克,89%):对c
23h29
cl2no7计算的lcms(esi)[m+h]
+
:502、504(3:2),实测502、504(3:2);1h nmr(400mhz,cdcl3)δ7.35(d,j=8.9hz,1h),6.79(d,j=8.9hz,1h),4.91-4.81(m,1h),4.57-4.41(m,1h),4.10-3.94(m,1h),3.91(s,3h),3.86-3.73(m,2h),2.68-2.40(m,2h),2.28-2.13(m,2h),1.84(d,j=35.4hz,6h),1.46(s,9h)。
[0472]
步骤b:将(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[(2,2-二甲基-4,6-二氧代-1,3-二氧杂环己烷-5-基)甲基]吡咯烷-1-甲酸叔丁酯(0.770克,1.53毫摩尔)和tfa(1毫升)在dcm(4毫升)中的溶液在室温下搅拌1小时并在减压下浓缩。残余物溶解在etoh(5毫升)中并用tea碱化至ph 8。所得混合物在80℃下搅拌1小时并在减压下浓缩。残余物通过用40%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-六氢吡咯里嗪-2-甲酸(0.440克,83%):对c
15h15
cl2no4计算
的lcms(esi)[m+h]
+
:344,346(3:2),实测344,346(3:2);1h nmr(300mhz,cdcl3)δ7.39-7.29(m,1h),6.77(d,j=8.8hz,1h),4.52(dd,j=17.6,10.1hz,1h),4.18-4.01(m,1h),4.00-3.85(m,1h),3.85-3.61(m,4h),3.40-3.22(m,1h),2.90-2.66(m,1h),2.43-2.10(m,2h),2.01-1.72(m,1h)。
[0473]
步骤c:将(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-六氢吡咯里嗪-2-甲酸(0.440克,1.28毫摩尔)、氯甲酸2-甲基丙酯(0.350克,2.56毫摩尔)和4-甲基吗啉(0.260克,2.56毫摩尔)在dme(5毫升)中的溶液在氮气气氛下在0℃下搅拌1小时。在室温下向上述混合物中加入nabh4(97.0毫克,2.56毫摩尔)。所得混合物搅拌附加的16小时并用饱和nh4cl水溶液(20毫升)猝灭。所得混合物用ea(3
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用40%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-2-(羟甲基)-六氢吡咯里嗪-3-酮(93毫克,22%):对c
15h17
cl2no3计算的lcms(esi)[m+h]
+
:330,332(3:2),实测330,332(3:2)。
[0474]
步骤d:将(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-2-(羟甲基)-六氢吡咯里嗪-3-酮(90.0毫克,0.27毫摩尔)和bbr3(0.13毫升,1.38毫摩尔)在dcm(3毫升)中的溶液在室温下搅拌20分钟,在0℃下用meoh(2毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x bridge shield rp18 obd column,19
×
250mm,10μm;流动相a:水(加10mm nh4hco3),流动相b:acn;流速:20ml/min;梯度:在5.5分钟内由45%b至50%b;检测器:uv 210nm;保留时间:5.55分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物247((6r,7as)-6-(2,3-二氯-6-羟苯基)-2-(羟甲基)-六氢吡咯里嗪-3-酮)(43.5毫克,50%):对c
14h15
cl2no3计算的lcms(esi)[m+h]
+
:316,318(3:2),实测316,318(3:2);1h nmr(400mhz,cd3od)δ7.23(d,j=8.9hz,1h),6.74(d,j=8.7hz,1h),4.54-4.37(m,1h),4.18-4.04(m,1h),3.99-3.91(m,1h),3.86(td,j=10.2,9.7,4.9hz,1h),3.79-3.69(m,1h),3.31-3.23(m,1h),3.11-2.78(m,1h),2.60-2.31(m,1h),2.22-1.77(m,3h)。
[0475]
实施例88.化合物248((6r,7as)-2-氨基-6-(2,3-二氯-6-羟苯基)-六氢吡咯里嗪-3-酮异构体1)和化合物249((6r,7as)-2-氨基-6-(2,3-二氯-6-羟苯基)-六氢吡咯里嗪-3-酮异构体2)步骤a:在室温下在氮气气氛下向(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-六氢
吡咯里嗪-2-甲酸(0.400克,1.16毫摩尔)在甲苯(4毫升)中的搅拌溶液中加入tea(0.65毫升,6.39毫摩尔)和dppa(1毫升,3.65毫摩尔)。反应在100℃下搅拌2小时。在室温下向反应混合物中逐滴加入苄醇(4毫升)。所得混合物在100℃下搅拌附加的2小时。所得混合物用水(20毫升)稀释,随后用dcm(3
×
20毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用ea/pe(1/1)和dcm洗脱的硅胶柱色谱法提纯以提供作为灰白色固体的n-[(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-六氢吡咯里嗪-2-基]氨基甲酸苄酯(60.0毫克,11%):对c
22h22
cl2n2o4计算的lcms(esi)[m+h]
+
:449,451(3:2),实测449,451(3:2)。1h nmr(400mhz,cdcl3)δ7.46-7.31(m,6h),6.77(d,j=8.9hz,1h),5.53(s,1h),5.16(s,2h),4.54(d,j=46.9hz,2h),4.08-3.87(m,2h),3.81(s,3h),3.41-3.23(m,1h),3.13-2.98(m,1h),2.32-2.14(m,1h),2.01-1.84(m,1h),1.84-1.69(m,1h)。
[0476]
步骤b:将n-[(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-六氢吡咯里嗪-2-基]氨基甲酸苄酯(50.0毫克,0.11毫摩尔)和bbr3(0.05毫升,0.53毫摩尔)在dcm(1毫升)中的溶液在室温下搅拌1小时,在0℃下用meoh(2毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在5.5分钟内由20%b至50%b;检测器:uv 210nm;保留时间:5.56分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的(6r,7as)-2-氨基-6-(2,3-二氯-6-羟苯基)-六氢吡咯里嗪-3-酮(16.0毫克,34%):对c
13h14
cl2n2o2计算的lcms(esi)[m+h]
+
:301,303(3:2),实测301,303(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.78(d,j=8.8hz,1h),4.63-4.45(m,1h),4.42(dd,j=11.6,7.8hz,1h),4.23-4.10(m,1h),4.10-4.05(m,1h),3.45-3.35(m,1h),2.94-2.83(m,1h),2.55-2.15(m,2h),2.03-1.87(m,1h)。
[0477]
步骤c:(6r,7as)-2-氨基-6-(2,3-二氯-6-羟苯基)-六氢吡咯里嗪-3-酮(14.0毫克,0.03毫摩尔)通过制备手性hplc采用以下条件来分离:柱:chiralpak ie,2
×
25cm,5μm;流动相a:hex/dcm=3/1(加10mm nh
3-meoh)-hplc,流动相b:etoh-hplc;流速:20ml/min;梯度:在9分钟内由20%b至20%b;检测器:uv 220/254nm;保留时间1:5.13分钟;保留时间2:6.76分钟;注射体积:1ml;运行数量:2。获得在5.13分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物248((6r,7as)-2-氨基-6-(2,3-二氯-6-羟苯基)-六氢吡咯里嗪-3-酮异构体1)(0.7毫克,7%):对c
13h14
cl2n2o2计算的lcms(esi)[m+h]
+
:301,303(3:2),实测301,303(3:2);1h nmr(400mhz,cd3od)δ7.23(d,j=8.8hz,1h),6.73(d,j=8.7hz,1h),4.56-4.40(m,1h),4.22-4.11(m,1h),3.92(dd,j=11.3,7.0hz,1h),3.71(dd,j=8.9,4.4hz,1h),3.37-3.33(m,1h),2.32-2.22(m,1h),2.18-2.07(m,2h),2.02-1.96(m,1h)。获得在6.76分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物249((6r,7as)-2-氨基-6-(2,3-二氯-6-羟苯基)-六氢吡咯里嗪-3-酮异构体2)(3.3毫克,32.50%):对c
13h14
cl2n2o2计算的lcms(esi)[m+h]
+
:301,303(3:2),实测301,303(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.76(d,j=8.8hz,1h),4.57-4.43(m,1h),4.06-3.86(m,3h),3.30-3.23(m,1h),2.82-2.67(m,1h),2.23-2.04(m,2h),1.69-1.60(m,1h)。
[0478]
实施例89.化合物250((8r,9as)-8-(2,3-二氯-6-羟苯基)-2-羟基-八氢喹嗪-4-酮)步骤a:在-78℃下在氮气气氛下向1,3-二噻烷-2-基膦酸二乙酯(1.98克,7.73毫摩尔)在thf(30毫升)中的搅拌溶液中逐滴加入n-buli(3.14毫升,7.854毫摩尔,2.5m在己烷中)。反应在-78℃下搅拌1小时。随后,加入(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基哌啶-1-甲酸叔丁酯(中间体10,实施例8)(2.50克,6.44毫摩尔)。反应在-78℃至-30℃下搅拌附加的1小时,用水(30毫升)猝灭并用ea(3
×
30毫升)萃取。合并的有机层用盐水(3
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(3/1)洗脱的硅胶柱色谱法提纯以提供作为黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(1,3-二噻烷-2-亚基甲基(dithian-2-ylidenemethyl))哌啶-1-甲酸叔丁酯(2.20克,63%):对c
22h29
cl2no3s2计算的lcms(esi)[m+h]
+
:490,492(3:2),实测490,492(3:2);1h nmr(400mhz,cdcl3)δ6.74(d,j=8.9hz,1h),6.01(d,j=7.9hz,1h),4.73-4.62(m,1h),3.87-3.76(m,5h),3.74-3.60(m,1h),3.49-3.37(m,1h),3.02-2.85(m,3h),2.88-2.75(m,1h),2.39-2.24(m,1h),2.23-2.12(m,2h),1.99-1.87(m,2h),1.68-1.62(m,1h),1.52(s,9h)。
[0479]
步骤b:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(1,3-二噻烷-2-亚基甲基)哌啶-1-甲酸叔丁酯(1.20克,2.45毫摩尔)在meoh(10毫升)中的搅拌溶液中加入cuso4·
5h2o(3.05克,12.23毫摩尔)。反应在65℃下搅拌1小时。将所得混合物过滤,并且滤饼用meoh(2
×
5毫升)洗涤。滤液在减压下浓缩。残余物通过用pe/ea(3/1)洗脱的硅胶柱色谱法提纯以提供作为浅黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(2-甲氧基-2-氧代乙基)哌啶-1-甲酸叔丁酯(0.540克,46%):对c
20h27
cl2no5计算的lcms(esi)[m+h]
+
:432,434(3:2),实测432,434(3:2);1h nmr(400mhz,cd3od)δ7.38(d,j=8.9hz,1h),6.97(d,j=9.0hz,1h),4.20-4.06(m,1h),3.87(s,3h),3.81-3.74(m,1h),3.70-3.52(m,4h),3.47-3.36(m,1h),2.80-2.56(m,2h),2.51-2.37(m,1h),1.99-1.85(m,2h),1.73-1.63(m,1h),1.51(s,9h)。
[0480]
步骤c:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(2-甲氧基-2-氧代乙基)哌啶-1-甲酸叔丁酯(0.540克,1.25毫摩尔)在meoh(4毫升)和h2o(2毫升)中的搅拌溶液中加入lioh
·
h2o(0.100克,2.50毫摩尔)。反应在40℃下搅拌1小时。所得混合物用柠檬酸酸化至ph 5,随后用ea(3
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为黄色油的[(2s,4r)-1-(叔丁氧基羰基)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]乙酸(0.500克,粗),其不经提纯直接用于下一步骤:对c
19h25
cl2no5计算的lcms(esi)[m+h]
+
:418,420(3:2),实测418,420(3:2)。
[0481]
步骤d:在室温下向[(2s,4r)-1-(叔丁氧基羰基)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]乙酸(0.500克,1.20毫摩尔)和米氏酸(0.260克,1.79毫摩尔)在dcm(5毫升)中的搅拌溶液中加入dmap(0.220克,1.79毫摩尔)和edci(0.340克,1.79毫摩尔)。反应搅拌1小时。所得混合物用hcl水溶液(1m,2
×
20毫升)洗涤。有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物溶解在etoh(5毫升)中,在90℃下搅拌1小时并在减压下浓缩。残余物通过用75%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(4-乙氧基-2,4-二氧代丁基)哌啶-1-甲酸叔丁酯(0.360克,两个步骤总计为59%):对c
23h31
cl2no6计算的lcms(esi)[m+h]
+
:488,490(3:2),实测488,490(3:2);1h nmr(400mhz,cdcl3)δ7.31(d,j=8.9hz,1h),6.74(d,j=8.9hz,1h),4.28-4.04(m,3h),3.83(s,3h),3.71-3.63(m,2h),3.53-3.41(m,3h),3.11(dd,j=16.3,5.1hz,1h),2.82(dd,j=16.2,7.7hz,1h),2.42-2.23(m,1h),2.02-1.79(m,3h),1.52(s,9h),1.35-1.24(m,3h)。
[0482]
步骤e:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(4-乙氧基-2,4-二氧代丁基)哌啶-1-甲酸叔丁酯(0.340克,0.70毫摩尔)在dcm(4毫升)中的搅拌溶液中逐滴加入tfa(1毫升)。反应搅拌1小时并在减压下浓缩。随后,在室温下向在meoh(3.5毫升)中的残余物中加入k2co3(0.480克,3.48毫摩尔)并搅拌附加的1小时。所得混合物用水(20毫升)稀释,随后用ea(3
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩,残余物通过用45%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-六氢-1h-喹嗪-2,4-二酮(87.0毫克,33%):对c
16h17
cl2no3计算的lcms(esi)[m+h]
+
:342,344(3:2),实测342,344(3:2);1h nmr(400mhz,cd3od)δ7.39(d,j=9.0hz,1h),6.96(d,j=9.0hz,1h),4.74(d,j=9.9hz,1h),3.84(d,j=5.7hz,3h),3.76-3.62(m,2h),3.48-3.34(m,2h),2.72-2.58(m,1h),2.44-2.20(m,3h),1.84-1.52(m,3h)。
[0483]
步骤f:在室温下向(8r,9as)-8-(2,3-二氯-6-甲氧基苯基)-六氢-1h-喹嗪-2,4-二酮(86.0毫克,0.25毫摩尔)在dcm(1毫升)中的搅拌溶液中加入bbr3(0.24毫升,0.95毫摩尔)。反应搅拌1小时,在0℃下用水(5毫升)猝灭并用ea(3
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为黄色油的(8r,9as)-8-(2,3-二氯-6-羟苯基)-六氢-1h-喹嗪e-2,4-二酮(60.0毫克,粗),其不经提
纯直接用于下一步骤:对c
15h15
cl2no3计算的lcms(esi)[m+h]
+
:328,330(3:2),实测328,330(3:2)。
[0484]
步骤g:在室温下向(8r,9as)-8-(2,3-二氯-6-羟苯基)-六氢-1h-喹嗪-2,4-二酮(60.0毫克,0.18毫摩尔)在thf(1毫升)中的搅拌混合物中加入nabh4(14.0毫克,0.37毫摩尔)。反应在室温下搅拌1小时。所得混合物在0℃下用饱和nh4cl水溶液(20毫升)猝灭,随后用ea(3
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.1%fa),流动相b:acn;流速:20ml/min;梯度:在5.5分钟内由35%b至65%b;检测器:uv 210nm;保留时间:5.57分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物250((8r,9as)-8-(2,3-二氯-6-羟苯基)-2-羟基-八氢喹嗪-4-酮)(19.0毫克,31%):对c
15h17
cl2no3计算的lcms(esi)[m+h]
+
:330,332(3:2),实测330,332(3:2);1h nmr(400mhz,cd3od)δ7.19(d,j=8.8hz,1h),6.70(d,j=8.8hz,1h),4.80-4.70(m,1h),4.02-3.92(m,1h),3.75-3.56(m,1h),3.55-3.43(m,1h),2.71-2.58(m,2h),2.53-2.19(m,4h),1.79-1.39(m,3h)。
[0485]
实施例90.化合物251((6r,7as)-6-(2,3-二氯-6-羟苯基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮)步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(羟甲基)吡咯烷-1-甲酸叔丁酯(实施例7,步骤b)(40.0克,95.68毫摩尔)、tscl(21.9克,115毫摩尔)和dmap(3.51克,28.7毫摩尔)在dcm(400毫升)中的搅拌溶液中逐滴加入tea(26.6毫升,263毫摩尔)。反应在室温下搅拌4小时,用水(100毫升)稀释并用dcm(2
×
200毫升)萃取。合并的有机层用盐水(2
×
200毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(3/1)洗脱的硅胶柱色谱法提纯以提供作为灰白色固体的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[(4-甲基苯磺酰基)氧基]甲基]吡咯烷-1-甲酸叔丁酯(42.5克,75%):对c
24h29
cl2no6s计算的lcms(esi)[m+h]
+
:530,532(3:2),实测530,532(3:2)。
[0486]
步骤b:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[(4-甲基苯磺酰基)氧基]甲基]吡咯烷-1-甲酸叔丁酯(12.0克,22.62毫摩尔)在dmso(20毫升)中的搅拌溶液中加入
kcn(2.95克,45.3毫摩尔)。反应在80℃下搅拌1小时,冷却至室温,用饱和nahco3水溶液(50毫升)稀释并用ea(3
×
50毫升)萃取。合并的有机层用盐水(3
×
50毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用35%在pe中的ea洗脱的硅胶色谱法提纯以提供作为黄色固体的(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)四氢-1h,3h-吡咯并[1,2-c]噁唑-3-酮(2.50克,36%):对c
13h13
cl2no3计算的lcms(esi)[m+h]
+
:302,304(3:2),实测302,304(3:2)。
[0487]
步骤c:在室温下向(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(50.0毫克,0.16毫摩尔)在dcm(1毫升)中的搅拌混合物中加入bbr3(0.05毫升,0.53毫摩尔)。反应搅拌1小时,用水(2毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x bridge shield rp18 obd column,30
×
150mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:60ml/min;梯度:在7分钟内由25%b至55%b;检测器:uv 220/254nm;保留时间:6.8分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物251((6r,7as)-6-(2,3-二氯-6-羟苯基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮)(17.5毫克,34.9%):对c
12h11
cl2no3计算的lcms(esi)[m+h]
+
:288,290(3:2),实测288,290(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.74(d,j=8.8hz,1h),4.58(dd,j=9.0,7.9hz,1h),4.46-4.34(m,1h),4.32(dd,j=9.0,3.2hz,1h),4.25-4.14(m,1h),3.93(dd,j=10.7,7.1hz,1h),3.46-3.40(m,1h),2.29-2.09(m,2h)。
[0488]
实施例91.化合物252((7r,8as)-7-(2,3-二氯-6-羟苯基)-六氢-[1,3]噁唑并[3,4-a]吡啶-3-酮)步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(羟甲基)哌啶-1-甲酸叔丁酯(中间体9,实施例8)(0.200克,0.51毫摩尔)和tscl(0.150克,0.77毫摩尔)在dcm(2毫升)中的搅拌溶液中加入tea(0.100克,1.03毫摩尔)和dmap(19.0毫克,0.15毫摩尔)。反应在室温下搅拌2小时,用水(50毫升)稀释并用ea(3
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(3/1)洗脱的硅胶柱色谱法提纯以提供作为灰白色半固体的(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-六氢-[1,3]噁唑并[3,4-a]吡啶-3-酮(0.120克,74%):对c
14h15
cl2no3计算的lcms(esi)[m+h]
+
:316,318(3:2),实测316,318(3:2)。
[0489]
步骤b:在室温下向(7r,8as)-7-(2,3-二氯-6-甲氧基苯基)-六氢-[1,3]噁唑并[3,4-a]吡啶-3-酮(80.0毫克,0.25毫摩尔)在dcm(1毫升)中的搅拌溶液中加入bbr3(0.640克,2.54毫摩尔)。反应搅拌1小时,用meoh(3毫升)猝灭并在减压下浓缩。残余物通过用35%在水中
的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为灰白色固体的化合物252((7r,8as)-7-(2,3-二氯-6-羟苯基)-六氢-[1,3]噁唑并[3,4-a]吡啶-3-酮)(34.0毫克,44%):对c
13h13
cl2no3计算的lcms(esi)[m+h]
+
:302,304(3:2),实测302,304(3:2);1h nmr(400mhz,cd3od)δ7.21(d,j=8.8hz,1h),6.72(d,j=8.8hz,1h),4.53-4.49(m,1h),4.01(dd,j=8.6,5.7hz,1h),3.96-3.84(m,2h),3.70-3.56(m,1h),3.07(td,j=13.0,3.5hz,1h),2.53-2.38(m,2h),1.83-1.73(m,1h),1.61-1.51(m,1h)。
[0490]
实施例92.化合物253((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(羟甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体1)和化合物254((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(羟甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体2)步骤a:在0℃下在氮气气氛下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基吡咯烷-1-甲酸叔丁酯(实施例7,步骤c)(0.480克,1.28毫摩尔)和甲基三苯基溴化鏻(0.920克,2.57毫摩尔)在thf(8毫升)中的搅拌混合物中加入t-buok(2.59毫升,2.59毫摩尔,1m在thf中)。反应在0℃下搅拌2小时,用水(20毫升)稀释并用ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(5/1)洗脱的硅胶柱色谱法提纯以提供作为灰白色固体的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-乙烯基吡咯烷-1-甲酸叔丁酯(0.400克,84%):对c
18h23
cl2no3计算的lcms(esi)[m+h]
+
:372,374(3:2),实测372,374(3:2);1h nmr(300mhz,cdcl3)δ7.25(d,j=8.9hz,1h),6.75(d,j=8.9hz,1h),5.95-5.76(m,1h),5.21-5.03(m,2h),4.32(q,j=7.9hz,1h),4.13-3.99(m,1h),3.86-3.67(m,5h),2.49-2.34(m,1h),2.32-2.17(m,1h),1.46(s,9h)。
[0491]
步骤b:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-乙烯基吡咯烷-1-甲酸叔丁酯(0.600克,1.61毫摩尔)在thf(3毫升)、h2o(3毫升)和丙酮(3毫升)中的搅拌混合物中加
吡咯并[1,2-c][1,3]噁唑-3-酮(22.5毫克,45%):对c
13h13
cl2no4计算的lcms(esi)[m+h]
+
:318,320(3:2),实测318,320(3:2):1h nmr(400mhz,cd3od)δ7.24(dd,j=8.7,1.8hz,1h),6.74(dd,j=8.7,1.8hz,1h),4.83-4.45(m,1h),4.44-4.31(m,1h),4.26-3.96(m,1h),3.96-3.88(m,1h),3.88-3.69(m,2h),3.47-3.39(m,1h),2.43-1.82(m,2h)。
[0495]
步骤f:产物(6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(羟甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(22.5毫克,0.07毫摩尔)通过制备手性hplc采用以下条件来分离:柱:chiralpak id,2
×
25cm,5μm;流动相a:hex(加0.1%fa)-hplc,流动相b:ipa-hplc;流速:20ml/min;梯度:在19分钟内由10%b至10%b;检测器:uv 220/254nm;保留时间1:13.49分钟;保留时间2:15.78分钟;注射体积:0.3ml;运行数量:7。获得在13.49分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物253((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(羟甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体1)(4.2毫克,18%):对c
13h13
cl2no4计算的lcms(esi)[m+h]
+
:318,320(3:2),实测318,320(3:2);1h nmr(300mhz,cd3od)δ7.24(d,j=8.7hz,1h),6.74(d,j=8.8hz,1h),4.83-4.75(m,1h),4.44-4.18(m,2h),4.00-3.72(m,3h),3.45-3.37(m,1h),2.40-2.38(m,1h),1.93-1.81(m,1h)。获得在15.78分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物254((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(羟甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体2)(8.80毫克,39%):对c
13h13
cl2no4计算的lcms(esi)[m+h]
+
:318,320(3:2),实测318,320(3:2);1h nmr(300mhz,cd3od)δ7.24(d,j=8.7hz,1h),6.74(d,j=8.8hz,1h),4.54-4.47(m,1h),4.47-4.26(m,1h),4.04-3.86(m,2h),3.86-3.65(m,2h),3.45-3.40(m,1h),2.32-2.16(m,2h)。
[0496]
实施例93.化合物255((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(2-羟基丙-2-基)四氢-1h,3h-吡咯并[1,2-c]噁唑-3-酮异构体1)、化合物256((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(2-羟基丙-2-基)四氢-1h,3h-吡咯并[1,2-c]噁唑-3-酮异构体2)和化合物257((4as,6r)-6-(2,3-二氯-6-羟苯基)-4-羟基-3,3-二甲基六氢-1h-吡咯并[1,2-c][1,3]噁嗪-1-酮)步骤a:在0℃下在氮气气氛下向异丙基三苯基碘化鏻(1.39克,3.215毫摩尔)在thf(10毫升)中的搅拌混合物中加入t-buok(3.21毫升,3.21毫摩尔,在thf中的1m溶液)。反应在0℃下搅拌10分钟,并加入在thf(5毫升)中的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基吡咯烷-1-甲酸叔丁酯(实施例7,步骤c)(0.600克,1.603毫摩尔)。反应在0℃下搅拌2小时,在0℃下用饱和nh4cl水溶液(30毫升)猝灭,并用ea(3
×
30毫升)萃取。合并的有机层用盐水
(3
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(3/1)洗脱的硅胶柱色谱法提纯以提供作为浅黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(2-甲基丙-1-烯-1-基)吡咯烷-1-甲酸叔丁酯(0.400克,62%):对c
20h27
cl2no3计算的lcms(esi)[m+h]
+
:400,402(3:2),实测400,402(3:2);1h nmr(300mhz,cdcl3)δ7.32(d,j=9.0hz,1h),6.76(d,j=8.9hz,1h),5.32(d,j=9.1hz,1h)4.77-4.72(m,1h),4.39-4.23(m,1h),3.84(d,j=4.4hz,3h),3.82-3.68(m,1h),3.63-3.59(m,1h),3.48-3.42(m,1h),2.82-2.68(m,1h),1.78-1.72(m,6h),1.47(d,j=5.8hz,9h)。
[0497]
步骤b:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(2-甲基丙-1-烯-1-基)吡咯烷-1-甲酸叔丁酯(0.200克,0.50毫摩尔)在dcm(2毫升)中的搅拌溶液中加入m-cpba(0.250克,1.50毫摩尔)。反应在室温下搅拌2小时,用饱和na2so3水溶液(20毫升)猝灭,并用ea(3
×
20毫升)萃取。合并的有机层用饱和nahco3水溶液(3
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(3,3-二甲基环氧乙烷-2-基)吡咯烷-1-甲酸叔丁酯(0.100克,粗):对c
20h27
cl2no4计算的lcms(esi)[m+h]
+
:416,418(3:2),实测416,418(3:2)。
[0498]
步骤c:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(3,3-二甲基环氧乙烷-2-基)吡咯烷-1-甲酸叔丁酯(0.100克,0.240毫摩尔)在meoh(1毫升)中的搅拌溶液中加入tsoh
·
h2o(9.00毫克,0.05毫摩尔)。反应搅拌1小时并在减压下浓缩。残余物通过用40%在水中的can溶液(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色油的(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-1-(2-羟基丙-2-基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(40.0毫克,46%):对c
16h19
cl2no4计算的lcms(esi)[m+h]
+
:360,362(3:2),实测360,362(3:2)。
[0499]
步骤d:在室温下向(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-1-(2-羟基丙-2-基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(50.0毫克,0.14毫摩尔)在dcm(1毫升)中的搅拌溶液中加入bbr3(0.13毫升,0.52毫摩尔)。反应搅拌1小时,用meoh(1毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在5.5分钟内由60%b至80%b;检测器:uv 220nm;保留时间1:5.56分钟;保留时间2:5.72分钟;保留时间3:6.03分钟。获得在5.56分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物255((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(2-羟基丙-2-基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体1)(4.6毫克,9.57%):对c
15h17
cl2no4计算的lcms(esi)[m+h]
+
:346,348(3:2),实测346,348(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.77(d,j=8.7hz,1h),4.34(td,j=7.9,2.7hz,1h),4.25-4.14(m,1h),3.98(dd,j=10.8,8.9hz,1h),3.78(dd,j=10.8,7.9hz,1h),3.66(d,j=2.7hz,1h),2.53-2.44(m,1h),2.39-2.28(m,1h),1.47(s,3h),1.44(s,3h)。获得在5.72分钟处的中间异构体,其为作为灰白色固体的化合物256((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(2-羟基丙-2-基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体2)(4.8毫克,9.99%):对c
15h17
cl2no4计算的lcms(esi)[m+h]
+
:
346,348(3:2),实测346,348(3:2);1h nmr(400mhz,cd3od)δ7.26(d,j=8.8hz,1h),6.78(d,j=8.8hz,1h),4.30-4.18(m,1h),4.04(dd,j=11.0,9.1hz,1h),3.97-3.90(m,1h),3.72(dd,j=11.0,7.4hz,1h),3.42(d,j=9.6hz,1h),2.51-2.42(m,1h),2.25-2.12(m,1h),1.43(s,3h),1.37(s,3h)。获得在6.03分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物257((4as,6r)-6-(2,3-二氯-6-羟苯基)-4-羟基-3,3-二甲基-四氢-4h-吡咯并[1,2-c][1,3]噁嗪-1-酮)(4.6毫克)(4.6毫克,9.57%):对c
15h17
cl2no4计算的lcms(esi)[m+h]
+
:346,348(3:2),实测346,348(3:2);1h nmr(400mhz,cd3od)δ7.25(dd,j=8.8,2.2hz,1h),6.76(d,j=8.8hz,1h),4.35-4.24(m,1h),4.15-4.03(m,1h),3.74-3.57(m,1h),3.57-3.48(m,1h),3.45(d,j=9.3hz,1h),2.49-2.39(m,1h),2.35-2.26(m,1h),1.44(d,j=3.0hz,3h),1.37(s,3h)。
[0500]
实施例94.以类似于对化合物255-257所描述的方式制备化合物258-259。
[0501]
实施例95.化合物260((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(1,2-二羟乙基)四氢-1h,3h-吡咯并[1,2-c]噁唑-3-酮异构体1)、化合物261((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(1,2-二羟乙基)四氢-1h,3h-吡咯并[1,2-c]噁唑-3-酮异构体2)、化合物262((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(1,2-二羟乙基)四氢-1h,3h-吡咯并[1,2-c]噁唑-3-酮异构体3)和化合物263((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(1,2-二羟乙基)四氢-1h,3h-吡咯并[1,2-c]噁唑-3-酮异构体4)
步骤a:在-65℃下在氮气气氛下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-甲酰基吡咯烷-1-甲酸叔丁酯(实施例7,步骤c)(1.00克,2.67毫摩尔)在thf(10毫升)中的搅拌溶液中加入乙烯基溴化镁(5.34毫升,5.34毫摩尔,在thf中的1m溶液)。反应在-65℃下搅拌2小时。所得混合物在室温下用饱和nh4cl水溶液(20毫升)猝灭,随后用ea(3
×
30毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用65%在水中的acn(加10mm nh4hco3)洗脱的反相色谱法提纯以提供作为黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(1-羟基丙-2-烯-1-基)吡咯烷-1-甲酸叔丁酯(0.800克,74%):对c
19h25
cl2no4计算的lcms(esi)[m+h]
+
:402,404(3:2),实测402,404(3:2);1h nmr(400mhz,cdcl3)δ7.38-7.31(m,1h),6.81-6.74(m,1h),6.04-5.11(m,3h),4.39-4.11(m,2h),4.11-3.89(m,1h),3.89-3.62(m,5h),2.73-1.87(m,2h),1.56-1.32(m,9h)。
[0502]
步骤b:在0℃下在氮气气氛下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(1-羟基丙-2-烯-1-基)吡咯烷-1-甲酸叔丁酯(0.800克,1.99毫摩尔)在dmf(8毫升)中的搅拌溶液中加入nah(0.100克,60%在油中,3.98毫摩尔)。反应在室温下搅拌16小时。所得混合物在室温下用水(50毫升)猝灭,随后用ea(3
×
30毫升)萃取。合并的有机层用盐水(5
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用60%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色油的(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-1-乙烯基-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(0.330克,51%):对c
15h15
cl2no3计算的lcms(esi)[m+h]
+
:328,330(3:2),实测328,330(3:2);1h nmr(400mhz,cdcl3)δ7.34(d,j=8.9hz,1h),6.78(d,j=8.9hz,1h),6.08-5.81(m,1h),5.58-5.43(m,1h),5.39-5.31(m,1h),5.23-4.78(m,1h),4.40-4.05(m,1h),4.00-3.78(m,5h),3.47-3.38(m,1h),2.28-1.77(m,2h)。
[0503]
步骤c:在室温下向(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-1-乙烯基-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(0.200克,0.61毫摩尔)在thf(1毫升)、丙酮(1毫升)和h2o(1毫升)
中的搅拌溶液中加入nmo(0.140克,1.22毫摩尔)和k2oso4·
2h2o(0.110克,0.31毫摩尔)。反应搅拌1小时,用饱和na2s2o3水溶液(1毫升)猝灭,并在减压下浓缩。残余物通过用50%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色油的(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-1-(1,2-二羟乙基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(0.180克,62%):对c
15h17
cl2no5计算的lcms(esi)[m+h]
+
:362,364(3:2),实测362,364(3:2);1h nmr(300mhz,cdcl3)δ7.33(d,j=8.9hz,1h),6.80-6.71(m,1h),4.69-4.45(m,1h),4.43-4.21(m,1h),4.19-3.85(m,4h),3.85-3.79(m,4h),3.47-3.34(m,1h),2.38(s,2h),2.29-1.97(m,2h)。
[0504]
步骤d:在室温下向(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-1-(1,2-二羟乙基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(0.180克,0.50毫摩尔)在dcm(2毫升)中的搅拌溶液中加入bbr3(0.47毫升,4.97毫摩尔)。反应搅拌1小时,用meoh(1毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在6.5分钟内由35%至65%;检测器:uv 254/220nm;保留时间:6.54分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的(6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(1,2-二羟乙基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(43.1毫克,24.9%):对c
14h15
cl2no5计算的lcms(esi)[m+h]
+
:348,350(3:2),实测348,350(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.74(d,j=8.8hz,1h),4.75-4.56(m,1h),4.50-4.31(m,1h),4.27-4.11(m,1h),4.01-3.86(m,1h),3.84-3.58(m,3h),3.48-3.38(m,1h),2.52-1.97(m,2h)。
[0505]
步骤e:产物(6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(1,2-二羟乙基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(40.0毫克,0.12毫摩尔)通过制备手性hplc采用以下条件来分离:柱:chiralpak if,2
×
25cm,5um;流动相a:hex(加0.1%fa)-hplc,流动相b:etoh-hplc;流速:20ml/min;梯度:在12分钟内由20%b至20%b;检测器:uv 254/220nm;保留时间1:8.16分钟;保留时间2:10.67分钟。获得在8.16分钟处的较快洗脱的异构体,其为作为灰白色固体的(1s,6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(1,2-二羟乙基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(12.7毫克,31.8%)。获得在10.67分钟处的较慢洗脱的异构体,其为作为灰白色固体的(1r,6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(1,2-二羟乙基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(16.8毫克,42.0%)。
[0506]
产物(6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(1,2-二羟乙基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体1(12.7毫克)通过制备手性hplc采用以下条件来分离:柱:chiralpak ic,2
×
25cm,5μm;流动相a:hex(加0.1%fa)-hplc,流动相b:etoh-hplc;流速:20ml/min;梯度:在10分钟内由20%至20%;检测器:uv 254/220nm;保留时间1:6.03分钟;保留时间2:8.65分钟。获得在6.03分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物260((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-[1,2-二羟乙基]-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体1)(8.5毫克,21%):对c
14h15
cl2no5计算的lcms(esi)[m+h]
+
:348,350(3:2),实测348,350(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.74(d,j=8.8hz,1h),4.47(dd,j=5.9,3.8hz,1h),4.45-4.35(m,1h),4.24-4.16(m,1h),3.91(dd,j
=10.7,7.0hz,1h),3.85-3.80(m,1h),3.73-3.62(m,2h),3.45-3.40(m,1h),2.31-2.14(m,2h)。获得在8.65分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物261((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-[1,2-二羟乙基]-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体2)(1.8毫克,4.5%):对c
14h15
cl2no5计算的lcms(esi)[m+h]
+
:348,350(3:2),实测348,350(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.74(d,j=8.8hz,1h),4.62-4.58(m,1h),4.46-4.34(m,1h),4.16-4.08(m,1h),3.96-3.87(m,1h),3.78-3.70(m,1h),3.68(d,j=6.8hz,2h),3.45-3.40(m,1h),2.31-2.15(m,2h)。
[0507]
产物(6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(1,2-二羟乙基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体2(16.8毫克)通过制备手性hplc采用以下条件来分离:柱:chiralpak ic,2
×
25cm,5μm;流动相a:hex(加0.1%fa)-hplc,流动相b:etoh-hplc;流速:20ml/min;梯度:在10分钟内由20%至20%;检测器:uv 254/220nm;保留时间1:5.75分钟;保留时间2:8.06分钟。获得在5.75分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物262((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-[1,2-二羟乙基]-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体3)(12.2毫克,30.5%):对c
14h15
cl2no5计算的lcms(esi)[m+h]
+
:348,350(3:2),实测348,350(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.73(d,j=8.7hz,1h),4.67(dd,j=9.2,7.7hz,1h),4.41-4.30(m,1h),4.27-4.16(m,1h),3.96(dd,j=10.7,7.3hz,1h),3.82-3.75(m,2h),3.66(dd,j=12.3,5.8hz,1h),3.45-3.40(m,1h),2.49-2.43(m,1h),2.08-1.98(m,1h)。获得在8.06分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物263((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-[1,2-二羟乙基]-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体4)(1.2毫克,3%):对c
14h15
cl2no5计算的lcms(esi)[m+h]
+
:348,350(3:2),实测348,350(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.73(d,j=8.8hz,1h),4.75-4.70(m,1h),4.40-4.29(m,1h),4.20-4.11(m,1h),3.99(dd,j=10.6,7.7hz,1h),3.89-3.81(m,1h),3.69-3.58(m,2h),3.42-3.36(m,1h),2.57-2.50(m,1h),1.93-1.84(m,1h)。
[0508]
实施例96.化合物264((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(羟甲基)-1-甲基四氢-1h,3h-吡咯并[1,2-c]噁唑-3-酮异构体1)和化合物265(((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(羟甲基)-1-甲基四氢-1h,3h-吡咯并[1,2-c]噁唑-3-酮异构体2)步骤a:在0℃下在氮气气氛下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-1,2-二甲
酸1-叔丁酯2-甲酯(2.00克,4.95毫摩尔)在thf(20毫升)中的搅拌溶液中加入memgcl(8.25毫升,24.8毫摩尔,3m在thf中)。反应在室温下搅拌2小时,用饱和nh4cl水溶液(20毫升)猝灭并用ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用pe/ea(2/1)洗脱的硅胶柱色谱法提纯以提供作为无色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(2-羟基丙-2-基)吡咯烷-1-甲酸叔丁酯(1.40克,70%):对c
19h27
cl2no4计算的lcms(esi)[m+h]
+
:404,406(3:2),实测404,406(3:2);1h nmr(400mhz,cdcl3)δ7.34(d,j=8.9hz,1h),6.77(d,j=8.9hz,1h),4.04(dd,j=9.7,7.8hz,1h),3.98-3.87(m,1h),3.85(s,3h),3.82-3.73(m,2h),2.41-2.31(m,1h),2.22-2.08(m,1h),1.49(s,9h),1.22(s,3h),1.16(s,3h)。
[0509]
步骤b:在-78℃下在氮气气氛下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(2-羟基丙-2-基)吡咯烷-1-甲酸叔丁酯(0.300克,0.74毫摩尔)在thf(4毫升)中的搅拌混合物中逐份加入socl2(0.12毫升,1.01毫摩尔)。反应在-78℃下搅拌1小时。在-78℃下向上述混合物中加入tea(1.03毫升,10.18毫摩尔)。反应在-78℃至室温下搅拌附加的16小时。所得混合物用水(10毫升)稀释并用ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用80%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为棕色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(丙-1-烯-2-基)吡咯烷-1-甲酸叔丁酯(0.13克,45%):对c
19h25
cl2no3计算的lcms(esi)[m+h]
+
:386,388(3:2),实测386,388(3:2);1h nmr(400mhz,cdcl3)δ7.34(d,j=8.9hz,1h),6.76(d,j=9.0hz,1h),5.06-4.65(m,2h),4.50-4.20(m,1h),4.20-3.92(m,1h),3.92-3.53(m,5h),2.59-2.40(m,1h),2.26-2.09(m,1h),1.76(s,3h),1.47(s,9h)。
[0510]
步骤c:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(丙-1-烯-2-基)吡咯烷-1-甲酸叔丁酯(0.130克,0.44毫摩尔)在dcm(2毫升)中的搅拌混合物中加入m-cpba(0.220克,1.32毫摩尔)。反应在室温下搅拌2小时,用饱和na2so3水溶液(20毫升)猝灭,并用ea(3
×
20毫升)萃取。合并的有机层用饱和nahco3水溶液(3
×
20毫升)和盐水洗涤,并随后在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用40%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为黄色油的(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-1-(羟甲基)-1-甲基-四氢吡咯并[1,2-c][1,3]噁唑-3-酮(60.0毫克,39%):对c
15h17
cl2no4计算的lcms(esi)[m+h]
+
:346,348(3:2),实测346,348(3:2):1hnmr(400mhz,cdcl3)δ7.35(dd,j=9.0,3.6hz,1h),6.79(dd,j=8.9,7.3hz,1h),4.50(s,1h),4.40-4.30(m,1h),3.99-3.91(m,2h),3.88-3.83(m,4h),3.83-3.69(m,1h),3.49-3.35(m,1h),2.53-1.87(m,2h),1.52(d,j=66.6hz,3h)。
[0511]
步骤d:在室温下向(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-1-(羟甲基)-1-甲基-四氢吡咯并[1,2-c][1,3]噁唑-3-酮(60.0毫克,0.17毫摩尔)在dcm(1毫升)中的搅拌溶液中加入bbr3(0.16毫升,1.69毫摩尔)。反应搅拌1小时,用meoh(1毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在6.5分钟内由35%
至40%;检测器:uv 254/220nm;保留时间1:6.57分钟;保留时间2:6.78分钟。获得在6.57分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物264((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(羟甲基)-1-甲基-四氢吡咯并[1,2-c][1,3]噁唑-3-酮异构体1)(7.40毫克,12.9%):对c
14h15
cl2no4计算的lcms(esi)[m+h]
+
:332,334(3:2),实测332,334(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.75(d,j=8.8hz,1h),4.44-4.33(m,1h),4.04(dd,j=11.1,5.8hz,1h),3.97(dd,j=10.6,7.5hz,1h),3.65(s,2h),3.43-3.38(m,1h),2.49-2.40(m,1h),1.94-1.83(m,1h),1.40(s,3h)。获得在6.78分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物265((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(羟甲基)-1-甲基-四氢吡咯并[1,2-c][1,3]噁唑-3-酮异构体2)(8.90毫克,15.5%):对c
14h15
cl2no4计算的lcms(esi)[m+h]
+
:332,334(3:2),实测332,334(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.74(d,j=8.7hz,1h),4.42-4.28(m,1h),3.95(dd,j=10.6,7.6hz,1h),3.88(dd,j=11.1,5.6hz,1h),3.70(s,2h),3.40-3.36(m,1h),2.46-2.40(m,1h),1.99-1.90(m,1h),1.58(s,3h)。
[0512]
实施例97.化合物266((4as,6r)-6-(2,3-二氯-6-羟苯基)-4-羟基-六氢吡咯并[1,2-c][1,3]噁嗪-1-酮异构体1)和化合物267((4as,6r)-6-(2,3-二氯-6-羟苯基)-4-羟基-六氢吡咯并[1,2-c][1,3]噁嗪-1-酮异构体2)步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-乙烯基吡咯烷-1-甲酸叔丁酯(实施例14,步骤a)(50.0毫克,0.13毫摩尔)在dcm(1毫升)中的搅拌混合物中加入m-cpba(70毫克,0.40毫摩尔)。反应在室温下搅拌2小时,用饱和na2so3水溶液(20毫升)猝灭并用ea(3
×
20毫升)萃取。合并的有机层用饱和nahco3水溶液(2
×
20毫升)和盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为灰白色固体的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(环氧乙烷-2-基)吡咯烷-1-甲酸叔丁酯(80.0毫克,粗),其不经提纯直接用于下一步骤:对c
18h23
cl2no4计算的lcms(esi)[m+h-56]
+
:332,334(3:2),实测332,334(3:2)。
[0513]
步骤b:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(环氧乙烷-2-基)吡咯烷-1-甲酸叔丁酯(50.0毫克,0.13毫摩尔)在meoh(1毫升)中的搅拌混合物中加入tsoh(4毫克,0.03毫摩尔)。反应搅拌3小时并在减压下浓缩。残余物通过用50%在水中的acn(加0.05%
tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的(4as,6r)-6-(2,3-二氯-6-羟苯基)-4-羟基六氢-1h-吡咯并[1,2-c][1,3]噁嗪-1-酮(14.0毫克,36%):对c
14h15
cl2no4计算的lcms(esi)[m+h]
+
:332,334(3:2),实测332,334(3:2);1h nmr(400mhz,cd3od)δ7.41(d,j=9.0hz,1h),6.99(d,j=8.9hz,1h),4.83-4.47(m,1h),4.47-4.33(m,1h),4.24-3.93(m,1h),3.84(d,j=3.7hz,3h),3.83-3.71(m,3h),3.48-3.36(m,1h),2.30-1.86(m,2h)。
[0514]
步骤c:在室温下向(4as,6r)-6-(2,3-二氯-6-甲氧基苯基)-4-羟基-六氢吡咯并[1,2-c][1,3]噁嗪-1-酮(14.0毫克,0.04毫摩尔)在dcm(1毫升)中的搅拌混合物中加入bbr3(0.01毫升,0.03毫摩尔)。反应在室温下搅拌1小时,用meoh(2毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在5.5分钟内由30%b至40%b;检测器:uv 254/210nm;保留时间1:5.56分钟,保留时间2:5.85分钟。获得在5.56分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物266((4as,6r)-6-(2,3-二氯-6-羟苯基)-4-羟基-六氢吡咯并[1,2-c][1,3]噁嗪-1-酮异构体1)(0.600毫克,4.47%):对c
13h13
cl2no4计算的lcms(esi)[m+h]
+
:318,320(3:2),实测318,320(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.76(d,j=8.8hz,1h),4.42-4.31(m,2h),4.30-4.17(m,1h),4.14-4.05(m,2h),3.97-3.88(m,1h),3.53-3.49(m,1h),3.02-2.96(m,1h),1.97-1.85(m,1h)。获得在5.85分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物267((4as,6r)-6-(2,3-二氯-6-羟苯基)-4-羟基-六氢吡咯并[1,2-c][1,3]噁嗪-1-酮异构体2)(1.20毫克,8.95%):对c
13h13
cl2no4计算的lcms(esi)[m+h]
+
:318,320(3:2),实测318,320(3:2);1h nmr(400mhz,cd3od)δ7.26(d,j=8.8hz,1h),6.76(d,j=8.8hz,1h),4.32-4.19(m,2h),4.11-3.97(m,2h),3.87-3.74(m,1h),3.64-3.49(m,2h),2.49-2.43(m,1h),2.36-2.29(m,1h)。
[0515]
实施例98.化合物268((4as,6r)-6-(2,3-二氯-6-羟苯基)-3-(羟甲基)六氢-1h-吡咯并[1,2-c][1,3]噁嗪-1-酮异构体1)和化合物269((4as,6r)-6-(2,3-二氯-6-羟苯基)-3-(羟甲基)六氢-1h-吡咯并[1,2-c][1,3]噁嗪-1-酮异构体2)步骤a:在0℃下在氮气气氛下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(羟甲基)吡咯烷-1-甲酸叔丁酯(实施例7,步骤b)(2.00克,5.32毫摩尔)、pph3(2.79克,10.64毫摩尔)和i2(1.35克,5.32毫摩尔)在干燥thf(15毫升)中的搅拌溶液中逐滴加入dead(1.67毫升,9.58
毫摩尔)。反应在室温下搅拌12小时并在减压下浓缩。残余物通过用ea/pe(1/3)洗脱的硅胶柱色谱法提纯以提供作为灰白色固体的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(碘甲基)吡咯烷-1-甲酸叔丁酯(0.95克,37%):对c
17h22
cl2ino3计算的lcms(esi)[m+h]
+
:486,488(3:2),实测486,488(3:2);1h nmr(300mhz,cdcl3)δ7.33(d,j=8.9hz,1h),6.77(d,j=8.9hz,1h),4.17-4.00(m,1h),3.93-3.71(m,6h),3.65-3.49(m,2h),2.64-2.45(m,1h),2.33-2.18(m,1h),1.50(s,9h)。
[0516]
步骤b:在-78℃下在氮气气氛下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(碘甲基)吡咯烷-1-甲酸叔丁酯(0.800克,1.65毫摩尔)、cui(0.620克,3.29毫摩尔)在thf(8毫升)中的搅拌溶液中逐滴加入乙烯基溴化镁(5.27毫升,5.27毫摩尔,1m在thf中)。反应在-30℃下搅拌附加的3小时,用饱和nh4cl水溶液(30毫升)猝灭并用ea(3
×
30毫升)萃取。合并的有机层用盐水(2
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用70%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为灰白色固体的(2r,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(丙-2-烯-1-基)吡咯烷-1-甲酸叔丁酯(0.550克,87%):对c
19h25
cl2no3计算的lcms(esi)[m+h]
+
:386,388(3:2),实测386,388(3:2);1h nmr(300mhz,cdcl3)δ7.36(d,j=8.9hz,1h),6.80(d,j=8.6hz,1h),5.97-5.71(m,1h),5.14(dd,j=14.0,8.0hz,2h),4.23-3.92(m,2h),3.91-3.65(m,5h),2.83-2.57(m,1h),2.57-2.34(m,1h),2.26-2.02(m,2h),1.53(s,9h)。
[0517]
步骤c:在室温下向(2r,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(丙-2-烯-1-基)吡咯烷-1-甲酸叔丁酯(0.200克,0.52毫摩尔)在dcm(2毫升)中的搅拌溶液中加入m-cpba(0.270克,1.55毫摩尔)。反应搅拌2小时,用饱和na2so3水溶液(20毫升)猝灭并用ea(3
×
20毫升)萃取。合并的有机层用饱和nahco3水溶液(2
×
20毫升)、盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用45%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为灰白色固体的(4as,6r)-6-(2,3-二氯-6-甲氧基苯基)-3-(羟甲基)-六氢吡咯并[1,2-c][1,3]噁嗪-1-酮(0.110克,61%):对c
15h17
cl2no4计算的lcms(esi)[m+h]
+
:346,348(3:2),实测346,348(3:2);1h nmr(400mhz,cd3od)δ7.42(d,j=9.0hz,1h),7.00(d,j=9.0hz,1h),4.56-4.23(m,2h),4.02-3.95(m,1h),3.93-3.81(m,4h),3.81-3.66(m,2h),3.54(td,j=10.3,3.3hz,1h),2.46-2.28(m,1h),2.28-2.11(m,2h),1.92-1.57(m,1h)。
[0518]
步骤d:在室温下向(4as,6r)-6-(2,3-二氯-6-甲氧基苯基)-3-(羟甲基)-六氢吡咯并[1,2-c][1,3]噁嗪-1-酮(0.11克,0.32毫摩尔)在dcm(2毫升)中的搅拌溶液中逐滴加入bbr3(0.21毫升,0.84毫摩尔)。反应搅拌1小时,用meoh(2毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,5μm,19
×
150mm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在6.5分钟内由35%b至40%b;检测器:uv 210nm;保留时间:6.54分钟。收集含有所需产物的级分并在减压下浓缩以提供所需产物。产物通过制备手性hplc采用以下条件来分离:柱:chiralpak ie,2
×
25cm,5um;流动相a:hex(加0.1%fa)-hplc,流动相b:etoh-hplc;流速:20ml/min;梯度:在
13分钟内由15%b至15%b;检测器:uv:220/254nm;保留时间1:9.62分钟;保留时间2:11.27分钟;注射体积:0.8ml;运行数量:7。获得在9.62分钟处的较快洗脱的异构体,其为作为灰白色固体的的化合物268((4as,6r)-6-(2,3-二氯-6-羟苯基)-3-(羟甲基)-六氢吡咯并[1,2-c][1,3]噁嗪-1-酮异构体1)(23.6毫克,22.36%):对c
14h15
cl2no4计算的lcms(esi)[m+h]
+
:332,334(3:2),实测332,334(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.76(d,j=8.9hz,1h),4.53(d,j=6.1hz,1h),4.35-4.18(m,1h),4.12-4.06(m,1h),3.97-3.83(m,1h),3.83-3.64(m,2h),3.57-3.50(m,1h),2.47-2.25(m,2h),2.25-2.11(m,1h),1.94-1.78(m,1h)。获得在11.27分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物269((4as,6r)-6-(2,3-二氯-6-羟苯基)-3-(羟甲基)-六氢吡咯并[1,2-c][1,3]噁嗪-1-酮异构体2)(31.3毫克,29.66%):对c
14h15
cl2no4计算的lcms(esi)[m+h]
+
:332,334(3:2),实测332,334(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.8hz,1h),6.76(d,j=8.8hz,1h),4.44-4.36(m,1h),4.34-4.22(m,1h),4.12-4.07(m,1h),3.93-3.81(m,1h),3.73(qd,j=12.1,4.4hz,2h),3.55-3.50(m,1h),2.45-2.39(m,1h),2.34-2.27(m,1h),2.25-2.15(m,1h),1.71-1.56(m,1h)。
[0519]
实施例99.化合物270((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(2-羟乙基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体1)和化合物271((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(2-羟乙基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体2)步骤a:在室温下向(2r,4r)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-1,2-二甲酸1-叔丁酯2-甲酯(1.50克,3.71毫摩尔)在meoh(10毫升)和h2o(5毫升)中的搅拌混合物中加入lioh
·
h2o(0.310克,7.38毫摩尔)。反应搅拌1小时,用柠檬酸酸化至ph 4并用ea(3
×
30毫升)萃取。合并的有机层用盐水(2
×
30毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为灰白色固体的(2r,4r)-1-(叔丁氧基羰基)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-甲酸(1.20克,83%):对c
17h21
cl2no5计算的lcms(esi)[m+na]
+
:412,414(3:2),实
210nm;保留时间:6.54分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的(6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(2-羟乙基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(52.4毫克,27%):对c
14h15
cl2no4计算的lcms(esi)[m+h]
+
:332,334(3:2),实测332,334(3:2);1h nmr(300mhz,cd3od)δ7.23(d,j=8.7hz,1h),6.73(d,j=8.7hz,1h),4.98-4.89(m,0.5h),4.68-4.60(m,0.5h),4.48-4.26(m,1h),4.25-4.12(m,1h),4.03-3.85(m,1h),3.79-3.67(m,2h),3.48-3.36(m,1h),2.44-2.15(m,1h),2.08-1.78(m,3h)。
[0524]
步骤f:产物(6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(2-羟乙基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(40.0毫克,0.12毫摩尔)通过制备手性hplc采用以下条件来分离:柱:chiralpak ic,2
×
25cm,5μm;流动相a:hex(加8mmol/l nh3·
meoh)-hplc,流动相b:etoh-hplc;流速:20ml/min;梯度:在11.5分钟内由20%b至20%b;检测器:uv 220/254nm;保留时间1:7.81分钟;保留时间2:9.41分钟。获得在7.81分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物270((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(2-羟乙基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体1)(5.1毫克,13%):对c
14h15
cl2no4计算的lcms(esi)[m+h]
+
:332,334(3:2),实测332,334(3:2);1h nmr(400mhz,cd3od)δ7.23(d,j=8.8hz,1h),6.73(d,j=8.8hz,1h),4.96-4.89(m,1h),4.41-4.28(m,1h),4.23-4.12(m,1h),3.97(dd,j=10.7,7.4hz,1h),3.79-3.66(m,2h),3.43-3.39(m,1h),2.39-2.33(m,1h),2.06-1.80(m,3h)。获得在9.41分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物271((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(2-羟乙基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体2)(9.4毫克,23%):对c
14h15
cl2no4计算的lcms(esi)[m+h]
+
:332,334(3:2),实测332,334(3:2);1h nmr(400mhz,cd3od)δ7.23(d,j=8.6hz,1h),6.74(d,j=8.7hz,1h),4.68-4.54(m,1h),4.44-4.27(m,1h),4.01-3.87(m,2h),3.79-3.71(m,2h),3.45-3.40(m,1h),2.29-2.12(m,2h),2.12-1.89(m,2h)。
[0525]
实施例100.化合物272((6r,7as)-1-(氨基甲基)-6-(2,3-二氯-6-羟苯基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体1)和化合物273((6r,7as)-1-(氨基甲基)-6-(2,3-二氯-6-羟苯基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体2)
步骤a:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-乙烯基吡咯烷-1-甲酸叔丁酯(实施例14,步骤a)(3.30克,8.86毫摩尔)在dcm(25毫升)中的搅拌混合物中加入m-cpba(4.59克,26.6毫摩尔)。反应搅拌2小时,用饱和na2so3水溶液(30毫升)猝灭并用ea(3
×
30毫升)萃取。合并的有机层用饱和nahco3水溶液(2
×
30毫升)和盐水(2
×
30毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色油的(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(环氧乙烷-2-基)吡咯烷-1-甲酸叔丁酯(3.50克,粗),其不经提纯直接用于下一步骤:对c
18h23
cl2no4计算的lcms(esi)[m+h-56]
+
:332,334(3:2),实测332,334(3:2)。
[0526]
步骤b:将(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-(环氧乙烷-2-基)吡咯烷-1-甲酸叔丁酯(3.30克,8.50毫摩尔)和tsoh(0.150克,0.85毫摩尔)在meoh中(25毫升)的搅拌混合物在室温下搅拌3小时并在减压下浓缩。残余物通过用50%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色固体的(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-1-(羟甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(1.7克,60%):对c
14h15
cl2no4计算的lcms(esi)[m+h]
+
:332,334(3:2),实测332,334(3:2);1h nmr(400mhz,cdcl3)δ7.35(d,j=8.9hz,1h),6.78(dd,j=8.9,2.1hz,1h),4.86-4.47(m,1h),4.42-4.26(m,1h),4.16-3.87(m,3h),3.87-3.81(m,4h),3.48-3.38(m,1h),2.30-2.19(m,1h),2.12-1.85(m,1h)。
[0527]
步骤c:在0℃下向(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-1-(羟甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(0.400克,1.20毫摩尔)和tea(0.240克,2.41毫摩尔)在dcm(5毫升)中的搅拌混合物中加入mscl(0.170克,1.45毫摩尔)。反应在室温下搅拌1小时,用饱和nahco3水溶液(20毫升)稀释并用dcm(2
×
20毫升)萃取。合并的有机层用盐水(2
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供作为浅黄色油的甲磺酸[(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-基]甲酯(0.500克,粗),其不经提纯直接用于下一步骤:对c
15h17
cl2no6s计算的lcms(esi)[m+h]
+
:410,412(3:2),实测410,412(3:2)。
[0528]
步骤d:在氮气气氛下在室温下向甲磺酸[(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代四氢-1h,3h-吡咯并[1,2-c]噁唑-1-基]甲酯(0.150克,0.37毫摩尔)在dmso(2毫升)中的搅拌混合物中加入nan3(14.0毫克,0.22毫摩尔)。反应在80℃下搅拌2小时,冷却至室温,用水(20毫升)稀释并用ea(3
×
10毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。在过滤后,滤液在减压下浓缩以提供(6r,7as)-1-(叠氮甲基)-6-(2,3-二氯-6-甲氧基苯基)四氢-1h,3h-吡咯并[1,2-c]噁唑-3-酮,其不经进一步提纯直接用于下一步骤:对c
14h14
cl2n4o3计算的lcms(esi)[m+h+mecn]
+
:398,400(3:2),实测398,400(3:2)。
[0529]
步骤e:在氮气气氛下向(6r,7as)-1-(叠氮甲基)-6-(2,3-二氯-6-甲氧基苯基)四氢-1h,3h-吡咯并[1,2-c]噁唑-3-酮(0.150克,0.42毫摩尔)在ea(2毫升)中的搅拌溶液中加入pto2(48.0毫克,0.21毫摩尔)。悬浮液在减压下脱气并用氢气吹扫三遍。混合物在氢气气氛
(1.5atm)下在室温下搅拌4小时。随后,将反应过滤并在减压下浓缩。残余物通过用35%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为灰白色固体的(6r,7as)-1-(氨基甲基)-6-(2,3-二氯-6-甲氧基苯基)四氢-1h,3h-吡咯并[1,2-c]噁唑-3-酮(76毫克,55%):对c
14h16
cl2n2o3计算的lcms(esi)[m+h]
+
:331,333(3:2),实测331,333(3:2)。
[0530]
步骤f:在室温下向(6r,7as)-1-(氨基甲基)-6-(2,3-二氯-6-甲氧基苯基)四氢-1h,3h-吡咯并[1,2-c]噁唑-3-酮(90.0毫克,0.27毫摩尔)在dcm(2毫升)中的搅拌混合物中加入bbr3(0.05毫升)。所得混合物搅拌2小时,用meoh(4毫升)猝灭并在减压下浓缩。残余物通过用35%在水中的acn(0.05%tfa)洗脱的反相色谱法提纯以提供作为灰白色固体的(6r,7as)-1-(氨基甲基)-6-(2,3-二氯-6-羟苯基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(36.5毫克,31%):对c
13h14
cl2n2o3计算的lcms(esi)[m+h]
+
:317,319(3:2),实测317,319(3:2);1h nmr(400mhz,cd3od)δ7.26(dd,j=8.8,2.1hz,1h),6.75(dd,j=8.8,1.9hz,1h),4.73(d,j=9.5hz,1h),4.47-4.26(m,1h),4.03-3.88(m,2h),3.51-3.35(m,2h),3.31-3.21(m,1h),2.35-1.84(m,2h)。
[0531]
步骤g:产物(6r,7as)-1-(氨基甲基)-6-(2,3-二氯-6-羟苯基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(34.0毫克,0.08毫摩尔)通过制备手性hplc采用以下条件来分离:柱:chiralpak ig,2
×
25cm,5μm;流动相a:hex(加8mm nh3·
meoh)-hplc,流动相b:etoh-hplc;流速:20ml/min;梯度:在22分钟内由30%b至30%b;检测器:uv 220/254nm;保留时间1:4.34分钟;保留时间2:17.34分钟。获得在4.34分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物272((6r,7as)-1-(氨基甲基)-6-(2,3-二氯-6-羟苯基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体1)(3.4毫克,14%):对c
13h14
cl2n2o3计算的lcms(esi)[m+h]
+
:317,319(3:2),实测317,319(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.74(d,j=8.7hz,1h),4.78-4.68(m,1h),4.43-4.30(m,1h),4.27-4.17(m,1h),3.95(dd,j=10.7,7.4hz,1h),3.43-3.38(m,1h),3.01(dd,j=13.7,8.6hz,1h),2.92(dd,j=13.6,4.5hz,1h),2.35-2.30(m,1h),1.92-1.82(m,1h)。获得在17.34分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物273((6r,7as)-1-(氨基甲基)-6-(2,3-二氯-6-羟苯基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体2)(5.2毫克,21%):对c
13h14
cl2n2o3计算的lcms(esi)[m+h]
+
:317,319(3:2),实测317,319(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.74(d,j=8.8hz,1h),4.52-4.45(m,1h),4.45-4.33(m,1h),3.99-3.87(m,2h),3.45-3.40(m,1h),2.97(d,j=5.7hz,2h),2.32-2.14(m,2h)。
[0532]
实施例101.化合物274(n-(((6r,7as)-6-(2,3-二氯-6-羟苯基)-3-氧代四氢-1h,3h-吡咯并[1,2-c]噁唑-1-基)甲基)-2-羟基乙酰胺异构体1)和化合物275(n-(((6r,7as)-6-(2,3-二氯-6-羟苯基)-3-氧代四氢-1h,3h-吡咯并[1,2-c]噁唑-1-基)甲基)-2-羟基乙酰胺异构体2)
步骤a:在室温下向hatu(0.240克,0.63毫摩尔)和甲氧基乙酸(46.0毫克,0.51毫摩尔)在dmf(2毫升)中的搅拌溶液中加入(6r,7as)-1-(氨基甲基)-6-(2,3-二氯-6-甲氧基苯基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(0.140克,0.42毫摩尔)和tea(86.0毫克,0.85毫摩尔)。反应搅拌2小时,用水(20毫升)猝灭,并用ea(3
×
20毫升)萃取。合并的有机层用盐水(5
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用50%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为无色油的n-[[(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-基]甲基]-2-甲氧基乙酰胺(0.130克,76%):对c
17h20
cl2n2o5计算的lcms(esi)[m+h]
+
:403,405(3:2),实测403,405(3:2);1h nmr(400mhz,cdcl3)δ7.35(dd,j=8.9,3.9hz,1h),7.17-7.01(m,1h),6.78(dd,j=8.9,4.1hz,1h),5.75-5.70(m,1h),4.83-4.51(m,1h),4.41-4.07(m,1h),4.07-3.89(m,2h),3.89-3.79(m,5h),3.62-3.52(m,1h),3.45(s,3h),3.44-3.24(m,1h),2.29-1.86(m,2h)。
[0533]
步骤b:在室温下向n-[[(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-基]甲基]-2-甲氧基乙酰胺(0.130克,0.32毫摩尔)在dcm(2毫升)中的搅拌溶液中加入bbr3(0.810克,3.22毫摩尔)。反应搅拌1小时,用水(2毫升)猝灭,用饱和nahco3水溶液(20毫升)中和至ph 8,并用ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在6.5分钟内由40%b至45%b;检测器:uv 210nm;保留时间:6.45分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的n-[[(6r,7as)-6-(2,3-二氯-6-羟苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-基]甲基]-2-羟基乙酰胺(40.0毫克,33%):对c
15h16
cl2n2o5计算的lcms(esi)[m+h]
+
:375,377(3:2),实测375,377(3:2):1h nmr(400mhz,cd3od)δ7.24(dd,j=8.8,3.5hz,1h),6.74(dd,j=8.8,4.3hz,1h),4.64-4.58(m,1h),4.43-4.19(m,1h),4.02(d,j=8.3hz,2h),3.99-3.87(m,2h),3.75-3.49(m,2h),3.46-3.36(m,1h),2.44-1.87(m,2h)。
[0534]
步骤c:n-[[(6r,7as)-6-(2,3-二氯-6-羟苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]
噁唑-1-基]甲基]-2-羟基乙酰胺(36.0毫克,0.10毫摩尔)通过制备手性hplc采用以下条件来分离:柱:chiralpak ig,2
×
25cm,5μm;流动相a:hex(加0.5%2m nh
3-meoh)-hplc,流动相b:etoh-hplc;流速:20ml/min;梯度:在32分钟内由30%b至30%b;检测器uv254/220nm;保留时间1:19.66分钟;保留时间2:26.24分钟;注射体积:0.5ml;运行数量:3。获得在19.66分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物274(n-[[(6r,7as)-6-(2,3-二氯-6-羟苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-基]甲基]-2-羟基乙酰胺异构体1)(4.30毫克,11.9%):对c
15h16
cl2n2o5计算的lcms(esi)[m+h]
+
:375,377(3:2),实测375,377(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.75(d,j=8.8hz,1h),4.93-4.90(m,1h),4.44-4.29(m,1h),4.27-4.17(m,1h),4.01(s,2h),3.96(dd,j=10.7,7.4hz,1h),3.70(dd,j=14.1,4.6hz,1h),3.54(dd,j=14.1,8.4hz,1h),3.45-3.39(m,1h),2.40-2.36(m,1h),1.98-1.86(m,1h)。获得在19.66分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物275(n-[[(6r,7as)-6-(2,3-二氯-6-羟苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-基]甲基]-2-羟基乙酰胺异构体2)(12.0毫克,33.3%):对c
15h16
cl2n2o5计算的lcms(esi)[m+h]
+
:375,377(3:2),实测375,377(3:2):1h nmr(400mhz,cd3od)δ7.23(d,j=8.8hz,1h),6.73(d,j=8.8hz,1h),4.66-4.56(m,1h),4.46-4.28(m,1h),4.03(s,2h),4.00-3.85(m,2h),3.67-3.55(m,2h),3.45-3.39(m,1h),2.31-2.09(m,2h)。
[0535]
实施例102.以类似于对化合物274-275所描述的方式制备化合物276-279。
[0536]
实施例103.化合物279((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(哌嗪-1-基甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体1)和化合物280((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(哌嗪-1-基甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体2)步骤a:在室温下向(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-1-(羟甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(实施例18,步骤b)(0.400克,1.20毫摩尔)在dcm(2毫升)中的搅拌溶液中加入dess-martin氧化剂(1.02克,2.41毫摩尔)。反应搅拌3小时并在0℃下用饱和na2so3水溶液(20毫升)和nahco3(20毫升)猝灭,随后用ea(3
×
30毫升)萃取。合并的有机层用盐水(3
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用45%在水中的acn(加0.1%fa)洗脱的反相色谱法提纯以提供作为灰白色固体的(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-甲醛(0.240克,60%):对c
14h13
cl2no4计算的lcms(esi)[m+h]
+
330,332(3:2),实测330,332(3:2)。
[0537]
步骤b:在室温下向(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-甲醛(80.0毫克,0.24毫摩尔)和哌嗪-1-甲酸叔丁酯(90.0毫克,0.49毫摩尔)在dcm(3毫升)中的搅拌溶液中加入acoh(15.0毫克,0.24毫摩尔)和nabh(aco)3(0.150克,0.73毫摩尔)。反应搅拌16小时并用水(30毫升)稀释,随后用ea(3
×
30毫升)萃取。合并的有机层用盐水(2
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用55%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为灰白
色固体的4-[[(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-基]甲基]哌嗪-1-甲酸叔丁酯(0.100克,82%):对c
23h31
cl2n3o5计算的lcms(esi)[m+h]
+
500,502(3:2),实测500,502(3:2);1h nmr(400mhz,cdcl3)δ7.35(dd,j=8.9,4.1hz,1h),6.78(dd,j=9.4,4.1hz,1h),5.43-4.86(m,2h),4.42-4.24(m,1h),4.14-4.02(m,1h),4.00-3.88(m,1h),3.85(d,j=4.1hz,3h),3.60-3.32(m,5h),2.91-2.44(m,5h),2.30-1.84(m,2h),1.49(s,9h)。
[0538]
步骤c:在室温下向4-[[(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-基]甲基]哌嗪-1-甲酸叔丁酯(0.100克,0.20毫摩尔)在dcm(3毫升)中的搅拌溶液中加入bbr3(0.500克,2.00毫摩尔)。反应搅拌3小时,用meoh(2毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在6.5分钟内由20%b至40%b;检测器:uv 254/210nm;保留时间:6.45分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的(6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(哌嗪-1-基甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(51.0毫克,51%):对c
17h21
cl2n3o3计算的lcms(esi)[m+h]
+
386,388(3:2),实测386,388(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.7hz,1h),6.74(dd,j=8.8,1.4hz,1h),5.02-4.94(m,0.5h),4.73-4.68(m,0.5h),4.47-4.17(m,1h),4.01-3.88(m,2h),3.43(td,j=10.4,4.6hz,1h),3.31-3.24(m,4h),3.01-2.79(m,6h),2.421.81(m,2h)。
[0539]
步骤d:(6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(哌嗪-1-基甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(51.0毫克,0.10毫摩尔)通过制备手性hplc采用以下条件来分离:柱:chiralpak ig,20
×
250mm,5μm;流动相a:hex(加0.5%2m nh
3-meoh)-hplc,流动相b:etoh-hplc;流速:20ml/min;梯度:在17分钟内由30%b至30%b;检测器:uv 254/220nm;保留时间1:11.13分钟;保留时间2:15.48分钟。获得在11.13分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物279((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(哌嗪-1-基甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体1)(8.6毫克,27.6%):对c
17h21
cl2n3o3计算的lcms(esi)[m+h]
+
:386,388(3:2),实测386,388(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.74(d,j=8.8hz,1h),5.00-4.93(m,1h),4.39-4.29(m,1h),4.27-4.14(m,1h),3.96(dd,j=10.7,7.4hz,1h),3.45-3.40(m,1h),2.93-2.89(m,4h),2.80-2.69(m,2h),2.69-2.59(m,2h),2.59-2.51(m,2h),2.36-2.30(m,1h),1.92-1.84(m,1h)。获得在11.13分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物280((6r,7as)-6-(2,3-二氯-6-羟苯基)-1-(哌嗪-1-基甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮异构体2)(5.7毫克,18.27%):对c
17h21
cl2n3o3计算的lcms(esi)[m+h]
+
:386,388(3:2),实测386,388(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.74(d,j=8.8hz,1h),4.71-4.63(m,1h),4.46-4.30(m,1h),3.97-3.87(m,2h),3.46-3.40(m,1h),2.95-2.90(m,4h),2.82-2.67(m,2h),2.67-2.54(m,4h),2.29-2.16(m,2h)。
[0540]
实施例104.以类似于对化合物279-280所描述的方式制备化合物281-285。
[0541]
实施例105.化合物286((6r,7as)-6-(2,3-二氯-6-羟苯基)-3-氧代四氢-1h,3h-吡咯并[1,2-c]噁唑-1-甲酰胺异构体1)和化合物287((6r,7as)-6-(2,3-二氯-6-羟苯基)-3-氧代四氢-1h,3h-吡咯并[1,2-c]噁唑-1-甲酰胺异构体2)步骤a:在0℃下向(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-1-(羟甲基)-四氢-1h-吡咯并[1,2-c][1,3]噁唑-3-酮(实施例18,步骤b)(0.400克,1.20毫摩尔)在ccl4(3毫升)和acn(3
毫升)中的搅拌溶液中加入在水(1毫升)中的naio4(0.900克,4.22毫摩尔),随后加入rucl3·
h2o(14.0毫克,0.06毫摩尔)。反应在室温下搅拌16小时并在0℃下用水(50毫升)稀释,随后用ea(3
×
50毫升)萃取。合并的有机层用盐水(3
×
50毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用45%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为灰白色泡沫的(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-甲酸(0.340克,82%):对c
14h13
cl2no5计算的lcms(esi)[m+h]
+
:346,348(3:2),实测346,348(3:2);1h nmr(400mhz,cdcl3)δ7.40-7.31(m,1h),6.83-6.73(m,1h),5.29-4.75(m,1h),4.49-4.32(m,1h),4.25-4.09(m,1h),4.02-3.90(m,1h),3.86(s,3h),3.54-3.39(m,1h),2.45-2.27(m,1h),2.20-2.06(m,1h)。
[0542]
步骤b:在室温下向(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-甲酸(70.0毫克,0.20毫摩尔)、hobt(42.0毫克,0.30毫摩尔)和edci(58.0毫克,0.30毫摩尔)在dmf(1毫升)中的搅拌溶液中加入nh4cl(55.0毫克,1.01毫摩尔)和tea(61.0毫克,0.61毫摩尔)。反应在40℃下搅拌24小时并用水(30毫升)稀释,随后用ea(3
×
30毫升)萃取。合并的有机层用盐水(3
×
30毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过用50%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为无色油的(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-甲酰胺(40.0毫克,57%):对c
14h14
cl2n2o4计算的lcms(esi)[m+h]
+
:345,347(3:2),实测345,347(3:2);1h nmr(400mhz,cdcl3)δ7.36(d,j=8.9hz,1h),6.79(d,j=8.9hz,1h),6.73(s,1h),6.02(s,1h),4.76(d,j=2.6hz,1h),4.45-4.34(m,1h),4.32-4.20(m,1h),3.91(dd,j=11.3,6.3hz,1h),3.86(s,3h),3.49-3.40(m,1h),2.45-2.32(m,1h),2.12-2.06(m,1h)。
[0543]
步骤c:在室温下向(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-甲酰胺(40.0毫克,0.12毫摩尔)在dcm(1毫升)中的搅拌溶液中加入bbr3(0.290克,1.16毫摩尔)。所得混合物搅拌4小时,用meoh(2毫升)猝灭并在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x select csh prep c18 obd column,19
×
250mm,5μm;流动相a:水(加0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在6.5分钟内由35%至40%;检测器:uv 254/220nm;保留时间1:6.54分钟;保留时间2:7.01分钟。获得在6.54分钟处的较快洗脱的异构体,其为作为灰白色固体的化合物286((6r,7as)-6-(2,3-二氯-6-羟苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-甲酰胺异构体1)(6.9毫克,18%):对c
13h12
cl2n2o4计算的lcms(esi)[m+h]
+
:331,333(3:2),实测331,333(3:2);1h nmr(400mhz,cd3od)δ7.24(d,j=8.8hz,1h),6.74(d,j=8.8hz,1h),5.20(d,j=8.7hz,1h),4.49-4.33(m,2h),3.98(dd,j=10.7,7.3hz,1h),3.49-3.43(m,1h),2.25-2.19(m,1h),2.03-1.93(m,1h)。获得在7.01分钟处的较慢洗脱的异构体,其为作为灰白色固体的化合物287((6r,7as)-6-(2,3-二氯-6-羟苯基)-3-氧代-四氢-1h-吡咯并[1,2-c][1,3]噁唑-1-甲酰胺异构体2)(6.8毫克,17.72%):对c
13h12
cl2n2o4计算的lcms(esi)[m+h]
+
:331,333(3:2),实测331,333(3:2);1h nmr(400mhz,cd3od)δ7.25(d,j=8.7hz,1h),6.75(d,j=8.7hz,1h),4.87(d,j=3.4hz,1h),4.48-4.35(m,1h),4.20(td,j=8.3,3.4hz,1h),3.93(dd,j=10.8,
6-甲氧基苯基)-2-[[(2-甲氧基乙基)氨基]甲基]吡咯烷-1-甲酸叔丁酯(0.500克,86%)。对c
20h30
cl2n2o4计算的lcms(esi)[m+h]
+
:433,435(3:2),实测433,435(3:2);1h nmr(400mhz,cdcl3)δ7.37(d,j=8.9hz,1h),6.78(d,j=9.0hz,1h),4.25-4.07(m,2h),3.86(s,3h),3.81-3.73(m,1h),3.74-3.61(m,3h),3.55(s,1h),3.52-3.34(m,4h),3.24-3.11(m,2h),2.48-2.26(m,2h),1.49(s,9h)。
[0546]
步骤b:在室温下向(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)-2-[[(2-甲氧基乙基)氨基]甲基]吡咯烷-1-甲酸叔丁酯(0.500克,1.15毫摩尔)在dcm(4毫升)中的搅拌溶液中加入tfa(1毫升)。反应搅拌1小时并在减压下浓缩。残余物通过用50%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为浅黄色油的[[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]甲基](2-甲氧基乙基)胺(0.400克,73%):对c
15h22
cl2n2o2计算的lcms(esi)[m+h]
+
:333,335(3:2),实测333,335(3:2)。
[0547]
步骤c:在0℃下向[[(2s,4r)-4-(2,3-二氯-6-甲氧基苯基)吡咯烷-2-基]甲基](2-甲氧基乙基)胺(0.300克,0.90毫摩尔)在acn(3毫升)中的搅拌溶液中加入cdi(0.100克,0.63毫摩尔)。反应在0℃下搅拌12小时,用水猝灭,并在减压下浓缩。残余物通过用50%在水中的acn(加0.05%tfa)洗脱的反相色谱法提纯以提供作为无色油的(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-2-(2-甲氧基乙基)-四氢-1h-吡咯并[1,2-c]咪唑-3-酮(0.160克,49%):对c
16h20
cl2n2o3计算的lcms(esi)[m+h]
+
:359,361(3:2),实测359,361(3:2)。
[0548]
步骤d:在室温下向(6r,7as)-6-(2,3-二氯-6-甲氧基苯基)-2-(2-甲氧基乙基)-四氢-1h-吡咯并[1,2-c]咪唑-3-酮(80.0毫克,0.22毫摩尔)在dcm(1毫升)中的搅拌溶液中加入bbr3(0.560克,2.22毫摩尔)。反应搅拌1小时,用饱和nh4hco3水溶液(20毫升)猝灭,随后用ea(3
×
20毫升)萃取。合并的有机层用盐水(3
×
20毫升)洗涤并在无水na2so4上干燥。过滤后,滤液在减压下浓缩。残余物通过制备hplc采用以下条件提纯:柱:x bridge shield rp18 obd column,19
×
250mm,10μm;流动相a:水(加10mm nh4hco3),流动相b:acn;流速:20ml/min;梯度:在5.5分钟内由40%b至70%b;检测器uv 254/210nm;保留时间:5.53分钟。收集含有所需产物的级分并在减压下浓缩以提供作为灰白色固体的化合物290((6r,7as)-6-(2,3-二氯-6-羟苯基)-2-(2-羟乙基)-四氢-1h-吡咯并[1,2-c]咪唑-3-酮(13.0毫克,17%):对c
14h16
cl2n2o3计算的lcms(esi)[m+h]
+
:331,333(3:2),实测331,333(3:2):1h nmr(400mhz,cd3od)δ7.20(d,j=8.8hz,1h),6.71(d,j=8.8hz,1h),4.38-4.19(m,1h),4.01-3.87(m,2h),3.83-3.63(m,3h),3.54(dd,j=9.4,2.2hz,1h),3.39-3.35(m,2h),3.30-3.24(m,1h),2.29-2.23(m,1h),2.06-1.90(m,1h)。
[0549]
实施例108.以类似于对化合物290所描述的方式制备化合物291-293。
[0550]
实施例109.kv1.3钾通道阻滞剂活性的评价该测定用于评价所公开的化合物作为kv1.3钾通道阻滞剂的活性。
[0551]
细胞培养将稳定表达kv1.3的cho-k1细胞在含有10%热灭活的fbs、1mm丙酮酸钠、2mm l-谷氨酰胺和g418(500μg/ml)的dmem中培养。在5%co2增湿培养箱中在37℃在培养瓶中培养细胞。
[0552]
溶液将细胞浸入含有140mm nacl、4mm kcl、2mm cacl2、1mm mgcl2、5mm葡萄糖和10mm hepes的细胞外溶液中;用naoh将ph调至7.4;295-305mosm。内部溶液含有50mm kcl、10mm nacl、60mm kf、20mm egta和10mm hepes;用koh将ph调至7.2;285mosm。将所有化合物以30mm溶解在dmso中。将化合物储备溶液用外部溶液新鲜稀释至30nm、100nm、300nm、1μm、3μ
m、10μm、30μm和100μm的浓度。dmso的最高含量(0.3%)存在于100μm中。
[0553]
电压方案通过施加从-90mv(保持电位)至+40mv的100ms除极化脉冲以0.1hz频率施加而诱发电流。所应用的每种化合物浓度的对照(无化合物)和化合物脉冲串含有20个脉冲。
[0554]
在脉冲串之间使用了10秒间歇(见下表2)。
[0555]
表2.电压方案
[0556]
膜片箝记录和化合物应用借助于自动化膜片箝平台patchliner(nanion technologies gmbh)实现全细胞电流记录和化合物应用。将epc 10膜片箝放大器(heka elektronik dr.schulze gmbh)以及patchmaster软件(heka elektronik dr.schulze gmbh)用于数据采集。将数据在10khz采样,没有过滤。使用p/4程序(heka elektronik dr.schulze gmbh)在线减去被动泄漏电流。将递增的化合物浓度连续应用到相同细胞,之间没有冲洗。在下一个脉冲串之前的总化合物温育时间不超过10秒。在化合物平衡期间观察到峰值电流抑制。
[0557]
数据分析用patchmaster(heka elektronik dr.schulze gmbh)获得auc和峰值。为了确定ic
50
,使用了对应于给定化合物浓度的脉冲串中的最后一个单脉冲。将在化合物存在下获得的auc和峰值标准化到不存在化合物时的对照值。使用origin(oridinlab),从拟合至hill方程式的数据得到ic
50
:i
化合物
/i
对照
=(100-a)/(1+([化合物]/ic
50
)nh)+a,其中ic
50
值是电流
抑制为半数最大值时的浓度,[化合物]是应用的化合物浓度,a是未被阻断的电流分数,且nh是希尔系数。
[0558]
实施例110.herg活性的评价该测定用于评价公开的化合物对herg通道的抑制活性。
[0559]
herg电生理学该测定用于评价公开的化合物对herg通道的抑制活性。
[0560]
细胞培养将稳定表达herg的cho-k1细胞在含有10%热灭活的fbs、1%青霉素/链霉素、潮霉素(100μg/ml)和g418(100μg/ml)的ham's f-12培养基(含有谷氨酰胺)中培养。在5%co2增湿培养箱中在37℃在培养瓶中培养细胞。
[0561]
溶液将细胞浸入含有140mm nacl、4mm kcl、2mm cacl2、1mm mgcl2、5mm葡萄糖和10mm hepes的细胞外溶液中;用naoh将ph调至7.4;295-305mosm。内部溶液含有50mm kcl、10mm nacl、60mm kf、20mm egta和10mm hepes;用koh将ph调至7.2;285mosm。将所有化合物以30mm溶解在dmso中。将化合物储备溶液用外部溶液新鲜稀释至30nm、100nm、300nm、1μm、3μm、10μm、30μm和100μm的浓度。dmso的最高含量(0.3%)存在于100μm中。
[0562]
电压方案将电压方案(见表3)设计成模拟心脏动作电位期间的电压变化,其中300ms除极化至+20mv(类似于心脏动作电位的平台期),复极化300ms至-50mv(诱导尾电流),和最后一步达到-80mv的保持电位。脉冲频率为0.3hz。应用的每种化合物浓度的对照(无化合物)和化合物脉冲串包含70个脉冲。
[0563]
表3.herg电压方案膜片箝记录和化合物应用借助于自动化膜片箝平台patchliner(nanion)实现全细胞电流记录和化合物应用。将epc 10膜片箝放大器(heka)以及patchmaster软件(heka elektronik dr.schulze gmbh)用于数据采集。将数据以10khz采样,没有过滤。将递增的化合物浓度连续应用到相同细胞,之间没有冲洗。
[0564]
数据分析用patchmaster(heka elektronik dr.schulze gmbh)获得auc和peak值。为了确定ic
50
,使用了对应于给定化合物浓度的脉冲串中的最后一个单脉冲。将在化合物存在下获得的auc和peak值标准化至不存在化合物时的对照值。使用origin(oridinlab),从拟合至hill方程式的数据得到ic
50
:i
化合物
/i
对照
=(100-a)/(1+([化合物]/ic
50
)nh)+a,其中ic
50
是电流抑制为半数最大值时的浓度,[化合物]是应用的化合物浓度,a是未被阻断的电流分数,
且nh是希尔系数。
[0565]
表4和表5提供了某些选定的化合物对kv1.3钾通道和herg通道的抑制活性的总结。
[0566]
表4.某些示例的化合物对kv1.3钾通道和herg通道的ic
50
(μm)值
*未测试。
[0567]
表5.某些例示的化合物对kv1.3钾通道和herg通道的ic
50
(μm)值
*未测试。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1