用细胞周期蛋白依赖性激酶7(CDK7)抑制剂治疗生物标志物鉴定的患者的癌症的方法与流程
用细胞周期蛋白依赖性激酶7(cdk7)抑制剂治疗生物标志物鉴定的患者的癌症的方法
1.相关申请的交叉引用
2.本技术要求于2019年10月29日提交的美国临时申请第62/927,561号的申请日的权益,其内容通过引用整体并入本文。
3.发明背景
4.医疗保健的长期演进已经到了开始实现生物标志物分析承诺的时间点。当医生可以将患者、甚至是那些具有许多相似生特征并表现出给定疾病的普遍症状的患者分层到更具体的组时,他们可以更好地为每个患者量身定制治疗并优化结果。然而,开发分子诊断技术具有挑战性,并且很少能够商用。
技术实现要素:
5.本发明的特征尤其在于用于鉴定可用本文所述的cdk7抑制剂治疗的癌症患者的诊断方法(即,用于选择可治疗的患者的诊断方法)以及用单独或与一种或多种额外的治疗剂(例如,第二抗癌剂)联合的此类抑制剂治疗所鉴定的患者的方法,如下文进一步描述。诊断方法包括鉴定有可能对本文公开的cdk7抑制剂治疗有良好反应的癌症患者的步骤,如下文显示和进一步描述。治疗方法包括将此类cdk7抑制剂施用于所鉴定的患者的步骤,其反应可以是,例如,显著抑制肿瘤生长(tgi;例如超过约80%至90%的tgi和/或即使在停止治疗之后仍继续抑制肿瘤)。因此,本发明涵盖了其中患者仅被诊断为治疗的良好候选者(即,鉴定为可进行治疗的患者)的方法,其中已被确定为治疗的良好候选者(例如,先前所鉴定的患者)的患者接受了治疗的方法,以及要求患者如本文所述既被诊断也接受治疗的方法。
6.当我们提及“本文所述的cdk7抑制剂”时,我们表示包括本文所述那些化合物的任何一种的化合物,包括式(i)的化合物:
[0007][0008]
或其药学上可接受的盐,其中:
[0009]
环a是选自的双环6,5环系统,并且包含不超过四个环氮原子;
[0010]
x是n或c(r6),其中r6是氢、-cn、-ch3、-ch2f、-chf2或-cf3;
[0011]
每个y独立地是n或c(r7),其中r7是氢或r5;
[0012]
z是n或c(r8),其中r8是氢或氟;
[0013]
r1是氢、-c
1-c6烷基、-o-(c
1-c
6-亚烷基)-o-(c
1-c
4-烷基)、-(c
0-c6亚烷基)-(c
3-c8环烷基)、-(c
1-c6亚烷基)-杂环基、-(c
1-c6亚烷基)-杂芳基、-(c
1-c6亚烷基)-n(r1’
)2、-(c
1-c6亚烷基)-nr1’‑
s(o)
2-(c
1-c4烷基)、-(c
1-c6亚烷基)-nr1’‑
so
2-n(r1’
)2、-(c
1-c6亚烷基)-s(o)
2-(c
1-c4烷基)或-(c
1-c6亚烷基-s(o)
2-n(r1’
)2,其中r1的任何烷基、亚烷基、环烷基、杂环基或杂芳基部分任选地被取代;
[0014]
每个r1’
独立地是氢或任选地取代的c
1-c6烷基,或
[0015]
两个r1’
任选地与它们所结合的氮原子一起形成包含至多2个选自n、o和s的额外杂原子的4-6元、任选地取代的杂环基或杂芳基环,其中:
[0016]
如果存在,每个r2独立地是卤素、-oh、-cn、-c
1-c6烷基、-(c
0-c6亚烷基)-(c
3-c8环烷基)、-(c
0-c6亚烷基)-杂环基、-(c
0-c6亚烷基)-杂芳基、-(c
0-c6亚烷基)-芳基、-(c
0-c6亚烷基)-c(o)-杂环基、-(c
0-c6亚烷基)-c(o)-杂芳基、-o-(c
1-c
6-烷基);-o-(c
1-c
6-亚烷基)-o-(c
1-c
4-烷基);-o-(c
1-c
4-亚烷基)-(c
3-c8环烷基)、-o-(c
1-c
6-亚烷基)-杂环基、-o-(c
1-c
6-亚烷基)-杂芳基或-o-(c
1-c
6-亚烷基)-芳基,或
[0017]
r1和任何r2与它们所结合的原子一起形成与哌啶环稠合、螺合或桥接的任选地取代的杂环基或杂芳基环,或
[0018]
两个r2一起形成氧代(=o),或与它们所结合的一个或多个原子以及任何居间的环原子一起形成与哌啶环稠合、螺合或桥接的任选地取代的芳基、环烷基、杂环基或杂芳基环,
[0019]
其中r2的任何烷基、亚烷基、环烷基、杂环基或杂芳基部分、r1与r2一起形成的任何环、或者两个r2一起形成的任何环任选地被取代:
[0020]
r3是氢、卤素、-cn、任选地取代的-c
1-c6烷基或任选地取代的c
3-c8环烷基;
[0021]
r4是卤素、-cn、-c
1-c6烷基、-c
2-c6烯基、c
2-c6炔基、-o-c
1-c6烷基、-s-c
1-c6烷基或c
3-c8环烷基,其中r4的任何烷基、烯基或炔基部分任选被取代;
[0022]
每个r5独立地是卤素、-oh、-c
1-c6烷基、-cn、-(c
0-c6亚烷基)-c(o)oh、-(c
0-c6亚烷基)-c(o)-(c
1-c4烷基)、-(c
0-c6亚烷基)-c(o)-n(r1’
)2、-(c
0-c6亚烷基)-s(o)
2-(c
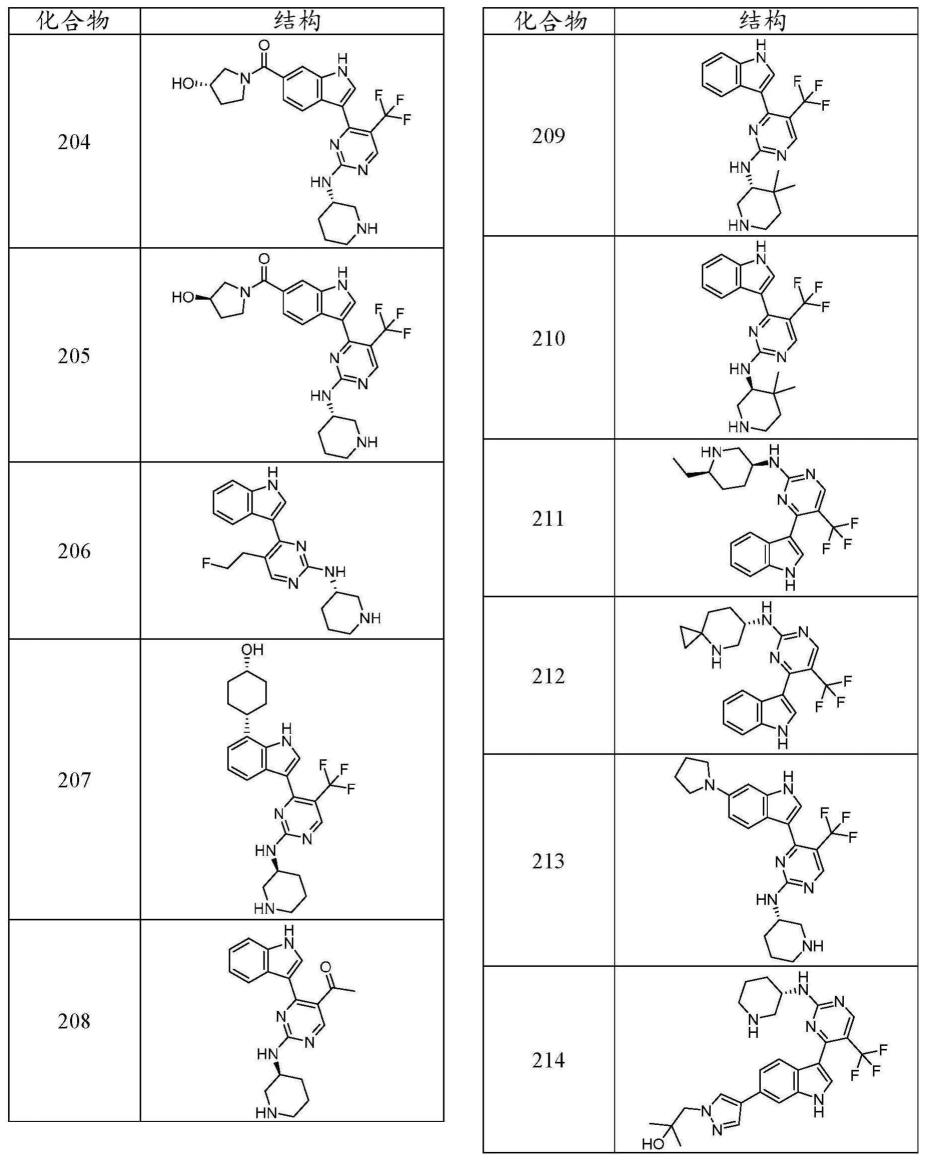
1-c4烷基)、-(c
0-c6亚烷基)-s(o)
2-n(r1’
)2、-(c
0-c6亚烷基)-p(o)-o-(c
1-c4烷基)2、-(c
0-c6亚烷基)-p(o)-(c
1-c4烷基)(o-c
1-c4烷基)、-(c
0-c6亚烷基)-p(o)(c
1-c4烷基)2、-(c
0-c6亚烷基)-(c
3-c8环烷基)、-(c
0-c6亚烷基)-杂环基、-(c
0-c6亚烷基)-杂芳基、-(c
0-c6亚烷基)-c(o)-杂环基、-(c
0-c6亚烷基)-c(o)-杂芳基、-o-(c
1-c
6-烷基)、-o-(c
1-c
6-亚烷基)-o-(c
1-c
4-烷基)、-o-(c
0-c
6-亚烷基)-(c
3-c8环烷基)、-o-(c
1-c
6-亚烷基)-杂环基或-o-(c
1-c
6-亚烷基)-杂芳基,其中r5的任何烷基、亚烷基、环烷基、杂环基和杂芳基部分任选地被取代;或
[0023]
两个连位r5与它们所结合的环原子一起形成任选地取代的环烷基或任选地取代的杂环基,其中每个环烷基或杂环基与环a稠合;
[0024]
r5’
是氢、-cn、-c
1-c6烷基、-(c
0-c6亚烷基)-s(o)
2-n(r1’
)2、-(c
0-c6亚烷基)-(c
3-c8环烷基)、-(c
0-c6亚烷基)-c(o)-n(r1’
)2、-(c
0-c6亚烷基)-芳基、-(c
0-c6亚烷基)-杂环基、-(c
0-c6亚烷基)-杂芳基、-(c
0-c6亚烷基)-s(o)
2-(c
1-c4烷基)、-(c
1-c6亚烷基)-o-(c
1-c3亚烷基)-c(o)-n(r1’
)2、-(c
1-c6亚烷基)-o-(c
1-c4亚烷基)-p(o)(c
1-c4烷基)2、-(c
1-c6亚烷基)-o-(c
1-c4亚烷基)-p(o)(c
1-c4烷基)-o-(c
1-c4烷基)、-(c
1-c6亚烷基)-o-(c
1-c4亚烷基)-p(o)-(o-c
1-c4烷基)2、-(c
1-c6亚烷基)-o-(c
1-c4亚烷基)-s(o)
2-(c
1-c4烷基)、-(c
1-c6亚烷
基)-o-(c
1-c4亚烷基)-s(o)
2-n(r1’
)2、-(c
1-c6亚烷基)-o-(c
1-c4烷基)、-(c
1-c6亚烷基)-o-(c
3-c8环烷基)、-(c
1-c6亚烷基)-o-杂芳基、-(c
1-c6亚烷基)-o-杂环基、-(c
1-c6亚烷基)-p(o)(c
1-c4烷基)2、-(c
1-c6亚烷基)-p(o)(c
1-c4烷基)-o-(c
1-c4烷基)、-(c
1-c6亚烷基)-p(o)-(o-c
1-c4烷基)2、-(c
1-c6亚烷基)-c(o)-(c
1-c4烷基)或-(c
1-c6亚烷基)-c(o)oh,其中r5’
的任何烷基、亚烷基、环烷基、杂环基或杂芳基部分任选地被取代;和
[0025]
n是0、1、2、3或4。如有疑问,则每种此类化合物都是“本文所述的cdk7抑制剂”,如下所述的每个实施方案和不同的化合物也是如此。
[0026]
在各种实施方案中,r1是-c(o)-o-(c
1-c6烷基)或-(c
0-c6亚烷基)-碳环基,其中碳环基任选被取代。
[0027]
在各种实施方案中,如果存在,每个r2是-nh-c(o)-c
1-c4烷基、-c(o)-nh-(未取代的c
1-c4烷基)、-(c
0-c6亚烷基)-碳环基或-o-(c
1-c
4-亚烷基)-碳环基,其中每个亚烷基或碳环基任选地被取代。
[0028]
在一些实施方案中,r3另外地选自任选地取代的碳环基。
[0029]
在一些实施方案中,r4另外地选自任选地取代的碳环基。
[0030]
在一些实施方案中,每个r5另外地选自-(c
0-c6亚烷基)-碳环基、-o-(c
0-c
6-亚烷基)-碳环基、苯基、-(c
2-c4亚烯基)-苯基、-s(o)-(c
1-c4烷基)、-s-(c
1-c4烷基)、-s(o)-oh和-s(o)
2-oh,其中任何烷基、亚烷基、亚烯基、碳环基或苯基任选地被取代。
[0031]
在一些实施方案中,r5’
和任何r5与它们所结合的环原子一起形成任选地取代的杂环基,其中每个杂环基与环a稠合。
[0032]
在一些实施方案中,式(i)化合物不是:
[0033]
或前述化合物的药用盐。
[0034]
在一些实施方案中,式(i)化合物不是:
[0035][0036]
或前述化合物的任何一种的药学上可接受的盐。
[0037]
在一些实施方案中,环a是:
[0038][0039]
在一些实施方案中,环a是吲哚-3-基或吲唑-3-基。在一些实施方案中,环a是吲哚-3-基。在一些实施方案中,环a是:
[0040][0041]
在一些实施方案中,r1的任何烷基或亚烷基部分任选地被一个或多个独立选择的一价取代基取代(例如,此类取代基不包括=o)。
[0042]
在一些实施方案中,r1的任何杂环基或杂芳基部分任选地且独立地被一个或多个独立地选自以下各项的取代基取代:卤素、c
1-c4烷基、c
3-c6环烷基、-oh、=o、-cn、-c(o)n(r1’
)2、-s(o)
2-(c
1-c
4-烷基)和-s(o)
2-n(r1’
)2;r1的任何烷基、亚烷基或环烷基部分或其上的取代基任选地被一个或多个独立地选自氟、oh和cn的取代基取代。
[0043]
在一些实施方案中,r1是氢、-c
1-c6烷基、-o-(c
1-c
6-亚烷基)-o-(c
1-c
4-烷基)、-(c
1-c6亚烷基)-n(r1’
)2、-(c
1-c6亚烷基)-nr1’‑
s(o)
2-(c
1-c4烷基)、-(c
1-c6亚烷基)-nr1’‑
so
2-n(r1’
)2、-(c
1-c6亚烷基)-s(o)
2-(c
1-c4烷基)、-(c
1-c6亚烷基-s(o)
2-n(r1’
)2、或者-(c
0-c6亚烷基)-(c
3-c8环烷基),其中r1的任何烷基或亚烷基部分任选地被一个或多个独立选择的一价取代基取代,r1的任何环烷基部分任选地被一个或多个独立选择的取代基取代;并且其中每个r1’
独立地是氢或任选地取代的c
1-c6烷基(即两个r1’
不能一起形成环)。
[0044]
在一些实施方案中,r1是氢、环丙基、-ch3、-ch2ch3、-ch2ch2och3、-ch(ch3)2或-ch2ch(ch3)2,或r1与一个r2及各自连接的环原子一起形成桥环,该桥环与r1和r2所结合的环一起形成在一些实施方案中,r1是氢、-ch3或-ch2ch2och3。在一些实施方案中,r1是氢。
[0045]
在一些实施方案中,任何r1’
中的每个烷基任选地被一个或多个独立地选自氟、-oh和-cn的取代基取代。
[0046]
在一些实施方案中,由两个r1’
形成的任何杂环基和杂芳基环任选地被一个或多
个独立地选自以下各项的取代基取代:卤素;c
1-c4烷基;c
3-c6环烷基,其任选被一个或多个独立地选自氟、-oh和-cn的取代基取代;-oh;=o;-cn;-c(o)nh2;-c(o)nh(c
1-c4烷基);-c(o)n(c
1-c4烷基)2;-s(o)
2-c
1-c
4-烷基;-s(o)
2-nh2;-s(o)
2-nh(c
1-c4烷基);和-s(o)
2-n(c
1-c4烷基)2,其中由两个r1’
形成的任何杂环基和杂芳基环上的取代基的任何烷基部分任选地被一个或多个独立地选自氟、-oh和-cn的其他取代基取代。
[0047]
在一些实施方案中,r2的任何烷基、亚烷基或芳基部分任选地被一个或多个独立选择的一价取代基取代。例如,r2的任何烷基、亚烷基、芳基、环烷基、杂环基或杂芳基部分,通过r1与r2一起形成的任何环,或通过两个r2一起形成的任何环,可以任选地被一个或多个独立选择的一价取代基取代。
[0048]
在一些实施方案中,r2的任何杂环基和杂芳基部分任选地被一个或多个独立地选自以下各项的取代基取代:卤素、-c
1-c4烷基、-oh、=o、-cn、-c(o)n(r1’
)2、-c(o)or1’
、-c(o)oh、-s(o)
2-(c
1-c
4-烷基)、-s(o)
2-n(r1’
)2;并且r2的任何烷基、亚烷基和环烷基部分或其上的取代基任选地被一个或多个独立地选自氟、-oh和-cn的取代基取代。
[0049]
在一些实施方案中,当两个r2一起形成环,或r1和r2一起形成环时,所得环任选地被一个或多个独立地选自以下各项的取代基取代:卤素、c
1-c4烷基、-oh、=o、-cn、-c(o)nr1’2、-s(o)
2-c
1-c
4-烷基、-s(o)
2-n(r1’
)2;当两个r2一起形成环或r1和r2一起时,并且形成的环上的取代基的任何烷基部分任选地被一个或多个独立地选自氟、-oh和-cn的取代基取代。在一些实施方案中,如果存在,每个r2独立地选自卤素、-oh、-c
1-c6烷基、-nhc(o)-(c
1-c4烷基)、-c(o)nh-c
1-c4烷基、-c(o)-(任选地取代的杂环基)、任选地取代的芳基和任选地取代的杂芳基;或
[0050]
r1和任何r2与它们所结合的原子一起形成与哌啶环稠合、螺合或桥接的任选地取代的杂环基或杂芳基环,或
[0051]
两个r2一起形成氧代(=o),或与它们所结合的一个或多个原子以及任何居间的环原子一起形成与哌啶环稠合、螺合或桥接的任选地取代的芳基、环烷基、杂环基或杂芳基环,
[0052]
其中r2的任何烷基或亚烷基部分、由r1与r2一起形成的任何环、或者由两个r2一起形成的任何环任选地被一个或多个独立选择的一价取代基取代。
[0053]
在一些实施方案中,如果存在,每个r2独立地是卤素、=o、-oh、任选地取代的-c
1-c4烷基、任选地取代的苯基或任选地取代的杂芳基。在一些实施方案中,作为-c
1-c4烷基或苯基的每个r2任选地被一个或多个独立选择的一价取代基取代。在一些实施方案中,如果存在,每个r2独立地是卤素或任选地取代的-c
1-c4烷基。在一些实施方案中,如果存在,每个r2独立地是卤素或任选地被一个或多个独立选择的一价取代基取代的-c
1-c4烷基。在一些实施方案中,如果存在,每个r2是卤素。在一些实施方案中,如果存在,每个r2是任选地取代的-c
1-c4烷基。在一些实施方案中,如果存在,每个r2任选地被一个或多个独立选择的一价取代基取代的-c
1-c4烷基。
[0054]
在一些实施方案中,n是0、1、2或3。
[0055]
在一些实施方案中,n是0、1、2或3,并且如果存在,每个r2独立地是氟、-ch3、-ch2ch3、-oh或未取代的苯基,或两个r2一起形成氧代。
[0056]
在一些实施方案中,n是0、1、2或3,并且如果存在,每个r2独立地是-ch(ch3)2、-c
(o)nhch3、-nhc(o)ch2ch3、3-甲基-1,2,4-恶二唑-5-基、1,2,4-三唑并[4,3-a]吡啶-3-基、8-(甲基磺酰基)-1,2,4-三唑并[4,3-a]吡啶-3-基、吡咯烷-1-基羰基或3-羟基吡咯烷-1-基羰基;或不同原子上的两个r2与它们所结合的原子及任何居间的环原子一起形成环,该环与两个r2所结合的哌啶环一起形成或两个与同一环原子结合的r2与它们所结合的原子一起形成环,该环与两个r2所结合的哌啶环一起形成:所结合的哌啶环一起形成:
[0057]
在一些实施方案中,r3的每个烷基或环烷基部分任选地且独立地被一个或多个氟取代。
[0058]
在一些实施方案中,r3是氢。
[0059]
在一些实施方案中,r4的任何烷基、烯基、炔基或环烷基部分任选地且独立地被一个或多个独立地选自-oh和氟的取代基取代。
[0060]
在一些实施方案中,r4是卤素、-cn、任选地取代的c
1-c4烷基、任选地取代的c
2-c4炔基、任选地取代的-o-c
1-c4烷基或任选地取代的c
3-c6环烷基。在一些实施方案中,r4是卤素、-cn、任选地取代的c
1-c4烷基或任选地取代的c
1-c4卤代烷基。在一些实施方案中,r4是卤素、c
1-c4烷基或c
1-c4卤代烷基。在一些实施方案中,r4是c
1-c4烷基。在一些实施方案中,r4是c
1-c4卤代烷基。在一些实施方案中,r4是卤素。
[0061]
在一些实施方案中,r4是氢或-c(o)-(任选地取代的c
1-c4烷基)。
[0062]
在一些实施方案中,r4是氯、氟、溴、碘、环丙基、-cn、-cf3、-ch2cf3、-ch3、-ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-och3或-cchh。在一些实施方案中,r4是氯、氟、-cf3、-ch2cf3、-ch3、-ch2ch3或-ch氟、。在一些实施方案中,r4是氯、-cf3、-ch3或-ch2ch3。在一些实施方案中,r4是氯或-cf3。在一些实施方案中,r4是氯。在一些实施方案中,r4是-cf3。
[0063]
在一些实施方案中,r4是-ch2ch2f、-ch2ch2ch3、-ch(oh)ch3、-ch=ch2、-c(o)ch3、-ochf2、-s-ch3、-s-chf2或-s-cf3。
[0064]
在一些实施方案中,每个r5的任何杂环基或杂芳基部分或两个连位的r5结合在一起时形成的环任选地且独立地被一个或两个独立地选自卤素、-cn、c
1-c6烷基、-oh、=o、-c(o)nr1’2或-so2-nr1’2的取代基取代;r5的任何烷基、亚烷基和环烷基部分,r5上的取代基,或者通过将两个r5结合在一起形成的环上的取代基,任选地被一个或多个独立地选自氟、-oh和-cn的取代基取代。
[0065]
在一些实施方案中,一个r5是任选地取代的杂芳基或任选地取代的杂环基。例如,该杂芳基或杂环基是吡唑-4-基、咪唑-1-基、吗啉-4-基、吡啶-4-基、哒嗪-4-基、1h-吡咯-3-基、哒嗪-4-基、1,2,4-三唑-3-基或1,2,4-恶二唑-3-基;并且任选地被一个或两个选自
o-(c
1-c4烷基)。例如,r5’
可以是氢、甲基、异丙基、-ch
2-o-ch3、-(ch2)
2-o-ch3或苯基。在一些实施方案中,r6是氢或甲基。
[0072]
在一些实施方案中,式(i)化合物是式(i-a)化合物:
[0073]
(i-a)或其药学上可接受的盐,其中环a、r1、r2、r3、r4和n中的每一个如式(i)所定义。
[0074]
在一些实施方案中,式(i)化合物是式(i-b)化合物:
[0075]
(i-b)或其药学上可接受的盐,其中环a、r1、r2、r3、r4和n中的每一个如式(i)所定义。
[0076]
在一些实施方案中,式(i)化合物是式(i-c)化合物:
[0077]
(i-c)、或者其药学上可接受的盐,其中x、r2、r5、r
5,
、r7、r8和n中的每一个如式(i)所定义;y1是n或c(r
7a
);y2是n或c(r
7b
);并且x、y1或y2中不超过一个是n,其中r
7a
、r
7b
和r
7c
各自独立地选自如式(i)所定义的r7。
[0078]
在一些实施方案中,式(i-c)化合物是式(i-c1)化合物:
[0079]
(i-c1)、或者其药学上可接受的盐,其中r6也如式(i)所定义。
[0080]
在一些实施方案中,式(i-c)化合物是式(i-c2)化合物:
[0081]
(i-c2)或者其药学上可接受的盐。
[0082]
在一些实施方案中,式(i)化合物是式(ii)化合物:
[0083]
(ii)或者其药学上可接受的盐,其中:y3是n或c(r
7e
);
[0084]r2a
和r
2b
中每一个独立地是氢或c
1-c3烷基;或
[0085]r2a
和r
2b
一起形成与哌啶环螺稠合的环烷基或杂环,其中该环烷基或杂环任选地被一个或多个独立选择的c
1-c4烷基或c
1-c4卤代烷基取代;
[0086]r7d
是氢、-c(o)-(c
1-c4烷基)、-cn、或者任选被一个或多个独立选择的c
1-c4烷基或c
1-c4卤代烷基取代的杂芳基;
[0087]
如果存在,r
7e
是氢、卤素、-s(o)
2-(c
1-c4烷基)、-p(o)(c
1-c4烷基)2、-c(o)nh-(c
1-c4烷基)、-c(o)n(c
1-c4烷基)2、-s(o)2nh-(c
1-c4烷基)、-s(o)2n-(c
1-c4烷基)2、或者任选被一个或多个独立选择的c
1-c4烷基或c
1-c4卤代烷基取代的杂芳基;和
[0088]r14
是c
1-c3烷基或c
1-c3卤代烷基。
[0089]
在一些实施方案中,式(ii)化合物是式(iia)化合物:
[0090]
(iia)或者其药学上可接受的盐,其中y3、r
2a
、r
2b
、r
7d
、r
7e
和r
14
如式(ii)中所定义。
[0091]
在一些实施方案中,式(ii)化合物是式(iib)化合物:
[0092]
(iib)或者其药学上可接受的盐,其中y3、r
2a
、r
2b
、r
7d
、r
7e
和r
14
如式(ii)中所定义。
[0093]
在一些实施方案中,式(i)化合物是式(iii)化合物:
[0094]
(iii)或者其药学上可接受的盐,其中y3、r
2a
、r
2b
、r
7d
、r
7e
和r
14
如式(ii)中所定义。
[0095]
在一些实施方案中,式(iii)化合物是式(iiia)化合物:
[0096]
(iiia)或者其药学上可接受的盐,其中y3、r
2a
、r
2b
、r
7d
、r
7e
和r
14
如式(ii)中所定义。
[0097]
在一些实施方案中,式(iii)化合物是式(iiib)化合物:
[0098]
(iiib)或者其药学上可接受的盐,其中y3、r
2a
、r
2b
、r
7d
、r
7e
和r
14
如式(ii)中所定义。
[0099]
在一些实施方案中,在式(ii)、(iia)、(iib)、(iii)、(iiia)或(iiib)中任一项的化合物中:
[0100]r2a
是氢或-ch3;
[0101]r2b
是氢、-ch3、-ch2ch3或-ch(ch3)2,或者r
2a
和r
2b
一起形成氧杂环丁-3-基;
[0102]r7d
是氢、-c(o)ch3、-cn、吡啶-3-基、吡啶-4-基、1-甲基-5-氰基吡咯-3-基、1-甲基吡唑-4-基、1-甲基吡唑-3-基、1h-吡唑-4-基、1h-吡唑-3-基、1h-咪唑-2-基、1,3-二甲基吡唑-4-基、1,5-二甲基吡唑-4-基、1,5-二甲基-1,2,4-三唑-3-基、咪唑-1-基、1-二氟甲基吡唑-3-基、1-二氟甲基吡唑-4-基或噻唑-2-基;
[0103]
如果存在,r
7e
是氢、氟、氯、溴、-cn、-p(o)(ch3)2、-s(o)2ch(ch3)2、-s(o)2ch2ch3、-s(o)2n(ch3)2、-c(o)nhch3、吡啶-4-基、哒嗪-4-基、5-甲基-1h-吡唑-4-基、1-甲基吡唑-4-基、4-甲基-1h-咪唑-1-基、1h-苯并[d]咪唑-5-基、6-(三氟甲基)-1h-吡咯并[3,2-c]吡啶-3-基、1-甲基-6-(三氟甲基)-1h-吡咯并[3,2-c]吡啶-3-基、异喹啉-7-基、异喹啉-5-基、吡嗪-2-基、2h-吲唑-6-基、3,5-二甲基异恶唑-4-基、噻唑-2-基、4-甲基吡啶-3-基、1-甲基吲唑-6-基、喹啉-4-基、苯并[d]噻唑-6-基或1,3-二甲基吡唑-4-基;和
[0104]r14
是-ch3、-cf3、-ch2ch3、-ch2cf3、-ch2ch2f或-ch(ch3)2。
[0105]
在一些实施方案中,在式(ii)化合物中,r
2a
是氢或-ch3;r
2b
是氢或-ch3;r
7d
是氢、-cn、吡嗪-2-基、噻唑-2-基或3,5-二甲基异恶唑-4-基;如果存在,r
7e
是氢、氟、-c(o)nhch3、-p(o)(ch3)2、-s(o)2ch3、-s(o)2n(ch3)2、1,3-二甲基吡唑-4-基或哒嗪-4-基;r
14
是-ch2ch3或-cf3。
[0106]
在一些实施方案中,式(i)化合物是图1a-1x的表中的任何一种化合物或其药学上可接受的盐。
[0107]
本文所述的诊断和治疗方法还可以使用与吡唑并[1,5-a]嘧啶-5,7-二胺相关的化合物(即,可以将此类化合物施用于经鉴定以本文所述方式进行治疗的患者):
[0108]
并且应当重申,所有此类化合物,包括下面描述的亚属中的那些,都涵盖在“本文所述的cdk7抑制剂”的引用中。更具体地说,涉及4-[[(7-氨基吡唑并[1,5-a]嘧啶-5-基)氨基]甲基]哌啶-3-醇:
[0109]
更具体地,所使用的化合物是式(iv)的某种取代的4-[[(7-氨基吡唑并[1,5-a]嘧啶-5-基)氨基]甲基]哌啶-3-醇,其具有以下结构式,其中r
15
、r
16
和r
17
如本文所定义。
[0110]
式(iv),其中r
15
是氢、c
1-c
6-烷基(例如,甲基)或c
3-c
6-环烷基,各自任选地被1-3个(例如,1或2个)卤素(例如,氟)取代;r
16
是氢、卤素、c
1-c
6-烷基或c
1-c
6-卤代烷基;r
17
是任选地被1-3个(例如,1或2个)选自卤素(例如氟)、-cn、c
1-c
6-烷基(例如,甲基)、c
3-c
6-环烷基和c
1-c
6-卤代烷基的取代基取代的苯基。
[0111]
在一些实施方案中,r
15
是氢、c
1-c
6-烷基或c
3-c
6-环烷基。在一些实施方案中,r
15
是氢、乙基、异丙基或环丙基。在一些实施方案中,r
16
是氢或卤素。在一些实施方案中,r
17
是任选地被1个选自卤素、-cn、c
1-c
6-烷基、c
3-c
6-环烷基和c
1-c
6-卤代烷基的取代基取代的苯基。在一些实施方案中,r
17
是任选地被1个选自卤素和-cn的取代基取代的苯基。在一些实施方案中,r
15
是氢、c
1-c
6-烷基或c
3-c
6-环烷基;r
16
是氢或卤素;r
17
是任选地被1个选自卤素和-cn的取代基取代的苯基。
[0112]
示例性/有用的化合物如图2的表x所示。本诊断和/或治疗方法可以用以下化合物(icec0942)进行,该化合物也是“本文所述的cdk7抑制剂”:
[0113][0114]
本文所述的诊断和治疗方法也可以使用式(x)化合物(即,此类化合物可以施用于鉴定为以本文所述方式进行治疗的患者):(x),其中:r
a6
是c
1-c6烷基;r
a7
是c
1-c6烷基;r2是键;q是任选地取代的二价杂芳基;r3是c
1-c4亚烷基;z是单环杂芳基;r4是式(ii-1):
[0115]
(ii-1),其中l3是键;y是o、s或n(r6),其中r6是氢;r
e1
是氢;r
e2
是氢;r
e3
是ch2n(r9)2,其中r9是氢或未取代的烷基。在其他实施方案中,在式(x)化合物中,r
a6
是甲基;r
a7
是c3烷基(例如,支链c3烷基,如ch2(ch3)2);q是未取代的二价哌啶;r3是c2亚烷基;z是吡咯基;y是o;r9是甲基。在一个实施方案中,r3是c2亚烷基,其中第一个亚甲基单元被-o-替换并且第二个亚甲基单元被-c(o)-替换。在一个实施方案中,r
a7
是支链c3烷基(ch2(ch3)2),并且r3是c2亚烷基,其中第一个亚甲基单元被-o-替换并且第二个亚甲基单元被-c(o)-替换。
[0116]
例如,化合物/cdk7抑制剂可以是
[0117]
可用于本方法的其他cdk7抑制剂是:
[0118][0119]
关于ykl-5-124和ykl-5-167以及其他类似化合物的合成的信息和关于例如剂量和适应症的指导,可见于美国申请公开号2019/0055248,其全部内容通过引用并入本文。
[0120]
鉴定可进行治疗的患者的诊断方法包括通过确定生物标志物状态、已经确定生物标志物状态或接收关于生物标志物状态的信息来分析从患者获得的生物样品中的一种或多种本文所述的生物标志物的步骤。在各种实施方案中,基于以下各项来评估状态:存在野生型或突变形式的生物标志物基因,不存在野生型或突变形式的生物标志物基因(例如,基因缺失),野生型或突变形式的生物标志物基因的位置(例如,染色体易位),或野生型或突变形式的生物标志物基因的拷贝数,包含表观遗传修饰,生物标志物基因与超级增强子(se)或具有一定强度、流行率等级或顺序等级的se相关联,生物标志物基因的表达水平(例如通过其rna(例如,初级rna转录物或mrna(例如,前体mrna或成熟mrna))的表达水平所证明的),和/或由生物标志物基因编码的蛋白质的表达水平或活性水平,下文将进一步讨论
其中的每一项。本领域普通技术人员将理解rna序列可以被逆转录以生成互补dna(cdna),并且本文描述的任何方法和用途可以用从本文所述的rna生成的cdna来实施(即,可以使用cdna而不是rna确定患者的生物标志物状态)。可以根据刚刚列出的任何一个或多个特征来评估生物标志物的状态,而不管使用的确切生物标志物或评估生物标志物的精确方法或背景如何。给定生物标志物的状态(例如,其拷贝数、关联增强子、表达水平或活性)可以等于或高于预定阈值水平或临界值或者等于或低于预定阈值水平或临界值,如下进一步所述。在本发明的方法中,人们可以通过确定、已经确定和/或接收此类生物标志物的状态等于或高于(例如,高于)预定阈值水平(对于rb1-e2f家族成员,参见下表和随附的教导)的信息来分析选自基因braf、c-myc(也称为myc)、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca和某些编码e2f通路成员的基因(参见下表)或由其编码的蛋白的生物标志物。可选地,或另外地,可以通过确定、已经确定和/或接收此类生物标志物的状态等于或低于(例如,低于)预定阈值水平(对于rb/e2f家族成员,参见下表)的信息,分析选自基因bcl2样1、cdk7、cdk9、cdkn2a和rb(也称为rb1或另一个e2f通路成员)和/或由其编码的蛋白质的生物标志物。选择使用何种生物标志物可能部分取决于影响患者的特定癌症以及本文所述的其他因素。cdk18编码cdk18,cdk19编码cdk19(介体共激活复合物的组分);ccne1编码细胞周期蛋白e1(参见koff等人,cell 66:1217-1228,1991);fgfr1编码fgfr1,一种具有酪氨酸激酶活性的细胞表面膜受体;rb编码prb,其与激活剂e2f的激活剂结构域结合;bcl2样1编码bcl-xl,一种线粒体中的跨膜蛋白;cdk7编码cdk7;cdk9编码cdk9;cdkn2a编码p16和p14arf。在除智人之外的物种中,本文描述为生物标志物的基因和蛋白质的别名、染色体位置、剪接变体和同源物是本领域已知的。
[0121]
本发明的治疗方法和相应的“用途”包括施用或使用本文所述的cdk7抑制剂(例如,式(i)的化合物),其中的任何一种可以被包含在药学上可接受的组合物中并通过一定途径和方案(例如,如本文进一步描述)施用于如本文所述鉴定的患者(例如,具有本文所述癌症类型的患者)。
附图说明
[0122]
图1a至图1x是示例性/有用的式(i)化合物的表格。
[0123]
其他示例性/有用的化合物显示于下表x中。
[0124]
图2是说明可用于本发明方法的另外的cdk7抑制剂的表格(表x)。
具体实施方式
[0125]
我们相信如本文所述的cdk7抑制剂或其药学上可接受的盐在具有某些遗传特征(即,特定状态下的一种或多种生物标志物,也如本文所述)的患者中的功效将更高。此外,我们相信当如本文所述与其他抗癌疗法联合时,这些化合物及其盐在患者(包括患有本文所述的癌症和/或通过如本文所述的生物标志物鉴定的患者)中的功效可以得到增强。
[0126]
除非上下文另有明确说明,否则以下定义适用于本文所述的组合物、方法和用途,并且应理解权利要求可根据需要或预期修改以包括定义内的语言。此外,这些定义适用于已定义术语的语言和语法变体(例如,术语的单数和复数形式),下面特别提到了一些语言变体(例如,“施用(administration和administering)”)。化学元素是根据元素周期表,cas
版,handbook of chemistry and physics,第75版鉴定的。此外,有机化学的一般原理已经确定,如果需要,本领域的普通技术人员可以参考以下文献:thomas sorrell的organic chemistry,university science books,sausalito,1999;smith和march,march’s advanced organic chemistry,第5版,john wiley&sons,inc.,纽约,2001;larock,comprehensive organic transformations,vch publishers,inc.,纽约,1989;以及carruthers,some modern methods of organic synthesis,第3版,cambridge university press,剑桥,1987。
[0127]
术语“约”在涉及数值时表示任何为规定数值
±
10%的数值或数值范围(例如,在规定数值
±
1%、
±
2%、
±
3%、
±
4%、
±
5%、
±
6%、
±
7%、
±
8%、
±
9%或
±
10%之内)。例如,约10mg的剂量表示任何比10mg低10%的剂量(9mg)、任何比10mg高10%的剂量(11mg)以及任何介于其间的剂量或剂量范围(例如,9mg~11mg;9.1mg~10.9mg;9.2mg~10.8mg;等等)。作为另一个例子,群体中流行率等级为约80%表示72%~88%(例如,79.2%~80.8%)的流行率等级。如有疑问,“约x”可以是“x”(例如,约80%可以是80%)。在不能超过规定数值的情况下(例如100%),“约”表示至多为并且包括比规定数值小于10%的任何数值或数值范围(例如,纯度为约100%表示90%~100%纯(例如,95%~100%纯、96%~100%纯、97%~100%纯等
……
)。如果测量数值的仪器或技术具有大于10%的误差范围,则当它们都在该仪器或技术的误差范围内时,给定数值将与规定数值大致相同。
[0128]
术语“施用”及其变体(比如“administration”及“administering”等)是指将本文所述的cdk7抑制剂(包括符合本文公开的化学式的化合物或其药学上可接受的盐、额外的/第二药剂、或者含有一种或多种任何此类化合物的组合物)施用于受试者(例如,人类患者)或系统(例如,离体维持的基于细胞或组织的系统);作为施用的结果,化合物或含有该化合物的组合物(例如,药物组合物)被引入受试者或系统。除了本发明的组合物和可用于联合疗法的第二药剂之外,用作阳性对照、阴性对照和安慰剂的物品(其中任何一种也可以是化合物)也可以被“施用”。本领域普通技术人员将了解在适当情况下可用于对受试者或系统进行施用的多种途径。例如,施用途径可以是口服的(即,通过吞咽药物组合物),或可以是肠胃外的。更具体地,施用途径可以是支气管(例如,通过支气管滴注)、经口(即,口服)、皮肤(其可以是或包含局部应用至真皮或皮内、皮间或透皮施用)、胃内或肠内(即,分别直接进入胃或肠)、髓内、肌肉内、鼻内、腹膜内、鞘内、肿瘤内、静脉内(或动脉内)、心室内、通过应用或注射到特定器官(例如,肝内)、粘膜(例如,口腔、直肠、舌下或阴道)、皮下、气管(例如,通过气管内滴注)或眼部(例如,局部、结膜下或玻璃体内)。施用可以涉及间歇给药(即,相隔不同时间的剂量)和/或周期性给药(即,相隔相同时间的剂量(例如,每隔多少小时、每天(例如,每天一次口服给药)、每周、每周两次等))。在其他实施方案中,施用可涉及在选定时间(例如,约1~2小时)内连续给药(例如,灌注)。
[0129]
如果第一个事件的一个或多个特征(例如,其存在、水平和/或形式)与第二个事件的特征相关,则两个事件、两个实体或一个事件和一个实体相互“关联”。例如,如果其存在、水平和/或形式与疾病(例如,本文公开的癌症)的发生率、严重性和/或易感性相关,则第一个实体(例如,酶(例如,cdk7))、基因表达谱、遗传特征(即,细胞中具有独特基因表达特征模式的单个或组合基因组)、代谢物或事件(例如,骨髓浸润)与事件(例如,特定疾病的发作或进展)关联。本文所述的生物标志物与以本文所述的方式(例如,凭借其表达水平)鉴定的
患者关联。关联通常在相关群体中评估。如果两个或多个实体直接或间接相互作用,则它们在物理上彼此“关联”,使得它们在给定的环境中(例如,在维持在生理条件下的细胞内(例如,在细胞培养物中)或在药物组合物中)彼此物理接近和/或保持物理接近。彼此物理关联的实体可以通过例如氢键、范德华力、疏水相互作用、磁性或其组合彼此共价关联或非共价关联。本文所述的cdk7抑制剂或其药学上可接受的盐可以与cdk7非共价关联。
[0130]
术语“生物样品”是指从感兴趣的生物来源(例如,组织或生物体(例如,动物或人类患者)或细胞培养物)获得或衍生的样品。例如,生物样品可以是从通过本发明的方法诊断和/或治疗的患有疾病(或者,在动物模型的情况下,可为模拟人类患者中的该疾病)的个体(例如,患者或动物模型)或从作为参考或对照身份的个体(或其样品有助于参考标准或对照群体的个体)获得的样品。生物样品可以含有生物细胞、组织或液体或其任何组合。例如,生物样品可以是或可以包括腹水;血液;血细胞;体液,其中任何一种可以包含或不包含(例如,肿瘤细胞(例如,至少在血管或淋巴管中发现的循环肿瘤细胞(ctc));骨髓或其组分(例如,造血细胞、骨髓脂肪组织或基质细胞);脑脊液(csf);粪便;挠曲液体(flexural fluid);自由浮动核酸(例如,循环肿瘤dna);妇科液体;免疫浸润物;淋巴;腹膜液;血浆;唾液;痰;手术获得的标本;从皮肤或黏膜(例如,鼻、口或阴道内的粘膜)刮取或擦拭的组织;组织或细针活检样品;尿液;冲洗液或灌洗液,如导管灌洗液或支气管肺泡灌洗液;或其他体液、组织、分泌物和/或排泄物。体液(例如,血液、csf、淋巴、血浆或尿液)的样品或从体液获得的样品可以包括肿瘤细胞(例如,ctc)和/或肿瘤的自由浮动核酸或无细胞核酸。样品中的细胞(例如,癌细胞)可能已经从打算进行治疗的个体患者中获得。以其获取形式使用的样品可称为“初级”样品,经过进一步操作(例如,通过去除样品的一种或多种组分)的样品可称为“次级”或“加工”样品。此类加工样品可以含有或富集特定细胞类型(例如,表达cdk7的细胞,其可以是肿瘤细胞)、细胞组分(例如,膜部分)、或者细胞材料(例如,包括cdk7的一种或多种细胞蛋白质,可以编码cdk7并且可以进行扩增的dna或rna(例如,mrna(例如,前体mrna或成熟mrna)))。如本文所用,术语“生物标志物”是指其状态与特定生物事件相关的实体,因此其被认为是该事件(例如,特定癌症的存在和/或其对本文所述的cdk7抑制剂或其药学上可接受的盐的易感性)的“标志物”。可以在核酸或蛋白质水平上分析生物标志物;在核酸水平上,人们可以分析野生型或突变型中基因的存在(例如,拷贝数改变(cna))、缺失、或者染色体位置,表观遗传改变(例如,甲基化),其与超级增强子的关联,和/或其表达水平(例如,通过初级rna转录物或mrna(例如,前体mrna或成熟mrna)水平所证明)。在蛋白质水平上,人们可以分析由生物标志物基因编码的蛋白质的表达水平和/或活性。生物标志物可以表明其治疗结果或可能性(例如,可能性增加)。因此,生物标志物可以是预测性的或预后性的,因此可用于如本文所述的鉴定或治疗患者的方法。
[0131]
术语“癌症”是指其中生物细胞表现出异常生长表型的疾病,其特征在于细胞增殖失控到对该疾病的患者有害的程度。癌症可以通过其起源的组织类型(组织学类型)和/或首先发展该癌症的体内原发部位进行分类。根据组织学类型,癌症通常分为六个主要类别:癌;肉瘤;脊髓瘤;白血病;淋巴瘤;以及混合类型。如本文所述治疗的癌症可以是这些类型中的任何一种并且可以包含癌前(例如,良性)、恶性、转移前、转移性和/或非转移性的细胞。具有恶性肿瘤或恶性病变的患者患有癌症。本公开特别鉴定了可能与其教导特别相关的某些癌症,并且这些癌症中的一种或多种可特征在于实体瘤或血液肿瘤(其也可以称为
血癌(例如,本文所述的类型))。尽管并非所有癌症都表现为实体瘤,但我们可以互换使用术语“癌细胞”和“肿瘤细胞”来指代任何恶性细胞。
[0132]
术语“联合疗法”是指受试者暴露于两种或更多种治疗方案(例如,两种或更多种治疗剂)以治疗单一疾病(例如,癌症)的那些情况。两种或更多种方案/药剂可以同时或顺序施用。当同时施用时,第一药剂的剂量和第二药剂的剂量在大约相同的时间施用,使得两种药剂在相同时间对患者发挥作用,或者,如果第一药剂比第二药剂更快或更慢起作用,则两种药剂在重叠的时间段内发挥作用。当顺序施用时,第一药剂和第二药剂的剂量在时间上是分开的,从而它们可能会或可能不会在相同时间对患者产生作用。例如,可以在同一小时或同一天内给予第一药剂和第二药剂,在这种情况下,当施用第二药剂时,第一药剂可能仍然有效。或者,在第一药剂和第二药剂的施用之间可以经过更长的时间段,使得当施用第二药剂时第一药剂不再具有活性(例如,第一方案的所有剂量通过相同或不同的途径在第二方案的任何剂量之前施用,如在治疗难治性癌症中可能发生的那样)。为清楚起见,联合治疗不需要在单一组合物中或在相同时间施用两种药剂,尽管在一些实施方案中,两种或更多种药剂,包括本文所述的cdk7抑制剂或其药学上可接受的盐和本文所述的第二药剂,可以在同一时间段内(例如,在同一小时、同一日、同一周或同一月内)施用。
[0133]
术语“临界”和“临界值”是指在定义两个群体子集(例如,可能为应答者和无应答者(例如,本文所述的cdk7抑制剂或其药学上可接受的盐的应答者和无应答者))之间的分界线的检验中测量的值。在某些情况下,等于或高于临界值的值定义一个群体子集,低于临界值的值定义另一个群体子集。在其他情况下,等于或低于临界值的值定义一个群体子集,高于临界值的值定义另一个。如下所述,临界或临界值可以定义阈值。
[0134]
如本文所用,“诊断信息”是可用于确定患者是否患有疾病和/或将疾病分类(分层)为或对疾病的预后或其对治疗(一般治疗或本文所述的任何特定治疗)的可能反应具有显著性的基因型或表型类别或任何类别的信息。同样,“诊断”是指获取或提供任何类型的诊断信息,包括但不限于患者是否可能患有或发展疾病;该疾病是否已经或可能达到某种状态或阶段或表现出特定特征(例如,对治疗剂的抗性);与肿瘤性质或分类有关的信息;与预后相关的信息(也可能涉及抗药性);和/或可用于选择适当治疗的信息(例如,选择本文所述的cdk7抑制剂或其药学上可接受的盐用于被鉴定为患有可能对此类抑制剂或其他治疗有反应的癌症的患者)。根据本文所述的方法分类(分层)并选择用本文所述的cdk7抑制剂或其药学上可接受的盐治疗的患者可能对治疗反应良好,意味着此类患者比患有相同类型癌症的尚未被如此鉴定并且不在同一类的患者更可能被成功治疗。可用的治疗包括治疗剂和其他治疗方式(如手术、放射等),并且选择适当的治疗涵盖选择不使用特定的治疗剂;选择给药方案;以及选择采用联合疗法。诊断信息可用于对患者进行分层,因此可用于根据例如生物标志物状态鉴定和分类给定患者。获得诊断信息可以构成本文所述的任何患者分层方法中的步骤。
[0135]
本领域普通技术人员将理解术语“剂型”可用于指代施用于患者的活性剂(例如,治疗剂或诊断剂)的物理离散单元。通常,每个此类的单元含有预定数量的活性剂。在一些实施方案中,此类量是适合于根据给药方案施用的单位剂量(或其整个部分),该给药方案已被确定为在施用于相关群体(即,使用治疗性给药方案的群体)时与预期和有益结果相关。本领域普通技术人员理解施用于特定患者的治疗组合物或药剂的总量由一位或多位主
治医师确定并且可能涉及多种剂型的施用。
[0136]
本领域普通技术人员将理解,术语“给药方案”可用于指在相隔相等或不相等时间的情况下单独施用给患者的一组单位剂量(通常多于一个)。给定的治疗剂通常具有推荐给药方案,其可以涉及一次或多次剂量,每次剂量可以含有相同的单位剂量或不同的量。在一些实施方案中,给药方案包括第一剂量量(the first dose amount)的第一次剂量(the first dose),然后是不同于第一剂量量的第二剂量量(the second dose amount)的一次或多次额外剂量。在一些实施方案中,当在相关群体中施用时,给药方案与预期或有益结果相关(即,该方案是治疗性给药方案)。
[0137]
如本文所用,试剂(例如,本文所述的化合物)(例如式(i)的化合物或本文所述的其他cdk7抑制剂)的“有效量”是指产生或期望产生施用该量所预期的效果的量。如以下进一步讨论和本领域公认的,有效量将取决于如预期生物学终点、所施用化合物的药代动力学、待治疗的病症、施用方式和患者特征等因素而变化。该术语可以应用于治疗性和预防性方法。例如,治疗有效量是降低疾病的一种或多种体征或症状的发生率和/或严重性的量。例如,在治疗癌症时,有效量可以减少肿瘤负荷、抑制肿瘤生长、抑制转移或延长患者生存期。本领域普通技术人员将理解,该术语实际上并不要求在任何特定个体中实现成功治疗。相反,治疗有效量是当施用于需要此治疗的患者时在大量患者中提供特定的预期药理学反应的量。在一些实施方案中,提及治疗有效量可以是提及在一种或多种特定组织(例如,受疾病影响的组织)或体液(例如,血液、唾液、血清、汗液、眼泪、尿液等)中施用的量或测量的量。有效量可以以单一剂量或多个剂量(例如,作为给药方案的一部分)配制和/或施用。
[0138]
如本文所用,“增强子”是基因组dna中有助于调节最高达1mbp左右的基因的表达的区域。增强子可以与基因编码区域重叠,但通常不由基因编码区域组成。增强子通常通过转录因子结合并由特定的组蛋白标记指定。
[0139]“mrna”是通过dna转录合成的单链rna产物,其包括基因的一个或多个编码序列。mrna可以是前体(pre-mrna)的形式,或者可以进一步加工成缺乏内含子的成熟形式的mrna。
[0140]
术语“患者”是指已经或可以经历本文所述的诊断方法或者出于例如实验、诊断、预防和/或治疗目的而已经或可以对其施用本文所述的化合物或其药学上可接受的盐的生物体。典型的患者包括动物(例如,哺乳动物,如小鼠、大鼠、兔、非人灵长类动物和人;驯养动物,如狗和猫;以及牲畜或任何其他具有农业或商业价值的动物)。患者可以患有或易患(即,具有高于平均的发展风险)本文所述的疾病并且可以表现出其一种或多种体征或症状。
[0141]
当应用于用于配制本文公开的组合物(例如,药物组合物)的载剂时,术语“药学上可接受的”是指与组合物的其他成分相容且对患者无害的载剂(例如,其在所需和/或施用的量时(例如,在单位剂型时)是无毒的)。
[0142]
当应用于盐时,术语“药学上可接受的”是指在合理的医学判断范围内适用于与人(例如,患者)和低等动物(包括但不限于实验室研究中使用的小鼠和大鼠)的组织接触而没有不可接受的毒性、刺激性、过敏反应等并且可以以与合理的收益/风险比相称的方式使用的化合物的盐形式。许多药学上可接受的盐是本领域熟知的(参见例如,berge等人,j.pharm.sci.66:1-19,1977)。本文所述化合物的药学上可接受的盐包括衍生自合适的无
机和有机的酸和碱的那些。药学上可接受的无毒酸加成盐的示例是氨基与无机酸(比如盐酸、氢溴酸、磷酸、硫酸和高氯酸等)或有机酸(比如乙酸、草酸、马来酸、酒石酸、柠檬酸、琥珀酸或丙二酸等)形成的盐或通过使用本领域已知的其他方法(比如离子交换等)形成的盐。其他药学上可接受的盐包括己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡糖酸盐、十二烷基硫酸盐、乙磺酸盐、甲酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、葡糖酸盐、半硫酸盐、庚酸盐、己酸盐、氢碘酸盐、2-羟基-乙磺酸盐、乳糖醛酸盐、乳酸盐、月桂酸盐、月桂基硫酸盐、苹果酸盐(malatle)、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯丙酸盐、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、对甲苯磺酸盐、十一酸盐、戊酸盐等。衍生自适当碱的盐包括碱金属盐、碱土金属盐、铵盐和n
+
(c
1-4
烷基)4盐。代表性的碱金属盐或碱土金属盐包括钠、锂、钾、钙、镁等。如果合适的话,其他药学上可接受的盐包括使用抗衡离子(如卤离子、氢氧根、羧酸根、硫酸根、磷酸根、硝酸根、低级烷基磺酸根和芳基磺酸根)形成的无毒的铵盐、季铵盐和胺阳离子盐。
[0143]
如本文所用,术语“群体”是指足以合理反映在群体中测量的值在更大的组中的分布的某些数量的项目(例如,至少30、40、50或更多)。在本发明的上下文中,群体可以是出于数据收集和分析的目的通过至少一个相同特征来鉴定的人、实验室动物或细胞系(例如)的离散组。例如,“样品群体”是指足够大以合理反映数值(例如,与生物标志物状态相关的数值)在更大的样品组中的分布的多个样品。如本文所述,群体中的项目可以是生物样品。例如,样品群体中的每个样品可以是细胞系的细胞或从患者或异种移植物(例如,通过将致瘤细胞系或患者样品植入小鼠体内而在小鼠中生长的肿瘤)获得的生物样品。如前所述,群体中的个体可以是由相同特征鉴定的离散组,相同特征可以是相同的疾病(例如,相同类型的癌症),无论样品从患有相同类型癌症的生物体还是代表该癌症的细胞系或异种移植物中获得。
[0144]
如本文所用涉及特定值(例如,与本文公开的生物标志物相关的se的强度)时,术语“流行率临界值”表示定义了两个群体子集(例如,“应答者”子集和“无应答者”子集,顾名思义,它们分别包括可能或可能不对一种或多种治疗剂产生有益反应的患者)之间的分界线的流行率等级。因此,等于或高于(例如,较低的百分比值)流行率临界值的流行率等级定义了群体的一个子集;低于(例如,较高的百分比值)流行率临界值的流行率等级定义了群体的另一子集。
[0145]
如本文所用,针对特定值(例如,特定生物标志物的mrna水平)的术语“流行率等级”是指群体中等于或大于该特定值的百分比。例如,针对测试细胞中特定生物标志物的mrna(例如,前体mrna或成熟mrna)量的35%流行率等级意味着与测试细胞相比,群体的35%具有该水平以上的生物标志物mrna。
[0146]“初级rna转录物”是通过dna转录合成并被加工以产生各种成熟的rna产物(如mrna、trna和rrna)的单链核糖核酸(rna)产物。被称为mrna的初级rna转录物是从包括一个或多个基因编码区(外显子)的dna序列转录而来的,并且可以包括从与基因关联的调节区(例如,增强子或超级增强子)转录而来的序列。这些初级rna转录物进行修饰以准备翻译。前体mrna(pre-mrna)是通过转录产生的第一种rna形式,其被修饰以成为缺乏内含子的成
熟mrna。
[0147]
如本文所用,术语“预后信息”和“预测信息”用于指代可用于指示在不存在或存在治疗的情况下疾病或病状过程的任何方面的任何诊断信息。此类信息可能包括但不限于患者的平均预期寿命、患者在给定时间量(例如,6个月、1年、5年等)内存活的可能性、患者疾病将被治愈的可能性、患者的疾病将对特定疗法产生反应的可能性(其中反应可以以多种方式中的任何一种来定义)。诊断信息可以是预后性的或预测性的。
[0148]
如本文所用,术语“等级排序”是指数值从最高到最低或从最低到最高的排序。
[0149]
如本文所用,术语“rb-e2f途径”和“rb-e2f家族”是指如下的一组基因和由其编码的蛋白质:如上下文将说明的,其表达或活性调节rb基因家族的活性,进而调节e2f转录因子家族的活性,这些转录因子是进入和通过细胞周期所必需的。下表包含rb-e2f家族中的基因列表、当前了解的编码蛋白质的功能的指示以及这些生物标志物在癌症中的状态。使用简写“激活的或过表达的”来表示基因的属性(例如,其拷贝数或表达水平)或其编码的蛋白质(例如,其表达或活性水平)在一些患有某些癌症的患者中高于健康受试者。此类激活的或过表达的rb-e2f家族成员的预定阈值可以通过比较分析确定,并且当在癌症患者中发现或超过该水平(例如,mrna(例如,前体mrna或成熟mrna)水平、蛋白质水平、基因拷贝数、与该基因相关的增强子强度)时,将该患者鉴定为用于本文所述进行治疗的候选者。使用简写“失活的或低表达的”来表示基因的某个属性(例如,其拷贝数或表达水平)或其编码的蛋白质(例如,其表达或活性水平)在一些患有某些癌症的患者中低于健康受试者。此类失活的或低表达的rb-e2f家族成员的预定阈值可以通过比较分析确定,并且当在癌症患者中未达到该水平(例如,mrna水平、蛋白质水平、基因拷贝数、与该基因关联的增强子强度)时,将该患者鉴定为如本文所述进行治疗的候选者。
[0150]
基因功能癌症中的状态e2f1e2f家族-细胞周期进入的转录控制激活或过表达e2f2e2f家族-细胞周期进入的转录控制激活或过表达e2f3e2f家族-细胞周期进入的转录控制激活或过表达e2f4e2f家族-细胞周期进入的转录控制激活或过表达e2f5e2f家族-细胞周期进入的转录控制激活或过表达e2f6e2f家族-细胞周期进入的转录控制激活或过表达e2f7e2f家族-细胞周期进入的转录控制激活或过表达e2f8e2f家族-细胞周期进入的转录控制激活或过表达rb1rb家族-e2f家族抑制失活或低表达rbl1rb家族-e2f家族抑制失活或低表达rbl2rb家族-e2f家族抑制失活或低表达cdk4rb家族抑制激活或过表达cdk6rb家族抑制激活或过表达cdk2rb家族抑制激活或过表达ccnd1cdk4/6调控激活或过表达ccnd2cdk4/6调控激活或过表达ccnd3cdk4/6调控激活或过表达
cdkn2acdk4/6调控失活或低表达cdkn2bcdk4/6调控失活或低表达cdkn2ccdk4/6调控失活或低表达cdkn2dcdk4/6调控失活或低表达ccne1cdk2调控激活或过表达ccne2cdk2调控激活或过表达cdkn1acdk2调控失活或低表达cdkn1bcdk2调控失活或低表达cdkn1ccdk2调控失活或低表达fbxw7ccne调控失活或低表达
[0151]
如本文所用,“参考”是指相对于其执行比较的标准或对照。例如,将感兴趣的试剂、患者、群体、样品、序列或数值与参考试剂、患者、群体、样品、序列或数值进行比较。参考可以与感兴趣的项目的分析或测定基本上同时进行分析或测定,或者其可以构成历史标准或控制,在较早的时间点确定并且任选地体现在有形介质中。本领域的普通技术人员在选择适当的参考方面受过良好的训练,这些参考通常在与感兴趣的项目所遇到的条件相当的条件下测定或表征。技术人员将理解,存在足够的相似性以证明对作为标准或对照的特定可能参考的依赖和/或比较。
[0152]
如本文所用,对治疗的“反应”是由治疗引起或与治疗相关的患者病症的任何有益改变。改变可以是稳定病症(例如,抑制在没有治疗的情况下会发生的恶化)、改善病症的一种或多种体征或症状、延迟病症的一种或多种体征或症状发作、和/或降低病症的一种或多种体征或症状的频率、改善病症治愈前景、更长的存活时间等。反应可以是患者的反应或肿瘤的反应。
[0153]
如本文所用,当术语“强度”用于指增强子或se的一部分时,其表示h3k27ac或其他基因组标记读数的数量针对所分析的基因组dna片段长度的曲线下面积。因此,“强度”是在定义选择要测量的区域的碱基对的跨度上测量给定碱基对的标记所产生的信号的积分。
[0154]
如本文所用,术语“超级增强子”是指相对于特定细胞或细胞类型中相对于其他增强子而言,含有不成比例份额的组蛋白标记和/或转录蛋白的增强子子集。预计受se调节的基因对细胞的功能非常重要。通常通过以下方式来确定se:基于强度对细胞中的所有增强子进行等级排序,并且使用可用的软件如rose(bitbucket.org/young_computation/rose)确定其强度显著高于细胞中的中位增强子的强度的增强子子集(参见例如,美国专利号9,181,580,其通过整体引用并入本文)。
[0155]
术语“阈值”和“阈值水平”是指定义两个群体子集(例如,应答者和非应答者)之间的分界线的水平。阈值或阈值水平可以定义流行率临界或临界值。
[0156]
如本文所用,术语“治疗(treatment、treating和treating)”是指逆转、减轻本文所述的“病理状况”(例如,疾病,如癌症)、延迟其发作和/或抑制其进展。在一些实施方案中,“治疗(treatment、treating和treating)”需要已经发展或已经观察到疾病的体征或症状。在其他实施方案中,可以在没有疾病或病状的体征或症状的情况下施用治疗(例如,根据症状史和/或根据遗传或其他易感性因素)。也可以在症状消退后继续治疗,例如延迟或抑制复发。
[0157]
由于本发明涉及用于诊断和治疗患有癌症的患者的组合物和方法,术语“活性剂”、“抗癌剂”、“药剂”和“治疗剂”可互换使用(除非上下文另有明确说明),并且本文所述的cdk7抑制剂及其药学上可接受的盐将被本领域普通技术人员理解为活性剂、抗癌剂、药剂或治疗剂。如所指出的,治疗方法和用途涵盖其中将本文所述的cdk7抑制剂或其药学上可接受的盐与如本文所述的一种或多种额外的药剂(例如,额外的抗癌治疗剂)联合施用或使用的联合疗法/用途。按照惯例,在需要两种药剂的任何实施方案中,我们可以将一个称为“第一”药剂并且将另一个称为“第二”药剂,以强调第一和第二药剂彼此不同。
[0158]
本发明的特征还在于包括如本文所述的cdk7抑制剂或其药学上可接受的盐和描述合适/鉴定的患者的说明材料的试剂盒、鉴定此类患者以进行治疗的方法(例如,通过本文所述的任何一种诊断分层方法)、和/或单独或与至少一种其他治疗剂(例如,额外的/第二抗癌治疗剂)联合施用cdk7抑制剂的说明。本发明的试剂盒还可包括第二药剂(例如,抗癌剂)(包括本文所述的任何一种或多种第二药剂)和用于如所述鉴定的患者群体中的说明。
[0159]
如所指出的,使用本文所述的cdk7抑制剂或其药学上可接受的盐的每种治疗方法和任何诊断方法也可以在使用方面表达,反之亦然。例如,本发明涵盖本文所述的化合物或组合物在治疗本文所述的疾病(例如,癌症)中的用途;用于诊断和/或治疗疾病(例如,癌症)的化合物或组合物;以及该化合物或组合物在制备用于治疗本文所述疾病(例如,癌症)的药物中的用途。
[0160]
本发明涉及诊断和/或治疗本文所述的癌症(或cdk7抑制剂用于此目的)的方法可明确排除本文所述的任何一种或多种类型的癌症。例如,本发明的特征在于通过施用本文所述的cdk7抑制剂或其药学上可接受的盐来治疗癌症的方法,附带条件是癌症不是乳腺癌;附带条件是癌症不是乳腺癌或白血病;附带条件是癌症不是乳腺癌、白血病或卵巢癌;等等,在本文列出的任何疾病中排除,并且在与本发明的其他方面(例如,本文描述的化合物或试剂盒和药物组合物的组分的化学取代基)相关的元素列表中具有相同的变量排除概念。
[0161]
在一个方面,本发明的特征在于本文所述的cdk7抑制剂或其药学上可接受的盐在治疗已被鉴定为具有以下特征的患者的癌症中的用途:(a)生物样品(包括从患者获得的癌细胞)中的bcl2样1rna(例如,初级rna转录物或编码bcl-xl的mrna(例如,前体mrna或成熟mrna))的水平,该水平等于或低于预定阈值;或(b)rb-e2f通路中的至少一个基因,其具有dna的改变(例如,突变)、表观遗传改变、rna表达水平改变(例如,mrna(例如,前体mrna或成熟mrna))或编码蛋白质的表达或活性水平的改变。此类患者可以是:用铂基治疗剂(例如,卡铂或奥沙利铂)作为第二药剂进行治疗;癌症对铂基治疗剂(例如,卡铂或奥沙利铂)产生抗药性的患者;或正在接受单独使用或与芳香酶抑制剂、选择性雌激素受体调节剂或选择性雌激素受体降解剂中的一种或多种联合使用的cdk4/6抑制剂治疗的患者。患者的癌症可能已经对cdk4/6抑制剂产生抗药性或有发生抗药性的风险。在此处描述的用途的背景下(例如,已根据具有等于或低于预定阈值水平的blc2样1mrna(例如,前体mrna或成熟mrna)的水平选择了患者),癌症可以是乳腺癌(例如,三阴性乳腺癌(tnbc)、卵巢癌、肺癌(例如,非小细胞肺癌)或血癌(例如,急性髓性白血病(aml)),其中任何一种都可以是新诊断的(未接受过治疗)或复发的或对先前的治疗无效的。
[0162]
患者可以是已经经历、正在经历或将经历(例如,已被开具处方要经历)bcl-2抑制剂如维奈托克治疗的人。在这种用途的背景下,可以通过以下一项或多项来选择患者:a)癌症中的ccne1基因拷贝数、mrna(例如,前体mrna或成熟mrna)或蛋白质水平等于或高于预定阈值;b)癌症中rb1基因拷贝数、mrna或蛋白质的水平等于或低于预定阈值,或不存在表达的野生型rb1基因;c)cdk6 mrna(例如,前体mrna或成熟mrna)的水平等于或高于预定阈值水平;d)ccnd2 mrna(例如,前体mrna或成熟mrna)的水平等于或高于预定阈值水平;e)cdkn2a mrna(例如,前体mrna或成熟mrna)水平等于或低于预定阈值水平。在具体的实施方案中,患者通过以下选择:癌症中的ccne1基因拷贝数、mrna或蛋白质水平等于或高于预定阈值;癌症中rb1基因拷贝数、mrna或蛋白质的水平等于或低于预定阈值;或缺乏表达的野生型rb1基因。在这种用途的背景下,患者可能患有卵巢癌、乳腺癌、tnbc或激素受体阳性乳腺癌,并且患者可能是已经经历、正在经历或将经历选择性雌激素受体调节剂如他莫昔芬、选择性雌激素受体降解剂如氟维司群、和/或parp抑制剂如奥拉帕尼或尼拉帕尼治疗的人。
[0163]
在另一方面,本发明的特征在于本文所述的cdk7抑制剂或其药学上可接受的盐在治疗如本文所述鉴定的患者中的用途,以及本文所述的cdk7抑制剂或其药学上可接受的盐与有效量的第二药剂的联合疗法在治疗患有癌症的患者中的用途,其中:(a)癌症是tnbc、雌激素受体阳性(er+)乳腺癌、胰腺癌或头颈部鳞状细胞癌;第二药剂是cdk4/6抑制剂;(b)癌症是乳腺癌或卵巢癌;第二药剂是parp抑制剂;(c)癌症是aml;第二药剂是flt3抑制剂;(d)癌症是卵巢癌;第二药剂是铂基抗癌剂;(e)癌症是tnbc、aml、尤文氏肉瘤或骨肉瘤;第二药剂是bet抑制剂;(f)癌症是tnbc、aml、卵巢癌或非小细胞肺癌;第二药剂是bcl-2抑制剂。在特定实施方案中,癌症是aml(例如,单核细胞亚型,例如,aml的m4或m5亚型),并且第二药剂是bcl-2抑制剂,如维奈托克;癌症是上皮性卵巢癌、输卵管癌、原发性腹膜癌、三阴性乳腺癌或her2
+
/er-/pr-乳腺癌,并且第二药剂是parp抑制剂,如奥拉帕尼或尼拉帕尼;癌症是卵巢癌,并且第二药剂是铂基抗癌剂,如卡铂或奥沙利铂。
[0164]
在一个实施方案中,本发明的特征在于治疗癌症的方法,该方法包括将有效量的本文所述的cdk7抑制剂或其药学上可接受的盐施用于对被鉴定为在癌症中(例如,在从待治疗的患者获得的生物样品中)具有等于或低于预定阈值的水平的b细胞淋巴瘤-超大(bcl-xl)mrna(例如,前体mrna或成熟mrna)的患者(例如,人类患者)(即,“所鉴定的患者”)。该方法可以进一步包括测定存在于来自患者的癌细胞样品中的bcl-xl mrna水平的步骤,这对于本文所述的治疗方法通常是正确的;无论分析的生物标志物或所讨论的癌症类型如何,治疗方法可以在没有分析生物标志物的明确步骤或有分析生物标志物的明确步骤(例如,通过获得来自患者的生物样品)的情况下对鉴定的患者进行。人类患者可能已被诊断为患有对响应于测定的cdk7抑制剂敏感的癌症,并且bcl-xl生物标志物的状态可以以本文所述的任何其他方式测定。预定的阈值是临界值或流行率临界。确定患有对cdk7抑制剂敏感的癌症的患者可以另外施用bcl-2抑制剂(例如,维奈托克(可作为venclexta获得),并且如本文所述选择的患者(通过分析bcl-xl的状态)可能患有乳腺癌、卵巢癌、肺癌或血癌。更具体地说,患者可能患有tnbc、卵巢癌、非小细胞肺癌或aml。
[0165]
在一个实施方案中,本发明的特征在于治疗癌症(例如,如本文所述的乳腺癌,包括tnbc或hr+乳腺癌)的方法,该方法包括将有效量的本文所述的cdk7抑制剂或其药学上可接受的盐施用于患者(例如,人类患者)的步骤,该患者已通过如下鉴定:突变、拷贝数改变
1287、vs2-370或voruciclib(先前称为p1446a-0);激素受体(例如,雌激素受体)降解剂,如氟维司群(例如,作为faslodex和其他销售);flt3(fms样酪氨酸激酶3)抑制剂,如cdx-301、cg’806、ct053ptsa、克莱拉尼(例如,苯磺酸克莱拉尼)、enmd-2076、ff-10101-01、flysyn、吉列替尼(asp2215)、hm43239、来他替尼(lestautinib)、帕纳替尼(例如,作为iclusig销售,先前为ap24534)、nms-088、索拉非尼(例如,作为nexavar销售)、舒尼替尼、帕克替尼、培西达替尼/plx3397、奎扎提尼、米哚妥林(例如,作为rydapt销售)、sel24、ski-g-801、或者sklb1028;parp抑制剂,如奥拉帕尼(例如,作为lynparza销售)、卢卡帕尼(例如,作为rubraca销售)、他拉唑帕尼(例如,作为talzenna销售)、维利帕尼(abt-888)、或者尼拉帕尼(例如,作为zejula销售);bet抑制剂,如abbv-075、bay-299、bay-1238097、bms-986158、cpi-0610、cpi-203、ft-1101、gs-5829、gsk-2820151、gsk-525762、i-bet151、i-bet762、incb054329、jq1、ms436、otx015、pfi-1、plx51107、rvx2135、ten-010、zen-3694,或美国申请号12/810,564(现为美国专利号8,476,260)中公开的化合物,其在此通过整体引用并入本文;基于铂的治疗剂,如顺铂、奥沙利铂(例如,作为eloxatin销售)、奈达铂、卡铂(例如,作为paralatin销售)、菲铂(phenanthriplatin)、吡铂、赛特铂(jm216)或四硝酸三铂;cdk4/6抑制剂,如bpi-1178、g1t38、帕博西尼(例如,作为ibrance销售)、瑞博西尼(例如,作为kisqali销售)、on 123300、曲拉西利或阿贝西利(abemaciclib)(例如,作为verzenio销售);mek抑制剂,如曲美替尼(例如,作为mekinist销售);或磷酸肌醇3-激酶(pi3激酶)抑制剂,任选i类(例如ia类)和/或任选针对特定pi3k同种型。pi3k抑制剂可以是艾代拉里斯(idelalisib)(例如,作为zydelig销售)、库潘尼西(例如,作为aliqopa销售)、杜韦利西布(例如,作为copiktra销售)或阿培利司(例如,作为piqray销售)。在其他实施方案中,附加/第二药剂可以是卡培他滨(例如,作为xeloda销售)。
[0169]
apg-1252是双重bcl-2/bcl-xl抑制剂,当患有sclc或其他实体瘤的患者在28天的周期中每周两次静脉给药10mg~400mg之间(例如,160mg)并持续三周时,其在早期临床试验中显示出前景(参见lakhani等人,j.clin.oncol.36:15_suppl,2594和clinicaltrials.gov标识符nct03080311)。apg-2575是bcl-2选择性抑制剂,在fl和dlbcl联合依鲁替尼的临床前研究中显示出前景(参见fang等人,aacr annual meeting 2019,cancer res.79(13suppl):abstract no.2058)并已开始作为血癌患者的单一药剂治疗的临床试验;在剂量递增研究中,患者每天一次口服给药20mg,连续4周作为一个周期。计划递增至50mg、100mg、200mg、400mg、600mg和800mg以鉴定mtd(参见clinicaltrials.gov标识符nct03537482)。bp1002是针对bcl-2mrna的不带电荷的p-乙氧基反义寡脱氧核苷酸,其副作用可能比其他反义类似物更少,并且已显示出抑制与bp1002一起孵育四天的人淋巴瘤细胞系和植入scid小鼠的cj细胞(转化fl细胞)的生长的前景(参见ashizawa等人,aacr annual meeting 2017,cancer res.77(13suppl):abstract no.5091)。bp1002还与阿糖胞苷(ldac)联合施用于aml患者(参见clinicaltrials.gov标识符nct04072458)。s55746/bcl201是口服的选择性bcl-2抑制剂,在小鼠中,在两种血癌异种移植模型中显示出抗肿瘤功效(casara等人,oncotarget 9(28):20075-88,2018)。i期剂量递增研究旨在向cll或b细胞nhl(包括fl、mcl、dlbcl、sll、mzl和mm)患者施用含有50mg或100mg s55746的薄膜包衣片剂,剂量最高达1500mg(参见clinicaltrials.gov标识符nct02920697)。维奈托克片剂已被
批准用于治疗患有cll或sll的成年患者,并与氮杂胞苷、或者地西他滨或低剂量阿糖胞苷联合用于治疗至少75岁的新诊断aml患者或患有无法使用强化诱导化疗的合并症的新诊断aml患者。cll/sll的给药可以遵循五周的加速计划,aml的给药可以遵循四天的加速,两者以及其他相关信息都在产品插页中描述(另见美国专利号8,546,399;9,174,982;和9,539,251,其通过整体引用并入本文)。阿伏西地(alvocidib)与阿糖胞苷/米托蒽醌或阿糖胞苷/柔红霉素联合用于aml患者的研究,施用详情可在clinicaltrials.gov获得,标识符为nct03563560(另见yeh等人,oncotarget6(5):2667-2679,2015,morales等人,cell cycle15(4):519-527,2016,和zeidner等人,haematologica100(9):1172-1179,2015)。at7519已以剂量递增形式施用于患有难治性实体瘤的符合条件的患者。虽然有一些临床活性的证据,但qtc延长的出现阻止了mahadevan等人描述的剂量方案的进一步发展(j.clin.oncol.asco abstract no.3533;另见santo等人,oncogene29:2325-2336,2010,描述了at7519在mm中的临床前活性)。azd5576在纳摩尔水平上诱导乳腺癌和肺癌细胞系的细胞凋亡(参见li等人,bioorg.med.chem.lett.27(15):3231-3237,2017),并已单独和与阿卡替尼联合在nhl治疗中进行了检查(参见aacr 2017abstract no.4295)。bay1251152是i期临床试验的主题,用于表征晚期血癌患者的mtd;该药剂以21天的周期每周输注一次(参见clinicaltrials.gov标识符nct02745743;另见luecking等人,aacr 2017abstract no.984)。voruciclib是临床阶段的口服cdk9抑制剂,可抑制mcl-1并使高危dlbcl对bcl2抑制敏感。dey等人(scientific reports7:18007,2017)表明voruciclib和维奈托克的联合对于一部分高危dlbcl患者是有前景的(另见clinicaltrials.gov标识符nct03547115)。氟维司群已被批准施用于患有晚期激素受体(hr)阳性、her2阴性乳腺癌,以及在其他抗雌激素疗法治疗后疾病进展的hr阳性转移性乳腺癌的绝经后妇女,并与帕博西尼(ibrance)联合用药。氟维司群在第1天、第15天和第29天通过肌肉注射施用500mg或250mg(推荐用于中度肝功能不全患者的较低剂量),之后每月一次(有关更多信息,请参见产品插页;另见美国专利号6,744,122;7,456,160;8,329,680和8,466,139,其中每个在此通过整体引用并入本文)。帕纳替尼已在临床试验中用于cml或all患者(参见clinicaltrials.gov标识符nct0066092072、nct012074401973、nct02467270、nct03709017、nct02448095、nct03678454和nct02398825)以及实体瘤,如胆管癌和nsclc(nct02265341、nct02272998、nct01813734、nct02265341、nct02272998、nct01813734、nct02265341、nct02272998、nct01813734、nct01935336、nct03171389和nct03704688;另见综述文章tan等人,onco.targets ther.12:635-645,2019)。有关给药方案的更多信息可在产品插页中找到;另见美国专利号8,114,874;9,029,533;和9,493,470,其中每个在此通过整体引用并入本文。索拉非尼已被批准用于治疗肾癌和肝癌、aml和放射性碘抵抗性晚期甲状腺癌,并在硬纤维瘤型纤维瘤病患者中启动了临床试验(参见clinicaltrials.gov标识符nct02066181)。有关剂量的信息可在产品插页中找到,该插页建议每天两次施用两片400mg片剂;另见美国专利号7,235,576;7,351,834;7,897,623;8,124,630;8,618,141;8,841,330;8,877,933;和9,737,488,其中每个在此通过整体引用并入本文。米哚妥林已施用于患有aml、mds或全身性肥大细胞增多症的患者,并且已发现当与常规诱导和巩固治疗相结合时,可显著延长flt3突变的aml患者的生存期(参见stone等人,ash 57th annual meeting,2015和gallogly等人,ther.adv.hematol.8(9):245-251,2017;临床参见产品插页、clinicaltrials.gov标识符
nct03512197、以及美国专利号7,973,031、8,222,244和8,575,146,其中每个通过整体引用并入本文。此处提供的信息和公开可用的信息可用于实践本发明的方法和用途。如有疑问,本发明涵盖需要本发明化合物或其药学上可接受的盐和任何一种或多种附加/第二药剂的联合疗法,其可以以或低于当前批准用于单次使用的剂量(例如,如上所述)施用于如本文所述的患者。
[0170]
在使用如本文所述的cdk7抑制剂和以下药剂联合治疗的情况下:cdk4/6抑制剂,患者可能患有乳腺癌(例如,tnbc或er+乳腺癌)、胰腺癌、肺癌(例如,sclc或nsclc)或头颈部鳞状细胞癌;cdk9抑制剂,患者可能患有乳腺癌,更具体地说,患有her2
+
/er-/pr-乳腺癌;flt3抑制剂(例如,米哚妥林),患者可能患有血液癌症(例如,aml);bet抑制剂,患者可能患有血液癌症(例如,aml)、乳腺癌(例如,tnbc)、骨肉瘤或尤文氏肉瘤;bcl-2抑制剂(例如,维奈托克),患者可能患有乳腺癌(例如,tnbc)、卵巢癌、肺癌(例如,nsclc)或血液癌症(例如,aml(例如,新诊断的aml))、慢性淋巴细胞性白血病(cll)或小淋巴细胞性淋巴瘤(sll),具有或不具有17p缺失;或parp抑制剂(例如,尼拉帕尼或奥拉帕尼),患者可能患有乳腺癌(例如,tnbc或her2
+
/er-/pr-乳腺癌)、卵巢癌(例如,上皮性卵巢癌)、输卵管癌症或原发性腹膜癌。当患者用如本文所述的cdk7抑制剂和bcl-2抑制剂(例如,维奈托克)治疗时,患者也可以用选自阿扎胞苷、地西他滨和低剂量阿糖胞苷的第三药剂治疗。
[0171]
本发明提供了用于治疗癌症的药物试剂盒,其包含本文所述的cdk7抑制剂或其药学上可接受的盐和任选地选自以下各项的第二治疗剂:(a)bcl-2抑制剂,(b)cdk9抑制剂,(c)flt3抑制剂,(d)parp抑制剂,(e)bet抑制剂,和(f)cdk4/6抑制剂,其中任何一种可以选自本文公开的那些,并如本文所述或如制造商的指示施用。该试剂盒可以包括关于以下各项的说明书:(a)重构(如有必要)本文所述的cdk7抑制剂或其药学上可接受的盐和/或第二治疗剂;(b)施用本文所述的cdk7抑制剂或其药学上可接受的盐和/或第二治疗剂中的每一种;和/或(c)该试剂盒适用的特定癌症列表或可用于确定这些癌症的诊断方法。该试剂盒还可以包括任何类型的用于施用其中所含的活性剂的用具(例如,管子、注射器、针头、无菌敷料、胶带等)。
[0172]
本发明提供了治疗患有癌症的人类患者的方法,该方法包括:向被鉴定为具有至少一个参与rb-e2f通路的基因的患者施用有效量的本文所述的cdk7抑制剂或其药学上可接受的盐:(1)dna改变(例如基因拷贝数、突变、甲基化);(2)表观遗传改变(例如组蛋白甲基化、组蛋白乙酰化);(3)rna(例如,mrna(例如,前体mrna或成熟mrna))或蛋白质的表达水平的改变。患者为被鉴定(即,选择)为具有由参与rb-e2f通路的至少一个基因表达的mrna(例如,前体mrna或成熟mrna)水平的改变。在这方面,在向患者施用有效量的本文所述的cdk7抑制剂或其药学上可接受的盐之前,确定患者具有至少一个涉及rbe2f通路的基因的rna(例如,mrna(例如,前体mrna或成熟mrna))的水平等于或高于预定阈值,或具有至少一个涉及rb-e2f通路的基因的rna(例如,mrna(例如,前体mrna或成熟mrna))的水平等于或低于预定阈值。
[0173]
对于本领域普通技术人员来说,对于那些在癌症中激活或过表达的rb-e2f通路中的基因,将很容易选择那些具有以下的患者:(1)编码导致表达增加的此类基因的dna改变(例如基因拷贝数增加、导致活性增加的突变、导致表达增加的甲基化变化);(2)与导致表达增加的基因相关的表观遗传改变(例如导致表达增加的组蛋白甲基化或组蛋白乙酰化模
式);或(3)mrna(例如,前体mrna或成熟mrna)或由该基因编码的蛋白质的表达水平增加。对于那些在癌症中失活或低表达的rb-e2f通路中的基因,将很容易选择那些具有以下的患者:(1)编码导致表达或活性降低的此类基因的dna改变(例如基因拷贝数减少、导致活性降低的突变、导致表达降低的甲基化变化);(2)与导致表达降低的基因相关的表观遗传改变(例如导致表达降低的组蛋白甲基化或组蛋白乙酰化模式);或(3)mrna (例如,前体mrna或成熟mrna)或由该基因编码的蛋白质的表达水平降低。
[0174]
在与使用rb-e2f通路基因作为生物标志物有关的一些方面,本发明提供了治疗患有癌症的人类患者的方法,该方法包括向被鉴定为具有以下的患者施用有效量的cdk7抑制剂:(a)癌症中ccne1 mrna(例如,前体mrna或成熟mrna)或蛋白质的水平等于或高于预定阈值;和/或(b)癌症中rb1mrna(例如,前体mrna或成熟mrna)或蛋白质的水平等于或低于预定阈值。在这些方法的一些实施方案中,还可以确定来自患者的癌细胞样品中存在的rb1和/或ccne1 mrna(例如,前体mrna或成熟mrna)或蛋白质的水平。在一些实施方案中,人类患者被诊断为患有对响应于测定的cdk7抑制剂敏感的癌症;人类患者患有卵巢癌;和/或人类患者患有乳腺癌。在一些实施方案中,人类患者患有三阴性乳腺癌(tnbc)或激素受体阳性(hr
+
(例如,hr+/her2-)乳腺癌。在这些实施方案中的任一个中,cdk7抑制剂是本文所述的cdk7抑制剂或其药学上可接受的盐,该抑制剂或其盐任选地与parp抑制剂或serm或serd如他莫昔芬或氟维司群共同施用。在这些实施方案中的一些中,癌症对帕博西尼是难治性的。
[0175]
本发明提供了治疗人类患者癌症的方法,该方法通过向患者施用cdk7抑制剂和针对此类癌症的铂基标准治疗(soc)抗癌剂或紫杉烷的组合。癌症可以是卵巢癌;soc抗癌剂可以是铂基抗癌剂(例如,卡铂、顺铂或奥沙利铂);和本文所述的cdk7抑制剂或其药学上可接受的盐。在一些实施方案中,当作为单一疗法或与除cdk7抑制剂之外的其他抗癌剂联合施用时,人类患者对铂基抗癌剂抗药、已确定对其抗药、或已变得对其抗药(在一些初始反应之后)。在该实施方案的一些方面,当作为单一疗法或与除cdk7抑制剂之外的抗癌剂联合施用时,在先前治疗的一些初始功效之后,已确定人类患者对铂基抗癌剂产生抗药性。在该实施方案的一些方面,soc抗癌剂是紫杉烷(例如,紫杉醇)。
[0176]
本发明提供治疗基于对cdk4/6抑制剂治疗具有抗药性而选择的人类患者的hr+乳腺癌的方法,包括向患者施用本文所述的cdk7抑制剂或其药学上可接受的盐的步骤。在一些实施方案中,在施用本文所述的cdk7抑制剂或其药学上可接受的盐之前,患者对先前治疗抗药、已确定对其抗药、或已变得对其抗药(在一些初始反应之后),先前治疗单独使用cdk4/6抑制剂或与除cdk7抑制剂之外的另一种乳腺癌soc药剂联合使用,如芳香酶抑制剂(例如,来曲唑、阿那曲唑)或serm或serd如他莫昔芬或氟维司群。换言之,基于对单独使用cdk4/6抑制剂或与除cdk7抑制剂之外的另一种乳腺癌soc药剂联合的先前治疗有抗药性,选择所鉴定的患者使用本文所述的cdk7抑制剂或其药学上可接受的盐进行治疗。在一些实施方案中,本文所述的cdk7抑制剂或其药学上可接受的盐与另一种soc药剂共同施用,如芳香酶抑制剂(例如,阿那曲唑、依西美坦或来曲唑)或serm或serd如他莫昔芬或氟维司群,或芳香酶抑制剂或氟维司群失败后的二线治疗。在一些实施方案中,在施用本文所述的cdk7抑制剂或其药学上可接受的盐之前,患者是、已确定或已变得对治疗有抗药性(在一些初始反应之后),该治疗单独使用cdk4/6抑制剂或与除cdk7抑制剂之外的另一种soc药剂联合使用,如芳香酶抑制剂(例如,阿那曲唑、依西美坦或来曲唑)、或者serm或serd如他莫昔芬或
205515396处的cdk18基因有关联的se基因座;与chr6:110803523-110896277处的cdk19基因有关联的se基因座;与chr19:30418503-30441450处的ccne1基因有关联的se基因座;和与chr8:38233326-38595483处的fgfr1基因有关联的se基因座。所有基因座均基于人类基因组构建hg19/grch37的gencode v19注释。
[0181]
chip-seq用于通过将染色质免疫沉淀(chip)与大规模平行dna测序相结合来分析蛋白质与dna的相互作用,以鉴定dna相关蛋白质的结合位点。其可用于精确绘制任何感兴趣的蛋白质的全局结合位点。以往,chip-on-chip是用于研究这些蛋白质-dna关系的最常用技术。成功的chip-seq取决于许多因素,包括超声强度和方法、缓冲液成分、抗体质量和细胞数量(参见例如,furey,nature reviews genetics13:840-852,2012);metzker,nature reviews genetics11:31-46,2010;以及park,nature reviews genetics10:669-680,2009)。除h3k27ac外,可用于使用chip-seq鉴定se的基因组标记包括p300、cbp、brd2、brd3、brd4、介体复合物的组分(loven等人,cell,153(2):320-334,2013)、组蛋白3赖氨酸4单甲基化(h3k4me1)和其他组织特异性增强子相关转录因子(smith和shilatifard,nature struct.mol.biol.,21(3):210-219,2014;以及pott和lieb,nature genetics,47(1):8-12,2015)。可以使用se分数确定增强子强度的量化和se的鉴定(mckeown等人,cancer discov.7(10):1136-1153,2017;doi:10.1158/2159-8290.cd-17-0399)。
[0182]
在某些情况下,细胞系或患者样品的整个基因组的h3k27ac或其他标记的chip-seq数据se图已经存在。然后人们可以简单地确定此类图中增强子或se在chr8:128628088-128778308(基因组构建hg19)基因座处的强度、顺序等级或流行率等级是否等于或高于预定阈值水平。在一些实施方案中,人们将简单地确定此类图中的增强子或超级增强子在chr1:205399084-205515396(基因组构建hg19)基因座处的强度或顺序等级是否等于或高于预定阈值水平。
[0183]
应当理解,braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)和malat1的特定染色体位置可能因不同的基因组构建和/或不同的细胞类型而有所不同。对于bcl2样1、cdk7、cdk9、cdkn2a和rb(也称为rb1或在癌症中低表达的另一种e2f通路成员(参见本文表格))也是如此。然而,普通技术人员,特别是鉴于本教导,可以通过在这样的其他基因组构建中定位与基因组构建体hg 19中的基因座相对应的特定序列来确定这种不同的位置。
[0184]
在本方法的背景下可用于鉴定se的其他方法包括染色质免疫沉淀(delmore等人,cell,146(6):904-917,2011)、芯片阵列(chip-chip)和在qpcr(chip-qpcr)之后的染色质免疫沉淀,后者使用相同的免疫沉淀基因组标记和与chr8:128628088-128778308(基因组构建hg19)myc基因座或chr1:205399084-205515396(基因组构建hg19)cdk18基因座(例如)杂交的寡核苷酸序列。在chip芯片的情况下,与其他基于阵列的技术一样,信号通常通过探针和输入测定样品的杂交产生的强度荧光来检测。对于chip-qpcr,在插入pcr反应中生成的双链dna后会变成荧光的染料用于测量模板的扩增。
[0185]
在一些实施方案中,确定细胞是否具有等于或高于必要的阈值水平的braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的se强度是通过比较braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路
成员的某些基因(参见本文表格)在测试细胞中的增强子强度与braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)在细胞样品群中的强度,其中每个细胞样品获自反映相同待治疗疾病的不同来源(例如,不同的患者、不同的细胞系、不同的异种移植物)。在一些实施方案中,仅来自患者的原发性肿瘤细胞样品用于确定阈值水平。在这些实施方案的一些方面,将测试群体中的至少一些样品对特定cdk7抑制剂(例如,本文所述的cdk7抑制剂或其药学上可接受的盐)的反应性,以确定:(a)对特定化合物有反应的群体中样品的最低mbraf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的增强子强度(“最低应答者”);并且,任选地,(b)对特定化合物无反应的群体中样品的最高braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的增强子强度(“最高无应答者”)。在这些实施方案中,braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的临界值设置了测试细胞将被认为对该特定化合物有反应的增强子强度:i)与群体中最低应答者的braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的增强子强度相等或高至多5%;或ii)与群体中最高无应答者的braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的增强子强度相等或高至多5%;或iii)介于群体中最低应答者和最高无应答者的braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的增强子强度之间的值。
[0186]
在上述实施方案中,并非群体中的所有样品都需要测试对特定cdk7抑制剂(例如,本文所述的cdk7抑制剂或其药学上可接受的盐)的反应性,但测量所有样品的braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的增强子强度。在一些实施方案中,样品基于m braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的增强子轻度进行排序。选择上述三种方法中的哪一种来确定临界值将取决于群体中最低应答者和最高无应答者的braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的增强子强度之间的差异,以及目标是最小化假阳性的数量还是最小化错过潜在反应性样品或患者的机会。当最低应答者和最高无应答者之间的差异很大时(例如,当很多未测试响应性的样品落入最低应答者和最高无应答者的braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的增强子强度的排序之间时),临界值通常设置为与群体中最低应答者的braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的增强子强度相等或高至多5%。此临界值最大化潜在应答者的数量。当这种差异很小时(例如,当很少或没有未测试响应性的样品落入最低应答者和最高无应
答者的braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的增强子强度排序之间时),临界值通常设置为最低应答者和最高无应答者的braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的增强子强度之间的值。此临界值最小化假阳性的数量。当最高无应答者具有高于最低应答者的braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的增强子强度时,临界值通常设置为与群体中最高无应答者的braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的增强子强度相等或高至多5%。此临界值也最小化假阳性的数量。
[0187]
在一些实施方案中,上述方法可用于简单地确定来自患者的患病细胞(例如癌细胞)是否具有与如本文所述的生物标志物(例如braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)或由其编码的蛋白质)关联的se。se的存在表明患者可能对本文所述的cdk7抑制剂或其药学上可接受的盐反应良好。当增强子的强度等于或高于与malat-1关联的增强子时,确定细胞具有与生物标志物(例如,braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)或由其编码的蛋白质)关联的se。在替代实施方案中,当braf-、myc-、cdk1-、cdk2-、cdk4-、cdk6-、cdk17-、cdk18-、cdk19-、ccna1-、ccnb1-、ccne1-、esr-1-、fgfr1-、pic3ca-或编码e2f通路成员的某些基因-(参见本文表格)关联的增强子的强度至少10倍高于细胞中所有增强子的中值强度时,确定细胞具有与braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)关联的se。在其他实施方案中,当基因关联增强子的强度高于细胞中增强子强度的等级排序图中切线斜率为1的点时,确定细胞具有与上述基因关联的se。
[0188]
在涉及cdk18的实施方案中,增强子强度的临界值可转换为流行率临界值,然后可将其应用于cdk18 mrna(例如,前体mrna或成熟mrna)水平以确定给定mrna测定中的mrna临界值。
[0189]
在一些实施方案中,本文所述的遗传生物标志物的特征(例如,mrna(例如,前体mrna或成熟mrna)水平)用于确定患者对本文所述的cdk7抑制剂或其药学上可接受的盐的敏感性。
[0190]
在一些实施方案中,使用相同的测定法将患者(如所评估的,例如,从患者获得的生物样品中)中的感兴趣基因/生物标志物mrna水平与患有相同疾病或病症(或足以允许有效比较的疾病或病症)的患者群体中相同的感兴趣基因/生物标志物mrna水平进行比较,以鉴定对本文所述的cdk7抑制剂或其药学上可接受的盐的可能地应答者。当选择生物标志物的另一个特征进行分析时(例如,其拷贝数、染色体位置、初级rna转录物水平或mrna(例如,前体mrna或成熟mrna)水平、或者表达蛋白水平),可以进行类似的比较。在生物标志物(例如,cdk18、cdk19和ccne1)与对本发明化合物的反应性相关(例如,与其表达(例如,mrna(例如,前体mrna或成熟mrna)相关)的实施方案中,将测试群体中的至少一些样品对抑制剂(例
如,本文所述的cdk7抑制剂或其药学上可接受的盐)的反应性,以确定:(a)对该特定化合物有反应的群体的样品中的最低水平(例如,mrna水平)(“最低mrna应答者”);和,任选地,(b)对该特定化合物没有反应的群体的样品中的最高水平(例如,最高mrna水平)(“最高mrna无应答者”)。在这些实施方案中,将被认为对特定化合物有反应性的测试细胞的生物标志物mrna水平的临界值设定为:i)与群体中最低mrna应答者的水平(例如,mrna水平)相等或高至多5%;或ii)与群体中最高mrna无应答者的水平(例如,mrna水平)相等或高至多5%;或iii)介于群体中最低应答者(例如,最低mrna应答者)和最高无应答者(例如,最高mrna)的水平(例如,mrna水平)之间的值。
[0191]
在mrna(例如,前体mrna或成熟mrna)水平与对本文所述的cdk7抑制剂或其药学上可接受的盐的敏感性正相关的实施方案中,并非群体中的所有样品都需要测试对化合物(或盐)的反应性,但所有样品都测量了感兴趣的基因的mrna水平。在一些实施方案中,样品基于感兴趣的基因mrna水平进行排序。选择上述三种方法中的哪一种来确定临界值将取决于群体中最低mrna应答者和最高mrna无应答者之间感兴趣基因的mrna水平的差异,以及该临界值是否设计为最小化假阳性或最大化应答者的潜在数量。当这种差异很大时(例如,当有很多未测试反应性的样品落在最低mrna应答者和最高mrna无应答者的mrna水平排序之间时),通常将临界值设置为与最低mrna应答者的mrna水平相等或高至多5%的值。当这种差异很小时(例如,当有很少或没有未测试反应性的样品落在最低mrna应答者和最高mrna无应答者的mrna水平排序之间时),通常将临界值设置为最低mrna应答者和最高mrna无应答者的mrna水平之间的值。当最高mrna无应答者的mrna水平高于最低mrna应答者时,通常将临界值设置为与群体中最高mrna无应答者的mrna水平相等或高至多5%的值。
[0192]
在感兴趣的基因/生物标志物是其mrna(例如,前体mrna或成熟mrna)表达与对本文所述的cdk7抑制剂或其药学上可接受的盐(即,bcl-xl、cdk7、cdk9或rb1家族成员)的反应性负相关的实施方案中,将测试群体中的至少一些样本进行对该化合物的反应性以确定:(a)对该特定化合物有反应的群体的样品的最高mrna水平(“最高mrna应答者”);和,任选地,(b)对该特定化合物没有反应的群体的样品的最低mrna水平(“最低mrna无应答者”)。在这些实施方案中,将被认为对特定化合物有反应性的测试细胞的mrna水平的临界值设定为:i)与群体中最高mrna应答者的水平相等或低至多5%;或ii)与群体中最低mrna无应答者的水平相等或低至多5%;或iii)介于群体中最低mrna无应答者和最高mrna应答者的mrna水平之间的值。
[0193]
在mrna(例如,前体mrna或成熟mrna)水平与对本发明化合物的敏感性负相关的实施方案中,并非群体中的所有样品都需要测试对化合物的反应性,但所有样品都测量了感兴趣的基因的mrna水平。在一些实施方案中,样品基于感兴趣的基因mrna水平进行排序。选择上述三种方法中的哪一种来确定临界值将取决于群体中最高mrna应答者和最低mrna无应答者之间感兴趣基因的mrna水平的差异,以及该临界值是否设计为最小化假阳性或最大化应答者的潜在数量。当这种差异很大时(例如,当有很多未测试反应性的样品落在最高mrna应答者和最低mrna无应答者的mrna水平排序之间时),通常将临界值设置为与最高mrna应答者的mrna水平相等或低至多5%的值。当这种差异很小时(例如,当有很多或没有未测试反应性的样品落在最高mrna应答者和最低mrna无应答者的mrna水平排序之间时),通常将临界值设置为最高mrna应答者和最低mrna无应答者的mrna水平之间的值。当最高
mrna应答者的mrna水平低于最低mrna无应答者时,通常将临界值设置为与群体中最低mrna无应答者的mrna水平相等或低至多5%的值。
[0194]
在涉及cdk18的实施方案中,cdk18 mrna(例如,前体mrna或成熟mrna)水平的临界值可以使用基于cdk18增强子强度建立的流行率临界值来确定,如上所述。在这些实施方案的一些方面,测量群体的mrna水平,并且将先前确定的流行率临界值应用于该群体以确定mrna临界水平。在这些实施方案的一些方面,创建群体中cdk18 mrna水平的等级标准曲线,并且将预定的流行率临界值应用于该标准曲线以确定cdk18 mrna的临界水平。
[0195]
在将测试细胞或样品与群体进行比较的一些实施方案中,针对群体获得的临界mrna(例如,前体mrna或成熟mrna)水平值转换为流行率等级并且mrna水平的临界值表示为具有临界值或更高(例如流行率临界值)的群体的百分比。
[0196]
不受理论束缚,申请人相信测试样品的流行率等级和群体中的流行率临界值将是相似的,而与用于测定mrna水平的方法无关。
[0197]
如果通过例如rna(例如,在来自患者的生物样品中的mrna (例如,前体mrna或成熟mrna)水平)确定的braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的状态对应于(例如,等于或大于)分别通过braf、myc、cdk1、cdk2、cdk4、cdk6、cdk17、cdk18、cdk19、ccna1、ccnb1、ccne1、esr-1、fgfr1、pic3ca或编码e2f通路成员的某些基因(参见本文表格)的状态(通过评估群体中的相同参数(例如,mrna水平)来确定)确定的群体中约80%、79%、78%、77%、76%、75%、74%、73%、72%、71%、70%、69%、68%、67%、66%、65%、64%、63%、62%、61%、60%、59%、58%、57%、56%、55%、54%、53%、52%、51%、50%、49%、48%、47%、46%、45%、44%、43%、42%、41%、40%、39%、38%、37%、36%、35%、34%、33%、32%、31%、30%、29%、28%、27%、26%、25%、24%、23%、22%、21%或20%的流行率等级,可以将患者鉴定为可能对本文所述的cdk7抑制剂或其药学上可接受的盐反应良好。如果bcl2样1、cdk7、cdk9、cdkn2a和rb的状态(如通过例如rna(例如,在来自患者的生物样品中的mrna(例如,前体mrna或成熟mrna)水平)水平或相应的蛋白质水平确定)低于分别通过bcl2样1、cdk7、cdk9、cdkn2a和rb的状态(通过评估群体中的相同参数(例如,mrna水平)来确定)确定的群体中约80%、79%、78%、77%、76%、75%、74%、73%、72%、71%、70%、69%、68%、67%、66%、65%、64%、63%、62%、61%、60%、59%、58%、57%、56%、55%、54%、53%、52%、51%、50%、49%、48%、47%、46%、45%、44%、43%、42%、41%、40%、39%、38%、37%、36%、35%、34%、33%、32%、31%、30%、29%、28%、27%、26%、25%、24%、23%、22%、21%或20%的流行率等级,可以将患者鉴定为可能对本文所述的cdk7抑制剂或其药学上可接受的盐反应良好。在一些实施方案中,临界值或阈值是基于生物标志物(例如,mrna)流行率值建立的。
[0198]
在一些实施方案中,群体可以分为三组:应答者、部分应答者和无应答者,并且设置或确定了两个临界值(或阈值)或流行率临界值。部分应答者组可以包括应答者和无应答者以及对本文所述cdk7抑制剂或其药学上可接受的盐的反应不如应答者组高的那些患者。当在群体中,最高无应答者的值(例如,mrna(例如,前体mrna或成熟mrna)水平)高于最低应答者的值(对于相同的参数(例如,mrna水平)评估)时,这种类型的分层可能特别有用。在这种情况下,对于cdk18或cdk19,应答者和部分应答者之间的临界水平或流行率临界值设置
为与最高cdk18或cdk19 mrna无应答者的cdk18或cdk19 mrna水平相等或高至多5%;部分应答者和无应答者之间的临界水平或流行率临界值设置为与最低cdk18或cdk19 mrna应答者的cdk18或cdk19 mrna水平相等或低至多5%。对于bcl-xl、cdk7或cdk9,当最高mrna应答者的mrna水平低于最低mrna无应答者的mrna水平时,这种类型的分层可能很有用。在这种情况下,对于bcl-xl、cdk7或cdk9,应答者和部分应答者之间的临界水平或流行率临界值设置为与最低mrna非应答者的mrna水平相等或低至多5%;部分应答者和无应答者之间的临界水平或流行率临界值设置为与最高mrna应答者的mrna水平相等或高至多5%。是否应向部分应答者施用本文所述的cdk7抑制剂或其药学上可接受的盐的确定将取决于治疗医师的判断和/或监管机构的批准。
[0199]
可用于量化生物样品中特定初级rna转录物的方法是本领域已知的,包括但不限于荧光杂交,如由nanostring technologies提供的服务和产品中所使用的、基于阵列的技术(affymetrix)、逆转录酶qpcr与sybrgreen(life technologies)或taqman技术(life technologies)、rna测序(例如rna-seq)、与rnascope(advanced cell diagnostics)一起使用的rna杂交和信号放大、或者rna印迹。在一些情况下,各种细胞类型中各种基因的mrna表达值是公开可用的(参见例如,broadinstitute.org/ccle;和barretina等人,nature,483:603-607,2012)。
[0200]
在一些实施方案中,测试生物样品和参考标准或群体的所有成员中的生物标志物的状态(例如,如通过rna转录物的水平评估)在比较之前归一化。归一化涉及通过与两种细胞中天然存在并以相同水平存在的另一种rna转录物(例如,gadph mrna、18s rna)或与在确定超级增强子强度之前“加标”到每个细胞的样品中固定水平的外源rna进行比较,来调整初级rna转录物的测定水平。
[0201]
患有本文所述癌症并基于生物标志物状态如本文所述鉴定的患者(例如人)可能已确定为对在本文所述的cdk7抑制剂或其药学上可接受的盐之前施用的治疗剂具有抗药性(或在一些初始功效后获得抗药性)和/或对先前施用的化学治疗剂(例如,bcl-2抑制剂如维奈托克、bet抑制剂、cdk4/6抑制剂如帕博西尼或瑞博西尼、cdk9抑制剂如阿伏西地(alvocidib)、flt3抑制剂、mek抑制剂例如曲美替尼、parp抑制剂如奥拉帕尼或尼拉帕尼、pi3k抑制剂如阿培利司或卡培他滨、铂基治疗剂如顺铂、奥沙利铂、奈达铂、卡铂、菲铂(phenanthriplatin)、吡铂、赛特铂(jm216)或四硝酸三铂、serm如他莫昔芬、法洛昔芬(faloxifene)或托瑞米芬,或类固醇受体降解剂(例如,serd如氟维司群))具备抗药性。包括一种或多种这些药剂的联合疗法(其中对如本文所述或以其他方式选择的患者进行施用)也在本发明的范围内并且在本文中进一步讨论。例如,在一个实施方案中,方法包括使用或施用本文所述的cdk7抑制剂或其药学上可接受的盐与serd如氟维司群联合,以治疗对cdk4/6抑制剂(如帕博西尼或瑞博西尼)的治疗具有抗药性的癌症(例如,乳腺癌(例如,er+乳腺癌(例如,hr+/her2-癌症)))。
[0202]
在一些实施方案中,先前治疗剂可以是作为单一疗法或与soc药剂联合施用的铂基抗癌剂。大多数癌症患者最终会通过以下一种或多种机制对铂基疗法产生耐药性:(i)细胞膜转运蛋白的分子改变降低了铂剂的吸收;(ii)阻止细胞诱导细胞死亡的凋亡信号传导通路的分子改变;(iii)某些基因(例如,brca1/2、chek1、chek2、rad51)的分子改变可恢复细胞修复铂剂诱导的dna损伤的能力。k.n.yamamoto等人,plos one 9(8):e105724,2014。
术语“分子改变”包括来自参与这些功能的基因的mrna(例如,前体mrna或成熟mrna)表达增加或减少;来自这些基因的蛋白质表达增加或减少;以及从这些基因表达的mrna/蛋白质的突变。
[0203]
抗药性通常由治疗期间的疾病进展(例如,肿瘤大小和/或数量的增加)或肿瘤缩小率的降低确定。在某些情况下,如果患者的癌症在治疗期间有反应或稳定,但在使用该药剂治疗后1-6个月内出现进展,则该患者将被视为对铂基药剂产生抗药性。在使用铂基药剂进行任意次数的治疗后,可能会出现抗药性。在一些情况下,疾病进展发生在完成治疗期间或完成治疗的1个月内。在这种情况下,患者被认为从未表现出对药剂的反应。这也被称为对于该疗法“难治”。当铂剂不再被认为是癌症的有效治疗方法时,治疗医师也可以确定抗药性。
[0204]
在一些实施方案中,患者是或已确定对作为单一疗法或与soc药剂联合施用的cdk4/6抑制剂的治疗有抗药性。
[0205]
已知癌症中的cdk4/6抑制剂(例如,如本文所述的hr+乳腺癌)通过诱导g1停滞来阻断进入细胞周期的s期。已证明癌症(例如hr+转移性乳腺癌)对cdk4/6抑制剂的抗药性部分由以下分子改变介导:1)增强cdk4/6活性,如cdk6、ccnd1或fgfr1的扩增(formisano等人,sabcs 2017,publication number gs6-05;cruz等人,sabcs 2017publication number pd4-05),或2)重新激活cdk4/6下游的细胞周期进入,如rb1丢失和ccne1扩增(condorelli,ann oncol,pmid:29236940,2017;herrera-abreu,cancer research pmid:27020857,2016)。
[0206]
与通常施用一段时间然后是一段无治疗期的铂基药剂不同,cdk4/6抑制剂如帕博西尼、瑞博西尼或阿贝西利(abemaciclib)会一直施用,直到观察到疾病进展。在某些情况下,当患者的癌症在治疗期间最初有反应或稳定,但最终在仍在治疗期间开始进展时,患者将被认为已变得对cdk4/6抑制剂有抗药性。在某些情况下,如果癌症在治疗期间进展而没有表现出任何显著的反应或稳定,则认为患者对cdk4/6抑制剂的治疗具有抗药性或难治性。当cdk4/6抑制剂不再被认为是癌症的有效治疗方法时,治疗医师也可以确定抗药性。
[0207]
本发明的方法可以使用药物组合物,其包括本文所述的cdk7抑制剂或其药学上可接受的盐和任选地药学上可接受的载剂。在某些实施方案中,药物组合物包括本文所述式的化合物(一般地或具体地)或其药学上可接受的盐。如所指出的,药物组合物可以包括一种或多种药学上可接受的载剂,并且其中可以提供有效量(例如,治疗有效量或预防有效量)的活性剂/成分。如有任何疑问,本文所述的任何cdk7抑制剂或其药学上可接受的盐可包括在本发明的药物组合物中并用于本文所述的诊断和治疗方法中。
[0208]
本发明的药物组合物可以通过药理学领域已知的相关方法制备。一般而言,此类制备方法包括将本文所述的化合物,包括本文所述的cdk7抑制剂或其药学上可接受的盐,与载剂和/或一种或多种其他活性成分(例如,本文所述的第二药剂)和/或辅助成分结合的步骤,然后如有需要和/或预期,将产品成型和/或包装成预期的单剂量或多剂量单位(例如,用于口服给药)。辅助成分可提高本文所述的cdk7抑制剂或其药学上可接受的盐的生物利用度,可减少和/或改变其代谢,可抑制其排泄,和/或可改变其在体内的分布(例如,通过靶向病变组织(例如,肿瘤))。药物组合物可以多种方式包装,包括在散装容器中且作为单个或多个单位剂量(包含,例如,离散的、预定量的活性剂),并且任何此类包装或分开的剂
型都在本发明的范围内。活性成分的量可以等于构成单位剂量或剂量的方便部分的量,例如剂量的二分之一或三分之一。
[0209]
本发明的药物组合物中的活性剂/成分、药学上可接受的载剂和/或任何附加成分的相对量可以变化,这取决于所治疗的受试者的身份、体型和/或状况并且进一步取决于施用组合物的途径和待治疗的疾病。举例而言,该组合物可包含约0.1%(w/w或w/v)至99.9%(w/w或w/v)的活性剂/成分。
[0210]
可用于制备本文所述药物组合物的药学上可接受的载剂在药物制剂领域是众所周知的,包括惰性稀释剂、分散剂和/或成粒剂、表面活性剂和/或乳化剂、崩解剂、粘合剂、防腐剂、缓冲剂、润滑剂、和/或油。可用于制备本文所述药物组合物的药学上可接受的载剂包括但不限于离子交换剂、氧化铝、硬脂酸铝、卵磷脂、血清蛋白如人血清白蛋白、缓冲物质如磷酸盐、甘氨酸、山梨酸、山梨酸钾、饱和植物脂肪酸的部分甘油酯混合物、水、盐或电解质如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐、硅胶、三硅酸镁、聚乙烯吡咯烷酮、纤维素基物质、聚乙二醇、羧甲基纤维素钠、聚丙烯酸酯、蜡、聚乙烯-聚氧丙烯-嵌段聚合物、聚乙二醇和羊毛脂。
[0211]
如本文所述使用的药物组合物可以口服施用。此类口服可接受的剂型可以是固体(例如,胶囊、片剂、袋剂、粉剂、颗粒剂和口腔可分散薄膜)或液体(例如,安瓿、半固体、糖浆、悬浮液或溶液(例如,水性悬浮液或分散体和溶液)。在片剂的情况下,常用的载体包括乳糖和玉米淀粉。也可以包括润滑剂如硬脂酸镁。在胶囊的情况下,有用的稀释剂包括乳糖和干玉米淀粉。当配制水性悬浮液时,活性剂/成分可以与乳化剂和悬浮剂组合。在任何口服制剂中,也可以添加甜味剂、调味剂或着色剂。在本文所述的各个实施方案中的任一个中,口服制剂可以被配制用于立即释放或持续/延迟释放并且可以是包衣的或未包衣的。所提供的组合物也可以是微囊化的。
[0212]
适用于口腔或舌下施用的组合物包括片剂、锭剂和软锭剂。制剂也可以制备用于皮下、静脉内、肌肉内、眼内、玻璃体内、关节内、滑膜内、胸骨内、鞘内、肝内、腹膜内病灶内和通过颅内注射或输注技术。优选地,组合物口服、皮下、腹膜内或静脉内施用。本发明组合物的无菌可注射形式可以是水性或油质悬浮液。这些悬浮液可以根据本领域已知的技术使用合适的分散剂或润湿剂和悬浮剂来配制。无菌注射制剂也可以是在无毒的肠胃外可接受的稀释剂或溶剂中的无菌注射溶液或混悬液,例如作为在1,3-丁二醇中的溶液。可以使用的可接受的载体和溶剂包括水、林格氏液和等渗氯化钠溶液。此外,无菌的不挥发油通常用作溶剂或悬浮介质。
[0213]
尽管本文提供的药物组合物的描述主要针对适合施用于人的药物组合物,但本领域普通技术人员将理解,此类组合物通常适合施用于各种动物。修饰适合施用于人的药物组合物以使该组合物适合施用于各种动物是众所周知的,并且普通兽医药理学家可以设计和/或进行这种修饰。
[0214]
本文所述的化合物通常配制成剂量单位形式,例如单一单位剂量形式,以便于施用和剂量的均匀性。对于任何特定受试者或生物体的具体治疗或预防有效剂量水平将取决于多种因素,包括所治疗的疾病和病症的严重程度;使用的特定活性成分的活性;采用的特定组合物;受试者的年龄、体重、一般健康状况、性别和饮食;所用特定活性成分的施用时间、施用途径和排泄速率;治疗的持续时间;与所使用的特定活性成分联合或同时使用的药
物;以及医学领域中众所周知的类似因素。
[0215]
达到有效量所需的化合物的确切量可以因受试者而异,这取决于例如受试者的物种、年龄、和一般状况、副作用的严重程度、待治疗的疾病、待施用的特定化合物的身份、施用方式等。预期的剂量可以每天三次、每天两次、每天一次、每隔一天、每三天、每周、每两周、每三周或每四周递送。在某些实施方案中,可以使用多次施用(例如,两次、三次、四次、五次、六次、七次、八次、九次、十次、十一次、十二次、十三次、十四次或更多次施用)来递送预期的剂量。
[0216]
在某些实施方案中,用于一天一次或多次(例如,一次)向成年人(例如,70kg)施用的cdk7抑制剂的有效量可以包含约1mg至100mg、约1mg至50mg、约1mg至35mg(例如,约1mg至5mg、1mg至10mg、1mg至15mg、1mg至20mg、1mg至25mg或1mg至30mg)、约2mg至20mg、约3mg至15mg或约10mg至30mg(例如,10mg至20mg或10mg至25mg)。此处和引用范围的任何地方都包括端点。此处提供的剂量可以针对不同体重或体表的患者进行调整,并且可以按患者体表的每m2表示。
[0217]
在某些实施方案中,本发明的组合物可以每天施用一次。本文所述的cdk7抑制剂或其药学上可接受的盐的剂量可以是约1mg、100mg、约1mg、50mg、约1mg、25mg、约2mg、20mg、约5mg、15mg、约10mg、15mg、或者约13mg、14mg。
[0218]
在某些实施方案中,本发明的组合物可以每天施用两次。在一些实施方案中,每次施用的式(i)化合物或其亚属或种的剂量为约0.5mg至约50mg、约0.5mg至约25mg、约0.5mg至约1mg、约1mg至约10mg、约1mg至约5mg、约3mg至约5mg、或者约4mg至约5mg。
[0219]
本文所述的化合物或其他组合物(例如,包含cdk7抑制剂的药物组合物)可以与本文所述的一种或多种第二药剂在联合疗法(例如,如本文所定义和进一步描述的)中施用。联合治疗中使用的附加/第二药剂最有可能对相同的病症(例如,相同的癌症)达到预期效果,但它可能会达到对患者有帮助的不同效果。因此,本发明的特征在于含有治疗有效量的本文所述cdk7抑制剂或其药学上可接受的盐的药物组合物;第二药剂选自bcl-2抑制剂如维奈托克,parp抑制剂如奥拉帕尼或尼拉帕尼,铂基抗癌剂如卡铂、顺铂或奥沙利铂,紫杉烷如紫杉醇,cdk4/6抑制剂如帕博西尼、瑞博西尼、阿贝西利(abemaciclib)或曲拉西利,选择性雌激素受体调节剂(serm)如他莫昔芬(商品名为nolvadex
tm
和soltamox
tm
)、雷洛昔芬(商品名为evista
tm
)和托瑞米芬(可作为fareston
tm
获得),和选择性雌激素受体降解剂如氟维司群(作为faslodex
tm
获得),每一种都处于治疗有效量;和药学上可接受的载体。
[0220]
所鉴定的患者可以是“新诊断的”,因此之前未暴露于如本文所述的第二药剂,在这种情况下,患者可以被定义为未接受过治疗。
[0221]
除非另有说明,当在本发明的方法中使用本文所述的cdk7抑制剂或其药学上可接受的盐和第二治疗剂的组合时,第二治疗剂可以与本文所述的cdk7抑制剂或其药学上可接受的盐同时、之前或之后施用。第二治疗药剂可以以针对该药剂确定的剂量和/或时间安排施用。第二治疗剂也可以与本文所述的cdk7抑制剂或其药学上可接受的盐一起以单一剂型施用或分开以不同剂型施用。一般而言,预期与本文所述的cdk7抑制剂或其药学上可接受的盐联合使用的第二治疗剂将以不超过它们单独使用的水平的水平使用。在一些实施方案中,联合使用的第二治疗剂的水平由于协同作用将低于在单一疗法中使用的水平。
[0222]
对于本文所述的cdk7抑制剂或其药学上可接受的盐和选自本文所述的那些中的
任何一种的额外/第二药剂的组合,可以提供包含两种活性治疗剂(或更多,例如,进一步包括第三药剂)中的每一种的试剂盒并且在本发明的范围内。此类试剂盒可用于本文所述的任何诊断和治疗方法。在一些情况下,第一和第二药剂将在分开的容器中(例如,第一药剂被限制在第一容器中并且第二药剂被限制在第二容器中)和/或配制在药学上可接受的组合物中,任选地以单位剂型,其包括第一药剂、第二药剂和药学上可接受的载体。在一些情况下,试剂盒包括书面插页或标签,以及在患有癌症(例如,如本文所述)的患者中使用两种(或多种)治疗剂并被鉴定为适合通过本文所述的方法进行治疗的说明。说明书可以粘附或以其他方式附在包含治疗剂的一个或多个容器上。或者,说明书和容器可以彼此分开,但一起存在于单个试剂盒、包装、盒子、袋子或其他类型的容器中。试剂盒中的说明通常由批准该组合的治疗用途的政府机构强制或建议(例如,在如本文所述鉴定的患者群体中)。说明书可以任选地包含每种治疗剂的剂量信息、批准或可以处方的联合治疗的癌症类型、每种治疗剂的物理化学信息、每种治疗剂的药代动力学信息、药物-药物相互作用信息、或者诊断信息(例如,如本文所述的基于生物标志物或鉴定患者以进行治疗的方法)。本发明的试剂盒还可以包括可用于本文所述的诊断方法的试剂。
[0223]
实施例
[0224]
为了可以更充分地理解本文描述的本发明,提出以下实施例。本技术中描述的合成和生物学实施例用于说明本文提供的化合物、药物组合物和方法,不应以任何方式解释为限制它们的范围。
[0225]
本文提供的化合物可以使用对本领域技术人员公知的下文阐述的具体合成方案的修改从容易获得的起始材料制备。应当理解,在给出典型或优选的工艺条件(即,反应温度、时间、反应物的摩尔比、溶剂、压力等)的情况下,除非另有说明,否则也可以使用其他工艺条件。最佳反应条件可随所用的特定反应物或溶剂而变化,但此类条件可由本领域技术人员通过常规优化程序确定。
[0226]
此外,如对本领域技术人员显而易见的,常规保护基团可能是必要的以防止某些官能团发生非预期的反应。为特定官能团选择合适的保护基团以及保护和去保护的合适条件是本领域众所周知的。例如,greene等人,protecting groups in organic synthesis,second edition,wiley,纽约,1991和其中引用的参考文献中描述了许多保护基团以及它们的引入和去除。
[0227]
来自图1a-1x的示例性化合物的合成描述于wo2018/013867。
[0228]
实施例1:cdk激酶活性的抑制。在biortus biosciences(中国江苏省江阴市)使用激酶测定法测定本发明化合物对cdk7、cdk9、cdk12和cdk2活性的抑制,每种cdk用caliper/labchip ez reader(perkin elmer,waltham,ma)开发。这些测定法测量作为总肽的一部分的磷酸化肽底物的量,然后是使用以下组分的27℃孵育期:测试化合物(在一系列3倍系列稀释液中从10μm降至0.508nm的不同浓度)、活性cdk激酶蛋白(带有指示cyclin,每个cdk在下面列出)、atp(2mm)、和在以下缓冲液中的底物肽(在下面列出):2-(n-吗啉代)乙磺酸盐(mes缓冲液,20mm),ph 6.75,0.01%(v/v)tween20去污剂,0.05mg/ml牛血清白蛋白(bsa)。
[0229]
具体而言,cdk7抑制测定使用cdk7/cyclin h/mat1复合物(6nm)和“5-fam-cdk7tide”肽底物(2μm,合成的荧光团标记肽具有以下序列:5-fam-ysptspsysptspsysptspskkkkk(seq id no:1),其中“5-fam”是指5-羧基荧光素),在上面列
出的缓冲组合物中含有6mm mgcl2。此外,cdk9抑制测定使用cdk9/cyclin t1复合物(8nm)和“5-fam-cdk9tide”肽底物(2μm,合成的荧光团标记肽具有以下序列:5-fam-gsrtpmy-nh2,其中5-fam定义如上,nh2表示c端氨基),在上述缓冲液组合物中含有10mm mgcl2。cdk12抑制测定使用cdk12(aa686-1082)/cyclin k复合物(50nm)和如上定义的“5-fam-cdk9tide”(2μm),在上述缓冲液组合物中含有2mm mgcl2。此外,cdk2抑制测定使用cdk2/cyclin e1复合物(0.5nm)和如上定义的“5-fam-cdk7tide”肽(2μm),在上述缓冲液组合物中含有2mm mgcl2。
[0230]
对于每个cdk的抑制测定,选择27℃的孵育期,以使每个测定中产生的磷酸化肽产物的比例相对于总肽浓度约为未抑制激酶的20%(
±
5%)(cdk7 35分钟,cdk2 35分钟,cdk12 3小时,cdk9 15分钟)。在测试化合物滴定并导致肽产物形成抑制的情况下,拟合这些数据以产生最佳拟合ic
50
值。这些测定的结果显示于下表1中,其中“a”表示计算出的ic
50
小于20nm;“b”表示计算出的ic
50
介于20nm至小于200nm之间;“c”表示计算出的ic
50
介于200nm至小于5μm之间;“d”表示计算出的ic
50
大于或等于5μm,“nt”表示在指定测定中未检测到指定化合物。
[0231]
表1.选定的本发明化合物对cdk2、cdk7、cdk9和cdk12的抑制活性。
[0232]
[0233]
[0234]
[0235][0236]
实施例2.细胞增殖的抑制。
[0237]
a673细胞:a673细胞是源自人肌肉尤文氏肉瘤的细胞系。在不同浓度(从4μm到126.4pm;0.5log系列稀释)下测试本发明的代表性化合物抑制a673细胞增殖的能力。已知的cdk抑制剂dinaciclib或n-((1s,3r)-3-((5-氯-4-(1h-吲哚-3-基)嘧啶-2-基)氨基)环己基)-5-((e)-4-(二甲基氨基)丁-2-烯酰胺基)吡啶酰胺和雷公藤内酯用作阳性对照。细胞在杜尔贝科改良伊格尔培养基、+10%fbs+1mm丙酮酸钠中生长。细胞在5%co2存在下在加湿室中于37℃培养。在72小时的时间段内进行增殖测定。按照制造商的说明和使用
cyquant试剂盒提供的试剂用cyquant(life technologies,chicago,il usa)评估化合物的抗增殖作用。测定结果如下表1所示,其中“a”表示计算出的ic
50
小于20nm;“b”表示计算出的ic
50
介于20nm到小于200nm之间;“c”表示计算出的ic
50
介于200nm到小于5μm之间;“d”表示计算出的ic
50
大于5μm。
[0238]
hcc70细胞:hcc70细胞是源自人三阴性乳腺癌的细胞系。在不同浓度(从4μm到126.4pm;0.5log系列稀释)下测试本发明的代表性化合物抑制hcc70细胞增殖的能力。已知的cdk抑制剂dinaciclib或n-((1s,3r)-3-((5-氯-4-(1h-吲哚-3-基)嘧啶-2-基)氨基)环己基)-5-((e)-4-(二甲基氨基)丁-2-烯酰胺基)吡啶酰胺和雷公藤内酯用作阳性对照。细胞在atcc配制的rpmi-1640培养基(atcc 30-2001)+10%fbs中培育。细胞在5%co2存在下在加湿室中于37℃培养。在72小时的时间段内进行增殖测定。按照制造商的说明并使用cyquantdirect cell试剂盒提供的试剂用cyquantdirect cell proliferation assay(life technologies,chicago,il usa)评估化合物的抗增殖作用。测定的结果显示于下表2中,其中“a”表示计算出的ic
50
小于100nm;“b”表示计算出的ic
50
介于100nm到小于1000nm之间;“c”表示计算出的ic
50
介于1000nm到小于5μm之间;“d”表示计算出的ic
50
大于5μm。
[0239]
表2.本发明化合物对a673细胞和hcc70细胞增殖的抑制。
[0240]
[0241]
[0242]
[0243]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1