一种具有抗流感病毒作用的艾纳香提取物及其制备方法与流程
8mpa;提取时间为30-240min;所得产物挥去乙醇,得艾纳香提取物。
13.本发明的部分实施方案中,夹带剂为75-95%的乙醇,优选为95%的乙醇;其用量为原料量的4-8倍,优选为5-6倍;
14.或/和萃取温度为35-50℃,优选为45℃;萃取压力为22.0-26.0mpa;
15.或/和分离釜一的温度为40-55℃,压力为5-8mpa;优选地,分离釜一的温度为45℃,压力为6mpa;
16.或/和分离釜二的温度为40-55℃,压力为4-6mpa;优选地,分离釜二的温度为45℃,压力为5mpa;
17.或/和提取时间为60-180min,优选为120min;
18.优选地,分离釜二的压力小于分离釜一。
19.本发明的部分实施方案中,所述提取方法为冷浸法时,包括以下步骤:取艾纳香原料,按料液比1:5-40加入60-95%的乙醇,冷浸2-72小时,过滤,收集滤液,挥去乙醇,得艾纳香提取物。
20.本发明的部分实施方案中,所述料液经为1:10-30,优选为1:20;
21.或/和冷浸时间为8-60小时,优选为48小时;
22.或/和乙醇浓度为75-95%,优选为95%。
23.本发明的部分实施方案中,所述提取方法为超声提取法时,包括以下步骤:将艾纳香原料适量,加入60-95%的乙醇超声,收集滤液,挥去乙醇,得艾纳香提取物;
24.优选地,加入75-95%的乙醇超声,更优选地,加入95%的乙醇超声;
25.优选地,艾纳香原料与乙醇的料液比为1:5-40,更优选为1:10-30,进一步优选为1:20;
26.优选地,提取次数为1-3次,更优选为2次;
27.优选地,超声温度优选为常温;
28.优选地,每次的超声时间为10-120min,更优选为60min。
29.本发明的部分实施方案中,所述方法为冷浸与超声提取法时,包括以下步骤:取艾纳香原料,加入60-95%的乙醇冷浸后,超声,过滤,收集滤液,挥去乙醇,得艾纳香提取物;
30.优选地,加入75-95%的乙醇冷浸,更优选地,加入95%的乙醇冷浸;
31.优选地,艾纳香原料与乙醇的料液比为1:5-40,更优选为1:10-30,进一步优选为1:20;
32.优选地,冷浸时间为2-72小时,更优先为8-60小时,进一步优选为48小时;
33.优选地,超声时间为0.5-4小时,优选为2小时;
34.优选地,超声温度优选为常温。
35.本发明的部分实施方案中,所述方法为回流法时,包括以下步骤:取艾纳香原料,加入50-70%的乙醇加热回流,保持微沸,提取,过滤,收集滤液,挥去乙醇,得艾纳香提取物;
36.优选地,加入60%的乙醇加热回流;
37.优选地,提取次数为1-3次,更优选为1次或2次;
38.优选地,每次提取时间为0.5-4小时,更优选为2小时;
39.优选地,艾纳香原料与乙醇的料液比为1:5-40,更优选为1:10-30,进一步优选为
1:20。
40.本发明的部分实施方案中,所述方法为渗漉法时,包括以下步骤:取艾纳香原料,加入1-3倍原料体积的60-95%的乙醇拌匀,密闭放置1-5小时,使材润湿及膨胀后,装筒,再加入10-15倍原料体积60-95%乙醇浸渍24-48小时,渗漉,渗漉液流速为1-5ml/min,收集渗漉液,挥去乙醇,得艾纳香提取物;
41.优选地,加入1倍原料体积的95%的乙醇拌匀,密闭放置2小时;
42.优选地,装筒后再加入15倍原料体积95%的乙醇浸渍24小时;
43.优选地,渗漉液流速为2-3ml/min。
44.本发明的部分实施方案中,采用紫外-可见分光光度法测定总黄酮,具体为:
45.(1)波长的选择。取样品液适量,在0.3ml5%亚硝酸钠溶液存在的碱性条件下,经硝酸铝显色后,以试剂为空白参比液在420~700nm波长范围测定络合物的吸光度,络合物于504nm波长处有最大吸收。
46.(2)标准曲线绘制。分别精密吸取芦丁对照液(0.10mg/ml)0.00,1.00,2.00,3.00,4.00,5.00ml于10.00ml容量瓶中,分别加入5%亚硝酸钠溶液0.30ml,摇匀,静置6min,再加入10%硝酸铝溶液0.3ml,摇匀,静置6min,再加4%氢氧化钠溶液4.00ml,用水稀释至刻度,摇匀,静置12min,以试剂作空白参比液,于504nm处测吸光度。
47.(3)供试品溶液配制。量取本品0.5ml置于10ml量瓶中,分别加入5%亚硝酸钠溶液0.3ml,摇匀,静置6min,再加入10%硝酸铝溶液0.3ml,摇匀,静置6min,再加4%氢氧化钠溶液4ml,用水稀释至刻度,摇匀,静置12min后即得。
48.(4)在504nm处测定吸光度,计算总黄酮含量。
49.本发明中,所述艾纳香为菊科艾纳香属植物blumea dc.的叶及嫩枝。
50.本发明的部分技术方案中,艾纳香为blumea balsamifera(l.)dc.、b.balsamifera(l.)dc.、b.oblongifolia kitam、或b.megacephala(randeria)cc.chang et yq.tseng的叶及嫩枝。
51.与现有技术相比,本发明具有以下有益效果:
52.本发明首次对艾纳香除了挥发油以外的成分进行了研究,采用乙醇为溶剂,制得艾纳香乙醇提取物。本发明意外地发现,艾纳香乙醇提取物具有抗多种流感病毒作用。实验表明,艾纳香乙醇提取物对a型流感病毒及b型流感病毒均有良好的抑制作用。
53.本发明的制备方法简单,操作简单,质量可控,适宜于工业化生产。
附图说明
54.附图1为加药处理实验设计图。
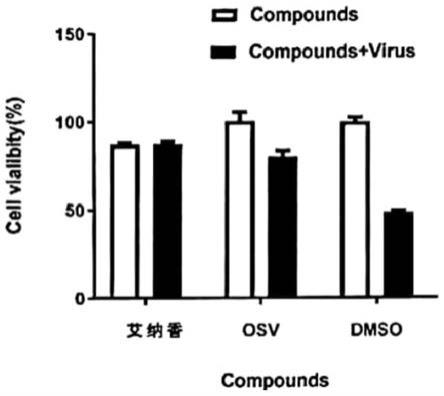
55.附图2为实施例6的艾纳香提取物抗流感病毒活性测试结果图,其中艾纳香指艾纳香提取物,osv为阳性药物奥司他韦,dmso为空白样品。
56.附图3为实施例7的不同浓度的艾纳香提取物对h1n1病毒抑制率曲线图。
57.附图4为实施例8中艾纳香提取物抗yamagata系b型病毒活性测试结果图。
58.附图5为实施例9中艾纳香提取物抗b型流感病毒yamagata系活性测试结果图。
59.附图6为实施例9中艾纳香提取物抗b型流感病毒yamagata系半数抑制浓度结果图。
60.附图7为实施例10中艾纳香提取物抗victoria系b型病毒活性测试结果图。
61.附图8为实施例11中艾纳香提取物抗b型流感病毒victoria系活性测试结果图。
62.附图9为实施例11中艾纳香提取物抗b型流感病毒victoria系半数抑制浓度结果图。
63.附图10为实施例12中艾纳香提取物抗a型流感病毒h3n2活性测试结果图。
64.附图11为实施例12艾纳香提取物抗a型流感病毒h3n2半数抑制浓度结果图。
65.附图12为实施例13艾纳香提取物抗奥司他韦耐药的b型流感病毒yamagata系活性测试结果图。
66.附图13为实施例13艾纳香提取物抗奥司他韦耐药的b型流感病毒yamagata系半数抑制浓度结果图。
67.附图14为实施例14艾纳香提取物抗奥司他韦耐药的b型流感病毒victoria系活性测试结果图。
68.附图15为实施例14艾纳香提取物抗奥司他韦耐药的b型流感病毒victoria系半数抑制浓度结果图。
具体实施方式
69.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
70.本发明实施例中所述的超声提取时超声功率为100w,频率40khz。
71.实施例1
72.本实施例公开了采用超临界co2提取法制备艾纳香提取物,具体为:
73.取艾纳香(blumea balsamifera(l.)dc.)粗粉适量,置于co2超临界提取装置中,以95%乙醇为夹带剂,其用量为原料的6倍(体积/质量,质量为g时,体积为ml)。
74.萃取温度为45.0℃,萃取压力为22.0mpa;分离釜一温度为50.0℃,压力为6mpa;分离釜二温度为50.0℃,压力为5mpa;萃取时间为120min。所得产物挥去乙醇,得艾纳香提取物,其总黄酮含量为28wt%。
75.实施例2
76.本实施例公开了本发明采用冷浸法制备艾纳香提取物,具体为:取艾纳香(b.balsamifera(l.)dc.)原料粗粉,按料液比1:20加95%的乙醇,冷浸48小时,过滤,收集滤液,挥去乙醇,得艾纳香提取物,其总黄酮含量为24wt%。
77.实施例3
78.本实施例公开了本发明采用超声提取法制备艾纳香提取物,具体为:取艾纳香(blumea balsamifera(l.)dc.)原料适量,提取2次,每次加20倍量95%乙醇,常温下超声60min后过滤,收集滤液,挥去乙醇,得艾纳香提取物,其总黄酮含量为19wt%。
79.实施例4
80.本实施例公开了本发明采用冷浸与超声提取法制备艾纳香提取物,具体为:取艾纳香(b.balsamifera(l.)dc.)原料适量,按料液比1:20加95%的乙醇,冷浸48小时后超声2
小时,过滤,收集滤液,挥去乙醇,得艾纳香提取物,其总黄酮含量为29wt%。
81.实施例5
82.本实施例公开了本发明回流法制备艾纳香提取物,具体为:取艾纳香(b.balsamifera(l.)dc.)原料适量,按料液比1:10加60%的乙醇,加热回流提取,保持微沸,提取2h,过滤,收集滤液,挥去乙醇,得艾纳香提取物,其总黄酮含量为30wt%。
83.实施例6-14
84.实施例6-14为对本发明的艾纳香提取进行的抗病毒研究测试。
85.实施例6
86.本实施例公开了对本发明的艾纳香提取物样品抗流感病毒活性评价。本实施例中所述的艾纳香提取物为按实施例1的方法制得。研究测试方法具体为:
87.1.病毒株:流感病毒减毒活毒株a/wsn/33(h1n1)
88.2.细胞:mdck细胞(madin-daby canine kidney cells),分离培育于1958年9月,来源于考克斯班尼犬的肾脏。当前,mdck细胞扩增病毒具有感染率高、增殖快、稳定性高等特点,所以该细胞被认为是最适用于甲、乙型流感病毒疫苗生产的3种细胞系之一。
89.3.加药处理
90.给药方式如附图1所示:b2-g9区域每一竖排分别加不同的待测样品,b10-g10区域加阳性对照奥司他韦,b11-g11区域加阴性对照dmso;黑线下面的三横排再加入病毒。这样的给药方式既可以检测出样品的抗病毒活性,又可以检测其细胞毒性。
91.4.分组与剂量设计
92.(1)艾纳香提取物以dmso溶解,加药剂量为50μg/ml
93.(2)阳性药物对照:奥司他韦(osv),加药剂量设计为100μm/ml;
94.(3)阴性对照:空白dmso。
95.5.细胞病变
96.流感病毒能引起mdck细胞发生病变,称之为cpe效应,细胞活力显著降低。阴性对照dmso组加入病毒后能看到明显的cpe效应,而样品如能有效抑制流感病毒的感染,则加入等量病毒后细胞状态依旧良好。
97.6.细胞活力检测:
98.实验采用试剂盒检测细胞活力。celltiter-glo方法是通过对atp进行定量测定来检测培养物中细胞活力的一种均质检测方法。活细胞中的atp直接参与反应,反应产生的光与活细胞数量成正比,通过检测化学发光值即可获知待测孔中的细胞活力,从而反映待测样品是否具有抑制流感病毒感染细胞的活性。
99.7.数据处理:
100.以空白对照(dmso)组的化学发光值对应的细胞活力定义为100%,
101.相对细胞活力=各组细胞的检测值/空白对照组细胞的检测值
×
100%
102.抑制率=(1-(提取物对细胞作用检测值-提取物对病毒作用检测值)/(空白组检测值-病毒对照检测值)
×
100%
103.抑制率是指化合物起到抑制病毒生长的作用的比率。反映了化合物抗病毒活性。
104.研究测试结果:
105.如附图2所示,在本实验条件下,50μg/ml艾纳香提取物呈现出显著的抗流感病毒
活性,同时也呈现出轻微的细胞毒性。
106.实施例7
107.本实施例公开了不同剂量艾纳香提取物抗流感病毒活性评价,本实施例中所述的艾纳香提取物为按实施例1的方法制得。具体研究方法如下:
108.1材料
109.1.1试剂
110.dmem培养基(gibco公司);dmso(天津津东天正精细化工试剂厂);奥司他韦(osv,安耐吉公司);tpck-胰蛋白酶(上海国源生物技术有限公司);celltiter-glo试剂盒((promega corp.,madison,wi,usa)。
111.1.2仪器
112.qp-160型co2恒温培养箱(biobase公司);xds-1倒置相差显微镜(深圳市星明光学仪器有限公司);l500低速离心机(湖南湘仪实验仪器开发有限公司);1510全波长酶标仪(thermofisher公司)。
113.1.3病毒与细胞
114.甲型流感病毒减毒株a/wsn/33(h1n1),由中国医学科学院医学生物研究所提供;犬肾细胞(madin-daby canine kidney cells,mdck),由中国医学科学院医学生物研究所提供。
115.2方法
116.2.1供试品制备
117.本实施例所用样品为按实施例1的方法制得的艾纳香提取物,以dmso溶解提取物配置成浓度为10mg/ml、5mg/ml、2.5mg/ml、1.25mg/ml、0.63mg/ml、0.32mg/ml、0.16mg/ml、0.08mg/ml的母液,再分别将母液用培养基稀释,依次配置成为100μg/ml、50μg/ml、25μg/ml、12.5μg/ml、6.25μg/ml、3.13μg/ml、1.56μg/ml和0.78μg/ml八个浓度,作为提取物组待测溶液。
118.以dmso溶解osv,再用培养基稀释为100μm/ml浓度,作为阳性对照组待测溶液;配置含1%dmso的培养基,作为空白对照组待测溶液。
119.2.2病毒培养与毒力测定
120.将病毒接种于9~11日龄的鸡胚尿囊腔,35℃培育72h,无菌操作收获尿囊液。3000rpm离心15min以除去沉淀,收集上清液。将收集的病毒液做10倍系列稀释为10-1
至10-8
共8个稀释度,加入已贴壁的96孔板mdck细胞中,每个浓度8个孔,每孔细胞大约3
×
104个,同时设空白对照组。各孔中mdck细胞于35℃吸附病毒2h后换用培养液,置于培养箱中继续培养(37℃,5%co2),48h后在显微镜下观察细胞病变效应,根据按reed-muench法计算病毒的半数细胞培养物感染量tcid
50
/ml=10-6.25
。
121.2.3提取物对细胞的毒性作用测定
122.将mdck细胞以每孔3
×
104个细胞接种于96孔板,置培养箱(37℃,5%co2)中,待细胞单层吸附于96孔板,吸弃上清液。分别加入100μl不同浓度提取物溶液作为提取物组,每个浓度重复3个孔,同时设阳性对照组(osv,100μm/ml)和空白对照组(dmso,1%),置培养箱(37℃,5%co2)中培养36~40h后,采用celltiter-glo试剂盒检测细胞活力。
123.细胞活力=各组细胞的检测值/空白对照组细胞的检测值
×
100%
124.2.4提取物对流感病毒感染细胞活性的影响
125.取细胞已单层吸附的96孔板,接种100tcid
50
病毒液,每孔100μl,在培养箱(37℃,5%co2)中吸附2h后,吸弃病毒液。往各孔中分别加入不同浓度提取物溶液作为提取物组,每个浓度重复3个孔,同时设阳性药组、病毒对照组和空白对照组。置培养箱(37℃,5%co2)中培养36~40h以后,测定含病毒状态下各组的细胞活力。计算提取物对病毒的抑制率,采用probit回归分析
14.得出半数抑制浓度(50%inhibiting concentration,ic
50
),并计算选择指数(selection index,si)。
126.提取物对病毒抑制率=1-(提取物对细胞作用检测值-提取物对病毒作用检测值)/(空白组检测值-病毒对照检测值)
127.si=tc
50
/ic
50
128.2.5统计方法
129.实验数据采用spss 21.0软件进行统计学分析,定量资料采用均数
±
标准差表示,多组间数据比较采用单因素方差分析。检验水准α除特别说明外均设定为0.05。
130.3结果
131.3.1提取物对细胞毒性作用测定结果
132.如表1中数据所示,当提取物浓度为0.78μg/ml、1.56μg/ml、3.13μg/ml、6.25μg/ml、12.5μg/ml、25μg/ml和50μg/ml时,细胞活力与空白组差异无统计学意义(p》0.05);在取物浓度升高到100μg/ml时,细胞活力降低至87.42%,低于空白对照组(p《0.05),提取物在此浓度下表现出轻微细胞毒性,但也可推断提取物对细胞的半数中毒浓度(tc
50
)应大于100μg/ml。
133.表1不同浓度提取物对mdck细胞活力的影响
[0134][0135]
注:与空白对照组相比,*p《0.05,**p《0.01;
[0136]
3.2提取物体外抗病毒作用测定结果
[0137]
如表2中数据所示,当提取物浓度为0.78μg/ml、1.56μg/ml、3.13μg/ml时,提取物组的细胞活力与病毒对照组相比差异无统计学意义(p》0.05),表明提取物在这些浓度时对流感病毒没有抑制作用;当提取物浓度为6.25μg/ml、12.5μg/ml、25μg/ml、50μg/ml、100μg/ml时,提取物组细胞活力高于病毒对照组,差异有统计学意义(p《0.05),表明提取物在这些浓度时对流感病毒有抑制作用。
[0138]
表2不同浓度提取物对病毒抑制作用的影响
[0139][0140][0141]
注:1)与病毒对照组相比,δp《0.05,δδp《0.01;与阳性对照组相比,#p《0.05,##p《0.01。2)抑制率大于100%的情况均按100%表示。
[0142]
3.3提取物对病毒的半数抑制浓度
[0143]
通过probit回归分析计算提取物对病毒的半数抑制浓度(ic
50
)为8.71μg/ml,见图3。si=tc
50
/ic
50
,因tc
50
应大于100μg/ml,所以提取物选择指数si应大于11.48。(在此筛选体系下osv的ic
50
为7.12μg/ml)
[0144]
实施例8
[0145]
本实施例公开了本发明的艾纳香提取物对yamagata系b型流感病毒的抗病毒活性初步评价。本实施例所述的艾纳香提取物为按实施例2的方法制得。研究测试方法具体为:
[0146]
1.病毒株:流感病毒减毒活毒株b/darwin/58/2019(yamagata)
[0147]
b型流感病毒是根据其抗原特性和ha1区的核苷酸序列分为两大谱系,yamagata系和victoria系。本实验所采用的b/darwin/58/2019(yamagata)病毒株为b型流感/darwin实
验室分离的/该实验室编号58/2019年的毒株(属于b型流感的yamagata毒株)。
[0148]
2.细胞:mdck细胞(madin-daby canine kidney cells)
[0149]
3.病毒培养与毒力测定
[0150]
将病毒接种于9~11日龄的鸡胚尿囊腔,35℃培育72h,无菌操作收获尿囊液。3000rpm离心15min以除去沉淀,收集上清液。将收集的病毒液做10倍系列稀释为10-1
至10-8
共8个稀释度,加入已贴壁的96孔板mdck细胞中,每个浓度8个孔,每孔细胞大约3
×
104个,同时设空白对照组。各孔中mdck细胞于35℃吸附病毒2h后换用培养液,置于培养箱中继续培养(37℃,5%co2),48h后在显微镜下观察细胞病变效应。
[0151]
4.加药处理
[0152]
给药方式如附图1所示:b2-g9区域每一竖排分别加不同的待测样品,b10-g10区域加阳性对照奥司他韦,b11-g11区域加阴性对照dmso;黑线下面的三横排再加入病毒。这样的给药方式既可以检测出样品的抗病毒活性,又可以检测其细胞毒性。
[0153]
5.分组与剂量设计
[0154]
(1)将艾纳香提取物用dmso溶解,并用培养基稀释为50μg/ml;
[0155]
(2)阳性药物对照:奥司他韦(osv),加药剂量设计为100μm/ml;
[0156]
(3)阴性对照:空白dmso。
[0157]
6.细胞病变与细胞活力检查
[0158]
流感病毒能引起mdck细胞发生病变,称之为cpe效应,细胞活力显著降低。阴性对照dmso组加入病毒后能看到明显的cpe效应,而化合物如能有效抑制流感病毒的感染,因此加入等量病毒后细胞状态依旧良好。
[0159]
实验采用试剂盒检测细胞活力。以空白对照(dmso)组的化学发光值对应的细胞活力定义为100%,
[0160]
相对细胞活力=各组细胞的检测值/空白对照组细胞的检测值
×
100%
[0161]
7.数据处理
[0162]
抑制率是指化合物起到抑制病毒生长的作用的比率。反映了化合物抗病毒活性。
[0163]
提取物对病毒抑制率=1-(提取物对细胞作用检测值-提取物对病毒作用检测值)/(空白组检测值-病毒对照检测值)
×
100%
[0164]
研究测试结果:
[0165]
艾纳香提取物对mdck细胞活性的影响和抗yamagata系b型流感病毒的活性测试结果如表3和图4所示。在本实验条件下,艾纳香提取物在50μg/ml剂量时,未对mdck细胞活力造成影响,同时对yamagata系b型流感病毒表现出抑制作用,抑制率为91.84%。本实验所采用的yamagata系b型流感病毒对奥司他韦(osv)具有一定耐药性,在相同实验条件下的osv抑制率仅为40.61%。
[0166]
表3.艾纳香提取物对yamagata系b型流感病毒测试对比
[0167]
[0168][0169]
小结:
[0170]
在本实验条件下,艾纳香提取物对奥司他韦耐药的yamagata系b型流感病毒具有抗病毒活性,剂量50μg/ml的艾纳香提取物对病毒的抑制率为91.84%。
[0171]
实施例9
[0172]
本实施例公开了本发明的不同剂量的艾纳香提取物对b型流感病毒yamagata系的抗病毒活性评价。本实施例所述的艾纳香提取物为按实施例1的方法制得。研究测试方法具体为:
[0173]
1.病毒株:
[0174]
流感病毒疫苗株b/darwin/58/2019(yamagata)
[0175]
注:b型流感病毒是根据其抗原特性和ha1区的核苷酸序列分为两大谱系,yamagata系和victoria系。本实验所采用的是b/darwin/58/2019(yamagata)病毒株。
[0176]
2.细胞:mdck细胞(madin-daby canine kidney cells)
[0177]
3.病毒培养与毒力测定
[0178]
将病毒接种于9~11日龄的鸡胚尿囊腔,35℃培育72h,无菌操作收获尿囊液。3000rpm离心15min以除去沉淀,收集上清液。将收集的病毒液做10倍系列稀释为10-1
至10-8
共8个稀释度,加入已贴壁的96孔板mdck细胞中,每个浓度8个孔,每孔细胞大约3
×
104个,同时设空白对照组。各孔中mdck细胞于35℃吸附病毒2h后换用培养液,置于培养箱中继续培养(37℃,5%co2),48h后在显微镜下观察细胞病变效应。根据按reed-muench法计算病毒的半数细胞培养物感染量tcid
50
/ml=10-5.73
。本实验moi=0.001。
[0179]
4.加药处理
[0180]
给药方式如附图1所示:b2-g9区域每一竖排分别加不同的待测样品,b10-g10区域加阳性对照奥司他韦,b11-g11区域加阴性对照dmso;黑线下面的三横排再加入病毒。这样的给药方式既可以检测出样品的抗病毒活性,又可以检测其细胞毒性。
[0181]
5.分组与剂量设计
[0182]
(1)将艾纳香提取物用dmso溶解,并用培养基梯度稀释为50、25、12.5、6.25、3.13、1.56、0.78、0.39μg/ml 8个浓度;
[0183]
(2)阳性对照:奥司他韦(osv),加药剂量设计为100μm/l;
[0184]
(3)阴性对照:1%dmso。
[0185]
6.细胞病变与细胞活力检查
[0186]
流感病毒能引起mdck细胞发生病变,称之为cpe效应,细胞活力显著降低。阴性对照dmso组加入病毒后能看到明显的cpe效应,而化合物如能有效抑制流感病毒的感染,则加入等量病毒后细胞状态依旧良好。
[0187]
实验采用试剂盒检测细胞活力。以空白对照(dmso)组的化学发光值
对应的细胞活力定义为100%,
[0188]
相对细胞活力=各组细胞的检测值/空白对照组细胞的检测值
×
100%
[0189]
7.数据处理
[0190]
抑制率是指化合物起到抑制病毒生长的作用的比率。反映了化合物抗病毒活性。
[0191]
提取物对病毒抑制率=1-(提取物对细胞作用检测值-提取物对病毒作用检测值)/(空白组检测值-病毒对照检测值)
×
100%
[0192]
计算提取物对病毒的抑制率,采用graphpad prism软件分析得出半数抑制浓度(50%inhibiting concentration,ic
50
)。
[0193]
研究测试结果:
[0194]
艾纳香提取物抗b型流感病毒yamagata系活性测试结果如图5所示,以奥司他韦(osv,100μm)作为阳性对照,dmso作为阴性对照。当艾纳香提取物浓度大于25μg/ml时,具有显著抑制病毒感染宿主细胞。
[0195]
通过倍比稀释,获得在此条件下艾纳香提取物抗病毒的半数抑制浓度(ic
50
)为10.14μg/ml(如图6所示)。
[0196]
小结:
[0197]
在本实验条件下,艾纳香提取物抗b型流感病毒yamagata系活性与剂量成正相关,当剂量浓度大于25μg/ml时,具有显著抑制病毒感染宿主细胞的活性,半数抑制浓度(ic
50
)为10.14μg/ml。
[0198]
实施例10
[0199]
本实施例公开了本发明的艾纳香提取物对b型流感病毒victoria系的抗病毒活性评价。本实施例中所述的艾纳香提取物为按实施例3的方法制得。研究测试方法具体为:
[0200]
研究测试方法:
[0201]
1.病毒株:流感病毒减毒活毒株b/四川高新/531/2018(victoria)
[0202]
b型流感病毒是根据其抗原特性和ha1区的核苷酸序列分为两大谱系,yamagata系和victoria系。本实验所采用的b/四川高新/531/2018(victoria)病毒株为b型流感/四川高新实验室分离的/该实验室编号531/2018年的毒株(属于b型流感的victoria毒株)。
[0203]
2.细胞:mdck细胞(madin-daby canine kidney cells)
[0204]
3.病毒培养与毒力测定
[0205]
将病毒接种于9~11日龄的鸡胚尿囊腔,35℃培育72h,无菌操作收获尿囊液。3000rpm离心15min以除去沉淀,收集上清液。将收集的病毒液做10倍系列稀释为10-1
至10-8
共8个稀释度,加入已贴壁的96孔板mdck细胞中,每个浓度8个孔,每孔细胞大约3
×
104个,同时设空白对照组。各孔中mdck细胞于35℃吸附病毒2h后换用培养液,置于培养箱中继续培养(37℃,5%co2),48h后在显微镜下观察细胞病变效应。
[0206]
4.加药处理
[0207]
给药方式如附图1所示:b2-g9区域每一竖排分别加不同的待测样品,b10-g10区域加阳性对照奥司他韦,b11-g11区域加阴性对照dmso;黑线下面的三横排再加入病毒。这样的给药方式既可以检测出样品的抗病毒活性,又可以检测其细胞毒性。
[0208]
5.分组与剂量设计
[0209]
(1)将艾纳香提取物用dmso溶解,并用培养基稀释为50μg/ml;
[0210]
(2)阳性药物对照:奥司他韦(osv),加药剂量设计为100μm/ml;
[0211]
(3)阴性对照:空白dmso。
[0212]
6.细胞病变与细胞活力检查
[0213]
流感病毒能引起mdck细胞发生病变,称之为cpe效应,细胞活力显著降低。阴性对照dmso组加入病毒后能看到明显的cpe效应,而化合物如能有效抑制流感病毒的感染,因此加入等量病毒后细胞状态依旧良好。
[0214]
实验采用试剂盒检测细胞活力。以空白对照(dmso)组的化学发光值对应的细胞活力定义为100%,
[0215]
相对细胞活力=各组细胞的检测值/空白对照组细胞的检测值
×
100%
[0216]
7.数据处理
[0217]
抑制率是指化合物起到抑制病毒生长的作用的比率。反映了化合物抗病毒活性。
[0218]
提取物对病毒抑制率=1-(提取物对细胞作用检测值-提取物对病毒作用检测值)/(空白组检测值-病毒对照检测值)
×
100%
[0219]
研究测试结果:
[0220]
艾纳香提取物对mdck细胞活性的影响和抗victoria系b型流感病毒的活性测试结果如表4和图7所示。在本实验条件下,艾纳香提取物在50μg/ml剂量时,未对mdck细胞活力造成影响,同时对victoria系b型流感病毒表现出抑制作用,抑制率为88.16%。本实验所采用的victoria系b型流感病毒对奥司他韦(osv)耐药性,在相同实验条件下的osv并未表现出抗病毒效果。
[0221]
表4.艾纳香提取物对victoria系b型流感病毒测试对比
[0222][0223]
小结:
[0224]
在本实验条件下,艾纳香提取物对奥司他韦耐药的victoria系b型流感病毒具有抗病毒活性,剂量50μg/ml的艾纳香提取物对病毒的抑制率为88.16%。
[0225]
实施例11
[0226]
本实施例公开了本发明的不同剂量的艾纳香提取物对b型流感病毒victoria系的抗病毒活性评价。本实施例所述的艾纳香提取物为采用实施例1的方法制得。研究测试方法具体为:
[0227]
1.病毒株:流感病毒疫苗株b/四川高新/531/2018(victoria)
[0228]
b型流感病毒是根据其抗原特性和ha1区的核苷酸序列分为两大谱系,yamagata系和victoria系。本实验所采用的是b/四川高新/531/2018(victoria)病毒株。
[0229]
2.细胞:mdck细胞(madin-daby canine kidney cells)
[0230]
3.病毒培养与毒力测定
[0231]
将病毒接种于9~11日龄的鸡胚尿囊腔,35℃培育72h,无菌操作收获尿囊液。3000rpm离心15min以除去沉淀,收集上清液。将收集的病毒液做10倍系列稀释为10-1
至10-8
共8个稀释度,加入已贴壁的96孔板mdck细胞中,每个浓度8个孔,每孔细胞大约3
×
104个,同时设空白对照组。各孔中mdck细胞于35℃吸附病毒2h后换用培养液,置于培养箱中继续培养(37℃,5%co2),48h后在显微镜下观察细胞病变效应。根据按reed-muench法计算病毒的半数细胞培养物感染量tcid
50
/ml=10-4.37
。本实验moi=0.0005。
[0232]
4.加药处理
[0233]
给药方式如附图1所示:b2-g9区域每一竖排分别加不同的待测样品,b10-g10区域加阳性对照奥司他韦,b11-g11区域加阴性对照dmso;黑线下面的三横排再加入病毒。这样的给药方式既可以检测出样品的抗病毒活性,又可以检测其细胞毒性。
[0234]
5.分组与剂量设计
[0235]
(1)将艾纳香提取物用dmso溶解,并用培养基梯度稀释为50、25、12.5、6.25、3.13、1.56、0.78、0.39μg/ml等8个浓度;
[0236]
(2)阳性对照:奥司他韦(osv),加药剂量设计为100μm/l;
[0237]
(3)阴性对照:1%dmso。
[0238]
6.细胞病变与细胞活力检测
[0239]
流感病毒能引起mdck细胞发生病变,称之为cpe效应,细胞活力显著降低。阴性对照dmso组加入病毒后能看到明显的cpe效应,而化合物如能有效抑制流感病毒的感染,则加入等量病毒后细胞状态依旧良好。
[0240]
实验采用试剂盒检测细胞活力。以空白对照(dmso)组的化学发光值对应的细胞活力定义为100%,
[0241]
相对细胞活力=各组细胞的检测值/空白对照组细胞的检测值
×
100%
[0242]
7.数据处理
[0243]
抑制率是指化合物起到抑制病毒生长的作用的比率。反映了化合物抗病毒活性。
[0244]
提取物对病毒抑制率=1-(提取物对细胞作用检测值-提取物对病毒作用检测值)/(空白组检测值-病毒对照检测值)
×
100%
[0245]
计算提取物对病毒的抑制率,采用graphpad prism软件分析得出半数抑制浓度(50%inhibiting concentration,ic
50
)。
[0246]
研究测试结果:
[0247]
艾纳香提取物抗victoria系b型病毒活性测试结果如图8所示,以奥司他韦(osv,100μm)作为阳性对照,dmso作为阴性对照。当艾纳香提取物浓度大于25μg/ml时,具有显著抑制victoria系b型病毒感染宿主细胞的活性。
[0248]
通过倍比稀释,获得在此条件下艾纳香提取物抗victoria系b型病毒的半数抑制浓度(ic
50
)为3.17μg/ml(如图9所示)。
[0249]
小结:
[0250]
在本实验条件下,艾纳香提取物抗b型流感病毒victoria系活性与剂量成正相关,当剂量浓度大于25μg/ml时,具有显著抑制病毒感染宿主细胞的活性,半数抑制浓度(ic
50
)为3.17μg/ml。
[0251]
实施例12
[0252]
本实施例公开了本发明的不同剂量艾纳香提取物样品对a型流感病毒h3n2的抗病毒活性评价。本实施例中所述的艾纳香提取物为按实施例1的方法制得。研究测试方法具体为:
[0253]
1.病毒株:
[0254]
流感病毒疫苗株a/hong kong/4801/2014(h3n2)
[0255]
2.细胞:mdck细胞(madin-daby canine kidney cells)
[0256]
3.病毒培养与毒力测定
[0257]
将病毒接种于9~11日龄的鸡胚尿囊腔,35℃培育72h,无菌操作收获尿囊液。3000rpm离心15min以除去沉淀,收集上清液。将收集的病毒液做10倍系列稀释为10-1
至10-8
共8个稀释度,加入已贴壁的96孔板mdck细胞中,每个浓度8个孔,每孔细胞大约3
×
104个,同时设空白对照组。各孔中mdck细胞于35℃吸附病毒2h后换用培养液,置于培养箱中继续培养(37℃,5%co2),48h后在显微镜下观察细胞病变效应。
[0258]
4.加药处理
[0259]
给药方式如附图1所示:b2-g9区域每一竖排分别加不同的待测样品,b10-g10区域加阳性对照奥司他韦,b11-g11区域加阴性对照dmso;黑线下面的三横排再加入病毒。这样的给药方式既可以检测出样品的抗病毒活性,又可以检测其细胞毒性。
[0260]
5.分组与剂量设计
[0261]
(1)将艾纳香提取物用dmso溶解,并用培养基梯度稀释为50、25、12.5、6.25、3.13、1.56、0.78、0.39μg/ml等8个浓度;
[0262]
(2)阳性对照:奥司他韦(osv),加药剂量设计为100μm/l;
[0263]
(3)阴性对照:1%dmso。
[0264]
6.细胞病变与细胞活力检测
[0265]
流感病毒能引起mdck细胞发生病变,称之为cpe效应,细胞活力显著降低。阴性对照dmso组加入病毒后能看到明显的cpe效应,而化合物如能有效抑制流感病毒的感染,则加入等量病毒后细胞状态依旧良好。
[0266]
实验采用试剂盒检测细胞活力。以空白对照(dmso)组的化学发光值对应的细胞活力定义为100%,
[0267]
相对细胞活力=各组细胞的检测值/空白对照组细胞的检测值
×
100%
[0268]
7.数据处理
[0269]
抑制率是指化合物起到抑制病毒生长的作用的比率。反映了化合物抗病毒活性。
[0270]
提取物对病毒抑制率=1-(提取物对细胞作用检测值-提取物对病毒作用检测值)/(空白组检测值-病毒对照检测值)
×
100%
[0271]
计算提取物对病毒的抑制率,采用graphpad prism软件分析得出半数抑制浓度(50%inhibiting concentration,ic
50
)。
[0272]
研究测试结果:
[0273]
艾纳香提取物抗a型流感病毒h3n2活性测试结果如图10所示,以奥司他韦(osv,100μm)作为阳性对照,dmso作为阴性对照。当艾纳香提取物浓度大于6.25μg/ml时,具有显著抑制a型流感病毒h3n2感染宿主细胞的活性。艾纳香提取物剂量浓度为6.25μg/ml、12.5μg/ml、25μg/ml和50μg/ml时,对a型流感病毒a/hong kong/4801/2014(h3n2)毒株的抑制率
分别为60.48%、29.36%、106.28%和113.03%,本实验所采用的a/hong kong/4801/2014(h3n2)毒株对奥司他韦(osv)具有一定耐药性,在相同实验条件下100μm的osv抑制率仅为50.97%。
[0274]
通过倍比稀释,获得在此条件下艾纳香提取物抗a型流感病毒h3n2的半数抑制浓度(ic
50
)为11.38μg/ml,如附图11所示。
[0275]
小结:
[0276]
在本实验条件下,艾纳香提取物对奥司他韦耐药的a型流感病毒a/hong kong/4801/2014(h3n2)具有抗毒活性,其活性与剂量成正相关,当剂量浓度大于6.25μg/ml时,具有显著抑制病毒感染宿主细胞的活性,半数抑制浓度(ic
50
)为11.38μg/ml。
[0277]
实施例13
[0278]
本实施例公开了不同剂量艾纳香提取物对奥司他韦耐药的b型流感病毒yamagata系的抗病毒活性评价。本实施例中所述的艾纳香提取物为按实施例1的方法制得。研究测试方法具体为:
[0279]
1.病毒株:
[0280]
流感病毒疫苗株b/phuket/3073/2013(b/yamagata lineage)
[0281]
2.细胞:mdck细胞(madin-daby canine kidney cells)
[0282]
3.病毒培养与毒力测定
[0283]
将病毒接种于9~11日龄的鸡胚尿囊腔,35℃培育72h,无菌操作收获尿囊液。3000rpm离心15min以除去沉淀,收集上清液。将收集的病毒液做10倍系列稀释为10-1
至10-8
共8个稀释度,加入已贴壁的96孔板mdck细胞中,每个浓度8个孔,每孔细胞大约3
×
104个,同时设空白对照组。各孔中mdck细胞于35℃吸附病毒2h后换用培养液,置于培养箱中继续培养(37℃,5%co2),48h后在显微镜下观察细胞病变效应。
[0284]
4.加药处理
[0285]
给药方式如附图1所示:b2-g9区域每一竖排分别加不同的待测样品,b10-g10区域加阳性对照奥司他韦,b11-g11区域加阴性对照dmso;黑线下面的三横排再加入病毒。这样的给药方式既可以检测出样品的抗病毒活性,又可以检测其细胞毒性。
[0286]
5.分组与剂量设计
[0287]
(1)将艾纳香提取物用dmso溶解,并用培养基梯度稀释为50、25、12.5、6.25、3.13、1.56、0.78、0.39μg/ml等8个浓度;
[0288]
(2)阳性对照:奥司他韦(osv),加药剂量设计为100μm/l;
[0289]
(3)阴性对照:1%dmso。
[0290]
6.细胞病变与细胞活力检查
[0291]
流感病毒能引起mdck细胞发生病变,称之为cpe效应,细胞活力显著降低。阴性对照dmso组加入病毒后能看到明显的cpe效应,而化合物如能有效抑制流感病毒的感染,则加入等量病毒后细胞状态依旧良好。
[0292]
实验采用试剂盒检测细胞活力。以空白对照(dmso)组的化学发光值对应的细胞活力定义为100%,
[0293]
相对细胞活力=各组细胞的检测值/空白对照组细胞的检测值
×
100%
[0294]
7.数据处理
[0295]
抑制率是指化合物起到抑制病毒生长的作用的比率。反映了化合物抗病毒活性。
[0296]
提取物对病毒抑制率=1-(提取物对细胞作用检测值-提取物对病毒作用检测值)/(空白组检测值-病毒对照检测值)
×
100%
[0297]
计算提取物对病毒的抑制率,采用graphpad prism软件分析得出半数抑制浓度(50%inhibiting concentration,ic
50
)。
[0298]
研究测试结果:
[0299]
艾纳香提取物抗奥司他韦耐药的b型流感病毒yamagata系活性测试结果如图12所示,以奥司他韦(osv,100μm)作为阳性对照,dmso作为阴性对照。当艾纳香提取物浓度大于12.5μg/ml时,具有显著抑制病毒感染宿主细胞的活性。艾纳香提取物剂量浓度为12.5μg/ml、25μg/ml和50μg/ml时,对b型流感病毒b/phuket/3073/2013(b/yamagata lineage)毒株的抑制率分别为71.17%、75.57%和97.94%,本实验所采用的b/phuket/3073/2013(b/yamagata lineage)毒株对奥司他韦(osv)具有一定耐药性,在相同实验条件下100μm的osv抑制率仅为62.64%。
[0300]
通过倍比稀释,获得在此条件下艾纳香提取物抗病毒的半数抑制浓度(ic
50
)为4.66μg/ml,如附图13所示。
[0301]
小结:
[0302]
在本实验条件下,艾纳香提取物对奥司他韦耐药的yamagata系b型流感病毒b/phuket/3073/2013(b/yamagata lineage)具有抗毒活性具有抗毒活性,其活性与剂量成正相关,当剂量浓度大于12.5μg/ml时,具有显著抑制病毒感染宿主细胞的活性,半数抑制浓度(ic
50
)为4.66μg/ml。
[0303]
实施例14
[0304]
本实施例公开了不同剂量艾纳香提取物对brisbane实验分离的b型流感病毒victoria系的抗病毒实验,具体的研究测试方法如下:
[0305]
1.病毒株:
[0306]
流感病毒疫苗株b/brisbane/60/2008/nymc bx-35(b/victoria lineage)
[0307]
2.细胞:mdck细胞(madin-daby canine kidney cells)
[0308]
3.病毒培养与毒力测定
[0309]
将病毒接种于9~11日龄的鸡胚尿囊腔,35℃培育72h,无菌操作收获尿囊液。3000rpm离心15min以除去沉淀,收集上清液。将收集的病毒液做10倍系列稀释为10-1
至10-8
共8个稀释度,加入已贴壁的96孔板mdck细胞中,每个浓度8个孔,每孔细胞大约3
×
104个,同时设空白对照组。各孔中mdck细胞于35℃吸附病毒2h后换用培养液,置于培养箱中继续培养(37℃,5%co2),48h后在显微镜下观察细胞病变效应。
[0310]
4.加药处理
[0311]
给药方式如附图1所示:b2-g9区域每一竖排分别加不同的待测样品,b10-g10区域加阳性对照奥司他韦,b11-g11区域加阴性对照dmso;黑线下面的三横排再加入病毒。这样的给药方式既可以检测出样品的抗病毒活性,又可以检测其细胞毒性。
[0312]
5.分组与剂量设计
[0313]
(1)将艾纳香提取物用dmso溶解,并用培养基梯度稀释为50、25、12.5、6.25、3.13、1.56、0.78、0.39μg/ml等8个浓度;
[0314]
(2)阳性对照:奥司他韦(osv),加药剂量设计为100μm/l;
[0315]
(3)阴性对照:1%dmso。
[0316]
6.细胞病变与细胞活力检测
[0317]
流感病毒能引起mdck细胞发生病变,称之为cpe效应,细胞活力显著降低。阴性对照dmso组加入病毒后能看到明显的cpe效应,而化合物如能有效抑制流感病毒的感染,则加入等量病毒后细胞状态依旧良好。
[0318]
实验采用试剂盒检测细胞活力。以空白对照(dmso)组的化学发光值对应的细胞活力定义为100%,
[0319]
相对细胞活力=各组细胞的检测值/空白对照组细胞的检测值
×
100%
[0320]
7.数据处理
[0321]
抑制率是指化合物起到抑制病毒生长的作用的比率。反映了化合物抗病毒活性。
[0322]
提取物对病毒抑制率=1-(提取物对细胞作用检测值-提取物对病毒作用检测值)/(空白组检测值-病毒对照检测值)
×
100%
[0323]
计算提取物对病毒的抑制率,采用graphpad prism软件分析得出半数抑制浓度(50%inhibiting concentration,ic
50
)。
[0324]
研究测试结果:
[0325]
艾纳香提取物抗奥司他韦耐药的b型病毒victoria系活性测试结果如图14所示,以奥司他韦(osv,100μm)作为阳性对照,dmso作为阴性对照。当艾纳香提取物浓度大于3.125μg/ml时,具有显著抑制奥司他韦耐药的victoria系b型病毒感染宿主细胞的活性。艾纳香提取物剂量浓度为3.125μg/ml、6.25μg/ml、12.5μg/ml、25μg/ml和50μg/ml时,对b型流感病毒b/brisbane/60/2008/nymc bx-35(b/victoria lineage)毒株的抑制率分别为44.83%、68.50%、77.22%、121.86%和114.02%,本实验所采用的b/brisbane/60/2008/nymc bx-35(b/victoria lineage)毒株对奥司他韦(osv)具有一定耐药性,在相同实验条件下100μm的osv抑制率仅为11.78%。
[0326]
通过倍比稀释,获得在此条件下艾纳香提取物抗奥司他韦耐药的victoria系b型病毒的半数抑制浓度(ic
50
)为4.29μg/ml(如图15所示)。
[0327]
小结:
[0328]
在本实验条件下,艾纳香提取物对奥司他韦耐药的yamagata系b型流感病毒b/brisbane/60/2008/nymc bx-35(b/victoria lineage)具有抗毒活性具有抗毒活性,其活性与剂量成正相关,当剂量浓度大于3.125μg/ml时,具有显著抑制病毒感染宿主细胞的活性,半数抑制浓度(ic
50
)为4.29μg/ml。
[0329]
最后应说明的是:以上各实施例仅仅为本发明的较优实施例用以说明本发明的技术方案,而非对其限制,当然更不是限制本发明的专利范围;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围;也就是说,但凡在本发明的主体设计思想和精神上作出的毫无实质意义的改动或润色,其所解决的技术问题仍然与本发明一致的,均应当包含在本发明的保护范围之内;另外,将本发明的技术方案直接或间接的运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1