一种蝶酰谷氨酸片剂及其制备方法与流程
1.本发明涉及药物领域,具体涉及一种蝶酰谷氨酸片剂及其制备方法。
背景技术:
2.叶酸,化学名为“蝶酰谷氨酸”,系由喋啶酸、对氨基苯甲酸与谷氨酸结合而成,是一种重要的b族水溶性维生素。叶酸的重要生理功能是促进骨髓中幼细胞成熟,为机体细胞生长和繁殖的必须物质。一般正常人叶酸的需要量为200~400μg/d。世界卫生组织建议成人至少为200μg/d,孕妇和乳母为400μg/d。
3.叶酸属于b族维生素,临床应用历史已久,是机体细胞生长和分裂所必须的物质,缺乏时,可致巨幼红细胞性贫血。叶酸缺乏的主要原因是:1)需要量增加,如妊娠、婴儿期及溶血性贫血;2)营养不良、偏食、饮酒;3)应用叶酸对抗药甲氨喋呤、甲氧苄氨嘧啶等;4)吸收不良、胃和小肠切除、胃肠功能紊乱等。众所周知,人体自身是无法合成叶酸的,因此,外源性补充叶酸成为临床上预防和治疗叶酸缺乏的唯一手段。
4.由于人体内的叶酸几乎完全依赖于食物摄入,因此,当叶酸摄入量不足或者利用率降低时,人体内便会出现叶酸缺乏的状况,导致红血球的异常未成熟细胞的增加和贫血,以及白血球减少,引发婴儿的核巨红细胞性贫血、孕妇的巨红细胞性贫血、新生儿的神经系统异常和老年期痴呆症等疾病。因此,叶酸具有十分重要的药用价值和开发前景。但是目前的市场上叶酸进入肠胃不易吸收,生物利用率低,有待解决。
技术实现要素:
5.本发明技术方案用以解决现有技术中的以下技术问题:现有技术中,叶酸进入肠胃不易吸收,生物利用度低。
6.为了解决以上技术问题,本发明通过以下技术方案来实现的:
7.一种蝶酰谷氨酸片剂,包括以下重量份的组分:
8.叶酸0.4份、二水磷酸氢钙30~80份、微晶纤维素10-60份、崩解剂5-20份、润滑剂1-4份。
9.优选地,一种蝶酰谷氨酸片剂,包括以下重量份的组分:
10.叶酸0.4份、二水磷酸氢钙30~80份、微晶纤维素10-60份、崩解剂5-20份、二氧化硅0.5~2份、硬脂酸镁0.5~2份。
11.优选地,所述崩解剂为预胶化淀粉。
12.优选地,所述叶酸、二水磷酸氢钙、微晶纤维素和崩解剂的粒度均小于250微米。
13.优选地,所述二氧化硅和硬脂酸镁的粒度均小于180微米。
14.本发明还公开了一种蝶酰谷氨酸片剂的制备方法,具体地,包括以下步骤:
15.(1)将二氧化硅、硬脂酸镁、叶酸、二水磷酸氢钙、微晶纤维素、预胶化淀粉分别进行粉碎过筛,备用;
16.(2)预混:称取处方量的叶酸、微晶纤维素、预胶化淀粉和二氧化硅,加入混合机中
进行混合,混合时间10-30分钟;
17.(3)混合:称取处方量的二水磷酸氢钙和混合机中,混合时间为10-30分钟;
18.(4)总混:将处方量的硬脂酸镁加入混合机中,混合时间10~30分钟,得总混物料;
19.(5)压片:总混物料直接压片,即得所述蝶酰谷氨酸片剂。
20.进一步地,所述步骤(4)还包括以下步骤:将总混物料测定休止角。
21.所述休止角为41
°
。
22.所述混合机为三维运动混合机。
23.所述蝶酰谷氨酸片剂片重为0.1g。
24.本发明具有如下的有益效果:
25.(1)从本发明产品质量检测数据可以看出,片剂溶出度均达到99%以上,由此可以看出通过本发明各组分之间的协同配合,以及制备工艺的优化,最终制得的产品溶出性良好,生物利用度高。
26.(2)本发明叶酸原料不含任何高糖量组分,配方合理,降低孕妇服用叶酸后高血糖的风险,有益身体健康。
27.(3)本发明提供一种制备工艺简单,生产成本低,适合工业化生产的叶酸片制备方法。
具体实施方式
28.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
29.下面为具体实施例:
30.实施例1
31.本实施例中提供一种蝶酰谷氨酸片剂:
32.1、处方组成:
33.组分名称重量份叶酸0.4份二水磷酸氢钙40份微晶纤维素47份预胶化淀粉10份二氧化硅2份硬脂酸镁0.6份制成1000片
34.2、工艺步骤:
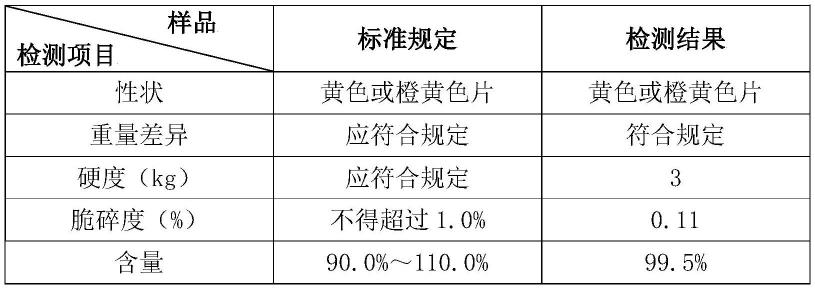
35.(1)原辅料粒度要求:二氧化硅、硬脂酸镁粒度优选小于180微米;叶酸、二水磷酸氢钙、微晶纤维素、预胶化淀粉粒度优选小于250微米。
36.(2)预混:称取处方量的叶酸、微晶纤维素、预胶化淀粉和二氧化硅,加入三维运动混合机中,混合时间10分钟。
37.(3)混合:称取处方量的二水磷酸氢钙加入三维运动混合机中,混合时间30分钟。
38.(4)总混:将处方量的硬脂酸镁加入三维运动混合机中,混合时间30分钟,得总混物料。总混物料测定休止角,休止角(θ)为41
°
。
39.(5)压片:总混物料直接压片,每片片重0.1g。
40.3、质量检测
41.参照叶酸片国家药品标准和2020版药典部附录相关规定检测制得的成品的质量。
[0042][0043][0044]
实施例2
[0045]
本实施例中提供一种蝶酰谷氨酸片剂:
[0046]
1、处方组成:
[0047]
组分名称重量份叶酸0.4份二水磷酸氢钙70份微晶纤维素17份预胶化淀粉10份二氧化硅2份硬脂酸镁0.6份制成1000片
[0048]
2、工艺步骤:
[0049]
(1)原辅料粒度要求:二氧化硅、硬脂酸镁粒度优选小于180微米;叶酸、二水磷酸氢钙、微晶纤维素、预胶化淀粉粒度优选小于250微米。
[0050]
(2)预混:称取处方量的叶酸、微晶纤维素、预胶化淀粉和二氧化硅,加入三维运动混合机中,混合时间10分钟。
[0051]
(3)混合:称取处方量的二水磷酸氢钙加入三维运动混合机中,混合时间30分钟。
[0052]
(4)总混:将处方量的硬脂酸镁加入三维运动混合机中,混合时间30分钟,得总混物料。总混物料测定休止角,休止角(θ)为41
°
。
[0053]
(5)压片:总混物料直接压片,每片片重0.1g。
[0054]
3、质量检测
[0055]
参照叶酸片国家药品标准和2020版药典部附录相关规定检测制得的成品的质量。
[0056][0057][0058]
实施例3
[0059]
本实施例中提供一种蝶酰谷氨酸片剂:
[0060]
1、处方组成:
[0061]
组分名称重量份叶酸0.4份二水磷酸氢钙80份微晶纤维素10份预胶化淀粉20份二氧化硅2份硬脂酸镁2份制成1000片
[0062]
2、工艺步骤:
[0063]
(1)原辅料粒度要求:二氧化硅、硬脂酸镁粒度优选小于180微米;叶酸、二水磷酸氢钙、微晶纤维素、预胶化淀粉粒度优选小于250微米。
[0064]
(2)预混:称取处方量的叶酸、微晶纤维素、预胶化淀粉和二氧化硅,加入三维运动混合机中,混合时间30分钟。
[0065]
(3)混合:称取处方量的二水磷酸氢钙加入三维运动混合机中,混合时间10分钟。
[0066]
(4)总混:将处方量的硬脂酸镁加入三维运动混合机中,混合时间10分钟,得总混物料。总混物料测定休止角,休止角(θ)为41
°
。
[0067]
(5)压片:总混物料直接压片,每片片重0.1g。
[0068]
3、质量检测
[0069]
参照叶酸片国家药品标准和2020版药典部附录相关规定检测制得的成品的质量。
[0070][0071][0072]
实施例4
[0073]
本实施例中提供一种蝶酰谷氨酸片剂:
[0074]
1、处方组成:
[0075]
组分名称重量份叶酸0.4份二水磷酸氢钙30份微晶纤维素60份预胶化淀粉5份二氧化硅0.5份硬脂酸镁0.5份制成1000片
[0076]
2、工艺步骤:
[0077]
(1)原辅料粒度要求:二氧化硅、硬脂酸镁粒度优选小于180微米;叶酸、二水磷酸氢钙、微晶纤维素、预胶化淀粉粒度优选小于250微米。
[0078]
(2)预混:称取处方量的叶酸、微晶纤维素、预胶化淀粉和二氧化硅,加入三维运动混合机中,混合时间18分钟。
[0079]
(3)混合:称取处方量的二水磷酸氢钙加入三维运动混合机中,混合时间25分钟。
[0080]
(4)总混:将处方量的硬脂酸镁加入三维运动混合机中,混合时间20分钟,得总混物料。总混物料测定休止角,休止角(θ)为41
°
。
[0081]
(5)压片:总混物料直接压片,每片片重0.1g。
[0082]
3、质量检测
[0083]
参照叶酸片国家药品标准和2020版药典部附录相关规定检测制得的成品的质量。
[0084][0085][0086]
由上述各实施例的质量检测数据可知,本发明制得蝶酰谷氨酸片剂性能优异,均符合药典要求,且最终制得产品的溶出度均达到99%以上,具有良好的溶出性生物利用度高。
[0087]
以上公开的本发明优选实施例只是用于帮助阐述本发明。优选实施例并没有详尽叙述所有的细节,也不限制该发明仅为的具体实施方式。显然,根据本说明书的内容,可作很多的修改和变化。本说明书选取并具体描述这些实施例,是为了更好地解释本发明的原理和实际应用,从而使所属技术领域技术人员能很好地理解和利用本发明。本发明仅受权利要求书及其全部范围和等效物的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1