桑黄用于制备改善肌少症的组合物的用途的制作方法
1.本发明是有关于一种桑黄的用途,特别是关于一种桑黄用于制备改善肌少症的组合物的用途。
背景技术:
2.肌少症是迈入老年后常见的疾病之一。肌少症的特征包含全身性骨骼肌重量及功能的持续地减少,如果肌少症持续恶化,不仅造成患者的活动力及生活品质下降,还可能提升其他疾病、失能、跌倒的发生率,甚至导致死亡。
3.肌少症的成因包含运动神经退化、营养素不均衡、蛋白质合成减少、慢性病及/或发炎反应等。目前肌少症无法通过药物控制,因此需靠运动、控制慢性疾病、发炎症状及补充特定营养素来延缓或改善肌少症。
4.桑黄(phellinus linteus),又称桑耳、桑臣,是绣革菌科桑黄属的药用真菌。桑黄生长于树干上,特别是桑属植物的树干上。桑黄的毒性低但具有许多功效,举例而言,抗氧化、抗发炎、提升免疫力、抗癌、护肝、抗失智症、心血管疾病预防、抗过敏(过敏性鼻炎、湿疹、类风湿性关节炎)、舒眠、镇痛(如经痛)、抑制尿酸及皮肤保养等。然而,目前少有针对桑黄改善肌少症的功效的研究。
技术实现要素:
5.因此,本发明的一实施方式是提供一种桑黄(phellinus linteus)用于制备改善肌少症的组合物的用途,以维持肌管直径、肌肉量及肌耐力。
6.根据本发明的上述的实施方式,提供一种桑黄用于制备改善肌少症的组合物的用途,其中桑黄是于2020年11月12日保藏于日本独立行政法人制品评价技术基盘机构(national institute of technology and evaluation,nite)特许生物保藏中心(international patent organism depositary,ipod),保藏编号为nite bp-03321。上述组合物包含桑黄的发酵萃取物及/或其衍生物做为有效成分。
7.依据本发明上述的实施例,上述发酵萃取物可例如通过对桑黄的第一菌丝体进行多阶段培养步骤及萃取步骤获得。首先,于15℃至30℃利用固态培养基对第一菌丝体进行固态培养步骤达1周至2周,以获得第二菌丝体。接着,于15℃至30℃利用第一培养液对第二菌丝体进行液态培养步骤达3天至14天,以获得第三菌丝体,其中第一培养液的酸碱值为ph 2至ph 6。接下来,于15℃至30℃利用第二培养液对第三菌丝体进行发酵培养步骤达3天至21天,以获得发酵物,其中第二培养液的酸碱值为ph 2至ph 6。
8.依据本发明上述的实施例,发酵萃取物包含发酵水萃物及/或发酵酒萃物,且衍生物可例如选自于由发酵水萃干燥物、发酵水萃浓缩物、发酵酒萃干燥物、发酵酒萃浓缩物及上述任意组合所组成的一族群。
9.依据本发明上述的实施例,发酵水萃物是通过水萃取步骤获得,且水萃取步骤包含于100℃以水对发酵物进行热水萃取处理。
10.依据本发明上述的实施例,发酵酒萃物是通过乙醇萃取步骤获得,且乙醇萃取步骤可包含以乙醇对发酵物进行超音波震荡处理。
11.依据本发明上述的实施例,发酵水萃物对动物肌肉细胞的有效剂量可例如为5μg/ml至15μg/ml。
12.依据本发明上述的实施例,发酵酒萃物对动物肌肉细胞的有效剂量可例如为0.5μg/ml至1.5μg/ml。
13.依据本发明上述的实施例,当组合物投予小鼠时,有效成分的有效剂量可例如为400mg/kg.体重(body weight,bw)/天至600mg/kg.bw/天。
14.依据本发明上述的实施例,当组合物投予人体时,有效成分的有效剂量可例如为2300mg/60kg.bw/天至2500mg/60kg.bw/天。
15.依据本发明上述的实施例,组合物可例如医药组合物或食品组合物,且组合物可包含但不限于食品或医疗上可接受的载体、赋形剂、稀释剂、辅助剂、防腐剂、填充剂及/或添加剂。
16.应用本发明的桑黄用于制备改善肌少症的组合物,此组合物含有桑黄的发酵萃取物及/或其衍生物做为有效成分,藉此投予受试对象,可维持肌管直径、肌肉量及肌耐力。
附图说明
17.为让本发明的上述和其他目的、特征、优点与实施例能更明显易懂,所附图式的详细说明如下:
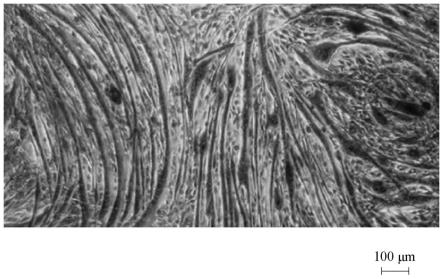
18.图1a至图1f是根据本发明的一实施例中以含或不含发酵萃取物及地塞米松的培养基培养小鼠骨骼肌细胞的组织染色显微照片。
具体实施方式
19.承上所述,本发明提供一种桑黄(phellinus linteus)用于制备改善肌少症的组合物的用途,其中组合物包含桑黄的发酵萃取物及/或其衍生物做为有效成分,以改善肌少症。
20.上述桑黄可例如于2020年11月12日保藏于日本独立行政法人制品评价技术基盘机构(national institute of technology and evaluation,nite)特许生物保藏中心(international patent organism depositary,ipod),保藏编号为nite bp-03321,其中桑黄是以菌丝体的形式保藏。
21.上述桑黄菌丝体经多阶段培养步骤后,可获得桑黄的发酵物。由于桑黄在不同生长或分化阶段需要不同的培养条件(包含:营养成分及环境因子),因此透过多阶段培养步骤,可调控桑黄在每个生长阶段的培养条件,以获得较多的生物量及/或特定有效成分。
22.在一实施例中,多阶段培养步骤可包含固态培养步骤、液态培养步骤及发酵培养步骤。详细而言,固态培养步骤可例如利用固态培养基培养桑黄的上述菌丝体(或称第一菌丝体),以获得第二菌丝体。上述固态培养基可包含碳源、氮源及其他桑黄生长所需的营养物质。在一实施例中,固态培养基可例如为马铃薯糊精培养基(potato dextrose agar,pda)。在一实施例中,固态培养步骤可例如在15℃至30℃培养1周至2周。
23.上述液态培养步骤可例如利用第一培养液对第二菌丝体进行液态培养步骤,以获
得第三菌丝体,其中第一培养液的酸碱值可例如ph 2至ph 6,且第一培养液可包含1重量%至3重量%的综合性碳氮源(例如谷类及/或豆类)、1重量%至4重量%的醣类(例如单醣及/或双醣)、0.1重量%至1重量%的酵母萃取物、0.1重量%至1重量%的蛋白胨及0.01重量%至0.05重量%的无机盐类(例如磷酸盐及/或硫酸盐)。应理解的是,前述第一培养液的成分可视使用需求做适当的调整。在一实施例中,第一培养液可例于15℃至30℃以110rpm至130rpm的转速培养3天至14天。
24.上述发酵培养步骤可例如于15℃至30℃下利用第二培养液对第三菌丝体进行发酵培养步骤达3天至21天,以获得发酵物,其中第二培养液的成分可例如相同于第一培养基,或视使用需求适当调整其成分,且第二培养液的ph值可例如为2至6。
25.上述发酵培养步骤是于发酵槽中进行。在一实施例中,在进行发酵培养步骤时,对发酵槽导入气体,其中气体可例如选自于由空气、氧气、二氧化碳、氦气及上述任意组合所组成的一族群。在一实施例中,槽压可例如0.5kg/cm2至1.0kg/cm2。在一实施例中,通气速率可例如0.01(通入气体体积/发酵液体积/分钟,vvm)至1.5vvm。在其他实施例中,发酵培养步骤的转速为50rpm至150rpm。
26.接着,对上述发酵物进行萃取步骤,以获得发酵萃取物。萃取步骤可利用现有萃取方法进行。在一实施例中,利用极性溶剂对发酵物进行溶剂萃取步骤,其中极性溶剂包含水及/或低级醇(例如:甲醇、乙醇、丙醇、异丙醇等)。值得注意的是,考量后续应用的需求,分别利用水或乙醇进行水萃取步骤或乙醇萃取步骤,以获得发酵水萃物或发酵酒萃物为较佳。
27.在一实施例中,上述水萃取步骤可选择性以沸水(如:90℃至100℃下)进行热水萃取处理。在另一实施例中,上述乙醇萃取步骤可选择性合并超音波震荡处理,以于室温(例如10℃至40℃)利用例如500w至700w、30khz至50khz的超音波进行。上述萃取步骤的时间不限。在一实施例中,热水萃取处理是进行20分钟至40分钟。在另一实施例中,上述乙醇萃取步骤合并超音波震荡处理是进行40分钟至80分钟,以获得较多的有效成分。
28.在上述实施例中,极性溶剂与发酵物重量二者的比值并无特别限制,可例如为10倍至30倍,但不限于此处所举。
29.在一实施例中,在多阶段培养步骤及萃取步骤间,可包含但不限于进行再加工处理,其中再加工处理可包含干燥步骤及/或浓缩步骤,以利后续萃取步骤的进行。
30.上述干燥步骤可以现有的干燥方法进行,例如:冷冻干燥法、真空干燥法或喷雾干燥法。在一实施例中,对发酵物进行干燥步骤,以获得发酵干燥物。
31.上述浓缩步骤可利用现有的浓缩方法进行,例如减压浓缩、蒸发浓缩法或膜浓缩法。
32.在一实施例中,在萃取步骤之后,亦可包含但不限于进行上述再加工处理,以获得发酵萃取物的衍生物。所述衍生物可选自于由发酵水萃干燥物、发酵水萃浓缩物、发酵酒萃干燥物、发酵酒萃浓缩物及上述任意组合所组成的族群。
33.上述发酵萃取物及/或其衍生物经证实可用于制备改善肌少症的组合物的用途。所述“改善肌少症”是指将上述组合物施予受试对象后,可延缓肌肉量及肌耐力的流失,其具体评估的指标包含可有效维持肌管直径、肌肉量及肌耐力。
34.经动物细胞实验证实,发酵水萃物及/或发酵酒萃物具有维持肌管直径的功效。在
此实施例中,发酵水萃物对动物肌肉细胞的有效剂量可例如为5μg/ml至15μg/ml,且发酵酒萃物对动物肌肉细胞的有效剂量可例如为0.5μg/ml至1.5μg/ml。上述剂量范围足以使发酵水萃物及/或发酵酒萃物具有延缓肌少症的效果,而不对肌肉细胞产生毒性。
35.此外,经动物实验评估后,发酵水萃物及/或发酵酒萃物可具有维持肌肉量及肌耐力的功效。
36.在应用时,前述发酵萃取物及/或其衍生物可添加于组合物,其有效剂量需视发酵萃取物及/或其衍生物的型态及/或施用对象而定。在一实施例中,发酵水萃物及/或发酵酒萃物投予小鼠时,有效剂量可例如为400mg/kg.体重(body weight,bw)/天至600mg/kg.bw/天。在一实施例中,发酵水萃物及/或发酵酒萃物投予人体时,有效剂量可例如为2300mg/60kg.bw/天至2500mg/60kg.bw/天。
37.在应用时,前述组合物可例如食品组合物或医药组合物。在一实施例中,组合物可选择性包含食品或医疗上可接受的载体、赋形剂、稀释剂、辅助剂、防腐剂、填充剂及/或添加剂。
38.以下利用数个实施例以说明本发明的应用,然其并非用以限定本发明,本领域技术人员,在不脱离本发明的精神和范围内,当可作各种的更动与润饰。
39.实施例一、制备桑黄的发酵萃取物及其衍生物
40.本实施例的桑黄(phellinus linteus)的第一菌丝体是保藏于2020年11月12日保藏于日本nite-ipod(地址:日本千叶县木更津市上总镰足2-5-8 120号室;邮政编码:292-0818),保藏编号为nite bp-03321。此菌株是自中国的野生桑黄子实体分离的菌丝体。
41.关于上述桑黄(nite bp-03321)的菌学特征及培养方式是参阅中国台湾申请号tw 109129939一案,此处一并列为参考文献。
42.将保藏于nite-ipod的桑黄的菌丝体(或称第一菌丝体)接种于马铃薯糊精培养基(potato dextrose agar,pda)上,并于25℃下培养7天,以获得第二菌丝体。然后,刮取部分的桑黄的第二菌丝体并接种于第一培养液中,以于25℃、ph 5、转速120rpm之下,进行7天的培养步骤,以获得第三菌丝体,其中上述第一培养液包含1重量%的综合性碳氮源、1.5重量%的醣类、0.3重量%的酵母抽出物、0.3重量%的蛋白胨及0.05重量%的无机盐类。上述综合性碳氮源为谷类(麦粉及/或麸皮粉)及/或豆类(黄豆粉、绿豆粉、大豆粉及/或肉桂粉)。上述醣类为单醣(葡萄糖及/或果糖)及/或双醣(麦芽糖及/或蔗糖)。上述无机盐类为磷酸盐(磷酸氢二钾、磷酸二氢钾)及/或硫酸盐(硫酸镁及/或硫酸铁)。综合性碳氮源、醣类及无机盐类的具体配方为本发明所属技术领域的技术人员所熟知,可视实际需求任意调整,并不影响发酵步骤的进行,在此不另赘述。
43.接着,取第一培养液中的部分桑黄的第三体菌丝体接种于含有第二培养液(成分相同于第一培养液)的发酵槽内,以25℃、ph 5、0.5kg/cm2的气压、1.0vvm的空气通气速率及80rpm搅拌速度进行发酵14天,以获得发酵物。
44.取发酵物进行冷冻干燥,以获得发酵冻干粉。在本实施例中,100l的发酵物可获得3kg发酵冻干粉。
45.再来,对发酵冻干粉进行萃取步骤,以获得发酵萃取物,其中发酵萃取物包含发酵水萃物及发酵酒萃物。上述发酵水萃物是利用蒸馏水于100℃进行热水萃取达30分钟后获得,其中水对发酵冻干粉的重量比值为20。待发酵水萃物冷却至室温后,进行冷冻干燥,以
获得样本1。
46.上述发酵酒萃物是利用乙醇于25℃进行超音波震荡处理达1小时后获得,其中超音波震荡处理是利用超音波洗净器(制造商:三角洲超音波有限公司,中国台湾;型号:dc600h)以600w、40khz的超音波进行,且乙醇对发酵冻干粉的重量比值为20。接着,进行离心以分层,其中上清液为发酵酒萃物。然后,对发酵酒萃物进行减压浓缩,以获得样本2。
47.分别以二甲基亚石枫(dimethyl sulfoxide,dmso)溶解样本1及样本2,以利于后述的配置。
48.实施例二、评估发酵萃取物维持肌管直径、肌肉量及肌耐力的功效
49.利用小鼠骨骼肌细胞(c2c12细胞株)建立肌少症模式。肌少症模式的建立可利用人工合成的皮质类固醇地塞米松(dexamethasone),其可抑制免疫系统,因此可做为抗发炎药或抗过敏药。然而,地塞米松还具有导致肌肉萎缩(包含肌肉量下降及/或肌耐力下降)的副作用,因此本实施例是利用塞米松诱导肌肉细胞萎缩来模拟肌少症。
50.首先,利用生长培养基[含10%胎牛血清的达尔伯克氏必需基本培养基(dulbecco's modified minimal essential medium,dmem)]于37℃、5%co2培养c2c12细胞株,其中c2c12细胞株的起始细胞密度是1x105至2x105个/ml。当c2c12细胞株长至70%满时,以分化培养基(含有2%马血清的dmem)进行分化培养达7天,期间每2天更换一次分化培养基,以获得分化后的细胞,其中90%分化成肌管。
[0051]
接下来,将上述分化后的细胞分成空白对照组、负对照组、实验组1、实验组2、实验组3及实验组4,其中空白对照组的培养基是含有0.1%dmso的dmem,负对照组的培养基是含有0.1%dmso及10μm地塞米松的dmem,实验组1的培养基是含有10μg/ml的样本1的dmem,实验组2的培养基是含有10μm地塞米松及10μg/ml的样本1的dmem,实验组3的培养基是含有1μg/ml的样本2的dmem,且实验组4的培养基是含有10μm地塞米松及1μg/ml的样本2的dmem。值得注意的是,因为样本1及样本2是先溶于dmso中再用于调配培养基,因此实验组1至实验组4的培养基中含有dmso,但浓度小于或等于0.1%,以避免对细胞造成毒性。
[0052]
在37℃、5%co2下分别以上述培养基培养上述分化细胞株达24小时后,进行苏木精伊红(hematoxylin and eosin,h&e)染色,再以光学显微镜观察分化细胞株中肌管的直径大小,如图1a至图1f所示。
[0053]
图1a至图1f是根据本发明一实施例中以含或不含发酵萃取物及/或地塞米松的培养基培养小鼠骨骼肌细胞的组织染色图,其中图1a、图1b、图1c、图1d、图1e及图1f分别对应空白对照组、负对照组、实验组1、实验组2、实验组3及实验组4。相较于图1a(空白对照组),图1b(负对照组)的肌管直径较小,但相较于图1b(负对照组),图1c至图1f(实验组1至实验组4)的肌管直径较大。
[0054]
利用市售软体(image-pro plus software)测量肌管直径,并将肌管直径的统计结果显示于表1,其中表1的统计方式是使用成对样本t检定(paired sample t-test)分析各项百分比,且“#”及“*”分别代表与空白对照组及负对照组间距有统计上具有显著差异(p《0.05,n=60)。
[0055]
表1
[0056][0057]
由表1可知,相较于空白对照组,负对照组的肌管直径显著下降,表示地塞米松确实可导致肌肉细胞萎缩。然而,相较于负对照组,实验组2及实验组4显著较高,表示发酵水萃物及/或发酵酒萃物可维持受地塞米松诱导的肌管直径的长度,意味着发酵水萃物及/或发酵酒萃物可延缓及/或避免肌肉量的流失。此外,实验组1及实验组3与空白对照组之间无显著差异,显示发酵水萃物或发酵酒萃物不影响肌管直径的大小,换言之,发酵水萃物或发酵酒萃物对肌管细胞不具细胞毒性。
[0058]
实施例三、评估发酵萃取物维持肌肉量及肌耐力的功效
[0059]
将上述样本1及样本2以等重量混合,以获得样本3。
[0060]
本实施例以c57bl/6j小鼠做为模式生物。将小鼠分为空白组、对照组及实验组,并以对应的试剂进行一天一次的管喂,其中实验组的试剂为样本3,且空白组及对照组的试剂为水。具体而言,样本3是溶解于适量水中,以控喂食量在500mg/kg.bw/次,且管喂空白组及对照组的水的体积等同于样本3与水混合的总体积。
[0061]
分别对实验组及对照组的小鼠的后肢进行石膏固定处理达7天,以诱导小鼠的后肢的萎缩。接着,拆下石膏,使小鼠在鼠笼中自由活动达7天。然后,进行肌耐力实验,再牺牲老鼠,以测量小鼠后肢骨骼肌。在上述石膏固定处理及自由活动期间(共14天),持续进行管喂。
[0062]
上述肌耐力实验是将小鼠放置在倾斜的跑步机上,其中跑步机的输送带是以18m/min至20m/min的速率往下输送,且跑步机的底部设有惊吓网格(shock grids)。如果小鼠不动,则输送带会将小鼠输送到跑步机底部,使小鼠的尾巴受到电击。一般而言,小鼠会为了避免尾巴遭受电击而往上跑动。然而,如果肌耐力不足,小鼠会无法克服输送带的速度而被输送到跑步机底部,从而遭受电击。在相同时间内,如果小鼠受到电击的次数越多,表示小鼠的肌耐力越差。利用市售软体[graphpad prism(version 8.0)]以单因子变异数分析(one-way anova)及dunnett's test事后检定(post-hoc)分析小鼠受到电击的次数,并将结果显示于表2,其中“#”及“*”分别表示与空白组及对照组间具有统计上的显著差异(p《0.05,n=6)。
[0063]
表2
[0064]
组别电击次数空白组3.00
±
2.28对照组500.83
±
257.37#实验组25.60
±
48.87*
[0065]
如表2所示,相较于空白组,对照组的小鼠受到的电击次数显著上升,显示石膏固定法确实可导致小鼠的骨骼肌萎缩而失去肌耐力。然而,相较于对照组,实验组的小鼠受到的电击次数显著下降,显示施予发酵水萃物与发酵酒萃物的混合物可有效维持肌肉量及肌
耐力,从而延缓及/或避免小鼠的肌耐力的流失。
[0066]
接着,牺牲小鼠并测量其后肢腓肠肌的重量。将结果利用市售软体[graphpad prism(version 8.0)]进行单因子变异数分析(one-way anova)及dunnett's test事后检定(post-hoc)分析来统计组间差异。结果是显示于表3,其中相对重量是腓肠肌的重除以小鼠体重,以排除体型上的个体差异的因素,且图号“#”及“*”分别表示与空白组及对照组间具有统计上的显著差异(p《0.05,n=6)。
[0067]
表3
[0068]
组别相对重量(mg/g)空白组5.485
±
0.234对照组4.895
±
0.384#实验组5.051
±
0.182*
[0069]
如表3所示,相较于空白组,对照组的腓肠肌的相对重量显著较小,显示石膏固定处理可造成肌肉量下降。然而,相较于对照组,实验组的腓肠肌的相对重量显著较大,显示施予发酵水萃物与发酵酒萃物的混合物可有效维持肌肉量,从而延缓及/或避免肌肉量的流失。
[0070]
实施例四、推估人体的有效剂量
[0071]
本实施例依据美国食品药物管理局2005年所公告的实验初期估算方法,以上述小鼠的有效剂量推估人体的有效剂量。此方法是以小鼠每公斤体重的有效剂量除以换算系数12.3,即为人体每公斤体重的有效剂量。依据本实施例中对小鼠每日施予的剂量500mg/kg.bw推估,人体的有效剂量为2400mg/60kg.bw/天(以成年人体体重为60kg.bw计算)。
[0072]
由上述可知,本发明的发酵水萃物及发酵酒萃物可有效维持肌管直径、肌肉量及肌耐力,因而可用于改善肌少症。
[0073]
需补充的是,本发明虽以特定的制程、特定的分析方法及/或特定仪器作为例示,说明本发明的桑黄用于制备改善肌少症的组合物的用途,惟本发明所属技术领域的技术人员可知,本发明并不限于此,在不脱离本发明的精神和范围内,本发明的桑黄用于制备改善肌少症的组合物的用途亦可使用其他制程、其他的分析方法或其他仪器进行。
[0074]
虽然本发明已以数个实施例揭露如上,然其并非用以限定本发明,在本发明所属技术领域的技术人员,在不脱离本发明的精神和范围内,当可作各种的更动与润饰,因此本发明的保护范围当视后附的申请专利范围所界定者为准。
[0075]
【生物材料保藏】
[0076]
桑黄(phellinus linteus)是于2020年11月12日保藏于日本独立行政法人制品评价技术基盘机构(national institute of technology and evaluation,nite)特许生物保藏中心(international patent organism depositary,ipod),地址:日本千叶县木更津市上总镰足2-5-8 120号室;邮政编码:292-0818;保藏编号为nite bp-03321。桑黄也于2019年7月18日保藏于中国台湾新竹食品路331号财团法人食品工业发展研究所生物资源中心(bcrc),且保藏编号为bcrc 930210。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1