一种治疗糖尿病并发症的缓释片及其制备方法
本发明涉及药物制剂领域,涉及一种治疗糖尿病神经病变的缓释片及其制备方法,更具体涉及一种包含依帕司他的缓释片及其制备方法。
背景技术:
:依帕司他(epalrestat)是苯基丙烯基噻唑烷羧酸,结构上属羧酸衍生物,用于治疗糖尿病性神经病变。依帕司他首先被发现可以抑制ar,有可能改善糖尿病的迟发性并发症,后在开发过程中制备成口服制剂,并于1992年在日本首次上市,商品名为(ono-2235),用以治疗神经病变和视网膜病变。自上市以来,依帕司他作为一种糖尿病性神经病变的治疗药物,能显著改善神经病变的症状,改善患者生活质量,临床疗效显著,副作用较少,临床上可单独使用或与其他药物联用,如与前列地尔联用,能显著改善病症,并使周围神经的传导速度明显提高;与α-硫酸锌和甲钴胺联用,治疗dpn的临床疗效显著,好于依帕司他单独用药,具有临床推广价值。依帕司他化学名是5-[(1z,2e)-2-甲基-3-苯基-2-丙烯亚基]-4-氧代-2-硫代-噻唑烷乙酸,分子式为c15h13no3s2,分子量为319.4,性状为黄色至橙色,晶体或结晶性粉末,较易溶于dmf,几乎不溶于水。tsrlinc网站显示logp=2.23,clogp=2.43,并将其归于bcsⅱ类,结构式如下:依帕司他是一种可逆性的醛糖还原酶非竞争性抑制剂,对醛糖还原酶具有选择性抑制作用。临床研究表明,依帕司他能抑制糖尿病性外周神经病变患者红细胞中山梨醇的积累,与对照组比较能改善患者的自觉症状和神经功能障碍。动物实验表明依帕司他可显著抑制糖尿病模型大鼠的坐骨神经、红细胞、视网膜中山梨醇的累积,提高其运动神经传导速度和自主神经机能;在神经形态学上,依帕司他可改善轴突流异常,增加其坐骨神经中有髓神经纤维密度、腓肠神经髓鞘厚度、轴突面积、轴突圆柱率;另外,依帕司他也可改善模型动物坐骨神经的血流并使其肌醇含量回升。白芨多糖,又称白芨胶,是从兰科植物白芨的干燥块茎中提取所得到的一种水溶性高分子多糖,其结构复杂,主要成分为葡萄甘露聚糖。由于具有功能缓释性、局部滞留性、自身降解性、无刺激性、无毒副作用、资源丰富、廉价易得等辅料的特性,在药物制备过程中应用上越来越受到重视,可作为乳化剂、超声耦合剂以及凝胶剂、口腔黏膜剂、滴眼剂、涂膜剂、软膏剂和栓剂的基质,也可作为载药黏膜黏附剂、片剂的粘合剂、糖衣片的隔离层、缓释制剂的长效辅料等等,在医药领域具有广泛的应用。技术实现要素:本发明目的在于,提供了一种稳定释放的含有依帕司他的缓释片,该依帕司他缓释片是通过速释部分和缓释部分两部分协同作用,达到了很好的缓释效果,从而保证了用药的安全性与有效性。为实现本发明目的,采用以下技术方案:一种依帕司他缓释片,由缓释部分和速释部分组成,其中速释部分和缓释部分中所含依帕司他的重量比为3.5:6.5~4.5:5.5。所述缓释部分为由缓释包衣液喷涂至少含有白芨多糖为填充材料的丸芯构成;所述缓释包衣液中缓释材料为经处理的葫芦巴胶;所述速释部分由填充剂、崩解剂和润滑剂制备而成;所述填充剂选自微晶纤维素、乳糖中的一种或两种,所述崩解剂为羧甲基淀粉钠,所述润滑剂选自硬脂酸镁、滑石粉和微粉硅胶中的一种或两种。进一步的,上述依帕司他缓释片,所述丸芯由活性成分依帕司他与填充材料采用挤出滚圆法制成,其中,填充材料还含有乳糖和微晶纤维素中的一种或两种;所述缓释包衣液是用85%-95%乙醇溶液溶解经处理的葫芦巴胶、增塑剂、抗黏剂制得。其中,增塑剂选自聚乙二醇6000、柠檬酸三乙酯中的一种或两种,抗黏剂选自硬脂酸镁或微粉硅胶。上述依帕司他缓释片,所述经处理的葫芦巴胶,其处理方法如下:将葫芦巴胶粉碎过20目筛;95%的乙醇、氢氧化钠和上述过筛粉碎物按重量比3:0.2:1搅拌4小时,得反应液;用732型强酸离子交换树脂中和上述反应液至ph=7;抽滤除去树脂,将滤液减压蒸馏浓缩至粘稠状;加入95%乙醇搅拌至分散浑浊,抽滤,滤液经喷雾干燥即得到经处理的葫芦巴胶。上述葫芦巴胶处理方法,所述喷雾干燥的设定条件:出口温度80℃,进口温度115℃,进料速度10ml/min。上述依帕司他缓释片,每1000片由以下原辅料制备而成:上述依帕司他缓释片,每1000片由以下原辅料制备而成:一种上述依帕司他缓释片的制备方法,包括如下步骤:(1)准备原辅料:将处方中原辅料分别过40目及以上筛,备用;(2)制备丸芯:将处方量的活性成分依帕司他与填充剂混合均匀后置于湿法制粒机中,逐渐加入纯化水为润湿剂制成软材,将制得的软材转移至挤出机中,经挤出筛板挤成条状物,将挤出的条状物转移至滚圆机中滚圆,滚圆2-4min后取出滚圆的丸芯进行干燥,干燥后的丸芯过筛,称取适量丸芯测定依帕司他含量,按速释部分与缓释部分中依帕司他的比例,折算缓释部分所需丸芯重量,并称重备用;(3)包缓释层:将处方量的缓释材料、增塑剂和抗黏剂搅拌下缓缓加入到85-95%乙醇中,搅拌至溶解,备用;将步骤(2)中称重好的丸芯置于流化床中,启动流化床,设定流化床后开始喷液包衣,制得含药缓释小丸;(4)压片:将步骤(3)中制得的含药缓释小丸与速释部分处方量的活性成分依帕司他、填充剂、崩解剂和润滑剂混合均匀后,采用直接压片法压片即得依帕司他缓释片。上述依帕司他缓释片的制备方法,步骤(2)中筛板孔径0.8mm,挤出转速40r/min,滚圆机转速为760r/min。上述依帕司他缓释片的制备方法,步骤(2)中取出滚圆的丸芯进行45-55℃减压干燥至水分小于2%。上述依帕司他缓释片的制备方法,步骤(2)中干燥后的丸芯过筛为筛分去除细粉和大颗粒,取20-24目过筛丸芯,备用。上述依帕司他缓释片的制备方法,步骤(3)中设定流化床参数分别为:喷嘴直径为0.5mm,进风温度为40-45℃,物料温度35-40℃,雾化压力0.20-0.25mpa。本发明提供的依帕司他缓释片,其在ph1.2的盐酸溶液中,2小时释放30%-40%(相当于口服50mg片剂),优选2小时释放30%-35%;8小时释放75%-85%,优选8小时释放75%-80%,12小时释放不低于85%,具有前期释药迅速、后期释药缓慢平稳的优点,药物可完全释放,能长期维持有效血药浓度,生物利用度高。本发明提供的依帕司他缓释片,其在ph6.8的盐酸溶液中,2小时释放30%-40%(相当于口服50mg片剂),优选2小时释放35%-40%;8小时释放75%-85%,优选8小时释放80%-85%,12小时释放不低于85%,具有前期释药迅速、后期释药缓慢平稳的优点,药物可完全释放,能长期维持有效血药浓度,生物利用度高。本发明依帕司他缓释片所达到的缓释效果是丸芯填充材料白芨多糖的延迟药物溶出的效果以及经处理的葫芦巴胶的缓释效果联合作用的结果,保证了缓释片在24小时内缓慢释放完全,可有效避免普通制剂血药浓度的峰谷现象,减少服药次数,降低不良反应发生率;增加了患者的顺应性;同时缓释部分与速释部分中依帕司他的比例3.5:6.5~4.5:5.5,保证了缓释片溶出释放平稳且完全,大大保证了依帕司他的治疗效果,临床疗效显著提高。附图说明图1:实施例1、实施例3、实施例5的依帕司他缓释片在ph1.2盐酸溶液中的溶出曲线图2:实施例1、实施例3、实施例5的依帕司他缓释片在ph6.8磷酸盐缓冲液的溶出曲线图3:对比例1、对比例2的依帕司他缓释片在ph1.2盐酸溶液中的溶出曲线图4:对比例1、对比例2的依帕司他缓释片在ph6.8磷酸盐缓冲液中的溶出曲线图5:对比例5的依帕司他缓释片在ph1.2盐酸溶液中的溶出曲线图6:对比例5的依帕司他缓释片在ph6.8磷酸盐缓冲液中的溶出曲线具体实施方式本发明公开了一种治疗糖尿病并发症的缓释片及其制备方法,本领域技术人员可以借鉴本发明的内容,结合药物制剂的相关原理,适当改进工艺参数来实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明范围内。本发明的应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
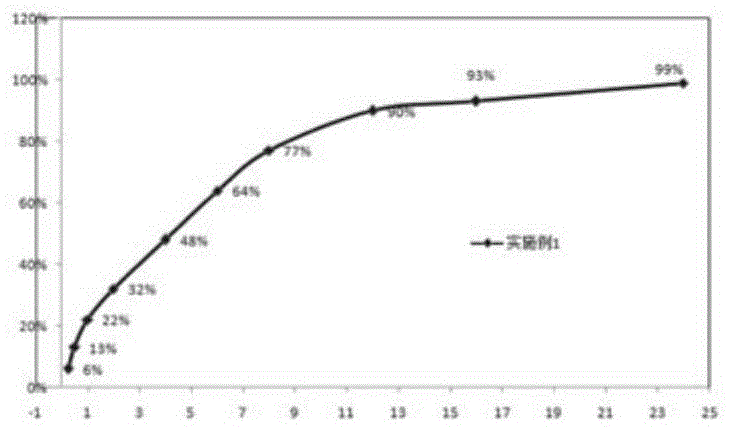
发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。为了更好地理解本发明而不是限制本发明的范围,在本申请中所用的表示用量、百分比的所有数字、以及其他数值,在所有情况下都应理解为以词语“大约”所修饰。各个数字参数至少应被看作是根据所报告的有效数字和通过常规的四舍五入方法而获得的。以下通过实施例来进一步阐述本发明,但实施例不对本发明做任何限定。制备例1:经处理的葫芦巴胶将葫芦巴胶粉碎过20目筛,95%的乙醇、氢氧化钠和上述过筛粉碎物按重量比3:0.2:1搅拌4小时,得反应液;用732型强酸离子交换树脂中和上述反应液至ph=7;抽滤除去树脂,将滤液减压蒸馏浓缩至粘稠状;加入95%乙醇搅拌至分散浑浊,抽滤,滤液经喷雾干燥,喷雾干燥的设定条件:出口温度80℃,进口温度115℃,进料速度10ml/min;得到经处理的葫芦巴胶。实施例1:依帕司他缓释片(一)处方组成:(二)制备方法:(1)准备原辅料:将处方中原辅料分别过40目筛,备用;(2)制备丸芯:将处方量的活性成分依帕司他与填充剂混合均匀后置于湿法制粒机中,逐渐加入45g纯化水为润湿剂制成软材;将制得的软材转移至挤出机中,经挤出筛板(筛板孔径0.8mm,挤出转速40r/min)挤成条状物,将挤出的条状物转移至滚圆机中滚圆,滚圆机转速为760r/min,滚圆3min后取出滚圆的丸芯进行干燥,50℃减压干燥至水分为1.5%;干燥后的丸芯过筛去除细粉和大颗粒,取20-24目过筛丸芯,称取适量丸芯测定依帕司他含量,按速释部分与缓释部分中依帕司他的比例,折算缓释部分所需丸芯重量,并称重备用;(3)包缓释层:将处方量的缓释材料、增塑剂和抗黏剂搅拌下缓缓加入到90%乙醇中,搅拌至溶解,备用;将步骤(2)中称重好的丸芯置于流化床中,启动流化床,设定流化床喷嘴直径为0.5mm,进风温度为40-45℃,物料温度35-40℃,雾化压力0.20-0.25mpa;后开始喷液包衣,制得含药缓释小丸;(4)压片:将步骤(3)中制得的含药缓释小丸与速释部分处方量的主药依帕司他、填充剂、崩解剂和润滑剂混合均匀后,采用直接压片法压片即得依帕司他缓释片。实施例2:依帕司他缓释片(一)处方组成:(二)制备方法:(1)准备原辅料:将处方中原辅料分别过40目筛,备用;(2)制备丸芯:将处方量的活性成分依帕司他与填充剂混合均匀后置于湿法制粒机中,逐渐加入45g纯化水为润湿剂制成软材;将制得的软材转移至挤出机中,经挤出筛板(筛板孔径0.8mm,挤出转速40r/min)挤成条状物,将挤出的条状物转移至滚圆机中滚圆,滚圆机转速为760r/min,滚圆3min后取出滚圆的丸芯进行干燥,50℃减压干燥至水分为1.5%;干燥后的丸芯过筛去除细粉和大颗粒,取20-24目过筛丸芯,称取适量丸芯测定依帕司他含量,按速释部分与缓释部分中依帕司他的比例,折算缓释部分所需丸芯重量,并称重备用;(3)包缓释层:将处方量的缓释材料、增塑剂和抗黏剂搅拌下缓缓加入到90%乙醇中,搅拌至溶解,备用;将步骤(2)中称重好的丸芯置于流化床中,启动流化床,设定流化床喷嘴直径为0.5mm,进风温度为40-45℃,物料温度35-40℃,雾化压力0.20-0.25mpa;后开始喷液包衣,制得含药缓释小丸;(4)压片:将步骤(3)中制得的含药缓释小丸与速释部分处方量的主药依帕司他、填充剂、崩解剂和润滑剂混合均匀后,采用直接压片法压片即得依帕司他缓释片。实施例3:依帕司他缓释片(一)处方组成:(二)制备方法:(1)准备原辅料:将处方中原辅料分别过60目筛,备用;(2)制备丸芯:将处方量的活性成分依帕司他与填充剂混合均匀后置于湿法制粒机中,逐渐加入43g纯化水为润湿剂制成软材;将制得的软材转移至挤出机中,经挤出筛板(筛板孔径0.8mm,挤出转速40r/min)挤成条状物,将挤出的条状物转移至滚圆机中滚圆,滚圆机转速为760r/min,滚圆4min后取出滚圆的丸芯进行干燥,45℃减压干燥至水分为1.7%;干燥后的丸芯过筛去除细粉和大颗粒,取20-24目过筛丸芯,称取适量丸芯测定依帕司他含量,按速释部分与缓释部分中依帕司他的比例,折算缓释部分所需丸芯重量,并称重备用;(3)包缓释层:将处方量的缓释材料、增塑剂和抗黏剂搅拌下缓缓加入到95%乙醇中,搅拌至溶解,备用;将步骤(2)中称重好的丸芯置于流化床中,启动流化床,设定流化床喷嘴直径为0.5mm,进风温度为40-45℃,物料温度35-40℃,雾化压力0.20-0.25mpa;后开始喷液包衣,制得含药缓释小丸;(4)压片:将步骤(3)中制得的含药缓释小丸与速释部分处方量的主药依帕司他、填充剂、崩解剂和润滑剂混合均匀后,采用直接压片法压片即得依帕司他缓释片。实施例4:依帕司他缓释片(一)处方组成:(二)制备方法:(1)准备原辅料:将处方中原辅料分别过60目筛,备用;(2)制备丸芯:将处方量的活性成分依帕司他与填充剂混合均匀后置于湿法制粒机中,逐渐加入40g纯化水为润湿剂制成软材;将制得的软材转移至挤出机中,经挤出筛板(筛板孔径0.8mm,挤出转速40r/min)挤成条状物,将挤出的条状物转移至滚圆机中滚圆,滚圆机转速为760r/min,滚圆4min后取出滚圆的丸芯进行干燥,45℃减压干燥至水分为1.4%;干燥后的丸芯过筛去除细粉和大颗粒,取20-24目过筛丸芯,称取适量丸芯测定依帕司他含量,按速释部分与缓释部分中依帕司他的比例,折算缓释部分所需丸芯重量,并称重备用;(3)包缓释层:将处方量的缓释材料、增塑剂和抗黏剂搅拌下缓缓加入到95%乙醇中,搅拌至溶解,备用;将步骤(2)中称重好的丸芯置于流化床中,启动流化床,设定流化床喷嘴直径为0.5mm,进风温度为40-45℃,物料温度35-40℃,雾化压力0.20-0.25mpa;后开始喷液包衣,制得含药缓释小丸;(4)压片:将步骤(3)中制得的含药缓释小丸与速释部分处方量的主药依帕司他、填充剂、崩解剂和润滑剂混合均匀后,采用直接压片法压片即得依帕司他缓释片。实施例5:依帕司他缓释片(一)处方组成:(二)制备方法:(1)准备原辅料:将处方中原辅料分别过80目筛,备用;(2)制备丸芯:将处方量的活性成分依帕司他与填充剂混合均匀后置于湿法制粒机中,逐渐加入40g纯化水为润湿剂制成软材;将制得的软材转移至挤出机中,经挤出筛板(筛板孔径0.8mm,挤出转速40r/min)挤成条状物,将挤出的条状物转移至滚圆机中滚圆,滚圆机转速为760r/min,滚圆2min后取出滚圆的丸芯进行干燥,55℃减压干燥至水分为1.9%;干燥后的丸芯过筛去除细粉和大颗粒,取20-24目过筛丸芯,称取适量丸芯测定依帕司他含量,按速释部分与缓释部分中依帕司他的比例,折算缓释部分所需丸芯重量,并称重备用;(3)包缓释层:将处方量的缓释材料、增塑剂和抗黏剂搅拌下缓缓加入到85%乙醇中,搅拌至溶解,备用;将步骤(2)中称重好的丸芯置于流化床中,启动流化床,设定流化床喷嘴直径为0.5mm,进风温度为40-45℃,物料温度35-40℃,雾化压力0.20-0.25mpa;后开始喷液包衣,制得含药缓释小丸;(4)压片:将步骤(3)中制得的含药缓释小丸与速释部分处方量的主药依帕司他、填充剂、崩解剂和润滑剂混合均匀后,采用直接压片法压片即得依帕司他缓释片。实施例6:依帕司他缓释片(一)处方组成:(二)制备方法:、(1)准备原辅料:将处方中原辅料分别过80目筛,备用;(2)制备丸芯:将处方量的活性成分依帕司他与填充剂混合均匀后置于湿法制粒机中,逐渐加入41g纯化水为润湿剂制成软材;将制得的软材转移至挤出机中,经挤出筛板(筛板孔径0.8mm,挤出转速40r/min)挤成条状物,将挤出的条状物转移至滚圆机中滚圆,滚圆机转速为760r/min,滚圆2min后取出滚圆的丸芯进行干燥,55℃减压干燥至水分为1.8%;干燥后的丸芯过筛去除细粉和大颗粒,取20-24目过筛丸芯,称取适量丸芯测定依帕司他含量,按速释部分与缓释部分中依帕司他的比例,折算缓释部分所需丸芯重量,并称重备用;(3)包缓释层:将处方量的缓释材料、增塑剂和抗黏剂搅拌下缓缓加入到85%乙醇中,搅拌至溶解,备用;将步骤(2)中称重好的丸芯置于流化床中,启动流化床,设定流化床喷嘴直径为0.5mm,进风温度为40-45℃,物料温度35-40℃,雾化压力0.20-0.25mpa;后开始喷液包衣,制得含药缓释小丸;(4)压片:将步骤(3)中制得的含药缓释小丸与速释部分处方量的主药依帕司他、填充剂、崩解剂和润滑剂混合均匀后,采用直接压片法压片即得依帕司他缓释片。对比例1-2:依帕司他缓释片(一)处方组成:(二)制备方法:同实施例1对比例3-4:依帕司他缓释片(一)处方组成:(二)制备方法:同实施例1对比例5:依帕司他缓释片(一)处方组成:缓释材料为未经处理的葫芦巴胶,其余同实施例1。(二)制备方法:同实施例1。实施例7:ph1.2盐酸溶液溶出度(一)测定方法根据中国药典2015版四部通则0931溶出度与释放度测定方法第一法,将依帕司缓释制剂置于溶出杯中,以900ml经脱气的ph1.2的盐酸溶液为释放介质,转速为75rpm,温度为(37±0.5)℃,依法操作,分别在15min、30min、1h、2h、4h、6h、8h、12h、16h,取释放溶液10ml,同时补充等量同温新鲜介质,经0.45μm微孔滤膜滤过,取续滤液注入高效液相色谱仪中测定。高效液相色谱:色谱柱:色谱柱为十八烷基键合硅胶为填充剂的色谱柱,4.6mm(内径)×250mm(长度),5μm(填料颗粒);流动相:体积比为2:1的磷酸盐缓冲液(体积比为1:1的0.05mol/l磷酸二氢钾:0.05mol/l磷酸氢二钠,用磷酸调ph值为6.5):乙腈;检测波长:280nm;柱温:25℃;进样量:3μl;流速:1.0ml/min。(二)测定结果:根据上表的溶出度测定结果可知,实施例1-6制备的依帕司他缓释片在ph1.2的盐酸溶液中,2小时释放30%-35%(相当于口服50mg片剂),前期药物释放迅速,达到迅速起效的效果,缓释部分具有较好的缓释效果,8小时释放75%-80%,12小时释放不低于85%,后期释药缓慢平稳的优点,药物可完全释放,能长期维持有效血药浓度,生物利用度高。从对比例1、对比例2可以看出,当速释部分和缓释部分中所含依帕司他的重量比不在3.5:6.5~4.5:5.5范围内时,(1)对比例1的重量比为5:5,制备得到的依帕司他缓释片溶出较快,2小时释放42%,8小时释放88%,12小时释放98%,缓释效果较差;(2)对比例2的重量比为3:7,制备得到的依帕司他缓释片溶出较慢,2小时释放22%,8小时释放65%,12小时释放79%,24小时释放92%,溶出较慢,影响治疗效果。从对比例3、对比例4、对比例5可以看出,本发明依帕司他缓释片所达到的缓释效果是丸芯填充材料白芨多糖的延迟药物溶出的效果以及经处理的葫芦巴胶的缓释效果联合作用的结果:(1)当白芨多糖用量较少时,如对比例3,制备得到的依帕司他缓释片溶出较快,2小时释放55%,8小时释放95%,12小时释放100%,缓释效果较差;(2)当白芨多糖用量较多时,如对比例4,制备得到的依帕司他缓释片溶出较慢,2小时释放32%,8小时释放68%,12小时释放77%,24小时溶出91%,溶出较慢,影响治疗效果;(3)当使用未经处理的葫芦巴胶时,如对比例5,制备得到的依帕司他缓释片溶出较快,2小时释放60%,8小时释放100%,缓释效果较差。实施例8:ph6.8磷酸盐缓冲液溶出度(一)测定方法:根据中国药典2015版四部通则0931溶出度与释放度测定方法第一法,将依帕司缓释制剂置于溶出杯中,以900mlph6.8磷酸盐缓冲液为释放介质,转速为50rpm,温度为(37±0.5)℃,依法操作,分别在2h、4h、6h、8h、12h、16h,取释放溶液10ml,同时补充等量同温新鲜介质,经0.45μm微孔滤膜滤过,取续滤液注入高效液相色谱仪中测定。高效液相色谱:色谱柱:色谱柱为十八烷基键合硅胶为填充剂的色谱柱,4.6mm(内径)×250mm(长度),5μm(填料颗粒);流动相:体积比为2:1的磷酸盐缓冲液(体积比为1:1的0.05mol/l磷酸二氢钾:0.05mol/l磷酸氢二钠,用磷酸调ph值为6.5):乙腈;检测波长:280nm;柱温:25℃;进样量:3μl;流速:1.0ml/min。(二)测定结果:2h4h6h8h12h16h24h实施例136%51%69%81%92%95%99%实施例239%53%70%82%96%95%100%实施例338%53%71%81%92%95%99%实施例439%53%69%83%93%95%99%实施例535%54%68%81%92%95%99%实施例635%51%70%81%90%92%99%对比例147%65%82%92%100%100%100%对比例227%40%55%69%80%84%92%对比例360%76%93%99%100%100%101%对比例437%46%58%72%79%81%90%对比例565%82%95%100%100%100%100%根据上表的溶出度测定结果可知,实施例1-6制备的依帕司他缓释片在ph6.8的磷酸盐缓冲液中,2小时释放35%-40%(相当于口服50mg片剂),前期药物释放迅速,达到迅速起效的效果,缓释部分具有较好的缓释效果,8小时释放80%-85%,12小时释放不低于85%,后期释药缓慢平稳的优点,药物可完全释放,能长期维持有效血药浓度,生物利用度高。从对比例1、对比例2可以看出,当速释部分和缓释部分中所含依帕司他的重量比不在3.5:6.5~4.5:5.5范围内时,(1)对比例1的重量比为5:5,制备得到的依帕司他缓释片溶出较快,2小时释放47%,8小时释放92%,12小时释放100%,缓释效果较差;(2)对比例2的重量比为3:7,制备得到的依帕司他缓释片溶出较慢,2小时释放27%,8小时释放69%,12小时释放80%,24小时释放92%,溶出较慢,影响治疗效果。从对比例3、对比例4、对比例5可以看出,本发明依帕司他缓释片所达到的缓释效果是丸芯填充材料白芨多糖的延迟药物溶出的效果以及经处理的葫芦巴胶的缓释效果联合作用的结果:(1)当白芨多糖用量较少时,如对比例3,制备得到的依帕司他缓释片溶出较快,2小时释放60%,8小时释放99%,12小时释放100%,缓释效果较差;(2)当白芨多糖用量较多时,如对比例4,制备得到的依帕司他缓释片溶出较慢,2小时释放37%,8小时释放72%,12小时释放79%,24小时溶出90%,溶出较慢,影响治疗效果;(3)当使用未经处理的葫芦巴胶时,如对比例5,制备得到的依帕司他缓释片溶出较快,2小时释放65%,8小时释放100%,缓释效果较差。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1