一种阻断耐药性传播的抗菌敷料
1.本发明属于生物医用材料技术领域,研制出一种阻断耐药性传播的抗菌敷料,具体涉及一种咪唑基聚离子液体
‑
铈抗菌敷料及其制备方法和应用。
背景技术:
2.随着抗药性细菌的不断出现,预计到2050年,每年将有1000万人死于败血症及其相关的感染性疾病;因此,细菌耐药性的源头控制和阻断迫在眉睫。
3.细菌可以通过抗生素耐药基因(antibiotics resistance genes,args)逃避抗生素的攻击,args可以产生使抗生素失活的酶、改变抗生素的靶点、增加细菌细胞膜的通透性和影响主动外排系统等。例如,耐甲氧西林金黄色葡萄球菌(methicillin
‑
resistant s.aureus,mrsa)中的meca基因可以编码青霉素结合蛋白2a,从而导致对所有β
‑
内酰胺类抗生素的耐药性。此外,细菌可以利用多种可移动基因元件,如质粒和噬菌体作为载体实现基因水平转移,使得耐药性在微生物之间传播。
4.与细菌相比,耐药基因对人体健康的影响并不直接。由于耐药基因可被转移,且很难降解,这意味着即使杀死细菌,其释放的耐药基因仍然可以通过食物链及其它途径传播。因此,耐药基因具有更大的潜在危害,已被认为是一种新的污染物。这些发现表明细菌耐药性不仅是一个医学问题,也是一个生态问题。在杀死细菌的同时使耐药基因失活至关重要。
5.耐药基因本质上是dna,一种由脱氧核苷酸单元组成的互补双链,由3',5'
‑
磷酸二酯键连接。dna作为生命遗传信息的载体,在环境中具有很高的稳定性,半衰期可达521年。即使采用紫外线、氯气和臭氧等物理方法,对dna的破坏效果也不理想。然而,dna可被天然核酸酶分解,如脱氧核糖核酸酶i(dnase i),通过作用于3',5'
‑
磷酸二酯键分解dna。天然酶具有催化效率高、特异性强、反应条件温和等优点,但易受多种理化因素的影响而失活。此外,稀有的来源和高昂的价格大大限制了天然酶的实际应用。
6.近年来,已经开发出人工模拟酶来克服天然酶的缺点。目前,人工核酸酶常以溶液形态应用于科研与生产,国内外尚无将其整合到有形抗菌材料中,在杀灭细菌的同时,分解清除细菌耐药基因污染的报道。
技术实现要素:
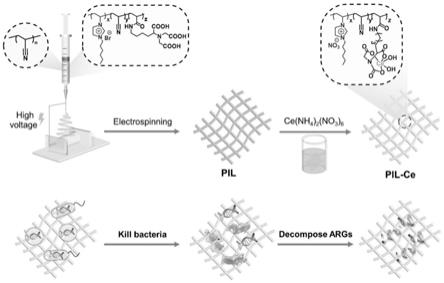
7.本发明基于dnase模拟酶活性,提出杀灭细菌的同时分解细菌耐药基因,首要目的是提供一种阻断耐药性传播的新型抗菌敷料,该咪唑基聚离子液体
‑
铈纳米静电纺丝敷料兼具高效抗菌与基因分解性能,且毒副作用小。
8.本发明的第二个目的是提供上述咪唑基聚离子液体
‑
铈抗菌敷料的制备方法。
9.本发明的第三个目的是提供上述咪唑基聚离子液体
‑
铈抗菌敷料的应用。
10.为达到上述首要目的,本发明的解决方案是:
11.一种咪唑基聚离子液体
‑
铈抗菌敷料(即铈离子配位的咪唑类聚离子液体纳米纺丝膜),其结构通式为:
[0012][0013]
式中,n取0
‑
14中的整数,a为no3‑
。
[0014]
优选地,本发明的咪唑基聚离子液体
‑
铈抗菌敷料的结构通式为:
[0015][0016]
为达到上述第二个目的,本发明的解决方案是:
[0017]
一种上述的咪唑基聚离子液体
‑
铈抗菌敷料的制备方法,其包括如下步骤:
[0018]
(1)将咪唑基离子液体、金属配体单体、丙烯腈和引发剂溶于n,n
‑
二甲基甲酰胺中,在50
‑
80℃下聚合8
‑
15h;聚合完成后用丙酮将聚合产物沉析得到共聚物,洗涤,烘干备用;
[0019]
(2)将共聚物和聚丙烯腈溶于n,n
‑
二甲基甲酰胺中,采用静电纺丝技术,得到咪唑基聚离子液体纺丝膜;
[0020]
(3)将咪唑基聚离子液体纺丝膜浸入硝酸铈铵溶液中进行络合反应,得到咪唑基聚离子液体
‑
铈抗菌敷料。
[0021]
作为本发明的优选实施例,步骤(1)中,引发剂为偶氮二异丁腈。
[0022]
作为本发明的优选实施例,步骤(1)中,金属配体单体为2,2'
‑
(5
‑
丙烯酰胺基
‑1‑
羧甲基)己二酸(aanta)。
[0023]
作为本发明的优选实施例,步骤(2)中,静电纺丝的工艺参数为:流速为0.5
‑
1.5ml/h,电压为10
‑
20kv,纺丝时间为5
‑
12h,接收距离为8
‑
20cm。
[0024]
作为本发明的优选实施例,步骤(3)中,络合反应的时间为2
‑
5h,络合反应的温度为20
‑
50℃。
[0025]
为达到上述第三个目的,本发明的解决方案是:
[0026]
一种上述的咪唑基聚离子液体
‑
铈抗菌敷料在皮肤创面感染中得以应用。
[0027]
由于采用上述方案,本发明的有益效果是:
[0028]
本发明通过将咪唑类pil抗菌电纺丝与ce(iv)离子配合,制备相应的兼具耐药基因分解特性的pil
‑
ce膜,体外和体内实验结果表明,含ce的pil膜具有高效的杀灭细菌和降解耐药基因的作用,以耐甲氧西林金黄色葡萄球菌mrsa和卡那霉素抗性大肠杆菌感染的小鼠伤口治疗实验进一步证明,pil
‑
ce抗菌膜兼具dnase模拟酶特性,可作为一种新型抗菌膜在临床应用中可分解破坏耐药基因,从而避免耐药基因进一步污染影响环境生物。
附图说明
[0029]
图1为本发明的咪唑基聚离子液体
‑
铈纳米静电纺丝抗菌敷料的合成路线图。
[0030]
图2为本发明中实施例1的共聚物p(il
‑
co
‑
aanta
‑
co
‑
an)合成路线图。
[0031]
图3为本发明中实施例和对比例的产品示意图及抗菌性能结果图((a)实施例1至实施例3的咪唑基聚离子液体
‑
铈抗菌敷料(pil
‑
ce膜)及其相应的对比例咪唑基聚离子液体纺丝膜(pil膜);(b)采用涂板法比较三种实施例pil
‑
ce膜的体外抗菌效果,大肠杆菌、金黄色葡萄球菌分别与三种实施例pil
‑
ce膜、对照pet膜接触4h后,用涂板法计数细菌菌落,比较材料的抗菌性能)。
[0032]
图4为本发明中实施例1的pil
‑
ce膜与对比例pil膜的结构表征图(pil膜与pil
‑
ce膜的图片(a)、傅里叶红外光(ftir)谱图(b)、x射线光电子(xps)谱图(c);pil膜(d)、泡水2h后pil膜(e)及pil
‑
ce膜(f)的扫描电子显微镜图,标尺:5μm;(g)pil膜、泡水2h后pil膜与pil
‑
ce膜的纺丝纤维直径分布图及pil膜与pil
‑
ce膜的能量色散光谱(eds)数据;(h)pil
‑
ce纺丝纤维的透射电镜图以及相应的元素分布情况,标尺:200nm)。
[0033]
图5为本发明中实施例1的pil
‑
ce膜与对比例pil膜的体外抗菌效果图((a)大肠杆菌、(b)卡那霉素抗性大肠杆菌、(c)金黄色葡萄球菌和(d)耐甲氧西林金黄色葡萄球菌,分别与pil膜、pil
‑
ce膜、对照pet膜接触4h过程中的细菌存活率变化图;活/死细菌染色分析材料处理4h时(e)卡那霉素抗性大肠杆菌和(f)耐甲氧西林金黄色葡萄球菌的存活情况图,styo和pi染色分别表示活菌和死菌,标尺:7μm,放大的图像显示的是合并图中方框标示的区域)。
[0034]
图6为本发明中实施例1的pil
‑
ce膜分解双(对硝基苯基)磷酸酯(bnpp)的性能图((a)pil
‑
ce膜分解bnpp机理示意图,其中右上角显示pil
‑
ce膜、pil膜分别与5mm的bnpp溶液(3ml)及pbs溶液作用12h后的变化,空白对照为不添加膜材料的bnpp溶液;pil膜(b)、pil
‑
ce膜(c)分别与5mm的bnpp溶液作用12h过程的紫外光谱变化;(d)pil
‑
ce膜分解不同浓度bnpp溶液的初始速率变化图;(e)pil
‑
ce膜分解bnpp的循环使用性能测试)。
[0035]
图7为本发明中实施例1的pil
‑
ce膜分解dna的性能图((a)pil
‑
ce膜分解dna机理示意图;琼脂糖凝胶电泳显示测试膜对细菌基因组dna(b)和质粒(c)的分解效果,分别提取卡那霉素抗性大肠杆菌的基因组dna和质粒,并将浓度均调至200ng/μl,取500μl分别与对照pet膜、pil膜及pil
‑
ce膜作用,不同时间取样进行琼脂糖凝胶电泳;(d)卡那霉素抗性基因(kan
r
)在大肠杆菌质粒上的位置以及pcr扩增kan
r
基因以进一步检测pil
‑
ce膜对耐药基因的分解效果)。
[0036]
图8为本发明中实施例1的pil
‑
ce膜对细菌耐药基因的分解效果图((a)代表性图像显示耐药菌的菌液(100μl,~108cfus)分别滴加在对照pet膜、pil膜、pil
‑
ce膜上作用4h;(b)耐甲氧西林金黄色葡萄球菌的耐药基因meca与(c)卡那霉素抗性大肠杆菌的耐药基因kan
r
的pcr产物的琼脂糖凝胶电泳图)。
[0037]
图9为本发明的实施例1的pil
‑
ce膜对小鼠皮肤伤口模型中细菌及其耐药基因的体内效果评价图((a)伤口治疗实验的代表性图像,选用雄性balb/c小鼠(6
‑
8周),在背部制造皮肤开放性伤口(1.0cm2),选择mrsa和卡那霉素抗性大肠杆菌两种耐药细菌造模;每个伤口接种细菌溶液(100μl,~108cfus),分别覆盖无菌纱布、pil膜、pil
‑
ce膜,4h后取下敷料浸泡在无菌pbs溶液中,进一步分析敷料浸泡液中细菌及其耐药基因含量;琼脂平板图片
显示测试敷料的浸泡液中mrsa和大肠杆菌(kan
r
)的菌落数目;(b)接种具有生物发光活性的mrsa的伤口图,不同颜色表示细菌生物发光信号的强度,最上面的的深灰色代表细菌信号最高,中间的灰色降低,下面的黑色为低信号;(c,d)pcr分析显示测试敷料对伤口细菌中的耐药基因meca(mrsa)和kan
r
(e.coli)的降解作用)。
具体实施方式
[0038]
本发明通过合成咪唑基聚离子液体
‑
铈纳米静电纺丝膜,提供一种阻断耐药性传播的新型抗菌敷料。
[0039]
<咪唑基聚离子液体
‑
铈抗菌敷料>
[0040]
本发明的咪唑基聚离子液体
‑
铈抗菌敷料的结构通式为:
[0041][0042]
式中,n取0
‑
14中的整数,a为no3‑
,x、y和z的数值根据原料单体的使用量进行调整。
[0043]
咪唑基离子液体中无论a为cl
‑
、br
‑
、i
‑
其中任何一种,在最后配位过程都需要浸入硝酸铈铵溶液后都会变成no3‑
,所以a并不仅限于为no3‑
。
[0044]
优选地,本发明的咪唑基聚离子液体
‑
铈抗菌敷料的结构通式为:
[0045][0046]
其中,聚离子液体(poly(ionic liquid),pil)是由阴离子、阳离子基团构成的离子液体单体聚合而成的一类聚合物,兼具离子液体和聚合物的优良性能。近年来,由于其分子可设计性和化学稳定性,在抗菌材料领域引起了广泛关注。其抗菌原理包括:pil的阳离子基团可以通过静电作用吸附带负电荷的细菌细胞壁,而pil的亲脂性疏水片段可插入细菌膜的磷脂双分子层,破坏细菌结构完整性,导致微生物死亡。其中,咪唑阳离子类pil对人类细胞毒副作用小,具有更广泛的生物医用前景。
[0047]
人工核酸酶利用多核金属配合物裂解dna等核酸分子中的磷酸二酯键,主要包括过渡金属和稀土元素,例如cu(ii)、cr(iii)、zn(ii)和ce(iv)。其中,铈(ce)配合物具有优良的dna分解催化效率和生物相容性。
[0048]
鉴于此,本发明通过合成咪唑类聚离子液体抗菌材料,并采用静电纺丝技术制备成纳米抗菌纺丝膜,再与ce(iv)离子配合获得相应的pil
‑
ce膜,从而将核酸模拟酶结构整合到有形的抗菌材料中,实现杀菌及分解耐药基因的双重功能,研制一种阻断耐药性传播的新型抗菌敷料应用于临床耐药菌感染的创面。
[0049]
<咪唑基聚离子液体
‑
铈抗菌敷料的制备方法>
[0050]
本发明的咪唑基聚离子液体
‑
铈抗菌敷料的制备方法包括如下步骤:
[0051]
(1)将咪唑基离子液体、金属配体单体、丙烯腈和引发剂溶于n,n
‑
二甲基甲酰胺中,在50
‑
80℃下聚合8
‑
15h;聚合完成后用丙酮将聚合产物沉析得到共聚物,洗涤,烘干备用;
[0052]
(2)将共聚物和聚丙烯腈溶于n,n
‑
二甲基甲酰胺中,采用静电纺丝技术,得到咪唑基聚离子液体纺丝膜;
[0053]
(3)将咪唑基聚离子液体纺丝膜浸入硝酸铈铵溶液中进行络合反应,得到咪唑基聚离子液体
‑
铈抗菌敷料。
[0054]
具体地,如图1所示,本发明通过合成咪唑类聚离子液体(pil)抗菌材料,并采用静电纺丝技术制备成纳米抗菌纺丝膜,再与ce(iv)离子配合获得相应的pil
‑
ce膜。从而将核酸模拟酶结构整合到有形的抗菌材料中,实现杀菌及分解抗生素耐药基因(args)的双重功能,研制一种阻断耐药性传播的新型抗菌敷料。
[0055]
在步骤(1)中,引发剂为偶氮二异丁腈。
[0056]
在步骤(1)中,金属配体单体为2,2'
‑
(5
‑
丙烯酰胺基
‑1‑
羧甲基)己二酸(aanta)。
[0057]
在步骤(2)中,静电纺丝的工艺参数为:流速为0.5
‑
1.5ml/h,电压为10
‑
20kv,纺丝时间可以为5
‑
12h,优选为10h,纺丝时间越长,得到的膜越厚;接收距离可以为8
‑
20cm,优选为14cm。
[0058]
在步骤(3)中,络合反应的时间为2
‑
5h,优选为2h,此时已经能够完全配位,延长时间也不会提高性能。络合反应的温度为20
‑
50℃。
[0059]
<咪唑基聚离子液体
‑
铈抗菌敷料的应用>
[0060]
本发明的咪唑基聚离子液体
‑
铈抗菌敷料在皮肤创面感染中得以应用,可用于临床伤口护理,如治疗烧伤、烫伤、刀伤、刺伤、碰伤、手术创口、褥疮、糖尿病足溃疡等,在阳离子聚合物杀灭细菌的同时,通过其dnase模拟酶活性分解细菌的耐药基因,从而阻断耐药性的进一步传播,是一种新型优良的医用抗菌敷料。
[0061]
以下结合实施例对本发明作进一步的说明。
[0062]
实施例1:
[0063]
本实施例的咪唑基聚离子液体
‑
铈抗菌敷料(简称pil
‑
ce膜)的制备方法包括如下步骤:
[0064]
如图2所示,通过合成(a)金属配体单体aanta、(b)咪唑类离子液体单体[hvim][br],再将两者经自由基聚合获得(c)共聚物p(il
‑
co
‑
aanta
‑
co
‑
an)。具体地,
[0065]
(1)咪唑基离子液体单体[hvim][br]的制备:将1
‑
乙烯基咪唑(4.0g,42mmol)和1
‑
溴己烷(7.01g,42mmol)溶解于30ml的乙腈中,并在室温下搅拌72h;将反应后的混合物滴入乙酸乙酯中析出得到反应产物,即为溴代3
‑
己基
‑1‑
乙烯基咪唑([hvim][br]),并用乙酸乙酯重复洗涤三次,以去除未反应的原料。
[0066]
(2)金属配体单体aanta的制备:首先,将溴乙酸(8.34g,60mmol)与n
‑
羰基苄氧基
‑
l
‑
赖氨酸(cbz
‑
lys,8.40g,30mmol)分别溶解于30ml与40ml浓度为2m的氢氧化钠溶液中;再将cbz
‑
lys溶液在冰浴条件下缓慢滴入溴乙酸溶液中,然后在室温下搅拌12h;搅拌完后将溶液加热至70℃;待冷却至室温后,滴入30ml浓度为1m的盐酸溶液,得到白色沉淀,即为n2,n2‑
二(羧基甲基)
‑
n6‑
cbz
‑
l
‑
赖氨酸(cbz
‑
nta);
[0067]
其次,将1.2g含量为5%的钯碳和cbz
‑
nta(6.0g,15mmol)加入到100ml的甲醇中,在氢气氛围下搅拌过夜;将得到的混合物室温旋蒸下除去甲醇,然后再将得到的产物溶解于水中,并滤去不溶物,得到溶液;将溶液放置于
‑
20℃冰箱中,滴入乙醇,直到析出白色沉淀,即为6
‑
氨基
‑2‑
(双(羧甲基)
‑
氨基)己酸(nh2‑
nta);
[0068]
最后,将丙烯酰氯(0.30g,3.3mmol)溶解在15ml甲苯中,然后在冰浴条件下缓慢滴加到27ml溶解含有nh2‑
nta(0.79g,3.0mmol)浓度为0.4m的氢氧化钠溶液中;将所得溶液在室温下搅拌12h,然后再在室温下旋蒸以除去甲苯;剩余的水溶液,用阳离子交换树脂(dowex50wx8)除去钠离子后,冷冻干燥,最终得到0.474g白色固体产物,产率为50%,即为2,2'
‑
(5
‑
丙烯酰胺基
‑1‑
羧甲基)己二酸(aanta)。
[0069]
(3)咪唑基聚离子液体共聚物p(il
‑
co
‑
aanta
‑
co
‑
an)的制备:将咪唑基离子液体(1.0g,3.86mmol)、金属配体单体(0.81g,2.56mmol)、丙烯腈(0.34g,6.41mmol)和偶氮二异丁腈(aibn,0.012g,0.07mmol,作为引发剂)溶于4ml的n,n
‑
二甲基甲酰胺中,在70℃(安瓿瓶内,氮气下)聚合12h;聚合完成后用丙酮将聚合产物沉析得到共聚物p(il
‑
co
‑
aanta
‑
co
‑
an),即聚(3
‑
丁基
‑1‑
乙烯基咪唑
‑
co
‑
2,2
’‑
(5
‑
丙烯酰胺基
‑1‑
羧甲基)己二酸
‑
co
‑
丙烯腈),洗涤三次,烘干备用。
[0070]
(4)咪唑基聚离子液体纺丝膜的制备:将0.85g共聚物与0.26g聚丙烯腈(m
w
=15000)溶于8ml的n,n
‑
二甲基甲酰胺中,采用静电纺丝技术制成纳米纤维膜(即咪唑基聚离子液体纺丝膜);静电纺丝的工艺参数:流速为0.5ml/h,电压为10kv,纺丝时间为10h,接收距离为14cm。
[0071]
(5)咪唑基聚离子液体
‑
铈纺丝膜的制备:将咪唑基聚离子液体纺丝膜(3.0cm2)浸入60ml、0.009mmol/ml的硝酸铈铵溶液(ce(nh4)2(no3)6)中进行络合反应,反应时间为2h,反应的温度为20℃,得到咪唑基聚离子液体
‑
铈抗菌敷料(又称pil
‑
ce膜)。
[0072]
实施例2:
[0073]
本实施例的咪唑基聚离子液体
‑
铈抗菌敷料(简称pil
‑
ce膜)的制备方法与实施例1基本一致,不同的是:步骤(3)中,金属配体单体的添加量为0.60g,1.8mmol。
[0074]
实施例3:
[0075]
本实施例的咪唑基聚离子液体
‑
铈抗菌敷料(简称pil
‑
ce膜)的制备方法与实施例1基本一致,不同的是:步骤(3)中,金属配体单体的添加量为1.04g,3.3mmol。
[0076]
对比例:
[0077]
本对比例的咪唑基聚离子液体纺丝膜的制备方法与实施例不同的是:未进行步骤(5),即未将咪唑基聚离子液体纺丝膜浸入硝酸铈铵溶液中,从而得到咪唑基聚离子液体纺丝膜(pil膜)。
[0078]
<实验>
[0079]
实施例1至实施例3的三种pil
‑
ce膜进行体外抗菌性测试:选择金黄色葡萄球菌(s.aureus)与大肠杆菌(e.coli),将细菌菌株分别接种于液态luria
‑
bertani(lb)培养基中,置于恒温摇床(37℃、150rpm)过夜培养至指数生长阶段。取100μl细菌悬液(细菌数约为106)滴至灭菌的pil
‑
ce膜及对照pet膜上(均为1.0cm2),置于恒温培养箱(37℃,90%相对湿度)。不同接触时间下,分别取10μl细菌悬液均匀涂布在lb琼脂平板上,将平板置于37℃恒温培养箱中孵育24h,观察计数菌落形成单位(cfu),并据此评价材料的抗菌性能。其结果如图3所示。
[0080]
将实施例1及其对比例的产品分别进行如下实验:
[0081]
(1)材料结构表征实验:对pil膜与pil
‑
ce膜进行系列结构表征,如ftir、xps、sem、tem、纺丝纤维直径、eds、元素分布等测试,其结果如图4所示。
[0082]
(2)体外抗菌实验:选择金黄色葡萄球菌(s.aureus)、大肠杆菌(e.coli)、耐甲氧西林金黄色葡萄球菌(mrsa)和卡那霉素抗性大肠杆菌(e.coli,kan
r
)四种病原菌,对本发明中纺丝膜产品进行抗菌性能测试。包括以下两种方法:
[0083]
菌落计数法:将上述细菌菌株分别接种于lb培养基中,置于恒温摇床(37℃、150rpm)过夜培养至指数生长阶段。将100μl细菌悬液(细菌数约为106)滴至灭菌的pil膜、pil
‑
ce膜、及对照pet膜上(均为1.0cm2),置于恒温培养箱(37℃,90%相对湿度)。不同接触时间下,分别取10μl细菌悬液均匀涂布在lb琼脂平板上,将平板置于37℃恒温培养箱中孵育24h,计数菌落形成单位,并据此计算材料相应的细菌存活率,其结果如图5a
‑
5d所示。
[0084]
活/死细菌染色法:采用绿色的syto和红色的碘化丙啶(pi)染料分别染色活菌和死菌,再用荧光显微镜观察细菌的形态及荧光染色情况,其结果如图5e
‑
5f所示。
[0085]
(3)双(对硝基苯基)磷酸酯(bnpp)的降解实验:将pil
‑
ce膜与pil膜(均为1.0cm2)分别与等体积的5mm的bnpp溶液(3ml)及pbs溶液作用,空白对照为不添加膜材料的bnpp溶液,观察12h作用过程中溶液的颜色变化,并记录其紫外光谱,其结果如图6a
‑
6c所示。同样根据紫外光谱变化,观察pil
‑
ce膜分解不同浓度bnpp溶液的初始速率,其结果如图6d所示。还将进行pil
‑
ce膜分解bnpp的循环使用性能的测试,其结果如图6f所示。
[0086]
(4)提取的细菌基因组dna与质粒的降解实验:分别提取卡那霉素抗性大肠杆菌的基因组dna和质粒,并将浓度均调至200ng/μl;取500μl分别与对照pet膜、pil膜及pil
‑
ce膜(均为1.0cm2)作用,不同时间取样进行琼脂糖凝胶电泳;根据表1中的引物,采用pcr法扩增kan
r
基因,进一步观察pil
‑
ce膜对质粒上的耐药基因kan
r
的分解效果,结果如图7a
‑
7d所示。
[0087]
表1聚合酶链反应(pcr)法检测细菌耐药基因所用的引物
[0088][0089]
(5)细菌耐药基因的分解实验:将100μl耐药菌mrsa(meca)或e.coli(kan
r
)的细菌悬液(细菌数约为106),分别滴至pil膜、pil
‑
ce膜、及对照pet膜上(均为1.0cm2),置于恒温培养箱(37℃,90%相对湿度)。接触4h后,取1μl细菌悬液,采用表1中的引物,进行聚合酶链反应(pcr)扩增,并用1.5%琼脂糖凝胶电泳检测耐药基因的含量,其结果如图8所示。
[0090]
(6)细胞毒性实验:取灭菌的pil膜与pil
‑
ce膜(均为1.0cm2),与人成纤维细胞(~3
×
104)共培养48h,采用噻唑蓝(mtt)法,分光光度计测试490nm的吸收度来评估细胞活性,计算细胞相对生长率(rgr),其结果如表2所示。
[0091]
(7)溶血性实验:取灭菌的pil膜与pil
‑
ce膜(均为1.0cm2),与2%人红细胞共培养3h,然后分光光度计测试上清液576nm的吸收值,以2%的triton和pbs处理的红细胞悬液分别作为阳性对照和阴性对照,计算溶血率,其结果如表2所示,用mtt法和溶血法分别检测材料对人成纤维细胞的细胞毒性和人红细胞的血液相容性。
[0092]
表2pil
‑
ce膜与pil膜的细胞相对生长率(rgr)和溶血率
[0093][0094]
(8)小鼠皮肤伤口治疗实验:
[0095]
选择6
‑
8周龄雄性balb/c小鼠,腹腔注射戊巴比妥钠(50mg/kg)进行麻醉,在小鼠背部制造全层皮肤开放性伤口,分别选择mrsa或卡那霉素抗性大肠杆菌两种耐药细菌造模;每个伤口接种细菌溶液(100μl,~108cfus),分别覆盖无菌纱布、pil膜、pil
‑
ce膜(均为1.0cm2);4h后取下敷料浸泡在无菌pbs溶液中,进一步分析敷料浸泡液中细菌及其耐药基因含量;采用lb琼脂平板进行菌落计数,并根据伤口细菌生物荧光强度变化,比较三种敷料的抗菌性能,其结果如图9a
‑
9b所示。同时根据表1中的引物进行pcr分析,测试敷料对伤口细菌中的耐药基因meca(mrsa)和kan
r
(e.coli)的降解作用,其结果如图9c
‑
9d所示。
[0096]
实验结果:
[0097]
实施例1至实施例3的体外抗菌效果:如图3a所示,实施例1至实施例3及其对比例产品纺丝膜均匀致密柔软,可剪裁为任意形状;其中pil膜为白色,pil
‑
ce膜为浅灰色;如图3b所示,细菌与三种pil
‑
ce膜接触4h后,实施例1与实施例2作用下金葡菌和大肠杆菌都基本被杀灭,而实施例3中两种细菌仍存在较多菌落,说明实施例1与实施例2具有同样高效的抗菌性能,而实施例3的抗菌性较弱。实施例1至实施例3的材料组成差别在于金属配体单体含量,从低到高依次为:实施例2<实施例1<实施例3,这意味着实施例3较弱的抗菌性与较多的金属配体单体含量有关。由于本发明开发的是抗菌敷料首先需要对细菌尽可能杀灭破坏,才能充分释放出细菌内部的耐药基因,进而利用dnase模拟酶活性结构,分解死细菌释
放的耐药基因。本发明中实施例1金属配体单体含量高于实施例2,却也能高效杀灭细菌,所以我们选择实施例1进行后续的体内外实验验证。
[0098]
实施例1及其对比例产品的实验结果如下所述:
[0099]
(1)材料结构表征结果:如图4a可见,实施例1及其对比例产品纺丝膜均匀致密,pil膜为白色,pil
‑
ce膜为浅灰色;首先用傅里叶红外光谱(ftir)对膜的化学结构进行了表征(图4b)。1375cm
‑1与1550cm
‑1两个峰来源于羧基的伸缩振动峰,而1627cm
‑1的峰对应的是咪唑阳离子,2239cm
‑1对应腈基的峰;当纺丝配位了ce金属离子后,1722cm
‑1吸收峰降低,这证明了ce的成功配位;此外,其它的吸收峰并没有发生变化,这说明ce的配位并不会破坏pil纺丝原有的化学结构。图4c中xps谱图中900ev的峰对应ce的3d轨道峰,这证明了ce金属元素的存在。图4d
‑
4f的sem图显示,pil膜、泡水后pil膜与pil
‑
ce膜的纺丝粗细均匀,直径都约为430nm;其中pil
‑
ce膜与泡水后pil膜的纺丝都存在轻微的褶皱,提示这与配位过程中水溶液浸泡造成纺丝纤维的溶胀有关。图4g的能量色散光谱(eds)数据显示,pil
‑
ce多了ce元素的存在,而少了br元素,这是因为经硝酸铈铵溶液配位后,过量的硝酸根阴离子通过阴离子交换,取代了原来pil中的br离子。从图4h的pil
‑
ce元素分布图可见,ce离子均匀地分布在纺丝表面。上述结果证实成功制备了pil
‑
ce纳米纤维膜。
[0100]
(2)体外抗菌效果:pil膜与pil
‑
ce膜对被测试的四种病原菌(金黄色葡萄球菌、大肠杆菌、耐甲氧西林金黄色葡萄球菌和卡那霉素抗性大肠杆菌)均表现出高效的抗菌性能。如图5a
‑
5d所示,与pil膜和pil
‑
ce膜接触4h后,存活细菌几乎完全消失;对两株耐药菌e.coli(kan
r
)和mrsa抗菌过程的动态变化进一步展示了本发明中纺丝膜产品的抗菌过程;图5e
‑
5f中两株耐药菌的活/死细菌染色结果显示,作用4h后,pil膜和pil
‑
ce膜组均出现pi染色的死细菌信号,而对照pet膜上均是syto染色的活细菌信号,这与菌落形成法测定的抗菌性一致,说明含ce的pil膜与pil膜均具有高效杀灭耐药菌的性能。
[0101]
(3)bnpp分解性能:bnpp与dna一样存在磷酸酯键,常用作测试dnase模拟酶活性的底物。如图6a所示,当一个分子bnpp的磷酸酯键被分解时,会产生两分子的对硝基苯酚;对硝基苯酚溶液呈黄色,在400nm处有最大的吸收峰,通过对溶液颜色及吸收峰的检测,可反映被分解的磷酸酯键,从而对pil
‑
ce膜的dnase模拟酶活性进行定量分析。图6a中右上角插入的图片可见,相对于空白对照组与pil组,pil
‑
ce膜与bnpp共同作用12h后溶液的颜色变成深灰色,这是因为pil
‑
ce膜分解bnpp产生了对硝基苯酚所致。图6b
‑
6c可见,与pil组相比,随着与bnpp作用时间的延长,pil
‑
ce组的400nm吸收峰逐渐增大,这意味着pil
‑
ce有着持续分解磷酸酯键的能力。图6d显示,随着底物浓度升高,pil
‑
ce膜分解bnpp的初始速率呈快速升高趋势;当底物浓度到达1mm后,分解速率升高不再明显,这种速率的变化符合酶动力学模型特征,进一步提示pil
‑
ce膜具有dnase模拟酶的活性。图6e可见pil
‑
ce膜的五次重复使用,分解效率仍可达90%,这说明pil
‑
ce膜具有较好的可回收利用性能。
[0102]
(4)提取的细菌基因组dna与质粒的降解性能:dna链是由若干个脱氧核苷酸通过3',5'
‑
磷酸二酯键连接而成,pil
‑
ce膜可通过催化磷酸二酯键的降解破坏dna(图7a)。图7b
‑
7c中琼脂糖凝胶电泳图可见,60min时pil
‑
ce组的dna条带均消失,而其它组的相应条带依然存在。图7d进一步展示了所提取大肠杆菌质粒上耐药基因kan
r
长度信息,采用pcr扩增kan
r
基因产物,琼脂糖凝胶电泳图可见,30min时pil
‑
ce组的kan
r
基因产物条带便可消失,而其它组的相应条带依然存在,说明pil
‑
ce膜对提取的细菌质粒上的耐药基因也具有快速高
效的分解性能。此外,图7b
‑
7d中pil组的dna条带强度也有所降低,这考虑与咪唑阳离子对带负电荷的dna分子的静电吸附有关。
[0103]
(5)细菌耐药基因的降解效果:与两株耐药菌e.coli(kan
r
)和mrsa作用4h后,如图8琼脂糖凝胶电泳结果显示,pil
‑
ce膜可使耐药基因(meca和kan
r
)的pcr产物条带消失,而pil膜与对照组中的耐药基因仍存在,结合体外抗菌测试的结果,说明pil
‑
ce膜能够杀灭破坏细菌,且具有分解细菌耐药基因的效果。
[0104]
(6)生物相容性测试结果:良好的生物相容性对于医用材料必不可少的,如表2所示产品膜对人成纤维细胞的相对生长速率(rgr)和对人红细胞的溶血率,pil
‑
ce膜的rgr值超过85%(>75%),而溶血率仅为0.43%(<5%),说明材料产品膜对人成纤维细胞的毒性低,对人红细胞几乎不溶血,pil
‑
ce膜具有优良的生物相容性。
[0105]
(7)小鼠皮肤伤口模型中细菌及其耐药基因的体内效果:如图9a所示,与两株耐药菌e.coli(kan
r
)和mrsa作用4h后,与对照组相比,pil膜和pil
‑
ce膜两组细菌菌落基本消失,这与其体外抗菌性一致。虽然细菌感染4h创面无肉眼可见的变化,但图9b荧光图片显示,pil膜和pil
‑
ce膜组治疗4h时感染伤口的mrsa荧光信号几乎消失;而对照组荧光信号却明显增强,且分布于整个创面,说明伤口细菌增多。上述结果进一步证实了pil膜材料的体内抗菌性能。同时,图9c
‑
9d琼脂糖凝胶电泳显示,两种耐药细菌感染伤口的模型中,pil
‑
ce组耐药基因(meca和kan
r
)的pcr产物条带均消失,而pil膜与对照组中的耐药基因仍存在,这进一步证实了pil
‑
ce膜在杀灭伤口细菌的同时,还能分解死细菌释放的耐药基因,从而阻断细菌耐药性的传播。
[0106]
上述对实施例的描述是为了便于该技术领域的普通技术人员能理解和使用本发明。熟悉本领域技术人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中,而不必经过创造性的劳动。因此,本发明不限于上述实施例。本领域技术人员根据本发明的原理,不脱离本发明的范畴所做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1