人工椎间盘组织及构建、制备方法、计算机可读存储介质、设备
本发明属于椎间盘技术领域,特别是涉及人工椎间盘组织及构建、制备方法、计算机可读存储介质、设备。
背景技术:
健康的椎间盘在椎骨活动时可吸收和分散冲击,利于脊柱运动。现在多数学者认为腰椎退行性改变的始动因素为椎间盘,而随着年龄的增加,椎间盘逐渐退化,进而出现骨质增生、骨赘,韧带肥厚、钙化等情况,椎间盘退化是后续结构退化的始动因素,椎间盘自体无法再生。
目前针对腰椎退行性疾病中老化的椎间盘,多采用椎间盘清理,椎间植骨融合手术,也就是切除椎间盘的大部分,填塞骨头,使上下两个椎体骨长在一起。其次可以采用人工椎间盘置换的方式。前种方式丧失了该脊柱单元的活动度,后种方式价格较贵,同时人工椎间盘多为金属材质,磨损碎屑等可引起异物反应。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供人工椎间盘组织及构建、制备方法、计算机可读存储介质、设备。所述人工椎间盘组织从上至下依次包括第一软骨板、椎间盘体部和第二软骨板,所述人工椎间盘组织还包括髓核单元,所述椎间盘体部设有容纳所述髓核单元的髓核空腔。本发明应用可有效替换退化椎间盘组织,提升椎间盘活性,延缓腰椎老化,延长椎间盘使用寿命;同时降低腰椎间盘切除,椎间融合、造成的椎间盘功能缺失,脊柱运动单元活动度下降,以及椎间盘金属假体置换的相关问题。
为实现上述目的及其他相关目的,本发明第一方面提供一种人工椎间盘组织,从上至下依次包括第一软骨板、椎间盘体部和第二软骨板,所述人工椎间盘组织还包括髓核单元,所述椎间盘体部设有容纳所述髓核单元的髓核空腔。
本发明第二方面提供上述人工椎间盘组织的构建方法,其特征在于,包括如下步骤:
1)构建腰椎模型;
2)确定切除范围,在所述腰椎模型上模拟切除得到切除后的腰椎模型,并以切除部分作为初始人工椎间盘组织模型;
3)以初始人工椎间盘组织模型的外轮廓为基准,构建第一软骨板模型、椎间盘体部模型、第二软骨板模型和髓核单元模型,构建椎间盘体部模型设有容纳髓核单元模型的髓核空腔。
本发明第三方面提供上述人工椎间盘组织的制备方法,包括:根据上述人工椎间盘组织模型的构建方法构建获得人工椎间盘组织模型,制备人工椎间盘组织。
本发明第四方面提供一种计算机可读存储介质,其上存储有计算机程序,所述程序被处理器执行时实现上述人工椎间盘组织模型的构建方法的步骤,或如上述人工椎间盘组织的制备方法的步骤。
本发明第五方面提供一种设备,包括:处理器和存储器,所述存储器用于存储计算机程序,所述处理器用于执行所述存储器存储的计算机程序,以使所述设备执行如上述人工椎间盘组织模型的构建方法的步骤,或如上述人工椎间盘组织的制备方法的步骤。
如上所述,本发明至少具有以下有益效果之一:
1)本发明通过组织工程学技术,制造具有生物活性的人工椎间盘组织,促进椎间盘再生,延长椎间盘使用寿命,延缓椎间盘及相关组织退变,解决目前椎间盘组织无法进行生物活性假体置换的问题。
2)本发明应用可有效替换退化椎间盘组织,提升椎间盘活性,延缓腰椎老化,延长椎间盘使用寿命;同时降低腰椎间盘切除,椎间融合、造成的椎间盘功能缺失,脊柱运动单元活动度下降,以及椎间盘金属假体置换的相关问题。
3)本发明降低了腰椎退化疾病的治疗费用,解决脊柱退化引起的疼痛、活动障碍等问题。
附图说明
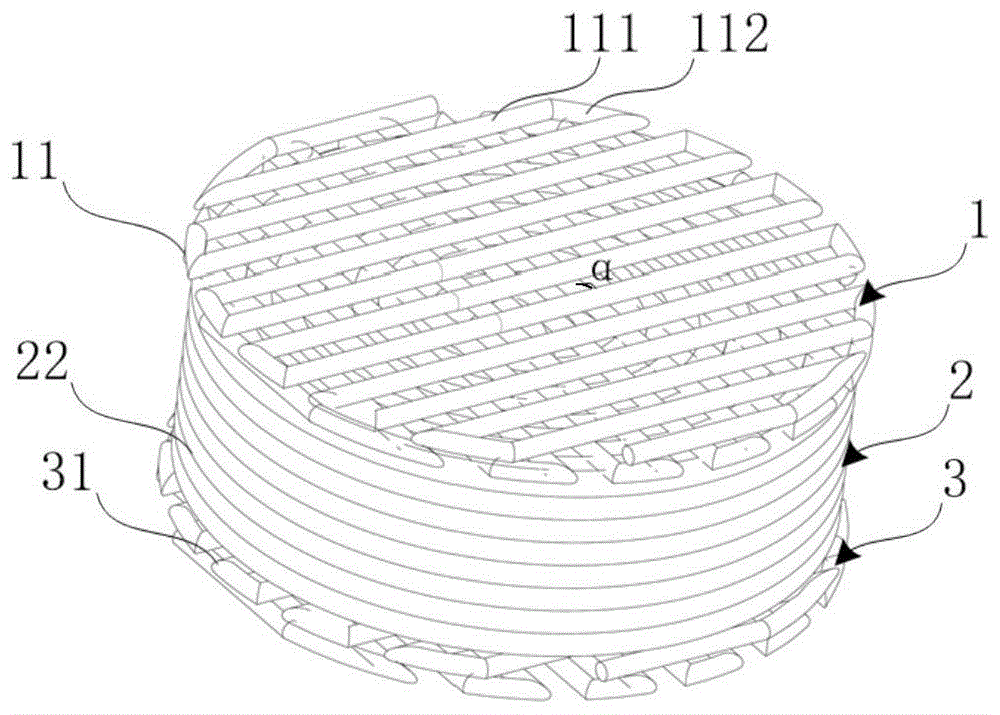
图1显示为本发明人工椎间盘组织的结构示意图。
图2显示为本发明人工椎间盘组织中第二软骨板的结构示意图。
图3显示为本发明人工椎间盘组织中椎间盘体部、第二软骨板和髓核单元的结构示意图。
图4显示为图1人工椎间盘组织剖开后的结构示意图。
图5显示为本发明人工椎间盘组织中髓核单元的结构示意图。
附图标记:
1第一软骨板
11第一软骨板层
111第一软骨单元
112第一连接单元
2椎间盘体部
21髓核空腔
22椎间盘体部层
221椎间盘体部件
2211第一椎间盘体部单元
2212第二椎间盘体部单元
3第二软骨板
31第二软骨板层
311第二软骨单元
312第二连接单元
4髓核单元
具体实施方式
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效。
请参阅图1至图5。须知,本说明书所附图式所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本发明所能产生的功效及所能达成的目的下,均应仍落在本发明所揭示的技术内容得能涵盖的范围内。同时,本说明书中所引用的如“上”、“下”、“左”、“右”、“中间”及“一”等的用语,亦仅为便于叙述的明了,而非用以限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容下,当亦视为本发明可实施的范畴。
一种人工椎间盘组织,如图1所示,从上至下依次包括第一软骨板1、椎间盘体部2和第二软骨板3,所述人工椎间盘组织还包括髓核单元4,所述椎间盘体部2设有容纳所述髓核单元4的髓核空腔21。
该人工椎间盘组织可以对患者缺损的椎间盘组织进行替换,具有该脊柱单元的活动度。
在一个优选的实施例中,所述人工椎间盘组织整体呈圆柱形。
在一个优选的实施例中,如图1所示,所述第一软骨板1包括若干层的第一软骨板层11。第一软骨板1模拟椎间盘椎体连接处软骨层。
在一个优选的实施例中,如图1所示,所述第一软骨板层11包括若干平行的第一软骨单元111。
在一个优选的实施例中,相邻层的第一软骨单元111交叉角度α为30~90°。
在一个优选的实施例中,在同一第一软骨板层的相邻的第一软骨单元的材料分别为高分子聚合物和混有软骨细胞和软骨细胞生长因子的水凝胶。高分子聚合物提供所需的力学强度,混有软骨细胞和软骨细胞生长因子的水凝胶使得人工椎间盘组织具有生物活性,促进椎间盘再生,延长椎间盘使用寿命,延缓椎间盘及相关组织退变。
在一个优选的实施例中,所述高分子聚合物选自聚己内酯、聚乳酸-羟基乙酸共聚物和聚乳酸中的至少一种。
在一个优选的实施例中,所述软骨细胞生长因子选自骨形态发生蛋白-4/7和联合转录生长β中的一种或多种。
在一个优选的实施例中,软骨细胞的密度为5000~8000个/mm3。
在一个优选的实施例中,软骨细胞生长因子的浓度为10~100000ng/ul。
在一个优选的实施例中,相邻的第一软骨板层的材料分别为高分子聚合物和混有软骨细胞和软骨细胞生长因子的水凝胶。高分子聚合物提供所需的力学强度,混有软骨细胞和软骨细胞生长因子的水凝胶使得人工椎间盘组织具有生物活性,促进椎间盘再生,延长椎间盘使用寿命,延缓椎间盘及相关组织退变。
在一个优选的实施例中,所述高分子聚合物选自聚己内酯、聚乳酸-羟基乙酸共聚物和聚乳酸中的至少一种。
在一个优选的实施例中,所述软骨细胞生长因子选自骨形态发生蛋白-4/7和联合转录生长β中的一种或多种。
在一个优选的实施例中,软骨细胞的密度为5000~8000个/mm3。
在一个优选的实施例中,软骨细胞生长因子的浓度为10~100000ng/ul。
在一个优选的实施例中,如图1所示,所述第一软骨板层11还包括第一连接单元112,所述第一连接单元112连接相邻的第一软骨单元111。
在一个优选的实施例中,所述第一连接单元112的材料为高分子聚合物。
在一个优选的实施例中,所述高分子聚合物选自聚己内酯、聚乳酸-羟基乙酸共聚物和聚乳酸中的至少一种。
在一个优选的实施例中,如图2所示,所述第二软骨板3包括若干层的第二软骨板层31。第二软骨板模拟椎间盘椎体连接处软骨层。
在一个优选的实施例中,如图2所示,所述第二软骨板层31包括若干平行的第二软骨单元311。
在一个优选的实施例中,相邻层的第二软骨单元311交叉角度β为30~90°。
在一个优选的实施例中,在同一第二软骨板层的相邻的第二软骨单元的材料分别为高分子聚合物和混有软骨细胞和软骨细胞生长因子的水凝胶。高分子聚合物提供所需的力学强度,混有软骨细胞和软骨细胞生长因子的水凝胶使得人工椎间盘组织具有生物活性,促进椎间盘再生,延长椎间盘使用寿命,延缓椎间盘及相关组织退变。
在一个优选的实施例中,所述高分子聚合物选自聚己内酯、聚乳酸-羟基乙酸共聚物和聚乳酸中的至少一种。
在一个优选的实施例中,所述软骨细胞生长因子选自骨形态发生蛋白-4/7和联合转录生长β中的一种或多种。
在一个优选的实施例中,软骨细胞的密度为5000~8000个/mm3。
在一个优选的实施例中,软骨细胞生长因子的浓度为10~100000ng/ul。
在一个优选的实施例中,相邻的第二软骨板层的材料分别为高分子聚合物和混有软骨细胞和软骨细胞生长因子的水凝胶。高分子聚合物提供所需的力学强度,混有软骨细胞和软骨细胞生长因子的水凝胶使得人工椎间盘组织具有生物活性,促进椎间盘再生,延长椎间盘使用寿命,延缓椎间盘及相关组织退变。
在一个优选的实施例中,所述高分子聚合物选自聚己内酯、聚乳酸-羟基乙酸共聚物和聚乳酸中的至少一种。
在一个优选的实施例中,所述软骨细胞生长因子选自骨形态发生蛋白-4/7和联合转录生长β中的一种或多种。
在一个优选的实施例中,软骨细胞的密度为5000~8000个/mm3。
在一个优选的实施例中,软骨细胞生长因子的浓度为10~100000ng/ul。
在一个优选的实施例中,如图3所示,所述第二软骨板层31还包括第二连接单元312,所述第二连接单元312连接相邻的第二软骨单元311。
在一个优选的实施例中,所述第二连接单元312的材料为高分子聚合物。
在一个优选的实施例中,所述高分子聚合物选自聚己内酯、聚乳酸-羟基乙酸共聚物和聚乳酸中的至少一种。
在一个优选的实施例中,如图4所示,所述椎间盘体部2呈圆环空心圆柱的形状,所述髓核空腔21为圆环空心圆柱的空腔。
在一个优选的实施例中,如图1、图3和图4所示,所述椎间盘体部2包括若干层的椎间盘体部层22。椎间盘体部2模拟椎间盘纤维环。
在一个优选的实施例中,如图3和图4所示,所述椎间盘体部层22包括多个呈同心圆排布的椎间盘体部件221。
在一个优选的实施例中,如图4所示,所述人工椎间盘组织在同一椎间盘体部层包括第一椎间盘体部单元2211和第二椎间盘体部单元2212,第一椎间盘体部单元2211的材料为混有成纤维细胞和成纤维细胞生长因子的水凝胶,第二椎间盘体部单元2212的材料为高分子聚合物;每个椎间盘体部层从外至内依次以第一椎间盘体部单元2211和第二椎间盘体部单元2212交替排列。高分子聚合物提供所需的力学强度,混有成纤维细胞和成纤维细胞生长因子的水凝胶使得人工椎间盘组织具有生物活性,促进椎间盘再生,延长椎间盘使用寿命,延缓椎间盘及相关组织退变。
在一个优选的实施例中,最外侧的椎间盘体部单元为混有成纤维细胞和成纤维细胞生长因子的水凝胶。
在一个优选的实施例中,成纤维细胞的密度为4000~6000个/mm3。
在一个优选的实施例中,成纤维细胞生长因子的浓度为10~100000ng/ul。
在一个优选的实施例中,所述高分子聚合物选自聚己内酯、聚乳酸-羟基乙酸共聚物和聚乳酸中的至少一种。
在一个优选的实施例中,如图5所示,所述髓核单元4为鸡蛋的形状。该设计在椎间盘压缩时髓核单元能够变形,压缩去除后能够回弹。该设计使得人工椎间盘组织具有脊柱单元的活动度。
在一个优选的实施例中,所述髓核单元4的材料为水凝胶,包括但不限于gelma。
本发明第二方面提供上述人工椎间盘组织的构建方法,包括如下步骤:
1)构建腰椎模型;
所述腰椎模型通常可以根据ct数据和/或mri数据进行构建,构建过程中可以将数据导入e3d等三维重建设计软件等软件,并进行配准融合,从而构建所述腰椎模型;
2)确定切除范围,在所述腰椎模型上模拟切除得到切除后的腰椎模型,并以切除部分作为初始人工椎间盘组织模型;
确定切除范围时,通常在模型中选定出现高度塌陷,钙化,突出的椎间盘作为切除目标,在模型中确定位置和大小。
3)以初始人工椎间盘组织模型的外轮廓为基准,构建第一软骨板模型、椎间盘体部模型、第二软骨板模型和髓核单元模型,构建椎间盘体部模型设有容纳髓核单元模型的髓核空腔。
在一个优选的实施例中,构建第一软骨板层模型为若干层的第一软骨板层模型,构建第二软骨板模型为若干层的第二软骨板层模型,构建椎间盘体部模型为若干层的椎间盘体部层。
在一个优选的实施例中,构建第一软骨板层模型为若干平行的第一软骨单元模型,构建第二软骨板层模型为若干平行的第二软骨单元模型,构建椎间盘体部层模型为多个呈同心圆排布的椎间盘体部单元模型。
在一个优选的实施例中,构建相邻层的第一软骨单元模型交叉角度α为30~90°。
在一个优选的实施例中,在第一软骨板层模型上构建第一连接单元模型,连接相邻的第一软骨单元模型。
在一个优选的实施例中,构建相邻层的第二软骨单元模型交叉角度β为30~90°。
在一个优选的实施例中,在第二软骨板层模型上构建第二连接单元模型,连接相邻的第二软骨单元模型。
在一个优选的实施例中,构建椎间盘体部模型呈圆环空心圆柱的形状,髓核空腔为圆环空心圆柱的空腔。
在一个优选的实施例中,构建髓核单元模型为鸡蛋的形状。
在一个优选的实施例中,所述构建方法还包括:构建固定单元模型,固定单元模型从椎间盘体部模型的一侧贯穿至另一侧且经过髓核单元模型。
本发明第三方面提供上述人工椎间盘组织的制备方法,所述制备方法包括:根据上述人工椎间盘组织模型的构建方法构建获得人工椎间盘组织模型,制备人工椎间盘组织。
在一个优选的实施例中,通过3d打印制备人工椎间盘组织。
根据上述人工椎间盘组织模型的构建方法构建获得人工椎间盘组织模型,设置打印路径,生成计算机stl文件,然后将文件转移到3d打印机的程序中,开始打印。
一种计算机可读存储介质,其上存储有计算机程序,所述程序被处理器执行时实现如上述人工椎间盘组织模型的构建方法的步骤,或如上述人工椎间盘组织的制备方法的步骤。
所述计算机可读存储介质,本领域普通技术人员可以理解:实现上述各方法实施例的全部或部分步骤可以通过计算机程序相关的硬件来完成。前述的计算机程序可以存储于一计算机可读存储介质中。该程序在执行时,执行包括上述各方法实施例的步骤;而前述的存储介质包括:rom、ram、磁碟或者光盘等各种可以存储程序代码的介质。
一种设备,包括:处理器和存储器,所述存储器用于存储计算机程序,所述处理器用于执行所述存储器存储的计算机程序,以使所述设备执行如上述人工椎间盘组织模型的构建方法的步骤,或如上述人工椎间盘组织的制备方法的步骤。
实施例1
一种人工椎间盘组织,从上至下依次包括第一软骨板1、椎间盘体部2和第二软骨板3,所述人工椎间盘组织还包括髓核单元4,所述椎间盘体部2设有容纳所述髓核单元4的髓核空腔21,所述人工椎间盘组织整体呈圆柱形。
所述第一软骨板1包括2层的第一软骨板层11,所述第一软骨板层11包括多个平行的第一软骨单元111,平行的第一软骨单元的数量根据椎间盘大小确定,相邻层的第一软骨单元111交叉角度α为90°,相邻的第一软骨单元的材料分别为聚己内酯和混有软骨细胞和软骨细胞生长因子的水凝胶,所述软骨细胞生长因子为骨形态发生蛋白-4/7,软骨细胞的密度为5000~8000个/mm3,软骨细胞生长因子的浓度为10~100000ng/ul;所述第一软骨板层11还包括第一连接单元112,所述第一连接单元112连接相邻的第一软骨单元111,所述第一连接单元112的材料为聚己内酯。
所述椎间盘体部2呈圆环空心圆柱的形状,所述髓核空腔21为圆环空心圆柱的空腔,所述椎间盘体部2包括多层椎间盘体部层22,层数根据椎间盘大小确定,所述椎间盘体部层22包括多个呈同心圆排布的椎间盘体部件221,个数根据椎间盘大小确定,所述人工椎间盘组织在同一椎间盘体部层包括第一椎间盘体部单元2211和第二椎间盘体部单元2212,第一椎间盘体部单元2211的材料为混有成纤维细胞和成纤维细胞生长因子的水凝胶,第二椎间盘体部单元2212的材料为高分子聚合物,高分子聚合物为聚己内酯;每个椎间盘体部层从外至内依次以第一椎间盘体部单元2211和第二椎间盘体部单元2212交替排列,最外侧的椎间盘体部单元为混有成纤维细胞和成纤维细胞生长因子的水凝胶,成纤维细胞的密度为5000个/mm3,成纤维细胞生长因子的浓度为400ng/ul。
所述髓核单元4为鸡蛋的形状,所述髓核单元4的材料为水凝胶。
所述第二软骨板3包括2层的第二软骨板层31,所述第二软骨板层31包括多个平行的第二软骨单元311,平行的第二软骨单元的数量根据椎间盘大小确定,相邻层的第二软骨单元311交叉角度β为90°,相邻的第二软骨单元的材料分别为聚己内酯和混有软骨细胞和软骨细胞生长因子的水凝胶,所述软骨细胞生长因子为骨形态发生蛋白-4/7,软骨细胞的密度为5000~8000个/mm3,软骨细胞生长因子的浓度为10~100000ng/ul;所述第二软骨板层31还包括第二连接单元312,所述第二连接单元312连接相邻的第二软骨单元311,所述第二连接单元312的材料为聚己内酯。
上述人工椎间盘组织的制备方法,所述制备方法包括:
1)构建腰椎模型;
所述腰椎模型通常可以根据ct数据和/或mri数据进行构建,构建过程中可以将数据导入e3d等三维重建设计软件等软件,并进行配准融合,从而构建所述腰椎模型;
2)确定切除范围,在所述腰椎模型上模拟切除得到切除后的腰椎模型,并以切除部分作为初始人工椎间盘组织模型;
确定切除范围时,通常在模型中选定出现高度塌陷,钙化,突出的椎间盘作为切除目标,在模型中确定位置和大小。
3)以初始人工椎间盘组织模型的外轮廓为基准,构建第一软骨板模型、椎间盘体部模型、第二软骨板模型和髓核单元模型,构建椎间盘体部模型设有容纳髓核单元模型的髓核空腔;
构建第一软骨板层模型为2层的第一软骨板层模型,构建第二软骨板模型为2层的第二软骨板层模型,构建椎间盘体部模型为多层椎间盘体部层,层数根据椎间盘大小确定。
构建第一软骨板层模型为多个平行的第一软骨单元模型,平行的第一软骨单元模型的数量根据椎间盘大小确定,构建第二软骨板层模型为多个平行的第二软骨单元模型,平行的第二软骨单元模型的数量根据椎间盘大小确定,构建椎间盘体部层模型为多个同心圆排布的椎间盘体部件模型,个数根据椎间盘大小确定。
构建相邻层的第一软骨单元模型交叉角度α为90°。在第一软骨板层模型上构建第一连接单元模型,连接相邻的第一软骨单元模型。构建相邻层的第二软骨单元模型交叉角度β为90°。在第二软骨板层模型上构建第二连接单元模型,连接相邻的第二软骨单元模型。
构建椎间盘体部模型呈圆环空心圆柱的形状,髓核空腔为圆环空心圆柱的空腔。构建髓核单元模型为鸡蛋的形状。
4)通过3d打印制备人工椎间盘组织。
根据上述人工椎间盘组织模型的构建方法构建获得人工椎间盘组织模型,设计打印路径,生成计算机stl文件,然后将文件转移到3d打印机的程序中,开始打印。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!