负载Dox及siLPCAT1的蛋黄脂质纳米药物及其制备方法和应用与流程
本发明属于肿瘤治疗领域,涉及用于食管鳞癌靶向治疗的纳米药物,具体涉及负载dox及silpcat1的蛋黄脂质纳米药物eylns-dox-silpcat1及其制备方法和应用。
背景技术:
食管鳞癌是威胁我国男性生命健康的第5大恶性肿瘤,全球约一半的食管癌发生于中国,主要组织类型为鳞状细胞癌,患者总5年生存率不足20%。同步放化疗仍是目前治疗中晚期食管癌的主要手段,虽然国内外已开展了多项针对食管癌的分子靶向药物临床研究(包括以egfr为靶点的药物西妥昔单抗,tki药物厄洛替尼,以her2受体为靶点的药物曲妥珠单抗,以血管内皮生长因子vegf为靶点的药物贝伐单抗等),但均未取得显著的临床疗效,很大程度地限制了中晚期食管癌的治疗效果,因此,寻求新的食管癌靶向治疗手段仍是目前亟待解决的关键问题。
随着纳米科技的发展,纳米递送系统介导的肿瘤靶向治疗受到广泛关注,其不仅可增加药物的溶解性,降低药物的清除率,最重要的是通过实体瘤的高通透性和滞留效应(epr效应)介导的被动靶向效应及各种修饰介导的主动靶向效应以发挥更为高效的肿瘤抑制作用。
技术实现要素:
本发明的第一个目的在于提供一种负载化学药物dox及小分子核酸制剂silpcat1的蛋黄脂质纳米药物eylns-dox-silpcat1;本发明的第二个目的在于提供蛋黄脂质纳米药物eylns-dox-silpcat1的制备方法;本发明的第三个目的在于提供纳米药物eylns-dox-silpcat1在食管鳞癌治疗方面的应用。
本发明的技术解决方案是:负载dox及silpcat1的蛋黄脂质纳米药物eylns-dox-silpcat1,其特征是:该纳米药物以蛋黄脂质为基础,同时负载化学药物dox及核酸制剂silpcat1。
其中,负载dox及silpcat1的蛋黄脂质纳米药物eylns-dox-silpcat1的制备方法,其特征是该制备方法的具体步骤如下:
(1)预制备蛋黄脂质纳米载体eylns:通过脂质提取试剂盒(cellbiolabs)分别提取需要的蛋黄脂质,提取具体方法依据试剂盒提供步骤进行;将混合脂质装至玻璃安剖瓶中,干燥后加入400μl双蒸水,水浴超声5-10分钟至溶液透亮,获得eylns;
(2)制备蛋黄脂质纳米药物eylns-dox-silpcat1:取3mg预制备的蛋黄脂质纳米载体eylns与33μgpei于室温震荡孵育1小时,15000rpm离心20分钟后加入500μl的双蒸水,每3分钟行水浴超声1次,共3次;然后加入5nmol的silpcat1,震荡孵育30分钟后每2分钟水浴超声1次,共3次;再加入500μgdox,室温孵育30分钟,4℃超声5分钟,15000rpm离心5分钟,沉淀,烘干,得纳米药物eylns-dox-silpcat1。
更进一步的是,所述的混合脂质由卵磷脂pc、鞘磷脂sm、溶血卵磷脂lpc、磷脂酰乙醇胺pe、磷脂酰肌醇pi、磷脂酰甘油pg以质量比75.5:12.7:6.55:4.37:0.54:0.34混合而成。
其中,负载dox及silpcat1的蛋黄脂质纳米药物eylns-dox-silpcat1的应用,其特征是:所述纳米药物在食管鳞癌治疗中的应用。
本发明的优点是:以蛋黄脂质纳米载体eylns为核心,研制了一种同时负载化学药物dox及核酸制剂silpcat1的纳米药物eylns-dox-silpcat1,前期研究数据已证实该纳米药物通过dox与silpcat1的协同效应实现更为高效的食管鳞癌抑制效果。
附图说明
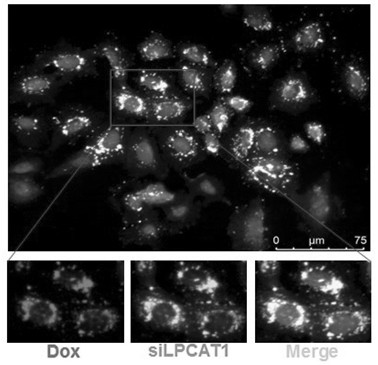
图1为纳米药物eylns-dox-silpcat1共负载dox及silpcat1的鉴定;红色荧光为dox,绿色荧光为fitc-silpcat1;
图2为纳米药物eylns-dox-silpcat1形态及粒径鉴定;a是透射电子显微镜观察纳米药物的形态,b是粒度仪检测其粒径分布约100nm;
图3为纳米药物eylns-dox-silpcat1对食管鳞癌细胞lpcat1表达的影响;食管鳞癌细胞kyse-150分别经pbs、dox、eylns-dox及eylns-dox-silpcat1处理,westernblot法检测lpcat1表达;
图4为纳米药物eylns-dox-silpcat1体外食管鳞癌细胞杀伤活性分析;a是对kyse-150细胞克隆增殖作用影响,b是对kyse-150细胞迁移功能影响,c是对kyse-150细胞侵袭能力的影响;
图5为纳米药物eylns-dox-silpcat1体内抗食管鳞癌活性分析;a是药物在小鼠食管鳞癌异种移植组织中的分布检测,b是活体成像比较纳米药物eylns-dox-silpcat1与dox、eylns-dox的体内抗小鼠食管鳞癌活性,c是小鼠食管鳞癌生长情况,d是各组小鼠食管鳞癌瘤体影像。
具体实施方式
下面结合实施例进一步说明本发明的技术解决方案,但不能理解为是对技术方案的限制,在此基础上的适应性改进皆属于本发明的保护范围。
1、预制备蛋黄脂质纳米载体eylns:通过脂质提取试剂盒(cellbiolabs)分别提取需要的蛋黄脂质,提取具体方法依据试剂盒提供步骤进行;将混合脂质装至玻璃安剖瓶中,干燥后加入400μl双蒸水,水浴超声5-10分钟至溶液透亮,获得eylns;所述的混合脂质由卵磷脂pc、鞘磷脂sm、溶血卵磷脂lpc、磷脂酰乙醇胺pe、磷脂酰肌醇pi、磷脂酰甘油pg以质量比75.5:12.7:6.55:4.37:0.54:0.34混合而成。
2、纳米药物eylns-dox-silpcat1的制备:取3mg预制备的蛋黄脂质纳米载体eylns与33μgpei于室温震荡孵育1小时,15000rpm离心20分钟后加入500μl的双蒸水,每3分钟行水浴超声1次,共3次;然后加入5nmol的silpcat1,震荡孵育30分钟后每2分钟水浴超声1次,共3次;再加入500μgdox室温孵育30分钟,4℃超声5分钟,15000rpm离心5分钟,沉淀,所得纳米药物eylns-dox-silpcat1以pbs重悬备用。
3、纳米药物eylns-dox-silpcat1中dox与silpcat1共负载鉴定:首先制备携带fitc荧光标记的silpcat1以及dox;取3mg预制备的蛋黄脂质纳米载体eylns与33μgpei于室温震荡孵育1小时,15000rpm离心20分钟后加入500μl的双蒸水,每3分钟行水浴超声1次,共3次;然后加入5nmol的携带fitc荧光标记silpcat1,震荡孵育30分钟后每2分钟水浴超声1次,共3次;再加入500μg携带fitc荧光标记dox室温孵育30分钟,4℃超声5分钟,15000rpm离心5分钟,沉淀,得携带fitc荧光标记纳米药物eylns-dox-silpcat1;最后将携带fitc荧光标记纳米药物与食管鳞癌细胞kyse-150孵育12小时,通过免疫荧光方法观察dox与fitc-silpcat1的共负载情况。
图1为纳米药物eylns-dox-silpcat1共负载dox及silpcat1鉴定,其中:红色荧光为dox,绿色荧光为fitc-silpcat1。
4、纳米药物eylns-dox-silpcat1形态、粒径表征:取10μl制备好的eylns-dox-silpcat1滴于碳包覆的铜网上,质量浓度1%的醋酸铀酰负性染色后通过透射电镜观察其形态;取20μl纳米药物eylns-dox-silpcat1溶于400μl双蒸水,移至样品管后通过粒度仪分析纳米药物粒径大小。
图2为纳米药物eylns-dox-silpcat1形态及粒径鉴定;其中:a是透射电子显微镜观察纳米药物的形态,b是粒度仪检测其粒径分布约100nm。
5、纳米药物eylns-dox-silpcat1对食管鳞癌细胞lpcat1表达的影响:将食管鳞癌细胞培养于6孔板中,24小时后分别予pbs、dox、eylns-dox及eylns-dox-silpcat1处理,48小时后收集细胞、裂解液裂解,bca法蛋白定量后,100℃、10分钟使蛋白变性,然后行sds-page电泳及pvdf膜转印;质量浓度5%bsa封闭后加入抗lpcat1一抗以及二抗孵育;最后行ecl显色lpcat1的表达。
图3为纳米药物eylns-dox-silpcat1等对食管鳞癌细胞lpcat1表达的影响;其中,食管鳞癌细胞kyse-150分别经pbs、dox、eylns-dox及eylns-dox-silpcat1处理,westernblot法检测lpcat1表达。
6、纳米药物eylns-dox-silpcat1体外抗食管鳞癌细胞活性:克隆增殖实验、transwell迁移和侵袭实验用来评估纳米药物体外抗食管鳞癌细胞能力;克隆增殖实验:食管鳞癌细胞kyse-150铺于6孔细胞培养板中(500/孔),然后分别予pbs、dox、eylns-dox及eylns-dox-silpcat1处理,每3天处理1次,处理3次;然后将细胞克隆进行固定、染色后拍照;迁移实验:kyse-150细胞(2×103)重悬于200μldmem培养基后置于8mm孔径的transwell小室上室,下室为含质量浓度10%fbs的dmem培养基,然后细胞分别经pbs、dox、eylns-dox及eylns-dox-silpcat1处理,48小时后,擦去滤网上表面的细胞,将下表面细胞固定、0.1%结晶紫染色后进行拍照计数;侵袭实验:通过matrigel包被的transwell进行检测,其余方法同迁移实验。
图4为纳米药物eylns-dox-silpcat1体外食管鳞癌细胞杀伤活性分析;其中:a是对kyse-150细胞克隆增殖作用影响;b是对kyse-150细胞迁移功能影响;c是对kyse-150细胞侵袭能力的影响。
7、纳米药物eylns-dox-silpcat1体内抗食管鳞癌疗效分析:分别以表达luciferase报告基因的食管鳞癌细胞kyse-150建立裸小鼠食管鳞癌异种移植模型,瘤体长至约100mm3时将小鼠随机分为4组,分别给予pbs、dox、eylns-dox以及eylns-dox-silpcat1处理(dox剂量按5mg/kg小鼠体重给药),每6天处理一次,共处理5次,每6天对小鼠进行一次活体成像,每3天测量一次小鼠肿瘤大小及小鼠体重。
图5为纳米药物eylns-dox-silpcat1体内抗食管鳞癌活性分析;其中:a,药物在小鼠食管鳞癌异种移植组织中的分布检测;b,活体成像比较纳米药物eylns-dox-silpcat1与dox、eylns-dox的体内抗小鼠食管鳞癌活性;c,小鼠食管鳞癌生长情况;d,各组小鼠食管鳞癌瘤体影像。
结果显示:我们制备获得了粒径约100nm,同时负载dox及silpcat1的纳米药物eylns-dox-silpcat1;该纳米药物有效降低了食管鳞癌细胞中lpcat1的表达,进而抑制了其增殖、迁移以及侵袭能力;小鼠食管鳞癌异种移植模型进一步证实eylns-dox-silpcat1较dox及eylns-dox发挥更为有效的抗食管鳞癌效果。
- 还没有人留言评论。精彩留言会获得点赞!