依法韦仑在制备治疗前列腺癌的药物中的应用的制作方法
本发明涉及前列腺癌技术领域,具体而言,涉及依法韦仑在制备治疗前列腺癌的药物中的应用。
背景技术:
目前,前列腺癌已成为全球男性中的第二大常见癌症,同时也是中国排名第五的男性常见癌症。我国前列腺癌发病率远低于欧美国家,但由于早期诊断率较低,中国前列腺癌患者的死亡率远远高于发达国家。前列腺癌现有的治疗方式包括手术、放疗、内分泌治疗、化疗以及新型内分泌治疗。随着前列腺癌的治疗时间的延长,由于治疗带来的压力等因素导致前列腺癌细胞不断的变异,最终进入去势抵抗即crpc(去势抵抗性前列腺癌)阶段。前列腺癌患者在确诊crpc时出现肿瘤转移的概率高达85%,且其中超过80%的crpc患者存在骨转移,即mcrpc(转移性去势抵抗性前列腺癌)目前在临床上尚无治愈的选择,主要的治疗目标为延长患者生存(os)和提高患者生活质量(qol)。
依法韦仑是一种非核苷类逆转录酶抑制剂(nnrti),最初在医疗界用作抵抗艾滋病毒的特效药物。在前期研究(专利号au2013375157b2)中发现,将依法韦仑用于治疗前列腺癌,具有一定的疗效,其主要是通过抑制肿瘤细胞内line-1转座子编码的逆转录酶(l1-rt)的表达及活性,靶向非雄激素依赖性的耐药机制,达到治疗内分泌疗法耐药型前列腺癌的效果。由此可见,依法韦仑作为一种针对mcrpc的新型抗肿瘤药物,具有良好的临床应用潜力及市场前景。然而,该专利中仅对依法韦仑可用于治疗前列腺癌和依法韦仑用于治疗前列腺癌的有效的临床给药剂量进行了研究,但依法韦仑治疗前列腺癌的具体分子机制仍不清楚,如果深入研究依法韦仑抗前列腺癌的分子机制,将有利于为其后续的临床应用奠定分子生物学的基础。
技术实现要素:
本发明的目的在于提供一种依法韦仑在制备治疗前列腺癌的药物中的应用。
本发明解决其技术问题是采用以下技术方案来实现的。
本申请实施例提供一种依法韦仑在制备治疗前列腺癌的药物中的应用。
相对于现有技术,本发明的实施例至少具有如下优点或有益效果:
本发明提供了依法韦仑用于制备治疗前列腺癌的药物,并揭示了依法韦仑治疗前列腺癌的分子机制,为依法韦仑用于制备抗前列腺癌药物的后续研究奠定了分子生物学的基础。
本发明研究表明,依法韦仑治疗前列腺癌具有靶向性,即靶向前列腺癌细胞,抑制其增殖同时促进前列腺癌细胞的凋亡,同时不伤害正常组织细胞,反映其在前列腺癌临床给药中可能产生的毒性较低。
通过对依法韦仑抗前列腺癌的分子机制的研究,在后续出现耐药性或者其他因素导致的抗癌效果差时,可根据分子机制选择与依法韦仑互补的药物进行联用,以增强临床治疗中对前列腺癌的抗肿瘤效果。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
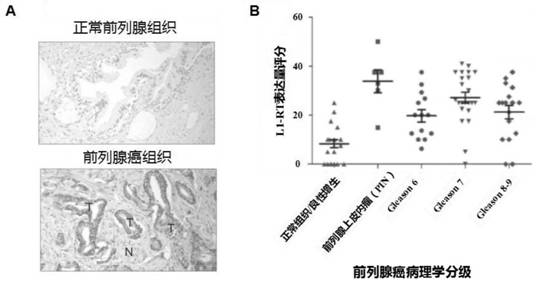
图1为前列腺癌组织细胞中l1-rt的表达量显著高于正常前列腺组织及l1-rt活性与前列腺癌的病理分级呈现显著相关性的结果;
图2为依法韦仑抑制非雄激素依赖性及雄激素依赖性的前列腺癌细胞的增殖并促进其凋亡的结果图;
图3为依法韦仑给药通过激活caspase信号通路促进肿瘤细胞的凋亡的结果图;
图4为依法韦仑抑制前列腺癌细胞系du145肿瘤细胞的克隆形成及生长的结果图;
图5为杂交液配方;
图6为依法韦仑给药对人类前列腺癌细胞系du145细胞表达谱的影响;
图7为依法韦仑给药后前列腺癌细胞系du145的表达谱中呈现显著差异表达的基因;
图8为依法韦仑抑制裸鼠接种人源前列腺癌细胞后肿瘤生长的结果图;
图9为依法伟仑对前列腺癌细胞及正常组织细胞增殖的影响。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将参考具体实施例来详细说明本发明。
本申请实施例提供依法韦仑在制备治疗前列腺癌的药物中的应用。
在本发明的一些实施例中,上述应用中所述依法韦仑通过影响细胞形态发生、细胞生长和细胞凋亡过程的相关功能基因的表达以实现抗前列腺癌的效果。
在本发明的一些实施例中,上述应用中所述依法韦仑通过信号通路cytochromec-caspase9-caspase3-dff促进前列腺癌细胞的凋亡。
在本发明的一些实施例中,上述应用中所述依法韦仑通过上调tmeff1、tac1、tfpi2、serpinf1基因中的一种或多种抑制前列腺癌的发生和发展。
在本发明的一些实施例中,上述应用中所述依法韦仑通过下调fn1或ctgf基因抑制前列腺癌的发生和发展。
在本发明的一些实施例中,上述应用中所述前列腺癌包括非雄激素依赖性的前列腺癌和/或雄激素依赖性的前列腺癌。在临床研究中,同一前列腺癌患者体内,可能同时存在雄激素依赖性的前列腺癌细胞,也存在非雄激素依赖性的前列腺癌细胞,但是其中一种占优势。根据前列腺癌的病程发展过程,早期前列腺癌中的肿瘤细胞多为雄激素依赖类型,因此目前临床应用的主流内分泌疗法均为靶向雄激素依赖性前列腺癌细胞的疗法。然而随着病程的进展,肿瘤细胞在药物的压力筛选下,非雄激素依赖性的前列腺癌细胞逐渐成为优势细胞群体,进而对内分泌疗法产生耐药性。因此,本发明的研究提供了一种靶向非雄激素依赖性的前列腺癌细胞的新的治疗思路,可以有效弥补目前针对内分泌疗法耐药型的晚期前列腺癌的临床用药缺口。
在本发明的一些实施例中,上述应用中所述依法韦仑抑制非雄激素依赖性的前列腺癌的细胞增殖的半数有效浓度为34~100μm。
在本发明的一些实施例中,上述应用中所述依法韦仑诱导非雄激素依赖性的前列腺癌的细胞凋亡的半数有效浓度为37~193μm。
在本发明的一些实施例中,上述应用中所述依法韦仑抑制雄激素依赖性的前列腺癌的细胞增殖的半数有效浓度为33μm。
在本发明的一些实施例中,上述应用中所述依法韦仑诱导雄激素依赖性的前列腺癌的细胞凋亡的半数有效浓度为22μm。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
试验例
1、前列腺癌组织细胞中l1-rt的表达情况
line-1转座元件的表达与活性在在正常组织细胞中受到显著抑制,而在多种肿瘤细胞中呈现高表达与转录再激活的状态。line-1的表达量与活性的提高,尤其是line-1转座元件orf2编码的逆转录酶l1-rt的高表达与再激活,通过影响遗传稳定性以及表观遗传学修饰等方式,在多种癌症的发生以及肿瘤趋向恶性的发展过程中发挥着重要的致病性作用。为了研究前列腺癌是否适用于依法韦仑为核心药物分子的抗肿瘤疗法,首先需要研究前列腺癌肿瘤细胞中l1-rt的表达量是否明显高于正常前列腺组织细胞。本实施例选取正常前列腺组织以及前列腺癌患者的肿瘤组织,制作石蜡切片,并使用靶向l1-rt的单克隆抗体进行免疫组织化学染色实验,分析前列腺癌肿瘤组织(t)、癌旁组织(n)及正常前列腺组织细胞中l1-rt表达量的差异。免疫组化步骤如下:
(1)洗载玻片:将载玻片置于重铬酸钾和浓h2so4混合液中,目的是为了是载玻片上的硅胶等除去,同时使一些肉眼看不见的凹凸不平的表面变平整,便于组织吸附,然后置于清水中清洗,除去残余的重铬酸钾和浓h2so4(大约冲一个小时左右),再将载玻片浸泡于酒精之中,然后放到架子上,置于37℃温箱中,将多聚赖氨酸涂布于玻片的表面,由于lys带正电,而大多数的组织带负电荷,从而产生吸附作用。
(2)包埋组织:先在铁模具中加入一些液态石蜡,先稍微冷却,然后再将待包埋的组织(手术切除的肿瘤组织或癌旁的正常肺部组织)置于石蜡之中,并排列整齐,再将塑料模具盒盖上,最后加入少许液体石蜡,进行冷冻,使石蜡变成固态。
(3)切片:将包埋好的组织从模具上取下来,并置于石蜡切片机上,切片机通过调节上下左右来来使组织和切割方向一致,然后调节切片的厚度,一般为5μm,如果比较难切,则可以适当调整厚度,用毛笔将切割的载玻片向外拉,并用小镊子将包含有完整组织的载玻片置于40℃温水中。
(4)捞组织:当组织载玻片置于40℃温水中之前,要先将水浴中的气泡赶走,以免气泡受热上浮而贴到组织上,组织受热展开,最好是组织不起皱纹,用载玻片捞组织时,一般取载玻片的下1/3或者下1/2,一般每种组织捞5-6张,其中2-3张是备用的,每张载玻片上通常捞两份组织,做对照使用,这样形成的误差较小。捞载玻片的时候最好方向一致,以便观察,再将捞出的载玻片置于架子上,放入37℃温箱中烘干。
(5)脱蜡:依次将载玻片放入二甲苯-二甲苯-100%酒精-100%酒精-95%酒精-90%酒精-80%酒精-70%酒精。依据相似相溶的原理,起脱蜡作用的主要是二甲苯,每种试剂中放置10min-15min。脱蜡后在清水中冲洗一段时间,加入3%h2o2浸泡10min,从而除去内源性的过氧化氢酶,然后倒掉h2o2,在清水中洗两次,再加入柠檬酸缓冲液,放入微波炉中加热3min(中火),一般刚到沸腾即可,冷却至室温,然后再加热一次,冷却至室温,加热的目的是暴露抗原位点。
(6)血清封闭:冷却至室温后,将柠檬酸缓冲液倒掉,水洗2次,并将载玻片置于pbs中5min,洗2次,擦干组织周围的pbs液,马上加上血清,封闭一些非特异性的抗原位点。然后放入37℃温箱中半小时。血清封闭液需要稀释10倍后使用(900μlpbs:100μl血清封闭液)。
(7)加一抗(l1-rt单克隆抗体):将温箱中的载玻片取出,用吸水纸擦干载玻片反面和正面组织周围的血清,加一抗,置于4℃冰箱中保存过夜。
(8)加二抗(生物素标记的二抗):将载玻片从冰箱中取出,放入pbs中洗3次,每次5min,擦干组织周围的pbs后加二抗,然后置于37℃温箱中半小时。
(9)加链酶亲和素-过氧化物酶复合物hrp-sa:将片子从温箱中取出,放入pbs中洗3次,每次5min,擦干组织周围的pbs后加hrp-sa,然后置于37℃温箱中半小时。hrp-sa稀释100倍(990μlpbs:10μlhrp-sa)。
(10)加显色剂:将片子从温箱中取出,放入pbs中洗3次,每次5min,擦干组织周围的pbs后加上显色剂。显色剂的配制方法如下:在1ml水中加1滴显色剂a,摇匀,然后加1滴显色剂b,摇匀,再加1滴显色剂c,摇匀。其中各成分分别为a:dab(二甲基联苯胺),b:h2o2(过氧化氢),c:磷酸缓冲液。
(11)复染:将显色后的片子用清水冲洗一段时间后,浸泡于苏木精中染色30s。
(12)脱水:将复染后的片子置于水中冲洗后,依次将载玻片放入70%酒精-80%酒精-90%酒精-95%酒精-100%酒精-100%酒精-二甲苯-二甲苯。每个试剂中放置2min,最后浸泡在二甲苯中,搬到通风柜中。
(13)封片:用中性树胶滴在组织旁边,再用盖玻片盖上,要先放平一侧,然后轻轻放下另一侧,以免产生气泡,封好片子后置于通风柜中晾干。
正常前列腺组织及前列腺癌组织的石蜡切片使用l1-rt单克隆抗体及苏木精染色结果如图1.a所示。其中,图1.a为正常的前列腺组织以及前列腺癌患者手术切除的肿瘤组织制作的石蜡切片,使用l1-rt逆转录酶单克隆抗体作为一抗,二抗选用生物素标记的抗体,使用dab-hrp辣根过氧化物酶显色并进行苏木精复染后的图片。苏木精染色的部位为细胞核染色质,染色呈现蓝紫色;l1-rt单克隆抗体靶向l1-rt蛋白质,阳性呈现深浅程度不同的棕褐色颗粒;颜色越深,代表该部位l1-rt表达量越高。
图1.a(上)为正常组织。图1.a(下)中标注的t代表肿瘤组织,n代表癌旁组织。由图1.a可知,正常前列腺组织切片主要呈现为细胞核被苏木精染色后的蓝紫色,而肿瘤组织切片中,肿瘤组织(t)与癌旁组织(n)对比,呈现出明显的棕褐色颗粒,表明该部位抗原-抗体反应阳性,即与癌旁组织及正常前列腺组织相比,前列腺癌肿瘤组织细胞内l1-rt的表达量显著偏高。
2、l1-rt的活性与前列腺癌的病理分级关系
临床诊断普遍认为,gleason分级评分7-10,表明患者组织病理学分化程度处于g3(低分化或未分化阶段),表明肿瘤的恶性度较高。采集自77例处于不同前列腺癌病理分级阶段患者的组织样本,使用l1-rt单克隆抗体进行免疫组织化学染色,对组织切片中的免疫组化染色的阳性信号的强度进行归一化统计分析,获得l1-rt表达量评分值。77例组织样本按照患者病理分级阶段分为5组:(1)正常前列腺组织/良性前列腺增生(bph)组织,共计17例;(2)属于前列腺癌前病变的前列腺上皮内瘤pin,共计6例;(3)前列腺癌病理诊断gleason分级=6,共计14例;(4)前列腺癌病理诊断gleason分级=7,共计23例;(4)前列腺癌病理诊断gleason分级=8或9,共计17例。
l1-rt表达量与前列腺癌的病理分级之间的相关性如图1.b所示,结果表明:病理诊断为癌前病变以及gleason分级评分相对较高(gleason>3+3)的肿瘤组织中,其l1-rt的表达量显著高于正常前列腺组织与良性前列腺增生组织。
结合图1.a和图1.b结果可知:l1-rt在前列腺癌细胞与正常组织细胞中呈现差异性表达,意味着依法韦仑的抗肿瘤作用具有一定的靶向性,在抑制肿瘤细胞生长的同时,表现出对正常组织细胞较低的毒性作用。l1-rt在前列腺癌肿瘤细胞中的高表达量,意味着依法韦仑可以高效地靶向并作用于前列腺癌肿瘤细胞,发挥抗肿瘤作用。同时,l1-rt表达量及活性与前列腺癌的病理分级密切相关。病理分级的gleason评分越高,表明肿瘤的恶性程度越高。因此,l1-rt的药物拮抗作用很可能有利于降低前列腺癌的恶性程度并延缓其病程的进展。
3、依法韦仑可以有效抑制前列腺癌细胞的增殖并促进其凋亡
为了研究依法韦仑对前列腺癌来源的肿瘤细胞的增殖及凋亡过程的影响,本实施例选取三种人源前列腺癌细胞系,进行体外梯度给药实验。依法韦仑药物工作浓度范围设定在10-7~10-3m之间,进行依法韦仑给药后肿瘤细胞增殖及凋亡水平的评估。其中,两种为非雄激素依赖性前列腺癌细胞系du145细胞与pc-3细胞,第三种为雄激素依赖性的前列腺癌细胞系lncap细胞。将前列腺癌细胞置于包含不同浓度依法韦仑的培养基中培养48h后,进行细胞增殖及凋亡数量统计。采用cck8试剂盒进行细胞计数,并计算细胞增殖指数(proliferationindex,pi),是指每个实验组中,经过处理48h后孔内的细胞数量与未经任何处理的初始细胞数量的比值。采用caspase3/7活性细胞凋亡检测试剂盒染色,结合流式细胞仪,分析细胞群中凋亡途径中关键的caspase3阳性细胞的百分比,以此来评估细胞的凋亡水平。
使用prism8.0对体外梯度给药实验的数据进行非线性回归分析,结果如图2所示,结果表明在给药浓度10-5~10-4m量级的条件下,依法韦仑可以有效抑制前列腺癌细胞的增殖,并通过激活caspase3蛋白等途径诱导细胞凋亡过程的发生。图2.a与b的统计分析结果表明,依法韦仑对于非雄激素依赖性的前列腺癌细胞系du145与pc-3细胞,发挥增殖抑制作用的ec50分别为34μm和100μm;产生诱导凋亡作用的ec50分别为37μm和193μm。需要注意的是,此处的浓度是ec50即半数有效浓度,也可称为50%有效浓度或50%抑制浓度(ec50),后续同理。
另外,依法韦仑除了可以有效对非雄激素依赖性的前列腺癌细胞产生抗肿瘤作用外,还可以有效抑制依赖雄激素信号生长的前列腺癌细胞系lncap,如图2.c所示,依法韦仑发挥发挥增殖抑制和诱导凋亡作用的ec50分别为33μm和22μm。
上述实验结果表明,依法韦仑可以有效抑制前列腺癌细胞的增殖并促进其凋亡过程,且其抗肿瘤作用不限于针对非雄激素依赖性的前列腺癌,对雄激素依赖性的前列腺癌细胞依然有效。这意味着以依法韦仑为核心药物分子的全新的抗肿瘤疗法,不仅可以应用于目前临床中针对前列腺癌患者主流的内分泌疗法耐药(即去势抵抗性)后的疾病进展阶段,也可以与多种雄激素拮抗类的内分泌疗法进行联合用药,在前列腺癌早期发挥协同的抗肿瘤作用,延缓现有疗法耐药性的产生以及前列腺癌的进展。
4、依法韦仑给药诱导前列腺癌细胞凋亡的分子机制
前述体外细胞实验结果表明,特定给药剂量范围内的依法韦仑可以有效诱导前列腺癌细胞的凋亡,本实施例将在分子水平,进一步研究依法韦仑给药诱导前列腺癌细胞发生凋亡的分子机制。本实施例选取经不同浓度的依法韦仑给药处理的前列腺癌细胞系pc-3细胞,提取细胞质总蛋白进行蛋白质免疫印迹(westernblot)实验,检测凋亡途径中关键活性因子的含量及激活情况,来反映前列腺癌细胞中的凋亡途径是否被启动。
caspases是一类半胱氨酸蛋白酶,在细胞凋亡信号传导的级联反应中协同作用。这种级联反应的结果是细胞内大量蛋白质的裂解,接着是细胞的解体、细胞的死亡,最后是细胞的吞噬作用和细胞碎片的清除。在包括fasl(fas配体)、tnf(肿瘤坏死因子)、granzyme-b、grb(生长因子受体结合蛋白)、dna损伤等促凋亡刺激信号的介导下,启动caspases(包括8、9、10和12)被激活,这些caspases将裂解并激活下游效应caspases(包括3、6和7)。
caspase8裂解bid(bh3相互作用死亡域),tbid(truncatedbid)破坏线粒体外膜,导致促凋亡因子细胞色素c(cytochrome-c)的释放,而后者对激活caspase9酶原(pro-caspase9)至关重要。从膜间隙释放的cytoc与apaf1(凋亡蛋白酶激活因子-1)结合,后者招募caspase9,进而通过水解caspase3酶原(pro-caspase3)而获得caspase3。
在非凋亡细胞中,caspase-3以酶原(32kd)的形式存在于胞浆中,在凋亡的早期阶段,它被激活,活化的caspase-3由两个大亚基(17kd)和两个小亚基(12kd)组成,裂解相应的胞浆胞核底物,最终导致细胞凋亡。
dff(dnafragmentationfactor)是一类dna片断化分解因子,属于caspase3下游作用的底物之一。其中的dff40/cad也称作caspase激活的dna酶。在非凋亡细胞中,dff由分子量45kd的分子伴侣/抑制剂的dff45-icad-l亚单位和40kd的dff40/cad/cpan两个亚单位组成,以无活性的异源二聚体形式存在。然而,在启动凋亡程序的细胞中,caspase3/7的凋亡激活作用引起dff45-icad-l裂解,从而释放dff40/cad,使其成为有活性的dna核酸酶,引起dna断裂和染色质凝聚,是caspase级联反应介导的细胞凋亡中关键性的一环。
因此,本实施例选取上述凋亡信号通路中的4个关键蛋白,通过蛋白质免疫印迹wb实验检测其在细胞质中的表达量或活化状态。4个目标蛋白分别为:
(1)细胞色素c(cytochrome-c):凋亡启动后由线粒体释放,细胞质含量应该上升;
(2)caspase9酶原(pro-caspase9):凋亡启动后自切割活化为caspase9,分子量由45kd减小为35kd。
(3)caspase3酶原(pro-caspase3):凋亡启动后被水解切割,活化为caspase3,分子量由32kd减小为17kd。
(4)dff45(dna片断化分解因子):凋亡启动后被caspase3裂解,抗体可检测到的蛋白分子量由45kd减小为11kd,此处使用的wb检测抗体为cleaveddff45(asp224)antibody。
给药实验设计如下:
包括1个未加药处理的对照组与4个不同依法韦仑给药浓度的给药组,4组依法韦仑给药的终浓度分别为:10μm,25μm,50μm,100μm。按照设计对前列腺癌细胞系pc-3细胞进行加药处理,在37℃5%co2的培养箱中孵育1小时,胰蛋白酶消化、离心收集各组细胞,进行蛋白质免疫印迹实验。检测如下蛋白cytochromec:细胞色素c(14kd);pro-caspase9:caspase9酶原(45kd);pro-caspase3:caspase3酶原(32kd);dff:dff45(dna片断化分解因子,45kd)。
细胞蛋白质提取及蛋白质免疫印迹实验(westernblot)的操作步骤如下:(1)胰蛋白酶消化,pbs洗涤三次,800rpm,4℃5min离心收集细胞。(2)弃上清,加入细胞裂解液,裂解30min。(3)最大转速4℃离心15min,取上清,加入50μl蛋白上样缓冲液。(4)置于95℃水浴锅中孵育10min,取出置于冰上。(5)15%sds-page凝胶电泳。(6)剪取硝酸纤维素膜和滤纸,硝酸纤维素膜在电转液中浸泡3min,按序插入电转槽中。(7)转膜:100v恒压1h。(8)取出硝酸纤维素膜在tsb中漂洗,置于平皿,室温轻摇1h。(9)将滤膜放入杂交盒,加入5%脱脂奶粉作为封闭液,1:1000加入靶标蛋白的一抗,4℃摇床滚动过夜。(10)取出滤膜,使用tbst(含0.05%tween20的tbs)洗涤3次,5min/次,将滤膜放入杂交盒。(11)1:10000加入二抗,置于室温水平摇床避光摇动1h。(12)取出滤膜,tbst漂洗2次,tbs漂洗1次,5min/次。(13)显色:有蛋白条带的滤膜一面朝上放入保鲜膜,将显色底物a液b液等体积混匀,混合物覆盖保鲜膜表面,包好放入夹杯。(14)ibrightcl750智能成像,调整曝光时间,拍照记录包含目标蛋白的条带。
蛋白质免疫印迹实验结果如图3所示,从上而下依次为cytochromec(45kda、11kda)、pro-caspase9(45kda、11kda)、pro-caspase3(45kda、11kda)和dff(45kda、11kda),可以观察到随着依法韦仑给药剂量的增加,尤其是依法韦仑给药浓度达到100μm的给药组中,细胞质中细胞色素c含量显著增加,表明线粒体外膜破坏,细胞色素c被释放。
caspase9酶原(pro-caspase9,45kd)含量降低,同时活化的caspase9(35kd)的含量增加,表明caspase9酶原被激活,自切割为具有水解酶活性的caspase9。
caspase3酶原(pro-caspase3,32kd)含量降低,同时活化的caspase3其中的大亚基(17kd)的含量增加,表明caspase3酶原被激活,被水解为活化的caspase3。
作为caspase3下游底物的dff45,表现为完整的45kd的dff被caspase3裂解,部分在asp224位置被切割后产生11kd的条带。
上述实验结果均表明,依法韦仑在给药终浓度达到100μm的条件下,可以有效诱导前列腺癌细胞pc-3内的凋亡的发生,其通过启动caspase级联反应的信号通路,促进了肿瘤细胞的程序性死亡。
5、依法韦仑给药可以有效降低前列腺癌细胞的克隆形成及生长
肿瘤细胞的克隆形成能力远强于正常组织细胞。当单个细胞在体外增殖6代以上,其后代所组成的细胞群体,成为集落或克隆。其中细胞克隆形成率即细胞接种存活率,表示接种细胞后贴壁的细胞成活并形成克隆的数量。贴壁后的细胞不一定每个都能增殖和形成克隆,而形成克隆的细胞必为贴壁和有增殖活力的细胞。肿瘤细胞的体外克隆能力越强,一定程度意味着该肿瘤细胞在体内的成瘤性越强,细胞克隆形成实验可以算是一种模拟体内成瘤的体外实验。
前期研究结果已经表明:依法韦仑给药可以有效抑制前列腺癌细胞的增殖并诱导其凋亡。因此,为了进一步研究依法韦仑给药对前列腺癌细胞的抗肿瘤作用,本实施例通过细胞克隆形成实验,来检测依法韦仑给药对前列腺癌细胞增殖能力及侵袭性的影响。本实施例选取平板克隆形成法(colonyformation)进行细胞克隆形成实验,该方法主要适用于贴壁细胞。具体实验操作如下:
(1)取对数生长期的du145细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,并把细胞悬浮在完全培养基(基础培养基+10%胎牛血清)中备用。(2)流式细胞仪进行单细胞分选,将单个du145细胞接种至微孔板的每个孔中。对照组使用不加药物处理的培养基,给药组使用含有不同终浓度依法韦仑的培养基进行细胞培养,给药剂量梯度中的依法韦仑给药浓度分别为:100nm,300nm,1μm,3μm,10μm,30μm。(3)细胞培养板置于37℃,5%co2的细胞培养箱中培养2周。(4)当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用pbs小心浸洗2次。(5)加纯甲醇或13醋酸/甲醇5ml,固定15min。(6)去固定液,加适量giemsa染色液染色30min。(7)用流水缓慢洗去染色液,空气干燥。(8)将平皿倒置并叠加一张带网格的透明胶片,在显微镜(低倍镜)进行克隆及单克隆内细胞数量计数,并计算克隆形成率。克隆形成率=(克隆数/接种细胞数)×100%。
细胞克隆形成实验的结果如图4所示。图4.a为未加药处理的对照组(nt)中du145细胞培养2周后的克隆形成情况。x轴数值表示单个细胞克隆包含的细胞数量,对应的y轴数值表示包含该数量细胞的克隆的形成数量。图4.b依法韦仑给药组(给药剂量:培养基中依法韦仑efv的终浓度为10μm)中du145细胞培养2周后的克隆形成情况。图4.c为体外依法韦仑给药浓度梯度下的du145细胞克隆形成的实验结果-1,箱线图反映了整体克隆形成中单个克隆包含细胞数量的分布情况。除一组未加药处理的对照组nt外,给药剂量梯度中的依法韦仑给药浓度分别为:100nm,300nm,1μm,3μm,10μm,30μm。y轴表示单个细胞克隆包含的细胞数量。图4.d为体外依法韦仑给药浓度梯度下的du145细胞克隆形成的实验结果-2,柱形图反映了细胞的克隆形成率。单个细胞集落包含细胞数量>200的情况下记为一个克隆。
通过比较未加药处理的对照组(nt,图4.a)与依法韦仑给药组(efv10μm,图4.b)中du145细胞培养2周后的克隆形成结果,可以观察到:在依法韦仑给药剂量≥10μm的条件下,依法韦仑给药组的细胞克隆形成率大大降低,且单个克隆内的细胞数量显著下降,表明肿瘤细胞克隆的生长受到抑制。图4.c中表明,与未经给药处理的对照组相比,依法韦仑给药组(efv10μm)中单个克隆包含的平均细胞数量降低了约50倍。图4.d反映,与未经给药处理的对照组相比,依法韦仑给药组(efv10μm)的克隆形成率由93%降低到30%。
上述体外细胞克隆形成实验结果表明,依法韦仑可以有效抑制前列腺癌细胞系du145肿瘤细胞的克隆形成及生长。依法韦仑既可以阻断单个肿瘤克隆的出现,降低克隆形成率;也可以在克隆形成后显著抑制克隆的生长。
6.依法韦仑给药改变前列腺癌细胞的基因表达谱
前述研究结果表明,依法韦仑给药可以有效抑制人源前列腺癌细胞的增殖并促进其凋亡。为了进一步研究依法韦仑的抗肿瘤作用机制,阐明依法韦仑给药对于肿瘤细胞基因表达谱的影响。本实施例采用affymetrix公司的人类基因表达谱芯片genechiptmhumangenomeu133a2.0array,对经过dmso处理(对照组)以及经过依法韦仑给药处理(给药组)的du145细胞进行基因表达谱的检测及差异分析。
本实施例使用的genechiptm人类基因表达谱芯片u133a2.0的规格及参数如下所示:单个微阵列芯片包含>22,000条25-mer长度的寡核苷酸探针,可检测>500,000种寡核苷酸特征;可覆盖检测分析14,500个已充分研究的人类基因,18,400个转录本及突变体的表达水平;单个杂交信号的成像分辨率为11μm,每条序列对应11个探针作为平行重复,为每个转录本获得多个独立的测量值,其检测结果具有相当的准确性和灵敏度(1100,000)。
选取人类前列腺癌细胞系du145进行体外给药实验:
对照组-1使用dmso处理细胞,给药组使用培养基中终浓度为30μm的依法韦仑处理细胞,给药组设置两个平行重复实验(n=2)。持续培养72小时后,胰蛋白酶消化、收集细胞、制备样品,使用人类基因表达谱芯片进行基因表达差异分析。另外设置对照组-2为不加任何处理的du145细胞,直接收集相应数量的细胞进行样品制备及芯片杂交检测。
样品制备及使用人类基因表达谱芯片进行检测分析的操作步骤如下所示:
(1)总rna提取:每组收集2×106个细胞,使用trizol法提取总rna。
(2)使用qiagenrneasytotalrnaisolationkit纯化总rna。
(3)使用(qiagenoligotexdirectmrnakit提取poly(a)+rna。
(4)使用affymetrix的one-cyclecdnasynthesiskit将poly(a)+rna合成双链dna:包含准备polyacontrol,第一链dna合成,第二链dna合成及dna双链纯化。
(5)使用
(6)获得片段化crna:20μgcrna与fragmentationbuffer混合,94℃,35min。反应结束后置于冰上。
(7)微阵列芯片杂交:1)芯片使用前需平衡至室温。2)在新的1.5mlrnase-free离心管中按下表配方配制杂交液。3)杂交液先99℃,5min;再45℃,5min。4)在进行上述步骤的同时通过加样孔加入适量体积的1×杂交缓冲液湿润芯片。5)杂交炉中45℃,60rpm预杂交芯片10min。6)步骤5处理过的样品最大速离心5min。7)从芯片中取出杂交缓冲液,加等体积处理好的杂交液(配方如图5所示)。8)杂交炉中45℃,60rpm杂交芯片16小时。
(8)洗脱、染色、扫描芯片:根据affymetrix基因表达谱芯片操作指南,配置洗脱液、sape和mes染色液及抗体溶液,选择对应真核11μm的洗脱程序eukge-ws2v5操作洗涤工作站进行洗脱、染色。使用genearrayscanner30007g扫描芯片,采集荧光信号。
(9)数据处理及分析:
使用gcos(数据处理软件)对采集的荧光信号进行统计分析,阵列中每个点的信号(signal)扫描仪检测出的光强度经过归一化后的数据。差异基因的挑选标准需要计算实验组和对照组的信号比值取log2后的数据,即signallogratio。有关差异表达的基因,其上调(up)和下调(down)的筛选是按如下条件计算所得,cutoff设定为foldchange1.5,即upsignallogratio>=0.58,downsignallogratio<=-0.58。
选取实验前后(对照组细胞加dmso处理(对照组-1),给药组细胞加依法韦仑处理,分别与处理前的细胞(对照组-2)的基因表达谱进行比较分析),表达谱中差异倍数超过1.5的基因,根据发挥不同功能的多种细胞信号通路对其进行基因聚类分析,对照组(control(dmso)组)与给药组(efavirenz组)处理前后差异基因聚类的结果分别如图6.a与图6.b所示。可以观察到,与加dmso处理的对照组相比,加依法韦仑处理的给药组在涉及细胞形态发生、器官发育、细胞生长过程、细胞死亡等信号通路中,发生显著差异表达的基因数量显著上升,整个肿瘤细胞的基因表达发生了重编程,表明依法韦仑的给药可能通过影响这些细胞生理调节相关的信号通路,发挥抗肿瘤作用。
两个独立、平行的依法韦仑给药组的差异基因筛选结果交集揭示了92个差异基因,其中包括58个上调基因以及34个下调基因。为了提高筛选结果的可靠性,本实施例选取了依法韦仑给药及奈韦拉平(另一种非核苷类逆转录酶抑制剂)给药后,在两种同类药物的给药组中均发生差异表达的基因,如图7所示,共计27个基因:包括21个上调基因和6个下调基因。通过分析各个基因的功能可以发现,部分列表中的基因已被明确报道在多种肿瘤的发生及进展过程中发挥重要作用。具体如下:
上调基因:
(1)tmeff1:编码一种脑肿瘤抑癌蛋白,其上调有利于抑制肿瘤的发生。
(2)tac1:前体速激肽,tac1被报道在结肠癌中发生显著下调。
(3)tfpi2:tfpi2的上调被报道与胰腺癌细胞的增殖抑制、潜在的转移性及侵袭性下降相关。
(4)serpinf1:色素上皮衍生因子,又名pedf,已有报道表明其对于恶性前列腺癌、神经胶质瘤、胰腺癌等具有抗肿瘤活性,该蛋白可通过抑制血管生成、诱导肿瘤细胞分化及凋亡等途径协同发挥抗肿瘤作用,因此其上调有利于抑制肿瘤的发生及进展。
下调基因:
(1)fn1:纤维连接蛋白,是一类细胞黏附分子,与肿瘤细胞的转移性相关。有报道表明:人纤维肉瘤浸润的肺组织与周围组织相比,其fn1表达明显上调,表明fn1的高表达有利于肿瘤的转移。其下调将有利于降低肿瘤的转移性,进而抑制肿瘤的进展。
(2)ctgf:结缔组织生长因子,有研究报道可以促进胰腺癌细胞的生长、侵袭、转移及血管生成。其下调将有利于抑制肿瘤的发生及进展。
综上所述,通过对经依法韦仑给药处理(给药组)前后的人前列腺癌细胞系du145细胞进行基因表达谱的检测、差异表达基因及信号通路聚类分析,可以发现依法韦仑给药对前列腺癌细胞的整个基因表达谱产生了显著的影响,实现了基因组的重编程。差异表达基因及信号通路聚类分析的结果进一步证明了,依法韦仑以改变肿瘤细胞的基因表达谱的方式,上调部分具有抗肿瘤活性或降低肿瘤转移性及侵袭性的抑癌基因,下调部分有利于肿瘤发生发展的基因表达。通过抑制肿瘤组织附近的血管生成、抑制肿瘤细胞增殖、诱导肿瘤细胞分化及凋亡等途径,达到抗肿瘤的作用效果。
7.依法韦仑可以有效抑制裸鼠接种的人源前列腺癌肿瘤的生长
为了进一步证明依法韦仑对前列腺癌的抗肿瘤作用,本实施例选取裸鼠进行体内成瘤实验,并通过依法韦仑给药研究其对肿瘤生长过程的影响。
具体实验操作及结果如下:
选取balb/c品系的裸鼠进行体内成瘤实验。制备人源前列腺癌细胞系du145的细胞悬液,通过细胞计数,调整细胞浓度为106-107个/ml,按照0.2ml/只注射接种于裸鼠鼠蹊部皮下。注射后用小镊子夹针孔片刻,可避免注入液外溢。
实验分为对照组与给药组:对照组在肿瘤细胞接种后不进行给药处理,给药组在肿瘤细胞接种1天后,使用灌胃法进行给药处理,每日依法韦仑的给药剂量为:每日一次,每次60mg/kg。自接种肿瘤日起40天内,选取共计7个时间点(t=0,13,17,21,25,30,37天),进行肿瘤接种部位的拍照记录及取样,测量肿瘤大小(直径)并计算其体积,每个数据点为组内取样所有数据的平均值。
实验结果如图8所示,图8.a(左)为接种肿瘤40天内,未给药对照组(ctr)与依法韦仑给药组(efv)裸鼠成瘤的体积(cm3)大小比较分析结果。可以观察到:与未给药处理的对照组相比,依法韦仑给药组的裸鼠的肿瘤生长明显受到抑制。依法韦仑给药组的裸鼠体内肿瘤生长至可测量水平的速度较慢(ctr=13天,efv=25天),表明其肿瘤生长明显受到抑制。接种37天后(图8.a,右图),依法韦仑给药组的裸鼠接种部位的肿瘤体积明显较小,平均大小仅为对照组的1/5,表明表明依法韦仑可以有效抑制裸鼠接种的人源前列腺癌的生长。
为了进一步证明依法韦仑给药对于裸鼠接种的人源前列腺癌生长的抑制作用,本实施例还采取免疫组织化学分析比较了未给药处理的对照组(ctr)与依法韦仑给药组(efv)裸鼠接种成瘤部位来源的肿瘤细胞中,肿瘤标志物psma和ki-67的表达水平。对未给药处理的对照组(ctr)与依法韦仑给药组(efv)的裸鼠接种部位获取的肿瘤标本进行常规脱水,石蜡包埋,切片,并按照试剂盒说明进行免疫组织化学sabc法染色(免疫组化染色操作步骤参考1,在本实施例中,使用的两种一抗分别为小鼠抗人psma的单克隆抗体及小鼠抗人ki-67单克隆抗体;二抗依旧使用生物素标记的羊抗小鼠二抗),检测肿瘤组织中肿瘤标志物psma和ki-67的表达水平。阳性呈现深浅程度不同的棕褐色颗粒;颗粒颜色越深,密度越大,代表该部位相应靶点蛋白表达量越高。
前列腺特异性膜抗原(prostatespecificmembraneantigen,psma)是前列腺癌的特征性蛋白之一,在前列腺癌细胞中表达量很高,而在其他类型的肿瘤或正常组织中表达量很低。另外,随着前列腺癌恶性程度的增高,前列腺癌细胞表达psma的量也相应增加。即从良性上皮细胞→高级别前列腺上皮内瘤(hgpin)→前列腺癌的过程中,psma阳性的细胞比例及细胞内psma的表达量会逐渐增加,免疫组织化学染色也会趋于加深。ki-67是细胞增殖相关的核蛋白,其表达水平可以有效反映肿瘤细胞的增殖速率。ki-67表达量下调,意味着肿瘤细胞的增殖过程受到抑制。
对psma及ki-67蛋白的免疫组织化学显色切片在光学显微镜下进行观察记录,结果如图8.b所示,与未给药处理的对照组(ctr)相比,依法韦仑给药组(efv)的肿瘤组织中psma及ki-67蛋白的表达量显著下调,表现为切片中免疫组化染色阳性的棕褐色颗粒密度及数量显著下降。上述两种肿瘤标志物表达量的下调,意味着在经过依法韦仑给药后,人前列腺癌来源的du145细胞在裸鼠体内的增殖及侵袭性受到抑制,表明依法韦仑可以有效抑制人源前列腺癌肿瘤的生长及进展。
8.依法伟仑对前列腺癌细胞及正常组织细胞增殖的影响
为了研究作为逆转录酶抑制剂的依法韦仑对于肿瘤细胞及正常组织细胞增殖的影响,本实施例选取前列腺癌细胞系du145及其对应的正常组织细胞系rwpe-2(非致瘤性),进行依法韦仑给药培养,给药起6天内,光学显微镜下观察细胞形态变化,并采用cck8法检测每日细胞增殖数量,以此来研究依法韦仑对于该细胞系增殖功能的影响。
实验结果如图9所示,结果表明,在依法韦仑给药后,非致瘤性的正常组织细胞rwpe-2的增殖几乎不受影响,而对应的前列腺癌细胞du145的增殖则明显受到抑制。后续研究表明,依法韦仑对肿瘤细胞增殖的抑制是可逆的,撤除药物后,细胞的增殖功能可以迅速恢复(本发明未示出)。以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!