一种斯赤列提取物的应用
本发明属于生物医药技术领域,具体涉及一种斯赤列提取物的应用。
背景技术:
骨质疏松是一种骨形成和骨吸收紊乱导致的代谢性骨疾病。该病与年龄呈正相关,目前我国人口老龄化日趋严重,骨质疏松症已成为我国面临的公共健康问题[2-4]。骨质疏松性骨折是老年患者致残和致死的主要原因之一,有研究表明,髋部发生骨折后1年之内,20%患者死于各种并发症,有50%患者因致残生活质量显著降低,造成巨大的家庭和社会负担。在骨骼组织微环境中,成骨细胞和破骨细胞的动态平衡维持着骨骼的稳态和重塑。成骨细胞主要负责骨形成,而破骨细胞主要负责骨吸收,健康状态下,二者的功能和活性处于平衡状态。当破骨细胞异常激活时,骨吸收量高于骨形成量,则会发生骨质流失骨密度减少,矿物质含量降低,骨骼脆性升高,导致骨质疏松,进而增加骨折的风险。目前临床上骨质疏松的治疗方案主要是使用双膦酸盐和降钙素类药物来抑制破骨细胞的活性,使骨吸收进程减慢,但是长期应用会导致破骨细胞处于“无应答”状态,临床效果不尽人意。近年来以增强成骨细胞的活性进而加快骨形成的方法引起学者注意,有望成为理想的治疗方法。
斯赤列(sambucusadnatawall.)为忍冬科接骨木属植物,干燥地上部分或全草,又名血满草、接骨药、接骨丹、大血草等,主要分布于云南四川等地。发明人在对斯赤列的提取分离过程中,意外地发现斯赤列提取物能够促进成骨细胞增殖与分化活性,具有成为治疗/预防骨质疏松药物的前景。
技术实现要素:
本发明的目的在于提供斯赤列提取物在制备治疗/预防骨质疏松药物中的应用。
本发明的目的是这样实现的:
斯赤列提取物在制备治疗/预防骨质疏松药物中的应用。
斯赤列提取物提高成骨细胞的增殖能力。
斯赤列提取物促进碱性磷酸酯酶的形成。
斯赤列提取物促进骨矿化结节的形成。
斯赤列提取物使得成骨细胞分化标记基因runx2、bsp、ocn和col1a1相对表达量上升。
斯赤列提取物促进成骨细胞分化。
斯赤列提取物通过以下方式得到:称取斯赤列样品100g,置具塞锥形瓶中,加溶剂50ml,超声提取2次,每次1h,抽滤,合并滤液减压浓缩得浸膏,所得浸膏经冷冻干燥后即得。
溶剂为水、二氯甲烷、乙醇、甲醇、丙酮、氯仿、乙酸乙酯、石油醚或正丁醇。
一种药物组合物,包含斯赤列提取物作为活性成分或者是药用载体。
本发明优点:
本发明提供的斯赤列提取物能够有效治疗/预防骨质疏松。
附图说明
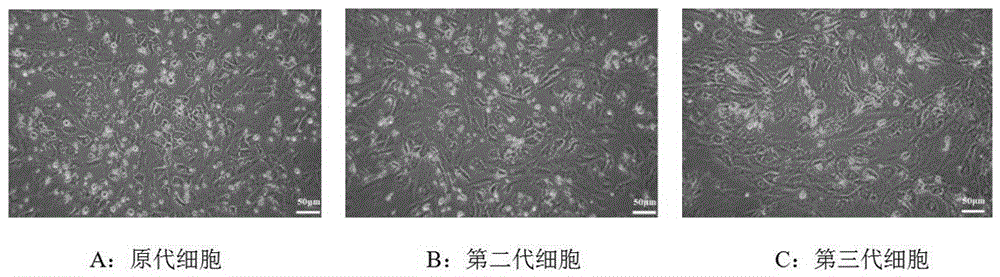
图1为成骨细胞的分离培养(×200)。
图2为saw-a/saw-b对成骨细胞的毒性分析。
图3为saw-a/saw-b对成骨细胞凋亡的影响。
图4为saw-a/saw-b对碱性磷酸酶活性的影响(×200)。
图5为saw-a/saw-b对成骨细胞钙化结节的影响(×200)。
图6为saw-a/saw-b对细胞增殖的影响。
图7为saw-a/saw-b对成骨细胞分化基因的影响。
具体实施方式
下面对本发明作进一步的说明,但不以任何方式对本发明加以限制,基于本发明所作的任何变换,均属于本发明的保护范围。
斯赤列提取物在制备治疗/预防骨质疏松药物中的应用。
斯赤列提取物提高成骨细胞的增殖能力。
斯赤列提取物促进碱性磷酸酯酶的形成。
斯赤列提取物促进骨矿化结节的形成。
斯赤列提取物使得成骨细胞分化标记基因runx2、bsp、ocn和col1a1相对表达量上升。
斯赤列提取物促进成骨细胞分化。
斯赤列提取物通过以下方式得到:称取斯赤列样品100g,置具塞锥形瓶中,加溶剂50ml,超声提取2次,每次1h,抽滤,合并滤液减压浓缩得浸膏,所得浸膏经冷冻干燥后即得。
溶剂为水、二氯甲烷、乙醇、甲醇、丙酮、氯仿、乙酸乙酯、石油醚或正丁醇。
一种药物组合物,包含斯赤列提取物作为活性成分或者是药用载体。
实施例1
称取斯赤列样品100g,置具塞锥形瓶中,加水50ml,超声提取2次,每次1h,抽滤,合并滤液减压浓缩得浸膏,所得浸膏经冷冻干燥后即得斯赤列水提物(saw-a)样品(1.5g,提取率为1.5%)。
实施例2
称取斯赤列样品100g,置具塞锥形瓶中,加二氯甲烷50ml,超声提取2次,每次1h,抽滤,合并滤液减压浓缩得浸膏,所得浸膏经冷冻干燥后即得斯赤列二氯甲烷提取物(saw-b)样品(2.0g,提取率为2.0%)。上述样品置于4℃冰箱保存、备用。
实施例3
同实施例1,其中不同的地方是:溶剂为乙醇。
实施例4
同实施例1,其中不同的地方是:溶剂为甲醇。
实施例5
同实施例1,其中不同的地方是:溶剂为丙酮。
实施例6
同实施例1,其中不同的地方是:溶剂为氯仿。
实施例7
同实施例1,其中不同的地方是:溶剂为乙酸乙酯。
实施例8
同实施例1,其中不同的地方是:溶剂为石油醚。
实施例9
同实施例1,其中不同的地方是:溶剂为正丁醇。
实施例10
以实施例1和实施例2制备得到的斯赤列提取物进行试验,具体试验方法和结果如下:
1.实验方法
1.1大鼠成骨细胞分离与培养将新生sd大鼠用体积分数为75%乙醇浸洗,在超净操作台内解剖取出颅骨,去除其他组织后剪成1mm×1mm×1mm大小组织块,组织块放入无菌离心管中并加入0.25%胰蛋白酶在37℃下消化30min,离心弃去上清液,加入2g/mlⅱ型胶原酶在37℃下消化4h,再次离心弃去上清液,加入体积分数为10%胎牛血清和1%抗生素混合物的dmem培养基,调整细胞浓度为5×106个/l,将细胞悬液接种于100mm培养皿,每皿接种10ml,置于37℃、体积分数为5%的co2培养箱中培养,1d后更换培养基,弃未贴壁细胞,之后每3d换液;待细胞基本融合后,用胰酶消化,以1:2比例传代之后继续培养,选取生长良好的第3代成骨细胞进行下列实验。
1.2cck-8检测取第3代对数生长期的成骨细胞以5×103个/孔接种于96孔培养板,培养24h后更换分别含有saw-a或saw-b(78.125~20000µg/ml)的l-dmem培养基干预培养,受试物干预48h后,进行cck8检测saw-a和saw-b的细胞毒性。确定两受试物的最大无毒浓度后,另取成骨细胞以5×103个/孔接种于96孔细胞培养板内,各组细胞均同时设置3个复孔。分别加saw-a和saw-b干预24h、48h、72h后,进行cck-8检测。酶标仪测定450nm处的od值。
1.3流式细胞仪检测取第3代对数生长期成骨细胞以2×104个/孔接种于6孔培养板,培养24h后,分别加saw-a(312.5µg/ml)和saw-b(156.15µg/ml)干预培养6d,消化细胞,pbs洗3遍,将爬片置入fda/pi混合液(fda与pi工作终浓度分别为100,400mg/l)中,避光染色5min,流式细胞仪检测细胞活性。
1.4碱性磷酸酶染色取第3代对数生长期成骨细胞以2×104个/孔接种于6孔培养板,培养24h后,更换含不同浓度的saw-a和saw-b的l-dmem培养基,saw-a的浓度为312.5µg/ml,saw-b的浓度为156.15µg/ml,干预培养6d,取出细胞爬片,pbs洗3遍,4℃下40g/l多聚甲醛固定30min,再次用pbs清洗3次,每次3-5min。清洗完毕后,去除洗涤液,加入适量bcip/nbt染色工作液,确保能充分覆盖样品,室温避光孵育5-30min,显色至预期深浅后去除bcip/nbt染色工作液,用蒸馏水洗涤两次,在光学显微镜下观察并拍照。
1.5钙化结节(茜素红法)染色取第3代对数生长期成骨细胞以2×104个/孔接种于6孔培养板,24h后,分别加saw-a(312.5µg/ml)和saw-b(156.15µg/ml)干预细胞;干预6d后,取出细胞爬片,pbs洗3遍,4℃下40g/l多聚甲醛固定30min,然后用ddh2o清洗3次,每次3-5min。清洗完毕后,将水完全吸干净,慢慢加入茜素红染色液,染色20-30min,ddh2o洗3-5次,每孔加入适量ddh2o防止孔内干燥,光学显微镜下观察并拍照。
1.6实时荧光定量pcr(qpcr)取第3代对数生长期成骨细胞以2×104个/孔接种于6孔培养板,培养24h后,分别加saw-a(312.5µg/ml)和saw-b(156.15µg/ml)干预细胞6d后,总rna提取采用trizol法,pcr过程及相关程序操作参考说明书,相关引物序列见表1,进行qpcr检测成骨相关基因runx2、bsp、ocn和col1a1,采用2-δδct法并以β-actin为内参计算基因相对表达量。
1.7统计学分析采用spss22.0统计学软件分析,计量数据以±s表示,组间比较采用单因素方差分析,方差齐采用lsd或tukey分析,p<0.05为差异有统计学意义。
结果
2.1大鼠成骨细胞原代培养
原代成骨细胞大多呈梭形且有多个长长的胞浆突起,细胞核较大呈圆形或椭圆形,后期向成纤维化细胞型态发展,详见图1a;第二代细胞形态多样,呈梭形、菱形、多边形或不规则形状,详见图1b;第三代细胞呈梭形或不规则的多角形,详见图1c,第三代的细胞成骨细胞典型特征明显,故后续实验选取稳定性和均一性较好的第三代细胞作为研究对象。
2.2saw-a/saw-b对成骨细胞的毒性分析
结果显示,用不同浓度saw-a/saw-b干预成骨细胞后,saw-a的最大无毒浓度为312.5µg/ml,saw-b的最大无毒浓度156.15µg/ml,详见图2。
2.3saw-a/saw-b对成骨细胞凋亡的影响
结果显示,经saw-a和saw-b干预后,成骨细胞的凋亡率下降,提示saw-a和saw-b具有抑制成骨细胞凋亡的作用,其中saw-b组的凋亡细胞最少,详见图3。
2.4saw-a/saw-b对碱性磷酸酶活性的影响
结果显示,saw-a、saw-b组染色区域明显增大,且saw-b组更明显,说明saw-a和saw-b均可提高alp活性,详见图4。
2.5成骨细胞钙化结节染色结果
与对照组相比,经saw-a、saw-b干预后细胞中钙化结节的数量和面积明显增多,且saw-b干预组更明显,说明saw-a和saw-b均可促进成骨细胞向成骨分化,详见图5。
2.6saw-a/saw-b对成骨细胞增殖的影响
结果显示,与对照组相比较,saw-a和saw-b均可显著促进成骨细胞的增殖,作用在48h及72h尤为明显,且saw-b的作用要强于saw-a,详见图6。
2.7saw-a/saw-b对成骨细胞分化基因的影响
结果显示,与对照组相比,saw-a/saw-b处理后,成骨细胞分化基因runx2、bsp、ocn和col1a1相对表达量均明显上升,并且对bsp和col1a1基因表达的促进作用saw-b强于saw-a的,详见图7。
成骨细胞由骨髓间充质干细胞分化而成,参与骨形成和调控破骨细胞功能进而影响骨吸收,促进成骨细胞增殖与分化,改善骨的动态平衡,是预防和治疗骨质疏松的重要手段。碱性磷酸酶(alp),由成骨细胞分泌,是评价骨形成和骨转换的最常用、最经典的生化指标之一,alp活性的提高是骨髓间充质干细胞向成骨细胞分化的重要标志,可反映成骨细胞的活性及状态。alp是与成骨分化正相关的分化标志物,而矿化是细胞内钙盐的直接反映,钙盐形成越多则成骨分化越活跃。alp和钙化结节可分别作为成骨分化早期和晚期的标志。本实验的结果显示,saw-a/saw-b具有明显促进成骨细胞增殖,提高alp活性及促进钙化结节形成的作用,提示它们可促进成骨分化。runx2被认为是早期激活成骨细胞分化和去分化的特异性转录因子,在成骨分化的多种信号中起到了中心作用,参与多种信号途径的,有研究已证实敲除runx2基因会导致小鼠的骨形成明显减少,甚至出生时会因呼吸衰竭而死亡。此外runx2通过直接或间接调节众多的成骨细胞相关基因来调节成骨细胞分化,其表达增加能够刺激干细胞向成骨细胞分化。而ocn是runx2的下游转录因子,在骨细胞的成熟、形态和功能中起着重要作用;此外ocn还是成骨细胞活性、组织矿化的重要指标,ocn的表达水平,是骨形成晚期高度特异性的成骨细胞标志物。bsp、col1a1均是骨形成过程中起关键调节作用的重要因子,近几年研究均表明其高表达与成骨分化成正相关,很多研究将bsp、col1a1当成成骨细胞的标记物。通过本实验的研究,结果表明saw-a和saw-b对四个成骨细胞分化基因均有促进其表达的作用,其中,saw-b的活性要强于saw-a。
实施例11
分别以实施例3至实施例9制备得到的斯赤列提取物进行试验,试验方法同实验例10,结果均表明,本发明所述的斯赤列提取物可促进成骨细胞分化,是一种治疗/预防骨质疏松药物。
- 还没有人留言评论。精彩留言会获得点赞!