SAGE1抑制剂在制备药物或试剂盒中的用途
本案为分案申请,原申请的申请号为201911282567.1,申请日为2019-12-13,发明创造名称为《sage1抑制剂在制备药物或试剂盒中的用途》本发明涉及生物
技术领域:
,特别是涉及sage1抑制剂在制备药物或试剂盒中的用途。
背景技术:
:2001年tuschl等人首次证明人工合成的sirna导入到哺乳动物细胞后可以实现对靶基因的表达抑制,自此以后,在基础研究与制药应用两大领域,rna干扰技术均被广泛应用。该技术被认为在传统药物不可行(undrugable)的疾病或靶点上仍具有巨大的应用潜力。因此,rna干扰技术不仅作为一种高效多能的重要生物医学研究工具脱颖而出,更为靶向药物的研制带来了革命性的突破。短短十来年,基于rna干扰的生物制药业已成为一个新兴战略领域,并已取得了巨大的进展。目前,已有进入各期临床研究阶段的药物品种主要集中在抗病毒、抗肿瘤,以及一些罕见病、或无药可用(未满足)的病症上。目前已经报道的sirna体内外递送策略大致可分为病毒载体递送和非病毒载体递送两大类。裸sirna/shrna/dsrna可以全身递送给药或依赖于递送技术将靶向于特定基因的sirna直接递送至作用部位可以产生预期的诱导抑制效应。常见的病毒递送载体包括腺病毒、腺相关病毒、逆转录病毒、慢病毒等,比如疱疹病毒载体和杆状病毒载体也已用于在转导进入细胞后表达shrna。新兴抗肿瘤治疗药物溶瘤病毒就属于这一类,并不是所有的病毒在感染后都会导致宿主细胞死亡,为了达到目的,通过连入特异性靶向促癌基因的shrna等方法可以进一步强化溶瘤病毒对于肿瘤细胞的杀伤能力。用于定向沉默的靶基因以及靶向序列的选择对于这些病毒类药物至关重要。技术实现要素:鉴于以上所述现有技术的缺点,本发明的目的在于提供sage1抑制剂在制备药物或试剂盒中的用途,用于解决现有技术中的问题。为实现上述目的及其他相关目的,本发明一方面提供sage1抑制剂在制备药物或试剂盒中的用途,所述药物或试剂盒用于:调节sage1-ints3复合物的表达水平。在本发明一些实施方式中,所述sage1抑制剂能够抑制sage1的表达和/或功能。在本发明一些实施方式中,所述sage1抑制剂为单一有效成分。在本发明一些实施方式中,所述sage1抑制剂选自核酸分子、蛋白分子或化合物。在本发明一些实施方式中,所述核酸分子选自针对sage1的干扰rna、针对sage1的反义寡核苷酸、用于敲除或敲减sage1表达的物质。在本发明一些实施方式中,所述蛋白分子选自抗sage1抗体,优选为单克隆抗体。在本发明一些实施方式中,所述核酸分子的靶序列包括seqidno.1~9其中之一所示的序列。在本发明一些实施方式中,所述核酸分子的多核苷酸序列包括seqidno.10~18其中之一所示的序列。在本发明一些实施方式中,所述核酸分子的多核苷酸序列包括seqidno.19~22其中之一所示的序列。在本发明一些实施方式中,所述sage1抑制剂选自能够与sage1竞争结合ints3或者干扰sage1与ints3之间的相互作用。在本发明一些实施方式中,所述sage1抑制剂选自ints6、ints6l中的一种或多种的组合。在本发明一些实施方式中,所述肿瘤为sage1阳性的肿瘤。在本发明一些实施方式中,所述肿瘤选自实体瘤或血液肿瘤,所述肿瘤优选选自肠癌、肺癌、肝癌、乳腺癌、食管癌、头颈癌、皮肤癌、肾癌、白血病、结肠癌、肝细胞肝癌、卵巢浆液性囊腺癌、子宫内膜癌、甲状腺癌、皮肤黑色素瘤、肺腺癌、头颈鳞状细胞癌、多形成性胶质细胞瘤、前列腺癌、胸腺癌、脑低级别胶质瘤、直肠腺癌、嗜铬细胞瘤和副神经节瘤、食管癌、肾透明细胞癌、宫颈鳞癌和腺癌、膀胱尿路上皮癌、肾乳头状细胞癌、胰腺癌、胃癌、肾嫌色细胞癌、乳腺浸润癌、肺鳞癌、肉瘤、急性髓细胞样白血病。本发明另一方面提供一种组合物,所述组合物包括sage1抑制剂,所述组合物用于:调节sage1-ints3复合物的表达水平。附图说明图1a显示为本发明实施例1测序分析结果示意图。图1b显示为本发明实施例1sage1阳性表达癌症患者比例分析示意图。图1c显示为本发明实施例1肿瘤组织和癌旁组织sage1表达对比示意图。图1d显示为本发明实施例1sage1阳性表达与sage1阴性表达患者的总体生存期对比示意图。图1e显示为本发明实施例1sage1高表达与sage1低表达患者的总体生存期对比示意图。图2a显示为本发明实施例2组织的肿瘤免疫成像示意图。图2b显示为本发明实施例2qpcr检测结果示意图。图2c显示为本发明实施例2针对通用细胞系lo2、293t、k562、hutu80、u2os的检测结果示意图。图2d显示为本发明实施例2qpcr检测结果示意图。图2e显示为本发明实施例2sage1表达与crc预后因素之间的相关性评估结果示意图。图3a显示为本发明实施例3sage1对a375肿瘤细胞增殖作用示意图。图3b显示为本发明实施例3sage1对hutu80肿瘤细胞增殖作用示意图。图3c显示为本发明实施例3sage1对caco2肿瘤细胞增殖作用示意图。图3d显示为本发明实施例3回复sage1细胞分选后进行软琼脂克隆形成实验示意图。图3e显示为本发明实施例3裸鼠十二指肠癌移植瘤实验结果示意图。图3f显示为本发明实施例3大肠癌移植瘤实验结果示意图。图4a显示为本发明实施例4针对sage1的shrna腺病毒对sage1阳性的肝癌肿瘤pdx模型的抑制结果示意图。图4b显示为本发明实施例4针对sage1的shrna腺病毒对sage1阳性的低分化非小细胞上皮来源肺癌pdx肿瘤模型的抑制结果示意图。图4c显示为本发明实施例4针对sage1的shrna腺病毒对sage1阴性的肝癌肿瘤pdx模型的抑制结果示意图。图5a显示为本发明实施例5银染胶分析结果示意图。图5b显示为本发明实施例5质谱鉴定结果示意图。图5c显示为本发明实施例5中sage1和ints3之间的细胞内源相互作用示意图。图5d显示为本发明实施例6体外纯化出sage1-ints3复合物蛋白结果示意图。图5e显示为本发明实施例6体外表达纯化出ints6-ints3复合物结果示意图。图5f显示为本发明实施例5中正常无sage1存在的293t细胞系中ints3和ints6作用关系分析结果示意图。图5g显示为本发明sage1和ints6的蛋白序列比对示意图。图5h显示为本发明针对sage1、ints3、ints6蛋白分别进行了体内细胞竞争实验结果示意图。图5i显示为本发明实施例6体外蛋白复合物竞争形成实验结果示意图。图5j显示为本发明实施例6sage1-ints3复合物晶体结构解析结果示意图。图6a显示为本发明实施例7野生型sage1和ints3的结合常数测量结果示意图。图6b显示为本发明实施例7突变体sage1和ints3的结合常数测量结果示意图。图6c显示为本发明实施例8293t细胞中的co-ip实验结果示意图。图6d显示为本发明实施例9敲低sage1的肠癌肿瘤细胞中野生型sage1和sage1突变体的回复实验结果示意图。图6e显示为本发明实施例9敲低sage1的食管癌肿瘤细胞中野生型sage1和sage1突变体的回复实验结果示意图。图6f显示为本发明实施例9敲除sage1的十二指肠肿瘤细胞中野生型sage1和sage1突变体的回复实验结果示意图。图6g显示为本发明实施例10移植瘤实验的瘤体积结果示意图。图6h显示为本发明实施例10移植瘤实验的瘤重量结果示意图。图6i显示为本发明实施例11hutu80中分别敲低sage1或ints3后rnaseq显著变化基因及变化方向一致性示意图。图6j显示为本发明实施例11敲低sage1的caco2里回复野生型sage1的rnaseq显著变化差异基因富集的相关信号通路示意图。图6k显示为本发明实施例11敲低sage1的caco2里回复突变体sage1的rnaseq显著变化差异基因富集的相关信号通路示意图。具体实施方式为了使本发明的发明目的、技术方案和有益技术效果更加清晰,以下结合实施例对本发明进行进一步详细说明,熟悉此技术的人士可由本说明书所揭露的内容容易地了解本申请发明的其他优点及功效。癌症/睾丸(cancer-testisantigen)抗原家族基因正常情况下仅表达于成年动物的睾丸,在其他正常的组织中低表达或不表达,但也表达在几乎所有类型的恶性肿瘤和血癌中。这些cta被认为是癌症的关键生物标志物,也是癌症免疫疗法的优良抗原来源,许多肿瘤睾丸抗原如ny-eso-1癌症疫苗已进入三期临床。近年来相关研究评估了它们在肿瘤发生中的作用可能涉及在发育,干细胞分化和癌发生过程中调节重要的细胞过程。已有研究证明了大量的癌一睾丸抗原在肿瘤干细胞(cscs)或肿瘤起源细胞(cics)中的选择性表达,然而,这些重新激活的睾丸蛋白是否以及如何在支持致瘤性中发挥作用仍然远未被理解。本发明发明人经过大量研究意外发现,位于x染色体(x:135895410-135913726,xq26.3)的ct-x癌症睾丸抗原sage1在正常睾丸组织外,sage1作为肿瘤特异性抗原在多种类型人类肿瘤中异常激活,并可以与ints3形成功能复合物,sage1-ints3复合物在多种肿瘤细胞及肿瘤组织中特异性存在,并进一步证实了特异性针对sage1基因/蛋白靶向,或针对sage1-ints3复合物基因/蛋白靶向能极大地抑制sage1阳性癌细胞的增殖、锚定非依赖性生长和体内异种移植瘤的生长,从而为肿瘤的治疗提供了新的有效靶点,在此基础上完成了本发明。本发明第一方面提供sage1抑制剂在制备药物或试剂盒中的用途,所述药物或试剂盒用于治疗肿瘤。本发明发明人发现,sage1不仅在肿瘤患者中具有普遍地跨癌种的阳性表达,且sage1阳性表达的患者普遍显示出较差的预后,还在肿瘤组织中特异性地阳性表达,而在健康组织(例如,癌旁组织中则没有表达)。在进一步对sage1的表达和/或功能进行抑制后发现,sage1的抑制可以显著地抑制肿瘤细胞的增殖、迁移、锚定非依赖性生长等,而在中断体细胞中回复sage1可以回复该细胞克隆形成能力,从而验证了sage1抑制剂可以被作为用于治疗肿瘤的药物。本发明中,“治疗”一词包括可导致欲求的药学和/或生理效果的预防性、治愈性或缓和性处置。该效果较佳是指医疗上可减少疾病的一种或多种症状或者完全消除疾病,或阻滞、延迟疾病的发生和/或降低疾病发展或恶化的风险。本发明第二方面提供sage1抑制剂在制备药物或试剂盒中的用途,所述药物或试剂盒用于调节sage1-ints3复合物的表达水平。本发明发明人发现,sage1作为肿瘤特异性抗原在异常激活后可以与ints3形成复合物,且sage1-ints3复合物在多种肿瘤细胞及肿瘤组织中特异性存在,并且在将sage1抑制以后,回复带有与ints3相互作用关键氨基酸突变的点突变sage1蛋白(f838a、f873a、k874a、r872a、m832a、q840a),回复突变体sage1无法像回复野生型sage1一样促进肿瘤细胞增殖,说明sage1必须通过和ints3相互作用形成复合物才能行使功能,从而验证了破坏sage1-ints3复合物的相互作用,减少细胞中存在的sage1-ints3复合物的量,可以被用于制备抑制肿瘤细胞生长的药物或试剂盒。本发明中,sage1-ints3复合物通常指sage1和ints3之间通过蛋白-蛋白相互作用所形成的复合物。所述ints3通常可以形成二聚体(例如,在溶液状态下),所形成的二聚体可以进一步与sage1形成sage1-ints3复合物,两者之间可以通过氢键、盐桥等相互作用。所述sage1-ints3复合物的晶体结构通常可以具有如下所示的晶胞参数:α=90±0.1°、β=113.280±0.1°、γ=90±0.1°。所述sage1-ints3复合物中,sage1与ints3之间形成复合物的关键氨基酸通常可以包括f838、f873、k874、r872、m832、q840等。本发明中,所述sage1抑制剂通常指可以抑制sage1的表达和/或功能的物质。例如,所述sage1抑制剂可以部分抑制,即降低sage1的表达和/或功能,也可为完全抑制,即完全消除sage1的表达和/或其功能,这一功能可以是sage1与ints3进行结合,形成sage1-ints3复合物的功能。合适的能够作为sage1抑制剂的物质的种类对于本领域技术人员来说应该是已知的,例如,所述抑制剂可以是拮抗剂、阻断剂等,再例如,所述sage1抑制剂的抑制功能可以是在sage1基因核酸分子水平(例如,mrna水平、dna水平)和/或蛋白分子水平上表达水平的抑制,再例如,所述sage1抑制剂也可以是与sage1竞争结合ints3的物质。更具体的,所述sage1抑制剂可以是核酸分子、蛋白分子或化合物等,例如,所述核酸分子可以选自针对sage1的干扰rna、针对sage1的反义寡核苷酸、用于敲除或敲减sage1表达的物质,更具体可以是sirna、mirna、shrna、基因敲除载体、基因表达载体(例如,能够表达sirna、shrna、干扰rna等)等;再例如,所述蛋白分子可以选自抗sage1抗体,所述抗体可以是单克隆抗体、多克隆抗体等;再例如,所述sage1抑制剂可以是能够与sage1竞争结合ints3的物质,具体可以是ints6(ddx26,accession:np_036273.1)、ints6l(ddx26b,accession:q8bnd4.1)等中的一种或多种的组合。在本发明一具体实施例中,所述核酸分子的靶序列可以包括seqidno.1~9其中之一所示的序列。在本发明另一具体实施例中,所述核酸分子的多核苷酸序列可以包括seqidno.10~18其中之一所示的序列。在本发明另一具体实施例中,所述核酸分子的多核苷酸序列可以包括seqidno.19~22其中之一所示的序列。本发明所提供的药物或试剂盒中,所述sage1抑制剂可以是作为单一有效成分,也可以与其他活性组分进行组合,共同地用于治疗肿瘤。本发明所提供的药物或试剂盒中,所述肿瘤通常为sage1阳性的肿瘤。所述sage1阳性通常指出现sage1的表达、或sage1的表达水平高于一定的标准,例如,sage1阳性可以是肿瘤组织中可检测出sage1的mrna的表达,再例如,sage1阳性可以是肿瘤组织中可检测出sage1的蛋白的表达,再例如,sage1阳性可以是肿瘤组织的sage1的mrna表达水平高于其周围健康组织,再例如,sage1阳性可以是肿瘤组织的sage1蛋白的表达水平高于其周围健康组织。所述肿瘤可以是实体瘤或血液肿瘤,更具体可以是肠癌、肺癌、肝癌、乳腺癌、食管癌、头颈癌、皮肤癌、肾癌、白血病、coad(结肠癌),lihc(肝细胞肝癌),ov(卵巢浆液性囊腺癌),ucec(子宫内膜癌),thca(甲状腺癌),skcm(皮肤黑色素瘤),luad(肺腺癌),hnsc(头颈鳞状细胞癌),gbm(多形成性胶质细胞瘤),prad(前列腺癌),thym(胸腺癌),lgg(脑低级别胶质瘤),read(直肠腺癌),pcpg(嗜铬细胞瘤和副神经节瘤),esca(食管癌),kirc(肾透明细胞癌),cesc(宫颈鳞癌和腺癌),blca(膀胱尿路上皮癌),kirp(肾乳头状细胞癌),paad(胰腺癌),stad(胃癌),kich(肾嫌色细胞癌),brca(乳腺浸润癌),lusc(肺鳞癌),sarc(肉瘤),laml(急性髓细胞样白血病)等。本发明第三方面提供一种组合物,所述组合物包括sage1抑制剂,所述组合物用于:治疗肿瘤;和/或,调节ints3-sage1复合物的表达水平。所述sage1抑制剂可以是如上所述的各种sage1抑制剂。本发明第四方面提供一种调控方法,所述调控方法可以用于调节sage1-ints3复合物的表达水平,具体可以用于调节个体、细胞等中sage1-ints3复合物的表达水平。例如,可以是向个体施用有效量的sage1抑制剂、或本发明第三方面所提供的组合物。本发明第五方面提供一种治疗方法包括:向个体施用治疗有效量的sage1抑制剂、或本发明第三方面所提供的组合物。本发明所提供的治疗方法可以用于治疗包括但不限于肿瘤等的适应症。所述肿瘤可以是实体瘤或血液肿瘤,更具体可以是肠癌、肺癌、肝癌、乳腺癌、食管癌、头颈癌、皮肤癌、肾癌、白血病、coad(结肠癌),lihc(肝细胞肝癌),ov(卵巢浆液性囊腺癌),ucec(子宫内膜癌),thca(甲状腺癌),skcm(皮肤黑色素瘤),luad(肺腺癌),hnsc(头颈鳞状细胞癌),gbm(多形成性胶质细胞瘤),prad(前列腺癌),thym(胸腺癌),lgg(脑低级别胶质瘤),read(直肠腺癌),pcpg(嗜铬细胞瘤和副神经节瘤),esca(食管癌),kirc(肾透明细胞癌),cesc(宫颈鳞癌和腺癌),blca(膀胱尿路上皮癌),kirp(肾乳头状细胞癌),paad(胰腺癌),stad(胃癌),kich(肾嫌色细胞癌),brca(乳腺浸润癌),lusc(肺鳞癌),sarc(肉瘤),laml(急性髓细胞样白血病)等。本发明中,“个体”通常包括人类、非人类的灵长类,如哺乳动物、狗、猫、马、羊、猪、牛等,其可因利用所述制剂、试剂盒或联合制剂进行治疗而获益。本发明中,“治疗有效量”通常指一用量在经过适当的给药期间后,能够达到治疗如上所列出的疾病的效果。本发明所提供的sage1基因可以作为靶点应用于肿瘤药物,沉默sage1基因表达可以显著抑制肿瘤细胞增殖、迁移,具体来说,针对多种sage1呈阳性表达的多种不同类型的肿瘤细胞,如恶性黑色素瘤a375、十二指肠腺癌hutu80、大肠癌caco2、食管癌te1中沉默干扰sage1表达均能显著抑制肿瘤细胞的增殖和迁移,说明sage1是一种跨癌种起作用的重要促癌因子。此外,沉默sage1基因表达可以显著抑制人源实体瘤的生长,并可以促进实体瘤部位肿瘤细胞的死亡,说明该靶点具有显著生理功能。另外,由于sage1在除了睾丸外其它正常组织中不表达,而在多种肿瘤组织中特异性表达,且sage1蛋白虽然定位在核内,但该蛋白肽端能被mhc特异性呈递在肿瘤细胞表面,有利于运用定向治疗靶向识别,或激活免疫系统应用于免疫靶向治疗,所以针对sage1进行基因干扰治疗具有良好的特异性,对sage1无表达的正常组织不影响,不会影响正常的生理功能及健康。综上所述,sage1抑制剂(即,用于抑制sage1的表达和/或功能的物质)在生物制药业及肿瘤临床治疗等领域具有良好的应用前景。下面通过实施例对本申请的发明予以进一步说明,但并不因此而限制本申请的范围。除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本
技术领域:
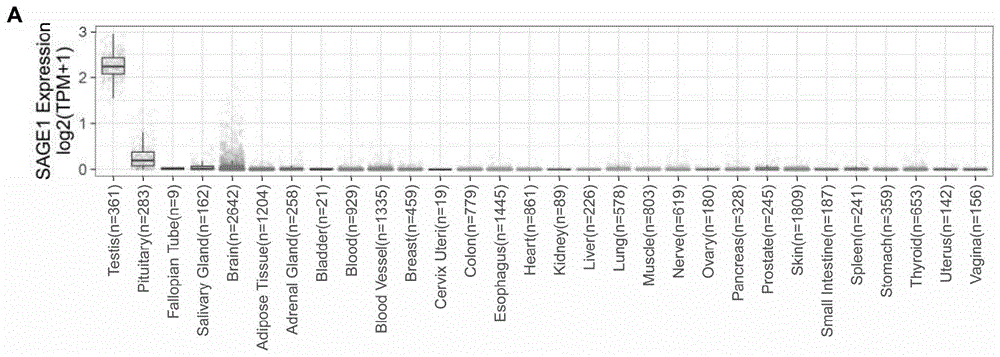
常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。实施例1运用gtex数据库(genotype-tissueexpression(gtex)program,http://commonfund.nih.gov/gtex/)中人正常组织rnaseq测序数据,以测序tpm值分析sage1的mrna表达量,针对正常人体30个部位测序分析结果显示sage1基因主要特异性高表达在睾丸中,同时在大脑神经组织中有微量表达,而在其他人体组织中基本没有转录表达,见图1a。运用tcga(thecancergenomeatlas,https://www.cancer.gov/about-nci/organization/ccg/research/structural-genomics/tcga)泛癌(pan-cancer)病人公共数据库(下载链接https://www.cbioportal.org)进行分析,在26种实体瘤(coad(结肠癌),lihc(肝细胞肝癌),ov(卵巢浆液性囊腺癌),ucec(子宫内膜癌),thca(甲状腺癌),tgct(睾丸癌),skcm(皮肤黑色素瘤),luad(肺腺癌),hnsc(头颈鳞状细胞癌),gbm(多形成性胶质细胞瘤),prad(前列腺癌),thym(胸腺癌),lgg(脑低级别胶质瘤),read(直肠腺癌),pcpg(嗜铬细胞瘤和副神经节瘤),esca(食管癌),kirc(肾透明细胞癌),cesc(宫颈鳞癌和腺癌),blca(膀胱尿路上皮癌),kirp(肾乳头状细胞癌),paad(胰腺癌),stad(胃癌),kich(肾嫌色细胞癌),brca(乳腺浸润癌),lusc(肺鳞癌),sarc(肉瘤))和1种血液癌(laml(急性髓细胞样白血病))病人中,sage1阳性表达(sage1阳性定义依据为该病例sage1fpkm>0,sage1阴性定义依据为该病例sage1fpkm=0)癌症患者的比例,见图1b。运用tcga(thecancergenomeatlas,https://www.cancer.gov/about-nci/organization/ccg/research/structural-genomics/tcga)泛癌(pan-cancer)病人公共数据库(下载链接https://www.cbioportal.org)进行分析,在25种实体瘤(coad(结肠癌),lihc(肝细胞肝癌),ov(卵巢浆液性囊腺癌),ucec(子宫内膜癌),thca(甲状腺癌),skcm(皮肤黑色素瘤),luad(肺腺癌),hnsc(头颈鳞状细胞癌),gbm(多形成性胶质细胞瘤),prad(前列腺癌),thym(胸腺癌),lgg(脑低级别胶质瘤),read(直肠腺癌),pcpg(嗜铬细胞瘤和副神经节瘤),esca(食管癌),kirc(肾透明细胞癌),cesc(宫颈鳞癌和腺癌),blca(膀胱尿路上皮癌),kirp(肾乳头状细胞癌),paad(胰腺癌),stad(胃癌),kich(肾嫌色细胞癌),brca(乳腺浸润癌),lusc(肺鳞癌),sarc(肉瘤))和1种血液癌(laml(急性髓细胞样白血病))病人中,sage1阳性表达根据测序fpkm进行表达量作图,同时将泛癌病人中sage1表达量和癌旁组织表达量进行作图,显示sage1在肿瘤组织表达量高于癌旁组织,见图1c。运用tcga(thecancergenomeatlas,https://www.cancer.gov/about-nci/organization/ccg/research/structural-genomics/tcga)泛癌(pan-cancer)病人公共数据库(下载链接https://www.cbioportal.org)进行分析,在25种实体瘤(coad(结肠癌),lihc(肝细胞肝癌),ov(卵巢浆液性囊腺癌),ucec(子宫内膜癌),thca(甲状腺癌),skcm(皮肤黑色素瘤),luad(肺腺癌),hnsc(头颈鳞状细胞癌),gbm(多形成性胶质细胞瘤),prad(前列腺癌),thym(胸腺癌),lgg(脑低级别胶质瘤),read(直肠腺癌),pcpg(嗜铬细胞瘤和副神经节瘤),esca(食管癌),kirc(肾透明细胞癌),cesc(宫颈鳞癌和腺癌),blca(膀胱尿路上皮癌),kirp(肾乳头状细胞癌),paad(胰腺癌),stad(胃癌),kich(肾嫌色细胞癌),brca(乳腺浸润癌),lusc(肺鳞癌),sarc(肉瘤))和1种血液癌(laml(急性髓细胞样白血病))共8979例病人中,sage1阳性表达(sage1阳性定义依据为该病例sage1fpkm>0,sage1阴性定义依据为该病例sage1fpkm=0)癌症患者(4483例)在96个月观察时间内显示总体生存期较短,预后较差(p=1.389031e-14**),具体结果如图1d所示。运用tcga(thecancergenomeatlas,https://www.cancer.gov/about-nci/organization/ccg/research/structural-genomics/tcga)泛癌(pan-cancer)病人公共数据库(下载链接https://www.cbioportal.org)进行分析,在25种实体瘤(coad(结肠癌),lihc(肝细胞肝癌),ov(卵巢浆液性囊腺癌),ucec(子宫内膜癌),thca(甲状腺癌),skcm(皮肤黑色素瘤),luad(肺腺癌),hnsc(头颈鳞状细胞癌),gbm(多形成性胶质细胞瘤),prad(前列腺癌),thym(胸腺癌),lgg(脑低级别胶质瘤),read(直肠腺癌),pcpg(嗜铬细胞瘤和副神经节瘤),esca(食管癌),kirc(肾透明细胞癌),cesc(宫颈鳞癌和腺癌),blca(膀胱尿路上皮癌),kirp(肾乳头状细胞癌),paad(胰腺癌),stad(胃癌),kich(肾嫌色细胞癌),brca(乳腺浸润癌),lusc(肺鳞癌),sarc(肉瘤))和1种血液癌(laml(急性髓细胞样白血病))sage1阳性表达(sage1阳性定义依据为该病例sage1fpkm>0,sage1阴性定义依据为该病例sage1fpkm=0)癌症患者(4483例)依据中位数区分sage1表达量高低(sage1高表达2242例,sage1低表达例2241),在96个月观察时间内显示sage1高表达病人总体生存期较短,预后较差(p=1.244621e-11**),具体结果如图1e所示。实施例2运用针对sage1的抗体特异性针对组织进行免疫组化,用作组织的肿瘤免疫成像:如图2a所示,图中用到的人正常睾丸、肠癌、食管癌、皮肤癌、喉癌、肾癌、切片均来自上海市第九人民医院北院肿瘤科,肝癌和肺癌切片取自上海市第九人民医院北院肿瘤科人源pdx肿瘤模型。1、试剂:pbst缓冲液、苏木素染色液、抗原复性剂、dab溶液、一抗稀释液、sage1一抗(novus,nbp1-84355sage1antibody兔抗人)、hrp标记的二抗(抗兔)。2、实验操作流程1)试剂配制二甲苯,100%乙醇,95%乙醇,75%乙醇,50%乙醇灭活酶试剂:3%h2o2-甲醇溶液,1ml30%h2o2加入到9ml甲醇中pbst洗涤液:1000mlph7.4pbs+3mltriton混匀一抗稀释液:3%bsa-pbst溶液,0.03gbsa溶于1mlpbst1%盐酸-乙醇溶液:1ml盐酸溶于99ml乙醇抗原复性剂ph6.0柠檬酸缓冲液:810ml0.1m柠檬酸溶液+190ml0.1m柠檬酸三钠溶液dab溶液:避光现用现配,配好之后3分钟内用完,85%ddh2o+5%dab缓冲液(20×)+5%dab底物(20×)+5%dab色原(20×)2)烘片:脱蜡前将组织石蜡切片放入恒温箱中,温度调至60℃烘烤30分钟。3)脱蜡复水:分别按下面步骤操作二甲苯两缸,每缸10分钟;无水乙醇两缸,每缸7分钟;95%酒精1缸,5分钟;75%酒精1缸,5分钟;50%酒精1缸,5分钟;ddh2o浸泡5分钟,清洗3次。4)抗原修复:柠檬酸高温高压修复法:提前将柠檬酸修复液放入高温高压灭菌锅中,盖上高压锅盖,待出气5分钟后停止加热,将脱蜡复水好的组织切片放入预热好的抗原修复液中,重新加热灭菌锅,待出气5分钟后关闭放气阀,温度升至121℃时开始计时5分钟后终止加热,温度稍降至100℃时慢慢排完气,将灭菌锅盖打开,使其自然冷却大于30分钟。5)洗涤:ddh2o浸泡5分钟,清洗2次,pbst浸泡5分钟,清洗2次。6)灭活酶:每张切片滴加50μl灭活酶试剂,室温避光处理15分钟。7)洗涤:pbst浸泡5分钟,清洗3次。8)封闭:每张切片滴加3%bsa的pbst封闭液50μl,湿盒中室温封闭30分钟。9)加一抗:弃去封闭液,每张切片滴加加sage一抗50μl,4℃湿盒中孵育过夜或37℃孵育2小时。sage一抗按1:3000稀释,为防止载玻片表面液体挥发,可轻轻附上一层parafilm膜。10)复温:4℃孵育过夜后次日取出,室温复温1小时。11)洗涤:pbst浸泡5分钟,清洗3次。(第一次迅速倒掉)12)加酶标二抗:每张切片滴加hrp标记的二抗(抗兔),37℃孵育30分钟。13)洗涤:pbst浸泡5分钟,清洗3次。(第一次迅速倒掉)14)显色(dab法):每张切片滴加50μl显色液,湿盒中显色5分钟。15)终止显色:用蒸馏水终止显色反应。利用倒置显微镜观察是否显色明显,背景深浅,并拍照存图。16)复染:每张切片滴加50μl苏木素体细胞染色液,染色5-10分钟,用ddh2o冲洗干净。17)脱色返蓝:每张切片依次滴加1%盐酸-乙醇3秒内迅速放入ddh2o终止,再放入pbst中返蓝5-30分钟。18)封片:分别在75%乙醇和无水乙醇中浸泡2分钟,用二甲苯浸泡2分钟2次后,在切片上滴加中性树胶,加盖玻片。19)观察:显微镜下彩色模式10倍和20倍镜下观察拍照存图。各组织的实验结果图如图2a所示,由图2a可知,运用特异性针对sage1的抗体进行免疫组化染色发现sage1在正常的睾丸组织和多种肿瘤组织中存在阳性表达(肝癌、肺癌来源于第九人民医院北院肿瘤科,pdx肿瘤切片、食管癌、头颈癌、皮肤癌、肾癌来源于北院肿瘤科切片)。取九例来源上海交通大学附属第九人民医院不同种类病人的肿瘤组织(hcc15:原发性肝细胞肝癌,q003:肺腺癌,lu1030:低分化鳞癌,crc31:结肠癌,hcc7:原发性肝细胞肝癌,q003:肺鳞癌,lu1062:肺腺癌,crc1:结肠癌,crc44:结肠癌)构建pdx肿瘤模型:pdxp0操作步骤:1)在无菌条件下,将新鲜人肿瘤组织置于rpmi1640细胞培养基(添加双抗)中修剪,去除坏死组织2)将肿瘤剪成直径5mm左右小块,置于matrigel中充分浸泡3)使用镊子夹取组织块,装入穿刺套管针4)酒精消毒裸鼠胸腹部皮肤,用剪刀于胸骨柄处剪一3mm-5mm切口,深度至皮下5)使用穿刺针,从切口进入,将肿瘤组织接种至腹部近腹股沟处皮下6)使用组织胶水封闭伤口,放回笼盒继续饲养7)定期观察,记录生长曲线,追溯临床信息。8)肿瘤生长至合适大小,为p0代。对9例来源于人源pdx肿瘤模型的肿瘤组织针对sage1进行qpcr检测,结果显示其中4例存在sage1转录表达(图2b);针对60例肠癌病人的癌旁和肿瘤组织进行sage1的qpcr检测(图2d),具体方法如下:本实例所使用的实验材料人源pdx肿瘤模型的肿瘤组织来源于上海九院肿瘤科,60例肠癌病人的癌旁和肿瘤组织来自天津肿瘤医院,经天津市癌症研究所和医院伦理委员会批准,包含大肠癌的组织和邻近正常结肠组织标本取自该机构(n=60)在组织病理学诊断为大肠癌后接受手术切除的患者(n=60)。所使用的rna抽提试剂盒为rneasyminikit(50)(qiangencatno./id:74104)以及gomagbloodandtissuernakit(志昂生物cat.#go-mntr),所用rna逆转录试剂盒为primescripttm1ststrandcdnasynthesiskit(takaracat.#6110a),所用q-pcr试剂盒为tbgreentmpremixextaqtmii(tlirnasehplus)(takaracat.#rr820a)。(1)rna抽提:rna抽提使用以下两种方法:离心柱法:1)收集细胞(根据情况选择至1a或1b)1a)悬浮细胞:确定细胞数量(总量不要超过1×107),通过离心(5min,300×g)将细胞收集到离心管中,小心吸取并弃去所有上清,用pbs清洗两遍待用。1b)单层贴壁细胞(以10cm培养皿为例,总量不要超过1×107):细胞使用pbs清洗两遍,弃去pbs,加入300-500微升胰酶(0.25%),混匀,放入37度培养箱孵育(孵育时间根据不同细胞系差别很大,典型细胞系如a375约3分钟,hutu80约3-5分钟),当细胞开始从培养皿上脱落时加入1毫升含10%血清培养基终止消化,将细胞收集到离心管中,5min,300×g离心5分钟,弃去上清,用pbs清洗两遍待用。2)向离心管中加入175微升预冷的(4度)bufferrln,冰上孵育5分钟。3)4度300×g离心2分钟,将上清转移到新的离心管中,弃去沉淀。4)向上清中加入600微升的bufferrlt,通过猛烈涡旋振荡的方式将其混匀。5)加入430微升的乙醇(96-100%),用枪吹打使其充分混合均匀(不要离心)。6)将700微升的样品(如果其中有沉淀生成也一起转移)转移到rneasyspincolumn中,轻柔地盖上盖子,10000×g离心30秒,弃去流穿的液体。重复这个步骤直到所有的样品都流过spincolumn。7)向rneasyspincolumn中加入700微升的bufferrw1,轻柔地盖上盖子,10000×g离心30秒,弃去流穿的液体。8)向rneasyspincolumn中加入500微升的bufferrpe,轻柔地盖上盖子,10000×g离心30秒,弃去流穿的液体。9)向rneasyspincolumn中加入500微升的bufferrpe,轻柔地盖上盖子,10000×g离心2分钟。10)将rneasyspincolumn转移至干净的2毫升收集管,将原先的收集管弃去,最大转速离心1分钟。11)弃去收集管,将rneasyspincolumn转移到新的1.5毫升收集管,向其中加入30-50微升rnase-free的水,轻柔地盖上盖子,10000×g离心1分钟,将rna从柱上洗脱。磁珠法:样品制备:a.血液样品:取100μl新鲜全血或白膜,加入350μl裂解液lr,旋涡振荡混匀2分钟。b.动物组织:取10mg左右动物组织,加入400μl裂解液lr,将组织充分研磨或匀浆。1)将按照“样品制备”步骤准备好的样品于室温孵育10分钟,期间可旋涡振荡1~2次,每次振荡1分钟。2)孵育结束后瞬时离心,然后加入510μl无水乙醇及60μl磁珠,旋涡振荡混匀后于室温静置5分钟,期间可旋涡振荡1~2次,每次振荡1分钟。室温吸附后,旋涡振荡混匀,将离心管置于磁力架上,磁吸1分钟或至溶液澄清。小心地将离心管内液体完全吸弃,注意不要触碰磁珠。3)加入750μl已添加β-me的洗涤液dw,盖上离心管管盖,旋涡振荡混匀1分钟,放回磁力架上,在离心管不离开磁力架的情况下,反复颠倒磁力架,将离心管管盖洗净(避免管盖上残留的裂解液对后续实验产生影响),磁吸1分钟或至溶液澄清。先吸弃管盖中的液体,然后吸弃所有液体。4)加入850μl已添加β-me的洗涤液dw,按照步骤3的方法洗涤1次。5)加入850μl80%etr,按照步骤3)的方法洗涤1次。6)加入1~5μldnase、55μl溶液db,充分混匀,室温放置10分钟,期间旋涡振荡混匀2次。7)dna消化结束后,旋涡振荡混匀,将离心管置于磁力架上,磁吸1分钟或至溶液澄清。小心地将离心管内液体完全吸弃,注意不要触碰到磁珠。8)加入850μl80%etr,按照步骤3)的方法洗涤1次。9)将离心管置于磁力架上,室温开盖干燥5~10分钟。10)加入50μl洗脱液de,旋涡振荡混匀后于室温洗脱5分钟。再次旋涡振荡混匀磁珠,于磁力架上磁吸1分钟后吸取上清,或进行下游实验,或于-80℃保存待用,注意避免将纯化后的rna反复冻融。(2)rna反转录1)在pcr管中准备好如下体系的混合液:表12)将样品在65度加热5分钟,然后立即放到冰上冷却。3)准备20微升反应液,反应液具体体系如下:表2第1步的混合液10微升5xprimescriptbuffer4微升rnaseinhibitor20单位primescriptrt100到200单位rnase-freeddh2o补足至20微升4)温和混匀。5)根据下面所示反应条件进行反应:表342度30-60分钟70度15分钟反应结束后放置于冰上待用。(3)rt-pcr本方法使用lightcycler/lightcycler480system进行。所用引物序列为正向引物sage-f:ggaagagtatgtcctcgtggtt(seqidno.23),反向引物sage-r:gcatcaggccatggtggag(seqidno.24)。内参gapdh正向引物gapdh-f:atcatccctgcctctactgg(seqidno.25),反向引物gapdh-r:gtcaggtccaccactgacac(seqidno.26)。1)准备好pcr混合液,混合液体系如下:表42)设置机器程序:表5实验结束后导出数据,进行结果分析,具体结果如图2b所示(hcc15:原发性肝细胞肝癌,q003:肺腺癌,lu1030:低分化鳞癌,crc31:结肠癌,hcc7:原发性肝细胞肝癌,q003:肺鳞癌,lu1062:肺腺癌,crc1:结肠癌,crc44:结肠癌),sage1在部分肿瘤中呈阳性表达(hcc15、q003、lu1030、crc31),在部分肿瘤中呈阴性表达。如图2d所示在60例肠癌病例中,有48位患者的肿瘤组织的sage1的mrna表达水平高于癌旁组织,进一步印证了sage1在肿瘤组织特异性表达。为了确定sage1表达对crc进展的病理意义,进一步评估了sage1表达与crc(肠癌)预后因素之间的相关性。统计分析配对数据的t检验用于比较平均值,方差分析用于检验具有连续变量的两组数据,分类数据采用fisherexact或χ2检验进行分析,使用spss软件程序(版本21.0;ibm公司)进行统计分析。结果pcr实验检测了sage1在人结直肠癌及癌旁正常结肠组织中的表达,sage1在大肠癌组织中的表达明显高于正常组织(p<0.001)(图2d)。为了确定sage1表达在crc进展中的病理意义,进一步评估了sage1表达与crc预后因素之间的相关性(结果如图2e所示)。在crc患者中,没有发现sage1的表达与性别、组织学分级和肿瘤大小之间的相关性。然而,在大肠癌标本中,sage1的表达与淋巴结转移呈正相关(χ2=9.586,p<0.01,r=0.421)。运用针对sage1的抗体特异性检测肿瘤细胞中sage1是否呈阳性表达:1)样品的准备:10cmdish的细胞用pbs漂洗两次,尽量吸尽残留的pbs液,每dish加300-400μl1×sds蛋白裂解液,用细胞刮匙轻轻把细胞刮下,收集到1.5ml的ep管中,待裂解充分后,用1ml注射器将粘稠物上下吹打,至裂解液变成悬滴状为止;(若是组织样品,我们之前的处理方式是加液氮研磨成粉后加入sds蛋白裂解液,其后相同)1×sds蛋白裂解液配方:50mm的tris·hcl(ph值6.8)2%的sds电泳级10%的甘油;2)bca(标准曲线)蛋白定量,计算待测样品的浓度;3)蛋白变性:将蛋白样品加入β-巯基乙醇,置98℃水浴锅中煮沸10min使蛋白变性;4)电泳:上样量80ug;5)电转:pvdf膜用依次用甲醇、ddh2o、转膜缓冲液浸泡后,bio-rad半干转20v,30min;电转缓冲液的配制即称取2.9g甘氨酸、5.8gtris碱和0.37gsds,加去离子水至总量为700ml,充分混匀后再加入200ml甲醇,最后定容至1l;6)免疫反应及结果显示;a)将pvdf膜浸泡于已配好的5%脱脂牛奶中4℃封闭过夜;b)一抗孵育:用1/500稀释sage1抗体(novus:nbp1-84355),将pvdf膜浸泡于稀释好的一抗中,4℃平缓摇动过夜;c)取出pvdf膜用tbst洗膜3次,每次10min;d)用封闭液稀释连接有hrp的二抗(羊抗鼠或羊抗兔1:3000),将pvdf膜浸泡于稀释好的二抗中,室温平缓摇动1小时;e)再用tbst洗膜3次,每次10min;f)化学发光显色。针对通用细胞系lo2、293t、k562、hutu80、u2os的相关检测结果如图2c所示,由图2c可知,运用特异性针对sage1的抗体分别针对正常肝细胞lo2、正常人肾上皮细胞系293t细胞、人髓系白血病细胞k562、人骨肉瘤细胞u2os、人十二指肠腺癌细胞系hutu80进行wb检测,发现在正常细胞lo2及293t中未检测到sage1的表达,sage1只特异性表达于某些肿瘤细胞系如k562、u2os、hutu80。实施例3在三种不同的肿瘤细胞系中分别筛选针对sage1的慢病毒敲低细胞系或cas9敲除细胞系,与野生型细胞对比进行细胞增殖实验,证明sage1对肿瘤细胞增殖具有至关重要的作用(图3a、图3b、图3c)。慢病毒携带外源基因导入a375(恶性黑色素瘤细胞系)和caco2(大肠腺癌细胞系)细胞系。1、制备携带外源目的基因或shrna的慢病毒(lentivirus)sage1shrna干扰慢病毒载体质粒,本专利提供9个从高通量商业文库中筛选出可以高效敲低sage1表达的target序列分别如表6所示,其中,seqidno.1~9为靶序列,seqidno.10~18分别为针对上述靶序列的shrna的多核苷酸序列:表6慢病毒包装使用sigma的mission慢病毒包装混合物(货号shp001),实施例中实际所使用的靶标方案为表6中的sh-1和sh-2。1)培养并传代包装慢病毒的细胞hek-293t:以3-5x106cells/10cm培养皿的密度传代,24小时后,待细胞贴壁率达60-80%时进行转染。2)将26ul慢病毒包装混合物与2.6μg慢病毒表达质粒加入至500ulopti-mem中充分混匀,加入16ulx-treme转染试剂,继续充分混匀,室温放置15分钟。37℃培养箱取出hek-293t细胞,用1ml移液枪将质粒与转染试剂混合液均匀滴加至hek-293t的培养液里,一边呈画圈状滴加一边轻轻混匀培养液,最后前后轻轻摇动培养液,使转染液均匀分布。3)37℃培养箱取出hek-293t细胞,用1ml移液枪将质粒与转染试剂混合液均匀滴加至hek-293t的培养液里,一边呈画圈状滴加一边轻轻混匀培养液,最后前后轻轻摇动培养液,使转染液均匀分布。4)37℃培养箱放置5~6小时后,取出hek-293t细胞,弃去含转染液的培养基,小心加入8-10ml新鲜培养基(勿对着细胞加入液体,以免冲掉细胞),继续置37℃培养箱培养;2、lentivirus病毒上清液的收集转染48小时后,用10ml注射器收集含lentivirus上清液的培养基,同时添加8-10ml新鲜培养基到hek-293t的培养皿中继续培养。0.45μm过滤器过滤病毒上清,过滤后的病毒上清液做好标记,置4℃冰箱保存;转染后72小时可再收集一次lentivirus上清液(逆转录病毒可每24小时收集一次),若细胞蜷缩成团开始调亡,停止收集。3、lentivirus病毒上清液感染目的细胞以2.5x105/6cm培养皿的密度传代待感染细胞,24小时后,于4℃冰箱取出已过滤的病毒上清液,吸取适量病毒液至待感染细胞的培养基中,37℃培养箱培养。24小时后更换新鲜病毒液,继续感染细胞。剩余病毒上清液置-80℃冰箱,分装保存。4、lentivirus感染细胞后的阳性筛选感染结束后24~48小时,对于携带表达抗生素基因的病毒,加入puromycin进行阳性克隆的筛选5-7天。5、稳定细胞株的鉴定收集病毒感染且筛选过的细胞总蛋白,进行westernblot检测这些细胞中目的基因转录和翻译水平的表达情况,以鉴定过表达外源基因或者shrna沉默内源基因的稳定细胞株的建立。western检测:1)跑sds电泳,跑完后用transferbuffer洗胶,shaker上洗5min,两次,同时滤纸用transferbuffer润湿;2)pvdf膜用乙醇活化后转膜,由下往上为滤纸,pvdf膜,胶,滤纸,用滚筒赶出其中的气泡,转膜时间为7-9分钟;3)用5%脱脂牛奶封闭pvdf膜,室温shaker上封闭一个小时,将pvdf膜上感兴趣的部分剪成小条,加入int3(兔,novus,nbp1-19091)作为一抗(4ml牛奶中加入2ul,1:2000),室温孵育一小时;4)将含一抗的牛奶倒掉,用tbst溶液洗5次*5min,加入二抗(羊抗兔,3mltbst中加入0.6ul,1:5000),室温孵育45min;5)用tbst溶液洗5次*5min,倒去所有tbst溶液,用ecl显色。hutu80(十二指肠腺癌)crispr稳定敲除sage1细胞系ko-1和ko-2的构建1.sgrna设计选择外显子区域高特异性的位点作为靶位点,生物信息学分析序列,对筛选的位点打分。选择评分最高的2个位点作为靶位点,设计2条sgrna序列克隆入px330载体质粒(采购于addgene)。humsage1sg1-up:accgaaggaagagtatgtcctcg(seqidno.19)humsage1sg1-d:aaaccgaggacatactcttcctt(seqidno.20)humsage1sg2-up:accgaagtaaatctggttgcaac(seqidno.21)humsage1sg2-d:aaacgttgcaaccagatttactt(seqidno.22)2.转染与细胞池建立/测序验证37℃预热转染试剂10~20min。dna-转染试剂混合物加入hutu80细胞中(步骤如前述),置于培养箱中培养。转染后培养2-3天,稀释后取1000个以上的转染细胞离心,去上清,提取dna并pcr检测。纯化目的基因后测序,比对测到的序列与原始序列,确认基因被敲除。3.单克隆筛选与测序验证等细胞生长至一定数量,消化细胞,细胞计数。将细胞稀释,再取100微升细胞稀释液种于96孔板中。细胞贴壁后继续加药筛选,待细胞汇合度达到70%以上时,使用突变检测试剂盒筛选阳性克隆,对筛选后的阳性克隆进行测序分析,比对测序结果,分析基因敲除情况。挑取基因敲除阳性克隆依次转至48孔板,24孔板,12孔板,6孔板中扩大培养。4.稳定细胞株的鉴定收集筛选过的单克隆细胞总蛋白,进行westernblot检测这些细胞中目的基因表达情况,以鉴定过表达外源基因或者shrna沉默内源基因的稳定细胞株的建立(方法如前述)。利用rtcaxcelligence系统进行细胞增殖实验:1.细胞悬液准备:1)在超净工作台内,于无菌条件下,吸除培养皿内旧培养液。2)以pbs液清洗1-2次,于培养皿内加入1ml(t75培养瓶)含edta的胰蛋白酶溶液。盖好盖,置37℃温箱中温育2-6min后,在倒置显微镜下观察细胞被消化的情况,若细胞质回缩,细胞间歇增大,终止消化。3)轻轻吸除消化液,加入培养基10ml/培养瓶,用移液管反复轻轻吹打贴壁的细胞,使它们形成细胞悬液。将细胞悬液转移到50ml离心管中,1000xrpm离心5min,去除上清,加入新鲜培养基,并用移液管将细胞吹打均匀。用计数板计数细胞悬液浓度后,配制成实验需要的细胞浓度。2.e-plate96准备:1)在e-plate96的孔中加入50μl培养基。2)将e-plate96放到rtcastation上。3)rtca系统会自动进行扫描(“scanplate”)->检查是否接触良好(在“message”页面显示connectionok)。4)开始检测基线(background)确定所选择的孔接触正常,所有孔的cellindex低于0,063。5)取出e-plate96,在孔中加入100μl混合均匀的a549细胞悬液,使每孔中细胞数目为2500cells/100μl。细胞加入e-plate96后无需再将细胞和孔中原有的培养基混匀。6)将e-plate96置于超净台中室温放置30min。7)将e-plate96放到培养箱中的rtcastation上。8)在系统自动扫描“scanplate”后,开始step2(检测细胞增殖曲线120小时)。3.实验layout及数据分析rtcaxcelligence系统自动读取细胞指数(cellindex,ci值),以每组细胞第一天的ci值为基准,计算得到细胞相对的吸光值,以每组细胞相对的吸光值对培养时间做图,绘制细胞生长曲线(图3a、3b、3c,其中,plko表示空白对照,即野生型细胞a375、hutu80、caco2细胞用不含shrna序列的空对照质粒进行对照试验)。增殖实验结果显示sage1的敲低或敲除在不同肿瘤细胞系中均显著抑制肿瘤细胞增殖。hutu80-ko1回复sage1细胞分选及软琼脂克隆形成实验(如图3d所示):hutu80回复sage细胞分选:1.使用293t细胞系包装慢病毒,提前将293t细胞传代至10cmdish中,当293t细胞在10cmdish中培养至密度约50%时,准备进行慢病毒包装;2.吸取800微升opti-mem培养基(gibco)至1.5mlep管中,向其中加入8ug目标质粒pcdh-gfp-sage1(于南京金斯瑞合成密码子优化的sage1基因连入pcdh-gfp质粒)、或pcdh-gfp(购于addgene,全名pcdh1-mcs2-ef1-copgfp)与慢病毒包装混合物混匀,向其中加入10ul转染试剂(x-tremegenehpdnatransfectionreagent,roche)。室温孵育15-30分钟,将ep管中所有液体逐滴加入至10cmdish中,混匀,放入37度二氧化碳培养箱培养6-8小时后换液,继续培养36-72小时;3.使用注射器将10cmdish中所有液体吸出,用0.45微米滤膜过滤后收集含病毒的培养基,在4度可保存一周或分装冻存于-80度备用;4.将需要进行病毒感染的细胞系hutu80-ko-1/caco2在6孔板中培养至密度为30%-50%,吸出所有培养基,向其中加入1毫升新鲜培养基和1毫升含病毒的培养基,再加入polybrene,使其终浓度为10-20微克/毫升,混匀后放入37度二氧化碳培养箱进行培养,12-24小时后换液,36-72小时可在荧光显微镜下观察荧光,判断细胞感染情况;5.使用0.25%的胰蛋白酶将贴壁细胞从6孔板上消化下来,离心去除胰酶,加入1毫升含1%penicillin/streptomycinsolution(gibco)的培养基,使用bdinflux流式细胞分选仪进行细胞分选,得到有gfp表达的细胞系,离心去除pbs,使用1毫升的新鲜培养基进行重悬,将其转入新的六孔板中培养,培养得到的细胞可用于冻存及后续实验。软琼脂克隆形成实验1)配制1.2%和0.7%的琼脂糖,高压灭菌后置于55℃水浴中,使其保持融化状态。2)配含20%fbs、2×抗生素的2×rpmi1640培养基,37℃预热。3)灌下层胶:1.2%的琼脂糖胶与2×培养基1:1混合,加入到6孔板中,每孔3ml,室温放置待其凝固。4)等待下层胶凝固过程中分别消化hutu80+pcdh-gfp、hutu80-ko1+pcdhgfp、hutu80-ko1+pcdh-gfp-sage1细胞(细胞系构建方法如前所述),计数,用无血清培养基调整浓度为5×104/ml,每孔用100μl细胞,设3个平行孔。5)下层胶凝固后灌上层胶:0.7%的琼脂糖胶与2×培养基1:1混合(温度约40℃左右),加入100μl细胞悬液,即5000个细胞,混匀,加入孔板中,每孔3ml。6)37℃5%co2培养,约2-3周收细胞,0.1%结晶紫染色,计数并比较3组克隆形成情况。根据图3d结果所示,敲除sage1能显著抑制hutu80肿瘤细胞的锚定非依赖性生长,而回复sage1的表达能明显恢复肿瘤细胞生长。裸鼠十二指肠癌(hutu80,图3e)和大肠癌(caco2,图3f)移植瘤实验证明sage1的表达对于异种移植瘤生长的重要性,且证明sage1的敲低可显著抑制异种移植瘤的生长,sage1的过表达可显著促进异种移植瘤的生长。1)接种前细胞培养:扩大培养待接种细胞(表达外源基因的细胞制备方法如前述):hutu80组:hutu80-ko1(即本实施例中crispr稳定敲除sage1细胞系ko-1),hutu80-ko1-sage1(即实施例9中回复野生型sage1表达的细胞系);caco2组:caco2(即本实施例中针对sage1的慢病毒敲低的caco2细胞系,靶点为针对sage的sh-1),caco2-sage1(即caco-sh-1中回复野生型sage1表达的细胞系);消化对数生长期细胞,计数,用1×pbs重悬细胞,调整其终浓度为1x108/ml,将细胞置于冰上,准备接种裸鼠。2)皮下接种:无菌环境下操作,充分重悬混匀细胞,注射剂量为每种细胞100μl/只,即1×107细胞/只。在同一只裸鼠前腋下皮下接种,每组6只裸鼠。3)观察裸鼠成瘤情况:观察记录每只裸鼠出现肿瘤的日期,一旦发现肿瘤形成,用游标卡尺隔日测量肿瘤的体积大小,观察裸鼠有无恶液质的出现。4)裸鼠的处死及肿瘤的分离处理:23天后,颈椎断颈法处死所有裸鼠,病理解剖,完整分离每只裸鼠的肿瘤,称取肿瘤重量并记录和拍照。肿瘤浸泡于福尔马林溶液中,固定过夜。实施例4分别针对sage1阳性的肝癌肿瘤pdx模型(hcc15,图4a)、sage1阳性的低分化非小细胞上皮来源肺癌pdx肿瘤模型(lu1030,图4b)、以及sage1阴性的肝癌肿瘤pdx模型(hcc7,图4c)采用特异性针对sage1基因敲低的腺病毒shrna进行瘤体注射治疗。结果显示针对sage1阳性的肿瘤,注射针对sage1的shrna腺病毒具有强烈抑制肿瘤生长的治疗效果,针对sage1阴性的肿瘤,注射针对sage1的shrna腺病毒不具有抑制肿瘤生长的治疗效果,显示sage1是特异性很强的治疗靶点。所使用的耗材如下:rpmi1640细胞培养基(gbico),青霉素+链霉素100×(gbico),pbs(hyclone),sage-1单抗,ki67单抗,balb/c裸鼠,雄性,4-6周龄。pdx操作步骤:1)在无菌条件下,将肿瘤从裸鼠皮下剥出,置于pbs中清洗2)将肿瘤转移至rpmi1640细胞培养基(添加双抗)中,去除包膜、血管及坏死组织3)将肿瘤剪成直径3mm左右均一小块,转移至新的rpmi1640细胞培养基(添加双抗)中4)使用镊子夹取组织小块,装入穿刺套管针5)酒精消毒裸鼠胸腹部皮肤,用剪刀于胸骨柄处剪一3mm-5mm切口,深度至皮下6)使用穿刺针,从切口进入,将肿瘤组织接种至腹部近腹股沟处皮下7)使用组织胶水封闭伤口,放回笼盒继续饲养8)隔天观察一次,至肿瘤生长至直径5mm左右分组,给予处理9)将对照腺病毒及sage-1shrna腺病毒(由上海和元生物运用生腺病毒包装载体生产的对照腺病毒及sage-1shrna腺病毒,针对sage1的序列参见表6)稀释于pbs,5×108cfu/100ul,肿瘤内部注射,间隔1-2天注射一次10)每隔2天使用游标卡尺测量肿瘤体积,至肿瘤生长至伦理终点时(最大直径=1.5cm)终止实验11)应用断髓法处死裸鼠,将肿瘤从裸鼠皮下剥出,拍照并称重12)取部分组织固定于福尔马林,部分组织置于液氮速冻,用于后续分析。ihc操作步骤:1)石蜡包埋,防脱片制片,切片厚度4um2)将切片在60℃恒温箱中烘烤30分钟3)脱蜡和水化:1)切片置于二甲苯中浸泡10分钟,更换二甲苯后再浸泡10分钟;2)无水乙醇中浸泡5分钟;3)95%乙醇中浸泡5分钟;4)70%乙醇中浸泡5分钟4)pbs洗2~3次各5分钟;3%h2o2(80%甲醇)滴加在tma上,室温静置10分钟;pbs洗2~3次各5分钟5)枸橼酸钠抗原修复6)免疫组织化学染色:pbs洗2~3次各5分钟;滴加正常山羊血清封闭液,室温20分钟。甩去多余液体。滴加一抗50μl,4℃过夜;37℃复温45分钟7)pbs洗3次各5分钟8)滴加二抗40~50μl,37℃1小时9)pbs洗3次各5分钟10)dab显色5~10分钟11)pbs或自来水冲洗10分钟12)苏木精复染2分钟,盐酸酒精分化13)自来水冲洗10~15分钟14)脱水、透明、封片、镜检、拍照。实施例5在特异性表达sage1的多种肿瘤细胞系hutu80(十二指肠腺癌)、u2os(骨肉瘤)、k562(慢性髓性白血病细胞),kyse30(人食管鳞癌细胞)中进行针对sage1的特异性抗体免疫共沉淀实验,通过银染胶分析和质谱鉴定,发现sage1在中瘤内特异性结合ints3蛋白(同时质谱鉴定到与ints3紧密结合的inip以及hssb1/2),银染胶分析具体结果如图5a所示,其中,ip-rb-igg表示用无特异性亲和力的igg兔抗进行内源免疫共沉淀实验作为对照,ip-sage1表示用特异性结合sage1的兔抗(novus,nbp1-84355sage1antibody)进行内源免疫共沉淀实验作为样本组,质谱鉴定结果如图5b所示,其中control为igg,每个肿瘤细胞系共有三个重复。结果证明sage1与ints3在所有实验组样本中均存在特异性内源相互作用。进一步分别用特异性针对sage1和ints3的抗体分别进行了ip-wb,验证了sage1和ints3之间存在相互作用(图5c)。在正常没有sage1表达的293t细胞中针对ints3蛋白进行内源ip(人肾上皮细胞系),具体实验流程如上所述,结果显示在正常无sage1存在的细胞系中,ints3结合ints6及其它ints蛋白,存在于integrator复合物中与之前科研文章报道的一致(图5f)。综合以上结果说明在sage1阴性的细胞内,ints3结合ints6形成integrator复合物,不存在sage1-ints3复合物。而当sage1出现表达的阳性细胞中ints3与sage1结合形成ints3-sage1复合物。1)将从10cmdish上收集到的hutu80/293t细胞用pbs清洗2次,加入0.5mliplysisbuffer,在非接触式超声破碎仪上破碎,共25个循环,超声5s,停5s,功率模式为high;iplysisbuffer:20mmtris.hcl(ph7.4)150mmnacl10%glycerol0.5%tritonx-1001mmedta1mmegta2)将超声后的破碎液放入冷冻台式离心机中,14000rpm离心15min,离心后取上清,弃去沉淀;3)将上清分为两个ep管,每个250ul,分别向上清中加入5ulsage1兔抗(novus,nbp-84355,0.5mg/ml)和2uligg兔抗(1.4mg/ml),放在4度混悬仪过夜;4)向两管中分别加入10-20ul使用iplysisbuffer平衡后的proteingbeads,放在4度混悬1个小时,取出后将ep管放在磁力架上,静置大约30s,待beads全部吸附到ep管壁上,使用1ml枪头小心将上清吸出,重新加入1ml的buffer,放入4度混悬仪混悬5分钟,重复上述过程3次;将所有上清吸干,向每管加入60ulelutebuffer(0.2mglycine,0.1%np40,ph2.2),置于冰上静置10min后吸出上清,将其加入到含20ul的trisbuffer(1mtrisph8.0)的ep管中,用枪吹匀,取10-20ul用于银染胶鉴定,取10ul用于wb检测sage1以及ints3,剩下送质谱鉴定。用特异性针对ints3的抗体(novus,nbp1-19091,ints3antibody)同样在以上几种肿瘤细胞系中进行内源ip-wb,证实在细胞内sage1特异性结合ints3行使功能(图5c)。wb检测内源ip样品具体实验:western检测:1)跑sds电泳,跑完后用transferbuffer洗胶,shaker上洗5min,两次,同时滤纸用transferbuffer润湿;2)pvdf膜用乙醇活化后转膜,由下往上为滤纸,pvdf膜,胶,滤纸,用滚筒赶出其中的气泡,转膜时间为7-9分钟;3)用5%脱脂牛奶封闭pvdf膜,室温shaker上封闭一个小时,将pvdf膜上感兴趣的部分剪成小条,加入int3(兔)作为一抗(4ml牛奶中加入2ul,1:2000),室温孵育一小时;4)将含一抗的牛奶倒掉,用tbst溶液洗5次*5min,加入二抗(羊抗兔,3mltbst中加入0.6ul,1:5000),室温孵育45min;5)用tbst溶液洗5次*5min,倒去所有tbst溶液,用ecl显色。实施例6运用clustalw软件(https://www.genome.jp/tools-bin/clustalw)比对sage1和ints6的蛋白序列,发现ints6的c端(790-887aa)在氨基酸序列上与sage1的c端(817-904aa)高度一致(图5g),说明sage1的c端和ints6的c端可能具有同样的功能。由于sage1和ints6都能结合ints3,所以认为这两个蛋白的c端都负责结合ints3。进一步通过体外蛋白复合物共纯化实验来证实上述结论。体外纯化出sage1-ints3复合物蛋白证实全新复合物sage1-ints3的存在(图5d),体外表达纯化出ints6-ints3复合物,验证ints3同样能和ints6相互作用(图5e)。1)质粒构建:复合物共表达质粒构建上采取两种策略,可以将ints3-c(accession:q68e01.1,572-978aa)和sage1(accession:q9nxz1.2,817-904aa)/ints6(accession:q9ul03.1,790-887aa)的基因分别构建到pet28a载体(kana),和pgex6p1载体进行共表达纯化。2)初始种子培养:挑取阳性克隆到10ml的含有amp抗生素的液体lb培养基中,在37℃过夜振荡培养。3)扩大培养:将初始种子接入1l含抗生素的液体培养基中,37℃振荡培养至菌浓od600为0.6-0.8时,降温至15℃或20℃;一个小时后加入终浓度为0.6mm的iptg,并诱导表达过夜。4)收集菌体:于4200rpm,4℃下离心15min,弃去上清,收获菌体;加入重悬溶液(25mmtris-hclph8.0,100mmnacl),悬浮菌体细胞;细胞破碎前加入终浓度为2mm的蛋白酶抑制剂pmsf(phenylmethylsulfonylfluoride,苯甲酸磺酰氟)。5)超声破碎细胞:400w下,超声3s,间隔6s,工作60次。6)超速离心:细胞裂解液于14000rpm,4℃下离心50min,收集上清液,进行下一步的分离纯化。7)ni-nta亲和层析:将上清液体倒入ni-nta柱中。流净后,用washbuffer(25mmtris-hclph8.0,100mmnacl,15mmimidazole)冲洗10个柱体积,除去杂蛋白;最后使用elutionbuffer(25mmtris-hclph8.0,100mmnacl,250mmimidazole)将目的蛋白洗脱下来。使用sds-page检测蛋白的可溶性、挂柱效率及蛋白的浓度。为了获得更纯净的、不带标签的蛋白,我们在有那个washbuffer冲洗去除杂蛋白以后,每根镍柱中加入5ml的重悬缓冲液然后加入100-200μl的ppase,3-5h后,用5ml重选冲洗柱子,电泳检测酶切效率。8)阴离子交换层析纯化:先平衡离子交换柱。然后将上一步洗脱下的蛋白用溶液a(25mmtris-hcl,ph8.0)稀释4-6倍,上样到离子交换柱sourceq上,使用溶液a与溶液b(25mmtris-hclph8.0,1mnacl)进行线性梯度洗脱。收集各个出峰位置(根据280nm的吸光值)附近的收集管。进行sds-page电泳,检测目的蛋白质出峰位置、纯度和浓度。9)超滤浓缩:将含有目的蛋白的洗脱液用超滤杯浓缩到2ml。10)分子筛柱层析纯化:注射上样到已经用溶液c(10mmtris-hcl,ph8.0,100mmnacl)平衡好的凝胶过滤层析柱superdex200上。用溶液c进行洗脱。出锋位置与蛋白的大小以及形状相关。收集蛋白峰进行sds-page电泳,检测蛋白质的纯度及性状。所有的蛋白纯化步骤均在4℃进行。最后,将浓度在5-10mg/ml左右、较为纯净的蛋白用液氮速冻,分装并保存在-80℃冰箱。由于ints3既能与ints6相互作用形成复合物,又能与sage1相互作用形成复合物,且ints6同sage1c端氨基酸高度类似,这两种复合物相互作用之间可能具有排他竞争性,既ints3如果和sage1相互作用就会抑制ints3-ints6的存在,如果ints6过量表达,会减少ints3-sage1复合物的存在。针对sage1、ints3、ints6这三个蛋白分别进行了体内和体外的竞争实验。如图5h,分别在没有sage1存在的293t细胞系中和过表达sage1的293t细胞系中(细胞系构建方法如前所述)进行针对ints3蛋白特异性抗体的免疫共沉淀实验,每组进行3个重复实验,最终产物用质谱检测。结果显示在没有sage1的情况下,ints3结合ints6形成复合物;在细胞存在sage1的情况下,ints3结合sage1形成ints3-sage1复合物,竞争抑制了ints3-ints6的形成。通过体外蛋白复合物竞争形成实验,进一步证实sage1和ints6之间竞争结合ints3,结果如图5i。将纯化获得的gst-sage1(817-904aa,纯化方法如前所述)蛋白,1:1的物质量加入纯化好的ints3-ints6复合物蛋白(无gst标签,纯化方法如前所述)。混匀4度孵育1小时后用gst磁珠亲和纯化,最终产物进行sds-page胶检测发现sage1竞争掉ints6,结合ints3形成了sage1-ints3复合物。sage1-ints3复合物晶体结构解析结果如图5j所示,找出该复合物相互作用关键氨基酸,具体方法如下:运用晶体学解析该复合物结构,通过结构解析发现sage1-ints3这一复合物形成的关键氨基酸(f838、f873、k874、r872、m832、q840),具体结果参见表7、表8和表9,其中,表7为晶体参数分析结果,表8所示为ints3二聚体之间相互作用的氨基酸位点,表9所示为ints3二聚体与sage1之间相互作用的氨基酸位点。表7valuesinparenthesesrefertothehighestresolutionshell.rfactor=σ||f(obs)-f(calc)||/σ|f(obs)|.rfree=rfactorcalculatedusing5.0%ofthereflectiondatarandomlychosenandomittedfromthestartofrefinement.表8表9实施例7根据晶体结构针对sage1与ints3之间的关键相互作用氨基酸设计突变体sage1(f838a、f873a、k874a、r872a、m832a、q840a),分别通过体外itc(等温滴定量热法)测定野生型sage1与突变体sage1和ints3的结合常数证明突变体失去ints3结合能力的有效性(图6a及图6b)。1、在大肠杆菌bl21de3中体外重组表达ints3(accession:q68e01.1,568aa-981aa)蛋白,以及sage1(accession:q9nxz1.2,815aa-905aa),sage1mutant(accession:q9nxz1.2,815aa-905aa、f838a、f873a、k874a、r872a、m832a、q840a)。重组蛋白表达载体采用商业化的pet28a质粒,蛋白表达纯化流程按照常规表达纯化步骤进行(参考分子克隆实验指南(第三版))。2、打开仪器itc200设备,将washtool插入样品池,形成闭合流路,组装注射针。清洗样品池及注射针。3、样品、buffer(2ml)、超纯水(2ml)500-600mmhg脱气10min。4、加样1)已脱气的超纯水300μl润洗2遍样品池,2)吸取ints3蛋白样品300μl,轻弹注射器壁赶出气泡(注:有效体积为190μl,但是加入体积少于300μl,仪器不稳定)3)将注射器对准样品池(左侧孔)插入,轻轻碰触底部后抬起约1mm,缓慢推入注射针(50μl)4)将空的注射针旋入黑色手柄内,放置仪器上(手柄上量程稍偏右感觉放置到槽内后向下用力、左旋、卡入槽内即可)5)校准注射针量程(52μl),可看到手柄内黑色点上下移动,最后回到定部6)取出注射针,先用buffer润洗2遍,并排除气泡后吸取样品sage1/sage1-mutant50μl7)将注射针旋入黑色手柄内,放置仪器上。5、设置参数,选择incrementaltitration后点击“insert”:1)设置两次滴定的时间间隔,通常120(s)2)样品单次注射体积:2(μl)3)总注射次数:254)点击“ok”6、设置syringeconcentration(注射器中液体浓度),cellconcentration(样品池中样品浓度)点击stimngrate选项后面的三角形蓝色键,点击最上面的三角形绿色键,保存数据至相应位置,实验结束后将样品吸出,按照实验开始时清洗仪器的步骤进行清洗。实验结束后经数据分析,野生型sage1与ints3结合常数为39nm(图6a),经关键氨基酸突变后sage1mutant与ints3不再结合(图6b)。充分证明新复合物sage1—ints3的紧密结合及解析的晶体结构的有效性。实施例8通过293t细胞中的co-ip实验证实sage1突变体不能结合ints3(图6c),具体方法如下:通过293t细胞co-ip实验验证定点突变(f838a,f873a,k874a,r872a,m832a,q840a)关键氨基酸能够中断ints3-sage1复合物之间的结合,结果如图6c所示,图6c中,图片上部的+和-表示该跑道中的加样方案,+表示加入了该蛋白,-表示未加入该蛋白,ints3表示野生型ints3蛋白,sage1表示野生型sage1蛋白,sage1-c-del表示c端缺失100个氨基酸残基的野生型sage1蛋白,sage1-mu表示突变体sage1(f838a、f873a、k874a、r872a、m832a、q840a)。具体方法如下:1、将分别转染好flag-sage1/flag-sagemutant和strep-ints3质粒的293t细胞接种于3×10cm培养皿中。2、用冰冷1xpbs洗涤细胞2~3次,每10cm培养皿加入0.67ml1xlysis缓冲液;将培养皿冰冻5min,然后将细胞重悬于2mlep管中(共2ml细胞裂解液)。3、在4c下13000rpm离心10分钟5.收集上清液;将每个样品分成三部分:a.作为对照输入;b.(阴性ctrl:无一抗,加入poteing珠);c.(加入一抗2g,加入poteina珠)。4、在4℃过夜混合。5、在裂解缓冲液中洗涤/平衡珠子:将38ulpoteing珠子加入1.5mlep管中,向管子中加入750ul裂解缓冲液,旋涡,以8200g离心30s,添加50ul裂解缓冲液重新悬浮。6、对于样品-b和样品-c,加入洗涤的蛋白a珠,在4c下混合2小时。7、以3000rpm离心2分钟,用1x裂解缓冲液洗珠2次,取15ul用于wb印迹。其余的以3000rpm离心2分钟,去掉悬浮液。8、对于样品b和样品c,加入洗脱缓冲液,取样进行wb验证。实施例9在敲低sage1的肠癌肿瘤细胞中(caco2)(即实施例3中针对sage1的慢病毒敲低的caco2细胞系,靶点为sage1,caco2-sh-1)分别进行野生型sage1以及携带与ints3相互作用关键氨基酸突变的sage-mutant的回复实验,数据显示,回复野生型sage1能显著促进癌细胞的增殖,而回复无法与ints3相互作用的sage1突变体则失去促进肿瘤细胞增殖的功能(图6d)。在敲低sage1的食管癌肿瘤细胞中(te1,敲低sage1的细胞系构建方法参照实施例3中sage1的慢病毒敲低的caco2细胞系实验方法)分别进行野生型sage1以及携带与ints3相互作用关键氨基酸突变的sage-mutant的回复实验,数据显示,回复野生型sage1能显著促进癌细胞的增殖,而回复无法与ints3相互作用的sage1突变体则失去促进肿瘤细胞增殖的功能(图6e)。在敲除sage1的十二指肠肿瘤细胞中(hutu80-ko1)(即实施例3中crispr稳定敲除sage1细胞系ko-1)分别构建野生型sage1以及携带与ints3相互作用关键氨基酸突变的sage-mutant的回复细胞系(参照实施例3中,构建hutu80回复sage细胞系实验操作),数据显示,回复野生型sage1能显著促进癌细胞的增殖,而回复无法与ints3相互作用的sage1突变体则失去促进肿瘤细胞增殖的功能(图6e)。筛选获得稳定过表达细胞系的实施方法如下,后继增殖实验操作方式同sage1在肿瘤细胞中敲低后进行的细胞增殖实验。1.使用293t细胞系包装慢病毒,提前将293t细胞传代至10cmdish中,当293t细胞在10cmdish中培养至密度约50%时,准备进行慢病毒包装;2.吸取800微升opti-mem培养基(gibco)至1.5mlep管中,向其中加入8ug目标质粒pcdh-gfp-sage1(从南京金斯瑞合成密码子优化的sage1基因连入pcdh-mcs2-ef1-copgfp载体)、pcdh-gfp-sage-mutant(从南京金斯瑞合成密码子优化的sage1突变体基因连入pcdh-mcs2-ef1-copgfp载体,包含突变f838a,f873a,k874a,r872a,m832a,q840a)、pcdh-gfp(购自addgene,pcdh-mcs2-ef1-copgfp),慢病毒包装液,混匀质粒,向其中加入10ul转染试剂(x-tremegenehpdnatransfectionreagent,roche)。室温孵育15-30分钟,将ep管中所有液体逐滴加入至10cmdish中,混匀,放入37度二氧化碳培养箱培养6-8小时后换液,继续培养36-72小时;3.使用注射器将10cmdish中所有液体吸出,用0.45微米滤膜过滤后收集含病毒的培养基,在4度可保存一周或分装冻存于-80度备用;4.将需要进行病毒感染的细胞系在6孔板中培养至密度为30%-50%,吸出所有培养基,向其中加入1毫升新鲜培养基和1毫升含病毒的培养基,再加入polybrene,使其终浓度为10-20微克/毫升,混匀后放入37度二氧化碳培养箱进行培养,12-24小时后换液,36-72小时可在荧光显微镜下观察荧光,判断细胞感染情况;5.使用0.25%的胰蛋白酶将贴壁细胞从6孔板上消化下来,离心去除胰酶,加入1毫升含1%penicillin/streptomycinsolution(gibco)的培养基,使用bdinflux流式细胞分选仪进行细胞分选,得到有gfp表达的细胞系,离心去除pbs,使用1毫升的新鲜培养基进行重悬,将其转入新的六孔板中培养,培养得到的细胞可用于冻存及后续实验。实施例10图6g/h运用裸鼠大肠癌移植瘤,分别移植野生型十二指肠癌细胞(hutu80),sage1敲除的十二指肠癌细胞(hutu80-ko1)以及回复野生型sage1、回复携带与ints3相互作用关键氨基酸突变的sage-mutant(两种细胞的构建方法参照实施例9)。实验证明,破坏ints3-sage1复合物的形成可显著抑制异种移植瘤的生长。以上实验证明sage1-ints3这一新发现的复合物可以作为抑制肿瘤细胞生长的靶点针对这一复合物相互作用的破坏可以显著抑制体内肿瘤细胞生长。具体方法如下:1)接种前细胞培养:扩大培养待接种细胞(表达外源基因的细胞制备方法如前述):hutu80,hutu80-ko1,hutu80-ko1-sage1(回复表达野生型sage1蛋白),hutu80-ko1-sage1-c-del(回复表达sage1截短体1aa-806aa,构建方法参照hutu80-ko1-sage1,仅回复表达的蛋白片段不同),hutu80-ko1-sage1mutant(回复表达sage1突变体蛋白,f838a,f873a,k874a,r872a,m832a,q840a,构建方法参照hutu80-ko1-sage1,仅回复表达的蛋白片段不同)。消化对数生长期细胞,计数,用1×pbs重悬细胞,调整其终浓度为1x108/ml,将细胞置于冰上,准备接种裸鼠。2)皮下接种:无菌环境下操作,充分重悬混匀细胞,注射剂量为每种细胞100μl/只,即1×107细胞/只。在同一只裸鼠前腋下皮下接种,每组6只裸鼠。3)观察裸鼠成瘤情况:观察记录每只裸鼠出现肿瘤的日期,一旦发现肿瘤形成,用游标卡尺隔日测量肿瘤的体积大小,观察裸鼠有无恶液质的出现。4)裸鼠的处死及肿瘤的分离处理:23天后,颈椎断颈法处死所有裸鼠,病理解剖,完整分离每只裸鼠的肿瘤,称取肿瘤重量并记录和拍照。肿瘤浸泡于福尔马林溶液中,固定过夜。实施例11将hutu80里面稳定干扰敲低ints3的细胞系(构建方法如前所述)及其对照组细胞系收集之后送样至安诺优达公司进行rnaseq测序寻找出敲低ints3造成的显著变化基因;将hutu80里面稳定敲除sage1的细胞系(构建方法如前所述)及其对照组细胞系收集之后送样至安诺优达公司进行rnaseq测序寻找出敲除sage1造成的显著变化基因;具体流程是对于rna-seq数据,用软件fastqc对其进行质控,用软件trimmomatic去除其中的接头序列以及低质量序列,用软件hisat2将保留下来的读段定位到人的参考基因组,根据ensembl网站的基因注释用软件featurecounts得到基因的原始表达量,最后用r软件包deseq2找到差异表达的基因及其差异倍数。高表达sage1或ints3后相互之间基因的差异表达的比较通过散点图展示(图6i)。如图所示,sage1表达量降低与ints3表达量降低所造成的显著差异基因变化一致,既sage1显著变化差异基因中上调的基因,在ints3显著变化差异基因中也上调,sage1显著变化差异基因中下调的基因,在ints3显著变化差异基因中也下调,说明sage1通过和ints3形成复合物调控改变肿瘤相关基因表达,且该复合物中ints3和sage1是协同正相关,作为一个整体起作用。为了验证破环ints3-sage1之间相互作用彻底破坏了sage1促进肿瘤细胞生长的通路机制,我们分别分析了在实施例9里敲低sage1的caco2里回复野生型sage1的rnaseq显著变化差异基因富集的相关信号通路(图6j)、以及敲低sage1的caco2里回复突变体sage1(突变了几个关键氨基酸,不能结合ints3)的rnaseq显著变化差异基因富集的相关信号通路(图6k)。具体操作如下:对于rna-seq数据,用软件fastqc对其进行质控,用软件trimmomatic去除其中的接头序列以及低质量序列,用软件hisat2将保留下来的读段定位到人的参考基因组,根据ensembl网站的基因注释用软件featurecounts得到基因的原始表达量,最后用r软件包deseq2找到差异表达的基因及其差异倍数。差异表达的基因所富集的kegg通路通过r软件包clusterprofiler获取。根据结果所示,过表达野生型sage1能显著上调许多肿瘤生长相关通路,如proteasome(蛋白酶体)、cellcycle(细胞周期)、dnareplication(dna复制)、pathwayincancer(癌症通路)等等都是重要促癌通路。而回复不能结合ints3的sage1的突变体蛋白显著差异基因富集通路则没有富集到这些通路。这一信号通路变化的差异与实施例9里面细胞实验的差异一致,说明sage1在细胞中出现,只有通过结合ints3形成sage1-ints3复合物,才能显著促进肿瘤细胞生长。综上所述,本发明有效克服了现有技术中的种种缺点而具高度产业利用价值。上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属
技术领域:
中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。序列表<110>上海交通大学医学院附属第九人民医院<120>sage1抑制剂在制备药物或试剂盒中的用途<160>26<170>siposequencelisting1.0<210>1<211>19<212>dna<213>人工序列(artificialsequence)<400>1gtcccacagggcttattaa19<210>2<211>19<212>dna<213>人工序列(artificialsequence)<400>2tggtatttcatgcagaagt19<210>3<211>19<212>dna<213>人工序列(artificialsequence)<400>3gttccacctggttgtatta19<210>4<211>21<212>dna<213>人工序列(artificialsequence)<400>4gctggaatttcatccacgatt21<210>5<211>21<212>dna<213>人工序列(artificialsequence)<400>5ctgctgcctatgtgtttacaa21<210>6<211>21<212>dna<213>人工序列(artificialsequence)<400>6ccaaggagaaacaaggacata21<210>7<211>21<212>dna<213>人工序列(artificialsequence)<400>7gctgcctatgtgtttacaaat21<210>8<211>21<212>dna<213>人工序列(artificialsequence)<400>8cccagactgataaggtcatat21<210>9<211>21<212>dna<213>人工序列(artificialsequence)<400>9cccaaactgataaggtcatat21<210>10<211>97<212>dna<213>人工序列(artificialsequence)<400>10tgctgttgacagtgagcgcggtcccacagggcttattaattagtgaagccacagatgtaa60ttaataagccctgtgggaccatgcctactgcctcgga97<210>11<211>97<212>dna<213>人工序列(artificialsequence)<400>11tgctgttgacagtgagcgactggtatttcatgcagaagtatagtgaagccacagatgtat60acttctgcatgaaataccagctgcctactgcctcgga97<210>12<211>97<212>dna<213>人工序列(artificialsequence)<400>12tgctgttgacagtgagcgaggttccacctggttgtattaatagtgaagccacagatgtat60taatacaaccaggtggaaccgtgcctactgcctcgga97<210>13<211>58<212>dna<213>人工序列(artificialsequence)<400>13ccgggctggaatttcatccacgattctcgagaatcgtggatgaaattccagctttttg58<210>14<211>58<212>dna<213>人工序列(artificialsequence)<400>14ccggctgctgcctatgtgtttacaactcgagttgtaaacacataggcagcagtttttg58<210>15<211>58<212>dna<213>人工序列(artificialsequence)<400>15ccggccaaggagaaacaaggacatactcgagtatgtccttgtttctccttggtttttg58<210>16<211>58<212>dna<213>人工序列(artificialsequence)<400>16ccgggctgcctatgtgtttacaaatctcgagatttgtaaacacataggcagctttttg58<210>17<211>58<212>dna<213>人工序列(artificialsequence)<400>17ccggcccagactgataaggtcatatctcgagatatgaccttatcagtctgggtttttg58<210>18<211>58<212>dna<213>人工序列(artificialsequence)<400>18ccggcccaaactgataaggtcatatctcgagatatgaccttatcagtctgggtttttg58<210>19<211>23<212>dna<213>人工序列(artificialsequence)<400>19accgaaggaagagtatgtcctcg23<210>20<211>23<212>dna<213>人工序列(artificialsequence)<400>20aaaccgaggacatactcttcctt23<210>21<211>23<212>dna<213>人工序列(artificialsequence)<400>21accgaagtaaatctggttgcaac23<210>22<211>23<212>dna<213>人工序列(artificialsequence)<400>22aaacgttgcaaccagatttactt23<210>23<211>22<212>dna<213>人工序列(artificialsequence)<400>23ggaagagtatgtcctcgtggtt22<210>24<211>19<212>dna<213>人工序列(artificialsequence)<400>24gcatcaggccatggtggag19<210>25<211>20<212>dna<213>人工序列(artificialsequence)<400>25atcatccctgcctctactgg20<210>26<211>20<212>dna<213>人工序列(artificialsequence)<400>26gtcaggtccaccactgacac20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1