右美托咪定在促进肝脏再生中的应用
1.本发明涉及右美托咪定在促进肝脏再生中的应用,属于生物医药技术领域。
背景技术:
2.肝脏具有较强的再生能力,可在损伤或切除后进行再生,从而有利于部分肝切除和活体肝移植等术后恢复[1]。但是,如果残余肝组织或移植物的功能不足或体积较小,则可能会导致术后肝功能障碍,这是发病率和死亡率的主要原因[2
‑
4]。此外,具有再生功能障碍的供体移植物会导致并发症,例如肝移植后的早期同种异体移植功能障碍(early allograft dysfunction,ead)和原发性无功能(primary non
‑
function,pnf),因为它不能满足受体的代谢需求[5]。深刻理解肝脏再生可以帮助解决这个问题。肝脏再生涉及肝细胞生长因子hgf(hepatocyte growth factor),表皮生长因子egf(epidermal growth factor),白介素il
‑
6(interleukin
‑
6),肿瘤坏死因子tnf
‑
α(tumor necrosis factor alpha)[6,7]等生长因子和细胞因子,及其nf
‑
kb(nuclear factor
‑
k
‑
gene binding)[8],pi3k/akt(phosphatidylinositol 3kinase(pi3k)/protein kinase b)[9],erk 1/2(extracellular signal
‑
regulated kinases 1 and 2)[10]等信号通路。但是,肝脏再生的机制尚不完全清楚[11],手术后增强肝脏再生的最佳方法也不清楚。右美托咪定(dexmedetomidine,dex)是一种高度选择性的α2
‑
肾上腺素能受体激动剂(alpha2
‑
ar),广泛用于麻醉、镇静和镇痛。α2
‑
ar亚家族在机体各种器官中普遍表达[12,13]。据报道,dex通过抗凋亡,抗炎和抗氧化等途径改善肝脏因缺血再灌注引起的损伤,败血症诱导的肝损伤和急性应激诱导的肝损伤,从而诱导肝脏保护[14
‑
16]。但目前,本技术领域几乎没有文章探讨dex对肝脏再生的作用。由于dex在多种模式下的麻醉、镇痛和镇静中具有重要作用,本技术领域亟需解决dex是否以及如何促进肝脏再生的技术问题。
[0003]
参考文献:
[0004]
1.shi,j.h.and p.d.line,hallmarks of postoperative liver regeneratio:an updated insight on the regulatory mechanisms.j gastroenterol hepatol,2020.35(6):p.960
‑
966.
[0005]
2.deschenes,m.,early allograft dysfunction:causes,recognition,and management.liver transpl,2013.19 suppl 2:p.s6
‑
8.
[0006]
3.dahm,f.,p.georgiev,and p.a.clavien,small
‑
for
‑
size syndrome after partial liver transplantation:definition,mechanisms of disease and clinical implications.am j transplant,2005.5(11):p.2605
‑
10.
[0007]
4.selvaggi,g.and a.tzakis,surgical considerations in liver transplantation:small for size syndrome.panminerva med,2009.51(4):p.227
‑
33.
[0008]
5.greenbaum,l.e.,c.ukomadu,and j.s.tchorz,clinical translation of liver regeneration therapies:a conceptual road map.biochem pharmacol,2020.175:p.113847.
[0009]
6.herranz
‑
iturbide,m.,et al.,nadph oxidase 4(nox4)deletion accelerates liver regeneration in mice.redox biol,2021.40:p.101841.
[0010]
7.carmona
‑
cuenca,i.,et al.,upregulation of the nadph oxidase nox4 by tgf
‑
beta in hepatocytes is required for its pro
‑
apoptotic activity.j hepatol,2008.49(6):p.965
‑
76.
[0011]
8.cressman,d.e.,et al.,rapid activation of post
‑
hepatectomy factor/nuclear factor kappa b in hepatocytes,a primary response in the regenerating liver.j biol chem,1994.269(48):p.30429
‑
35.
[0012]
9.jackson,l.n.,et al.,pi3k/akt activation is critical for early hepatic regeneration after partial hepatectomy.am j physiol gastrointest liver physiol,2008.294(6):p.g1401
‑
10.
[0013]
10.li,j.w.,et al.,eight paths of erk1/2 signalling pathway regulating hepatocyte proliferation in rat liver regeneration.j genet,2011.90(3):p.435
‑
42.
[0014]
11.preziosi,m.e.and s.p.monga,update on the mechanisms of liver regeneration.semin liver dis,2017.37(2):p.141
‑
151.
[0015]
12.niu,x.y.,et al.,effects of intravenous and intrathecal dexmedetomidine in spinal anesthesia:a meta
‑
analysis.cns neurosci ther,2013.19(11):p.897
‑
904.
[0016]
13.hussain,n.,et al.,investigating the efficacy of dexmedetomidine as an adjuvant to local anesthesia in brachial plexus block:a systematic review and meta
‑
analysis of 18randomized controlled trials.reg anesth pain med,2017.42(2):p.184
‑
196.
[0017]
14.brede,m.,et al.,alpha2
‑
adrenergic receptor subtypes
‑
novel functions uncovered in gene
‑
targeted mouse models.biol cell,2004.96(5):p.343
‑
8.
[0018]
15.knaus,a.e.,et al.,alpha2
‑
adrenoceptor subtypes
‑‑
unexpected functions for receptors and ligands derived from gene
‑
targeted mouse models.neurochem int,2007.51(5):p.277
‑
81.
[0019]
16.wang,y.,et al.,dexmedetomidine protects rat liver against ischemia
‑
reperfusion injury partly by the alpha2a
‑
adrenoceptor subtype and the mechanism is associated with the tlr4/nf
‑
kappab pathway.int j mol sci,2016.17(7).
技术实现要素:
[0020]
本发明的目的是为解决右美托咪定dex在肝脏再生应用中的技术问题。
[0021]
为达到解决上述问题的目的,本发明所采取的技术方案是提供右美托咪定在肝细胞再生的药物制备中的应用。
[0022]
本发明提供α2
‑
肾上腺素受体激动剂在肝细胞再生的药物制备中的应用。
[0023]
优选地,所述右美托咪定在肝细胞再生的药物制备中的应用,右美托咪定通过akt/gsk3beta/beta
‑
catenin信号通路促进肝细胞再生。
[0024]
优选地,所述右美托咪定在肝细胞再生的药物制备中的应用,右美托咪定通过α2
‑
肾上腺素受体激活akt/gsk3beta/beta
‑
catenin信号通路促进肝细胞再生。
[0025]
优选地,所述α2
‑
肾上腺素受体激动剂在肝细胞再生的药物制备中的应用,所述α2
‑
肾上腺素受体激动剂通过akt/gsk3beta/beta
‑
catenin信号通路促进肝细胞再生。
[0026]
优选地,所述α2
‑
肾上腺素受体激动剂在肝细胞再生的药物制备中的应用,所述α2
‑
肾上腺素受体激动剂通过α2
‑
肾上腺素受体激活akt/gsk3beta/beta
‑
catenin信号通路促进肝细胞再生。
[0027]
相比现有技术,本发明具有如下有益效果:
[0028]
本发明通过实验证实右美托咪定在肝脏再生中的作用及潜在机制,确定右美托咪定在肝再生方面的作用。本发明提供了α2
‑
肾上腺素受体激动剂在肝细胞再生的药物制备中的应用,以及右美托咪定在肝细胞再生的药物制备中的应用;具体通过α2
‑
肾上腺素受体激活akt/gsk3beta/beta
‑
catenin信号通路促进肝细胞再生;本发明为肝类疾病的治疗及预后提供了新的靶点和新的路径。
附图说明
[0029]
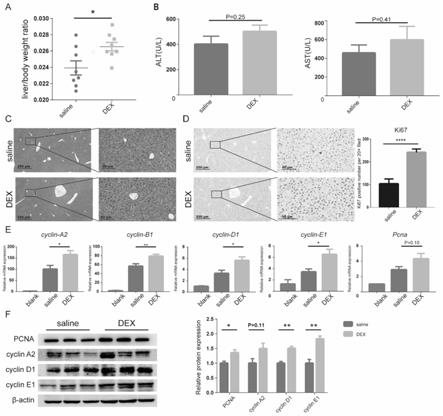
图1为右美托咪定(dex)促进小鼠70%肝切除术(phx)后肝再生指标图。
[0030]
其中a图和b图为saline组、dex组肝切术后48小时肝脏/体重指数、血清中ast、alt变化水平图;
[0031]
c图为saline组、dex组phx后48小时肝石蜡切片(5μm)苏木精和伊红染色图。
[0032]
d图为saline组、dex组phx 48h后肝脏石蜡切片(5μm)染色,200
×
视野ki67阳性细胞定量。
[0033]
e图为qpcr检测正常组织、saline组、dex组细胞周期、pcna mrna表达水平。数据与正常组织对比归一化。
[0034]
f图为western blot检测saline组、dex组细胞周期蛋白、pcna蛋白表达水平。数据与saline组对比归一化。
[0035]
图2为右美托咪定(dex)促进小鼠原代肝细胞(mphs)体外增殖。
[0036]
其中a图采用mtt法检测不同浓度dex处理24小时后mphs细胞活力。
[0037]
b图为western blot检测不同浓度(5、10、20μm)dex处理24h后mphs细胞周期蛋白、pcna蛋白表达水平。数据归一化到saline组。
[0038]
c图采用qpcr方法检测dex处理(10μm)24、48、72h后mphs细胞周期蛋白表达水平和pcna mrna水平。数据归一化到相应时间点的盐水组。
[0039]
d图,e图为右美托咪定处理后,通过edu和ki67染色检测增殖的pmhs。细胞用edu孵育4小时。edu定量,ki67阳性归一化至saline组。
[0040]
数据显示为平均值
±
sem,n=3;*p<0.05 dex vs saline组,**p<0.01 dex vs saline组,***p<0.001 dex vs saline组。
[0041]
图3为转录组测序表明右美托咪定影响肝脏再生的可能机制。
[0042]
其中a图为肝脏切除术后48小时,小鼠saline组和dex组差异表达基因火山图(绿
色点表示下调基因,橙色点表示上调基因)。
[0043]
b图为细胞周期、肝祖细胞、成熟肝细胞相关mrna水平热图。
[0044]
c图为go富集分析显示生物过程、细胞成分、分子功能富集部位前10位。
[0045]
d图为kegg富集分析显示富集路径前30位。
[0046]
图4为右美托咪定激活akt/gsk3beta/beta
‑
catenin通路。
[0047]
其中a图为western blot检测dex处理48h后小鼠肝脏组织akt/gsk3beta/beta
‑
catenin通路蛋白表达水平。b图为与saline组数据对比进行归一化处理。
[0048]
c图为western blot检测dex处理24h后mphs的akt/gsk3beta/beta
‑
catenin蛋白表达水平。d图为与saline组数据对比进行归一化处理。
[0049]
e图为saline组和dex组肝切除术后48小时肝脏组织石蜡切片(5μm)beta
‑
catenin免疫组化染色以及相应的阳性区域面积比例(f图);数据显示为mean
±
sem,n=3;*p<0.05 dex vs saline组,**p<0.01 dex vs saline组。
[0050]
图5为右美托咪定通过alpha2肾上腺素受体(a2r)激活akt/gsk3beta/beta
‑
catenin通路促进小鼠肝再生。
[0051]
其中a图,b图为saline组、dex组、ati组肝切术后48小时肝脏/体重指数、血清ast、alt水平。
[0052]
c图为saline组、dex组、ati组phx 48h后肝脏石蜡切片(5μm)染色,及200
×
视野ki67阳性细胞定量。
[0053]
d图为qpcr检测saline组、dex组、ati组细胞周期、pcna mrna表达水平,数据与saline组对比归一化。
[0054]
e图为western blot检测saline组、dex组、ati组akt/gsk3beta/beta
‑
catenin通路蛋白表达水平,与saline组数据对比进行归一化处理。
[0055]
f图为western blot检测saline组、dex组、ati组细胞周期蛋白、pcna蛋白表达水平,数据与saline组对比归一化。
[0056]
数据显示为mean
±
sem,n=3;*p<0.05 dex vs saline组,**p<0.01 dex vs saline组,***p<0.001 dex vs saline组。#p<0.05 dex vs ati组,##p<0.01 dex vs ati组,###p<0.001 dex vs ati组。
具体实施方式
[0057]
为使本发明更明显易懂,兹以优选实施例,并配合附图作详细说明如下:
[0058]
本发明提供了右美托咪定在肝细胞再生的药物制备中的应用。
[0059]
本发明提供了α2
‑
肾上腺素受体激动剂在肝细胞再生的药物制备中的应用。
[0060]
右美托咪定在肝细胞再生的药物制备中的应用,是通过akt/gsk3beta/beta
‑
catenin信号通路促进肝细胞再生。
[0061]
右美托咪定在肝细胞再生的药物制备中的应用,是通过α2
‑
肾上腺素受体激活akt/gsk3beta/beta
‑
catenin信号通路促进肝细胞再生。
[0062]
本发明提供了α2
‑
肾上腺素受体激动剂在肝细胞再生的药物制备中的应用,α2
‑
肾上腺素受体激动剂是通过akt/gsk3beta/beta
‑
catenin信号通路促进肝细胞再生;是通过α2
‑
肾上腺素受体激活akt/gsk3beta/beta
‑
catenin信号通路促进肝细胞再生。
[0063]
实施例:
[0064]
一、实验材料:
[0065]
本发明所用的b27无血清添加剂购于源培生物有限公司;n
‑
乙酰基
‑
l
‑
半胱氨酸(n
‑
acetylcysteine)、烟酰胺(nicotinamide)购于sigma
‑
aldrich;重组蛋白肝细胞生长因子(hgf)、表皮生长因子(egf)、血管内皮生长因子(vegf)和上皮生长因子(fgf10)购于peprotech公司;小分子化合物rock抑制剂(y
‑
27632)、tgf
‑
β抑制剂(a
‑
83
‑
01)购于陶素生化;advance dmem培养基购于gibco公司;青霉素与链霉素双联合抗生素购买自博锐生物医药公司;用于细胞的冲洗及重悬所用pbs缓冲液(phosphate buffer solution)和tryple购于gibco公司;胎牛血清(fbs)购于corning公司;用于细胞培养的低黏附孔板购于corning公司;气麻装置购于玉研生物,甲醇、无水乙醇、异丙醇、氯仿购于上海凌峰化学试剂有限公司;ripa裂解液购于上海碧云天生物有限公司;pvdf膜购于美国millipore公司;脱脂奶粉购于美国bd公司;逆转录试剂盒购于南京诺唯赞生物科技股份有限公司;山羊血清购于上海碧云天生物有限公司;盐酸右美托咪定购于扬子江药业集团;盐酸阿替美唑购于美国selleck公司;edu
‑
488细胞增殖检测试剂盒购于上海碧云天生物有限公司;alt,ast检测试剂盒购于长春汇力生物技术有限公司。
[0066]
异氟烷挥发罐购于德国drager公司;台式高速离心机allegra x
‑
22r购于美国beckman coulter公司;蛋白电泳仪购于美国bio
‑
rad公司;恒温培养箱购于美国thermo fisher scientific公司;荧光显微镜购于日本olympus公司。
[0067]
二、实验方法:
[0068]
本发明采用graphpad7生物统计软件对相应的实验数据进行分析,采用双尾非配对t检验和one
‑
way anova方差分析比较两组或多组不同处理之间的差异。所有的统计数据,至少使用了三个独立的样品或重复实验的数据,数据均以means
±
s.e.m.的形式表示,其中ns为无显着性,*p<0.05被认为存在统计学差异,其中**p<0.01,***p<0.0001。
[0069]
(一)小鼠70%肝脏切除手术
[0070]
1.分组:将6
‑
8周龄的c57bl/6小鼠分成3组:saline组,dex组,ati组,saline组术前30分钟腹腔注射500μl生理盐水,dex组术前30分种按照小鼠体重腹腔注射盐酸右美托咪定25μg/kg,ati组盐酸右美托咪定注射前10分钟按照小鼠体重腹腔注射盐酸阿替美唑250μg/kg同时记录下小鼠术前体重;
[0071]
2.按照随机分组预处理后,经异氟烷诱导麻醉,固定于泡沫板上,并给予异氟烷持续吸入麻醉;
[0072]
3.75%酒精消毒小鼠腹部,用有齿镊提起小鼠腹部中部皮肤,沿腹正中线分层剪开小鼠腹部皮肤及腹膜,暴露腹腔;
[0073]
4.使用曲别针弯钩将腹膜及皮肤拉开固定于两侧,使用生理盐水湿润的棉签拨开腹腔脏器暴露肝脏,并游离左叶和中叶;
[0074]
5.2
‑
0缝合线依次结扎左叶和中叶,并将其剪下,保留线结;
[0075]
6.用生理盐水湿润的棉签清理线结切口,检查是否存在渗血等情况;
[0076]
7.依次缝合腹膜及腹部皮肤切口,并第二天观察是否有切口疝出现;
[0077]
8.术后48小时,小鼠麻醉后通过心尖取血的方法获得小鼠血液,离心获得血清,冻在
‑
80℃,人道处死小鼠,取出小鼠的残余肝脏,并称重,保存于
‑
80℃进行后续实验。
[0078]
(二)小鼠原代肝细胞提取与培养
[0079]
1.分离原代肝细胞主要试剂配置
[0080]
1.1 100毫升p1配置:
[0081]
(1)将0.5g胎牛血清白蛋白(bsa)溶解至100毫升不含钙、镁离子的pbs溶液后,用玻璃棒搅匀至充分溶解;
[0082]
(2)按照1:1000加入100ul浓度为0.5m的乙二醇二乙醚二胺四乙酸(egta)溶液,充分混匀;
[0083]
(3)50毫升注射器吸入混合液体,经直径为0.22μm的滤器过滤后分装到50毫升无菌离心管中,最后放入预热的37℃水浴箱中备用。
[0084]
1.2 100毫升p2配置:
[0085]
(1)称取0.075g iv型胶原酶溶解至100毫升含钙、镁离子dmem高糖溶液中,充分混匀;
[0086]
(2)用50毫升注射器吸入混合液体,经0.22滤器过滤除菌后装入50毫升无菌离心管中,最后放入预热的37℃水浴箱中备用。
[0087]
2.小鼠原代肝细胞分离方法
[0088]
2.1台面准备
[0089]
(1)器械:2把剪刀、2把镊子、线
[0090]
(2)手术台:消毒棉球、棉棒若干、针头5个(4小1大固定)
[0091]
(3)消毒:酒精、碘酒、棉球、棉签、生理盐水、玻璃烧杯
[0092]
(4)冲洗泵:先用75%酒精冲洗管道消毒3min,再用无菌pbs冲洗,冲洗干净后将输液器中的转换器连上,套上静脉留置针接口,排净管道气体;
[0093]
(5)金属浴:调成42℃,将配置好的p1、p2溶液预热(详见材料部分)
[0094]
2.2麻醉
[0095]
手术前:小鼠腹腔注入工作浓度的三溴乙醇300μl
[0096]
2.3分离具体步骤
[0097]
(1)消毒:浸碘酒的棉球消毒小鼠腹部;
[0098]
(2)切口:下腹部起,沿腹白中线,作一长度为3
‑
4cm的切口,上至剑突。剪开后固定两侧,充分暴露腹部;
[0099]
(3)用棉签轻拨腹腔器官至右侧,暴露下腔静脉及肝门静脉;
[0100]
(4)用组织镊将肝门静脉与周围组织钝性分离后,将线从门静脉下方绕过,打松结;
[0101]
(5)排出针管内气体,刺入肝门静脉,插入点距扎线处约1cm,扎入后,沿着门静脉走行进针,抽出针芯,将结扎紧(注意平行打结,以防扎破血管),再用剩余的线和大针头固定留置针;
[0102]
(6)打开冲洗泵,用生理盐水或pbs冲洗肝脏,当肝脏体积充盈(肝脏膨胀)时,用剪断下腔静脉放血;
[0103]
(7)直到下腔静脉不再流出血水时,停止冲洗;
[0104]
(8)灌注p1:灌注时间6分钟为准,此时循环泵的流速为5毫升/分钟,大约灌注30ml;
[0105]
(9)灌注p2:灌注时间为7
‑
8分钟。可依据肝脏的消化程度适当加减。(肝脏消化程度可依据其出现斑点状、裂隙的时间及数量来判断),循环泵的流速为4毫升/分钟,灌注过程4
‑
5次按压下腔静脉出口,使得胶原酶充分灌注;
[0106]
(10)从小鼠腹腔将肝脏整块取出放入含培养基的无菌培养皿中。
[0107]
2.4收集细胞
[0108]
(1)释放肝细胞:将消化好的肝脏块移至超净工作台中,加入含有胎牛血清(fbs)和青霉素
‑
链霉素的dmem培养基终止消化,用剪刀将包膜刮开,再用1毫升注射器芯反复触碰肝脏组织直至释放全部肝细胞;
[0109]
(2)收集肝细胞:准备50ml离心管、70μm滤网,用滴管轻轻将肝细胞组织液从皿中转移至滤网上过滤;
[0110]
(3)低速离心:500rpm,5分钟;
[0111]
(4)清洗肝细胞:弃上清液,新鲜dmem(含fbs与双抗)重悬细胞,离心速度为500rpm,3分钟;
[0112]
(5)清洗肝细胞:再弃上清液,加20ml含血清的完全培养基重悬细胞,500rpm,3分钟;
[0113]
(6)细胞活率检测:新鲜培养基重悬细胞,用台盼蓝检测获取的原代肝细胞的活率。
[0114]
3.细胞种植与培养
[0115]
(1)培养基配制:基础培养基为dmem/f12培养基,添加1
×
b27 supplement(gibco)、1
×
l
‑
谷氨酰胺的试剂(如glutamax
‑
i)、1
×
ph调节剂(hepes)、1
×
原代细胞抗生素(如0.1mg/ml primocin)以及1
×
青霉素
‑
链霉素,同时加入1.56mm n
‑
乙酰半胱氨酸,10mm烟酰胺,0.5μm tgf
‑
β抑制剂a83
‑
01,10μm rock抑制剂y27632,3μm gsk3β抑制剂chir
‑
99021,50ng/ml egf,25ng/ml hgf;
[0116]
(2)细胞培养皿/板包被:用matrigel包被细胞培养皿/板;
[0117]
(3)细胞种植:根据获得细胞的数量和活率选择合适的密度种植;
[0118]
(4)细胞培养:环境为5%co2,37℃的细胞培养箱内,种植第二天换液,去除未贴壁的死细胞,此后每天观察细胞状态,待长满后即可传代进行其他细胞实验。
[0119]
(三)he染色
[0120]
1.固定/切片:在手术后48小时,切取肝脏组织浸泡于4%多聚甲醛中固定,经脱水、石蜡包埋后切片,切片厚度为5μm;
[0121]
2.65℃烤片1h;
[0122]
3.脱蜡/复水:将石蜡切片放入二甲苯ⅰ,ⅱ,ⅲ中脱蜡10min,经梯度无水乙醇ⅰ,ⅱ中孵育3min,95%乙醇ⅰ,ⅱ孵育3min,75%乙醇3min,ddh2o清洗5min;
[0123]
4.染色:将切片放入苏木精液中染色1min;自来水流水冲洗约10min;
[0124]
5.分化/漂洗:将切片放入1%盐酸乙醇中褪色,至切片变成浅红色,将细胞质内苏木精去除;将其再次放入自来水流水中冲洗使其恢复蓝色;
[0125]
6.复染:将其转移到0.5%伊红染色液中染色约10s;
[0126]
7.脱水:将石蜡切片放入75%乙醇1min,95%乙醇ⅰ,ⅱ1min,100%乙醇ⅰ,ⅱ1min;
[0127]
8.透明:用吸水纸吸干多余乙醇,将切片置于二甲苯ⅰ,ⅱ中慢摇3min;
[0128]
9.封片:用中性树脂封片剂进行封片;
[0129]
10.观察:于荧光显微镜下进行观察拍片。
[0130]
(四)免疫组化染色
[0131]
1.固定/切片:在手术后48小时,切取肝脏组织浸泡于4%多聚甲醛中固定,经脱水、石蜡包埋后切片,切片厚度为5μm;
[0132]
2.65℃烤片1h;
[0133]
3.脱蜡/复水:将石蜡切片放入二甲苯ⅰ,ⅱ,ⅲ中脱蜡10min,经梯度无水乙醇ⅰ,ⅱ中孵育3min,95%乙醇ⅰ,ⅱ孵育3min,75%乙醇3min,ddh2o清洗5min;
[0134]
4.抗原修复:将复水后的切片浸入柠檬酸钠缓冲液中,微波炉加热至沸腾;而后保持温度在95℃左右18分钟,冷却组织切片30分钟(不可干燥)。
[0135]
5.水化:用ddh2o洗涤切片5min
×
3遍;将其置于3%过氧化氢溶液中10min;用pbs洗涤5min
×
3遍;
[0136]
6.封闭:滴加适量山羊血清,室温封闭1h;
[0137]
7.一抗孵育:吸除封闭液,滴加抗体稀释液中稀释过的一抗,4℃冰箱孵育过夜;
[0138]
8.染色:吸除切片上一抗溶液,pbs清洗5min
×
3遍;配制dab溶液(现配先用),dab显色3
‑
5min;自来水冲洗5min,终止反应;
[0139]
9.复染:苏木精复染2min,盐酸酒精分化;自来水冲洗5min,终止反应;
[0140]
10.切片脱水:使用95%乙醇ⅰ,ⅱ孵育切片10s;使用100%乙醇ⅰ,ⅱ孵育10s;使用二甲苯ⅰ,ⅱ,ⅲ孵育1min;
[0141]
11.封片:用中性树脂封片剂进行封片;
[0142]
12.观察:于荧光显微镜下进行观察拍片;
[0143]
13.结果统计:将切片置于显微镜下观察并拍照;各样本选取5个20
×
视野,使用image j进行统计,计算各个视野阳性细胞数并进行统计分析。
[0144]
(五)edu染色
[0145]
1.细胞种植及处理:pmhs每孔1
×
105种植于12孔板种,每孔加入1ml培养基,第二天加入盐酸右美托咪定处理24小时;
[0146]
2.配制2x的edu工作液:用细胞培养液1:500稀释edu(10mm)即可得到2x的edu工作液(20μm);
[0147]
3.edu孵育:去除12孔板500μl培养基,将500μl 37℃预热的2x的edu工作液(20μm)加入12孔板中,细胞于培养箱种孵育4小时;
[0148]
4.固定:去除培养液,并加入1ml 4%的多聚甲醛室温固定15分钟;
[0149]
5.破膜:用pbs洗涤3min
×
3次,加入含0.3%triton x
‑
100的pbs室温孵育10min;
[0150]
6.配制click反应液;
[0151]
7.用pbs洗涤3min
×
3次,每孔加入0.5ml click反应液,轻轻摇晃培养板以确保反应混合物可以均匀覆盖样品,室温避光孵育30min;
[0152]
8.用pbs洗涤3min
×
3次,使用hoechst染料,用pbs按照1:1000进行稀释,每孔加入500μl,室温孵育10min;
[0153]
9.封片:加入中性树脂封片剂进行封片;
[0154]
10.观察:于荧光显微镜下进行观察拍片;
[0155]
11.结果统计:将切片置于显微镜下观察并拍照;各样本随机选取5个10
×
视野,使用image j进行统计,计算各个视野阳性细胞数并进行统计分析。
[0156]
三、实验结果:
[0157]
1.如图1所示;右美托咪定(dex)促进小鼠70%肝切除术(phx)后肝再生:
[0158]
右美托咪定预处理后小鼠进行70%肝切除术,48小时后取小鼠肝脏组织和血清检测肝脏再生和损伤的情况。右美托咪定预处理后,小鼠术后残肝重量/术前基础体重比例显著增高(如图1中a图)。但是谷丙转氨酶(alt),谷草转氨酶(ast)水平在dex处理后没有下降,反而略上升,两组间无统计学差异(如图1中b图)。对小鼠肝脏进行形态学的分析,he染色显示生理盐水(saline)组和dex组小鼠肝脏形态组织无明显变化(如图1中c图),ki67免疫组化染色中,dex组ki67阳性细胞数显著高于saline组(103.3
±
21.67 vs 241.3
±
14.97per 200
×
field,p<0.05)(如图1中d图)。实时定量聚合酶链式反应(real
‑
time pcr)检测肝脏组织的细胞周期、增殖相关的mrna水平,其中细胞周期标志物cyclin
‑
a2,cyclin
‑
b1,cyclin
‑
d1,cyclin
‑
e1 mrna水平,dex组显著高于saline组,增殖标志物pcna mrna水平,dex组高于saline,但未达到统计学差异(p=0.10)(如图1中e图)。蛋白质印迹法(western blot)检测肝脏组织的细胞周期、增殖相关的蛋白质水平,pcna,cyclin
‑
d1,cyclin
‑
e1蛋白质水平,dex组明显高于saline组,cyclin
‑
a2蛋白质水平,dex组高于saline,但没有明显统计学差异(p=0.11)(如图1中f图)。
[0159]
2.如图2所示:右美托咪定促进小鼠原代肝细胞(pmhs)体外增殖:
[0160]
体外检测右美托咪定对于小鼠原代肝细胞(primary mouse hepatocytes,pmhs)是否具有促进增殖作用。噻唑蓝mtt法检测细胞活力,dex处理细胞24小时后,在0
‑
80μm范围内对细胞活力未出现下降表现,细胞活力峰值出现在10μm浓度,从0
‑
10μm细胞活力逐渐上升,10
‑
80μm细胞活力逐渐下降(如图2中a图)。western blot检测dex处理后,细胞周期、增殖相关的蛋白质水平,与saline组比较,dex(5,10,20μm)处理后,pcna,cyclin d1,cyclin e1表达均明显提高,pcna表达在dex 20μm表达最高,cyclin d1和cyclin e1表达在dex 10μm,20μm水平相当(如图2中b图)。结合mtt结果,选择10μm为后续实验的浓度。real
‑
time pcr结果显示,dex处理24、48、72小时后细胞周期蛋白、pcna mrna表达水平(如图2中c图)。cyclin
‑
a2 mrna在24h后表达量比对照组增加1.91倍,在48h、72h时表达量下降,仍高于对照组。dex组在各时间点cyclin
‑
b1 mrna表达均逐渐升高,并高于对照组。有趣的是,dex组cyclin
‑
d1、pcna mrna在24h时表达较低,在48、72h时表达明显升高。通过edu试验和ki67免疫荧光染色(如图2中d图,e图)。edu孵育4小时后,增殖的细胞明显增多。dex处理后edu阳性细胞是saline组的2.7倍(p<0.05)(如图2中d图)。dex处理24h后ki67阳性细胞是saline组的1.3倍(p<0.05)(如图2中e图)。
[0161]
本部分结果提示右美托咪定可促进mphs增殖,减少细胞凋亡。
[0162]
3.如图3所示;为转录组测序提示右美托咪定影响肝再生的可能机制;
[0163]
为了探究dex介导的肝再生可能机制,对dex预处理肝切除术后的小鼠肝组织进行转录组测序。火山图显示dex组上调基因1283个,下调基因1319(log2fc≥1,p<0.05)(如图3中a图)。然后在热图中将这些差异表达基因(degs)分为三个集群(如图3中b图)。dex组细胞周期mrna表达水平升高,与体内和体外实验结果一致。dex组成熟肝细胞mrna表达水平较低,肝祖细胞(lpcs)mrna表达水平较高。go富集分析显示生物功能富集到细胞周期、细胞分
裂,说明dex预处理促进细胞增殖(如图3中c图)。go富集分析中分子功能和细胞组分富集到atp结合、线粒体,这些与能量供应相关,符合增殖过程中大量的能量消耗。kegg富集分析显示前30位信号通路为mtor信号通路、pi3k
‑
akt信号通路、jak
‑
stat信号通路(如图3中d图)。其中pi3k
‑
akt信号通路富集大量差异基因。转录组测序结果显示,dex预处理组有更多的肝细胞处于增殖状态,进入细胞周期,有更多的能量供应,pi3k
‑
akt信号通路可能是其作用机制。
[0164]
4.如图4所示;右美托咪定通过akt/gsk3beta/beta
‑
catenin通路促进小鼠肝细胞增殖:
[0165]
通过转录组测序,发现右美托咪定预处理后,akt信号通路明显被富集。申请者拟深入分析右美托咪定是否通过akt信号通路发挥促进肝再生作用。发现在肝再生动物模型中,dex组p
‑
akt p
‑
gsk3beta,beta
‑
catenin表达水平显著更高(如图4中a图,b图)。cylind1蛋白的表达水平在dex组也显著升高,而cyclind1是beta
‑
catenin下游效应分子(如图4中a图,b图)。在细胞水平也表现出同样的趋势(如图4中c图,d图)。beta
‑
catenin免疫组化显示dex组有更多的beta
‑
catenin的聚集(如图4中e图,f图)。综上所述,可以证实dex磷酸化激活akt,进而磷酸化gsk3beta使其失活,beta
‑
catenin磷酸化降解降低,聚集增加,增强cyclin
‑
d1蛋白表达。综上所述,akt/gsk3beta/beta
‑
catenin通路参与了dex介导的肝细胞增殖。
[0166]
5.如图5所示;右美托咪定通过alpha2肾上腺素受体(a2r)激活akt/gsk3beta/beta
‑
catenin通路促进小鼠肝再生
[0167]
已有文献报道右美托咪定通过与alpha2肾上腺素受体结合发挥作用。申请者在体外实验证实右美托咪定作用于akt/gsk3beta/beta
‑
catenin通路后,拟应用a2r抑制剂阿替美唑预处理进行体内进一步验证。抑制右美托咪定后,小鼠术后残肝重量/术前基础体重比例显著降低(ati组vs dex组,p<0.05)(如图5中a图)。alt,ast水平在dex处理后下降,但是与saline组或ati组比较均无统计学差异(如图5中b图)。ki67免疫组化染色中,dex组ki67阳性细胞数显著高于ati组(87.92
±
14.45vs 196.9
±
13.42per 200
×
field,p<0.05)(如图5中c图),而ati组与saline组阳性细胞数相当。real
‑
time pcr检测肝脏组织的细胞周期、增殖相关的mrna水平,其中cyclin
‑
a2,cyclin
‑
b1,cyclin
‑
d1,cyclin
‑
e1,pcna mrna水平,dex组显著高于saline组(p<0.05)(如图5中d图)。阿替美唑预处理后,p
‑
akt,p
‑
gsk3beta,beta
‑
catenin蛋白表达水平均下降,说明右美托咪定对akt/gsk3beta/beta
‑
catenin通路的激活被抑制(如图5中e图)。同样,pcna,cyclin
‑
a2,cyclin
‑
e1蛋白表达水平也在阿替美唑预处理后下降(如图5中f图)。体内实验的证据与体外实验相符,dex通过激活akt/gsk3beta/beta
‑
catenin通路和alpha2肾上腺素受体促进小鼠肝再生。
[0168]
以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1