包含天然混合物提取物作为活性成分的预防或治疗糖尿病并发症和血管性水肿的药物组合物的制作方法
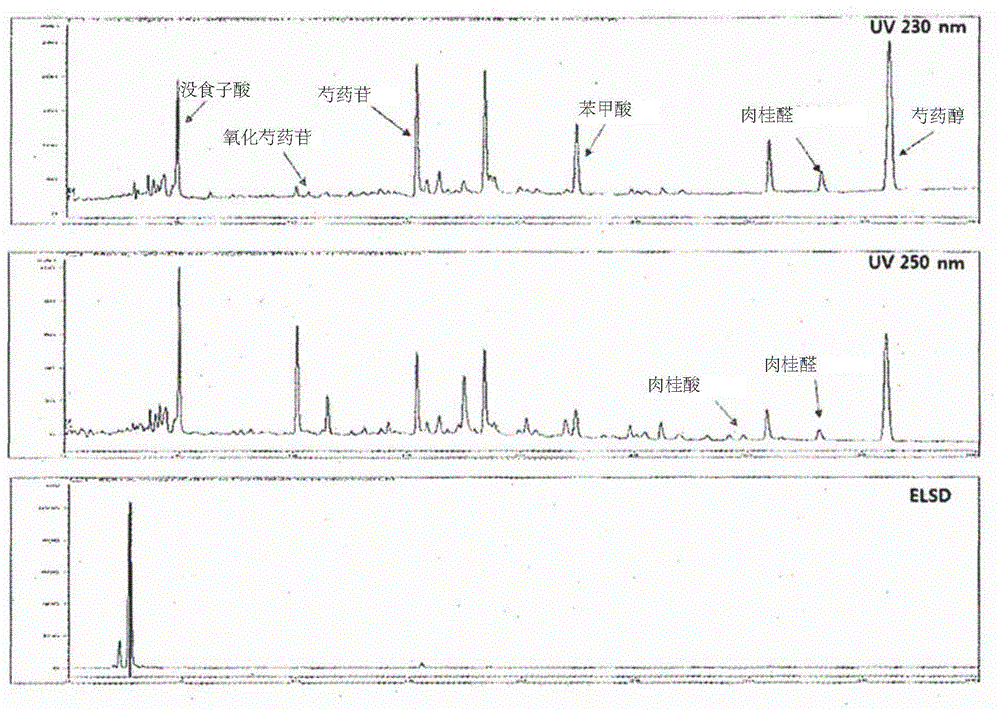
本申请是分案申请,原申请的申请日为2015年5月21日,申请号为201580039444.9,发明名称为“包含天然混合物提取物作为活性成分的预防或治疗糖尿病并发症和血管性水肿的药物组合物”。本发明涉及预防和治疗糖尿病并发症和血管性水肿的药物组合物,糖尿病并发症包括糖尿病性视网膜病、糖尿病性肾病和糖尿病性神经病,血管性水肿包括黄斑(视网膜)水肿、黄斑变性和静脉曲张(varicoseveins),其中组合物包含肉桂枝(cinnamontwig)和牡丹根皮(moutanrootbark)、肉桂枝和芍药根(peonyroot)、或肉桂枝和茯苓(poria)的混合物的提取物作为活性成分。
背景技术:
:据2009年美国医学协会杂志(journaloftheamericanmedicalassociation,jama)报道,全球糖尿病人群已超过2.4亿,并且全球糖尿病患者数量预期将于2025增长至3.8亿,并且其中,约60%将发生在亚洲区。具体地,随着近来老龄化社会出现和糖尿病发作年龄持续走低,糖尿病并发症发作迅速增加。近来,韩国糖尿病患病率已达到10%。具体地,糖尿病发作已发展至年轻人,并且因预期寿命增加,糖尿病并发症患者数量爆炸式增加。过去五年,糖尿病并发症的发生已增加60%,并且医疗费用也已增加54%。由此,医疗费用基本上已达到2035亿韩元(nationalhealthinsurancecorporation;2011年8月)。也就是说,糖尿病发作后10至15年,体内几乎所有器官都被损伤,导致糖尿病性视网膜病、糖尿病性白内障、糖尿病性肾病、糖尿病性神经病、糖尿病性足溃疡、糖尿病性心脏病、糖尿病性骨质疏松、或糖尿病性动脉硬化。虽然目前给予糖尿病患者的具有若干机制的糖尿病药物(例如,美福明(metformin)、罗格列酮(rosiglitazone)、zemiglo、捷诺维(januvia)等)调控早期糖尿病的血液葡萄糖水平,但该糖尿病药物因不可能完全治愈无法从根本上预防或治疗发生糖尿病并发症(糖尿病性眼病、肾病、神经病、足溃疡等)(通过慢性进展发生)的转变。糖尿病并发症始于糖尿病,但其转变机制不同于糖尿病本身。因此,需要通过联合使用能够延迟或预防糖尿病并发症同时还迅速调控血液葡萄糖的药物来延迟、预防、或治疗糖尿病并发症。慢性糖尿病性肾病需要血液透析和器官移植,并且糖尿病性白内障和视网膜病导致失明。在美国,据报道25至74岁失明的主要原因是糖尿病。关于糖尿病性足溃疡患者,其可不得不经历其臂和腿截肢的严重情形,并且糖尿病性神经病伴随刺痛感觉。另外,糖尿病性心脏病导致猝死。因此,当可使糖尿病患者的糖尿病并发症发作延迟甚至数年时,患者及其家庭的生活质量将得到改变,并且这将在很大程度上有助于国家财政。据报道,引起这些糖尿病并发症的代表性因素包括晚期糖化终产物产生、醛糖还原酶活化、pkc异构体活化、和己糖胺途径通量增加(nature,414,813-820,2000;diabetologia,38:357-394,1995)。这些因素的不可逆反应促进氧化应激(oxidativestress),从而进一步加重糖尿病并发症。蛋白质的非酶促糖化表示在无酶介导的情况下还原糖与蛋白质的氨基酸基团如赖氨酸残基的缩合反应(maillard反应)。该反应的结果是,生成晚期糖化终产物(age)。也就是说,其形成schiff碱作为早期产物,然后位于schiff碱附近的酮胺加合物与其反应生成可逆amadori型早期糖化产物;并且当高血糖状态持续时,可逆amadori型早期糖化产物不降解而只是重排生成不可逆的晚期糖化终产物。生成的不可逆晚期糖化终产物与蛋白质或脂质缀合或交联,导致糖蛋白或糖脂不可逆产生。晚期糖化终产物结合(交联)蛋白质如基膜、血浆白蛋白、晶状体蛋白、纤维蛋白和胶原蛋白、或结合脂质。因此,这些在其存活期间在组织中积累,从而异常地改变组织的结构和功能,进而引起并发症。另外,即使血液葡萄糖水平恢复正常,并发症也会发展,因为生成的晚期糖化终产物继续与蛋白质和脂质反应(n.engl.med.,1988,318,1315-1321)。另外,当抗氧自由基防御系统的功能在上述条件下下降时引起氧化应激(j.oftrad.med.2001,18:107-112)。据报道,为基于这种机制延迟、预防或治疗糖尿病并发症的发作,抑制晚期糖化终产物产生非常重要(n.engl.med.1998,318,1315-1321)。糖尿病性视网膜病损伤慢性高血糖状态中的血管和神经细胞,因此进展成非增生性视网膜病。结果是,其最终进展成增生性视网膜病,导致失明。也就是说,在高血糖状态中,包裹视网膜毛细血管的周细胞开始破裂,同时微动脉瘤(microaneurysm)现象发生,导致内皮细胞损伤。结果是,产生大量无法执行血管功能的无细胞毛细血管。这些异常新血管的壁脆弱到足以被轻易破坏,因此血液组分漏出,最终导致视力丧失。若干病理现象由于连接外周细胞、内皮细胞和类似物的紧密接合蛋白如闭合蛋白或紧蛋白受损而发生。为预防这种糖尿病性视网膜病,必须预防初始症状,即外周细胞损伤。非诺贝特(fenofibrate)(lipidil,abott)在2013年12月被澳大利亚fda批准作为pparα激动剂——治疗糖尿病性视网膜病的药物。accord研究和fild研究报道,得到严格血液葡萄糖控制的糖尿病患者中33%阻止了糖尿病性视网膜病转变,而患者中约40%延迟了糖尿病性视网膜病转变。iluvien(氟轻松玻璃体内植入物,alimerascience)在2014被usfda批准作为治疗糖尿病性黄斑水肿的药物。糖尿病性肾病通过糖化白蛋白(其中晚期糖化终产物与蛋白质偶联)在引起慢性糖尿病性肾病方面充当重要因素。糖化白蛋白与正常白蛋白相比更容易被引入小球细胞,并且长期高浓度葡萄糖刺激系膜细胞,从而增加胞外基质合成。过度引入的糖化白蛋白和增加的胞外基质导致小球纤维化。通过这些机制,小球持续受损,因而需要极端治疗,如血液透析和器官移植。血管性水肿意指位于皮肤内部深处或皮肤下方、或粘膜下方的血管的渗透性增加,从而导致其中的体液漏出和聚集在邻接组织周围,例如产生水肿的疾病。血管性水肿常发生于相对松散的组织中。其可容易发生在眼和唇周围、或手、粘膜(如,舌)中、口、喉、或胃肠道壁内。具体地,黄斑(视网膜)水肿、黄斑变性、或静脉曲张因血管性水肿导致血液-视网膜屏损伤而发生。年龄相关的黄斑变性(amd)意指不可逆疾病,并且是在很多老年人中发生并且引起失明的代表性疾病。其发病率因全球人口老龄化而逐渐增加。在美国,据报道,年龄相关的黄斑变性是失明的主要原因,并且环境和遗传因素也影响其发作。具体地,吸烟据报道是最大致命发病因素。另外,肥胖和抗氧化剂和膳食脂肪过量摄入也引起黄斑变性并且影响其进一步进展。因此,黄斑变性发作随健康饮食摄入、体重调控、适当锻炼、戒烟和类似手段而减少。在美国,40至50岁群体的早期(干)黄斑变性的患病率仅为3.9%,而显示其发病率在75岁和更老龄的年龄群中很高,为22.8%(beaverdameye研究)。另外,75岁和更老龄的老人显示发病率为5.4%,并且其中7.1%是末期黄斑变性患者。澳大利亚白种人中1.9%是末期黄斑变性患者,并且在五年时间期间,其发病率在55岁和更年轻的年轻年龄群中为0%,但在85岁和更老龄的老年龄群中18.5%患有黄斑变性。另外,其比率与亚洲马来人(澳大利亚的一个种族)的比率相似(bluemountaineyestudy;progressinretinalandeyeresearch,1-15,2014)。在韩国,韩国视网膜协会(koreanretinasociety)报告,在过去一年,湿黄斑变性患者的数量增加7.4倍,并且40至50岁群体中的发病率增加9倍。然而,最严重的问题是,用于黄斑变性的治疗还未被找到。novartis(一家瑞士制药公司)生产的lucentis是抗体治疗剂,并且非常昂贵。另外,lucentis的缺陷在于视敏度不能恢复到足以阻止疾病进展。黄斑变性分成干黄斑变性和湿黄斑变性。玻璃疣——一团废物——在黄斑中积累,并且破坏脉络膜和黄斑上部之间的代谢连接,从而产生干黄斑变性。另外,当这个过程继续进展时,其演变成湿黄斑变性。也就是说,由于废物在黄斑区域中积累,血管无法正常工作,因此营养物、氧和类似物无法被供应至其。结果是,其导致异常新血管生长——称为脉络膜新血管形成(cnv)。由此生成的血管具有非常脆弱的壁,因此血管中的蛋白质、红细胞或类似物漏出到黄斑区域和视网膜。另外,由于血液从血管放出,若干因素发生,如感光细胞(视杆细胞和视锥细胞)和视网膜色素上皮细胞层死亡等,从而导致失明(nutritionresearch,34,95-105,2014;plosone,8,e71064,2013)。视网膜色素上皮细胞(rpes)在维持健康视力中具有重要作用——通过支撑bruch膜(brm)和通过维持非增生性状态。从视网膜色素上皮细胞分泌的胱蛋白c(cystatinc)是一种强力半胱氨酸蛋白酶抑制剂,并且在适当调控brm的蛋白质循环中具有重要作用。然而,晚期糖化终产物的过度积累使胱蛋白c的表达和分泌减少,导致视网膜色素上皮细胞基部的蛋白质降解失衡。结果是,黄斑变性最终发生。相应地,据报道,通过抑制晚期糖化终产物产生也可预防(治疗)黄斑变性(kayp等,iovs,2014,55(2),926-34)。血管内皮生长因子(vegf)从视网膜色素上皮细胞层分泌,以正常调节bruch膜(brm)周围部分和调控脉络膜毛细血管内皮细胞的生长和紧凑性。在正常条件下,vegf分泌被严格调控,因此不发生新血管形成。然而,如果vegf分泌未被严格调控,则其担当导致达到黄斑变性末期的决定因素。当vegf分泌异常增加时,产生异常并且脆弱的血管,从而破坏血管(j.cell.mol.med.,17,7,833-843,2013)。静脉曲张是静脉朝向皮肤外部显现的疾病。肢体中分布的静脉分成位于肌肉之间的深静脉、皮肤下方可见的浅静脉、和连接这两者的穿静脉。其中,静脉曲张意指浅静脉伸长使得其显现突出在皮肤外部的静脉。另外,当恒定维持静脉中的血流以始终导向心脏的瓣膜使静脉曲张中的压力增加时,静脉壁变脆弱,因此瓣膜受损。结果是,流向心脏的血液回流,使得静脉伸长,从而导致静脉曲张。肉桂枝是桂皮树(肉桂树)的幼枝,桂皮树是一种常青树,樟属(cinnamomum)若干种类的其中之一。肉桂枝的口味辣而甜,其性温,并且其影响心、肺和膀胱。已知其强胃,抑制中风,具有缓解疼痛和强心作用,扩张皮肤血管,刺激汗腺以引起出汗从而对身体施以退热作用,并且对病毒具有抑制作用。另外,肉桂枝用于治疗受寒、发热、头痛、身体疼痛、心悸等,或在出汗不正常产生时使用。肉桂枝具有长圆柱形状,并且具有很多分枝,其长度为30cm至70cm,而粗壮部分的直径为0.3cm至1cm。表面具有红褐色或褐色垂直脊线,并且具有薄皱褶和小团块形式的叶和分枝痕迹。其质硬、脆并且易切割。广西和广东省是主要产生地,并且越南、斯里兰卡、印度是肉桂枝培育国家。根据肉桂枝的药理实验结果,揭示肉桂枝具有出汗、退热、止痛、强心、抗敏和抗病毒效果。然而,肉桂枝与糖尿病并发症或血管性水肿相关的效果还未被揭示。牡丹根皮是长久以来使用的重要草药,并且因其性冷作为治疗血液外渗的消炎凝结剂用于韩医学(orientalmedicine)。另外,其药效用于下腹部器官血管系统炎症、因充血造成的疼痛、发热、化脓、出血、和类似状况。具体地,牡丹根皮对抗炎、收缩、月经不规律解痉、子宫和附器炎症、充血、和牵引痛有效,并且也适用于治疗痔疮和阑尾炎。芍药根为多年生植物,属于毛茛科,并且分成白芍(radixpaeoniaealba)和赤芍(radixpaeoniaerubra)。白芍和赤芍通过壳的存在来确定;赤芍为具有壳的多年生植物;白芍是壳剥落的多年生植物(altern.med.rev.,6(5),pp495-499,2001)。白芍和赤芍具有用于胃、肠和子宫的平滑肌的抗收缩和冠状扩张(coronarydilatation)效果;用于血管疾病的预防动脉粥样硬化、降血压、提高血流的效果和抗氧化剂效果(ohsugim等,j.ethnopharmacol.,67,pp111-119,1999);血小板聚集抑制效果(linhc等,plantamed,65,pp595-599,1999);抗凝血效果(ishidah等,chem.pharm.bull,35(2),pp849-852,1987);和预防高脂血症(yangho等,fitoterapia,75(1),pp45-49,2004)。另外,据报道,糖苷——芍药根组分的一部分——有效治疗脑梗塞(yangj等,zhongyaocai,23(2),pp95-97,2000)。茯苓意指在松树根中生长并且具有直径5cm至7cm的球形或椭圆形形状的菌核。另外,其具有褐色或污黑色和泥土上树皮片外观。茯苓因栓化而硬质,覆以0.2mm至0.5mm厚度,和径向裂纹形式。虽然茯苓具有极少口味和气味,但其有时以轻质粘液散布并对碘显示阳性反应。另外,据报道,茯苓用作稳定剂,并且不仅具有稳定化先天性发热的效果,而且温和身体。因此,发明人已尝试开发安全且有效的天然药物用于预防和治疗糖尿病并发症和血管性水肿,其中天然药物不具有毒性和副作用。结果是,确认肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓的混合提取物抑制在慢性糖尿病条件下发生的晚期糖化终产物过度生成,呈现分裂晚期糖化终产物与基质蛋白之间的交联的效果,在抑制经历高血糖或衰老化环境的人视网膜色素上皮细胞系中晚期糖化终产物生成方面具有优越效果,并且在延迟、预防和治疗糖尿病并发症、黄斑变性、视网膜震荡、和糖尿病并发症不同动物模型下肢水肿、黄斑变性、和下肢水肿方面具有优越效果,因此混合提取物可有效用作预防和治疗糖尿病并发症和血管性水肿的组合物。据此完成了本发明。技术实现要素:[技术问题]本发明的一个目的是提供预防和治疗糖尿病并发症和血管性水肿的组合物,其包含肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓的混合提取物作为活性成分。[技术方案]为实现上述目的,本发明提供药物预防和治疗糖尿病并发症和血管性水肿的组合物,其包含肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓的混合物的提取物作为活性成分。另外,本发明提供预防和减轻糖尿病并发症和血管性水肿的健康功能性食品,其包含该混合提取物作为活性成分。另外,本发明提供治疗糖尿病并发症和血管性水肿的方法,包括步骤:向患有糖尿病并发症和血管性水肿的对象给予药学有效量的混合提取物。另外,本发明提供减轻糖尿病并发症和血管性水肿的方法,包括步骤:向患有糖尿病并发症和血管性水肿的对象给予药学有效量的混合提取物。另外,本发明提供混合提取物作为预防和治疗糖尿病并发症和血管性水肿的药物组合物的应用。另外,本发明提供混合提取物用作预防和减轻糖尿病并发症和血管性水肿的健康功能性食品的用途。[有利效果]根据本发明的肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓的混合提取物已被确认抑制在慢性糖尿病条件下发生的晚期糖化终产物过度生成,呈现分裂晚期糖化终产物与基质蛋白之间的交联的效果,在抑制经历高血糖或衰老化环境的人视网膜色素上皮细胞系中晚期糖化终产物生成方面具有优越效果,并在延迟、预防和治疗糖尿病并发症、黄斑变性、视网膜震荡、和下肢水肿——在糖尿病并发症各种动物模型中、黄斑变性、和下肢水肿方面具有优越效果,因此该混合提取物可有效用作预防和治疗糖尿病并发症和血管性水肿的组合物的活性成分,该糖尿病并发症包括糖尿病性视网膜病、糖尿病性肾病和糖尿病性神经病,该血管性水肿包括黄斑(视网膜)水肿、黄斑变性、和静脉曲张。附图说明图1a是cmo4(肉桂枝和牡丹根皮(1:8)的提取物)的成分分析结果显示图;图1b是cmo4-1(肉桂枝和牡丹根皮(1:8)的热水提取物)的;图1c是cpa4(肉桂枝和芍药根(1:8)的提取物)的;和图1d是cpa4-1(肉桂枝和芍药根(1:8)的热水提取物)的,全部都通过hplc来分析。图2是确认抑制晚期糖化终产物产生对经甘氨醛(glycoaldehyde)处理的胞外基质(ecm)的效果的图:ages:晚期糖化终产物;cmo4:肉桂枝和牡丹根皮(1:8)的提取物;cmo4-1:肉桂枝和牡丹根皮(1:8)的热水提取物;cpa4:肉桂枝和芍药根(1:8)的提取物;cpa4-1:肉桂枝和芍药根(1:8)的热水提取物;**p<0.01vs.non-ages;***p<0.001vs.non-ages;#p<0.05vs.ages;##p<0.01vs.ages;和###p<0.001vs.ages。图3是确认在高血糖环境下在人视网膜色素上皮细胞系中cmo2(肉桂枝和牡丹根皮(1:2)的提取物)、cmo4(肉桂枝和牡丹根皮(1:8)的提取物)、cmo4-1(肉桂枝和牡丹根皮(1:8)的热水提取物)、cpa1-1(肉桂枝和芍药根(2:1)的热水提取物)、cpa2-1(肉桂枝和芍药根(1:2)的热水提取物)、cpa4(肉桂枝和芍药根(1:8)的提取物)、和cpa4-1(肉桂枝和芍药根(1:8)的热水提取物)抑制晚期糖化终产物产生的效果的图:hg:高血糖治疗组;bsa:牛血清白蛋白治疗组;cmo2:肉桂枝和牡丹根皮(1:2)的提取物;cmo4:肉桂枝和牡丹根皮(1:8)的提取物;cmo4-1:肉桂枝和牡丹根皮(1:8)的热水提取物;cpa1-1:肉桂枝和芍药根(2:1)的热水提取物;cpa2-1:肉桂枝和芍药根(1:2)的热水提取物;cpa4:肉桂枝和芍药根(1:8)的提取物;cpa4-1:肉桂枝和芍药根(1:8)的热水提取物;ag:氨基胍治疗组作为阳性对照组;*p<0.05vs.con;**p<0.01vs.con;***p<0.001vs.con;#p<0.05vs.hg;##p<0.01vs.hg;和###p<0.001vs.hg。图4是确认在2型糖尿病模型db/db小鼠中给予cmo4-1(肉桂枝和牡丹根皮(1:8)的热水提取物)和cpa4-1(肉桂枝和芍药根(1:8)的热水提取物)12周后对血液-视网膜屏障损伤的预防效果——作为预防糖尿病性视网膜病效果的一部分——的图:nor:正常动物组(非糖尿病杂合子db/+小鼠);dm:糖尿病动物组(c57bl/ksj-leprdb/db糖尿病小鼠);feno-100:给予非诺贝特100mg/kg/天的小组;cmo4-1-100:给予cmo4-1100mg/kg/天的小组;cmo4-1-250:给予cmo4-1250mg/kg/天的小组;cpa4-1-100:给予cpa4-1100mg/kg/天的小组;和cpa4-1-250:给予cpa4-1250mg/kg/天的小组。图5是确认在2型糖尿病模型db/db小鼠中给予cmo4-1(肉桂枝和牡丹根皮(1:8)的热水提取物)和cpa4-1(肉桂枝和芍药根(1:8)的热水提取物)12周后对无细胞毛细血管形成的预防效果——作为预防糖尿病性视网膜病效果的一部分——的图:nor:正常动物组(非糖尿病杂合子db/+小鼠);dm:糖尿病动物组(c57bl/ksj-leprdb/db糖尿病小鼠);feno-100:给予非诺贝特100mg/kg/天的小组;cmo4-1-100:给予cmo4-1100mg/kg/天的小组;cmo4-1-250:给予cmo4-1250mg/kg/天的小组;cpa4-1-100:给予cpa4-1100mg/kg/天的小组;和cpa4-1-250:给予cpa4-1250mg/kg/天的小组。图6是确认在2型糖尿病模型db/db小鼠中给予cmo4-1(肉桂枝和牡丹根皮(1:8)的热水提取物)和cpa4-1(肉桂枝和芍药根(1:8)的热水提取物)12周后对闭合蛋白(紧密接合蛋白)损伤的预防效果——作为对糖尿病性视网膜病的预防效果的一部分——的图:nor:正常动物组(非糖尿病杂合子db/+小鼠);dm:糖尿病动物组(c57bl/ksj-leprdb/db糖尿病小鼠);feno-100:给予非诺贝特100mg/kg/天的小组;cmo4-1-100:给予cmo4-1100mg/kg/天的小组;cmo4-1-250:给予cmo4-1250mg/kg/天的小组;cpa4-1-100:给予cpa4-1100mg/kg/天的小组;和cpa4-1-250:给予cpa4-1250mg/kg/天的小组。图7是确认治疗血液-视网膜屏障损伤的效果——作为治疗糖尿病性视网膜病效果的一部分——的图,其中在2型糖尿病模型db/db小鼠中调控血液葡萄糖水平同时给予美福明12周后,将cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)与美福明共同给予12周:nor:正常动物组(非糖尿病杂合子db/+小鼠);dm:糖尿病动物组(c57bl/ksj-leprdb/db糖尿病小鼠);met:给予美福明350mg/kg/天的小组;met+feno:给予美福明350mg/kg/天和非诺贝特100mg/kg/天的小组;met+cmo4-100:给予美福明和cmo4100mg/kg/天的小组;met+cmo4-250:给予美福明和cmo4250mg/kg/天的小组;met+cpa4-100:给予美福明和cpa4100mg/kg/天的小组;met+cpa4-250:给予美福明和cpa4250mg/kg/天的小组;*p<0.05vs.nor;和#p<0.05vs.dm。图8是确认抑制无细胞毛细血管形成的效果——作为治疗糖尿病性视网膜病效果的一部分——的图,其中在2型糖尿病模型db/db小鼠中调控血液葡萄糖水平12周同时给予美福明后,将cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)与美福明共同给予12周:nor:正常动物组(非糖尿病杂合子db/+小鼠);dm:糖尿病动物组(c57bl/ksj-leprdb/db糖尿病小鼠);met:给予美福明350mg/kg/天的小组;met+feno:给予美福明350mg/kg/天和非诺贝特100mg/kg/天的小组;met+cmo4-100:给予美福明和cmo4100mg/kg/天的小组;met+cmo4-250:给予美福明和cmo4250mg/kg/天的小组;met+cpa4-100:给予美福明和cpa4100mg/kg/天的小组;met+cpa4-250:给予美福明和cpa4250mg/kg/天的小组;*p<0.05vs.nor;和#p<0.05vs.dm。图9是确认治疗紧密接合蛋白损伤的效果——作为治疗糖尿病性视网膜病效果的一部分——的图,其中在2型糖尿病模型db/db小鼠中调控血液葡萄糖水平12周同时给予美福明后,将cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)与美福明共同给予12周;图9a通过染色确认紧蛋白-5的损伤;和图9b是利用蛋白质印迹(westernblot)确认闭合蛋白变化的图:nor:正常动物组(非糖尿病杂合子db/+小鼠);dm:糖尿病动物组(c57bl/ksj-leprdb/db糖尿病小鼠);met:给予美福明350mg/kg/天的小组;met+feno:给予美福明350mg/kg/天和非诺贝特100mg/kg/天的小组;met+cmo4-100:给予美福明和cmo4100mg/kg/天的小组;met+cmo4-250:给予美福明和cmo4250mg/kg/天的小组;met+cpa4-100:给予美福明和cpa4100mg/kg/天的小组;met+cpa4-250:给予美福明和cpa4250mg/kg/天的小组;*p<0.05vs.nor;和#p<0.05vs.dm。图10和11分析减轻糖尿病性肾病的效果的图,其中在2型糖尿病模型db/db小鼠中调控血液葡萄糖水平12周同时给予美福明后,将cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)与美福明共同给予12周:nor:正常动物组(非糖尿病杂合子db/+小鼠);dm:糖尿病动物组(c57bl/ksj-leprdb/db糖尿病小鼠);met:给予美福明350mg/kg/天的小组;met+feno:给予美福明350mg/kg/天和非诺贝特100mg/kg/天的小组;met+cmo4-100:给予美福明和cmo4100mg/kg/天的小组;met+cmo4-250:给予美福明和cmo4250mg/kg/天的小组;met+cpa4-100:给予美福明和cpa4100mg/kg/天的小组;met+cpa4-250:给予美福明和cpa4250mg/kg/天的小组;*p<0.05vs.nor;和#p<0.05vs.dm(ordb/db)。图12是确认在mnu诱导型啮齿动物模型中cmo4(肉桂枝和牡丹根皮(1:8)的提取物)、cmo4-1(肉桂枝和牡丹根皮(1:8)的热水提取物)、和cpa4-1(肉桂枝和芍药根(1:8)的热水提取物)对感光细胞损伤(黄斑变性)的预防效果的图。nor:c57bl/6正常小鼠;mnu:n-甲基-n-亚硝基脲(mnu)诱导型动物模型;cmo4-100:给予cmo4100mg/kg/天的mnu诱导型动物模型;cmo4-1-50:给予cmo4-150mg/kg/天的mnu诱导型动物模型;cmo4-1-100:给予cmo4-1100mg/kg/天的mnu诱导型动物模型;cpa4-1-50:给予cpa4-150mg/kg/天的mnu诱导型动物模型;cpa4-1-100:给予cpa4-1100mg/kg/天的mnu诱导型动物模型;*p<0.05vs.nor;和#p<0.05vs.mnu。图13是确认在naio3诱导型啮齿动物模型中cmo4-1(肉桂枝和牡丹根皮(1:8)的热水提取物)和cpa4-1(肉桂枝和芍药根(1:8)的热水提取物)对视网膜色素上皮细胞损伤(黄斑变性)的预防效果的图;正常:c57bl/6正常小鼠;naio3:naio3诱导型动物模型;cmo4-1-50:给予cmo4-150mg/kg/天的naio3诱导型动物模型;cmo4-1-100:给予cmo4-1100mg/kg/天的naio3诱导型动物模型;cpa4-1-50:给予cpa4-150mg/kg/天的naio3诱导型动物模型;cpa4-1-100:给予cpa4-1100mg/kg/天的naio3诱导型动物模型;*p<0.05vs.nor;和#p<0.05vs.naio3。图14是确认在vldlr-/-黄斑变性动物模型中cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)对视网膜下新血管形成的抑制效果的图:nor:c57bl/6正常小鼠;vldlr-/-:湿黄斑变性小鼠模型;cmo4-100:给予cmo4100mg/kg/天的vldlr-/-小鼠;cpa4-100:给予cpa4100mg/kg/天的vldlr-/-小鼠;*p<0.05vs.con;和#p<0.05vs.vldlr-/-。图15是确认在vldlr-/-黄斑变性动物模型中cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)对视网膜色素上皮细胞损伤的抑制效果的图:nor:c57bl/6正常小鼠;vldlr-/-:湿黄斑变性小鼠模型;cmo4-100:给予cmo4100mg/kg/天的vldlr-/-小鼠;和cpa4-100:给予cpa4100mg/kg/天的vldlr-/-小鼠。图16是确认cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)对vldlr-/-小鼠视网膜中vegf表达(深紫色染色;如箭头所示)的抑制效果的图:nor:c57bl/6正常小鼠;vldlr-/-:湿黄斑变性小鼠模型;cmo4-100:给予cmo4100mg/kg/天的vldlr-/-小鼠;和cpa4-100:给予cpa4100mg/kg/天的vldlr-/-小鼠。图17是确认cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)对vldlr-/-小鼠视网膜中新血管形成的抑制效果的图:vldlr-/-:湿黄斑变性小鼠模型;cmo4-50:给予cmo450mg/kg/天的vldlr-/-小鼠;cmo4-100:给予cmo4100mg/kg/天的vldlr-/-小鼠;cpa4-50:给予cpa450mg/kg/天的vldlr-/-小鼠;和cpa4-100:给予cpa4100mg/kg/天的vldlr-/-小鼠。图18是确认cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)对具有激光致脉络膜新血管形成的大鼠的视网膜下区域中新血管形成的抑制效果的图:cnv:激光处理的湿黄斑变性小鼠模型;cmo4:激光处理的具有湿黄斑变性的小鼠,其中给予小鼠cmo4100mg/kg/天;cpa4:激光处理的具有湿黄斑变性的小鼠,其中给予小鼠cpa4100mg/kg/天;和#p<0.05vs.cnv。图19是确认在福尔马林诱导静脉曲张动物模型中预防和治疗静脉曲张的效果的图。正常:正常动物组(sd大鼠);水肿:诱导静脉曲张的动物组;cmo4-1-50:诱导静脉曲张的小组,给予cmo4-150mg/kg/天;cmo4-1-100:诱导静脉曲张的小组,给予cmo4-1100mg/kg/天;cpa4-1-50:诱导静脉曲张的小组,给予cpa4-150mg/kg/天;和cpa4-1-100:诱导静脉曲张的小组,给予cpa4-1100mg/kg/天。具体实施方式下文将更详细地描述本发明。本发明提供预防和治疗糖尿病并发症和血管性水肿的药物组合物,其包含肉桂枝提取物作为活性成分。提取物通过另外混合选自牡丹根皮、芍药根和茯苓的任一种来提取。提取物抑制晚期糖化终产物过度产生,呈现分裂晚期糖化终产物与基质蛋白之间的交联的效果,和抑制人视网膜色素上皮细胞系中晚期糖化终产物产生。另外,糖尿病并发症优选是选自糖尿病性视网膜病、糖尿病性白内障、糖尿病性肾病、糖尿病性神经病、糖尿病性足溃疡、糖尿病性心脏病、糖尿病性骨质疏松、或糖尿病性动脉硬化的任一种,但不限于此。另外,血管性水肿优选是选自黄斑变性、黄斑水肿、视网膜变性和静脉曲张的任一种,但不限于此。肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓的混合提取物优选按照下列步骤制备,但不限于此:1)提取肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓的步骤——通过向其中每一种添加提取溶剂;2)过滤步骤1)的提取物的步骤;和3)在减压下浓缩步骤2)的过滤提取物的步骤;其中,在上述方法中,步骤1)所用的肉桂枝、牡丹根皮、芍药根和茯苓可被非限制地使用;并且可被培育或购买。可优选将混合提取物以肉桂枝和牡丹根皮2:1至1:10的重量比混合,然后用提取溶剂提取。更优选地,将其以1:1至1:8的重量比混合,然后用提取溶剂提取。可优选将混合提取物以肉桂枝和芍药根2:1至1:10的重量比混合,然后用提取溶剂提取。更优选地,将其以2:1至1:8的重量比混合,然后用提取溶剂提取。可优选将混合提取物以肉桂枝和茯苓2:1至1:2的重量比混合,然后用提取溶剂提取。更优选地,将其以1:1的重量比混合,然后用提取溶剂提取。可优选使用水、醇、或其混合物作为提取溶剂。作为醇,可优选使用c1至c2低级醇。另外,可优选使用30%乙醇、50%乙醇、70%乙醇、或甲醇作为低级醇。关于提取方法,可优选使用高温除压法(high-temperaturedecompressionmethod)、热水提取法、回流提取法、水热提取法(hydrothermalextractionmethod)、浸渍提取法、室温提取法、超声提取法、或蒸汽提取法,但提取方法不限于此。提取溶剂量优选通过添加肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓量的1至10倍来提取。提取温度优选为30℃至100℃,但不限于此。进一步,提取时间优选为2小时至48小时,但不限于此。此外,提取频率优选为2至5次,但不限于此。在上述方法中,步骤3)的减压浓度优选利用真空减压浓缩器或旋转真空蒸发器来实现,但不限于此。另外,浓缩物优选利用减压干燥法、真空干燥法、沸腾干燥法、喷雾干燥法、或冷冻干燥法来干燥,但不限于此。混合提取物可通过混合肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓来制备。另外,可提取肉桂枝、牡丹根皮、芍药根、或茯苓中的每一种,然后混合制备混合提取物。在本发明的具体实施方式中,发明人以不同比例混合肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓以制备混合提取物,并且分析其成分(参见图1a至1d)。另外,确认每种提取物的芍药苷含量(参见表1),并且通过其确认体外抑制晚期糖化终产物产生的效果。结果是,本发明的混合提取物与阳性对照组相比呈现针对晚期糖化终产物产生的显著抑制效果。具体地,考虑氨基胍(阳性对照组)是单一合成化合物,确认本发明的混合提取物针对晚期糖化终产物产生呈现显著优越的抑制效果(参见表2)。另外,在用甘氨醛处理本发明的混合提取物后,确认抑制晚期糖化终产物产生的效果。结果是,确认根据本发明的肉桂枝和牡丹根皮提取物(cmo4和cmo4-1)和肉桂枝和芍药根提取物(cpa4和cpa4-1)以浓度依赖性方式(1μg/ml、5μg/ml、10μg/ml、20μg/ml、和50μg/ml)显著抑制晚期糖化终产物产生(参见图2)。另外,确认分裂晚期糖化终产物与基质蛋白之间的交联的效果的结果是,本发明的混合提取物与alt-711(阳性对照组)相比呈现更优的交联分裂效果。具体地,考虑alt-711(阳性对照组)是单一合成化合物,确认本发明的混合提取物呈现显著优越的交联分裂效果(参见表3)。另外,确认本发明混合提取物在高血糖环境下在人视网膜色素上皮细胞系中针对晚期糖化终产物产生的抑制效果。结果是,确认根据本发明的肉桂枝和牡丹根皮提取物(cmo2、cmo4和cmo4-1)和肉桂枝和芍药根提取物(cpa1-1、cpa2-1、cpa4和cpa4-1)以浓度依赖性方式(10μg/ml、20μg/ml、和50μg/ml)在高血糖环境下在人视网膜色素上皮细胞系中抑制晚期糖化终产物产生(参见图3)。基于上述结果,确认肉桂枝和牡丹根皮提取物、肉桂枝和芍药根提取物、和肉桂枝和茯苓提取物抑制晚期糖化终产物产生,抑制包覆以甘氨醛的ecm中的晚期糖化终产物,分裂已生成的晚期糖化终产物与基质蛋白之间的交联,和在高血糖环境下在人视网膜色素上皮细胞系中显著抑制晚期糖化终产物产生。另外,确认本发明混合提取物针对血液-视网膜屏障损伤的抑制效果的结果是,确认根据本发明的cmo4-1-100和cmo4-1-250(给予热水肉桂枝和牡丹根皮(1:8)的提取物的小组)、和cpa4-1-100(给予肉桂枝和芍药根(1:8)的热水提取物的小组)显著预防荧光材料从视网膜血管流出(参见图4)。另外,确认针对无细胞毛细血管形成的抑制效果的结果是,确认根据本发明的cmo4-1-100和cmo4-1-250(给予肉桂枝和牡丹根皮(1:8)的热水提取物的小组)和cpa4-1-100(给予肉桂枝和芍药根(1:8)的热水提取物的小组)显著预防无细胞毛细血管形成(参见图5)。另外,确认针对闭合蛋白(细胞之间的紧密接合蛋白)损伤的抑制效果的结果是,确认cmo4-1-100和cmo4-1-250(给予肉桂枝和牡丹根皮(1:8)的热水提取物的小组)无闭合蛋白损失(参见图6)。另外,确认本发明混合提取物针对血液-视网膜屏障损伤的抑制效果的结果是,确认当cmo4-100和cmo4-250(给予肉桂枝和牡丹根皮(1:8)的提取物的小组)和cpa4-100和cpa4-250(给予肉桂枝和芍药根(1:8)的提取物的小组)分别与美福明一起共同给予时,其18周和24周时通过显著预防荧光材料从视网膜血管流出显示治疗效果(参见图7)。确认针对无细胞毛细血管形成的抑制效果的结果是,确认当cmo4-100和cmo4-250(给予肉桂枝和牡丹根皮(1:8)的提取物的小组)分别与美福明一起共同给予时,两者均显著抑制无细胞毛细血管形成(参见图8)。确认针对紧蛋白-5(细胞之间的紧密接合蛋白)损伤的抑制效果的结果是,确认当cmo4-100和cmo4-250(给予肉桂枝和牡丹根皮(1:8)的提取物的小组)和cpa4-100和cpa4-250(给予肉桂枝和芍药根(1:8)的提取物的小组)分别与美福明一起共同给予时,其无紧蛋白-5损失(参见图9a)。另外,确认当cmo4-250(给予肉桂枝和牡丹根皮(1:8)的提取物的小组)和cpa4-250(给予肉桂枝和芍药根(1:8)的提取物的小组)分别与美福明一起共同给予时,两小组均显示紧蛋白-5量显著增加(参见图9b)。另外,确认本发明混合提取物预防和治疗肾功能降低的效果的结果是,确认当cmo4-100和cmo4-250(给予肉桂枝和牡丹根皮(1:8)的提取物的小组)和cpa4-100和cpa4-250(给予肉桂枝和芍药根(1:8)的提取物的小组)与美福明一起共同给予时,其显著抑制白蛋白和肌酸酐清除率(参见图10)。确认肾小球硬化(糖尿病性肾病引起的形态变化)的结果是,确认当cmo4-100和cmo4-250(给予肉桂枝和牡丹根皮(1:8)的提取物的小组)和cpa4-100和cpa4-250(给予肉桂枝和芍药根(1:8)的提取物的小组)与美福明一起共同给予时,这些小组显著抑制肾小球硬化(参见图11)。另外,为确认本发明混合提取物针对黄斑变性的预防和治疗效果,利用视网膜组织中外核层的厚度确认感光细胞的损伤和变性。结果是,在给予cmo4、cmo4-1(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4-1(肉桂枝和芍药根(1:8)的提取物)的小组中,mnu导致的感光细胞损伤得到显著抑制(参见图12)。视网膜色素上皮细胞的损伤和变性通过视网膜组织中外核层的折叠数来确认。结果是,在给予cmo4-1(肉桂枝和牡丹根皮(1:8)的热水提取物)和cpa4-1(肉桂枝和芍药根(1:8)的热水提取物)的小组中,由naoi3引起和上色的上皮细胞损伤得到抑制,从而显著抑制外核层屈曲的现象(参见图13)。另外,通过测量视网膜血管中的水肿尺寸来确认本发明混合提取物针对视网膜下新血管形成的抑制效果。结果是,通过给予cmo4(肉桂枝和牡丹根皮(1:8)的提取物),视网膜下新血管形成得到显著抑制(参见图14)。确认视网膜色素上皮细胞形态结构的变性。结果是,通过给予cmo4(肉桂枝和牡丹根皮(1:8)的提取物),其变性得到显著抑制(参见图15)。另外,确认对视网膜中vegf表达的抑制效果。结果是,通过给予cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物),vegf表达得到显著抑制(参见图16)。另外,确认本发明混合提取物针对视网膜下新血管形成的抑制效果。结果是,通过给予100mg/kg的cmo4(肉桂枝和牡丹根皮(1:8)的提取物),新血管形成得到显著抑制(参见图17)。确认针对视网膜下区域中视网膜下新血管形成的抑制效果的结果是,通过给予100mg/kg的cmo4(肉桂枝和牡丹根皮(1:8)的提取物),新血管形成得到显著抑制。另外,通过给予100mg/kg的cpa4(肉桂枝和芍药根(1:8)的提取物),新血管形成倾向于被抑制(参见图18)。确认视网膜神经组织中感光细胞损伤导致的外核层厚度变化的结果是,2.7%的cmo4(肉桂枝和牡丹根皮(1:8)的提取物)——其具有最低芍药苷含量——显示显著优越的效果。此结果表明,肉桂枝和牡丹根皮提取物、或肉桂枝和芍药根提取物的效果不仅仅是由芍药苷引起,而其效果事实上是肉桂枝和牡丹根皮提取物中或肉桂枝和芍药根提取物中存在的多种成分的协同效果(参见表4和5)。另外,确认利用本发明的混合提取物引起下肢水肿之前和之后的水肿状况的结果是,通过cmo4-1(肉桂枝和牡丹根皮(1:8)的提取物),下肢水肿造成的水肿尺寸变化在很大程度上没有被抑制,而其通过cpa4-1(肉桂枝和芍药根(1:8)的提取物)以浓度依赖性方式得到显著抑制(参见图19)。因此,根据本发明的肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓的混合提取物已被确认抑制在慢性糖尿病条件下发生的晚期糖化终产物过度产生,呈现分裂晚期糖化终产物与基质蛋白之间的交联的效果,在抑制经历高血糖或衰老化环境的人视网膜色素上皮细胞系中晚期糖化终产物产生方面具有优越效果,并在延迟、预防和治疗糖尿病并发症、黄斑变性、视网膜震荡、和下肢水肿——在糖尿病并发症各种动物模型中、黄斑变性、和下肢水肿方面具有优越效果,因此肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓的混合提取物可有效用作预防和治疗糖尿病并发症和血管性水肿的药物组合物。包含本发明的混合提取物的组合物可除上述成分外还包含至少一种呈现相同或相似功能的活性成分中。本发明的组合物可另外包括药学上可接受的添加剂,如淀粉、凝胶化淀粉、微晶纤维素、乳糖(milksugar)、聚维酮、胶体二氧化硅、磷酸氢钙、乳糖(lactose)、甘露醇、麦芽、阿拉伯胶、预凝胶化淀粉、玉米淀粉、粉末纤维素、羟丙基纤维素、欧巴代(opadry)、乙醇酸钠淀粉、巴西棕榈蜡、合成硅酸铝、硬脂酸、硬脂酸镁、硬脂酸铝、硬脂酸钙、蔗糖、右旋糖、山梨醇、和滑石等。优选包含基于组合物0.1wt%至90wt%的本发明的药学上可接受的添加剂,但添加剂不限于此。也就是说,本发明的组合物在实施实际临床给予时可以各种口服和胃肠外制剂被给予。当组合物被配制时,其可通过利用常规稀释剂或赋形剂来制备,如填充剂、增充剂、粘合剂、润湿剂、崩解剂、表面活性剂等。用于口服给予的固体制剂包括片剂、丸剂、颗粒、胶囊等,并且这些固体制剂可通过混合至少一种赋形剂(例如,淀粉、碳酸钙、蔗糖、乳糖、或明胶)与本发明的混合提取物来制备。另外,除单纯赋形剂外,还可使用润滑剂,如硬脂酸镁、滑石等。用于口服给予的液体制剂包括悬浮液、内用液体、乳液、和糖浆等,并且还可包含各种赋形剂,如湿润剂、增甜剂、芳香剂,和防腐剂等,以及水和液体石蜡(单纯的稀释剂)。用于胃肠外给予的制剂可包括无菌水溶液、非水溶剂、悬浮液、乳液、冻干剂、和栓剂。丙二醇、聚乙二醇、植物油如橄榄油、和可注射酯如油酸乙酯等可用作非水溶剂和悬浮液。witepsol、碳醋(macrogol)、吐温61、可可脂、laurinum、和甘油明胶等可用作栓剂的基础化合物。本发明的组合物可口服或胃肠外给予——取决于目的方法。当施以胃肠外给予时,优选选自皮肤或腹膜内注射、直肠内注射、皮下注射、静脉注射、肌内注射、或胸内注射的注射。剂量取决于患者体重、年龄、性别、健康状况、饮食、给予时间、给予方法、排泄率、和疾病严重程度而异。本发明组合物的剂量取决于患者体重、年龄、性别、健康状况、饮食、给予时间、给予方法、排泄率、和疾病严重程度而异,并且日剂量基于本发明的混合提取物量为0.0001mg/kg至100mg/kg。优选地,日剂量为0.001mg/kg至10mg/kg,并且可被给予一天1至6次。本发明的组合物可单独或结合预防和治疗糖尿病并发症或血管性水肿的手术、放射治疗、激素治疗、化学治疗、和利用生物响应调节剂的方法应用。另外,本发明提供预防和减轻糖尿病并发症和血管性水肿的健康功能性食品,其包含肉桂枝提取物作为活性成分。提取物通过另外混合选自牡丹根皮、芍药根、和茯苓的任一种来提取。提取物抑制晚期糖化终产物过度产生,呈现分裂晚期糖化终产物与基质蛋白之间的交联的效果,并且抑制人视网膜色素上皮细胞系中的晚期糖化终产物产生。另外,糖尿病并发症优选是选自糖尿病性视网膜病、糖尿病性白内障、糖尿病性肾病、糖尿病性神经病、糖尿病性足溃疡、糖尿病性心脏病、糖尿病性骨质疏松、或糖尿病性动脉硬化的任一种,但不限于此。另外,血管性水肿优选是选自黄斑变性、黄斑水肿、视网膜变性、和静脉曲张的任一种,但不限于此。肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓的混合提取物优选按照下列步骤制备,但不限于此:1)提取肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓的步骤——通过向其中每一种添加提取溶剂;2)过滤步骤1)的提取物的步骤;和3)在减压下浓缩步骤2)的过滤提取物的步骤;其中,在上述方法中,步骤1)所用的肉桂枝、牡丹根皮、芍药根、和茯苓可被非限制地使用;并且被培育或购买。可优选将混合提取物以肉桂枝和牡丹根皮2:1至1:10的重量比混合,然后用提取溶剂提取。更优选地,将其以1:1至1:8的重量比混合,然后用提取溶剂提取。可优选将混合提取物以肉桂枝和芍药根2:1至1:10的重量比混合,然后用提取溶剂提取。更优选地,将其以2:1至1:8的重量比混合,然后用提取溶剂提取。可优选将混合提取物以肉桂枝和茯苓2:1至1:2的重量比混合,然后用提取溶剂提取。更优选地,将其以1:1的重量比混合,然后用提取溶剂提取。可优选使用水、醇、或其混合物作为提取溶剂。作为醇,可优选使用c1至c2低级醇。另外,可优选使用30%乙醇、50%乙醇、70%乙醇、或甲醇作为低级醇。关于提取方法,可优选使用高温除压法、热水提取法、回流提取法、水热提取法、浸渍提取法、室温提取法、超声提取法、或蒸汽提取法,但提取方法不限于此。提取溶剂量优选通过添加肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓量的1至10倍来提取。提取温度优选为30℃至100℃,但不限于此。进一步,提取时间优选为2小时至48小时,但不限于此。此外,提取频率优选为2至5次,但不限于此。在上述方法中,步骤3)的减压浓度优选利用真空减压浓缩器或旋转真空蒸发器来实现,但不限于此。另外,浓缩物优选利用减压干燥法、真空干燥法、沸腾干燥法、喷雾干燥法、或冷冻干燥法来干燥,但不限于此。混合提取物可通过混合肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓来制备。另外,可提取肉桂枝、牡丹根皮、芍药根、或茯苓中的每一种,然后混合制备混合提取物。根据本发明的肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓的混合提取物已被确认抑制在慢性糖尿病条件下发生的晚期糖化终产物过度产生,呈现分裂晚期糖化终产物与基质蛋白之间的交联的效果,在抑制经历高血糖或衰老化环境的人视网膜色素上皮细胞系中晚期糖化终产物产生方面具有优越效果,并在延迟、预防和治疗糖尿病并发症、黄斑变性、视网膜震荡、和下肢水肿——在糖尿病并发症各种动物模型中、黄斑变性、和下肢水肿方面具有优越效果,因此肉桂枝和牡丹根皮、肉桂枝和芍药根、或肉桂枝和茯苓的混合提取物可用作预防和减轻糖尿病并发症和血管性水肿的健康功能性食品。健康功能性食品可以片剂、胶囊、粉末、颗粒、液体、丸剂等形式制备和加工,但不限于此。另外,其可以依据法律的任何形式制备和加工。本发明的混合提取物可单独或结合不同食品或食品成分被添加至食品。另外,其可适当地按照常规方法使用。活性成分混合量可根据应用活性成分的目的(预防或改善)来适当地确定。总体上,健康功能性食品中添加的混合提取物量可以是食品总重量的按重量计0.1至90份。然而,在为了健康和卫生或健康控制而长期摄入的情况下,该数量可低于上述范围。可选地,由于在安全性方面无问题,可使用数量高于上述范围的活性成分。用于本发明的健康功能性饮品的组合物可包含预定比例的上述混合提取物作为必需成分,和各种调味剂或天然碳水化合物作为附加成分——无具体限制,如常规饮品。上述天然碳水化合物的实例包括常规的糖,如单糖,例如,葡萄糖、果糖等;二糖,例如,麦芽糖、蔗糖等;和多糖,例如,糊精、环糊精等;和糖醇,如木糖醇、山梨醇、赤藓糖醇等。除上述成分外,天然调味剂(索马汀、甜菊(stevia)提取物(例如,莱鲍迪苷a、甘草皂苷等)和合成调味剂(例如,糖精、阿司帕坦等)也可有利地用作调味剂。除上述成分外,本发明的混合提取物还可进一步包含各种营养补充剂、维生素、矿物质(电解质)、调味剂如合成调味剂和天然调味剂、着色剂和增强剂(例如,芝士、巧克力等)、果胶酸及其盐、海藻酸及其盐、有机酸、保护性胶体增稠剂、ph调节剂、稳定剂、防腐剂、甘油、醇、和软饮料中使用的碳酸化剂。另外,本发明的提取物可包含用于制备天然果汁、果汁、和蔬菜饮料的浆料。这种成分可独立或结合其它成分使用。这些添加剂的比例不那么重要,但总体上在每100重量份的本发明混合提取物0.1至约20重量份的范围内选择。下文将伴随示例性实施方式和实验实施方式具体描述本发明。然而,本文描述的示例性和实验实施方式仅以示例为目的,不应被解释为限制本发明的范围。实施例1:肉桂枝和牡丹根皮混合提取物的制备肉桂枝和牡丹根皮购自baekjedang(韩国大田的草药商店),并如下进行实施例。另外,购买的肉桂枝和牡丹根皮存放在韩国韩医学研究院(koreainstituteoforientalmedicine)的糖尿病并发症研究组的冷室中。1-1制备cmo1——肉桂枝和牡丹根皮(1:1)的提取物将肉桂枝(12g)和牡丹根皮(12g)以1:1的比例混合,然后将其总共24g添加至50%乙醇(144ml)。其后,将所得物在约50℃下在回流下反复两次提取约3小时,从而制备cmo1——肉桂枝和牡丹根皮的提取物。1-2制备cmo1-1——肉桂枝和牡丹根皮(1:1)的热水提取物肉桂枝(90g)和牡丹根皮(90g)以1:1的比例混合,然后将其总共180g添加至纯净水(1080ml)。其后,将所得物在草药煎煮机中在热水下提取约2小时,从而制备cmo1-1——肉桂枝和牡丹根皮的热水提取物。1-3制备cmo2——肉桂枝和牡丹根皮(1:2)的提取物以与上述实施例1-1相同的方式,将肉桂枝(10g)和牡丹根皮(20g)以1:2的比例混合,然后将其总共30g添加至50%乙醇(180ml)。其后,将所得物在约50℃下在回流下反复两次提取约3小时,从而制备cmo2——肉桂枝和牡丹根皮的提取物。1-4制备cmo2-1——肉桂枝和牡丹根皮(1:2)的热水提取物以与上述实施例1-2相同的方式,将肉桂枝(60g)和牡丹根皮(120g)以1:1的比例混合,然后将其总共180g添加至纯净水(1080ml)。其后,将所得物在草药煎煮机中在热水下提取约2小时,从而制备cmo2-1——肉桂枝和牡丹根皮的热水提取物。1-5制备cmo3——肉桂枝和牡丹根皮的提取物(1:4)以与上述实施例1-1相同的方式,肉桂枝(6g)和牡丹根皮(24g)以1:4的比例混合,然后将其总共30g添加至50%乙醇(180ml)。其后,将所得物在约50℃下在回流下反复提取约3小时,从而制备cmo3——肉桂枝和牡丹根皮的提取物。1-6制备cmo3-1——肉桂枝和牡丹根皮的热水提取物(1:4)以与实施例1-2相同的方式,将肉桂枝(36g)和牡丹根皮(144g)以1:4的比例混合,然后将其总共180g添加至纯净水(1080ml)。其后,将所得物在草药煎煮机中在热水下提取约2小时,从而制备cmo3-1——肉桂枝和牡丹根皮的热水提取物。1-7制备cmo4——肉桂枝和牡丹根皮(1:8)的提取物以与实施例1-1相同的方式,将肉桂枝(3.5g)和牡丹根皮(28g)以1:8的比例混合,然后将其总共31.5g添加至50%乙醇(190ml)。其后,将所得物在约50℃下在回流下反复提取约3小时,从而制备cmo4——肉桂枝和牡丹根皮的提取物。1-8制备cmo4-1——肉桂枝和牡丹根皮(1:8)的热水提取物以与实施例1-2相同的方式,将肉桂枝(20g)和牡丹根皮(160g)以1:8的比例混合,然后将其总共180g添加至纯净水(1080ml)。其后,将所得物在草药煎煮机中在热水下提取约2小时,从而制备cmo4-1——肉桂枝和牡丹根皮的热水提取物。实施例2:制备肉桂枝和芍药根的混合提取物肉桂枝和芍药根购自baekjedang(韩国大田的草药商店),并如下进行实施例。另外,购买的肉桂枝和芍药根存放在韩国韩医学研究院的糖尿病并发症研究组的冷室中。2-1制备cpa1——肉桂枝和芍药根(2:1)的提取物以与实施例1-1相同的方式,将肉桂枝(16g)和芍药根(8g)以2:1的比例混合,然后将其总共24g添加至50%乙醇(144ml)。其后,将所得物在约50℃下在回流下反复两次提取约3小时,从而制备cpa1——肉桂枝和芍药根的提取物。2-2制备cpa1-1——肉桂枝和芍药根(2:1)的热水提取物以与实施例1-2相同的方式,将肉桂枝(120g)和牡丹根皮(60g)以2:1的比例混合,然后将其总共180g添加至纯净水(1080ml)。其后,将所得物在草药煎煮机中在热水下提取约2小时,从而制备cpa1-1——肉桂枝和芍药根的热水提取物。2-3制备cpa2——肉桂枝和芍药根(1:2)的提取物以与实施例1-1相同的方式,将肉桂枝(10g)和芍药根(20g)以1:2的比例混合,然后将其总共30g添加至50%乙醇(180ml)。其后,将所得物在约50℃下在回流下反复两次提取约3小时,从而制备cpa2——肉桂枝和芍药根的提取物。2-4制备cpa2-1——肉桂枝和芍药根(1:2)的热水提取物以与实施例1-2相同的方式,将肉桂枝(60g)和芍药根(120g)以1:2的比例混合,然后将其总共180g添加至纯净水(1080ml)。其后,将所得物在草药煎煮机中在热水下提取约2小时,从而制备cpa2-1——肉桂枝和芍药根的热水提取物。2-5制备cpa3——肉桂枝和芍药根(1:4)的提取物以与实施例1-1相同的方式,将肉桂枝(6g)和芍药根(24g)以1:4的比例混合,然后将其总共30g添加至50%乙醇(180ml)。其后,将所得物在约50℃下在回流下反复两次提取约3小时,从而制备cpa3——肉桂枝和芍药根的提取物。2-6制备cpa3-1——肉桂枝和芍药根(1:4)的热水提取物以与实施例1-2相同的方式,将肉桂枝(36g)和芍药根(144g)以1:4的比例混合,然后将其总共180g添加至纯净水(1080ml)。其后,将所得物在草药煎煮机中在热水下提取约2小时,从而制备cpa3-1——肉桂枝和芍药根的热水提取物。2-7制备cpa4——肉桂枝和芍药根(1:8)的提取物以与实施例1-1相同的方式,将肉桂枝(3.5g)和芍药根(28g)以1:8的比例混合,然后将其总共31.5g添加至50%乙醇(190ml)。其后,将所得物在约50℃下在回流下反复两次提取约3小时,从而制备cpa4——肉桂枝和芍药根的提取物。2-8制备cpa4-1——肉桂枝和芍药根(1:8)的热水提取物以与实施例1-2相同的方式,将肉桂枝(20g)和芍药根(160g)以1:8的比例混合,然后将其总共180g添加至纯净水(1080ml)。其后,将所得物在草药煎煮机中在热水下提取约2小时,从而制备cpa4-1——肉桂枝和芍药根的热水提取物。实施例3:制备肉桂枝和茯苓的混合提取物肉桂枝和茯苓购自baekjedang(韩国大田的草药商店),并如下进行实施例。另外,将购买的肉桂枝和茯苓存放在韩国韩医学研究院的糖尿病并发症研究组的冷室中。3-1制备cpo——肉桂枝和茯苓(1:1)的提取物以与实施例1-1相同的方式,将肉桂枝(12g)和茯苓(12g)以1:1的比例混合,然后将其总共24g添加至50%乙醇(144ml)。其后,将所得物在约50℃下在回流下反复两次提取约3小时,从而制备cpo——肉桂枝和茯苓的提取物。实施例4:制备kbt——肉桂枝、茯苓、牡丹根皮、赤芍和桃仁的混合提取物将相同量的肉桂枝、茯苓、牡丹根皮、赤芍和桃仁中的每一种混合,并向其添加10体积的蒸馏水。其后,将所得物利用超高速真空低温提取机煎煮约2小时,在高温、减压下提取,并干燥,从而制备kbt,即用作对照组的提取物。实施例5:制备kjt——肉桂枝、芍药根、甘草、姜和枣的混合提取物将肉桂枝、芍药根、甘草、姜和枣以3:2:1:1:1的比例混合,并向其添加10体积的蒸馏水。其后,将所得物利用超高速真空低温提取机煎煮约2小时,在高温、减压下提取,并干燥,从而制备kjt,即用作对照组的提取物。实施例6:分析肉桂枝和牡丹根皮提取物以及肉桂枝和芍药根提取物中的成分为确认cmo4(肉桂枝和牡丹根皮的提取物)、cmo4-1(肉桂枝和牡丹根皮的热水提取物)、cpa4(肉桂枝和芍药根的提取物)、和cpa4-1(肉桂枝和芍药根的热水提取物)的成分,进行hplc分析。结果是,如图1所示,确认cmo4(肉桂枝和牡丹根皮的提取物)和cmo4-1(肉桂枝和牡丹根皮的热水提取物)的指标成分(indexingredient)是没食子酸、氧化芍药苷、白芍苷、芍药苷、苯甲酸、肉桂酸、肉桂醛、和芍药醇(图1a至1b)。另外,还确认cpa4(肉桂枝和芍药根的提取物)和cpa4-1(肉桂枝和芍药根的热水提取物)的指标成分是没食子酸、氧化芍药苷、白芍苷、芍药苷、苯甲酸、肉桂酸、和肉桂醛(图1c至1d)。另外,如下表1所示,确认各提取物中的芍药苷含量(表1)。[表1]芍药苷(pf)的含量(%)cmo4(肉桂枝和牡丹根皮的提取物)2.7cmo4-1(肉桂枝和牡丹根皮的热水提取物)2.3cpa4(肉桂枝和芍药根的提取物)12.3cpa4-1(肉桂枝和芍药根的热水提取物)8.9实验实施例1:生成晚期糖化终产物(ages)的抑制发明人分析了实施例1至5制备的包含肉桂枝的混合提取物对体外生成的晚期糖化终产物的抑制效果。具体地,将溶于50mm磷酸盐缓冲液(ph7.4)的10mg/ml牛血清白蛋白(bsa,sigma,usa)用作蛋白质源,并将混合0.2m果糖和0.2m葡萄糖的溶液用作糖源。将实施例的提取物和氨基胍(阳性对照组)溶于0.2%二甲基亚砜(dmso),然后再溶于15%吐温80。将由此制备的蛋白质源、糖源和提取物混合,制备共1ml,在37℃下培养7天,并允许发生糖化。在此,添加0.02%叠氮化钠(抗细菌剂)以防止细菌产生。培育后,利用分光荧光检测器(bio-tek,usa)测量吸收波长350nm和发射波长450nm下的荧光。将其如下列方程式1所示计算,并且结果显示在下表2中。[方程式1]结果是,如下表2所示,确认cmo1、cmo2、cmo3和cmo4(肉桂枝和牡丹根皮的提取物)呈现针对晚期糖化终产物产生的抑制效果。即,cmo1、cmo2、cmo3和cmo4针对晚期糖化终产物产生的抑制效果分别是氨基胍(阳性对照组)的17倍、21.3倍、21.3倍和22.7倍。进一步,cpa1、cpa2、cpa3和cpa4(肉桂枝和芍药根的提取物)分别呈现针对晚期糖化终产物产生的抑制效果是氨基胍(阳性对照组)的8倍,10.9倍,10.1倍,和12.1倍。此外,cpo(肉桂枝和茯苓的提取物)呈现针对晚期糖化终产物产生的抑制效果是氨基胍(阳性对照组)的4倍(表2)。另外,确认cmo1、cmo2、cmo3和cmo4(肉桂枝和牡丹根皮的提取物)以及cpa1、cpa2、cpa3和cpa4(肉桂枝和茯苓的提取物)分别呈现针对晚期糖化终产物产生的抑制效果是kbt(实施例4的提取物)的抑制效果的4.8倍、5.9倍、5.9倍、6.3倍、2.3倍、3.0倍、2.8倍、3.4倍、和1.1倍。进一步,还确认cmo1、cmo2、cmo3和cmo4(肉桂枝和牡丹根皮的提取物)、以及cpa1、cpa2、cpa3和cpa4(肉桂枝和芍药根的提取物)、以及cpo(肉桂枝和茯苓的提取物)分别呈现针对晚期糖化终产物产生的抑制效果是kjt(实施例5的提取物)的抑制效果的8.5倍、10.4倍、10.4倍、10.4倍、11.1倍、4.1倍、5.4倍、8.6倍、和2.0倍(表2)。因此,考虑氨基胍(阳性对照组)是单一合成化合物,确认根据本发明的肉桂枝和牡丹根皮的提取物、肉桂枝和芍药根的提取物、或肉桂枝和茯苓的混合提取物呈现显著更优的针对晚期糖化终产物产生的抑制效果。同时,还确认,与kbt(实施例4的提取物)或kjt(实施例5的提取物)相比,肉桂枝和牡丹根皮的提取物、肉桂枝和芍药根的提取物、或肉桂枝和茯苓的混合提取物显著更优。[表2]实验实施例2:经甘氨醛处理的胞外基质(ecm)中针对晚期糖化终产物产生的抑制效果在用甘氨醛处理实施例1和2制备的混合提取物后,确认针对晚期糖化终产物产生的抑制效果。将胞外基质(ecm)(sigma-aldrich,cat.no.c-3867)设置为10μg/cm2,分配至96黑孔板中,和然后在4℃下包覆过夜。第二天,将包覆板中的ecm移除,在室温下充分干燥,然后与100mm甘氨醛(sigma-aldrich)和不同浓度(1μg/ml、5μg/ml、10μg/ml、20μg/ml、和50μg/ml)的已稀释的提取物混合,以使其总体积为100μl。其后,使所得物在37℃下反应4小时,并确认其是否抑制晚期糖化终产物(ages)产生。关于阳性对照组,仅将100mm甘氨醛(sigma-aldrich)添加至包覆板,以确认晚期糖化终产物产生。在用pbs洗涤所得物和阳性组两次后,添加50mm硼氢化钠(sigma-aldrich),然后使剩余醛基中和5分钟。在中和后,将其用pbs洗涤两次,然后向其再次添加pbs(100μl)以利用荧光光谱法(ex.370nm/em440nm)进行确认。关于统计学分析,利用prism5.0程序(graphpad)使显著值为p<0.05。结果是,如图2所示,确认根据本发明的cmo4和cmo4-1(肉桂枝和牡丹根皮的提取物)以及cpa4和cpa4-1(肉桂枝和芍药根的提取物)以浓度依赖性方式(1μg/ml、5μg/ml、10μg/ml、20μg/ml、和50μg/ml)显著抑制晚期糖化终产物产生(图2)。实验实施例3:分裂晚期糖化终产物交联的效果确认实施例1至3制备的混合提取物的效果——分裂晚期糖化终产物与基质蛋白之间的交联。alt-711(alteoninc.,ramsey,nj)用于阳性对照组。具体地,将1.0μg的age-bsa(transgenicinc.kobe,日本)分配到胶原蛋白包覆的96孔微量滴定板(greinerbio-one,德国)中,并在37℃下培养4小时,然后允许age-bsa和胶原蛋白交联。用pbst(0.05%)洗涤所得物3次以去除未连接的age-bsa,然后添加混合提取物和alt-711,和在37℃下培养4小时。其后,用pbst(0.05%)洗涤所得物,并且为了检测因交联至胶原蛋白而留下的age-bsa,将小鼠单克隆抗age-bsa抗体(6d12,transgenicinc.kobe,日本)以1:250稀释并分配,然后在37℃下培育1小时。1小时后,和所得物用pbst(0.05%)洗涤,并与连接hrp的山羊抗小鼠igg抗体(santacruz,usa)反应以生成tmb(3.3',5,5'-四甲基联苯胺)作为底物。其后,测量450nm下的吸光度。如下列方程式2所示计算age-bsa的交联分裂效果(%)。[方程式2]结果是,如下表3所示,确认cmo1、cmo1-1、cmo2、cmo2-1、cmo3、cmo3-1、cmo4和cmo4-1(肉桂枝和牡丹根皮的提取物)分别呈现晚期糖化终产物的交联分裂效果是alt-711(阳性对照组)的1183倍、12362倍、16726倍、4352倍、13225倍、3419倍、11685倍、和3281倍。进一步,还确认cpa1、cpa1-1、cpa2、cpa2-1、cpa3、cpa3-1、cpa4和cpa4-1(肉桂枝和芍药根的提取物)分别呈现晚期糖化终产物的交联分裂效果是alt-711(阳性对照组)的2221倍、13124倍、1965倍、12362倍、2093倍、11373倍、1977倍、和7515倍。此外,cpo(肉桂枝和茯苓的提取物)呈现晚期糖化终产物的交联分裂效果是alt-711(阳性对照组)的3495倍(表3)。因此,确认与alt-711(阳性对照组)相比,肉桂枝和牡丹根皮的提取物、肉桂枝和芍药根的提取物、或肉桂枝和茯苓的提取物具有较优的交联分裂效果。具体地,考虑alt-711(阳性对照组)是单一合成化合物,确认本发明的混合提取物具有显著较优的效果。[表3]实验实施例4:在高血糖环境下在人视网膜色素上皮细胞系中针对晚期糖化终产物产生的抑制效果确认来自实施例1和2制备的cmo2、cmo4和cmo4-1(肉桂枝和牡丹根皮的提取物)、以及cpa1-1、cpa2-1、cpa4和cpa4-1(肉桂枝和芍药根的提取物)在高血糖环境下在人视网膜色素上皮细胞系中针对晚期糖化终产物产生的抑制效果。具体地,将人色素上皮细胞系(arpe-19:atccno.crl-2302)在5%co2培育器中利用dulbecco改性eagles培养基(dmem,gibco,usa)在高血糖环境下培养。在包含最终浓度的bsa(500μg/ml)的高血糖条件(25mm)下培养人色素上皮细胞系后,以各个浓度(10μg/ml、20μg/ml、和50μg/ml)处理cmo2、cmo4和cmo4-1(肉桂枝和牡丹根皮的提取物)以及cpa1-1、cpa2-1、cpa4和cpa4-1(肉桂枝和芍药根的提取物)。另外,还处理氨基胍(ag,10mm)用于阳性对照组。在用1×pbs洗涤后,将样本用laemmli样本缓冲液(cat.no.161-0737,bio-radlaboratories,ca,usa)处理,在100℃下沸腾5分钟,然后在利用bca(piercebiotechnology,il,usa)定量样本的蛋白质后使用。使蛋白质在120v下在包含sds(page)的10%聚丙烯酰胺凝胶上电泳2小时,然后通过转移缓冲液(0.25mtris,1.92m甘氨酸,ph8.3至8.4)使蛋白质在250ma下转移至pvdf膜(bio-radlaboratories,ca,usa)1.5小时。在利用tbs-t(200mmtris,1.37mnacl,0.05%吐温20)溶液中5%无脂乳封闭后,使age抗体(抗ages单克隆ab,克隆编号6d12)在4℃下反应。洗涤后,使hrp缀合的二级抗体反应,再次洗涤,并通过增强化学发光(ecl)反应以利用las-3000(fujifilm,jpn)分析。其后,利用graphpadprism5(sandiego)对结果进行统计学分析。结果是,如图3所示,确认cmo2、cmo4和cmo4-1(肉桂枝和牡丹根皮的提取物)以及cpa1-1、cpa2-1、cpa4和cpa4-1(肉桂枝和芍药根的提取物)同样呈现以浓度依赖性方式(10μg/ml、20μg/ml、和50μg/ml)在高血糖环境下在人视网膜色素上皮细胞系中抑制晚期糖化终产物产生(图3)。基于上述结果,确认肉桂枝和牡丹根皮的提取物、肉桂枝和芍药根的提取物、和肉桂枝和茯苓的提取物抑制晚期糖化终产物产生,抑制甘氨醛包覆的ecm中的晚期糖化终产物产生,分裂已产生的晚期糖化终产物与基质蛋白之间的交联,并且在高血糖环境下在人视网膜色素上皮细胞系中显著抑制晚期糖化终产物产生。实验实施例5:在动物模型中的糖尿病并发症预防效果为确认在2型糖尿病模型db/db小鼠中cmo4-1(肉桂枝和牡丹根皮(1:8)的热水提取物)和cpa4-1(肉桂枝和芍药根(1:8)的热水提取物)针对糖尿病并发症的预防效果,将cmo4-1(肉桂枝和牡丹根皮(1:8)的热水提取物)和cpa4-1(肉桂枝和芍药根(1:8)的热水提取物)给予db/db小鼠12周。非诺贝特(澳大利亚批准用于治疗糖尿病性视网膜病的药物)用作阳性对照组。5-1实验动物育种和实验设计将7周龄雄性db/db小鼠(因瘦蛋白受体突变而产生糖尿病的2型糖尿病动物模型)分成如下7组——每组配置10只小鼠:(1)正常动物组(非糖尿病杂合子db/+小鼠,nor);(2)糖尿病动物组(c57bl/ksj-leprdb/db糖尿病小鼠,dm);(3)feno(给予非诺贝特100mg/kg/天的小组);(4)cmo4-1-100(给予cmo4-1100mg/kg/天的小组);(5)cmo4-1-250(给予cmo4-1250mg/kg/天的小组);(6)cpa4-1-100(给予cpa4-1100mg/kg/天的小组);和(7)cpa4-1-250(给予cpa4-1250mg/kg/天的小组)。所有药物悬浮于0.5%甲基纤维素中,并且一天一次被口服给予12周。在实验组(1)和(2)中,等量的单纯0.5%甲基纤维素溶液(媒介溶液)被口服给予。测量药物给予期期间的体重以及饲料和水摄入。5-2针对血液-视网膜屏障损伤的抑制效果如果高血糖持续,血液-视网膜屏障将因眼球视网膜血管功能失调而受损。关于这点,在给予cmo4-1(肉桂枝和牡丹根皮(1:8)的热水提取物)和cpa4-1(肉桂枝和芍药根(1:8)的热水提取物)后,确认抑制血液-视网膜屏障损伤的效果。具体地,通过腹膜内注射戊巴比妥钠(25mg/kg),将如实验实施例5-1设计的实验组中的小鼠麻醉,并打开腹膜腔和胸腔以获得(secure)心脏。另外,将通过溶解在无菌pbs(1ml)中而制备的50mg/ml荧光素-葡聚糖(2×106分子量)注入左心室。10分钟后,摘除眼球,并将左眼球置于眼杯中。将分离的视网膜置于玻片上,然后利用水性封固介质封固。在其充分干燥后,利用荧光显微镜对其进行观察。结果是,如图4所示,确认虽然在正常组(nor)中未观察到荧光流出,但在糖尿病组(dm)中因血液-视网膜屏障损伤而释放的荧光物质显著增加。另外,还确认在非诺贝特给予组(feno)(阳性对照组)中没有阻止荧光物质流出。然而,根据本发明的cmo4-1-100和cmo4-1-250(给予肉桂枝和牡丹根皮(1:8)的热水提取物的小组)以及cpa4-1-100(给予肉桂枝和芍药根(1:8)的热水提取物的小组)显著阻止荧光物质从视网膜血管流出(图4)。5-3针对无细胞毛细血管形成的抑制效果糖尿病性视网膜病初始症状其中之一是无细胞毛细血管形成,其杀死周细胞的核,导致视网膜病。关于这点,在给予实施例1和2制备的cmo4-1(肉桂枝和牡丹根皮(1:8)的热水提取物)和cpa4-1(肉桂枝和芍药根(1:8)的热水提取物)后确认针对无细胞毛细血管形成的抑制效果。具体地,以与实验实施例5-2相同的方式从小鼠摘除眼球,并且将视网膜从眼球摘除并用流水洗涤。其后,将其置于3%胰蛋白酶中并在37℃下培养1小时。将酶解的视网膜转移至pbs,并去除内部膜(细胞中存在的细胞器的膜)。利用玻璃棒将血管框架从视网膜背景分离,置于玻片上,并干燥。然后将干燥的血管框架用pas和苏木精染色,并确认细胞壁和核的变化。结果是,如图5所示,确认虽然在正常组(nor)中未观察到无细胞毛细血管形成,但在糖尿病组(dm)中无细胞毛细血管数量显著增加。另外,还确认在非诺贝特给予组(feno)中未阻止无细胞毛细血管形成。然而,根据本发明的cmo4-1-100和cmo4-1-250(肉桂枝和牡丹根皮(1:8)的热水提取物)和cpa4-1-100(肉桂枝和芍药根(1:8)的热水提取物)显著防止无细胞毛细血管形成(图5)。5-4针对细胞间紧密接合蛋白损伤的抑制效果在给予实施例1和2制备的cmo4-1(肉桂枝和牡丹根皮(1:8)的热水提取物)和cpa4-1(肉桂枝和芍药根(1:8)的热水提取物)后,确认针对闭合蛋白(细胞之间的紧密接合蛋白)损伤的抑制效果。具体地,将小鼠的眼球以与实验实施例5-2相同的方式摘除,并在10%中和福尔马林中固定过夜。另外,将所得物脱水并用二甲苯更替三次,从而使其嵌有石蜡。将嵌入组织块制成4μm厚度的连续切片,并置于玻片上备用。为去除内源过氧化物酶活性,使经历了脱石蜡和功能过程的玻片与3%过氧化氢溶液反应10分钟,然后用包含0.05%吐温20的pbs洗涤三次。为去除非特异性反应,利用5%酪蛋白进行封闭,然后分别将初级抗体以1:200的比例稀释。其后,将稀释初级抗体处理1小时或过夜。在用pbs洗涤1小时后,将带标记链霉亲和素生物素(labeledstreptoavidinbiotin,lsab)试剂盒(dako,usa)施用于所得物,用dab显色,然后利用光学显微镜观察。在荧光染色情况下,分别将fitc缀合的二级抗体以1:200的比例稀释,并反应1小时。其后,将所得物用dapi染色,并利用荧光显微镜观察。结果是,如图6所示,虽然确认了在糖尿病组(dm)中拍摄到连接线,如闭合蛋白线,但在非诺贝特给予组(feno)和给予肉桂枝和牡丹根皮(1:8)的热水提取物(cmo4-1-100和cmo4-1-250)的小组中无闭合蛋白损伤(图6)。实验实施例6:在动物模型中的糖尿病并发症治疗效果为确认共同给予cmo4(肉桂枝和牡丹根皮(1:8)的提取物)、cpa4(肉桂枝和芍药根(1:8)的提取物)和美福明的治疗效果,将美福明给予至2型糖尿病模型db/db小鼠12周,以调控血液葡萄糖水平。其后,将cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)与美福明一起再共同给予12周,以确认cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)对糖尿病性视网膜病和肾病的治疗效果。非诺贝特(澳大利亚批准用于治疗糖尿病性视网膜病的药物)用作阳性对照组。6-1实验动物育种和实验设计将7周龄雄性db/db小鼠(因瘦蛋白受体突变而产生糖尿病的2型糖尿病动物模型)分成如下8组——每组配置10只小鼠:(1)正常动物组(非糖尿病杂合子db/+小鼠,nor);(2)糖尿病动物组(c57bl/ksj-leprdb/db糖尿病小鼠,dm);(3)met(给予美福明350mg/kg/天的小组);(4)met+feno(给予美福明和非诺贝特100mg/kg/天的小组);(5)met+cmo4-100(给予美福明和cmo4100mg/kg/天的小组);(6)met+cmo4-250(给予美福明和cmo4250mg/kg/天的小组);(7)met+cpa4-100(给予美福明和cpa4100mg/kg/天的小组);和(8)met+cpa4-250(给予美福明和cpa4250mg/kg/天的小组)。在(3)至(8)组中,为使血液葡萄糖水平降低至某一水平,将美福明(350mg/kg)给予12周。将美福明和提取物悬浮于0.5%甲基纤维素中,并一天一次口服给予12周。在实验(1)和(2)组中将等量的单纯0.5%甲基纤维素溶液(媒介溶液)口服给予。在给予美福明12周后,各组相应的确定量提取物每日添加至美福明以共同给予。测量药物给予期期间的体重以及饲料和水摄入,并以四周间隔测量血液葡萄糖水平。6-2针对血液-视网膜屏障损伤的抑制效果如果高血糖持续,血液-视网膜屏障将因眼球视网膜血管功能失调而受损。关于这点,在给予cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)后,确认抑制血液-视网膜屏障损伤的效果。具体地,通过腹膜内注射戊巴比妥钠(25mg/kg),将如实验实施例6-1设计的实验组中的小鼠麻醉,并打开腹膜腔和胸腔以获得心脏。另外,将通过溶解在无菌pbs(1ml)中而制备的50mg/ml荧光素-葡聚糖(2×106分子量)注入左心室。10分钟后,摘除眼球,并将左眼球置于眼杯中。将分离的视网膜置于玻片上,然后利用水性封固介质封固。在其充分干燥后,利用荧光显微镜对其进行观察。分别在引起糖尿病的12周、18周和24周时确认结果。结果是,如图7所示,确认虽然在正常组(nor)中直到24周才观察到荧光流出,但糖尿病组(dm)呈现荧光物质因血液-视网膜屏障损伤而从血管漏出的现象,并且大部分对象在12周、18周和24周时确认了该现象。另外,在met(美福明给予组,为阳性对照组)中,与糖尿病组(dm)相比,荧光物质流出在18周时显著减少,但荧光物质流出在24周时未被阻止。在met+feno(共同给予美福明和非诺贝特的小组)中,在18周时荧光物质流出被阻止,但在24周时无阻止荧光物质流出的效果。另外,当根据本发明的cmo4-100和cmo4-250(给予肉桂枝和牡丹根皮(1:8)的小组)和cpa4-100和cpa4-250(给予肉桂枝和芍药根(1:8)的小组)分别与美福明一起被共同给予时,确认这些小组在18和24周时通过显著阻止荧光物质从视网膜血管流出具有治疗效果(图7)。基于上述结果,确认美福明可在一定期间预防视网膜血管损伤,而美福明具有最终阻止不了视网膜血管损伤的限制。6-3针对无细胞毛细血管形成的抑制效果糖尿病性视网膜病初始症状其中之一是无细胞毛细血管形成,其杀死周细胞的核,导致视网膜病。关于这点,在给予实施例1和2制备的cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)后,确认针对无细胞毛细血管形成的抑制效果。具体地,以与实验实施例6-2相同的方式从小鼠摘除眼球,并且将视网膜从眼球摘除并用流水洗涤。其后,将其置于3%胰蛋白酶中,并在37℃下培养1小时。将酶解的视网膜转移至pbs,并去除内部膜(细胞中存在的细胞器的膜)。利用玻璃棒将血管框架从视网膜背景分离,置于玻片上,并干燥。然后将干燥的血管框架用pas和苏木精染色,并确认细胞壁和核的变化。结果是,如图8所示,在分析各组的无细胞毛细血管数量时,糖尿病组(dm)中无细胞毛细血管的数量增加了5倍,而美福明给予组(met)和共同给予美福明和非诺贝特的小组(met+feno)不能防止无细胞毛细血管增生。然而,确认在根据本发明的cmo4-100和cmo4-250(给予肉桂枝和牡丹根皮(1:8)的提取物的小组)分别与美福明一起被共同给予时,本发明的这些小组显著抑制无细胞毛细血管形成(图8)。6-4针对细胞间紧密接合蛋白损伤的抑制效果在给予实施例1和2制备的cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)后,确认针对细胞间紧密接合蛋白损伤的抑制效果。具体地,将小鼠的眼球以与实验实施例6-2相同的方式摘除,并在10%中和福尔马林中固定过夜。另外,将所得物脱水并用二甲苯更替三次,从而使其嵌有石蜡。将嵌入组织块制成4μm厚度的连续切片,并置于玻片上备用。为去除内源过氧化物酶活性,使经历了脱石蜡和功能过程的玻片与3%过氧化氢溶液反应10分钟,然后用包含0.05%吐温20的pbs洗涤三次。为去除非特异性反应,利用5%酪蛋白进行封闭,然后分别将初级抗体以1:200的比例稀释。其后,将稀释初级抗体处理1小时或过夜。在用pbs洗涤1小时后,将带标记链霉亲和素生物素(lsab)试剂盒(dako,usa)施用于所得物,用dab显色,然后利用光学显微镜观察。在荧光染色情况下,分别将fitc缀合的二级抗体以1:200的比例稀释,并反应1小时。其后,将所得物用dapi染色,并利用荧光显微镜观察。结果是,如图9a和9b所示,确认在糖尿病组(dm)、美福明给予组(met)、或共同给予美福明和非诺贝特的小组(met+feno)中,在不同血管区域拍摄到连接线,如紧蛋白-5线。然而,在根据本发明的cmo4-100和cmo4-250(给予肉桂枝和牡丹根皮(1:8)的提取物的小组)以及cpa4-100和cpa4-250(给予肉桂枝和芍药根(1:8)的提取物的小组)分别与美福明一起被共同给予时,这些小组中无紧蛋白-5损失(图9a)。另外,闭合蛋白量在糖尿病组(dm)中显著减少,并且在美福明给予组(met)和共同给予美福明和非诺贝特的小组(met+feno)中其无显著增加。然而,确认在根据本发明的cmo4-250(给予肉桂枝和牡丹根皮(1:8)的提取物的小组)和cpa4-250(给予肉桂枝和芍药根(1:8)的提取物的小组)分别与美福明一起被共同给予时,这些小组显著增加闭合蛋白量(图9b)。6-5对肾功能和蛋白尿的效果为确认预防和治疗高血糖致肾功能退化的效果,确认24小时尿输出、蛋白尿、白蛋白尿、和肌酸酐清除率、以及尿液中的肾升压素(nephrin)、8-ohd和age量。结果是,如图10所示,在所有小组中,尿液中的肾升压素、8-ohd和age量显示显著效果,但在单独美福明给予小组中尿量以及白蛋白尿和肌酸酐清除率没有得到抑制。另外,确认在根据本发明的cmo4-100和cmo4-250(给予肉桂枝和牡丹根皮(1:8)的提取物的小组)以及cpa4-100和cpa4-250(给予肉桂枝和芍药根(1:8)的提取物的小组)分别与美福明一起被共同给予时,这些小组显著抑制白蛋白尿和肌酸酐清除率。然而,在met+feno(共同给予美福明和非诺贝特的小组)中未呈现对肌酸酐清除率的效果(图10)。基于上述结果,确认单独给予美福明不能抑制朝向糖尿病性肾病的进展。然而,在肉桂枝和牡丹根皮的提取物、或肉桂枝和芍药根的提取物与美福明一起共同给予时,其可显著治疗朝向糖尿病性肾病的进展。6-6肾小球硬化的改变通过pas染色和三色体(trichrome)染色确认肾小球硬化的症状,即系膜和胞外基质扩张。结果是,如图11所示,在糖尿病组中,观察到肾小球硬化症状,即因胞外基质物在肾小球中产生和积累而扩大和扩张的系膜区域。另外,确认在根据本发明的cmo4-100和cmo4-250(给予肉桂枝和牡丹根皮(1:8)的提取物的小组)以及cpa4-100和cpa4-250(给予肉桂枝和芍药根(1:8)的提取物的小组)分别与美福明一起共同给予时,这些小组显著抑制系膜和胞外基质扩张(图11)。实验实施例7:在啮齿动物动物模型中对黄斑变性的治疗效果7-1在mnu诱导年龄相关黄斑变性动物模型中预防和治疗黄斑变性的效果7-1-1实验动物育种和实验设计6周龄雄性c57bl/6小鼠在其纯化一周后投入使用。为引起在黄斑变性中出现的视网膜组织形态变化中的感光细胞损伤和变性,将60mg/kg的1%(0.05%乙酸)n-甲基-n-亚硝基脲(mnu,sigma,usa)腹膜内注入7周龄c57bl/6小鼠。将等量的0.05%乙酸腹膜内给予至正常组。将根据本发明的cmo4和cmo4-1(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4-1(肉桂枝和芍药根(1:8)的提取物)悬浮并制备于0.5%羧甲基纤维素钠(cmc)中,并在给予mnu那天前以50mg/kg和100mg/kg、或100mg/kg的专属浓度(exclusiveconcentration)口服给予一次。其后,在mnu给予后将所得物一天一次口服给予7天。在正常组和mnu诱导型小组中,仅口服给予等量的0.5%cmc。7-1-2组织病理学评价通过视网膜组织中的外核层厚度变化确认在黄斑变性中出现的视网膜组织形态变化中的感光细胞损伤和变性。具体地,利用实验实施例7-1-1制备的小鼠,将小鼠的眼球以与实验实施例6-2相同的方式摘除,并在10%中和福尔马林中固定过夜。另外,将所得物脱水并用二甲苯更替三次,从而使其嵌有石蜡。将嵌入组织块制成4μm厚度的连续切片,并置于玻片上备用。为去除内源过氧化物酶活性,使经历了脱石蜡和功能过程的玻片与3%过氧化氢溶液反应10分钟,然后用包含0.05%吐温20的pbs洗涤三次。将玻片切片用苏木精&eosin(h&e)染色,并利用光学显微镜进行观察。结果是,如图12所示,确认在视网膜中感光细胞的核致密形成的外核层的厚度(*)变薄,因为细胞数量因mnu给予造成的损伤而减少。然而,在给予cmo4和cmo4-1(肉桂枝和牡丹根皮(1:8)的提取物)以及cpa4-1(肉桂枝和芍药根(1:8)的提取物)的小组中,mnu造成的感光细胞损伤得到显著抑制(图12)。7-2在naio3诱导型动物模型中预防视网膜色素上皮细胞损伤的效果7-2-1实验动物育种和实验设计6周龄雄性sd大鼠在其纯化一周后投入使用。为引起视网膜色素上皮细胞损伤和变性(黄斑变性中出现的变化其中之一),将35mg/kg的3.5%naoi3(sigma,usa)在7周龄大鼠的舌下静脉内注入。将等量盐水给予正常组。将根据本发明的cmo4-1(肉桂枝和牡丹根皮(1:8)的热水提取物)和cpa4-1(肉桂枝和芍药根(1:8)的热水提取物)悬浮并制备于0.5%羧甲基纤维素钠(cmc)中,并在给予naoi3那天前以50mg/kg和100mg/kg的浓度口服给予一次。其后,在naoi3给予后将所得物一天一次口服给予7天。在正常组和对照组中,仅口服给予等量的0.5%cmc。7-2-2组织病理学评价通过视网膜组织中外核层的折叠数确认视网膜色素上皮细胞损伤和变性(黄斑变性中出现的变化其中之一)。具体地,利用实验实施例7-2-1制备的小鼠,将小鼠的眼球以与实验实施例6-2相同的方式摘除,并在10%中和福尔马林中固定过夜。另外,将所得物脱水并用二甲苯更替三次,从而使其嵌有石蜡。将嵌入组织块制成4μm厚度的连续切片,并置于玻片上备用。为去除内源过氧化物酶活性,使经历了脱石蜡和功能过程的玻片与3%过氧化氢溶液反应10分钟,然后用包含0.05%吐温20的pbs洗涤三次。将玻片切片用苏木精&eosin(h&e)染色,并利用光学显微镜进行观察。结果是,如图13所示,裸眼观察到如下现象:由于naoi3给予导致上色的上皮细胞的损伤,外核层(其中正位于上皮细胞上方的感光细胞的核是致密的)屈曲。然而,在给予cmo4-1(肉桂枝和牡丹根皮(1:8)的热水提取物)和cpa4-1(肉桂枝和芍药根(1:8)的热水提取物)的小组中,确认naoi3引起的上色的上皮细胞的损伤得到抑制,从而显著抑制外核层屈曲的现象(图13)。7-3在极低密度脂蛋白受体(vldlr)敲除小鼠中预防黄斑变性的效果7-3-1实验动物育种和实验设计一对雄性和雌性vldlr-/-小鼠(具有从3周龄表现的视网膜下新血管形成(湿黄斑变性的临床症状)的动物模型)购自jacson实验室。另外,通过育种上述小鼠获得2周龄小鼠,然后用于实验。关于正常动物,采用具有相同周龄的c57bl/6小鼠。将根据本发明的cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)悬浮和制备于0.5%cmc,然后以100mg/kg的浓度一天一次腹膜内给予7天。在正常组和对照组中,仅口服给予等量的0.5%cmc。7-3-2抑制视网膜下新血管形成测量视网膜血管水肿以确认针对视网膜下新血管形成的抑制效果。具体地,利用实验实施例7-3-1的动物模型,将zoletil50(virbac,30mg/kg)和rompun(bayerkorea,10mg/kg)在尸检期间以3:2的比例混合,并稀释10倍以制备盐水,然后将盐水(50μl)腹膜内注射进行麻醉。剖腹术后,将5mg异硫氰酸荧光素-葡聚糖(fd40s-1g,sigma)溶于pbs,并将其混合物(100μl)注入心脏。5分钟后,摘除眼球,并将一个眼球在10%中和福尔马林中固定,以制备视网膜组织切片,同时将另一眼球在4%仲甲醛中固定10分钟。其后,从中分离视网膜,准备平置视网膜玻片,并在荧光显微镜(bx51,olympus,日本)下观察该玻片。结果是,如图14所示,外核层下方的视网膜下区域中形成新血管,使得视网膜组织向上屈曲;在vldlr-/-小鼠中观察到这种现象。然而,确认这种新血管形成通过给予本发明的cmo4(肉桂枝和牡丹根皮(1:8)的提取物)而得到显著抑制(图14)。7-3-3针对视网膜色素上皮细胞损伤的抑制进行zo-1染色以确认视网膜色素上皮细胞形态结构变性存在或不存在。具体地,利用实验实施例7-3-1的动物模型,在从尸检提取的眼组织分离视网膜后,将结膜组织在4%仲甲醛中固定3小时,用pbs洗涤,并在包含5%tritonx-100和1%bsa的pbs中搅拌3小时。再次洗涤所得物后,将以1mg/ml溶于pbs的凝集素(l2140,sigma)以1:50的比例稀释,并在4℃下反应过夜。洗涤用包含0.05%吐温20的pbs所得物2小时后,将链霉亲和素tritc以1:500的比例稀释,在37℃下反应4小时,用pbs洗涤30分钟,并利用荧光显微镜(bx51,olympus,日本)进行观察。结果是,如图15所示,将正常小鼠的视网膜色素上皮细胞用zo-1染色,从而观察其对的形状。而在vldlr-/-小鼠中,观察到细胞受损和新血管生长变性的位点(箭头)。然而,确认视网膜色素上皮细胞变性通过给予本发明的cmo4(肉桂枝和牡丹根皮(1:8)的提取物)得到显著抑制(图15)。7-3-4针对视网膜中vegf表达的抑制效果通过染色确认针对视网膜中vegf表达的抑制效果。具体地,利用实验实施例7-3-1的动物模型,以与实验实施例7-2-2相同的方式制备玻片切片。将玻片切片用h&e染色,并且在光学显微镜下定量分析视网膜下区域的新血管损伤。结果是,如图16所示,确认在vldlr-/-小鼠中vegf(新血管和血管的渗透性涉及的重要因子)过度表达(深紫色染色),而vegf表达通过cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)的给予得到显著抑制(图16)。7-4治疗极低密度脂蛋白受体(vldlr)敲除小鼠的黄斑变性效果7-4-1实验动物育种和实验设计一对雄性和雌性vldlr-/-小鼠(具有从3周龄开始表现的视网膜下新血管形成(湿黄斑变性的临床症状)的动物模型)购自jacson实验室。另外,通过育种上述小鼠获得2周龄小鼠,然后用于实验。关于正常动物,采用具有相同周龄的c57bl/6小鼠。将根据本发明的cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)悬浮并制备于0.5%cmc中,然后从3周龄开始分别以50mg/kg和100mg/kg的浓度一天一次腹膜内给予7天。在正常组和对照组中,仅口服给予等量的0.5%cmc。7-4-2视网膜下新血管形成的抑制利用视网膜组织切片确认对黄斑变性中出现的视网膜下新血管形成的抑制效果。具体地,利用实验实施例7-4-1的动物模型,在荧光显微镜(bx51,olympus,日本)下以与实验实施例7-3-2相同的方式观察视网膜组织切片。结果是,如图17所示,新血管在外核层下方的视网膜下区域中形成,使得视网膜组织向上屈曲;在vldlr-/-小鼠中观察到这种现象。然而,确认这种新血管形成通过给予本发明的cmo4(100mg/kg)(肉桂枝和牡丹根皮(1:8)的提取物)得到显著抑制(图17)。7-5针对激光致脉络膜膜新血管大鼠模型的新血管形成的抑制效果7-5-1实验动物育种和实验设计通过腹膜内注射zoletil50(virbac,30mg/kg)和rompun(bayerkorea,10mg/kg),将7周龄雄性long-evans大鼠(slcjapan,日本东京)麻醉。其后,利用1%托品酰胺(tropicamide)滴眼液放大瞳孔,然后利用二极管激光器(波长:532nm,直径:100μm,功率:150mw,持续时间:0.1sec)在视神经头周围形成4个光凝点。通过区分气泡的形成检验bruch膜的破坏。将从麻醉觉醒的大鼠随机分组,并向其给予药物。将根据本发明的cmo4(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(肉桂枝和芍药根(1:8)的提取物)悬浮并制备于0.5%cmc中,然后将每种提取物以100mg/kg的浓度一天一次口服给予10天。在正常组中,仅口服给予等量的0.5%cmc。7-5-2视网膜下新血管形成的抑制利用视网膜组织切片确认对黄斑变性中出现的视网膜下新血管形成的抑制效果。具体地,利用实验实施例7-5-1的动物模型,在10天后,在尸检时通过腹膜内注射zoletil50(virbac,30mg/kg)和rompun(bayerkorea,10mg/kg)的3:2比例的混合溶液,将大鼠麻醉。剖腹术后,将5mg异硫氰酸荧光素-葡聚糖(mw2×106,sigma)溶于pbs,并将其混合物(100μl)注入心脏。10分钟后,将眼球摘除并在4%仲甲醛中固定10分钟。其后,从中分离视网膜,并将包含视网膜下区域的结膜组织制备成平置切片。在荧光显微镜(bx51,olympus,日本)下观察平置切片。利用imagej软件(nih,usa)分析新血管产生区域的尺寸。结果是,如图18所示,确认新血管形成通过本发明cmo4(100mg/kg)(肉桂枝和牡丹根皮(1:8)的提取物)的给予得到显著抑制。另外,新血管形成通过本发明cpa4(100mg/kg)(肉桂枝和芍药根(1:8)的提取物)的给予趋于得到抑制(图18)。实验实施例8:在mnu诱导黄斑变性的啮齿动物模型中预防和治疗黄斑变性的效果如表1的分析结果所示,确认肉桂枝和牡丹根皮(1:8)的提取物(cmo4和cmo4-1)、以及肉桂枝和芍药根(1:8)的提取物(cpa4和cpa4-1)中的芍药苷含量分别为2.7%、2.3%、12.3%和8.9%。据报道,由于芍药苷对人视网膜色素上皮细胞系(arpe-19)中h2o2引起的凋亡具有抑制效果,芍药苷可有效用于治疗眼科疾病,例如,黄斑变性(molecularvision2011;17:3512-3522)。然而,在动物模型中,对黄斑变性的预防和治疗效果未被证实,而仅仅在添加h2o2(区别于衰老化状况的毒性物质和视网膜色素上皮细胞系黄斑变性的一般诱因)后确认抗氧化剂效果和凋亡抑制作用。也就是说,芍药苷对黄斑变性的效果在动物模型中未被证实。因此,为证实虽然本发明的提取物包含芍药苷,但提取物的效果不仅是单纯的芍药苷效果,在动物模型中确认各提取物(100mg)中包含的芍药苷的效果。8-1实验动物育种和实验设计6周龄雄性c57bl/6小鼠在其纯化一周后投入使用。为引起在黄斑变性中出现的视网膜组织形态变化中的感光细胞损伤和变性,将1%(0.05%乙酸)n-甲基-n-亚硝基脲(mnu,sigma,usa)以60mg/kg的浓度腹膜内注入7周龄雄性c57bl/6小鼠。将等量的0.05%乙酸腹膜内给予正常组。作为样本,cmo4(100mg/kg)(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4(100mg/kg)(肉桂枝和芍药根(1:8)的提取物)、芍药苷-2.7(2.7mg/kg)、和芍药苷-12.3(12.3mg/kg)悬浮和制备于0.5%cmc中,并在mnu给予日前口服给予一次。在给予mnu后,将这些所得物分别一天一次口服给予7天。在正常组和mnu诱导组中,口服给予等量的0.5%cmc。8-2视网膜神经组织中的外核层厚度变化确认视网膜神经组织中感光细胞损伤导致的外核层厚度变化。具体地,将样本以与实验实施例8-1相同的方式处理的实验组在给药后尸检,并摘除眼球。其后,将摘除的眼球在10%中和福尔马林中固定一天,并嵌以石蜡,以制备玻片切片。将玻片切片用h&e染色,并在光学显微镜下进行观察。结果是,如表4所示,给予cmo4(肉桂枝和牡丹根皮(1:8)的提取物)的小组被证实具有比mnu给予组高50%的效果(1.23±0.20au→1.61±0.32au)。然而,确认给予cmo4(100mg)包含的芍药苷的小组(pf-2.7)与mnu给予组相比根本无效果(1.23±0.20au→1.23±0.21au)(表4)。另外,如表5所示,在mnu给予组中,视网膜中感光细胞核致密的外核层的损伤程度恶化约50%或更多(1.99±0.21au→0.92±0.17au)。然而,确认在给予cpa4(肉桂枝和芍药根(1:8)的提取物)的小组中,与mnu给予组相比,效果提高21.4%(0.92±0.17au→1.14±0.21au)。另外,还确认在给予cpa4(100mg)包含的芍药苷的小组(pf-12.4)中,效果提高17.5%(0.92±0.17au→1.11±0.19au),并且cpa4给予组与给予芍药苷(12.4mg/kg)的小组(pf-12.4)相比效果提高4%(表5)。[表4]实验组外核层厚度(au)外核层厚度(%)nor1.99±0.21100.00±27.72mnu1.23±0.20*0.00±25.55cmo41.61±0.32#50.31±42.41pf-2.71.23±0.210.76±27.23(*p<0.05vs.nor;#p<0.05vs.mnu)[表5]实验组外核层厚度(au)外核层厚度(%)nor1.99±0.21100.00±10.92mnu0.92±0.17*0.57±15.64cpa41.14±0.25#21.38±23.30pf-12.41.11±0.19#17.46±17.39(*p<0.05vs.nor;#p<0.05vs.mnu)基于上述结果,确认具有极低芍药苷含量的cmo4(肉桂枝和牡丹根皮(1:8)的提取物)的效果(2.7%)显著较优,不仅因为肉桂枝和牡丹根皮的提取物的效果不止由芍药苷引起,而且因为其效果事实上是肉桂枝和牡丹根皮的提取物中存在的多种成分的协同效果。另外,基于肉桂枝和牡丹根皮的提取物的结果,还确认肉桂枝和芍药根的提取物的效果不由芍药苷造成,而其效果是肉桂枝和芍药根的提取物中存在的多种成分的协同效果。另外,确认了cmo4或cmo4-1(肉桂枝和牡丹根皮提取物,与cpa4或cpa4-1(肉桂枝和芍药根提取物)相比具有较低芍药苷含量)的较优效果;其这种较优效果在之前的实验实施例中已被确认(图13至18)。这些结果证实,本发明的混合提取物的效果不是由芍药苷造成,而是混合提取物中存在的多种成分的协同效果。实验实施例9:抑制和治疗下肢水肿的效果9-1实验动物育种和实验设计6周龄雄性sd大鼠购自orientbioinc.(seongnam,韩国),并在其纯化一周后投入使用。在纯化后,将动物如下随机分组:正常:正常对照小组;水肿:下肢水肿诱导小组;cmo4-1-50:下肢水肿诱导小组+给予cmo4-1(50mg/kg/天)的小组;cmo4-1-100:下肢水肿诱导小组+给予cmo4-1(100mg/kg/天)的小组;cpa4-1-50:下肢水肿诱导小组+给予cpa4-1(50mg/kg/天)的小组;和cpa4-1-100:下肢水肿诱导小组+给予cpa4-1(100mg/kg/天)的小组。下肢水肿发作前三天、治疗前四天,将各小组一天一次口服给予,然后在下午诱导下肢水肿。制备cmo4-1(肉桂枝和牡丹根皮(1:8)的提取物)和cpa4-1(肉桂枝和芍药根(1:8)的提取物)——通过将其悬浮于0.5%cmc中。另外,在正常小组和下肢水肿诱导小组中,仅口服给予等量的0.5%cmc。通过将包含2.5%福尔马林的盐水(0.1ml)给予到大鼠右后足中诱导下肢水肿,并且正常组仅注入等量盐水。9-2下肢水肿状态变化确认下肢水肿诱导之前和之后的水肿状态。具体地,关于实验实施例9-1的实验组,利用体积描记器——水肿测量仪器(ugobasile,milan,italy),测量在给予福尔马林之前和给予其之后1小时的爪体积增加。通过下列方程式3计算水肿指数。[方程式3]如图19所示,确认水肿诱导之前和水肿发作之后1小时的水肿状态的结果是,在无菌盐水被注入正常组时水肿尺寸增加极少,但的确存在略微增加。进一步,确认在给予福尔马林的下肢水肿诱导小组中,尺寸显著增加约20%,但通过cmo4-1(肉桂枝和牡丹根皮(1:8)的提取物),下肢水肿造成的这种尺寸变化没有大幅增加。此外,还确认下肢水肿尺寸是浓度依赖性的并且在给予cpa4-1(肉桂枝和芍药根(1:8)的提取物)时得到显著抑制(图19)。基于上述结果,确认肉桂枝和芍药根的混合提取物对下肢水肿的预防和治疗效果显著优越。[工业应用性]本发明可不仅作为天然混合提取物的组合物用于预防和治疗糖尿病并发症和血管性水肿,而且可有效作为健康功能性食品使用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1