贝特类药物在制备用于预防或治疗老年人慢性炎症的药物中的应用
本发明涉及生物医药领域,具体涉及贝特类药物在制备用于预防或治疗老年人长期的慢性炎症的药物中的应用。
背景技术:
贝特类药物主要有如下种类:1.利贝特又称新安妥明,降脂新,降脂及啶,其使用法为25-50mg/次,一日三次,口服。2.苯扎贝特又称必降脂,降脂苯酰,是氯贝特的衍生物,其使用法为是每次口服0.2克,一日三次,口服因能减少空腹血糖的10%,多运用于糖尿病患者。此外,还有其长效的缓释制剂必降脂缓释片,又名脂康平,常用剂量为每次口服0.4克,每天一次。3.氯贝丁酸铝及双贝特:每日0.5g,一日三次,口服。4.非诺贝特(fenofibrate),分子式为c20h21clo4,为白色或类白色结晶性粉末,无臭,无味。极易溶于氯仿,易溶于丙酮或乙醚,略溶于乙醇,几乎不溶于水。非诺贝特主要用来降低有心血管疾病风险的患者的胆固醇水平。与其他贝特类药物一样,非诺贝特降低低密度脂蛋白(ldl)和极低密度脂蛋白(vldl)水平,并且能升高密度脂蛋白(hdl)水平和降低甘油三酯(tg)水平。非诺贝特可以单独使用也可以与他汀类药物联用来治疗高胆固醇血症和高甘油三酯血症。
非诺贝特自1975年起便开始使用,是最常用的贝特类药物之一,并且有着很好的效果和耐受性。近年来越来越多的研究证据显示随着年龄增加,人体内生理性慢性炎症水平的逐渐增加,会导致很多与老年相关的疾病,如动脉粥样硬化,冠心病,关节炎,感染和肿瘤等。
刊载于上海第二医科大学学报vol23no.3.2003的《非诺贝特缓释微丸对糖尿病患者糖脂代谢紊乱的影响》论文公开了非诺贝特能明显改善糖尿病患者的糖脂代谢紊乱,降低血尿酸,从而延缓代谢综合征的发展,是糖尿病高脂血症患者安全、有效、理想的降脂药物。
刊载于杂志《clinicaimedicationjoumai》2008第6卷,第2期的专家评说(文章编号:1672—3384(2008)一02—0001—03)的《贝特类调脂药物在降脂领域的地位及认识》公开了贝特类药物又称苯氧芳酸类药物,贝特类药物除了具有调脂作用外。还具有抗炎、降低纤维蛋白原及部分凝血因子水平、改善胰岛素敏感性、改善内皮细胞功能等调脂以外的抗动脉粥样硬化作用。
刊载于中南药学2011年7月第9卷第7期高脂血症药物治疗专题的论文《贝特类调脂药物研究进展》公开了贝特类药物又称苯氧芳酸类药物,是指包括吉非贝齐、氯贝特、非诺贝特、苯扎贝特和环丙贝特等在内的一类调脂药物等内容。
申请号为200980157806.9,发明名称为贝特类的新用途的中国专利公开了贝特类、特别是非诺贝特(尤其是固体口服组合物的形式)在制造用于治疗睡眠呼吸暂停、睡眠呼吸暂停综合征、特别是阻塞性睡眠呼吸暂停或阻塞性睡眠呼吸暂停综合征的药物中的用途。
申请号为201810023234.6。发明名称为非诺贝特的新用途以及针对新用途的药物的中国专利,公开了非诺贝特在制备治疗或预防高血脂症合并冠心病药物中的新用途,以及非诺贝特可以明显改善患者血液流变学指标,不仅能有效缓解患者的高血脂症表现,还能改善神经功能,从而有利于患者整体病情的恢复。
另外,中国专利cn201480056530.6公开了通过施用非诺贝特及其类似物治疗或预防神经退行性疾病的方法。中国专利cn200480028731.1公开了含有微粉化非诺贝特(fenofibrate)、表面活性剂和作为增溶助剂的粘合纤维素衍生物的非诺贝特组合物的用途,以及用于制备治疗高甘油三酯血症、高胆固醇血症或高脂血症同时减少对非诺贝特生物利用度的食物效应的药物
总之,通过对已公开论文和专利文献的检索,至今未见本发明的实质性的内容被公开。
目前,临床上常用的抗炎药包括非甾体类抗炎药,激素和抗生素等多用于急性感染性炎症的治疗,缺乏本发明人在研究中发现的贝特类药物尤其是非诺贝特在临床上的新应用。
技术实现要素:
针对现有技术中的不足,本发明提供了一种预防或治疗老年人慢性炎症的药物,具体为常用于降低有心血管疾病风险的患者的胆固醇水平的贝特类药物在制备用于预防或治疗老年人慢性炎症的药物中的应用。
所述贝特类药物在制备用于预防或治疗老年人长期的慢性炎症的药物中的应用,优选非诺贝特的应用,更优选为非诺贝特口服制剂,非诺贝特口服制剂规格为,每粒200mg。
贝特类药物在制备用于预防或治疗老年人长期的慢性炎症的药物中的应用时,可通过简单的外周血单核细胞提取和westernblot方法检测ppara含量,筛选出单核细胞中ppara低表达的患者为给药对象。
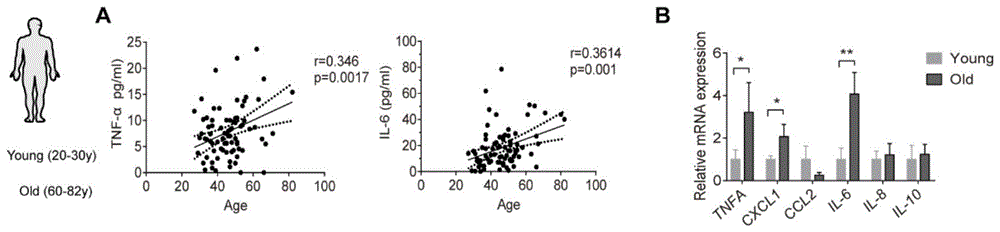
有证据表明,一些常见的慢性炎症因子如tnf-a和il6会在血清中随着年龄增加而升高。血液单核细胞是体内多器官巨噬细胞的前体细胞,也是产生多种炎症因子的重要细胞之一。本发明人首先收集了80例2019年在郑大一附院体检后无基础疾病的不同年龄的健康志愿者血清,elisa方法检测血清中炎症因子tnf-a和il6含量,结果表明:随着年龄增大,人外周血炎症细胞因子tnf-a和il6随着年龄的增加呈上升趋势。(图1a)随机取年轻人(20-30岁)和老年人(60-82岁)各8例,收集外周血,分离单核细胞,rt-pcr方法检测了几种不同炎症因子基因水平差异,结果也表明,老年人单核细胞il6和tnfa基因水平更高(图1b)。由此,我们推测,老年人外周血中高炎症因子il6和tnfa含量与单核细胞的改变有直接联系。
ppara是调控脂滴代谢的关键分子,它可以通过促进脂肪酸从细胞质转运到线粒体,从而进行脂肪酸氧化过程。若过多的脂肪酸在细胞质积累,会导致脂滴积累和炎症信号通路例如nf-kb激活,导致炎症因子的释放。
为了探索老年人单核细胞与年轻人单核细胞的差异,我们利用电镜直接观察了小鼠单核细胞的形态差异。我们发现老年小鼠单核细胞中有大量脂滴的积累。(图2a)应用bodipy染色,免疫荧光显微镜和流式细胞学方法,我们同样证实了老年人单核细胞中脂滴染色多于年轻组单核细胞。(图2b-c)。进一步通过转录组学测序对比老年和年轻单核细胞,我们发现:老年单核细胞中ppara分子水平下调。为了进一步证明ppara水平与脂滴和炎症因子水平之间的联系,我们分离了57例不同年龄的外周血单核细胞,westernblot方法验证了ppara蛋白水平表达(图3a),同时分析了其脂滴含量和炎症因子之间的相关性,结果发现:ppara蛋白水平与年龄负相关(图3b),与脂滴积累(图3c)负相关。此外,进一步分析也发现,脂滴含量与炎症因子tnf-a和il-6水平正相关,表明了脂滴含量可作为单核细胞炎症因子水平的指标(图4)。综合来看,ppara在老年单核细胞中下调是导致脂滴积累和炎症因子释放的重要原因。为了进一步证实ppara下调可以调控单核细胞脂滴积累和炎症因子分泌,我们在小鼠中敲除ppara基因,结果证明,被敲除ppara的小鼠单核细胞中有更多的脂滴积累和更高水平的il6和tnfa基因表达(图5a-c)。
由于ppara是调控脂滴代谢的关键分子,它可以通过促进脂肪酸从细胞质转运到线粒体,从而进行脂肪酸氧化过程。若过多的脂肪酸在细胞质积累,会导致脂滴积累和炎症信号通路例如nf-kb激活,导致炎症因子的释放。因此我们推测,ppara激活后可以促进老年单核细胞脂肪酸氧化,抑制脂滴积累和炎症因子产生。
非诺贝特(fenofibrate)是临床上常用的降脂药,主要用于治疗高胆固醇血症,同时非诺贝特也是ppara分子的激活剂,能够上调ppara的表达。为了验证非诺贝特对单核细胞脂滴积累和炎症因子释放的影响,我们首先挑选了8例高胆固醇患者,给予非诺贝特口服,200mg/d,共7天。在治疗前后检测单核细胞脂滴和血清炎症因子的变化。我们发现:大部分患者单核细胞中ppara表达上调(图6a),脂滴水平和炎症因子产生水平显著降低(图6b-d)。
综上所述,老年人单核细胞中调节脂质代谢的重要分子ppara降低,会导致单核细胞脂肪代谢异常,脂滴积累和慢性炎症因子释放。外周血中单核细胞脂滴可以作为ppara降低的指标,通过利用ppara激活剂非诺贝特可以通过上调单核细胞ppara水平,抑制脂滴积累和炎症因子释放,有利于减少老年人体内慢性炎症因子tnf-a和il6含量。
国外研究发表论文表明,贝特类药物都是ppara的激活剂。
总之,非诺贝特能够通过上调ppara抑制老年人单核细胞慢性炎症因子的释放,从而可用于慢性炎症的预防和治疗。
基于上述发现,本发明提供了贝特类药物尤其是非诺贝特在制备用于预防或治疗老年人慢性炎症的药物中的应用的新思路。
技术效果:临床实验证明,贝特类药物尤其是非诺贝特可有效在用于预防或治疗老年人慢性炎症,为与老年相关的疾病,如动脉粥样硬化,冠心病,关节炎,感染和肿瘤等的预防和治疗提供新的思路和方向,特别是在目前老年人长期的慢性炎症无明确疗效的药物的情况下,本发明具有重要价值。
附图说明
图1:炎症因子与年龄相关性统计分析。a,收集80例不同年龄健康志愿者血清,elisa检测tnf-a和il-6含量变化。b:收集不同年龄外周血单核细胞,pcr方法验证不同炎症因子基因包括tnfa,cxcl1,ccl2,il6,il8,il10水平变化。
图2:单核细胞中脂滴积累与年龄的相关性分析。老年单核细胞脂滴积累。收集分离不同年龄的外周血单核细胞,电镜a和bodipy脂滴染色(b)分别检测人和小鼠脂滴含量差异。
图3:单核细胞中ppara表达与年龄的相关性分析。老年单核细胞ppara下调。收集分离不同年龄外周血单核细胞,westernblot方法验证单核细胞ppara水平(a),并于年龄(b),脂滴含量(c)进行相关性分析。
图4:单核细胞脂滴含量与炎症因子tnf-a和il-6水平分析。老年单核细胞脂滴含量与炎症因子tnf-a和il-6水平正相关。分析30例不同年龄人外周血炎症因子与单核细胞脂滴水平的变化。
图5:ppara敲除小鼠中脂滴积累和炎症因子表达显著提高。构建ppara全身敲除小鼠,(a)westernblot方法验证外周血单核细胞ppara蛋白水平。(b)分离单核细胞,bodipy染色和流式细胞学方法检测单核细胞脂滴变化。(c)检测不同周龄小鼠单核细胞tnfa和il6基因水平变化。
图6。非诺贝特对人外周血单核细胞脂滴积累和炎症因子释放的影响。非诺贝特激活部分高血脂患者ppara蛋白含量,并抑制脂滴积累和血清炎症因子水平。随机选取无其他已知慢性炎症疾病的8例高血脂患者,给与非诺贝他单药治疗,治疗前后收集单核细胞和血清,(a)westernblot方法验证外周血单核细胞ppara蛋白水平。(b)pcr方法检测外周血单核细胞il6和tnfa基因水平改变。(c)bodipy染色和流式细胞学方法检测脂滴含量变化。(d)elisa方法检测血清炎症因子il6和tnfa含量改变。
具体实施方式
实施例1.炎症因子与年龄相关性统计分析。
一、实验准备
随机选取无基础疾病的年龄在20-82岁之间健康体检者,抽取空腹全血5ml.
二.实验方法
将全血置于10ml于抗凝管中,1500rpm离心5分钟,收集上层淡黄色的液体,即为血清,放置与-80摄氏度冰箱保存备用。
1.elisa方法检测外周血清中炎症因子tnf-a和il-6含量变化。应用人il-6elisamaxtmdeluxe(biolegend,cat#430504)和tnf-a(biolegend,cat#430204)试剂盒,将一抗包被在96孔板中4度孵育过夜,第二天加入血清(1:5稀释)100ul室温孵育2小时,pbs-tween-20洗4次,加入二抗孵育1小时,再次洗板子4次,加入hrp显示液孵育15分钟,1%硫酸终止反应,多功能酶标仪检测450-570吸光度,根据标准曲线计算血清中tnf-a和il-6浓度。根据计算所得的血清中炎症因子tnf-a和il-6含量,与对应的受检者年龄,使用graphpad6.0软件进行相关性分析。如图1a所示。
2.pcr方法检测炎症因子相关基因在不同年级受检者中的表达情况。具体方法为:收集不同年级的人单核细胞,各8例,使用ficoll试剂和梯度离心法分离单核细胞,将1mltrizol加入待分析的单核细胞样品中,枪头吹吸。溶解细胞中的rna;并收集至1.5ml的离心管中备用。在离心管中加入200μl氯仿,斡旋至液体呈乳白色,静置15min。在4℃,12000rpm离心15min。小心吸取上层水相至新的无酶管,切勿吸到中间白膜。加入等体积异丙醇,颠倒混匀,放于-20℃,静置1h。4℃,12000rpm离心30min。吸走上清,用预先准备的无酶水稀释的75%乙醇洗涤沉淀。4℃,12000rpm离心30min。吸走上清,沉淀晾干数分钟后,加入无酶水溶解混匀,用biorad仪器检测rna的浓度。rna反转录:按照40ul反应体系配好,混匀,置于pcr仪,反应程序为:37℃,15min,85℃,5s,之后放于-80℃。获取单核细胞dna。将cdna(1ul),引物(1ul),h20和2×mix混合,按反应程序:95℃10min;95℃10s,60℃10s,72℃10s,共40个循环;反应结束后继续进行溶解曲线质控,以gapdh或者actin作为内参,计算不同年龄人单核细胞中炎症因子包括tnfa,il6,cxcl1,ccl2,il8,il10基因水平变化(图1b)。
实施例2.单核细胞中脂滴积累与年龄的相关性分析。
一、实验准备
随机选取无基础疾病的年龄在20-82岁之间健康体检者6例,抽取空腹全血5ml。
二.实验方法
将全血置于10ml于抗凝管中,1500rpm离心5分钟,收集上层血清,在下层血细胞中加入3倍体积的磷酸盐缓存液(约5-6ml)稀释,待分离血液单核细胞。取新的15ml离心管,加入5ml的ficoll-paque溶液(1.077),500rpm离心1分钟后取出,将制备的新鲜分离的单核细胞悬液缓慢加入ficoll中,1800rpm(升速和降速均设置为0)离心15分钟后,收集单核细胞层(红色细胞层和棕色上清层中间白色的单核细胞层即为目的细胞层),加入10ml1×磷酸盐缓冲液(pbs),再次离心1500rpm,5分钟,弃上清,去除血小板,加入1ml红细胞裂解液室温放置1分钟,去除红细胞。之后再加无血清培养基5ml,5分钟,弃上清,加入rpmi1640完全培养基,接种在6孔板中,37度孵育1小时,去除未贴壁细胞,贴壁的为单核细胞。
1.电镜观察细胞内脂滴数量。将收集的不同年龄的单核细胞置于电镜固定液中,包埋切片后使用投射电镜对细胞层面进行扫描,扫描后镜下观察细胞结构(图2a)。
2.bodipy染色检测细胞内脂滴含量。收集单核细胞约10万个,铺在共聚焦小皿中培养2小时,待完全贴壁后,加入bodipy493/503染液(1mlpbs+0.5ul染料)放置37度15分钟,pbs洗去未结合染料。加入1:100cd14抗体,4℃孵育30分钟,pbs洗去未结合抗体,加入1:1000dapi染细胞核1分钟,共聚焦荧光显微镜观察对比不同年龄的单核细胞中脂滴(绿色荧光)含量(图2b)。
3.收集单核细胞约50万个,加入bodipy493/503染液(1mlpbs+0.5ul染料)放置37度15分钟,pbs洗去未结合染料。同时加入1:100cd14和cd16抗体,4度染30分钟。上机,流式细胞仪分析不同年龄单核细胞cd14和cd16中fitc通道中细胞平均荧光强度变化,以确定单核细胞中脂滴含量变化(图2c)。
实施例3.单核细胞中ppara表达与年龄的相关性分析。
一、实验准备
随机选取无基础疾病的年龄在20-82岁之间健康体检者,抽取空腹全血5ml.
二.实验方法
将全血置于10ml于抗凝管中,1500rpm离心5分钟,收集上层血清,在下层血细胞中加入3倍体积的磷酸盐缓存液(约5-6ml)稀释,待分离血液单核细胞。取新的15ml离心管,加入5ml的ficoll-paque溶液(1.077),500rpm离心1分钟后取出,将制备的新鲜分离的单核细胞悬液缓慢加入ficoll中,1800rpm(升速和降速均设置为0)离心15分钟后,收集单核细胞层(红色细胞层和棕色上清层中间白色的单核细胞层即为目的细胞层),加入10ml1×磷酸盐缓冲液(pbs),再次离心1500rpm,5分钟,弃上清,去除血小板,加入1ml红细胞裂解液室温放置1分钟,去除红细胞。之后再加无血清培养基5ml,5分钟,弃上清,加入rpmi1640完全培养基,接种在6孔板中,37度孵育1小时,去除未贴壁细胞,贴壁的为单核细胞,备后续试验。
蛋白提取。
将接种在6孔板中的单核细胞用细胞刷刮下来,收集在1.5ml的ep管中。每个ep管中加入100ul裂解液。(100ul:90ulripa+10ul蛋白酶抑制剂+5ul磷酸酶抑制剂+0.5ulpmsf);裂解30分钟,4℃裂解30min。每隔5min震荡一次。4度离心13000rpm,取上清(约可获得80ul)。-80℃保存或者蛋白浓度。
蛋白浓度测定:
配置bca工作液:bca试剂盒a液:b液=50:1稀释。配1ml,则加a液980ul,b液20ul。每孔加入1ul蛋白样品,每孔用19ulpbs补充至20ul,再加入200ul工作液。37℃孵育30min-60min。上机监测蛋白浓度。根据标准曲线计算出上样蛋白浓度。
蛋白样品制备
共上样20ug(20ul体系)蛋白,加入4ul5*sds蛋白上样缓冲液,(16-x)ul超纯水,xul(根据蛋白浓度不同有所不同)蛋白样品。95-100度水浴煮样10分钟,冰上冷却5min。4度离心10min,去除杂质。
蛋白上样和抗体检测。
根据蛋白浓度上样,总量为20ug,恒压条件进行sds-page电泳,浓缩胶80v跑30min,分离胶(10%浓度)120v跑1.5h,当sds至page胶底部时停止电泳,取下胶放入双蒸水中清洗两次。湿性转膜:在转膜液中,按顺序将胶和nc膜,滤纸夹入电极板。恒压转膜100v,120min;取出nc膜,用5%脱脂牛奶室温封闭1h。用5%bsa稀释一抗ppara,4℃孵育过夜。第2天,tbst洗3次,10min/次。室温孵育二抗1小时。tbst洗3次,10min/次。在曝光仪中,滴加适量ecl发光液于膜上,选择合适的曝光时间,确定ppara在治疗前后单核细胞中的表达。
结果分析。
用imagej软件分析westernblot条带中灰度,灰度越深代表蛋白含量越高,同时分析每个样本所对应的gapdh条带灰度,作为内参。根据ppar-a/gapdh灰度比值确定样本的相对蛋白表达量。将表达最高的蛋白量作为1,其他样品均与1对比,得到相对比值。再根据比值和对应年龄,用garphpad软件进行对应的分析。确定ppar-a表达与年龄的相关性。
如图3老年单核细胞ppara调图所示,随年龄的增加,ppar-a在外周血单核细胞中的相对表达值逐渐降低,具有统计学意义(p<0.001),且与年龄有负相关(r=0.3133)。
实施例4单核细胞脂滴含量与炎症因子tnf-a和il-6水平分析
一、实验准备
随机选取无基础疾病的年龄在20-82岁之间健康体检者30例,抽取空腹全血5ml。
二.实验方法
将收集到的不同年龄的外周血1500rpm离心5分钟,收集血清,放置-80℃备用;下层血细胞加入5ml的ficoll-paque溶液(1.077)中,1800rpm(升速和降速均设置为0)离心15分钟,收集单核细胞层,加入10ml1×磷酸盐缓冲液(pbs),再次离心1500rpm,5分钟,弃上清,加入1ml红细胞裂解液室温放置1分钟,再加无血清培养基5ml,5分钟后弃上清,加入rpmi1640完全培养基,接种在6孔板中,37度孵育1小时,去除未贴壁细胞,贴壁的为单核细胞,备后续试验。
1.流式细胞学方法检测单核细胞中脂滴含量。收集单核细胞约50万个,加入bodipy493/503染液(1mlpbs+0.5ul染料)放置37度15分钟,pbs洗去未结合染料。同时加入1:100cd14和cd16抗体,4度染30分钟。上机,流式细胞仪分析非诺贝特治疗后单核细胞cd14和cd16中fitc通道中细胞平均荧光强度变化,以确定单核细胞中脂滴含量变化,脂滴含量用平均荧光强度(mfi)证明。
2.elisa方法检测外周血清中炎症因子tnf-a和il-6含量变化。应用人il-6elisamaxtmdeluxe(biolegend,cat#430504)和tnf-a(biolegend,cat#430204)试剂盒,将一抗包被在96孔板中4度孵育过夜,第二天加入血清(1:5稀释)100ul室温孵育2小时,pbs-tween-20洗4次,加入二抗孵育1小时,再次洗板子4次,加入hrp显示液孵育15分钟,1%硫酸终止反应,多功能酶标仪检测450-570吸光度,根据标准曲线计算血清中tnf-a和il-6浓度。
3.根据收集到的脂滴平均荧光强度(mfi)与同一受试者的血清炎症因子共同输入graphpad软件中,计算相关性。p<0.05表明具有统计学意义。r>0.3证明两个变量之间有一定相关性。结果表明血清中tnf-a含量与脂滴含量具有相关性,而il-6与脂滴含量无相关性(见图4)。
收集分离不同年龄外周血单核细胞,westernblot方法验证单核细胞ppara水平(a),并于年龄(b),脂滴含量(c)进行相关性分析。
实施例5.ppara敲除小鼠中脂滴积累和炎症因子表达显著提高。
一、实验准备
购买ppara全基因敲除小鼠。选择不同周龄(4周和20周),性别不限。
二.实验方法
1.小鼠单核细胞分离。
将同窝出生的wt野生型和ppara敲除小鼠作为对照,首先用异氟烷口鼻吸入麻醉后,眼球取血,每只小鼠约400ul,并加入10ul枸橼酸三钠抗凝,随后将血液进行1:3(全血:pbs)等倍数稀释。同样利用ficoll-paque溶液(1.084)进行单核细胞分离。1800rpm(升速和降速均设置为0)离心15分钟后,收集单核细胞层(红色细胞层和棕色上清层中间白色的单核细胞层即为目的细胞层),加入10ml1×磷酸盐缓冲液(pbs),再次离心1500rpm,5分钟,弃上清,去除血小板,加入1ml红细胞裂解液室温放置1分钟,去除红细胞。之后再加无血清培养基5ml,5分钟,弃上清,加入rpmi1640完全培养基,接种在6孔板中,37度孵育1小时,去除未贴壁细胞,贴壁的为单核细胞,备后续试验。
2.westernblot方法确定ppara在敲除鼠中表达情况。
将收集的单核细胞用同样方法进行蛋白提取,bca法测定蛋白浓度,蛋白上清中加入5×loadingbuffer,100℃加热10min,冰上冷却后。根据蛋白浓度上样,总量为20ug,恒压条件电泳,浓缩胶80v跑30min,分离胶120v跑1.5h。湿性转膜:在转膜液中,按顺序将胶和nc膜夹入电极板。恒压转膜100v,120min;5%bsa室温封闭1-2h。5%bsa稀释一抗ppara,4℃孵育过夜。第2天,tbst洗3次,10min/次。室温孵育二抗1小时。tbst洗3次,10min/次。在曝光仪中,滴加适量ecl发光液于膜上,选择合适的曝光时间,确定ppara在全基因敲除鼠中的表达情况。
3.脂滴染色和流式细胞学方法确定ppara敲除鼠单核细胞中脂滴含量。
如上述方法将单核细胞分离后。培养在12孔板中,制备bodipy493/503染液(1mlpbs+0.5ul染料),将染液加入细胞中放置37度15分钟,1ml的pbs洗去未结合染料2次。同时加入cd45(biolegend,1:100,apc-r700)和cd11b(biolegend,1:100,apc)抗体(1ul抗体中加入100ul的1%bsa抗体稀释液),4度染30分钟。上机,流式细胞仪分析cd45+cd11b+细胞中fitc通道(脂滴会被bopipy493/503染料染为绿色)中细胞平均荧光强度变化,以确定单核细胞中脂滴含量变化。荧光强度越高,表明细胞中脂滴含量越高。荧光强度用flowjo软件进行统计分析。
4.rt-pcr方法检测炎症基因tnfa和il6变化。将1mltrizol加入待分析的12孔板的单核细胞中,枪头吹吸。溶解细胞中的rna;并收集至1.5ml的离心管中备用。在离心管中加入200μl氯仿,斡旋至液体呈乳白色,静置15min。在4℃,12000rpm离心15min。小心吸取上层水相至新的无酶管,切勿吸到中间白膜。加入等体积异丙醇,颠倒混匀,放于-20℃,静置1h。4℃,12000rpm离心30min。吸走上清,用预先准备的无酶水稀释的75%乙醇洗涤沉淀。4℃,12000rpm离心30min。吸走上清,沉淀晾干数分钟后,加入无酶水溶解混匀,用biorad仪器检测rna的浓度。rna反转录:按照40ul反应体系配好,混匀,置于pcr仪,反应程序为:37℃,15min,85℃,5s,之后放于-80℃。获取单核细胞dna。将cdna(1ul),引物(1ul),h20和2×mix混合,按反应程序:95℃10min;95℃10s,60℃10s,72℃10s,共40个循环;反应结束后继续进行溶解曲线质控,以gapdh或者actin作为内参,计算治疗前后单核细胞中tnfa和il6基因水平变化。
如图5,ppara敲除介导小鼠单核细胞脂滴积累和外周血清炎症因子升高所示:构建ppara全身敲除小鼠,(a)westernblot方法验证外周血单核细胞ppara蛋白水平。(b)分离单核细胞,bodipy染色和流式细胞学方法检测单核细胞脂滴变化。(c)检测不同周龄小鼠单核细胞tnfa和il6基因水平变化。
实施例6.非诺贝特对人外周血单核细胞脂滴积累和炎症因子释放的影响。
一、实验准备
随机选取高胆固醇血脂患者8例(5男3女,年龄40-60岁,无其他基础疾病,胆固醇含量在6-8mmol/l之间)
二.实验方法
1.患者给予单纯非诺贝特(力平之胶囊)治疗,(早饭后口服,200mg/d,共7天)。给药前后分别取外周血10ml于抗凝管中,1500rpm离心5分钟,收集血清,下层血细胞加入5ml的ficoll-paque溶液(1.077)中,1800rpm(升速和降速均设置为0)离心15分钟,收集单核细胞层,加入10ml1×磷酸盐缓冲液(pbs),再次离心1500rpm,5分钟,弃上清,加入1ml红细胞裂解液室温放置1分钟,再加无血清培养基5ml,5分钟,弃上清,加入rpmi1640完全培养基,接种在6孔板中,37度孵育1小时,去除未贴壁细胞,贴壁的为单核细胞,备后续试验。
2.westernblot检测单核细胞中ppara的表达情况。
单核细胞加入rapa裂解液100微升,冰上裂解30min,4℃,12000rpm,30min。将上清收集到新的离心管。bca法测定蛋白浓度,蛋白上清中加入5×loadingbuffer,100℃加热10min,冷却,保存于80℃备用。根据蛋白浓度上样,总量为20ug,恒压条件电泳,浓缩胶80v跑30min,分离胶120v跑1.5h。湿性转膜:在转膜液中,按顺序将胶和nc膜夹入电极板。恒压转膜100v,120min;5%bsa室温封闭1-2h。5%bsa稀释一抗ppara,4℃孵育过夜。第2天,tbst洗3次,10min/次。室温孵育二抗1小时。tbst洗3次,10min/次。在曝光仪中,滴加适量ecl发光液于膜上,选择合适的曝光时间,确定ppara在治疗前后单核细胞中的表达。(图6a)
3.rt-pcr方法检测炎症基因tnfa和il6变化。
1mltrizol溶解单核细胞沉淀;加入200μl氯仿,斡旋至液体呈乳白色,静置15min。4℃,12000rpm离心15min。小心吸取上层水相至新的无酶管,切勿吸到中间白膜。加入等体积异丙醇,颠倒混匀,放于-20℃,静置0.5-1h。4℃,12000rpm离心30min。吸走上清,用预先准备的无酶水稀释的75%乙醇洗涤沉淀。4℃,12000rpm离心30min。吸走上清,沉淀晾干数分钟后,加入无酶水溶解混匀,检测rna的浓度。反转录:按照反应体系配好,混匀,置于pcr仪,反应程序为:37℃,15min,85℃,5s,之后放于-80℃。获取单核细胞dna。将dna,引物等混合,按反应程序:95℃10min;95℃10s,60℃10s,72℃10s,共40个循环;反应结束后继续进行溶解曲线质控,以gapdh作为内参,计算治疗前后单核细胞中tnfa和il6基因水平变化。
4.流式细胞学方法检测单核细胞中脂滴含量。
收集单核细胞约50万个,加入bodipy493/503染液(1mlpbs+0.5ul染料)放置37度15分钟,pbs洗去未结合染料。同时加入1:100cd14和cd16抗体,4度染30分钟。上机,流式细胞仪分析非诺贝特治疗后单核细胞cd14和cd16中fitc通道中细胞平均荧光强度变化,以确定单核细胞中脂滴含量变化。
5.elisa方法检测外周血清中炎症因子tnf-a和il-6含量变化。应用人il-6elisamaxtmdeluxe(biolegend,cat#430504)和tnf-a(biolegend,cat#430204)试剂盒,将一抗包被在96孔板中4度孵育过夜,第二天加入血清(1:5稀释)100ul室温孵育2小时,pbs-tween-20洗4次,加入二抗孵育1小时,再次洗板子4次,加入hrp显示液孵育15分钟,1%硫酸终止反应,多功能酶标仪检测450-570吸光度,根据标准曲线计算血清中tnf-a和il-6浓度。
三,实验结果:
如图6所示:患者1.3.4.5.8单核细胞中ppara蛋白水平在非诺贝特治疗后显著升高,其他患者升高不明显(a)。单核细胞中tnfa和il6总体基因水平显著下降,表明非诺贝特能够抑制炎症因子相关基因的表达(b)。流式细胞学染色结果表明单核细胞中脂滴含量显著降低(c)。且外周血炎症因子水平在非诺贝特治疗后均由明显的下降(d)。
- 还没有人留言评论。精彩留言会获得点赞!