一种铂纳米酶/葡萄糖氧化酶@透明质酸复合抗菌材料及其制备和应用
1.本发明属于纳米技术和靶向杀菌领域,涉及基于慢性伤口例如糖尿病慢性伤口的抗菌材料。
背景技术:
2.伤口,是指受伤破裂的地方,根据其形成原因的不同,可分为急性创伤、手术伤口和慢性伤口三类。前两者往往可以自主愈合,而慢性伤口则难以甚至无法自主愈合。
3.慢性伤口最常见的例子是糖尿病伤口。糖尿病是一类重要疾病,其发病率正在逐年增加,预计到2030年,全世界糖尿病患者将达到5.5亿人。糖尿病慢性伤口的问题也日益突出,因其难以愈合,给全球各国的医疗系统带来了沉重负担,每年有数以千万计的患者因感染加重造成溃疡而不得不截肢。糖尿病伤口难以愈合的直接原因是血糖浓度过高:一方面,高血糖会导致血管神经病变、血液循环受阻、免疫细胞失活、组织细胞脱水凋亡等一系列自身病变;另一方面,高血糖环境为细菌感染和增殖提供了充足的养分,造成感染面积扩大、难以愈合。发展针对慢性伤口感染的抗菌药物具有重要的基础研究价值和社会意义。
4.纳米材料在药物释放、体外检测、疾病诊断与治疗等领域得到了广泛研究。纳米酶是一类具有类酶催化活性的纳米材料,自2007年被报道以来,纳米酶研究进入了一个快速发展的时期。纳米酶抗菌是基于其过氧化物酶活性:纳米酶催化双氧水(h2o2),产生高活性的羟基自由基(
·
oh),进而破坏细菌结构,实现抗菌效果。但是,研究表明纳米酶在糖尿病型慢性伤口中的活性有限。另外,在保持纳米酶高效催化活性的前提下,如何提高抗菌材料的靶向性、降低纳米酶对人体正常细胞的损伤,也是纳米酶治疗研究中必须解决的重要科学问题,对伤口的快速愈合具有重要意义。
技术实现要素:
5.为解决纳米酶在慢性伤口抗菌过程中低活性的问题,本发明提供了一种铂纳米酶/葡萄糖氧化酶@透明质酸复合抗菌材料,旨在提供一种针对糖尿病慢性伤口的溶液稳定性好、具有优异靶向性以及抗菌活性的全新材料。
6.本发明第二目的在于,提供了所述的铂纳米颗粒
‑
核酸适配体/葡萄糖氧化酶 @透明质酸复合抗菌材料材料的制备方法。
7.本发明第三目的在于,提供了所述的在制药方面的用途。
8.本发明第四目的在于,提供了包含所述的铂纳米颗粒
‑
核酸适配体/葡萄糖氧化酶@透明质酸复合抗菌材料的治疗糖尿病慢性伤口药物。
9.一种铂纳米酶/葡萄糖氧化酶@透明质酸复合抗菌材料(本发明也称为 ptnps
‑
apta/gox@ha复合材料,或者简称为复合材料或pagh),包括核以及包覆核的壳;所述的核包括铂纳米酶和葡萄糖氧化酶,所述的铂纳米酶为修饰有核酸适配体的铂纳米颗粒;所述的壳为透明质酸。
10.本发明提供了一种核
‑
壳结构的全新材料,其创新地将葡萄糖氧化酶和铂纳米酶的复合物为核,且创新地将其包埋在透明质酸中,组装得到所述的核
‑
壳结构的复合材料。研究发现,本发明所述的复合材料,通过创新的成分以及成分的复合形貌的协同,能够有效协同,改善糖尿病慢性伤口部位的微环境,改善抗菌活性;不仅如此,本发明所述的材料,基本不会影响正常细胞的代谢,毒副作用小。
11.作为优选,所述的铂纳米颗粒性状为纳米花状,粒径优选不高于20nm,进一步优选为10
‑
15nm。
12.本发明中,所述的适配体为能够识别糖尿病伤口部位病原菌的适配体;优选为能识别金黄色葡萄球菌、大肠杆菌等中的至少一种病原菌的单一或者多种适配体。
13.本发明中,所述的核中,所述的葡萄糖氧化酶修饰在铂纳米酶的表面。
14.本发明研究发现,对所述的复合材料的成分的比例进行合理控制,有助于进一步改善复合材料的溶液稳定性以及被金黄色葡萄球菌选择性捕获效果,且可以进一步改善其对细菌的选择性以及杀伤力。
15.作为优选,铂纳米酶/葡萄糖氧化酶@透明质酸复合抗菌材料中,葡萄糖氧化酶、铂纳米颗粒
‑
核酸适配体和透明质酸的质量比为1~2∶6~12∶200~400;优选为1∶5~6∶200~250。研究发现,控制在优选的范围内,有助于控制材料的粒径,有助于改善溶液稳定性。
16.铂纳米酶/葡萄糖氧化酶@透明质酸复合抗菌材料的水合粒径不高于130nm;优选为70
‑
110nm。
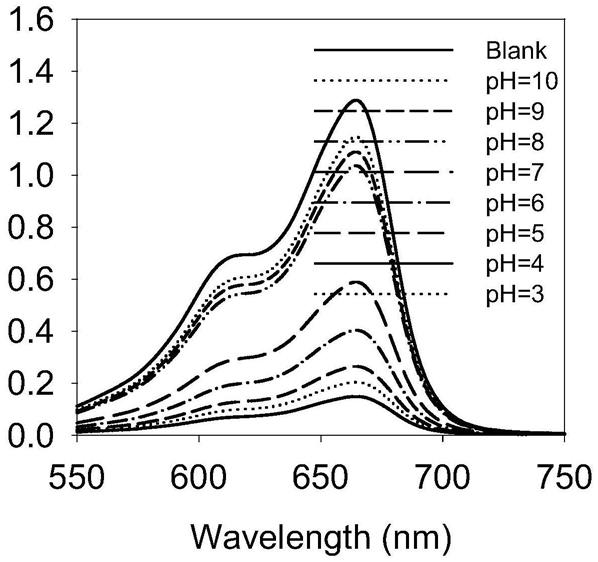
17.本发明还提供了所述的铂纳米酶/葡萄糖氧化酶@透明质酸复合抗菌材料的制备方法,将铂纳米颗粒
‑
核酸适配体和葡萄糖氧化酶水溶解混合,再加入至透明质酸水溶液里,搅拌组装,得悬浮液,随后离心处理,洗涤纯化后经冷冻干燥,即得。
18.作为优选,所述铂纳米颗粒
‑
核酸适配体的合成步骤为:
19.将铂纳米种子溶液加入含有氯铂酸的水中,随后加入柠檬酸钠和抗坏血酸混合溶液,在搅拌下升温至沸点,一定时间后获得铂纳米颗粒。将核酸适配体加入铂纳米颗粒溶液中,混合均匀,低温冷冻,取出后解冻,获得铂纳米颗粒
‑
核酸适配体。
20.作为优选,葡萄糖氧化酶水溶解中,葡萄糖氧化酶的浓度为0.002~0.050 mg/ml;优选为0.005~0.010mg/ml。
21.作为优选,透明质酸的水溶液中,透明质酸的浓度为1~2mg/ml;优选为1.5 mg/ml。
22.作为优选,葡萄糖氧化酶、铂纳米酶和透明质酸的质量比为1~2∶6~12∶200~400;优选为1∶5~6∶200~250。
23.搅拌组装的时间优选不低于8h;例如可以是8~24h。
24.本发明还公开了一种所述的铂纳米酶/葡萄糖氧化酶@透明质酸复合抗菌材料的应用,用于制备治疗伤口感染的抗菌药物。
25.优选地,用于制备治疗糖尿病慢性伤口感染的抗菌药物。本发明技术方案,通过所述的材料成分以及结构的联合,能够意外地产生协同性,能够有效解决铂纳米酶在糖尿病慢性伤口部位抗菌活性低的问题,有效改善糖尿病伤口的愈合。
26.进一步优选,所述的应用,用于制备金黄色葡萄球菌所致的糖尿病慢性伤口感染的药物。
27.更进一步优选,所述的应用,和药学上可接受的辅料配合,用于制备药学上可接受的任意给药途径的治疗糖尿病慢性伤口药物,优选用于制备注射给药、局部外用给药的治疗糖尿病慢性伤口感染的药物。
28.本发明还提供了一种治疗糖尿病慢性伤口药物,其包含药学有效量的所述的铂纳米酶/葡萄糖氧化酶@透明质酸复合抗菌材料。
29.作为优选,所述的治疗糖尿病慢性伤口药物,还包含药学上可接受的辅料。
30.作为优选,所述的治疗糖尿病慢性伤口药物为药学上可接受的任意剂型的药物。
31.进一步优选,所述的治疗糖尿病慢性伤口药物的给药剂型为注射制剂、局部外用制剂中的至少一种;
32.本发明中,所述的局部外用制剂优选为粉剂、涂剂、喷剂、凝胶剂、贴膏剂中的至少一种剂型。所述的注射制剂为患病部位的肌肉注射制剂,或者静脉注射制剂。
33.本发明所述的药物,能够在糖尿病伤口部位被细菌(例如常见的金黄色葡萄球菌)特异性捕获,并通过所述的材料以及结构的控制,能够协同调控体系的微环境,从而有效改善糖尿病慢性伤口抗菌效果。本发明所述的复合材料,具有低剂量、高靶向和高效治疗特点,可实现高效精准的糖尿病慢性伤口治疗,具有重要的基础研究价值与应用前景。
34.与现有技术相比,本发明的优势在于:
35.1、本发明提供了一种全新的铂纳米酶/葡萄糖氧化酶@透明质酸复合抗菌材料。本发明中,得益于所述材料的成分以及结构的联合控制,能够协同改善病原菌特异捕获率,调控微环境,改善糖尿病伤口抗菌活性。
36.2、本发明利用透明质酸酶依赖性的pagh“激活”和核酸适体
‑
细菌识别决定了抗菌的靶向性,降低毒副作用,促进伤口快速愈合。
附图说明
37.图1为实施例1中铂纳米酶在不同ph下的催化活性研究(blank:单纯的亚甲基蓝溶液;亚甲基蓝作为羟基自由基生成的指示剂,可被羟基自由基降解,其吸光度发生响应明显的变化。亚甲基蓝的最大吸收波长为665nm);
38.图2为实施例2中pagh纳米药物的稳定性研究:(a)pagh在不同体系中存放30天分散状况拍照;(b)pagh在不同体系中存放30天粒径变化情况;
39.图3为实施例3中pagh被透明质酸酶激活后,对体系ph下调研究(blank:单纯ph=8葡萄糖溶液体系);
40.图4为实施例4中pagh的透明质酸酶(haase)依赖性激活研究(blank:单纯的亚甲基蓝溶液);
41.图5为实施例5中平板涂布法表征pagh复合材料的抗菌性能;
42.图6为实施例6中pagh复合材料对小鼠糖尿病伤口的抗菌治疗研究:(a) 糖尿病小鼠伤口的实时拍照;(b)平板涂布法表征第12天小鼠伤口渗出液细菌数量;
具体实施方式
43.以下结合附图对本发明的实施例作详细说明:本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和过程,旨在易于理解本发明的技术方案特征,对本
发明的保护范围不构成任何限制。凡采用等同变换或者是等效替换而形成的技术方案,均落在本发明权利保护范围之内。
44.所述葡萄糖氧化酶(gox)和透明质酸(ha)从j&k百灵威试剂公司购买。
45.所述过氧化氢、六水合氯铂酸、柠檬酸、柠檬酸钠、抗坏血酸、硼氢化钠、亚甲基蓝均从国药集团化学试剂有限公司购买。
46.所述金黄色葡萄球菌由长沙理工大学化学与食品工程学院提供。
47.所述b6
‑
ob型糖尿病小鼠从江苏集萃药康生物有限公司购得。
48.pagh制备:
49.所述铂纳米酶/葡萄糖氧化酶@透明质酸复合抗菌材料(pagh)的合成步骤为:
50.步骤(1):制备50ml铂纳米种子溶液:
51.将3.6ml六水合氯铂酸溶液(20mm)加入46.4ml煮沸的去离子水中。1分钟后,加入11ml包含1%柠檬酸钠和0.05%柠檬酸的溶液。半分钟后,快速加入5.5 ml新鲜配置的0.08%硼氢化钠溶液(含1%柠檬酸钠和0.05%柠檬酸),随后冷却至室温,得到铂纳米种子溶液。
52.步骤(2):制备铂纳米酶(铂纳米颗粒
‑
核酸适配体):
53.在室温下将1ml铂纳米种子溶液加入29ml水中,再加入0.1ml六水合氯铂酸溶液(20mm),然后加入0.5ml含1%柠檬酸钠和1.25%抗坏血酸的溶液。最后在搅拌下升温至沸点,整个反应过程为30分钟。将得到的铂纳米颗粒用去乙醇洗涤3次,溶于15ml水中,得到0.03mg/ml铂纳米颗粒溶液。取200μl上述纳米颗粒溶液,将10μl hs
‑
ssdna(100μm)(序列为:hs
‑
aaa aaa aaa agc aatggt acg gta ctt cct cgg cac gtt ctc agt agc gct cgc tgg tcatcc cac agc tac gtc aaa agt gca cgc tac ttt gct aa)加入其中,并简单混合涡流。将该溶液放入冰箱
‑
20℃冷冻2
‑
3h后取出,在室温下融化,用去离子水清洗3次,得到铂纳米酶。
54.步骤(3):pagh装配:
55.取500μl的0.06mg/ml铂纳米酶与10μl的5mg/ml葡萄糖氧化酶溶液混合,将以上混合液加入至500μl的2mg/ml透明质酸(ha)溶液室温下磁搅拌12h,得到悬浮液,再用超纯水洗涤2
‑
3次,最后将制备的pagh纳米体系放入冷冻干燥机干燥,另分散在一定体积的超纯水中保存,以备后续待用。以下案例中,除特别声明外,所述的pagh均由该步骤制备得到。
56.实施例1:
57.铂纳米酶在不同ph下的催化活性研究
58.(1)在9个离心管中各取1ml 0.03mg/ml的铂纳米酶(由上述步骤(2)制备)溶液,离心去上清;
59.(2)分别加入去离子水(blank组)和ph分别为3,4,5,6,7,8,9,10 的pbs缓冲液各1ml;
60.(3)分别加入1μl的5mg/ml亚甲基蓝溶液和10μl的100mm过氧化氢溶液;
61.(4)37℃下各孵育8小时取出;
62.(5)测定上述9组实验溶液体系在665nm处mb(亚甲基蓝)的紫外吸收变化。
63.结果分析:基于mb染料可被
·
oh降解,并作为
·
oh生成的指示剂等性能,从图1中mb的紫外吸收变化可看出,铂纳米酶在酸性条件下催化过氧化氢产生更多的
·
oh,表现出
更好的催化活性,在ph=4时催化活性最佳。
64.实施例2:
65.稳定性研究
66.(1)将pagh纳米体系(步骤(3)制备)分别加入至去离子水(water)、生理盐水(saline)、磷酸盐缓冲液(pbs)、含10%胎牛血清的细胞培基(medium) 中;
67.(2)室温下,分别静置30天;
68.(3)图2的(a):观察并拍照记录pagh在不同体系中第1天、第5天、第 10天、第15天、第30天的分散情况变化,观察是否有沉淀生成;
69.(4)图2的(b):在第1天、第5天、第10天、第15天、第30天取不同体系中pagh测量其粒径,监测粒径变化情况。
70.结果分析:从图2(a)可以看出,从第1天到第30天,在去离子水(water)、生理盐水(saline)、磷酸盐缓冲液(pbs)、含10%胎牛血清的细胞培基(medium) 四种不同体系中,pagh均能稳定分散,没有观察到沉淀;从图2(b)可以看出,在不同体系中,pagh 30天内粒径大小变化很小,图2的(a)和(b)均说明pagh 具有良好的溶液稳定性。
71.实施例3
72.(1)取0.03mg/ml pagh溶于含有10mm葡萄糖的ph=8pbs缓冲液中;
73.(2)向上述体系加入100u/ml的haase溶液,充分混匀,在室温下反应;
74.(3)分别在反应开始后的在第0分钟,第30分钟,第60分钟,第90分钟,第 120分钟,第150分钟,第180分钟用ph计测量该体系的ph值并记录;
75.(4)以含有10mm葡萄糖的ph=8pbs缓冲液作为空白对照组。
76.结果分析:从图3可以看出,pagh被haase激活降解后,体系的ph值下降,溶液由碱性变为酸性,而对照组保持碱性。这说明pagh被haase激活后,释放出的gox能催化葡萄糖生成葡萄糖酸,降低溶液的ph。
77.实施例4
78.(1)配置3组分别含有10mm glu和5μg/ml mb的ph=8pbs溶液;其中,(a) 第1组加入100u/ml haase;(b)第2组加入0.03mg/ml pagh;(c)第3组加入 100u/ml haase和0.03mg/ml pagh(步骤(3)制备);
79.(2)37℃各孵育8小时;
80.(3)测定上述3组实验溶液体系在665nm处mb的紫外吸收变化;
81.(4)含5μg/ml mb的ph=8pbs溶液为空白对照组。
82.结果分析:从图4mb的紫外吸收变化可以看出,单独的haase或pagh存在时,不能产生
·
oh;pagh与haase共同存在的情况下,产生
·
oh降解mb,使mb的吸光度大大降低。说明pagh药物释放依赖haase的激活。
83.实施例5
84.平板涂布法表征pagh复合材料的抗菌性能
85.(1)从金葡菌斜面刮取少量细菌,溶于lb液体培养基中,37℃孵育12h;
86.(2)各取100μl菌液,溶于4组含有10mm glu的lb液体培养基中;其中, (a)第1组为对照组,不加入其他药品;(b)第2组加入pt
‑
apta@ha(步骤(3) 中,未添加gos);(c)第3组加入gox@ha(步骤(3)中,未添加铂纳米酶); (d)第4组加入0.03mg/ml pagh(上述步骤(3)制
备);
87.(3)共同37℃孵育8h;
88.(4)将以上4组稀释106,各取100μl滴在牛肉膏蛋白胨琼脂培养基表面,涂匀;
89.(5)放在恒温恒湿培养箱中孵育12h;
90.(6)取出观察菌落。
91.结果分析:观察图5发现,与对照组相比,第2组菌落数仍较多,说明单独的 pt
‑
apta@ha无杀菌效果;第3组菌落数比对照组少,但仍然有较多菌落,说明单独的gox@ha有一定杀菌效果,但效果较差;第4组几乎无菌落,说明pagh体系有好的杀菌效果。
92.实施例6
93.pagh复合材料对小鼠糖尿病伤口的抗菌治疗研究
94.(1)将b6
‑
ob糖尿病雌性小鼠分为4组,每组1只;
95.(2)在每只小鼠背部剪出一个直径约1厘米的圆形伤口;
96.(3)用50μl浓度为1
×
106cfu/ml的金葡菌液分别喷洒在4组伤口上,建立相同程度的糖尿病伤口感染模型;其中,(a)第1组伤口为对照组;(b)第2 组伤口分别在第1,3,5,7天滴加pt
‑
apta@ha溶液(同实施例5);(c)第3 组伤口分别在第1,3,5,7天滴加gox@ha溶液(同实施例5);(d)第4组伤口分别在第1,3,5,7天滴加pagh(同实施例5);
97.(4)图6的(a):分别在第0,3,6,9,12天拍照记录上述4组伤口愈合状况;
98.(5)图6的(b):在第12天分别取4组伤口渗出液,溶于lb液体培养基,孵育,用平板涂布法(同实施例5)表征伤口细菌数量。
99.结果分析:观察图6的(a)可知,在第12天,第1组和第2组伤口仍未愈合,且创面较大,说明不加以治疗糖尿病伤口难以愈合;pt
‑
apta@ha无治疗效果;第3组伤口从第9日起创面变小,至第12日观察到结痂情况,说明gox@ha具有一定治疗效果;第4组伤口从第6日起观察到结痂情况,至第12日已完全愈合,说明pagh对糖尿病伤口有良好的治疗效果。观察图6的(b)可知,第1,2组均有大量菌落,第3组仍有一定量菌落,第4组几乎无菌落,得出结论与观察图6的(a) 相同。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1