一种远程可控药物释放的结冷胶复合载药微球及其制备方法和应用与流程
本发明属于生物材料领域,具体涉及一种远程可控药物释放的结冷胶复合载药微球及其制备方法和应用。
背景技术:
创面常见于日常生活及外科手术中,若不及时治疗则容易引发感染,危害身心健康,创面修复是一个全世界医学领域关注的焦点问题。常用的创面修复方法是用药物干预伤口愈合,常见的药物递送方式有纱布敷药、口服、静脉注射和局部敷药等,微球是局部药物递送的方法之一。微球无需注射即可装载足量药物于创面处,储存药物并维持血液中药物的浓度,实现药物缓释,提高药物吸收率。此法解决了传统药物递送方法中的药物作用时间短、毒副作用大、创面透气性差的问题,在使用灵活、治疗功效、透气性、安全性方面具有独特优势,是一种值得期待的药物递送方式。传统的微球构造比较简单,功能较为单一,缺乏对结构的精细设计,无法保证载药量,性能不够理想,难以观察药物释放量,无法实现智能给药且传统的微球通常由人工合成的材料装载药物,所得微球的生物相容性较差并可能导致所装载药物及生长因子失活,其应用范围受到限制。
n-异丙基丙烯酰胺水凝胶是一种具有温度敏感性的水凝胶,其最低临界溶解温度(lcst)与人体温度相近,可以自动感知发热、感染时人体的温度变化,产生智能化相变。当身体温度高于水凝胶体积相变温度时,水凝胶收缩,人体温度正常时水凝胶恢复原状,通过n-异丙基丙烯酰胺水凝胶可逆的溶胀-收缩过程可以控制药物定时定点释放,实现智能给药。采用n-异丙基丙烯酰胺水凝胶前聚体溶液负复制光子晶体微球模板制得的n-异丙基丙烯酰胺反蛋白石结构微球在药物释放的过程中反射光谱发生变化,可以实时监测药物释放量。
结冷胶是一种来源于少动鞘氨醇单胞菌的新型微生物天然多糖,由葡萄糖、葡萄糖醛酸和鼠李糖按2:1:1的比例,四种单糖为重复结构单元组成,具有良好的稳定性,耐酸解、耐高温、热可逆,具有优异的抵抗微生物和酶的作用。在90℃左右溶于水中,含有二价阳离子且温度降低时形成透明坚实的凝胶。结冷胶凝胶用量较小,通常为琼脂和卡拉胶用量的1/3-1/2;作为一种微生物凝胶,结冷胶生产周期短且不受地理环境条件的限制,因与其他凝胶相比具有凝胶性能优越、使用量低、纯天然、便于快速生产等显著优势,在短时间内广泛应用于食品工业。
因此,在本发明中,结合以上两种水凝胶的优势,设计了一种远程可控药物释放的结冷胶复合载药微球,结冷胶的稳定性、透明度、抗微生物特性和适当的机械强度及弹性都可以和n-异丙基丙烯酰胺反蛋白石结构微球很好的结合,解决了传统微球结构简单、生物相容性较差、药物易失活、无法智能给药、难以感知药物释放量、药物释放率低的缺点。虽然壳聚糖与结冷胶相比同样具有抗菌特性,但壳聚糖交联后机械强度过大无法搭载在n-异丙基丙烯酰胺反蛋白石结构微球中以实现智能缓释的效果。结冷胶复合载药微球生物相容性好,释放效率高,可以很好的实现药物定时定点释放,并检测药物释放量,对于创面修复的药物缓释具有重要意义。
技术实现要素:
本发明针对现有技术中的不足,提供一种远程可控药物释放的结冷胶复合载药微球。
为实现上述目的,本发明采用以下技术方案制备一种远程可控药物释放的结冷胶复合载药微球:
s1、将单分散胶体粒子溶液与甲基硅油分别注入微流控装置的内相及外相,胶体粒子溶液经外相剪切后形成单分散液滴,收集入油相容器,加热固化,清洗、煅烧后制得光子晶体微球模板;
s2、将步骤s1制得的光子晶体微球模板浸入质量百分浓度为5%-20%的n-异丙基丙烯酰胺水凝胶前聚体溶液中,待其填充至光子晶体微球模板孔隙,交联固化,使用腐蚀液腐蚀光子晶体微球模板,得到n-异丙基丙烯酰胺反蛋白石结构微球;
s3、将药物加入结冷胶溶液中混合均匀得到预凝胶溶液,结冷胶溶液的质量百分浓度为0.4%-0.5%,将预凝胶溶液滴加在步骤s2所得的n-异丙基丙烯酰胺反蛋白石结构微球中,静置后滴加氯化钙溶液使体系固化,拨开固化体系中微球周围固化的结冷胶,剥离得到结冷胶复合载药微球。
为优化上述技术方案,采取的具体措施还包括:
进一步地,所述的步骤s1中单分散胶体粒子为二氧化硅、聚苯乙烯和二氧化钛中的一种。
进一步地,所述的步骤s1中内相、外相在微流控装置中的流速分别为3ml/h和0.5ml/h。
进一步地,所述的步骤s1中单分散胶体粒子溶液的质量体积浓度为20%。
进一步地,所述的步骤s2中腐蚀剂为氢氟酸、氢氧化钠溶液、焦硫酸钾溶液和四氢呋喃中的一种。
进一步地,所述的步骤s3中氯化钙溶液的质量体积浓度为10%。
进一步地,所述的步骤s3中药物为万古霉素、多粘菌素e和vegf生长因子中的一种或多种。
进一步地,所述的万古霉素在结冷胶溶液中的浓度为1×10-3-3×10-3g/ml,多粘菌素e在结冷胶溶液中的浓度为1×10-3-9×10-3g/ml,vegf生长因子在结冷胶溶液中的浓度为2×10-7-8×10-7g/ml,vegf生长因子主要起伤口愈合的作用,采用上述浓度的vegf生长因子可以使7天内结冷胶复合载药微球中药物的释放量达到40-60ng,以达到创面修复时的最佳药效;此外,多粘菌素e和万古霉素还可以起到很好的抑菌作用。
本发明的有益效果是:
(1)本发明中的n-异丙基丙烯酰胺反蛋白石结构微球通过n-异丙基丙烯酰胺水凝胶前聚体溶液负复制光子晶体微球模板得到,其内部呈纳米孔洞的有序排列,结构复杂,装载药物多,可实现智能和实时监控的药物释放且操作方法简单,技术要求不高,价格低廉。
(2)本发明设计了一种结冷胶复合载药微球,结冷胶与其它水凝胶前体相比,具有更加稳定的物理性质、优异的抗微生物特性,和n-异丙基丙烯酰胺反蛋白石结构微球交联后仍然能够保持适当的机械强度及弹性,因此使用纯天然结冷胶包裹药物和生长因子,得到的结冷胶复合载药微球可以实现药物缓释,且具有生物相容性好,药物不易变性,实用性强的优点,此外,透明的结冷胶不会影响药物缓释的智能监控。
(3)本发明可实现创面无痛给药,使用灵活,将所述的结冷胶复合载药微球敷于创面时透气性强、安全性高、创面愈合效果好。
附图说明
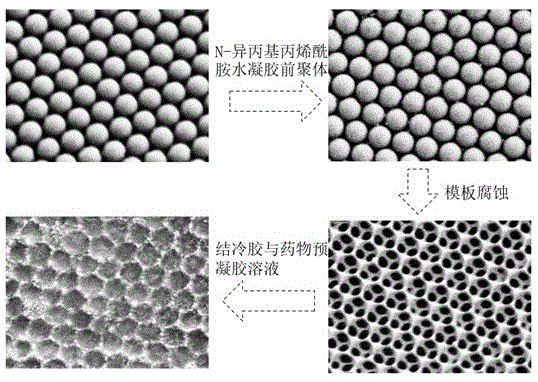
图1是结冷胶复合载药微球的制备过程(微球表面)。
图2是结冷胶复合载药微球制备过程(微球内部)。
图3是伤口愈合实验结果图。
具体实施方式
现在结合附图对本发明作进一步详细的说明。
实施例1
一种载万古霉素和多粘菌素e的结冷胶复合载药微球的制备方法,制备过程中微球表面以及内部的变化如图1和图2所示,具体制备过程包括以下步骤:
步骤s1、二氧化硅光子晶体微球模板的制备。使用液滴模板法制备二氧化硅光子晶体微球模板,配置质量体积浓度为20%的二氧化硅胶体溶液,将微流控装置充满硅油与二氧化硅胶体溶液,内相、外相在微流控装置中的流速分别为3ml/h和0.5ml/h,在微流控装置通道中,油相将水相剪切成液滴,这些液滴随后被收集在装有硅油的矩形容器中。在高温烘箱中矩形容器中的水被蒸发,二氧化硅胶体粒子自组装为有序晶格。固化过夜后,用正己烷反复洗涤除去胶体珠表面过量硅油,煅烧以增强其机械强度,煅烧后得到排列规则且整齐的二氧化硅光子晶体微球模板;
步骤s2、n-异丙基丙烯酰胺反蛋白石结构微球的制备。n-异丙基丙烯酰胺反蛋白石结构微球从光子晶体微球模板孔隙中被负复制,将二氧化硅光子晶体微球模板浸入质量百分浓度为20%的n-异丙基丙烯酰胺水凝胶前聚体溶液中8h,之后将整个体系用紫外灯照射15s后交联固化,微球内部部分交联,固化的体系浸入水中并用氢氟酸除去光子晶体微球模板后从中得到n-异丙基丙烯酰胺反蛋白石结构微球。
步骤s3、结冷胶和药物预凝胶溶液二次灌胶。预先制备5ml质量百分浓度为0.4%的结冷胶溶液,向结冷胶溶液中加入10mg的万古霉素和40mg的多粘菌素e,混合后得到预凝胶溶液,将反蛋白石结构微球浸于预凝胶溶液中4h以上,随后将质量体积浓度为10%的氯化钙溶液滴入其中以聚合固化体系使其完全固化,最后在固化体系中使用细玻璃棒拨开微球周围固化的结冷胶,即可剥离得到所述的载万古霉素和多粘菌素e的结冷胶复合载药微球。
将实施例1应用于生物相容性实验:
将实施例1所制备的结冷胶复合载药微球用紫外灯照射灭菌作为实验组后与小鼠胚胎成纤维细胞共培养,设置未添加结冷胶复合载药微球的对照组,3天后观察小鼠胚胎成纤维细胞生长情况,与对照组相比,实验组中小鼠胚胎成纤维细胞生长无明显抑制现象,表明实施例1制备的结冷胶复合载药微球具有良好的生物相容性。
实施例2
一种vegf生长因子的结冷胶复合载药微球的制备方法,包括以下步骤:
步骤s1、二氧化硅光子晶体微球模板的制备。使用液滴模板法制备二氧化硅光子晶体微球模板,首先,配置质量体积浓度为20%的二氧化硅胶体溶液,将微流控装置充满硅油与二氧化硅胶体溶液,内相、外相在微流控装置中的流速分别为3ml/h和0.5ml/h,在微流控装置通道中,油相将水相剪切成液滴,这些液滴随后被收集在装有硅油的矩形容器中。在高温烘箱中矩形容器中的水被蒸发,二氧化硅胶体粒子自组装为有序晶格。固化过夜后,用正己烷反复洗涤除去胶体珠表面过量硅油,煅烧以增强其机械强度,煅烧后得到二氧化硅光子晶体微球模板;
步骤s2、n-异丙基丙烯酰胺反蛋白石结构微球的制备。n-异丙基丙烯酰胺反蛋白石结构微球从光子晶体微球模板孔隙中被负复制,将二氧化硅光子晶体微球模板浸入质量百分浓度为20%n-异丙基丙烯酰胺水凝胶前聚体溶液中8h,之后将整个体系用紫外灯照射15s后交联固化,固化的体系浸入水中并用氢氟酸除去光子晶体微球模板后从中得到n-异丙基丙烯酰胺反蛋白石结构微球。
步骤s3、结冷胶和vegf生长因子预凝胶溶液二次灌胶。预先制备5ml质量百分浓度为0.4%的结冷胶溶液,加入2μgvegf生长因子溶解入结冷胶溶液并与vegf生长因子混合,得到预凝胶溶液,将100mg反蛋白石结构微球浸于预凝胶溶液中4h以上,预凝胶溶液的液面可以浸没所有的反蛋白石结构颗粒,随后向其中滴加质量体积浓度为10%的氯化钙溶液以聚合固化体系,使其完全固化,最后在固化体系中使用细玻璃棒拨开微球周围固化的结冷胶,即可剥离得到所述的载vegf生长因子的结冷胶复合载药微球,vegf生长因子的浓度保持在4×10-7g/ml,可以使7天内结冷胶复合载药微球中药物的释放量达到40-60ng,确保结冷胶复合载药微球的药物释放量达到创面修复时的最佳药效;。
此外,实施例1和实施例2中步骤s1使用的二氧化硅还可以替换成聚苯乙烯和二氧化钛中的任意一种,步骤s2中的氢氟酸还可以替换成氢氧化钠溶液、焦硫酸钾溶液和四氢呋喃中的任意一种,其中氢氧化钠溶液、焦硫酸钾溶液的使用浓度没有限制。
对比例1
本对比例与实施例2的区别在于将结冷胶替换为壳聚糖。
将实施例2、对比例1应用于结冷胶复合载药微球的伤口愈合实验:
建立sd大鼠创面模型,将大鼠随机分成3组:对照组(第1天将pbs溶液覆盖创面)、实验组(实施例2,第1天涂敷于创面处),对比组(对比例1,第1天涂敷于创面处),7天后观察大鼠创面面积,伤口处理前后的对比图如图3所示。从图3中可以看出,采用结冷胶复合载药微球治疗7天后的创面面积要明显小于采用pbs溶液和壳聚糖复合载药微球处理7天后的创面面积,说明采用结冷胶复合载药微球相比壳聚糖复合载药微球的治疗效果更好,由于壳聚糖交联后的机械强度过大,导致壳聚糖复合载药微球中药物的缓释效果相比结冷胶复合载药微球差,使得采用结冷胶复合载药微球用于伤口愈合的效果更好,体现了结冷胶复合载药微球良好的药物释放特性。
需要注意的是,发明中所引用的如“上”、“下”、“左”、“右”、“前”、“后”等的用语,亦仅为便于叙述的明了,而非用以限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容下,当亦视为本发明可实施的范畴。
以上仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!