右美托咪定在助眠药物制备中的应用的制作方法
1.本发明属于医疗卫生技术领域,具体涉及右美托咪定在助眠药物制备中的新应用。
背景技术:
2.失眠/失眠症是以频繁而持续的入睡困难和/或睡眠维持困难并导致睡眠感不满,进而影响日间社会功能实现的睡眠障碍。根据icsd
‑
3,其可分为慢性失眠症、短期失眠症和其他失眠症。根据病因,其又可划分为原发性失眠和继发性失眠。
3.市场调研显示,美国失眠用药主要涉及唑吡坦、右佐匹克隆、扎来普隆、苏沃雷生和多虑平,其中唑吡坦用量占比达80%以上。唑吡坦以片剂形式给药,目前对于其剂型的改良舌下膜剂、喷雾剂均没有取得成功,经过口服给药的改良缓释片剂获得了一定程度的成功。中国失眠用药中右佐匹克隆、佐匹克隆、唑吡坦三药三分天下,三药均为口服片剂制剂。结合以上,目前主流的失眠药仍以口服制剂为主。在用药风险方面:唑吡坦类的镇静/催眠药可以导致发生身体和精神依赖,依赖的风险随着剂量和治疗时间的增加而提高,在有精神异常和/或酒精或药物依赖史的患者中风险可能更高;佐匹克隆过量服用可导致深睡甚至昏迷。由此,目前市场上的以口服制剂为主的助眠药,还在用药安全性和副作用方面存在风险。
4.右美托咪定,dexmedetomidine,(+)
‑4‑
[(s)
‑1‑
(2,3
‑
二甲基苯基)乙基]
‑
1h
‑
咪唑,由orion pharma和abbott公司共同开发。目前的已上市剂型为注射剂,适应症为用于行全身麻醉的手术患者气管插管和机械通气时的镇静以及用于重症监护治疗期间开始插管和使用呼吸机病人的镇静。在此基础上,行业内对右美托咪定药物进行了进一步的开发。
[0005]
oluwaseun johnson
‑
akeju(dexmedetomidine promotes biomimetic non
‑
rapid eye movement stage 3sleep in humans:a pilot study;oluwaseun akeju.clinical neurophysiology,201801,1(129))披露的一项前瞻性实验显示,右美托咪定注射液剂量和缩短诱导睡眠时间为正相关,并且在健康受试者身上未观察到严重的不良事件。oluwaseun johnson
‑
akeju主导的一项临床试验(clinicaltrials.gov编号:nct02818569),进行了右美托咪定口服治疗诱导和维持安宁睡眠的安全性和有效性相关研究。oluwaseun johnson
‑
akeju的研究还指出,由于志愿者经常抱怨静脉注射部位整夜受到刺激,这项研究中右美托咪定促进睡眠的作用可能被低估了。也即意味着对于该特定适应症睡眠障碍,静脉注射对给药部位造成刺激不利于药效的发挥,需要进一步探索用于制备治疗睡眠障碍的无创、方便、高效的右美托咪定制剂,遗憾的是,该研究并未提供其它制剂或给药方案的实验或启示。
[0006]
公开号为wo2016061413a1的pct国际专利申请提供了右美托咪定经口腔粘膜施用(舌下)的组合物,该组合物可用于治疗睡眠失调,例如失眠症。其大鼠舌下动物实验结果显示:大于40ug/kg显著延长睡眠总时间,20~40ug/kg显著减低睡眠潜伏期(入睡时间)。然而基于对神经解剖学的理解,睡眠中枢主要位于脑干、下丘脑等部位,通过口腔粘膜或舌下递
送药物到该作用部位的效率可能仍然有限。并且,口腔粘膜或舌下很难避免吞咽经胃肠道吸收和首过效应的情况,从而影响药物作用的稳定发挥。
[0007]
袁友红(右美托咪定对术后失眠的疗效观察;袁友红.中国实用医药,201608,11(24))进行了1μg/kg和0.5μg/kg静脉泵注右美托咪定对术后失眠影响的研究,结果显示静脉泵注右美托咪定可以安全有效的改善术后失眠。其进一步提及了由于静脉剂型限制,在推广上有一定的局限性;若做成口服缓释剂,可明显增加患者的依从性。
[0008]
以上是右美托咪定关于失眠相关的近期研究进展披露。可知:
①
目前右美托咪定仍仅作为镇静的注射制剂市售。该剂型下的失眠症的新适应症相关研究,虽然证实了右美托咪定注射液缩短睡眠潜伏期、延长睡眠时间和剂量呈正相关。然而由于注射液剂型的特点限制,注射用药后人体最大血药浓度与注射剂量密切相关,故注射剂型开发时欲通过提升剂量的方式延长睡眠时间和缩短睡眠潜伏期,就不得不考虑高剂量注射剂带来过高血药浓度引起的副作用影响。
②
右美托咪定注射液剂型用于失眠症,其还存在与用于镇静适应症时相同的低血压、心动过缓及口干等副作用问题。
③
由于注射剂剂型本身限制,其必须由健康护理专业人员静脉内给药,一般难以在没有医院设施和专业技能的情况下使用。
④
虽然袁友红等披露了可以尝试将其研制成类似其他失眠症常见主流药物剂型的口服制剂,但是由于高首过消除效应,经胃口服右美托咪定很可能具有较低的全身生物利用度和更大的反应变异性,临床效果难以预期。综上,如何克服现有缺陷,开发出便于自我施用的右美托咪定失眠症药物,并取得相当的临床效果预期和更低的副作用,是迫切的临床需求。
技术实现要素:
[0009]
基于背景介绍,现有失眠症主要治疗药物以经口口服制剂为主,右美托咪定由于其本身性质原因改良为口服制剂的临床效果难以预期。舌下粘膜施用的右美托咪定方案,避免了胃肠消除效应影响,但其介入途径仍是与传统失眠症主要治疗药物的途径一致,并存在给药面积有限,给药剂量有限,给药后体内变异系数高等问题。
[0010]
依托本发明申请人企业自主研发的右美托咪定鼻喷制剂平台优势,本发明进一步提出了经鼻给予右美托咪定以治疗失眠症的设想,并发现,与空白制剂相比较,右美托咪定经鼻制剂药物在缩短睡眠潜伏期、延长睡眠时间、缩短药物起效时间、延长持续作用时间等的某一方面或者多方面均有积极的显著差异。即使与注射剂相比较,右美托咪定经鼻制剂药物在缩短睡眠潜伏期、延长睡眠时间、缩短药物起效时间、延长持续作用时间、更低的副作用等的某一方面或者多方面也具有相当或更好的积极效果。具体的,本发明鼻喷制剂具备无首过效应、使用方便、适应吞咽障碍患者的优势。在用药时,75ug~200ug及以上均可发挥药效,药效持续时间与缩短入睡时间与剂量呈正相关,且药效(睡眠深度)与剂量非正相关,维持最低有效血药浓度即起到助眠效果。也即意味着剂量虽然增加,睡眠深度与剂量非正相关,不呈现剂量依赖,不会出现深睡甚至昏迷的风险,治疗窗宽,安全性高,无过量使用风险。此外,本发明的鼻喷制剂在应用于助眠药物时,与注射剂相比,还能够降低低血压副作用,安全性更高。
[0011]
基于以上发现,本发明提供了右美托咪定在制备治疗失眠症的药物中的应用,该药物为经鼻给药剂型,具体的经鼻给药剂型可以是多种具体形式,例如滴鼻剂、鼻喷制剂等。
[0012]
相应的,提供失眠症的治疗方法,该治疗方法是经鼻向受试者给予有效量的右美托咪定药物,药物优选以滴鼻剂或鼻喷制剂的形式经鼻给予有效量的右美托咪定。
[0013]
再相应的,提供一种治疗失眠症的药物,该药物包含治疗有效量的右美托咪定或其药学上可接受的盐、溶剂化物或其异构体,其被配制成适于经鼻递送的剂型,优选为经鼻给药的滴鼻剂或鼻喷制剂。
[0014]
以上应用、治疗方法、药物中本发明所提供的治疗失眠症的药物中,根据本发明的具体实施方案:
[0015]
所对应治疗的失眠症可选自原发性失眠症或继发性失眠症。失眠症的相关表现可包括入睡困难、睡眠维持障碍、睡眠时间过短或睡眠原因导致的疲劳萎靡不振、专注力记忆力下降、情绪不稳、日间瞌睡或社交生活功能损害中的任意一种以上。
[0016]
失眠症尤其是继发性失眠症常常伴发着其他生理或心理因素影响,出于失眠症的治疗效果考量,所述药物还可以与除右美托咪定外的第二治疗剂进行联用,第二治疗剂可预混在右美托咪定药物中共同给药,也可以作为单独制剂与右美托咪定药物先后给药;第二治疗剂可选为镇静催眠剂或抗抑郁药剂,优选为bzds药物、nbzds药物、褪黑素、褪黑素受体激动剂、食欲素受体激动剂、巴比妥类药物、ssri药物、snri药物、ndri药物、sari药物、nri药物、nassa药物、maoi药物、三环类药物、四环类药物,更优选艾司唑仑、三唑仑、地西泮、阿普唑仑、劳拉西泮、氯硝西泮、佐匹克隆、右佐匹克隆、唑吡坦、扎来普隆、雷米替胺、苏沃雷生、戊巴比妥钠、曲唑酮、米氮平、氟伏沙明、多塞平、氟西汀、帕罗西汀、舍曲林、西酞普兰、艾司西酞普兰、文拉法辛、度洛西汀、安非他酮、奈法唑酮、瑞波西汀、吗氯贝胺、阿米替林、氯米帕明或米安色林。
[0017]
所称药物中右美托咪定的可选浓度为0.001%~1.3%,优选为0.0125%~0.7%,更优选为0.006%~0.108%。相应的,右美托咪定以盐酸右美托咪定存在时,盐酸右美托咪定在药物中的优选浓度为0.006%~1.54%,更优选为0.015%~0.83%,更优选为0.007%~0.13%。所称药物为鼻喷制剂时的右美托咪定每揿释放量优选为2.5~650μg。所称药物为鼻喷制剂时的喷雾粒径dv90值优选为50~152.1μm,更优选为52~142μm,进一步优选为51~66μm、66~81μm、81~104μm或104~152.1μm。喷雾粒径dv90值的大小可通过添加的增稠剂的量进行控制,控制喷雾颗粒dv90值有助于控制得到独特的药时曲线,以适于特定目的的临床施用。
[0018]
进一步的验证研究中发现,在右美托咪定药物中,相比于“苯基乙醇”或“山梨酸钾和edta
‑
2na的防腐组合”,防腐剂选择为苯扎氯铵时,右美托咪定鼻喷剂的稳定性有非常显著的增强。数据显示,选择“山梨酸钾和edta
‑
2na的防腐组合”时,总杂在加速10天即已超过1%,进一步的高温实验中更是达到了4.33%,显著超出了可控水平;选择“苯基乙醇”时,高温30d后,其api含量下降到92%左右,其总杂含量上升到了1.6%,显著超出了可控水平;而选择为苯扎氯铵时,室温10天和加速实验30天均未检出有关物质,高温30天过程中虽检出了有关物质(总杂0.06%),但也仍在很低的范围内。进一步的深入研究发现,载剂为水时,本发明的经鼻制剂在特定的防腐剂选择下,其处方稳定性均有着显著的增强。该些特定的防腐剂为阳离子表面活性剂类防腐剂例如苯扎氯铵、苯扎溴铵或苄索溴铵,对羟基苯甲酸酯类防腐剂例如对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯、对羟基苯甲酸丁酯、对羟基苯甲酸异丙酯、对羟基苯甲酸异丁酯、对羟基苯甲酸丙酯钠或对羟基苯甲酸甲
酯钠,非芳香的醇类防腐剂例如丙二醇或三氯叔丁醇。基于以上发现,本发明的右美托咪定鼻喷剂的防腐剂可选择为苯扎氯铵、苯扎溴铵、丙二醇、三氯叔丁醇、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯中的一种或两种以上的组合。防腐剂选择为苯扎氯铵或苯扎溴铵时,其浓度可选为0.002%以上,优选0.01%以上,更优选0.02%以上,更优选为0.01%~0.2%。防腐剂选择为对羟基苯甲酸甲酯时,其浓度可选为0.01%以上,优选为0.01%~0.25%。防腐剂选择为对羟基苯甲酸丙酯时,其浓度可选为0.01%以上,更优选为0.02%以上,更优选为0.02%~0.075%。防腐剂选择为丙二醇时,其浓度可选为0.05%以上,优选为0.05%~30%,更优选为0.1%~10%。防腐剂选择为三氯叔丁醇时,其浓度可选为0.05%以上,优选为0.05%~0.75%。防腐剂选择为对羟基苯甲酸甲酯和对羟基苯甲酸丙酯两种复配时,两者浓度依次可选为0.01%以上和0.01%以上,两者浓度依次优选为0.01%~0.25%和0.01%~0.075%,两者浓度依次更优选为0.02%~0.04%和0.01%~0.02%。防腐剂选择为丙二醇和苯扎氯铵两种复配时,两者浓度依次可选为0.1%以上和0.01%以上,两者浓度依次优选为0.1%~10%和0.01%~0.2%。载剂水的类型可以是药学可接受的种类,包括但不限于纯化水、注射用水等等。以上本发明所筛选出的防腐剂单方或复方组合还可选择配合抗氧剂共同使用,抗氧剂可选择为edta
‑
2na、bha叔丁基羟基茴香醚、bht2,6
‑
二叔丁基
‑4‑
甲基苯酚、焦亚硫酸钠、焦亚硫酸钾、丁基羟基苯甲醚、l
‑
抗坏血酸棕榈酸酯、硫代硫酸钠和维生素e中的一种或两种以上的组合。此外,根据本发明的具体实施例验证,本发明的防腐剂还可选择为山梨酸钾,但当防腐剂选择为山梨酸钾时制剂处方中应不包含edta
‑
2na,此时山梨酸钾的浓度可选择为0.01%~0.2%。
[0019]
当所称药物选择为经鼻制剂尤其是鼻喷制剂时,不同的增稠剂对其喷雾性能有着迥异的影响,在综合考虑粘度和喷雾形态多种因素下,为了获得良好的鼻喷喷雾性能,优选添加以下增稠剂,增稠剂为聚维酮类增稠剂、纤维素醚类增稠剂、粘多糖类增稠剂和聚丙烯酸类增稠剂中的一种或两种以上的组合,聚维酮类增稠剂可选为pvp k30或pvp k90,纤维素醚类增稠剂可选为微晶纤维素
‑
羧甲基纤维素钠复合物、羟丙甲纤维素、甲基纤维素、羧甲基纤维素、羧甲基纤维素钠或羟乙基纤维素,粘多糖类增稠剂可选为透明质酸钠或硫酸软骨素,聚丙烯酸类增稠剂可选为卡波姆。增稠剂选择为pvp k30时,其浓度可选为0.1%~5.0%。增稠剂选择为微晶纤维素
‑
羧甲基纤维素钠复合物时,其浓度可选为0.1%~3.0%。增稠剂选择为羟丙甲纤维素时,其浓度可选为0.1~5.0%,优选为0.2%~1.5%。增稠剂选择为透明质酸钠时,其浓度可选为0.01%~1.0%。增稠剂选择为卡波姆时,其浓度可选为0.05%~1.0%。所选择的增稠剂,在具有一定粘度增强(1.07mpa.s~8.24mpa.s)以提升鼻腔药物滞留量的基础上,还能使得右美托咪定药物保持良好的喷雾角(46.3
°
~53.1
°
)和喷雾宽度([3cm处喷雾宽度,1.8cm~2.8cm]、[6cm处喷雾宽度,0.5cm~3.8cm]),且无刺激性。
附图说明
[0020]
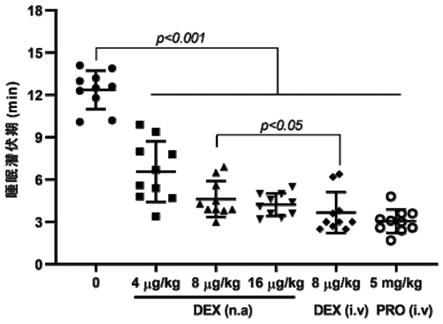
图1是本发明试验例2中盐酸右美托咪定经鼻制剂对小鼠睡眠潜伏期的影响;
[0021]
图2是本发明试验例2中盐酸右美托咪定经鼻制剂对小鼠睡眠时间的影响;
[0022]
图1和图2中:
[0023]
统计学:mean
±
sd,n=10。dex:盐酸右美托咪定;pro:异丙嗪;n.a:经鼻给药;i.v:注射给药。
[0024]
图3是本发明试验例3中盐酸右美托咪定经鼻制剂对小鼠睡眠潜伏期的影响;
[0025]
图4是本发明试验例3中盐酸右美托咪定经鼻制剂对小鼠睡眠时间的影响;
[0026]
图3和图4中:
[0027]
统计学:mean
±
sd,n=10。dex:盐酸右美托咪定;pro:异丙嗪;n.a:经鼻给药;i.v:注射给药。
具体实施方式
[0028]
下面结合附图及具体实施例对本发明做进一步阐释。
[0029]
本文中,除非另有规定定义,所采用的科技术语均遵照行业通常理解。
[0030]
本文中,遵照行业通常习惯,如无特别额外规定,所出现的百分含量例如“%”,均指代重量百分含量。本发明的制剂处方中,处方溶液体系的密度以1g/ml进行近似折算。例如以2.4mg盐酸右美托咪定,添加水定量至10ml的体系,其盐酸右美托咪定体系浓度为0.24mg/ml,处方溶液体系的密度以1g/ml进行近似折算后,盐酸右美托咪定体系的重量百分比浓度为0.024%;同理的,此时以右美托咪定计,折算后浓度为0.2mg/ml,重量百分比浓度为0.02%。
[0031]
本文中,盐酸右美托咪定和右美托咪定之间的重量换算系数以1.1822近似计算,之间换算时遵循四舍五入的计数保留方式。如无特别声明或行业习惯约束,本文中其他类似处需要计算的数据也沿用四舍五入的计数保留方式。
[0032]
本文中,各所列组分的具体数据数值,可涵盖上下10%含量变化的浮动。例如“右美托咪定浓度0.02%”可实际涵盖0.02%
±
0.002%,也即0.018%~0.022%的浓度范围。
[0033]
本文中,如无特别额外声明,所选用的试剂、仪器等材料均为普通市售产品,可通过常规市场采购获取。
[0034]
本文中,“有效量”一般表示能够引起生物学的或医学的响应的活性化合物或药剂的量,生物学的或医学的响应可以是人、动物个体、系统模型、组织、体外细胞等层面,其一般是由医药研究员、医生或临床医师等在实验中或临床中研究得到的。“生物学的或医学的响应”可以是病症或与病症关联症状的康复、消除、减缓或抑制、或预防等。“量”一般可根据受试对象的具体情形适应性决定具体的量,并对于有特定共同特征的受试对象亦可以确定一相对普适的范围。在本发明中,“有效量”亦可优选指代一些具体实施例中所描述的具体量或它们共同支持概括的范围。
[0035]
本发明中的术语及缩略语代号标识如下:
[0036]
dex:dexmedetomidine的简写,即右美托咪定
[0037]
edta
‑
2na:依地酸二钠的简写
[0038]
k90:pvp k90的简写,即聚乙烯吡咯烷酮k90,也称聚维酮k90、povidone k90
[0039]
k30:pvp k30的简写,即聚乙烯吡咯烷酮k30,也称聚维酮k30、povidone k30
[0040]
hec 250m:hydroxyethylmethyl cellulose 250m的简写,还简写作hec
‑
m,即羟乙基纤维素250m
[0041]
hec 250hx:hydroxyethylmethyl cellulose 250hx的简写,还简写作hec
‑
h,即羟乙基纤维素250hx
[0042]
透明质酸钠:即sodium hyaluronate
[0043]
cl
‑
611:的简写,即艾维素商品名,由fmc biopolymer公司生产,通用名为微晶纤维素
‑
羧甲基纤维素钠复合物,也即microcrystalline cellulose and cellulose gum
[0044]
rl
‑
591:的简写,即商品名,由fmc biopolymer公司生产,通用名为微晶纤维素
‑
羧甲基纤维素钠复合物,也即microcrystalline cellulose and cellulose gum
[0045]
hpmc e50:hydroxypropyl methylcellulose e50的简写,即羟丙甲纤维素e50、也写作羟丙基甲基纤维素e50、羟丙甲基纤维素e50
[0046]
tcb:trichloro
‑
t
‑
butyl alcohol的简写,也称2
‑
trichloromethyl
‑2‑
propanol、chlorobutanol,即三氯叔丁醇
[0047]
pe:phenylethyl alcohol的简写,即苯基乙醇
[0048]
甲酯:对羟基苯甲酸甲酯的简写,也称尼泊金甲酯、methylparaben
[0049]
丙酯:对羟基苯甲酸丙酯的简写,也称尼泊金丙酯、propylparaben
[0050]
bkb:苯扎溴铵,也即benzalkonlum bromide
[0051]
bkc:苯扎氯铵,也即benzalkonium chloride
[0052]
cbp:carbopol的简写,即卡波姆
[0053]
pg:propylene glycol的简写,即丙二醇
[0054]
实施例:
[0055]
本实施例具体提供一种治疗失眠症的药物右美托咪定鼻喷制剂的制备获取方式,其通用方法步骤为:称取api(指右美托咪定或其药学上可接受的盐、溶剂化物或其异构体)和辅料(辅料包含渗透压调节剂、防腐剂、增稠剂和抗氧剂等,辅料视配方情况选择性添加),添加适量纯化水溶解,可选的使用ph调节剂调节体系ph至4~7的预定范围,然后添加载剂水定容,混匀即得右美托咪定经鼻制剂。可选的分装入中硼硅玻璃瓶,组装上计量泵,轧盖,安装上推钮,即进一步制得右美托咪定鼻喷制剂。
[0056]
在一些具体的实施例中,提供了不同活性成分浓度的实例,所提供的右美托咪定经鼻制剂中右美托咪定以盐酸右美托咪定的形式存在,以右美托咪定计,其浓度分别为0.006%、0.02%、0.0592%、0.0593%、0.108%、0.01%、0.03%、0.04%、0.05%、0.07%、0.1%、0.2%、0.4%、0.7%、1%或1.3%。
[0057]
在另一些具体的实施例中,提供数种不同规格的右美托咪定鼻喷制剂。该鼻喷制剂包括药液部分和装置部分,装置内预载药液。装置包含计量给药装置,其由相互配合的计量泵和容器组成,容器的材质以塑料、低硼硅玻璃、中硼硅玻璃三种实施方式呈现,计量泵上设致动器。在致动器的控制下,以揿给药,再通过控制药液的右美托咪定含量浓度以及每揿的总药量,进行右美托咪定的定量每揿5μg、10μg、15μg、20μg、25μg、30μg、40μg、50μg、60μg、75μg、100μg或125μg给药。具体使用时,可以进行单次或多次鼻喷给药。
[0058]
在另一些具体的实施例中,经鼻制剂的体系ph为4~7,其可通过ph调节剂酸化剂和/或碱化剂调节,酸化剂包括盐酸、磷酸、酒石酸、柠檬酸、苹果酸、富马酸和苹果酸,碱化剂包括氨水、氢氧化钠、氢氧化钾、碳酸氢钠、碳酸钠、碳酸铵和硼砂;ph调节剂可进一步优选为盐酸、磷酸、酒石酸、柠檬酸、苹果酸、富马酸、苹果酸、氨水、氢氧化钠、氢氧化钾、碳酸氢钠、碳酸钠、碳酸铵和硼砂中的一种或两种以上的组合。
[0059]
在另一些具体的实施例中,经鼻制剂的渗透压可通过渗透压调节剂的浓度予以控制,渗透压调节剂为离子型或非离子型,离子型渗透压调节剂包括硼酸、氯化钠、氯化钙、氯化镁、氯化锌或氯化钾,非离子型渗透压调节剂包括无水葡萄糖、一水葡萄糖、右旋糖酐、甘油或d
‑
甘露糖醇;所述渗透压调节剂优选为硼酸、氯化钠、氯化钾、无水葡萄糖、一水葡萄糖、右旋糖酐、甘油和d
‑
甘露糖醇中的一种或两种以上的组合,所述渗透压调节剂尤其是优选为氯化钠或氯化钾,其浓度优选0.7%~1%。
[0060]
以下为数个典型实施例的配方表,该些典型实施例中的ph是通过1n氢氧化钠和1n盐酸调节的。
[0061]
[0062]
[0063][0064]
注[1]:处方量盐酸右美托咪定按右美托咪定计,盐酸右美托咪定和右美托咪定的换算系数为1.1822
[0065]
注[2]:“/”代表对应处方中不添加该类物质。
[0066]
试验例
[0067]
在前述实施例的基础上,参照《新药(西药)临床前研究指导原则汇编》神经系统药物药效学指导原则“镇静催眠药”章节等资料对右美托咪定经鼻制剂进行试验研究。
[0068]
试验例1:盐酸右美托咪定经鼻制剂对小鼠自主活动影响试验
[0069]
1.试验准备
[0070]
1.1试验药剂
[0071]
供试品、对照品和溶媒准备:
[0072]
供试品、溶媒制备:按下表比例分别称取盐酸右美托咪定(如配方中有)、氯化钠和苯扎氯铵,添加适量水溶解,调节ph至4.5~5.5,加水定容至100%,装入玻璃瓶,组装上计量泵,安装推钮,即得供试品和溶媒。作为供试品的盐酸右美托咪定鼻喷制剂每喷50μl,每喷含10μg右美托咪定(以游离右美托咪定计)。作为溶媒的盐酸右美托咪定鼻喷制剂(空白制剂)每喷50μl,每喷含0μg右美托咪定(以游离右美托咪定计)。
[0073][0074]
注:[1]以右美托咪定计。
[0075]
[2]苯扎氯铵以n
‑
c
12
h
25
和n
‑
c
14
h
29
同系物的总量之和折纯并折干计算。
[0076]
[3]“/”表示不添加该物质。
[0077]
对照品一准备:普通市售采购盐酸右美托咪定注射液作为对照品一。盐酸右美托咪定注射液规格:200μg/2ml(以右美托咪定计)。
[0078]
对照品二准备:普通市售采购盐酸异丙嗪注射液作为对照品二。盐酸异丙嗪注射液规格:50mg/2ml。工作液配制:
[0079]
盐酸右美托咪定经鼻制剂工作液配制:取供试品盐酸右美托咪定鼻喷制剂原液适量,加入不同体积的溶媒盐酸右美托咪定鼻喷制剂(空白制剂)原液,分别配制成24、48、96μg/ml的盐酸右美托咪定经鼻制剂工作液。
[0080]
盐酸右美托咪定注射液工作液配制:取盐酸右美托咪定注射液原液适量,用氯化钠注射液稀释成1.6μg/ml的盐酸右美托咪定注射液工作液。
[0081]
盐酸异丙嗪工作液配制:取盐酸异丙嗪注射液原液适量,用氯化钠注射液稀释成0.5mg/ml盐酸异丙嗪工作液。
[0082]
1.2试验动物
[0083]
小鼠,icr品系,spf级,雄性30只,雌性30只。雄性小鼠平均体重约为30g,雌性小鼠平均体重约为24g。
[0084]
60只小鼠,根据性别及给药前自主活动数(行走路程),采用分层随机法分组,将动物分为6组,分别为溶媒对照组、盐酸右美托咪定经鼻制剂8μg/kg组、盐酸右美托咪定经鼻制剂16μg/kg组、盐酸右美托咪定经鼻制剂32μg/kg组、盐酸右美托咪定注射液16μg/kg组、异丙嗪5mg/kg组。
[0085]
2.试验方案
[0086]
2.1给药方案
[0087]
[0088][0089]
注:n.a:(移液器)滴鼻给药;i.v:(尾静脉)注射给药
[0090]
给药前将各组小鼠放于自主活动仪内,检测10min内自主活动(行走路程和速度)。根据上表对各组小鼠进行给药,给药后即刻将小鼠放置于自主活动仪内。检测给药后10、30、60和90min的自主活动,检测每个时间点前后5分钟内的小鼠行走路程和速度,并与各组小鼠给药前的行走路程进行比较,计算行走路程抑制率和行走速度抑制率。
[0091][0092][0093]
2.2数据统计
[0094]
用excel软件录入小鼠行走路程和速度。spss软件进行统计分析和回归计算小鼠行走路程ed
50
。将各剂量组小鼠行走路程和速度分别作方差齐性检验。若方差齐(p>0.05)则做单因素方差分析,有显著性差别(p≤0.05),则各剂量组与对照组间做dunnett检验;否则检验结束。若方差不齐(p≤0.05),则进行非参数检验(kruskal
‑
wallis h检验,即k
‑
w h检验),如k
‑
w h检验有统计学差异(p≤0.05),则各剂量组与对照组间做mann
‑
whitney u检验;否则检验结束。
[0095]
3.试验结果
[0096]
盐酸右美咪定经鼻制剂对小鼠行走路程的抑制率(mean
±
sd,%)
[0097][0098]
注:与溶媒对照组比较:
*
p<0.05,
**
p<0.01,
***
p<0.001;与盐酸右美托咪定注射液16μg/kg组比较:
#
p<0.05,
##
p<0.01,
###
p<0.001。
[0099]
盐酸右美咪定经鼻制剂对小鼠行走速度的抑制率(mean
±
sd,%)
[0100][0101][0102]
注:与溶媒对照组比较:
*
p<0.05,
**
p<0.01,
***
p<0.001;与盐酸右美托咪定注射液16μg/kg组比较:
#
p<0.05,
##
p<0.01,
###
p<0.001。
[0103]
参见上表小鼠行走路程和行走速度的抑制率统计结果。
[0104]
盐酸右美托咪定经鼻制剂8、16和32μg/kg滴鼻给药后10和30min对小鼠行走路程的抑制率分别为4.9%、15.0%、74.5%和14.2%、23.5%、69.3%,呈剂量依赖性抑制自主活动且与溶媒对照比较均有显著性差异(p<0.01~0.001)。经鼻制剂给药后10min对小鼠行走路程的ed
50
为24.2μg/kg,给药后30min对小鼠行走路程的ed
50
为23.4μg/kg。盐酸右美托咪定注射液16μg/kg静注给药后10和30min对小鼠行走路程的抑制率明显高于盐酸右美托咪定经鼻制剂8和16μg/kg(p<0.05~0.001),与盐酸右美托咪定经鼻制剂32μg/kg无明显差异。
[0105]
盐酸右美托咪定经鼻制剂8、16和32μg/kg滴鼻给药后10和30min对小鼠行走速度的抑制率分别为71.6%、74.6%、92.4%和74.3%、77.1%、90.8%,呈剂量依赖性且与溶媒对照比较均有显著性差异(p<0.05~0.001)。盐酸右美托咪定注射液16μg/kg静注给药后10和30min对小鼠行走速度的抑制率明显高于盐酸右美托咪定经鼻制剂8和16μg/kg(p<0.05~0.01),与经鼻制剂32μg/kg无明显差异。阳性对照异丙嗪5mg/kg静脉注射,在给药后60min对小鼠行走速度抑制率为86.4%,与溶媒对照比较有显著性差异(p<0.01)。
[0106]
盐酸右美托咪定经鼻制剂32μg/kg滴鼻给药与盐酸右美托咪定注射液16μg/kg静注给药对小鼠自主活动的抑制作用强度基本一致。对两者的作用时效进一步分析显示,经鼻制剂32μg/kg滴鼻给药后60和90min对小鼠行走路程的抑制率分别为41.1%(p<0.01)和66.0%。注射剂16μg/kg静注给药后30和60min对小鼠行走路程的抑制率分别为79.5%(p<0.001)和8.4%。因此,相同的作用强度下,盐酸右美托咪定经鼻制剂滴鼻给药药效持续时间在60~90min之间,静脉注射剂注射给药药效持续时间在30~60min之间。
[0107]
综上,结论:
[0108]
与溶媒对照相比,盐酸右美托咪定经鼻制剂呈剂量依赖性抑制小鼠自主活动。盐酸右美托咪定经鼻制剂对小鼠作用起效时间为给药后10min内。
[0109]
与静注给药相比,盐酸右美托咪定经鼻制剂32μg/kg滴鼻给药可达到与盐酸右美托咪定注射液16μg/kg静注给药基本一致的小鼠自主活动抑制作用强度。相比于静注给药,盐酸右美托咪定经鼻制剂经鼻给药拥有更长的药效持续时间。
[0110]
试验例2:盐酸右美托咪定经鼻制剂延长戊巴比妥钠睡眠试验
[0111]
1.试验准备
[0112]
1.1试验药剂
[0113]
供试品、对照品和溶媒准备:
[0114]
供试品、溶媒制备:按下表比例分别称取盐酸右美托咪定(如配方中有)、氯化钠和苯扎氯铵,添加适量水溶解,调节ph至4.5~5.5,加水定容至100%,装入玻璃瓶,组装上计量泵,安装推钮,即得供试品和溶媒。作为供试品的盐酸右美托咪定鼻喷制剂每喷50μl,每喷含10μg右美托咪定(以游离右美托咪定计)。作为溶媒的盐酸右美托咪定鼻喷制剂(空白制剂)每喷50μl,每喷含0μg右美托咪定(以游离右美托咪定计)。
[0115][0116]
注:[1]以右美托咪定计。
[0117]
[2]苯扎氯铵以n
‑
c
12
h
25
和n
‑
c
14
h
29
同系物的总量之和折纯并折干计算。
[0118]
[3]“/”表示不添加该物质。
[0119]
对照品一准备:普通市售采购盐酸右美托咪定注射液作为对照品一。盐酸右美托咪定注射液规格:200μg/2ml(以右美托咪定计)。
[0120]
对照品二准备:普通市售采购盐酸异丙嗪注射液作为对照品二。盐酸异丙嗪注射液规格:50mg/2ml。工作液配制:
[0121]
盐酸右美托咪定经鼻制剂工作液配制:取盐酸右美托咪定鼻喷制剂原液适量,加入不同体积的盐酸右美托咪定鼻喷制剂(空白制剂),分别配制成12、24、48μg/ml的盐酸右美托咪定经鼻制剂工作液。
[0122]
盐酸右美托咪定注射液工作液配制:取盐酸右美托咪定注射液原液适量,用氯化钠注射液稀释成0.8μg/ml的盐酸右美托咪定注射液工作液。
[0123]
盐酸异丙嗪工作液配制:取盐酸异丙嗪注射液原液适量,用氯化钠注射液稀释成0.5mg/ml盐酸异丙嗪工作液。
[0124]
1.2试验动物
[0125]
小鼠,icr品系,spf级,雄性30只,雌性30只。雄性小鼠平均体重约为30g,雌性小鼠平均体重约为24g。
[0126]
60只小鼠,根据性别及体重,采用分层随机法分组,将动物分为6组,分别为溶媒对照组、盐酸右美托咪定经鼻制剂4μg/kg组、盐酸右美托咪定经鼻制剂8μg/kg组、盐酸右美托咪定经鼻制剂16μg/kg组、盐酸右美托咪定注射液8μg/kg组、异丙嗪5mg/kg组。
[0127]
2.试验方案
[0128]
2.1给药方案
[0129][0130][0131]
注:n.a:(移液器)滴鼻给药;i.v:(尾静脉)注射给药
[0132]
根据预试验结果,小鼠腹腔注射40mg/kg戊巴比妥钠后,12.4min左右小鼠翻正反射消失。将小鼠戊巴比妥钠阈上剂量设定为40mg/kg。
[0133]
各组小鼠根据上表给予各剂量药物,给药后即刻腹腔注射阈上剂量戊巴比妥钠40mg/kg(4mg/ml,0.1ml/10g体重),记录戊巴比妥钠注射时间、翻正反射消失时间、翻正反射恢复时间。以小鼠双侧翻正反射消失60s作为入睡标准。分别计算睡眠潜伏期和睡眠时间。
[0134]
睡眠潜伏期=翻正反射消失时间
‑
戊巴比妥钠注射时间
[0135]
睡眠时间=翻正反射恢复时间
‑
翻正反射消失时间
[0136][0137]
2.2数据统计
[0138]
用excel软件录入戊巴比妥钠注射时间、翻正反射消失时间、翻正反射恢复时间,并计算成睡眠潜伏期和睡眠时间。采用graphpad prism8软件作图,spss软件进行统计分析和回归计算小鼠睡眠潜伏期ed
50
。将各剂量组睡眠潜伏期和睡眠时间分别作方差齐性检验。若方差齐(p>0.05)则做单因素方差分析,有显著性差别(p≤0.05),则各剂量组与对照组间做dunnett检验;否则检验结束。若方差不齐(p≤0.05),则进行非参数检验(kruskal
‑
wallis h检验,即k
‑
w h检验),如k
‑
w h检验有统计学差异(p≤0.05),则各剂量组与对照组间做mann
‑
whitney u检验;否则检验结束。
[0139]
3.试验结果
[0140]
盐酸右美咪定经鼻制剂对戊巴比妥钠阈上剂量催眠作用的影响(mean
±
sd)
[0141]
组别睡眠潜伏期(min)睡眠时间(min)溶媒对照组12.4
±
1.38.8
±
5.6盐酸右美托咪定经鼻制剂4μg/kg组6.6
±
2.1
***##
23.3
±
9.0
***###
盐酸右美托咪定经鼻制剂8μg/kg组4.6
±
1.3
***#
26.4
±
6.9
***###
盐酸右美托咪定经鼻制剂16μg/kg组4.2
±
0.8
***
45.6
±
17.5
***#
盐酸右美托咪定注射液8μg/kg组3.7
±
1.4
***
71.7
±
19.5
***
异丙嗪5mg/kg组3.1
±
0.8
***
36.4
±
11.1
***
[0142]
统计学:与溶媒对照组比较,
**
p<0.01、
***
p<0.001;与盐酸右美托咪定注射液组比较,
#
p<0.05、
##
p<0.01、
###
p<0.001。
[0143]
盐酸右美咪定经鼻制剂对戊巴比妥钠阈上剂量睡眠潜伏期抑制百分率(mean
±
sd,%)
[0144]
组别睡眠潜伏期抑制率(%)溶媒对照组/盐酸右美托咪定经鼻制剂4μg/kg组47.0
±
17.3盐酸右美托咪定经鼻制剂8μg/kg组62.8
±
10.3盐酸右美托咪定经鼻制剂16μg/kg组65.9
±
6.3盐酸右美托咪定注射液8μg/kg组70.3
±
11.6异丙嗪5mg/kg组75.3
±
6.7
[0145]
参见上表及附图1和2小鼠潜伏期和睡眠时间统计结果。
[0146]
40mg/kg戊巴比妥钠腹腔注射后,小鼠睡眠潜伏期12.4min左右。盐酸右美托咪定经鼻制剂4、8、16μg/kg滴鼻给药呈剂量依赖性缩短小鼠睡眠潜伏期。各剂量盐酸右美托咪定经鼻制剂滴鼻给药对小鼠睡眠潜伏期的抑制率分别为47.0%、62.8%、65.9%,与溶媒对照组比较均具有显著性差异(p<0.001)。盐酸右美托咪定经鼻制剂抑制小鼠睡眠潜伏期ed
50
为4.289μg/kg,95%可信区间为0.741~6.567μg/kg。盐酸右美托咪定注射液8μg/kg静注给药也能明显缩短小鼠睡眠潜伏期(p<0.001),其作用强度强于右美托咪定经鼻制剂4、8μg/kg滴鼻给药(p<0.05~0.01),但与经鼻制剂16μg/kg作用强度相当(p>0.05)。阳性对照异丙嗪注射液5mg/kg静注也能明显缩短小鼠睡眠潜伏期(p<0.001)。
[0147]
40mg/kg戊巴比妥钠腹腔注射,可诱导小鼠持续睡眠8.8min左右。盐酸右美托咪定经鼻制剂4、8、16μg/kg滴鼻给药呈剂量依赖性增加小鼠睡眠时间,与溶媒对照组相比,均有显著差异(p<0.01~0.001)。盐酸右美托咪定注射液8μg/kg静注也能明显增加小鼠睡眠时间,其作用强度强于经鼻制剂8、16μg/kg滴鼻给药(p<0.05~0.001)。阳性对照异丙嗪注射液5mg/kg静注也能明显增加小鼠睡眠时间(p<0.001)。试验例3:盐酸右美托咪定经鼻制剂对戊巴比妥钠阈下剂量催眠作用的影响试验
[0148]
1.试验准备
[0149]
1.1试验药剂
[0150]
供试品、对照品和溶媒准备:
[0151]
供试品、溶媒制备:按下表比例分别称取盐酸右美托咪定(如配方中有)、氯化钠和苯扎氯铵,添加适量水溶解,调节ph至4.5~5.5,加水定容至100%,装入玻璃瓶,组装上计量泵,安装推钮,即得供试品和溶媒。作为供试品的盐酸右美托咪定鼻喷制剂每喷50μl,每喷含10μg右美托咪定(以游离右美托咪定计)。作为溶媒的盐酸右美托咪定鼻喷制剂(空白制剂)每喷50μl,每喷含0μg右美托咪定(以游离右美托咪定计)。
[0152][0153]
注:[1]以右美托咪定计。
[0154]
[2]苯扎氯铵以n
‑
c
12
h
25
和n
‑
c
14
h
29
同系物的总量之和折纯并折干计算。
[0155]
[3]“/”表示不添加该物质。
[0156]
对照品一准备:普通市售采购盐酸右美托咪定注射液作为对照品一。盐酸右美托咪定注射液规格:200μg/2ml(以右美托咪定计)。
[0157]
对照品二准备:普通市售采购盐酸异丙嗪注射液作为对照品二。盐酸异丙嗪注射液规格:50mg/2ml。工作液配制:
[0158]
盐酸右美托咪定经鼻制剂工作液配制:取盐酸右美托咪定鼻喷制剂原液适量,加入不同体积的盐酸右美托咪定鼻喷制剂(空白制剂),分别配制成24、48、96、144μg/ml的盐酸右美托咪定经鼻制剂工作液。
[0159]
盐酸右美托咪定注射液工作液配制:取盐酸右美托咪定注射液原液适量,用氯化钠注射液稀释成1.6μg/ml的盐酸右美托咪定注射液工作液。
[0160]
盐酸异丙嗪工作液配制:取盐酸异丙嗪注射液原液适量,用氯化钠注射液稀释成1.6mg/ml盐酸异丙嗪工作液。
[0161]
1.2试验动物
[0162]
小鼠,icr品系,spf级,雄性35只,雌性35只。雄性小鼠平均体重约为30g,雌性小鼠平均体重约为24g。
[0163]
70只小鼠,根据性别及体重,采用分层随机法分组,将动物分为7组,分别为溶媒对照组、盐酸右美托咪定经鼻制剂8μg/kg组、盐酸右美托咪定经鼻制剂16μg/kg组、盐酸右美托咪定经鼻制剂32μg/kg组、盐酸右美托咪定经鼻制剂48μg/kg组、盐酸右美托咪定注射液16μg/kg组、异丙嗪16mg/kg组。
[0164]
2.试验方案
[0165]
2.1给药方案
[0166][0167]
注:n.a:(移液器)滴鼻给药;i.v:(尾静脉)注射给药
[0168]
根据预试验结果,小鼠戊巴比妥钠阈下剂量设定为35mg/kg。
[0169]
各组小鼠根据上表给予各剂量药物,给药后即刻腹腔注射阈下剂量戊巴比妥钠35mg/kg(3.5mg/ml,0.1ml/10g体重),记录戊巴比妥钠注射时间、翻正反射消失时间、翻正反射恢复时间和30min内小鼠入睡数量。以小鼠双侧翻正反射消失60s作为入睡标准。分别计算睡眠潜伏期和睡眠时间。
[0170]
睡眠潜伏期=翻正反射消失时间
‑
戊巴比妥钠注射时间
[0171]
睡眠时间=翻正反射恢复时间
‑
翻正反射消失时间
[0172]
2.2数据统计
[0173]
用excel软件录入戊巴比妥钠注射时间、翻正反射消失时间、翻正反射恢复时间,并计算成睡眠潜伏期和睡眠时间。采用graphpad prism8软件作图,spss软件进行统计分析和回归计算正反射消失ed
50
。将各剂量组睡眠潜伏期和睡眠时间分别作方差齐性检验。若方差齐(p>0.05)则做单因素方差分析,有显著性差别(p≤0.05),则各剂量组与对照组间做dunnett检验;否则检验结束。若方差不齐(p≤0.05),则进行非参数检验(kruskal
‑
wallis h检验,即k
‑
w h检验),如k
‑
w h检验有统计学差异(p≤0.05),则各剂量组与对照组间做mann
‑
whitney u检验;否则检验结束。
[0174]
3.试验结果
[0175]
盐酸右美托咪定经鼻制剂对戊巴比妥钠阈下剂量催眠作用的影响(mean
±
sd)
[0176]
组别睡眠潜伏期(min)睡眠时间(min)溶媒对照组3.9
±
1.2(n=2)0.6
±
1.3(n=10)盐酸右美托咪定经鼻制剂8μg/kg组5.0
±
0.9(n=4)8.3
±
13.7
###
(n=10)盐酸右美托咪定经鼻制剂16μg/kg组5.8
±
0.9(n=4)14.0
±
20.7
###
(n=10)
盐酸右美托咪定经鼻制剂32μg/kg组5.6
±
2.9(n=8)44.1
±
33.8
**##
(n=10)盐酸右美托咪定经鼻制剂48μg/kg组6.9
±
4.2(n=9)76.1
±
41.4
***
(n=10)盐酸右美托咪定注射液16μg/kg组2.7
±
1.7(n=10)95.9
±
25.3
***
(n=10)异丙嗪16mg/kg组5.2
±
3.5(n=10)38.7
±
10.4
***
(n=10)
[0177]
注:未入睡动物不计入睡眠潜伏期统计,未入睡动物睡眠时间记为0min。统计学:与溶媒对照组比较,
**
p<0.01、
***
p<0.001;与盐酸右美托咪定注射液组比较,
##
p<0.01、
###
p<0.001。
[0178]
参见上表及附图3和4小鼠潜伏期和睡眠时间统计结果。
[0179]
溶媒对照组小鼠腹腔注射阈下剂量的戊巴比妥钠诱导2只小鼠在30min内翻正反射消失。各组小鼠滴鼻给予8、16、32、48μg/kg的盐酸右美托咪定经鼻制剂,阈下剂量戊巴比妥钠30min内翻正反射消失的比例分别为4/10、4/10、8/10、9/10。静脉注射16μg/kg组盐酸右美托咪定注射液,阈下剂量戊巴比妥钠30min内翻正反射消失的比例为10/10。阳性对照异丙嗪5mg/kg 30min内翻正反射消失的比例也为10/10。盐酸右美托咪定经鼻制剂促进阈下剂量戊巴比妥钠30min内翻正反射消失的ed
50
为13.781μg/kg,95%可信区间为3.850~23.144μg/kg。小鼠给予32、48μg/kg盐酸右美托咪定经鼻制剂与16μg/kg盐酸右美托咪定注射液,小鼠翻正反射消失比例相当。
[0180]
小鼠滴鼻8、16、32、48μg/kg盐酸右美托咪定经鼻制剂,即刻注射阈下剂量戊巴比妥钠,睡眠潜伏期为5~7min。静脉注射右美托咪定注射液16μg/kg,睡眠潜伏期为2.7min。从睡眠潜伏期均值分析,静脉注射右美托咪定注射液16μg/kg作用强度略强于盐酸右美托咪定经鼻制剂各剂量组,但由于标准差较大,无统计学差异。
[0181]
溶媒对照组小鼠腹腔注射阈下剂量的戊巴比妥钠,仅诱导2只小鼠在30min内翻正反射消失,平均睡眠时间为0.6min。滴鼻8、16、32、48μg/kg盐酸右美托咪定经鼻制剂,即刻注射阈下剂量戊巴比妥钠,小鼠睡眠时间呈剂量依赖性增加,且盐酸右美托咪定经鼻制剂32和48μg/kg组与溶媒对照组比较具有显著性差异(p<0.01~0.001)。静脉注射16μg/kg盐酸右美托咪定注射液也能明显诱导小鼠睡眠时间增加(p<0.001),其作用强度明显强于盐酸右美托咪定经鼻制剂8、16和32μg/kg(p<0.01~0.001),与盐酸右美托咪定经鼻制剂48μg/kg作用强度基本一致。与溶媒对照比较,阳性对照异丙嗪5mg/kg也能明显增加小鼠的睡眠时间(p<0.001)。
[0182]
试验例4:
[0183]
大鼠药代动力学试验1
[0184]
一、鼻喷剂的配方及制备工艺
[0185]
按照下表2.1比例,分别称取盐酸右美托咪定及各辅料,加水溶解,用氢氧化钠调节ph至5.0,分装入玻璃瓶,组装上定量泵,加推钮,即得右美托咪定鼻喷剂。
[0186]
表2.1
[0187]
原辅料名称用量盐酸右美托咪定35.5mg氯化钠1350mg苯扎氯铵30mg苯基乙醇534.3mg
水至150ml
[0188]
二、动物试验过程
[0189]
取上述右美托咪定鼻喷剂及市售盐酸右美托咪定注射液(2ml:200μg,江苏恒瑞医药股份有限公司)作为供试品,按下表2.2分别经鼻、静脉给予各组sprague dawley大鼠(sd大鼠)规定剂量的药物。各组于给药前及后5分钟、15分钟、30分钟、45分钟、1小时、1.5小时、2小时、4小时、6小时、8小时、24小时经颈静脉采血0.2ml,进行血药浓度检测。
[0190]
表2.2
[0191][0192]
注:给药浓度以右美托咪定计,注射液经生理盐水稀释后使用。
[0193]
三、试验结果
[0194]
将测得的血药浓度用phoenix winnonlin(v 6.4)作非房室模型分析,结果如下表2.3。
[0195]
表2.3
[0196][0197]
四、结果分析
[0198]
sd大鼠经鼻给予盐酸右美托咪定鼻喷剂后,绝对生物利用度达到83.8%,表明本发明所提供的盐酸右美托咪定鼻喷剂具有非常良好的生物利用度;经鼻组达峰时间(t
max
)仅为7.5分钟,表明该鼻喷剂可以快速吸收,快速起效,该特性对于临床上希望快速实现镇静效果是非常有利的。
[0199]
大鼠药代动力学试验2
[0200]
一、鼻喷剂的配方及制备工艺
[0201]
按照下表2.4比例,分别称取盐酸右美托咪定及各辅料,加水溶解,用氢氧化钠调节ph至5.0,分装入玻璃瓶,组装上定量泵,加推钮,即得右美托咪定鼻喷剂。
[0202]
表2.4
[0203]
原辅料名称用量盐酸右美托咪定0.02%(以右美托咪定计)氯化钠0.9%苯扎氯铵0.02%水至100%
[0204]
二、动物试验过程
[0205]
1.血样采集、检测及处理
[0206]
取上述右美托咪定鼻喷剂及市售盐酸右美托咪定注射液(2ml:200μg,江苏恒瑞医药股份有限公司)作为供试品,按下表2.5分别经鼻、静脉给予各组sprague dawley大鼠(sd大鼠)规定剂量的药物。各组于给药前及后5分钟、10分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、8小时、12小时、24小时经颈静脉采血0.2ml,血样经处理后进行检测。
[0207]
表2.5
[0208][0209]
2.大体解剖和组织病理学检查
[0210]
大体解剖:30μg/kg鼻喷剂组第7次给药后1天(即试验第八天)安乐死,对该组大鼠主要脏器(心、肾、脾、肝)、呼吸道(鼻咽部、支气管、肺)进行大体解剖观察。
[0211]
组织病理学检查:对30μg/kg鼻喷剂组所有大鼠的鼻咽部、支气管、肺进行按照组织病理学检查。
[0212]
三、试验结果
[0213]
1.药动学数据结果
[0214]
以经过验证的lc
‑
ms/ms法测定血浆中右美托咪定的浓度并计算药代动力学参数,主要结果见下表2.6
‑
大鼠单次经鼻/静脉注射后血浆中右美托咪定药动学参数(mean):
[0215]
表2.6
[0216][0217]
2.大体解剖和组织病理学检查
[0218]
sd大鼠连续7天滴鼻盐酸右美托咪定鼻喷剂30μg/kg,给药结束后经大体解剖观察,所有大鼠均未发现可能与盐酸右美托咪定鼻喷剂相关的肉眼异常改变。
[0219]
sd大鼠连续7天滴鼻盐酸右美托咪定鼻喷剂30μg/kg,给药结束后经组织病理学检查,所有大鼠均未发现可能与盐酸右美托咪定鼻喷剂相关的组织病理学异常改变。
[0220]
四、结果分析
[0221]
本发明的盐酸右美托咪定鼻喷剂滴鼻给药的血药浓度稍低或基本相当于静脉给药,暴露水平也与静脉给药相当,生物利用度较高,血药浓度达峰时间短,给药7天未观察到药物相关的毒性反应,显示了本发明的右美托咪定鼻喷剂良好的临床应用前景。
[0222]
试验例5:
[0223]
右美托咪定鼻喷剂临床药效试验
[0224]
受试者给予不同剂量的本发明右美托咪定鼻喷剂后,于不同时间对受试者的清醒、睡眠状态表现进行评分考察。评分分级表见下表5.1,各剂量组不同考察时间点的评分结果列于下表5.2。
[0225]
表5.1
[0226]
分数表现1烦躁不安2清醒,安静合作3嗜睡,对指令反应敏捷4浅睡眠状态,可迅速唤醒5入睡,对呼叫反应迟钝6深睡,对呼叫无反应
[0227]
表5.2
[0228][0229][0230]
结果表明,75
‑
200ug剂量下,鼻喷给药30min内均产生了明显助眠效果。随着剂量升高,嗜睡或入睡时间缩短,助眠效果的持续时间呈延长趋势。且随着剂量的升高,睡眠深度无显著进一步增长趋势。
[0231]
试验例6:
[0232]
右美托咪定鼻喷剂临床安全性试验
[0233]
采用随机、双盲、性别分层、两周期交叉的试验设计,清洗期7天,每组6例受试者,每周期分别空腹单次给予本发明的盐酸右美托咪定鼻喷剂或市售盐酸右美托咪定注射液中的一种。揭盲统计所有受试者的不良反应发生情况,不良反应分级见下表6.1,试验结果统计见下表6.2。
[0234]
表6.1
[0235][0236]
表6.2
[0237]
组别3级及以上的不良事件人次与研究药物关系转归25ug注射液组3(均为血压降低)很可能有关痊愈/恢复25ug鼻喷剂组0//
[0238]
结果显示,受试者随机接受同一剂量组的右美托咪定注射液或鼻喷剂,鼻喷剂显示了更好的安全性,该试验中观察到注射液产生的低血压不良反应也是注射液产品说明书中出现频率较高(25%)的不良反应之一。
[0239]
据市售盐酸右美托咪定注射剂公开的安全性资料显示,注射液的常见不良反应包括低血压、心动过缓及口干;在318例患者接受注射剂程序镇静治疗的临床试验中,平均给药总剂量为1.6μg/kg。盐酸右美托咪定注射剂安全性资料显示的低血压的发生率与本技术人进行的鼻喷剂临床试验中监测到的低血压(1级不良反应事件)的发生率比较结果如下:
[0240]
不良反应precedex受试组25μg鼻喷剂受试组75μg鼻喷剂受试组125μg鼻喷剂受试组低血压54%25.0%41.70%27.30%
[0241]
结果表明,本发明鼻喷剂的低血压的不良反应发生率远低于同剂量范围内的盐酸右美托咪定注射剂。即便是进一步加倍提高本发明鼻喷剂的给药剂量,低血压的不良反应发生率仍远低于现有盐酸右美托咪定注射剂,低血压1级不良反应事件发生率小于50%。
[0242]
本发明不局限于上述可选的实施方式,任何人在本发明的启示下都可得出其他各种形式的产品。上述具体实施方式不应理解成对本发明的保护范围的限制,本发明的保护范围应当以权利要求书中界定的为准,并且说明书可以用于解释权利要求书。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1