一种蛋白冻干粉及其溶液的制作方法
1.本发明属于药物制剂技术领域,涉及一种蛋白冻干粉及其溶液。更具体的是,该制剂在压缩式雾化器液器的作用下,能够保护蛋白的稳定性,保证蛋白在压缩过程中不发生变性并准确到达肺部。
背景技术:
2.本发明中的蛋白(简称ek1蛋白)为申请号为202010080751.4,发明名称为“多肽、其制备方法和用途”的专利申请所记载,是该申请的申请人在科学实验中发现的一种能够抑制新型冠状病毒(2019
‑
ncov)的蛋白。该蛋白的吸湿性极强,稳定性较弱,需要选择合理的制剂学方法才能够让它发挥最大的效果。
3.众所周知,目前常规使用的抑制新型冠状病毒(2019
‑
ncov)的方法为注射疫苗。但是,由于肌肉注射存在一定危险性,如热源反应以及注射安全的问题,并且存在一定的疼痛感,部分患者并不愿意接受。因此,研发一种能够让患者广泛接受,并且没有疼痛感,安全性高的制剂迫在眉睫。
4.冻干粉为蛋白药物常规使用的形式之一,其制备方法适合大多数蛋白药物,稳定性强,易于保存,并且能够复溶制备成多种制剂。因此,选择冻干粉来保护蛋白药物,是常见的制剂学应用之一。而冻干粉复溶后,可以有多种选择,进行给药。
5.在医疗工作中,为了达到肺部给药目的,雾化吸入为非常有效的方法之一。直达肺部,并且提高肺部吸收,提高生物利用度都是雾化吸入这一给药方式受到患者和医务工作者欢迎的主要原因。但是,在雾化吸入的过程中,需要使用压缩泵进行压缩,高强度的压缩会导致药液中不稳定物质发生变化,尤其是蛋白等大分子药物,无法耐受温度和压强变化而产生变性,从而造成药物失效,甚至产生副作用。
6.因此,如果能够制备一种含有ek1蛋白的制剂,既能够直达肺部,抑制病毒的存活,并且能够保证ek1蛋白的稳定性,使其在冻干压缩雾化过程中一直保持稳定,则势必能成为一种优秀的抑制新型冠状病毒(2019
‑
ncov)的制剂,同时也具有非常广泛的推广和使用前景。
技术实现要素:
7.发明要解决的问题
8.鉴于目前并无适合于ek1蛋白肺部给药的稳定制剂,本发明拟提供一种蛋白冻干粉以及由其制备的溶液,以满足相关需求。
9.用于解决问题的方案
10.第一方面,本发明提供了一种蛋白冻干粉,其由处方溶液经冻干工艺而制得,每1ml所述处方溶液中含有15mg的蛋白、20
‑
50mg的赋形剂、1.36~5.50mg的缓冲盐、将所述处方溶液的ph值调至设定值所对应的用量的ph调节剂以及余量的注射用水。
11.优选地,每1ml所述处方溶液中含有15mg的蛋白、30
‑
50mg的赋形剂、2.5~3.0mg的
缓冲盐、将所述处方溶液的ph值调至设定值所对应的用量的ph调节剂以及余量的注射用水。
12.更优选地,每1ml所述处方溶液中含有15mg的蛋白、40mg的赋形剂、2.76mg的缓冲盐、将所述处方溶液的ph值调至设定值所对应的用量的ph调节剂以及余量的注射用水。
13.进一步地,在上述蛋白冻干粉中,所述蛋白为ek1蛋白、ek1
‑
plam蛋白、ek1
‑
chol蛋白或其衍生物,优选ek1蛋白,这些蛋白均记载在申请号为202010080751.4,发明名称为“多肽、其制备方法和用途”的专利申请中。
14.优选地,在上述蛋白冻干粉中,所述蛋白为ek1蛋白(在1mg/ml的浓度下,其碱度约为8.5,理论等电点约为4.02)。
15.进一步地,在上述蛋白冻干粉中,所述赋形剂为甘露醇、丙二醇、葡萄糖中的一种或多种。
16.优选地,在上述蛋白冻干粉中,所述赋形剂为甘露醇。
17.进一步地,在上述蛋白冻干粉中,所述缓冲盐为磷酸二氢钠、磷酸氢二钠、碳酸氢钠、枸橼酸钠中的一种或多种。
18.优选地,在上述蛋白冻干粉中,所述缓冲盐为磷酸二氢钠。
19.进一步地,在上述蛋白冻干粉中,所述ph调节剂为氯化氢或氢氧化钠。
20.优选地,在上述蛋白冻干粉中,所述ph调节剂以水溶液的形式存在,优选浓度为0.5mol/l。
21.进一步地,在上述蛋白冻干粉中,所述ph调节剂将所述处方溶液的ph值调至5.0
‑
10.0。
22.更优选地,在上述蛋白冻干粉中,所述ph调节剂为0.5mol/l的氢氧化钠水溶液,其将所述处方溶液的ph值调至7.0
‑
10.0。
23.进一步地,在上述蛋白冻干粉中,所述处方溶液通过以下方法制备:在室温常压下,称取处方量的蛋白、赋形剂和缓冲盐,加入到适量的注射用水中,缓慢搅拌至溶解,用处方量的ph调节剂调节ph值,加入剩余的注射用水,混匀,滤膜过滤,得到处方溶液。
24.优选地,在上述处方溶液的制备方法中,所述滤膜为聚醚砜(pes)膜、聚偏三氟乙烯(pvdf)膜中的一种或多种,优选聚醚砜膜。
25.进一步地,在上述蛋白冻干粉中,所述冻干工艺包括如下步骤:首先,将处方溶液放置于冻干机中,降温至
‑
50℃,预冻1h,保持5
‑
6h;其次,在0.2
‑
0.4mbar下,升温至
‑
20℃,保持18
‑
24h;再次,在0
‑
0.2mbar下,升温至0℃;最后,升温至25℃,保持5h,得到蛋白冻干粉。
26.本发明的蛋白冻干粉并无专用溶剂,本领域常规使用的蛋白冻干粉溶剂均可适用。
27.本发明的蛋白冻干粉所使用的包装材料和/或容器情况如下:西林瓶:中硼硅玻璃管制注射剂瓶;胶塞:注射用冷冻干燥用氯化丁基橡胶塞;铝盖:抗生素瓶用铝塑组合盖。
28.第二方面,本发明提供了一种基于蛋白冻干粉的溶液,其包括上述蛋白冻干粉和溶剂。
29.进一步地,在上述溶液中,所述溶剂为生理盐水。
30.优选地,在上述溶液中,所述溶剂与蛋白冻干粉的用量比为1ml:10~20mg,优选
1ml:15mg。
31.第三方面,本发明提供了上述溶液的制备方法,其包括如下步骤:采用溶剂对蛋白冻干粉进行复溶,形成溶液。
32.第四方面,本发明提供了上述溶液的使用方法,其包括如下步骤:将溶液加入到雾化装置中,再通过雾化装置施用于对其有需要的个体。
33.进一步地,在上述使用方法中,所述雾化装置为压缩式雾化器液器。
34.优选地,在上述使用方法中,所述雾化装置为欧姆龙ne
‑
c25s或欧姆龙ne
‑
c28p型压缩式雾化器液器。
35.优选地,在上述使用方法中,所述溶液通过咬嘴模式或面罩模式进行雾化吸收。
36.发明的效果
37.本发明中所涉及的ek1蛋白,其自身理化性质不够稳定,吸湿性极强,并且ek1蛋白主要用于抑制冠状病毒,如何能够直达肺部,提高蛋白的生物利用度,都是研发阶段存在的困难。本发明充分利用了冻干粉提高蛋白稳定性的特征,制备了ek1冻干粉及其雾化制剂,并且利用了赋形剂(甘露醇等)对ek1蛋白的保护作用,在压缩喷雾状况下,依然能够保证ek1蛋白不受外界的影响而保持稳定,从而既改善了ek1蛋白严苛的保存环境,又通过制剂手段直达病灶,同时还保证了整个过程中ek1蛋白的稳定。
附图说明
38.图1示出了在ek1蛋白对2019
‑
ncov活病毒感染抑制作用试验中vero e6细胞情况。
39.图2示出了在ek1蛋白对2019
‑
ncov活病毒感染抑制作用试验中2019
‑
ncov病毒情况。
具体实施方式
40.实施例1:蛋白冻干粉的处方研究
41.1、处方筛选
42.以ek1蛋白为例,其碱度(1mg/ml)约为8.5,同时考虑到该蛋白的理论等电点约为4.02,结合制剂常规ph范围为4
‑
9,设计ph考察范围为3
‑
10,分别调节值分别为3.0
‑
10.0;处方中加入缓冲盐以增加制剂ph稳定性,缓冲盐选择:磷酸二氢钠、磷酸氢二钠、碳酸氢钠、枸橼酸钠;盐浓度选择:20mmol/l;ph调节剂为0.5mol/l盐酸溶液或0.5mol/l氢氧化钠溶液;处方中分别加入适量甘露醇作为赋形剂,设计处方。
43.称取处方量的甘露醇、磷酸二氢钠和ek1蛋白,加适量注射用水,缓慢搅拌使溶解,用氢氧化钠溶液调ph值至设定值,加入余量注射用水,混匀,用pes膜(双层)过滤,分装于玻璃管制注射剂瓶中,胶塞半压塞,冷冻干燥,全压塞,加铝塑组合盖轧盖,即得成品。
44.制备本发明的蛋白冻干粉所使用的处方溶液的具体情况如表1所示。
45.表1.处方溶液的具体组成
[0046][0047]
2、处方检测
[0048]
检测项目及检测方法(如表2所示)
[0049]
表2.蛋白冻干粉的检测项目
[0050][0051]
冻干粉检测方法:
[0052]
·
外观性状:取供试品,置明亮处观察。
[0053]
·
水分:取本品,照水分测定法(中国药典2015年版四部通则0832第一法2)测定。
[0054]
·
渗透压摩尔浓度:取本品,精密加入1ml水复溶后,依法测定(中国药典2015年版四部通则0632)毫渗透压摩尔浓度(mosmol/kg)。
[0055]
·
复溶时间:取本品5支,揭铝盖,用注射器注入1.0ml水,振摇,测定复溶时间。
[0056]
·
溶液澄清度与颜色:取本品,加水制成每1ml中约含ek1蛋白5mg的溶液,照中国药典2015年版四部通则0902第一法与中国药典2015年版四部通则0901第一法,检测溶液澄清度与颜色。
[0057]
·
酸碱度:取本品,加水制成每1ml中约含ek1蛋白5mg的溶液,依法测定(中国药典2015年版四部通则0631)酸碱度。
[0058]
·
有关物质/纯度:照高效液相色谱法(中国药典2015年版四部通则0512)测定。
[0059]
色谱条件与系统适用性试验:以十八烷基硅烷键合硅胶为填充剂(zorbax 300sb
‑
c18 3.5μm,4.6
×
150mm或效能相当的色谱柱);以30mmol/l的磷酸二氢钾溶液(取磷酸二氢钾4.08g,加水1000ml溶解,用42%的氢氧化钠溶液调节ph值至6.0)为流动相a,以乙腈为流动相b;流速为1.0ml/min;柱温为35℃;检测波长为215nm;按表3进行梯度洗脱。
[0060]
表3.纯度检测试验中液相色谱法适用的梯度洗脱条件
[0061]
时间(分钟)流动相a(%)流动相b(%)0955570304059414545555045555195560955
[0062]
测定方法:取本品,每瓶加水1ml复溶,再用流动相稀释制成每1ml中约含0.5mg的溶液,作为供试品溶液;精密量取供试品溶液20μl,分别注入色谱仪,记录色谱图;扣除溶剂及辅料峰,按面积归一化法计算主峰纯度。
[0063]
检测结果:
[0064]
冻干粉的检测结果如表4至表10所示。
[0065]
表4.冻干粉的外观考察结果
[0066][0067]
表5.冻干粉的水分(0天)考察结果
[0068]
处方编号123456水分(%)0.920.991.320.971.091.14
处方编号789101112水分(%)1.081.341.001.191.181.00
[0069]
表6.冻干粉的渗透压摩尔浓度(0天)考察结果
[0070][0071]
表7.冻干粉的最大复溶时间考察结果(以秒计)
[0072]
处方编号0天60℃5天60℃13天40℃5天40℃13天光照5天光照13天192517201920162910889883999891084899991195999891196899881187999999989998989989912811910898991291189989129128999898
[0073]
表8.冻干粉的复溶后溶液澄清度与颜色考察结果
[0074][0075]
表9.冻干粉的复溶后溶液酸碱度考察结果(以ph值计)
[0076]
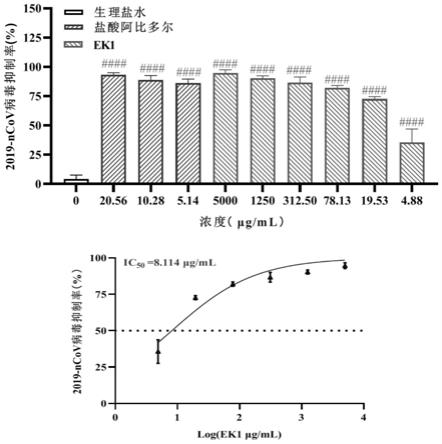
处方编号0天60℃5天60℃13天40℃5天40℃13天光照5天光照13天15.775.705.735.705.715.685.7126.576.566.556.556.566.536.5637.187.187.207.197.207.177.1948.088.118.148.118.128.098.1358.788.888.918.838.858.748.8169.609.649.639.619.649.659.6477.908.048.008.007.998.027.9688.128.228.218.168.198.188.1798.158.228.238.228.228.218.18109.9910.1510.1510.1510.1210.0910.05118.208.588.608.428.458.358.32128.158.278.268.248.248.248.23
[0077]
表10.冻干粉的主峰纯度(%)考察结果
[0078]
处方编号0天60℃5天60℃13天40℃5天40℃13天光照5天光照13天198.083793.663593.358997.837197.932698.104197.9988298.190895.061293.735897.948198.040898.045797.9334398.338196.061294.561297.962898.023798.073197.9612498.224196.313396.170097.699997.826798.094897.7381598.111297.304196.539198.145397.878698.433297.8437698.142596.008495.502797.935197.938398.247597.7846798.263795.951895.508097.947197.823298.165897.7950898.164096.228295.087097.996797.869698.031098.0249997.977395.926095.758697.916997.680397.720997.69441098.099395.985595.839998.045498.002897.878697.47201198.097997.242896.347297.935197.902298.024797.75381298.110497.289495.809997.956897.962698.106197.7909
[0079]
冻干粉试验结果表明:
[0080]
①
冻干粉各处方在各条件下外观均为白色疏松块状物;
[0081]
②
冻干粉各处方0天水分均小于2.0%;
[0082]
③
冻干粉处方1、3、4、5、6、11、12渗透压摩尔浓度均在260~320mosmol/kg,满足等渗要求;
[0083]
④
除处方1外,冻干粉其他处方在各条件下最大复溶时间均小于15s,满足要求;
[0084]
⑤
冻干粉各处方在各条件下复溶后溶液澄清度均为澄清溶液;
[0085]
⑥
冻干粉各处方在0天、40℃5天、光照5天及13天条件下复溶后溶液颜色均为无色溶液;处方1、2、3在60℃5天及13天、40℃13天条件下复溶后溶液颜色均为无色溶液;处方4~12在40℃13天条件下复溶后溶液颜色均为几乎无色溶液;处方4、5、8、9、11、12在60℃13天条件下复溶后溶液颜色均为几乎无色溶液;处方6、7、10在60℃13天条件下复溶后溶液颜色均为浅于1号黄色标准比色液;
[0086]
⑦
冻干粉各处方在各条件放置下复溶后酸碱度与0天对比,变化量均小于0.2;
[0087]
⑧
冻干粉各处方在40℃及光照13天后,纯度无明显变化;在60℃13天后,纯度有明显降低,其中处方1、2明显差于其余处方,其余处方纯度结果基本一致。
[0088]
综合上述结果显示,本品较稳定的ph范围为7~10;甘露醇用量不影响产品质量稳定性;不同缓冲盐不影响产品质量稳定性;故选择处方4为本品的冻干粉处方。
[0089]
实施例2:蛋白冻干粉的制备工艺研究
[0090]
1、冻干工艺
[0091]
ek1蛋白处方溶液共晶点为
‑
15℃~
‑
25℃。
[0092]
在室温常压下,将ek1蛋白处方溶液放置于冻干机中,降温至
‑
50℃,预冻1h,保持5
‑
6h;在0.2
‑
0.4mbar下,升温至
‑
20℃,保持18
‑
24h;在0
‑
0.2mbar下,升温至0℃;升温至25℃,保持5h,即可完成冻干,得到蛋白冻干粉。
[0093]
2、滤材选择
[0094]
在常温条件下,模拟药物实际过滤生产中最大过滤量的情况,根据亲水性聚醚砜(pes)膜及亲水性聚偏氟乙烯(pvdf)膜对产品ek1蛋白的吸附能力,选择合适滤膜。配制ek1
蛋白处方溶液500ml进行考察,按设计取样:取样点为a0
‑
a10,取样量a0
‑
a9为10ml,a10为取a0
‑
a9各1ml混匀;取样时过滤体积依次为50
‑
80ml逐量递增。分别测定各取样点其相对于过滤前各自的含量。取药液,用pes膜按过滤体积过滤。按取样点和取样量取样考察滤膜吸附。取样后的剩余滤液混匀分装于2ml中性硼硅玻璃管制注射剂瓶中,1.0ml/瓶,加注射用冷冻干燥无菌粉末用氯化丁基橡胶塞半压塞,按冻干曲线进行冷冻干燥,全压塞,加抗生素瓶用铝塑组合盖轧盖,即得制剂。
[0095]
取配制的药液,用pvdf膜按滤膜吸附过滤,按滤膜吸附取样点和取样量取样考察含量。分别精密量取各取样点溶液1ml,分置100ml量瓶中,加流动相稀释至刻度摇匀,即得各供试品溶液。照处方筛选与确定试验中有关物质检测条件。
[0096]
结果表明:采用亲水性pes膜及亲水性pvdf膜对ek1蛋白处方溶液进行过滤,对ek1蛋白基本无吸附,最终选择亲水性pes膜为本品过滤材质。
[0097]
实施例3:雾化稳定性考察
[0098]
雾化装置1:压缩式雾化器液器(欧姆龙ne
‑
c25s型)
[0099]
试验一:
[0100]
试验设计:
[0101]
压缩式雾化器液器厂家:欧姆龙,型号:ne
‑
c25s;药液杯的药液装量体积:2~6ml。
[0102]
取3个批次的蛋白冻干粉(处方4)(批号:200501、200502、200601)2瓶,每瓶加入3ml的0.9%氯化钠注射液溶解,摇匀,2瓶溶液转移至压缩式雾化器药液杯中混匀,药液杯组件密封连接滴管;15ml西林瓶中加水5ml作为接收液,将滴管口置于液面下,开启雾化器进行雾化取样,20分钟取样一次,取样两次(整体雾化时间约45min)。
[0103]
取雾化接收液作为有关物质供试品溶液。
[0104]
对照品溶液:称取ek1蛋白对照品约15mg,置100ml量瓶中,加0.9%氯化钠注射液溶解并稀释至刻度,混匀即得。
[0105]
混合溶液:取雾化接收液、对照品溶液和水按3:5:2体积比混匀即得。
[0106]
取水、0.9%氯化钠注射液、对照品溶液、有关物质供试品溶液、混合溶液各20μl,采用有关物质检测方法进行考察,有关物质采用面积归一化法计算,混合溶液考察主峰是否为单峰,保留时间是否与对照品溶液一致。另取200601批雾化接收液进行质谱分子量检测。
[0107]
试验结果:
[0108][0109]
对照品溶液主峰保留时间:25.751min;
[0110]
试验结论:ek1蛋白冻干粉用0.9%氯化钠注射液复溶后经雾化装置1雾化后,雾化接收液中溶质分子量与ek1蛋白理论分子量一致,色谱鉴别与ek1蛋白对照品溶液主峰保留
时间一致;有关物质无明显变化;故本品经雾化装置1雾化后质量未见明显变化,质量稳定。
[0111]
试验二:
[0112]
试验设计:
[0113]
压缩式雾化器液器厂家:欧姆龙,型号:ne
‑
c25s。
[0114]
取蛋白冻干粉(处方4)(批号:200501)2瓶,溶解并定容至200ml0.9%氯化钠注射液中,混匀;取适量置烧杯中,将雾化装置的药液杯及完全导气管浸泡于供试品溶液中。分别于0,2,4,8,24小时取适量供试品溶液,测定性状、澄清度与颜色、ph值、可见异物、不溶性微粒、含量,结果见下表。
[0115][0116]
试验结论:本品的0.9%氯化钠注射液配伍溶液与压缩式雾化器液器(欧姆龙ne
‑
c25s型)药液杯及安全导气管接触24h,供试品溶液各检测项目及含量无明显变化,表明雾化装置1对本品ek1蛋白无吸附。
[0117]
雾化装置2:压缩式雾化器液器(欧姆龙ne
‑
c28p型)
[0118]
试验一:
[0119]
试验设计:
[0120]
压缩式雾化器液器厂家:欧姆龙,型号:ne
‑
c28p;药液瓶容量:最大7ml。
[0121]
取3个批次的蛋白冻干粉(处方4)(批号:200501、200502、200601)2瓶,每瓶加入3ml0.9%氯化钠注射液溶解摇匀,2瓶溶液转移至压缩式雾化器药液杯中混匀,药液杯组件用封口膜密封连接滴管;15ml西林瓶中加水5ml作为接收液,将滴管口置于液面下,开启雾化器进行雾化取样,10分钟取样一次,取样两次(整体雾化时间约25min)。
[0122]
取雾化接收液作为有关物质供试品溶液。
[0123]
对照品溶液:称取ek1蛋白对照品约15mg,置100ml量瓶中,加0.9%氯化钠注射液溶解并稀释至刻度,混匀即得。
[0124]
混合溶液:取雾化接收液、对照品溶液和水按3:5:2体积比混匀即得。
[0125]
取水、0.9%氯化钠注射液、对照品溶液、有关物质供试品溶液、混合溶液各20μl,采用有关物质检测方法进行考察,有关物质采用面积归一化法计算,混合溶液考察主峰是否为单峰,保留时间是否与对照品溶液一致。另取雾化接收液进行质谱分子量检测。
[0126]
试验结果:
[0127]
考察项目200501
‑
前液200501
‑
后液200502
‑
前液200502
‑
后液200601
‑
前液200601
‑
后液
混合溶液保留时间(min)22.61322.15922.48522.54622.35722.198混合溶液是否为单峰是是是是是是最大单杂(%)0.610.610.610.620.630.64总杂(%)2.672.632.852.792.682.64分子量检测结果4372.84372.44372.44372.44372.54372.5
[0128]
对照品溶液主峰保留时间:22.250min;
[0129]
试验结论:ek1蛋白冻干粉用0.9%氯化钠注射液复溶后经雾化装置2雾化后,雾化接收液中溶质分子量与ek1蛋白理论分子量一致,色谱鉴别与ek1蛋白对照品溶液主峰保留时间一致;有关物质无明显变化;故本品经雾化后质量未见明显变化,质量稳定。
[0130]
试验二:
[0131]
试验设计:
[0132]
压缩式雾化器液器厂家:欧姆龙,型号:ne
‑
c28p。
[0133]
取蛋白冻干粉(处方4)(批号:200501)2瓶,溶解并定容至200ml0.9%氯化钠注射液中,混匀;取适量置烧杯中,将雾化装置的药液杯及吸嘴浸泡于供试品溶液中。分别于0,2,4,8,24小时取适量供试品溶液,测定性状、澄清度与颜色、ph值、可见异物、不溶性微粒、含量,结果见下表。
[0134][0135]
试验结论:本品的0.9%氯化钠注射液配伍溶液与压缩式雾化器液器(欧姆龙ne
‑
c28p型)的药液杯及吸嘴接触24h,供试品溶液各检测项目及含量无明显变化,表明雾化装置2对本品ek1蛋白无吸附。
[0136]
实施例4:ek1蛋白雾化剂吸入sd大鼠的药代动力学与分布排泄试验
[0137]
实验方法:
[0138]
取所需数量的处方4冻干粉(15mg/瓶),每瓶加入适量溶媒溶解并转移至量筒,每瓶再加入适量溶媒清洗供试品玻璃瓶,清洗液全部转至量筒后,缓慢加入适量溶媒至目标体积,混匀后得到浓度为45mg/ml(浓度=15mg
×
瓶数/体积)的溶液,之后梯度稀释配制浓度为15、5mg/ml的高、中、低三种浓度的蛋白溶液。供试品制剂于给药前一天(d
‑
1)配制,室温保存。
[0139]
选用sd大鼠48只,雌雄分组,低中高剂量组动物分别单次吸入上述配置好的溶液45min,颈静脉采集全血用于分析。采样点为药前,给药结束后5min
‑
24h的多个时间点采集血样。
[0140]
实验结果:
[0141]
取所需数量的处方4(15mg/瓶),每瓶加入适量溶媒溶解并转移至量筒,每瓶再加入适量溶媒清洗供试品玻璃瓶,清洗液全部转至量筒后,缓慢加入适量溶媒至目标体积,混匀后得到浓度为45mg/ml(浓度=15mg
×
瓶数/体积)的供试品制剂,之后梯度稀释配制浓度为15、5mg/ml的供试品制剂。供试品制剂于给药前一天(d
‑
1)配制,室温保存。
[0142]
大鼠血浆中ek1蛋白的绝对生物利用度(f%)在雄性和雌性动物体内均约为1%
‑
2%,ek1蛋白入血少,达到最大浓度的时间均约为0.03小时,在体内ek1蛋白的半衰期均约为2.5h。雌雄分组血浆中ek1蛋白的暴露量(auc
last
)均随剂量增加而增大,但暴露量增加的幅度小于剂量增加的幅度。
[0143][0144]
对主要代谢动力学参数进行双单侧t检验,结果显示雌雄动物血浆中ek1蛋白的暴露量均无统计学差异,各组雌性与雄性动物体内ek1蛋白的暴露量基本一致,动物血浆中ek1蛋白平均auc
last
的比率(雌/雄)在0.9至1.5之间。
[0145]
组织分布与排泄:大鼠吸入给予ek1蛋白制剂后,ek1蛋白在肺及气管组织中均为第一个检测时间点(给药结束后10min)浓度最高,且浓度基本随时间呈递减趋势。各时间点肺组织中浓度最高,约为血浆的40
‑
50倍以上。ek1蛋白在气管组织中代谢快,2h时气管组织中已检测不到。
[0146]
大鼠吸入给予ek1蛋白制剂后,主要通过肺脏排泄。
[0147]
实施例5:ek1蛋白雾化剂吸入beagle犬的药代动力学试验
[0148]
实验方法:
[0149]
取所需数量的处方4冻干粉(15mg/瓶),每瓶加入适量溶媒溶解并转移至量筒,每瓶再加入适量溶媒清洗供试品玻璃瓶,清洗液全部转至量筒后,缓慢加入适量溶媒至目标体积,混匀后得到浓度为45mg/ml(浓度=15mg
×
瓶数/体积)的溶液,之后梯度稀释配制浓度为15、5mg/ml的高、中、低三种浓度的蛋白溶液。供试品制剂于给药前一天(d
‑
1)配制,室温保存。
[0150]
选用beagle犬24只,雌雄分组,低中高剂量组动物分别单次吸入给予浓度制剂
30min,采集血样。采样点为药前,给药结束后5min
‑
24h的多个时间点采集血样。
[0151]
实验结果:单次吸入由ek1蛋白冻干粉(处方4)配制的溶液,犬血浆中ek1蛋白的绝对生物利用度(f%)在雄性和雌性动物体内均约为1%
‑
2%,ek1蛋白入血少,达到最大浓度的时间均约为0.5
‑
1小时,在体内ek1蛋白的半衰期均约为2.5h。雌雄分组血浆中ek1蛋白的暴露量(auclast)均随剂量增加而增大,但暴露量增加的幅度小于剂量增加的幅度。其中低剂量组大部分样品中ek1蛋白的浓度低于定量下限,部分参数无法求算,不能准确描述ek1蛋白的代谢特征。
[0152][0153]
对主要代谢动力学参数进行双单侧t检验,结果显示雌雄动物血浆中ek1蛋白的暴露量均无统计学差异,各组雌性与雄性动物体内ek1蛋白的暴露量基本一致,动物血浆中ek1蛋白平均auclast的比率(雌/雄)在1至1.8之间。
[0154]
实施例6:由ek1蛋白冻干粉(处方4)配制的溶液的体外药效试验
[0155]
1、实验方法
[0156]
将规格15mg/瓶,处方4的ek1蛋白冻干粉,用生理盐水溶解,得到50mg/ml ek1溶液。按试验设计配制各浓度溶液,具体配制量如下表所示,考察ek1蛋白对2019
‑
ncov活病毒感染抑制作用。
[0157]
采用cck
‑
8法检测细胞毒性,细胞点板后培养约24h换液,每孔加2%fbs培养基180μl,依次加入20μl的溶媒(0.9%氯化钠注射液)、阳性对照品(盐酸阿比多尔原料药)和各剂量组受试物,培养24h后,每孔加入20μl cck
‑
8试剂,继续培养1~4h后,测各孔吸光度根据吸光度计算多肽对细胞的抑制率;采用2019
‑
ncov活病毒的蚀斑法进行检测。不同浓度的ek1蛋白与2019
‑
ncov活病毒抚育30分钟,然后将它们加入到单层的ero
‑
e6细胞上。在适宜温度下培养1小时后,除去上清。然后加入0.9%的甲基纤维素覆盖细胞。72小时后,对细胞进行染色,观察和计数噬斑数量。
[0158][0159]
注:上表仅表示预实验供试品的配制,具体剂量组设置根据实际观察结果进行调整,以20μl/180μl/孔给药,溶媒对照组及各剂量组中生理盐水终浓度均为10%,各阳性对照组中dmso终浓度均为1%。
[0160]
2、实验结果
[0161]
如图1和图2所示,体外细胞毒性试验表明,该试验剂量范围内的ek1蛋白对vero e6细胞均无明显毒性作用,半数细胞毒浓度cc
50
>1100μm,且与对照组相比,ek1蛋白的毒性较小;体外噬斑试验表明,该试验剂量范围内的ek1蛋白对2019
‑
ncov病毒具有明显抑制作用,半数抑制浓度ic
50
值为1.5
‑
2μm左右,具有较大的安全窗口。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1