一种实验兔的固定方法
1.本发明涉及动物实验领域,尤其涉及一种实验兔的固定方法。
背景技术:
2.动物实验是指在实验室内,为了获得有关生物学、医学等方面的新知识或解决具体问题而使用动物进行的科学研究。动物实验所用的实验动物,是指经人工饲养、繁育,对其携带的微生物及寄生虫实行控制,遗传背景明确或者来源清楚的,应用于科学研究、教学、生产和检定以及其他科学实验的动物。
3.生物医学研究许多里程碑式的研究成果,都来自于实验动物。新西兰大白兔是生物医学实验研究中最常用的动物之一,广泛应用于心血管疾病、内分泌、遗传学、药理学、组织工程学等研究领域。为了顺利进行各类实验操作,检测实验实验动物(兔)的生理病理状况,一般需要将实验动物进行固定,甚至需要麻醉处理。以新西兰大白兔为例,其固定器有很多种类,耳缘静脉给药时可使用半圆桶形固定器,手术时可采用专用仰卧位固定器。
4.为了充分的验证科学问题,实时动态观察实验动物的各项生理指标,通常需要各类无创的辅助检查(功能学评价及成像检测)来辅助分析实验结果,现有的固定装置由于无法满足动物辅助检查时的不同体位需求,往往需要将实验动物先固定于圆筒形固定器内进行静脉麻醉后,再固定于专用动物仰卧位固定器。此种操作需要麻醉,一方面可能会影响功能学评价的结果,另一方面耗时耗力,还会给实验动物造成额外痛苦,甚至可能增加动物死亡风险。
5.因此,研究一种新的固定方法,使其适应实验动物在非麻醉状态下进行多体位辅助检查,进而节约时间成本,得到与生理状态更接近的实验数据具有重要意义。
技术实现要素:
6.本发明旨在提供一种实验兔的固定方法,通过改变实验兔的体位,使实验兔处于冷静状态,减少、放弃麻醉剂的使用,进而减少麻醉剂对试验兔的影响,提高试验准确度。
7.为达到上述目的,本发明是采用以下技术方案实现的:
8.本发明提供了一种实验兔的固定方法,包括以下步骤:
9.s1、将实验兔放置在固定装置上,固定装置顶面和底面均具有开合功能,实验兔处于趴卧位;
10.s2、将实验兔四肢固定在固定装置上;
11.s3、使实验兔处于冷静状态;
12.s4、转动固定装置,使实验兔处于仰卧位;
13.s5、打开固定装置正对实验兔腹部的面,露出实验兔的腹部。
14.进一步地,露出实验兔的腹部后对实验兔进行试验操作。
15.进一步地,所述试验操作包括抽血、x光透视。
16.进一步地,所述固定装置包括相对设置的左侧板(1)、右侧板(2),前挡板(3)竖直
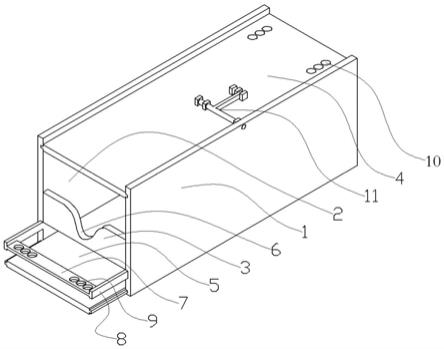
设置,前挡板(3)两侧边分别固连左侧板(1)前端、右侧板(2)前端,顶板(4)可拆卸的连接左侧板(1)顶边、右侧板(2)顶边,底板(5)可拆卸的连接左侧板(1)底边、右侧板(2)底边,底板(5)长度大于左侧板(1),前挡板(3)底边与底板(5)之间存在间隙,前挡板(3)顶部设置有固定凹陷(6),前肢固定装置两端分别固连左侧板(1)前端、右侧板(2)前端,后肢固定装置为设置在顶板(4)后部。
17.进一步地,底板(5)头端延伸至左侧板(1)外部。
18.进一步地,顶板(4)左边沿和右边沿均设置有第一滑动凸楞,第一滑动凸楞水平设置,左侧板(1)和右侧板(2)顶部均设置有适配第一滑动凸楞的第一滑槽,顶板(4)和左侧板(1)/右侧板(2)之间设置有滑销组件(11)。
19.进一步地,底板(5)左边沿和由边沿均设置有第二滑动凸楞,第二滑动凸楞水平设置,左侧板(1)和右侧板(2)底部均设置有适配第二滑动凸楞的第二滑槽。
20.进一步地,前肢固定装置包括第一固定板(7),第一固定板(7)水平设置,第一固定板(7)长度方向为自左向右设置,第一固定板(7)左端和右端分别通过第一支撑臂(8)固连左侧板(1)和右侧板(2),第一固定板(7)上设置多个第一孔洞(9)。
21.进一步地,后肢固定装置为设置在顶板(4)后部的第二孔洞(10),多个第二孔洞(10)自前向后等间隔设置。
22.本发明的有益效果:
23.1、本发明通过改变实验兔的体位,使实验兔处于冷静状态,减少、放弃麻醉剂的使用,进而减少麻醉剂对试验兔的影响,提高试验准确度。
24.2、本发明可以降低重新摆放动物的需要,减少麻醉剂的使用。
附图说明
25.图1为固定装置的示意图。图中:1
‑
左侧板、2
‑
右侧板、3
‑
前挡板、4
‑
顶板、5
‑
底板、6
‑
固定凹陷、7
‑
第一固定板、8
‑
第一支撑臂、9
‑
第一孔洞、10
‑
第二孔洞、11
‑
滑销组件。
26.图2为正常体位新西兰大白兔动脉血压及心电图。
27.图3为麻醉状态下仰卧位新西兰大白兔动脉血压及心电图。
28.图4为仰卧位新西兰大白兔动脉血压及心电图。
具体实施方式
29.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图,对本发明进行进一步详细说明。
30.本技术中的“左”、“前”方向是指靠近纸面的方向,“右”、“后”方向是指远离纸面的方向。
31.实施例1、本发明固定装置及使用方法
32.如图1所示,固定装置包括相对设置的左侧板1、右侧板2,前挡板3竖直设置,前挡板3两侧边分别固连左侧板1前端、右侧板2前端,顶板4可拆卸的连接左侧板1顶边、右侧板2顶边,底板5可拆卸的连接左侧板1底边、右侧板2底边,底板5长度大于左侧板1,底板5头端延伸至左侧板1外部,前挡板3底边与底板5之间存在间隙,前挡板3顶部设置有固定凹陷6,前肢固定装置两端分别固连左侧板1前端、右侧板2前端,顶板4左边沿和右边沿均设置有第
一滑动凸楞,第一滑动凸楞水平设置,左侧板1和右侧板2顶部均设置有适配第一滑动凸楞的第一滑槽,顶板4和左侧板1/右侧板2之间设置有滑销组件11,底板5左边沿和由边沿均设置有第二滑动凸楞,第二滑动凸楞水平设置,左侧板1和右侧板2底部均设置有适配第二滑动凸楞的第二滑槽,前肢固定装置包括第一固定板7,第一固定板7水平设置,第一固定板7长度方向为自左向右设置,第一固定板7左端和右端分别通过第一支撑臂8固连左侧板1和右侧板2,第一固定板7上设置多个第一孔洞9,后肢固定装置为设置在顶板4后部,后肢固定装置为设置在顶板4后部的第二孔洞10,多个第二孔洞10自前向后等间隔设置。
33.在上述实施例中,前肢固定装置的孔洞、后肢固定装置、绑扎装置不限于孔洞的形式,也可以是固定在装置上的凸楞、桩等实验室中的常见形式,
34.而这些固定装置的位置均是位于靠近侧板的位置,比如前肢固定装置上对应左前肢的孔洞应设于前肢固定装置的左端。
35.实际使用时,包括以下步骤:
36.s1、将实验兔放置在图1所述固定装置上,固定装置顶面和底面均具有开合功能,实验兔处于趴卧位,将顶板4移除,将兔子放置在左侧板1和右侧板2之间,兔头卡在固定凹陷6内,两个前肢从前挡板3与底板5之间的间隙伸出;
37.s2、将实验兔四肢固定在固定装置上;
38.s3、使实验兔处于冷静状态;
39.s4、转动固定装置,使实验兔处于仰卧位;
40.s5、打开固定装置正对实验兔腹部的面,露出实验兔的腹部;
41.s6、对实验兔进行试验操作,试验操作包括抽血、x光透视、药物注射试验等。
42.以下通过具体试验例证明本发明的有益效果。
43.试验例1、采用本发明固定方法固定实验兔
44.1、实验动物及设备耗材
45.1.1实验动物
46.选用9只普通级健康新西兰大白兔作为实验对象,体重2.5kg
±
0.2kg,购于四川省动物养殖中心(伦理备案号:2018190a),华西动物房饲养1w后待用。分为正常体位组、麻醉仰卧位组和仰卧位组。
47.1.2试剂耗材
48.戊巴比妥钠、生理盐水、肝素钠、三通开关、针灸针、医用纱布绷带、静脉留置针、无菌注射器。
49.1.3仪器设备
50.电子秤、bl
‑
n 420n生物信号采集与处理系统。
51.2、实验方法与结果
52.2.1动物准备
53.实验动物分为3组,正常体位组、仰卧位组和麻醉仰卧位组,每组3只,共9只。正常体位组和仰卧位组只需安抚动物,麻醉仰卧位组需要麻醉处理。
54.正常体位组:固定兔子正常的四肢在地面的体位(趴卧位),该体位无法进行胸腹部的检测。
55.仰卧位组:不使用麻醉,将兔子固定为背部在下,四肢朝上的体位,该体位可以进
行胸腹部的检测。
56.麻醉仰卧位组:将兔子麻醉后,将其固定为背部在下,四肢朝上的体位。
57.2.2动物麻醉
58.使用生理盐水配置浓度为3%的戊巴比妥钠注射液,实验动物称重后,按40mg/kg静脉注射配置好的戊巴比妥钠溶液。最初可较快推注,达半量后减慢注药速度,并注意观察动物反应,如呼吸慢而弱,每分钟不足10次或眼睑反射迟钝,颈项肌肉松弛时,观查5分钟,如确不需加药后肝素封管。戊巴比妥钠为中效巴比妥类药物,麻醉有效时间为3~5小时。根据操作需求,必要时可经耳缘静脉留置针适量追加。
59.2.3生理信号采集
60.首先连接bl
‑
n 420n多通道生理信号采集处理系统和计算机,开启计算机,打开生物信号采集处理系统软件,点击界面菜单栏中的“实验”,打开“循环”项目中的“动脉血压”和“心电图”两个通道模式。将血压和心电电极分别接入到多通道生理信号采集处理系统的ch1和ch2。分别于正常体位、麻醉后仰卧位及仰卧位条件下固定新西兰大白兔于实验台上(采用本技术实施例1所述固定装置及使用方法),耳缘动脉放置留置针,使用三通开关分别与肝素钠生理盐水和血压电极相连,在实验动物两前足与右后足的皮下插入针灸针,并与心电电极相连。安抚新西兰大白兔,待其保持平静之后,开始记录信号,记录时间约为3min。
61.在不同体位及麻醉状态下,选择一组动脉血压和心电信号,通过生物信号采集处理系统进行显示,如图2~4所示。其中每张图的上半部为动脉血压,下半部为心电图(electrocardiogram,ecg)。
62.2.4生理信号分析
63.将采集的动脉血压和心电信号在生理信号采集处理系统中打开。对于动脉血压,选取一段较平稳的信号,提取其中每个心动周期的心率(heart rate,hr)、收缩压(systolic blood pressure,sbp)、舒张压(diastolic blood pressure,dbp)、计算得到对应的平均动脉压(mean arterial pressure,map)和脉压差(pulse pressure,pp)指标。结果显示(表1),麻醉后dbp下降明显,与正常体位组比较存在显著性统计学差异,导致map和pp与正常组比较差异显著,且与正常体位比较,麻醉后心率下降明显。仰卧位与正常体位比较血压、心率均无统计学差异。
64.可见,动物试验中麻醉会影响动物的生理状态,从而可能影响功能学评价结果。采用非麻醉方法固定动物,不仅可以节省时间成本,并且更加符合动物伦理,并且可以得到与生理状态更接近的实验数据。
65.表1.各组动脉压及心率比较
[0066][0067]
注:与正常体位组比较,*p<0.05。
[0068]
兔子是动物实验中使用非常普遍的动物。目前,使用实验兔做动物实验时,采用正常体位很多生理指标无法获得。为了获得更多生理指标,需要在操作过程中改变实验兔的体位,如让实验兔仰卧。但是,现有固定方法无法同时满足不同体位需求,需要在实验操作中采用不同固定方法变换体位,在此过程中需要对实验兔进行麻醉。但是麻醉会影响动物的生理状态,从而可能影响功能学评价结果。
[0069]
实验结果表明:本发明固定方法可以采用非麻醉方法固定动物,并可以改变动物体位,同时满足不同体位需求。这样既可以节省时间成本,又能得到与生理状态更接近的实验数据,更利于研究结果的准确性。可见,本发明固定方法克服了正常体位和麻醉改变体位的缺陷,可以在非麻醉状态下进行多体位辅助检查,这对于保证动物实验结果的准确有重要意义。
[0070]
当然,本发明还可有其它多种实施例,在不背离本发明精神及其实质的情况下,熟悉本领域的技术人员可根据本发明作出各种相应的改变和变形,但这些相应的改变和变形都应属于本发明所附的权利要求的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1