一种醋酸奥曲肽注射液及其制备工艺的制作方法
本发明涉及医药技术领域,尤其涉及一种醋酸奥曲肽注射液及其制备工艺。
背景技术:
奥曲肽是人工合成的八肽化合物,为人生长抑素类似物,奥曲肽的药理作用与天然激素相似,但其抑制生长激素、胰高血糖素和胰岛素的作用较强。与生长抑素相似,奥曲肽也可抑制lh对gnrh的反应、降低内脏血流,抑制5-ht、胃泌素、血管活性肠肽、糜蛋白酶、胃动素、胰高血糖素的分泌。
奥曲肽经皮下注射后吸收迅速且完全,30min内血浆浓度达峰值;静脉注射后,4min达到峰值;分布容积是0.27l/kg,总体清除率是160ml/min。血浆蛋白质结合率达65%。与血细胞结合的奥曲肽可忽略不计;皮下给药的清除半衰期为100min;静脉注射后其消除呈双相,半衰期分别为10min和90min;大部分经粪便排泄,约32%在尿中以原型排出。
奥曲肽于1973年在绵羊下丘脑提取物中被发现,但其稳定性较差,后经瑞士诺华研究开发了醋酸奥曲肽注射液,最早于1987年在新西兰上市,剂型为注射剂,规格包括1ml:0.05mg,1ml:0.1mg,1ml:0.2mg,1ml:0.5mg,1ml:1mg,适应症为治疗肢端肥大症,还用于缓解与功能性胃肠胰腺内分泌肿瘤有关的症状,预防胰腺手术后并发症和肝硬化患者胃-食管静脉曲张所致出血的紧急治疗,目前已在美国、日本、英国、欧洲等国家和地区上市。原研瑞士诺华的醋酸奥曲肽注射液已进口中国,规格1ml:0.1mg,商品名为
国内有多家企业完成本品的工艺开发,但与原研瑞士诺华的醋酸奥曲肽注射液相比,目前国内生产的醋酸奥曲肽注射液一般存在渗透压偏低或有关物质放置过程中增加较快的问题。
渗透压作为注射液重要的质量属性,在一定程度上影响给药过程中的安全性。
技术实现要素:
有鉴于此,本发明提供了一种醋酸奥曲肽注射液及其制备工艺。本发明制得的醋酸奥曲肽注射液具有具有良好的稳定性
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供一种醋酸奥曲肽注射液的制备工艺,包括:
将甘露醇、第一注射用水混合搅拌,依次加入第二注射用水、乳酸,获得第一药液;
向所述第一药液中加入碳酸氢钠调节ph至3.9~4.3,加入醋酸奥曲肽,液面以下通入co2,控制溶氧量≤0.5mg/l,得第二药液;
在二氧化碳保护气下,将第二药液依次经过滤、灌封、灭菌,得到醋酸奥曲肽注射液。
本发明中,每1l醋酸奥曲肽注射液包括注射用水、碳酸氢钠和以下组分:
醋酸奥曲肽0.1g、甘露醇45g、乳酸3.4g;
其中,碳酸氢钠的用量为调节ph至3.9~4.3。
本发明中,在加入醋酸奥曲肽之前用碳酸氢钠调节药液的ph,调节至3.9~4.3后,加入醋酸奥曲肽。在本发明的一些具体实施例中,碳酸氢钠具体采用0.5mol/l碳酸氢钠溶液。
本发明中,所述第一用水为二氧化碳饱和的注射用水。
本发明中,第一注射用水和第二注射用水的体积比为1:2~2:1,具体可为1:2、1:1或2:1。
本发明中,所述灭菌的温度为121℃,灭菌的时间为12~15min。
本发明还提供了由本发明制备工艺制得的醋酸奥曲肽注射液。
本发明制得的醋酸奥曲肽注射液顶空残氧量≤10%,摩尔渗透压为315~350mosmol/kg。
一些具体实施例中,本发明制得的醋酸奥曲肽注射液的残氧量为3.6%,摩尔渗透压为342mosmol/kg。
本发明提供一种醋酸奥曲肽注射液的制备工艺,包括:将甘露醇、第一注射用水混合搅拌,依次加入第二注射用水、乳酸,获得第一混合药液;向所述第一混合药液中加入碳酸氢钠调节ph至3.9~4.3,加入醋酸奥曲肽,液面以下通入co2,控制溶氧量≤0.5mg/l,得第二混合药液;在二氧化碳保护气下,将第二混合药液依次经过滤、灌封、灭菌,得到醋酸奥曲肽注射液。试验表明,相比传统工艺制备的产品,本发明制备的醋酸奥曲肽注射液稳定性明显提高,放置10天,杂质总量为0.55%,最大单个杂质含量为0.25%;放置30天,杂质总量为0.53%。最大单个杂质含量为0.20%。
附图说明
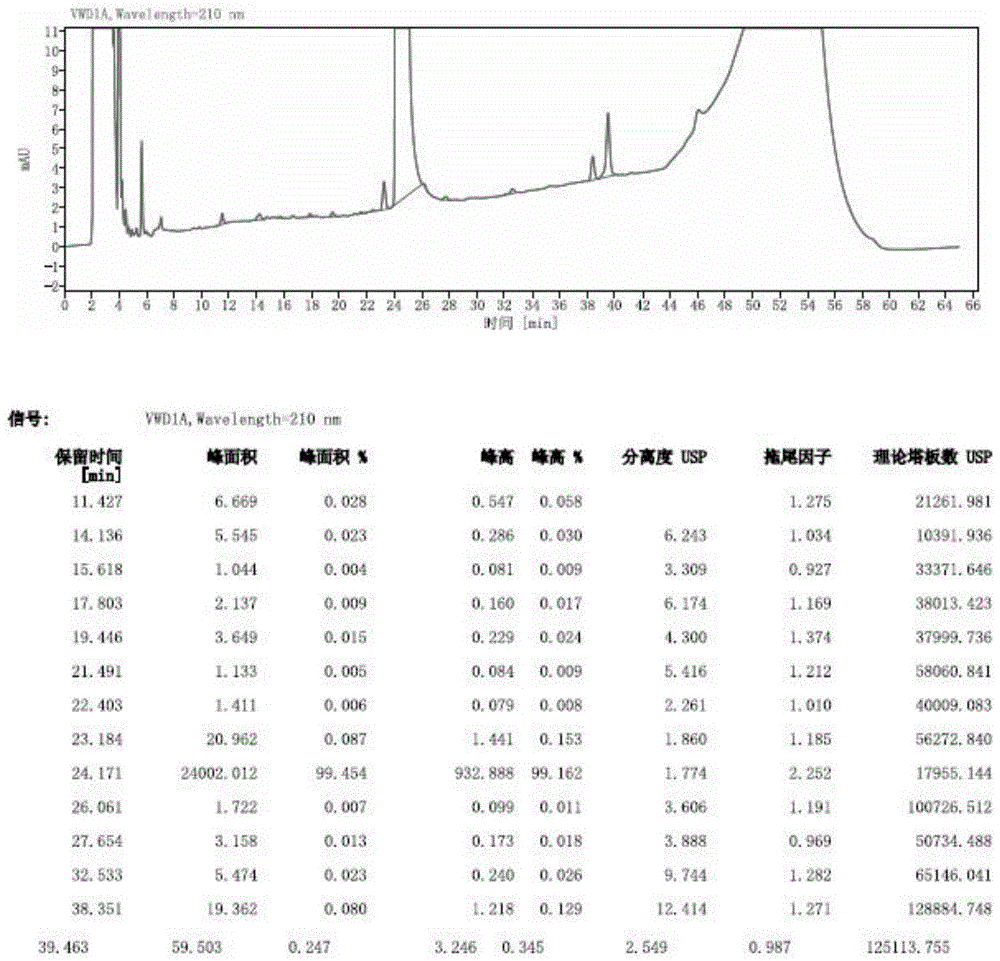
图1示实施例1的注射液10d的杂质水平检测结果;
图2示实施例1的注射液30d的杂质水平检测结果;
图3示对比例1的注射液10d的杂质水平检测结果;
图4示对比例1的注射液30d的杂质水平检测结果;
图5示对比例2的注射液10d的杂质水平检测结果;
图6示对比例2的注射液30d的杂质水平检测结果。
具体实施方式
本发明提供了一种醋酸奥曲肽注射液及其制备工艺。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明采用的试材皆为普通市售品,皆可于市场购得。
如无特殊说明,本发明采用的试材皆为普通市售品,皆可于市场购得。
下面结合实施例,进一步阐述本发明:
实施例1
每1l注射液的配方组成如下:
表1
按照表1的处方称取制备100l注射液所需的各组分,将称量好的甘露醇投入到不锈钢桶中,加入预通入co2的约50l的第一注射用水,搅拌后将其加入稀配罐中,加入第二注射用水至100kg。加入处方量乳酸,获得第一药液。
向第一药液中加入0.5mol/l碳酸氢钠溶液,直至药液ph值在3.9~4.3之间,将称量好的醋酸奥曲肽用注射用水溶解投入稀配罐中,向稀配罐液面以下通入co2,控制溶氧量≤0.5mg/l;如溶氧量高于0.5mg/l,继续充co2直至溶氧量≤0.5mg/l,获得第二药液;
将第二药液用滤器进行过滤,药液以co2为动力源经过滤器、管道输入接收罐;过滤完毕后,通入co2保压30min,使用co2为动力源将药液输送至缓冲罐。缓冲罐有药液存储后,保持co2吹扫。灌封前、后均进行co2充填保护,获得醋酸奥曲肽注射液。
对实施例1制备的注射液样品进行残氧量和摩尔渗透压检验,实施例1的样品残氧量为3.6%,摩尔渗透压为342mosmol/kg。
在40℃条件下,分别于10天和30天对杂质水平进行检验。实施例1的注射液样品的检测结果如图1~2所示,结果显示,放置10天,杂质总量为0.55%,最大单个杂质含量为0.25%(图1);放置30天,杂质总量为0.53%。最大单个杂质含量为0.20%(图2)。
对比例1
采用实施例1相同的处方,采用不添加co2保护的工艺制备注射液,其他步骤参数同实施例1。
经检测,制得的注射液样品中残氧量为19%,摩尔渗透压为285mosmol/kg。
在40℃条件下,分别于10天和30天对样品杂质水平进行检验。检验结果显示放置10天,杂质总量为0.1%,最大单个杂质含量为0.3%(图3);放置30天,杂质总量为1.51%。最大单个杂质含量为0.8%(图4)。
对比例2
采用实施例1相同的处方,将co2保护改为n2保护,其他步骤参数均与实施例1相同。经检测,制得的注射液样品中残氧量为4.0%,摩尔渗透压为288mosmol/kg。
在40℃条件下,分别于10天和30天对样品杂质水平进行检验。检验结果显示放置10天,杂质总量为0.9%,最大单个杂质含量为0.3%(图5);放置30天,杂质总量为1.44%。最大单个杂质含量为0.7%(图6)。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!