包含从夏枯草中分离的脓毒酸A作为有效成分的抗血管生成用组合物的制作方法
包含从夏枯草中分离的脓毒酸a作为有效成分的抗血管生成用组合物
技术领域
1.本发明涉及一种抗血管生成用组合物,所述组合物包含从夏枯草中分离且血管生成抑制效果优异的脓毒酸a作为有效成分,具有优异的血管生成抑制效果。
背景技术:
2.血管生成(angiogenesis)是从现有血管生成新的血管的过程,作为正常生理作用的一部分维持个体的稳态而必不可少的过程。这种血管生成是通过包括以下步骤的一系列连续的步骤而完成;由蛋白酶分解血管基底膜、形成血管壁的血管内皮细胞的迁移、增殖以及由血管内皮细胞分化而形成管来重组血管,以生成新的毛细血管。
3.由于血管具有为细胞提供氧气和养分的功能,因此,体内存在的所有细胞都存在于从血管中扩散氧气的范围的约100μm以内。当细胞超出这个范围时,该细胞就会暴露在缺氧环境(hypoxic environment)中,并分泌一种叫做缺氧诱导因子(hypoxia inducible factor 1α,hif1α)的物质来促进血管生成。
4.血管生成是除了生理作用以外,在肿瘤的生长、肺性高血压、糖尿病性视网膜病、老年性黄斑变性等多种疾病的病程中非常重要的现象。由于血管生成在各种疾病过程中所具有的重要性,已经进行了许多关于抑制血管生成过程的研究。
5.夏枯草为干燥唇形科植物夏枯草(prunella vulgaris l.)全草而得到。夏枯草又称蜂蜜草、夕句、乃东、燕面,生长在各地的山野、路旁。花开时切全草,在阴凉的地方晒干,苦味,性寒。
6.夏枯草作用于肝经,起到解热、解毒、明目作用。而且,众所周知,具有降血压作用、利尿作用、抗菌作用,对水肿、高血压、肺结核、流行性肝炎等也有效。
7.关于夏枯草的药理作用,韩国专利公开第10-2005-0119488号公开了一种用于预防和治疗退行性关节炎的药物组合物,所述药物组合物包括含有氨基葡萄糖和牛油提取物的牛油提取物混合物、鲨鱼软骨提取物、夏枯草提取物及圣约翰草提取物,另外,韩国专利公开第10-2008-0056462号公开了预防、治疗及抑制癌症疾病的组合物,所述组合物包括夏枯草提取物作为有效成分,另外,韩国专利公开第10-2012-0058756号公开了预防及治疗糖尿病性动脉粥样硬化的药物组合物。
8.【现有技术文件】
9.【专利文件】
10.(专利文件1)韩国专利公开第10-2005-0119488号
11.(专利文件2)韩国专利公开第10-2008-0056462号
12.(专利文件3)韩国专利公开第10-2012-0058756号
技术实现要素:
13.本发明的目的在于,提供一种抗血管生成用组合物,所述组合物包含从夏枯草中
epicorosolic acid)的物质,优选通过以下方法而分离;所述方法,包括:用醇提取夏枯草而获得夏枯草提取物的步骤;过滤所述夏枯草提取物获得滤液的步骤;对所述滤液进行减压浓缩获得夏枯草提取物浓缩液的步骤;通过向所述夏枯草提取物浓缩液添加浓缩液重量的20倍至25倍体积的蒸馏水进行振荡获得悬浮液的步骤;从所述悬浮液中分离出二氯甲烷(ch2cl2)馏份的步骤;对所述二氯甲烷馏分进行梯度洗脱获得脓毒酸a馏分的步骤;以及提纯所述脓毒酸a馏分,进行减压干燥获得脓毒酸a的步骤。
34.以下,将详细说明本发明。
35.夏枯草优选切割使用。对夏枯草添加夏枯草重量的6至8倍体积的醇来提取的。作为醇,优选使用具有碳数1至5的醇,更优选地,可以使用甲醇、乙醇及异丙醇中的一种以上。
36.作为提取方法,可以使用冷浸提取、热水提取、超声波提取、回流提取、冷却提取等的常规的提取方法,更优选通过回流冷却提取进行提取。提取进行2至4小时,更优选进行3小时。而且,提取可以反复进行1次或2次以上,优选反复进行2至4次,更优选反复进行3次。
37.提取后进行过滤获得滤液。将获得的滤液减压浓缩,获得脱醇的夏枯草提取物浓缩液。
38.对所述夏枯草提取物浓缩液添加浓缩液重量的20至25倍体积的蒸馏水后进行振荡获得悬浮液。
39.对所述悬浮液添加等量的二氯甲烷(ch2cl2)进行溶剂分馏来分离二氯甲烷馏份。
40.在流动相的乙酸乙酯和醇的混合液悬浮硅胶制造的柱中,对所述二氯甲烷馏分进行梯度洗脱,分离出含有脓毒酸a的馏分后进行浓缩获得脓毒酸a馏分。将分离出的脓毒酸a馏份通过制备高效液相色谱(prep hplc)进行提纯,并在40℃的温度下减压干燥6小时,获得纯物质的脓毒酸a。
41.将脓毒酸a的结构式示于图1。
42.如在transwell移动分析中的细胞侵袭减少效果、管形成分析中的管形成抑制效果、新生血管生成因子抑制效果、在体内血管生成模型中的血管生成减少及血红蛋白减少效果所确认,脓毒酸a的血管生成抑制效果优异。
43.因此,本发明的包含从夏枯草中分离的脓毒酸a作为有效成分的抗血管生成用组合物,具有优异的血管生成抑制效果,可有效地用于预防、治疗及改善与血管生成相关的疾病。
44.所述组合物优选包含浓度为20至40μm的脓毒酸a,较优选包含浓度为30至40μm的脓毒酸a,特别优选包含浓度为40μm的脓毒酸a。
45.下面,通过实施例更详细地说明本发明。这些实施例是本发明的例示,本发明的范围并不局限于此。
46.《实施例1》
47.脓毒酸a的分离
48.购买切割状态的夏枯草。在购买的300g的夏枯草中添加2l的甲醇,在加热罩(heating mantle)回流冷却,经3小时提取3次。
49.在布氏漏斗铺滤纸过滤减压获得的夏枯草提取物,对所获得的夏枯草滤液进行减压浓缩,获得22.4g的去除甲醇的浓缩提取物。
50.向22.4g的所得浓缩提取物添加500ml的蒸馏水,进行振荡悬浮后,添加等量的二
氯甲烷(ch2cl2),通过溶剂分馏分离8.4g的二氯甲烷(ch2cl2)馏分。
51.将250g的硅胶(230至400目)悬浮在乙酸乙酯(etoac):甲醇(meoh)=1:0的混合液(流动相)中,制成9:1大小的柱。将8.4g的二氯甲烷(ch2cl2)馏份溶解在初始流动相中并加载到所述柱上,然后,使用流动相溶剂进行梯度洗脱[etoac:meoh=10:0:0:10]。通过tlc(rp溶剂meoh:h2o=90:10,rf 0.3)确认在洗脱的馏分中含有脓毒酸a的馏分,合并后进行浓缩获得提纯的脓毒酸a馏分。将脓毒酸a馏分通过制备高效液相色谱(prep hplc)进行提纯,并在40℃的温度下减压干燥6小时而获得60mg的纯脓毒酸a。从草药提取物中获得的脓毒酸a的收率为0.027%。
[0052]
【实验例】
[0053]
准备细胞
[0054]
实验中使用svec4-10细胞,svec4-10细胞购自atcc。
[0055]
《实验例1》
[0056]
细胞侵袭减少效果
[0057]
通过transwell移动分析法(transwell migration assay)如下确认了脓毒酸a在由纤连蛋白(fn)诱导的细胞侵袭上的细胞侵袭减少效果。
[0058]
用5μg/ml的纤连蛋白包被transwell,在4℃的温度下放置过夜。将包被有纤连蛋白的transwell用1%bsa封闭(blocking)60分钟后用pbs清洗。
[0059]
将2
×
104细胞/孔的svec4-10细胞分别用10μm、20μm及40μm浓度的脓毒酸a预处理30分钟,然后,在经清洗的transwell的上室(upper chamber)进行分株,在37℃的温度、5%的湿度、co2的条件下培养16小时。
[0060]
将培养的transwell的细胞用4%多聚甲醛(paraformaldehyde)固定后,用0.1%结晶紫(crystal violet)染色。
[0061]
作为阴性对照组(nc)使用涂有2%bsa,并在4℃的温度下放置过夜的transwell上培养的svec4-10细胞,作为阳性对照(pc)使用未用脓毒酸a预处理而处理纤连蛋白的svec4-10细胞。
[0062]
细胞侵袭程度用与阳性对照组比较的百分比来确认,将其结果示于图2。
[0063]
如图2的结果所示,由纤连蛋白诱导的细胞侵袭通过脓毒酸a得到减少,并且,脓毒酸a的浓度越高,细胞侵袭的减少效果也越大。尤其,在40μm浓度下,细胞侵袭程度低于阴性对照组。
[0064]
《实验例2》
[0065]
管形成抑制效果
[0066]
通过管形成分析法(tube formation assay)如下确认了脓毒酸a的管形成抑制效果。
[0067]
在96孔板分别添加50μl的基质胶后,在37℃的温度下放置30分钟进行聚合反应。
[0068]
以4
×
104细胞/孔分株svec4-10细胞,并用10μm、20μm及40μm浓度的脓毒酸a预处理30分钟。
[0069]
将用脓毒酸a预处理的svec4-10细胞接种(seeding)在基质胶后,在37℃的温度、5%的湿度、co2条件下培养3小时。
[0070]
作为阴性对照组(nc)使用未经胎牛血清(fbs,fetal bovine serum)处理的
svec4-10,作为阳性对照组(pc)使用未经脓毒酸a预处理而处理fbs的svec4-10细胞。
[0071]
管形成程度用与阳性对照组比较的百分比来确认,将其结果示于图3。
[0072]
如图3的结果所示,当处理脓毒酸a时,管形成度得到抑制,并且,脓毒酸a的浓度越高,管形成抑制效果也越大。
[0073]
《实验例3》
[0074]
管形成抑制效果
[0075]
通过管形成分析法,如下比较脓毒酸a和新生血管抑制剂的su5416(semaxanib)的管形成抑制效果。
[0076]
在96孔板分别添加50μl的基质胶后,在37℃的温度下放置30分钟进行聚合反应。
[0077]
以4
×
104细胞/孔分株svec4-10细胞,用40μm的脓毒酸a和4μm的su5416分别预处理30分钟。
[0078]
将经预处理的svec4-10细胞接种在基质胶上后,在37℃的温度、5%湿度、co2条件下培养3小时。
[0079]
作为对照组(control)使用仅处理基质胶的svec4-10细胞。
[0080]
管形成程度用与对照组比较的百分比来确认,将其结果示于图4。
[0081]
如图4的结果所示,当处理脓毒酸a与新生血管抑制剂的su5416时,管形成度均得到抑制,并且,与处理su5416的情况相比,当用脓毒酸a处理时,管形成度进一步得到抑制。
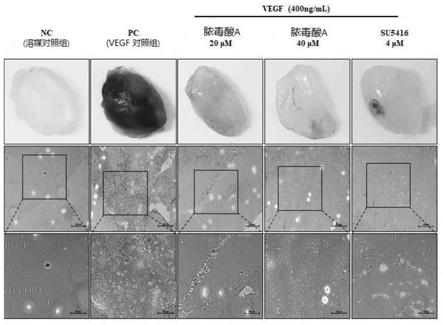
[0082]
用作阳性药物(positive drug)的su5416是公知的血管生成抑制剂。su5416的浓度参考先前的研究论文。(ref:penduliflaworosin,a diterpenoid from croton crassifolius,exerts anti-angiogenic effect via vegf receptor-2signaling pathway)
[0083]
《实验例4》
[0084]
血管生成因子抑制效果
[0085]
通过蛋白质印迹分析法(western blotting analysis)如下确认了脓毒酸a的血管生成因子抑制效果。
[0086]
将10μm、20μm及40μm的脓毒酸a对svec4-10细胞分别处理24小时,然后,使用ripa溶解缓冲液进行溶解。
[0087]
从10%十二烷基硫酸钠-聚丙烯酰胺凝胶上分离等量的蛋白质。将分离出的蛋白质转移到硝酸纤维素膜上,在tbst(10mmol/l tris ph 8.0,150mmol/l nacl,0.1%tween 2)用5%脱脂牛奶封闭1小时,然后,与对新生血管生成因子的fak、p-fak、src、p-src、akt、p-akt、erk及p-erk的一抗一起在4℃的温度下反应一晚上。作为标准物质使用β-肌动蛋白(β-actin)。
[0088]
用tbst清洗后,将硝酸纤维素膜与hrp-偶联二抗一起在室温下培养2小时。
[0089]
培养后,使用增强化学发光(ecl,enhanced chemiluminescence)试剂检测各蛋白质。
[0090]
作为阴性对照组(nc)使用未经胎牛血清(fbs,fetal bovine serum)处理的svec4-10,作为阳性对照组(pc)使用未经脓毒酸a预处理而处理fbs的svec4-10细胞。
[0091]
将其结果示于图5。
[0092]
如图5的结果所示,当处理脓毒酸a时,参与新生血管生成的蛋白质p-fak、p-src、
p-akt、p-erk的表达量受到抑制,并且,脓毒酸a的浓度越高,抑制效果也越大。
[0093]
《实验例5》
[0094]
血管生成因子抑制效果
[0095]
将脓毒酸a的血管生成因子抑制效果与新生血管抑制剂的su5416的血管生成因子抑制效果进行比较。
[0096]
将40μm的脓毒酸a和4μm的su5416对svec4-10细胞分别处理24小时,作为新生血管生成因子使用fak、p-fak、erk及p-erk,作为对照组使用仅处理基质胶的svec4-10细胞之外,以与实验例4相同的方式进行了实验。将其结果示于图6。
[0097]
如图6的结果所示,与处理新生血管抑制剂su5416的情况相比,处理脓毒酸a时,p-fak和p-erk的表达量得到进一步减少。
[0098]
用作阳性药物(positive drug)的su5416是公知的血管生成抑制剂。su5416的浓度参考先前的研究论文。(ref:penduliflaworosin,a diterpenoid from croton crassifolius,exerts anti-angiogenic effect via vegf receptor-2signaling pathway)
[0099]
《实验例6》
[0100]
体内基质胶塞分析(in vivo matrigel plug assay)
[0101]
在体内(in vivo)血管生成模型中,如下确认了脓毒酸a对血管生成和血红蛋白含量引起的效果。
[0102]
小鼠为从(株)coretech购买使用6周龄的小鼠。使用20μm和40μm的脓毒酸a作为实验样品,为了比较,使用了4μm的su5416。
[0103]
在4℃的温度下,对基质胶混合400ng/ml的vegf(vascular endothelial growth factor)和20u的肝素的基质胶混合物中混合每个样品之后,放在冰块上去除泡沫。麻醉准备号的小鼠,去除两肋的毛之后,在每个部位分别皮下插入200μl的所述基质胶混合物和实验样品的混合物。
[0104]
作为阴性对照组(nc),使用未经胎牛血清(fbs,fetal bovine serum)处理的svec4-10,作为阳性对照组(pc),使用未经脓毒酸a预处理而处理fbs的svec4-10细胞。
[0105]
放置一周后,解剖小鼠,确认基质胶的形态和颜色,将结果示于图7,确认基质胶中血管的密度,将结果示于图8。
[0106]
从图7及图8的结果可以确认,在处理vegf时,基质胶中形成了很多血管。处理脓毒酸a和sus5416时,血管生成得到减少,处理40μm脓毒酸a时,血管生成减少效果优于sus5416。
[0107]
此外,切除基质胶的一部分放入含有500μl的dw(+0.2%肝素)的管内,并在冰箱内放置过夜,然后以15,000rpm的速度离心分离20分钟。将离心分离的100μl的上清液与100μl的德腊布金(氏)试剂盒溶液(drabskin kit solution)混合,在540nm下测量血红蛋白的浓度,将结果示于图9。
[0108]
如图9的结果所示,确认到在体内血管生成模型中,vegf处理组显示出血红蛋白的含量较高,但处理脓毒酸a时,血红蛋白的含量显着降低,处理40μm的脓毒酸时,相较于sus5416,血红蛋白的含量更低。
[0109]
用作阳性药物(positive drug)的su5416是公知的血管生成抑制剂。su5416的浓
度参考先前的研究论文。(ref:penduliflaworosin,a diterpenoid from croton crassifolius,exerts anti-angiogenic effect via vegf receptor-2signaling pathway)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1