奥硝唑制剂及其制备方法和用途与流程
1.本技术一般涉及医药技术领域,具体涉及奥硝唑制剂及其制备方法和用途,更具体的,本技术涉及一种奥硝唑制剂、亚硝酸盐和硝酸盐作为标准品在对奥硝唑制剂进行质量控制中的用途、一种制备奥硝唑制剂的方法以及奥硝唑在制备药物中的用途。
背景技术:
2.奥硝唑(ornidazole,onz)的化学名称为1
‑
氯
‑3‑
(2
‑
甲基
‑5‑
硝基咪唑)异丙醇(式ⅰ),是继甲硝唑、替硝唑后的第3代硝基咪唑类药物,具有良好的抗厌氧菌、抗阿米巴原虫和抗滴虫作用,临床上主要用于手术前预防感染和手术后抗厌氧菌的治疗。左旋奥硝唑是奥硝唑的左旋体,其抗菌活性强于奥硝唑,且有较低的副作用,特别是其中枢神经毒性明显低于奥硝唑。
[0003][0004]
然而,对于奥硝唑的研究目前仍有待深入。
技术实现要素:
[0005]
本发明是基于发明人的下列发现而完成的:
[0006]
发明人在对奥硝唑制剂进行深入研究过程中,意外地发现奥硝唑制剂中存在之前尚未发现的杂质,即亚硝酸盐和硝酸盐中的至少之一。究其原因,有可能是因为奥硝唑制剂的制备中通常采用湿热灭菌从而造成亚硝酸盐或硝酸盐的产生。由于上述杂质的存在,使得奥硝唑制剂在储存过程中,尤其是高温储存过程中出现了有关物质的量显著降低、物料不平衡的现象。
[0007]
在本技术的第一个方面,本技术的实施例提供了一种奥硝唑制剂,基于所述奥硝唑制剂的总重量,所述奥硝唑制剂中亚硝酸盐和硝酸盐至少之一的含量不超过1重量%,该限量以下的亚硝酸盐和硝酸盐不会对人体产生明显的毒副作用,且不会影响奥硝唑制剂的稳定性和疗效。
[0008]
优选的,所述亚硝酸盐的含量不超过0.53重量%。
[0009]
优选的,所述亚硝酸盐的含量不超过0.15重量%。
[0010]
优选的,所述硝酸盐的含量不超过0.6重量%。
[0011]
优选的,所述硝酸盐的含量不超过0.15重量%。
[0012]
优选的,所述亚硝酸盐的含量为0.08~0.53重量%;和/或所述硝酸盐的含量为0.02~0.6重量%。
[0013]
优选的,所述奥硝唑为左奥硝唑,所述奥硝唑制剂为注射剂。
[0014]
更优选的,所述奥硝唑制剂为注射液。
[0015]
对于注射剂之溶液型注射液,例如大输液和小水针,通常采用湿热灭菌法对产品进行终端灭菌,使残存微生物污染概率≤10
‑6。湿热灭菌法多利用高压饱和蒸汽、过热水喷淋等手段,温度通常都达到115℃以上,本技术的发明人推测,在此温度下,可能是奥硝唑发生降解反应,从而产生对人体有害的杂质亚硝酸盐和/或硝酸盐。
[0016]
在本技术的第二个方面,本技术的实施例提供了亚硝酸盐和硝酸盐作为标准品在对奥硝唑制剂进行质量控制中的用途。
[0017]
由于亚硝酸盐和硝酸盐中的至少之一是发明人在奥硝唑药物产品中发现的杂质,在奥硝唑药物制备过程中不可避免的产生,且上述杂质为致癌物质,对奥硝唑药物质量的控制带来较大的风险。因此,采用硝酸盐和亚硝酸盐作为标准品能够有效地用于对奥硝唑药物中存在的上述杂质进行分析,进而对奥硝唑的质量进行控制。
[0018]
根据本发明的实施例,亚硝酸盐和硝酸盐作为标准品在对奥硝唑制剂进行质量控制中的用途在实践中,可以通过下列步骤进行:
[0019]
提供亚硝酸盐和硝酸盐,将其作为杂质标准品或杂质对照品;
[0020]
提供奥硝唑制剂供试品,检测奥硝唑制剂供试品中的杂质的存在和/或含量。
[0021]
在本技术的一个实施例中,亚硝酸盐作为标准品在对奥硝唑制剂进行质量控制中的用途在实践中,可以通过下列步骤进行:
[0022]
移取不同体积的亚硝酸盐溶液,依次加入适量水、对氨基苯磺酸溶液和氨基萘磺酸溶液后稀释至刻度,室温放置,得到对照品溶液;
[0023]
利用紫外分光光度计测定吸光度,绘制标准曲线,得到线性回归方程:
[0024]
移取待测奥硝唑制剂,依次加入适量水、对氨基苯磺酸溶液和氨基萘磺酸溶液后稀释至刻度,室温放置,得到供试品溶液;
[0025]
利用紫外分光光度计测定吸光度,带入所述线性回归方程进行计算,得到供试品溶液中亚硝酸盐含量。
[0026]
优选地,紫外分光光度计检测波长为524nm。
[0027]
在本技术的一个实施例中,硝酸盐作为标准品在对奥硝唑制剂进行质量控制中的用途在实践中,可以通过下列步骤进行:
[0028]
提供奥硝唑制剂供试品溶液;
[0029]
提供含有硝酸盐的对照品溶液;
[0030]
利用液相色谱对对照品溶液进行检测得到参照图谱,确定硝酸盐的保留时间;
[0031]
利用液相色谱对供试品溶液进行检测,确定供试品溶液中是否含有保留时间与硝酸盐保留时间一致的物质,从而确定供试品溶液中硝酸盐的存在和/或量。
[0032]
在本技术的一个实施例中,对照品溶液为每1ml含硝酸盐15μg的硝酸钠溶液。
[0033]
在本技术的一个实施例中,以十八烷基硅烷键合硅胶为色谱柱填料,以体积比为78~82:18~22的含0.25%四丁基氢氧化铵的磷酸二氢钾缓冲液
‑
乙腈混合液为流动相。
[0034]
在本技术的一个实施例中,检测的柱温为25~35℃,流速为0.7~0.9ml/min,进样
量为10μl,检测波长为220nm。
[0035]
在本技术的另一个实施例中,硝酸盐作为标准品在对奥硝唑制剂进行质量控制中的用途在实践中,可以通过下列步骤进行:
[0036]
提供奥硝唑制剂供试品溶液;
[0037]
提供含有硝酸盐的对照品溶液;
[0038]
利用离子色谱对对照品溶液进行检测得到参照图谱,确定硝酸盐的保留时间;
[0039]
利用离子色谱对供试品溶液进行检测,确定供试品溶液中是否含有保留时间与硝酸盐保留时间一致的物质,从而确定供试品溶液中硝酸盐的存在和/或量。
[0040]
在本技术的一个实施例中,对照品溶液为每1ml含硝酸盐15μg的硝酸钠溶液。
[0041]
在本技术的一个实施例中,采用阴离子交换色谱柱,采用25mm氢氧化钾溶液为淋洗液。
[0042]
在本技术的一个实施例中,检测的柱温为30℃,流速为1.0ml/min,进样量为50μl。
[0043]
在本技术的第三个方面,本技术提供了一种制备奥硝唑制剂的方法,包括:
[0044]
控制奥硝唑制剂中杂质的含量,
[0045]
其中,
[0046]
所述杂质包括亚硝酸盐和硝酸盐的至少之一,
[0047]
所述奥硝唑制剂中亚硝酸盐和硝酸盐至少之一的含量不超过1重量%。
[0048]
其中,杂质的含量的控制方法之一包括调控灭菌工艺,研究奥硝唑合适的灭菌循环。
[0049]
在本技术的第四个方面,本技术提供了奥硝唑在制备药物中的用途,所述药物用于治疗或者预防滴虫、阿米巴虫及厌氧菌感染,所述奥硝唑中亚硝酸盐和硝酸盐至少之一的含量不超过1重量%。
[0050]
根据本技术的实施例,本技术发现了新的左奥硝唑杂质亚硝酸盐和硝酸盐,属于左奥硝唑的高温降解产物,其在中国药典、美国药典、英国药典、欧洲药典等药典标准中均没有专门的论述和规定的限度,上述未被研究到的新降解产物无疑降低了左奥硝唑的质量,且具有致癌、致高铁血红蛋白血症等毒性,对药品中的亚硝酸盐和硝酸盐含量进行定性/定量检测对于保障药品安全性和药效一致性具有重要意义。
[0051]
根据本技术的实施例,本技术首次报道了奥硝唑制剂中存在的新杂质,且对其限定含量进行了规定,其作为标准品可用于检测奥硝唑制剂中的杂质,进而用于奥硝唑制剂的质量控制,为奥硝唑的安全用药提供了保障。
附图说明
[0052]
通过阅读参照以下附图所作的对非限制性实施例所作的详细描述,本技术的其它特征、目的和优点将会变得更明显:
[0053]
图1为市售供试品溶液的液相检测谱图;
[0054]
图2为含有硝酸盐的对照品溶液的液相检测图谱。
具体实施方式
[0055]
下面结合实施例对本技术作进一步的详细说明。可以理解的是,此处所描述的具
体实施例仅仅用于解释相关发明,而非对该发明的限定。
[0056]
需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。
[0057]
需要说明的是,在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
[0058]
实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
[0059]
一般方法
[0060]
如果特别说明,在下面的实施例中,采用下列方法对奥硝唑制剂进行下列测试。
[0061]
检测亚硝酸盐的方法:
[0062]
1)建立标准曲线
[0063]
取亚硝酸钠0.6g(按干燥品计算),精密称定,加水溶解并稀释至100ml,摇匀;精密量取1ml,用水稀释至200ml后,制得亚硝酸盐标准溶液;
[0064]
精密量取不同体积的亚硝酸盐溶液,先加水40ml,后加对氨基苯磺酸溶液(取对氨基苯磺酸0.5g,加冰醋酸30ml和水120ml,加热搅拌溶解,放冷,滤过)2ml,再加氨基萘磺酸溶液(称取1
‑
萘胺
‑7‑
磺酸0.5g,加冰醋酸30ml和水120ml,加热搅拌溶解,放冷,滤过)2ml,用水稀释至50ml,摇匀,室温放置1小时;
[0065]
取水1ml,先加水40ml,后加对氨基苯磺酸溶液2ml,再加氨基萘磺酸溶液2ml,用水稀释至50ml,摇匀,室温放置1小时,制得空白参考溶液;
[0066]
利用紫外分光光度计于524nm测定吸光度,绘制标准曲线,得到线性回归方程;
[0067]
2)样品处理和测定
[0068]
精密量取左奥硝唑氯化化注射液适量(约相当于左奥硝唑4.0mg),先加水40ml,后加对氨基苯磺酸溶液2ml,再加氨基萘磺酸溶液2ml,用水稀释至50ml,摇匀,室温放置1小时;
[0069]
利用紫外分光光度计于524nm测定吸光度,将吸光度值带入线性回归方程进行计算,计算获得供试品中的亚硝酸盐含量。
[0070]
检测硝酸盐的方法1:
[0071]
1)建立参考图谱
[0072]
取硝酸钠标准品适量,精密称定,用水稀释制成每1ml约含硝酸盐15μg的溶液(硝酸钠换算成硝酸盐的折算系数为0.7295);
[0073]
精密量取对照品溶液注入液相色谱仪,记录参考色谱图,色谱条件如下:
[0074]
用十八烷基硅烷键合硅胶为填充剂;以含0.25%四丁基氢氧化铵的磷酸二氢钾缓冲液(取10%四丁基氢氧化铵溶液25ml和磷酸二氢钾1.36g,加水溶解使成1000ml,并用磷酸调ph值至7.0)
‑
乙腈(80:20)为流动相;检测波长为220nm;柱温为30℃;流速为0.8ml/min;进样体积10μl;
[0075]
2)供试样品检测
[0076]
精密量取供试品溶液注入液相色谱仪,记录色谱图;供试品溶液色谱图中如有与硝酸盐保留时间一致的色谱峰,按外标法以峰面积计算硝酸盐含量。
[0077]
检测硝酸盐的方法2:
[0078]
1)建立参考图谱
[0079]
取硝酸钠标准品适量,精密称定,用水稀释制成每1ml约含硝酸盐15μg的溶液(硝酸钠换算成硝酸盐的折算系数为0.7295);
[0080]
精密量取对照品溶液注入液相色谱仪,记录参考色谱图,色谱条件如下:
[0081]
采用阴离子交换色谱柱(ionpac as19柱或效能相当的色谱柱);以25mm氢氧化钾溶液为淋洗液;检测器为电导检测器(其前接阴离子膜抑制器);检测方式为抑制电导检测;柱温为30℃;流速为1.0ml/min;进样体积50μl;
[0082]
2)供试样品检测
[0083]
精密量取供试品溶液注入液相色谱仪,记录色谱图;供试品溶液色谱图中如有与硝酸盐保留时间一致的色谱峰,按外标法以峰面积计算硝酸盐含量。
[0084]
若无特别说明,以下实施例中的硝酸盐含量测定采用检测方法1进行。
[0085]
实施例1奥硝唑制剂在低于20℃的长期稳定性试验
[0086]
对市售五个批次的左奥硝唑氯化钠注射液在低于20℃的储存条件下的亚硝酸盐和硝酸盐含量进行测定,具体考察了左奥硝唑氯化钠注射液在18个月储存期内的亚硝酸盐和硝酸盐含量,其中,前12个月内每储藏3个月测定一次,后6个月内每储藏6个月测定一次。
[0087]
结果如下表所示,其中一个批次的供试品溶液在储存前(即首次进行硝酸盐含量测定)的液相检测图谱如图1所示,含有硝酸盐的对照品溶液的液相检测图谱如图2所示:
[0088]
表1亚硝酸盐含量测定结果
[0089] 首次3个月后6个月后9个月后12个月后18个月后批次10.090.0790.0670.0720.0620.066批次20.0810.0680.0640.0740.0580.062批次30.0780.0680.0640.0740.0590.061批次40.0860.0640.0680.0690.0590.042批次50.0860.0710.0610.0450.0550.059
[0090]
表2硝酸盐含量测定结果
[0091] 首次3个月后6个月后9个月后12个月后18个月后批次10.020.050.080.090.110.15批次20.020.050.070.090.110.14批次30.020.050.070.090.10.14批次40.020.060.090.090.110.15批次50.020.060.180.10.120.16
[0092]
从图1和图2可以看出,左奥硝唑氯化钠注射液在7.503min处出现了硝酸盐的色谱峰;
[0093]
从表1和表2可以看出,左奥硝唑氯化钠注射液中的上述杂质亚硝酸盐和硝酸盐在初始制成的制剂中已经存在,说明亚硝酸盐和硝酸盐是左奥硝唑制备过程中产生的;其中,上述两种杂质在低温长期贮藏过程中的含量变化不明显。
[0094]
实施例2奥硝唑制剂在25
±
2℃的长期稳定性试验
[0095]
本技术的发明人同时对上述五个批次的左奥硝唑氯化钠注射液在25
±
2℃的储存条件下的亚硝酸盐和硝酸盐含量进行测定,具体考察了左奥硝唑氯化钠注射液在18个月储存期内的亚硝酸盐和硝酸盐含量,其中,前12个月内每储藏3个月测定一次,后6个月内每储藏6个月测定一次,实验结果如下表所示:
[0096]
表3亚硝酸盐含量测定结果
[0097] 首次3个月后6个月后9个月后12个月后18个月后批次10.090.0830.0980.0720.0850.091批次20.0810.0830.1020.1170.0880.091批次30.0780.0870.0990.120.0910.092批次40.0860.0870.0880.1080.0880.07批次50.0860.0800.0910.1080.0870.087
[0098]
表4硝酸盐含量测定结果
[0099] 首次3个月后6个月后9个月后12个月后18个月后批次10.020.080.140.180.250.39批次20.020.080.150.20.290.41批次30.020.080.150.20.280.43批次40.020.080.150.180.270.39批次50.020.10.170.220.320.45
[0100]
可以看出,相较于低温储藏,同一测定时期的左奥硝唑氯化钠注射液中的亚硝酸盐和硝酸盐含量呈现上升的趋势,说明亚硝酸盐和硝酸盐的产生与温度相关;其中,在该温度下的长期贮藏过程,亚硝酸盐的含量变化不明显,而硝酸盐的含量随储藏时间的增加呈现增长趋势。
[0101]
实施例3奥硝唑制剂在30
±
2℃的高温破坏试验
[0102]
基于上述实验,本技术的发明人发现左奥硝唑氯化钠注射液中的亚硝酸盐和硝酸盐含量与温度相关,同时对上述五个批次的左奥硝唑氯化钠注射液在30
±
2℃的储存条件下的亚硝酸盐和硝酸盐含量进行测定,具体考察了左奥硝唑氯化钠注射液在6个月储存期内的亚硝酸盐和硝酸盐含量,其中,前3个月内每储藏1个月测定一次,后3个月内每储藏3个月测定一次,实验结果如下表所示:
[0103]
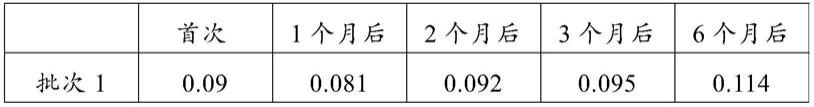
表5亚硝酸盐含量测定结果
[0104]
[0105][0106]
表6硝酸盐含量测定结果
[0107] 首次1个月后2个月后3个月后6个月后批次10.020.060.080.120.21批次20.020.050.080.120.24批次30.020.060.090.110.21批次40.020.060.090.110.21批次50.020.070.10.130.27
[0108]
可以看出,相较于低温储藏和25
±
2℃的储藏,同一测定时期的左奥硝唑氯化钠注射液中的亚硝酸盐和硝酸盐含量呈现明显的上升趋势,进一步说明亚硝酸盐和硝酸盐的产生与温度相关;其中,在该温度下的长期储藏过程中,亚硝酸盐和硝酸盐的含量均随储藏时间的增加呈现增长趋势。
[0109]
实施例4奥硝唑制剂在40
±
2℃的高温破坏试验
[0110]
进一步对上述五个批次的左奥硝氯化钠唑注射液在40
±
2℃的储存条件下的亚硝酸盐和硝酸盐含量进行测定,具体考察了左奥硝唑氯化钠注射液在6个月储存期内的亚硝酸盐和硝酸盐含量,其中,前3个月内每储藏1个月测定一次,后3个月内每储藏3个月测定一次,实验结果如下表所示:
[0111]
表7亚硝酸盐含量测定结果
[0112] 首次1个月后2个月后3个月后6个月后批次10.090.1240.1280.1320.122批次20.0810.1220.1420.1330.171批次30.0780.1240.1440.1320.159批次40.0860.1220.1480.1320.088批次50.0860.1240.130.150.151
[0113]
表8硝酸盐含量测定结果
[0114] 首次1个月后2个月后3个月后6个月后批次10.020.10.220.380.78批次20.020.090.190.370.73批次30.020.10.210.390.76批次40.020.110.220.380.81批次50.020.120.230.380.8
[0115]
可以看出,相较于30
±
2℃的储藏,亚硝酸盐和硝酸盐含量的增加更加明显,进一步验证了高温促使左奥硝唑氯化钠注射液中的亚硝酸盐和硝酸盐含量增加。
[0116]
基于上述实验,本技术发现亚硝酸盐和硝酸盐在左奥硝唑制备过程已产生,且与温度相关,发明人推测是湿热灭菌引起左奥硝唑降解而产生亚硝酸盐,可能的机理是水攻击左奥硝唑5位和4位,并发生亲核取代,使得5位上的硝基消除产生亚硝酸盐;进一步地,由于左奥硝唑注射液的ph值为3.2~4.5,且在其生产过程中未进行充氮,使得在空气存在的条件下,亚硝酸盐部分转化为硝酸盐。
[0117]
实施例5奥硝唑制剂中硝酸盐和亚硝酸盐限度制定
[0118]
美国环境保护署(epa)的综合风险信息系统(iris)数据库中包括了硝酸盐的人类健康评估信息,给出硝酸盐的慢性口服暴露参考剂量为1.6mg/kg/天;
[0119]
其中,以左奥硝唑氯化钠注射液为例,其治疗用法用量为:成人起始剂量为0.5~1g,每12小时静滴0.5g,连用5~10天,单次最长治疗时段为10天。按第1天最大用量为1.5g,之后每天用量为1.0g,连用5
‑
10天,计算得左奥硝唑的平均最大日用量为1.05~1.10g/天,计其平均最大日用剂量为1.10g/天;
[0120]
按iris数据库中1.6mg/kg/天的口服可摄入量计算,左奥硝唑注射液中的硝酸盐的可接受限度为1.6mg/kg/天
×
50kg
÷
1.10g/天≈7.3%;
[0121]
因此,基于所述奥硝唑制剂的总重量,将左奥硝唑制剂中的硝酸盐含量控制不超过1重量%可以确保不会对人体健康产生影响。
[0122]
进一步地,通过人类代谢组数据库(hmdb)查询可知,硝酸盐在人体内血液中的正常浓度为41.8μm;正常情况下,成人体内的血液占全身重量的7%
‑
8%,按50kg体重计算,血液总量大约为3500~4000ml;按人体内血液为3500ml计算,则人体血液内的硝酸盐(分子量为62.00)总量为:41.8μm
×
62.00g/mol
×
3.5l≈9.07mg;若按9.07mg/天的可摄入量计算,左奥硝唑注射液中的硝酸盐的可接受限度为9.07mg/天
÷
1.10g/天≈0.82%。
[0123]
因此,进一步优选左奥硝唑制剂中的硝酸盐含量不超过0.6重量%。
[0124]
进一步地,结合本技术的实施例对多批次左奥硝唑制剂中的硝酸盐含量进行跟踪检测,优选左奥硝唑制剂中的硝酸盐的含量为0.02~0.6重量%,更有选为不超过0.15重量%,能够保证产品的稳定性,也符合人体的安全摄入量。
[0125]
根据英国药典收载的甲硝唑注射液中亚硝酸盐的限度为0.8%(以甲硝唑计),基于所述奥硝唑制剂的总重量,将左奥硝唑制剂中的硝酸盐含量控制不超过1重量%可以确保不会对人体健康产生影响。
[0126]
进一步地,如上文描述可知,以左奥硝唑氯化钠注射液为例,左奥硝唑的最大日用量为1.5g,因此,优选左奥硝唑制剂中的亚硝酸盐限度为1g
×
0.8%
÷
1.5g≈0.53%,即优选左奥硝唑制剂中的硝酸盐含量不超过0.53重量%。
[0127]
进一步地,结合本技术的实施例对多批次左奥硝唑制剂中的亚硝酸盐含量进行跟踪检测,优选左奥硝唑制剂中的亚硝酸盐的含量为0.08~0.53重量%,更有选为不超过0.15重量%,能够保证产品的稳定性,也符合人体的安全摄入量。
[0128]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技
术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0129]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1