TRAF6抑制剂在制备黑色素瘤药物中的应用
traf6抑制剂在制备黑色素瘤药物中的应用
技术领域
1.本发明涉及生物医药技术领域,更具体地,涉及traf6抑制剂在制备黑色素瘤药物中的应用。
背景技术:
2.黑色素瘤,通常是指恶性黑色素瘤,是黑色素细胞来源的一种高度恶性的肿瘤,简称恶黑,多发生于皮肤,也可见于黏膜和内脏,约占全部肿瘤的3%。而皮肤黑素瘤具有侵袭力强、易转移、易复发等特点,居皮肤肿瘤致死原因的首位。在我国,最多见的皮肤黑素瘤临床类型为肢端型及黏膜型,且以每年3
‑
5%的发病速率快速增长。早期黑素瘤手术效果较好,但60
‑
70%为晚期皮肤黑素瘤患者,5年生存率仅为5%,恶性程度极高,目前辅助性干扰素、常规化疗等治疗手段疗效欠佳。
3.目前,癌症免疫治疗是继手术、放化疗和靶向治疗之后的新兴且最具前景的治疗方法,也是当下肿瘤研究领域的焦点和热点。肿瘤细胞表面表达程序性死亡配体1(pd
‑
l1),pd
‑
l1与t细胞上的受体程序性细胞死亡蛋白1(pd
‑
1)的相互作用阻止抗原特异性t细胞的激活,这种情况下,肿瘤可以逃避t细胞的监视而达到肿瘤细胞增殖。以抗pd
‑
1抗体为代表的免疫检查点抑制剂旨在通过消除pd
‑
1信号通路介导的免疫抑制,释放人体t细胞杀伤肿瘤的潜力。
4.抗pd
‑
1/pd
‑
l1疗法被用于黑素瘤等多种癌症治疗,延长了部分患者的生命,但是该疗法对高达60%的患者无效,其被证实与肿瘤微环境(tumor micro environment,tme)介导的免疫耐受密不可分。而转移性黑色素瘤中pd
‑
l1+细胞密度与cd8+t细胞密度显著相关,肿瘤细胞中pd
‑
l1的过度表达被认为是肿瘤微环境(tme)和肿瘤引流淋巴结中抑制抗肿瘤免疫的主要因素,提示tme内细胞表达pd
‑
l1的关键作用。靶向tme解除免疫抑制有利于恢复和重建人体正常抗肿瘤免疫防御能力,增强免疫治疗疗效。
5.肿瘤坏死因子受体相关因子6(tnf receptor
–
associated factor 6,traf6),是肿瘤坏死因子受体相关因子家族的成员之一,最初发现于白细胞介素1(il
‑
1)及cd40信号传导途径。作为e3泛素连接酶,traf6可以对其底物进行lys63连接的多聚泛素化修饰,进而促进其底物激酶如tak1和pkb(akt)的活性,在先天和后天免疫、骨代谢以及淋巴结发育中发挥重要作用。虽然还有报道公开了raf6与肿瘤关系的研究进展(李妙,周立军.traf6与肿瘤关系的研究进展[j].生物技术通报,2017,33(6):24
‑
31.),然而目前关于traf6在肿瘤细胞pd
‑
l1的表达调控、免疫抑制中的作用,目前尚未见报道。
技术实现要素:
[0006]
本发明的目的在于克服现有技术中存在的上述缺陷和不足,提供traf6抑制剂在制备抑制肿瘤细胞表面pd
‑
l1表达的制剂中的应用。
[0007]
本发明的第二个目的在于提供traf6抑制剂在制备黑色素瘤治疗药物中的应用。
[0008]
本发明的第三个目的在于提供traf6抑制剂作为pd
‑
l1调节剂在制备肿瘤治疗药
物中的应用。
[0009]
本发明的上述目的是通过以下技术方案给予实现的:
[0010]
本发明通过分析geo数据库中pd
‑
l1的高通量遗传文库筛选数据(gse129968)和黑色素瘤基因芯片数据(gse15605),得出e3泛素酶traf6是潜在参与调控pd
‑
l1的分子。本发明研究表明,traf6能够正向调控pd
‑
l1;通过抑制traf6的表达,可抑制肿瘤细胞表面pd
‑
l1的表达,降低pd
‑
l1与t细胞表面pd
‑
1结合的免疫逃逸现象,促进t细胞进行正常的免疫功能,增强机体免疫,降低肿瘤进展,降低免疫耐受;将traf6抑制剂作为pd
‑
l1调节剂,可显著提高肿瘤免疫治疗效果,且起到与pd
‑
1单抗类似的疗效。因此,本发明提供关于traf6及traf6抑制剂的以下用途:
[0011]
traf6在调控pd
‑
l1表达中的应用;具体为traf6正向调控pd
‑
l1的表达;更具体为traf6正向调控肿瘤细胞表面pd
‑
l1的表达。
[0012]
traf6在制备调控pd
‑
l1表达的制剂中的应用;包括制备pd
‑
l1表达促进剂或pd
‑
l1表达抑制剂。
[0013]
traf6抑制剂在制备抑制肿瘤细胞表面pd
‑
l1表达的制剂中的应用。所述traf6抑制剂包含抑制traf6表达的化合物、rna干扰的分子或与抗traf6的特异性单抗或者多抗。
[0014]
traf6抑制剂在制备黑色素瘤治疗药物中的应用,所述traf6抑制剂可抑制黑色素瘤细胞表面pd
‑
l1的表达,降低pd
‑
l1与t细胞表面pd
‑
1结合的免疫逃逸现象,促进t细胞进行正常的免疫功能,增强机体免疫,降低肿瘤进展。
[0015]
traf6抑制剂作为pd
‑
l1调节剂在制备肿瘤治疗药物中的应用。
[0016]
优选地,所述traf6抑制剂为临床用药硼替佐米或抑制traf6表达的shrna。
[0017]
优选地,硼替佐米抑制肿瘤细胞表面pd
‑
l1表达的最佳浓度和时间为为30nm和12h;硼替佐米可以有效抑制traf6表达以及pd
‑
l1的表达。
[0018]
优选地,硼替佐米作为pd
‑
l1调节剂的使用浓度为0.2mg/kg。
[0019]
优选地,所述肿瘤为黑色素瘤。
[0020]
与现有技术相比,本发明具有以下有益效果:
[0021]
本发明通过研究表明,traf6能够正向调控肿瘤细胞表面pd
‑
l1的表达;通过抑制traf6的表达,可抑制肿瘤细胞表面pd
‑
l1的表达,下调肿瘤内源性pd
‑
l1,降低pd
‑
l1与t细胞表面pd
‑
1结合的免疫逃逸现象,促进t细胞进行正常的免疫功能,增强机体免疫,降低肿瘤进展,降低免疫耐受;将traf6抑制剂作为pd
‑
l1调节剂,可显著提高肿瘤免疫治疗效果,且起到与pd
‑
1单抗类似的疗效。因此,traf6有望成为黑色素瘤免疫治疗与pd
‑
l1调控相关的潜在新靶点,为肿瘤免疫治疗提供新的视角和思路,具有较大的应用前景。
附图说明
[0022]
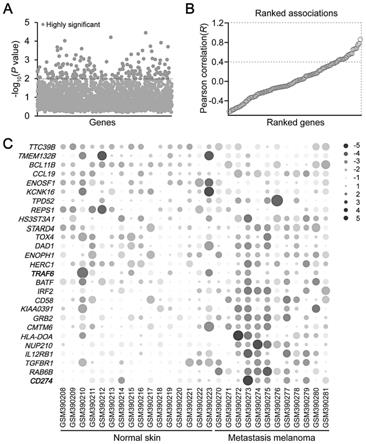
图1为筛选潜在参与pd
‑
l1调控的靶点。a为用显著倍数差异的2474个基因及其对应的
‑
log10(p value)值进行作图。大于2(粉红色)为高度显著性差异的基因(gse129968);b为计算12例转移黑色素瘤中143个基因与pd
‑
l1表达的相关性作图,r大于0.4代表中等或强正关(gse15605);c为26个基因与pd
‑
l1(cd274)于16例正常皮肤组织和12例转移黑色素瘤组织中的表达热图(gse15605)。行内标准化后,红色代表高表达,蓝色代表低表达。
[0023]
图2为两种黑色素瘤细胞系中敲低或过表达traf6后pd
‑
l1 mrna和蛋白变化情况。
a和d为利用qpcr技术检测敲低或过表达traf6的a2058或sk
‑
mel黑色素瘤细胞pd
‑
l1 mrna的表达水平;b和e为利用western blot检测敲低或过表达traf6的a2058或sk
‑
mel黑色素瘤细胞pd
‑
l1蛋白的表达水平;c和f为利用流式细胞术检测敲低或过表达traf6的a2058或sk
‑
mel黑色素瘤细胞pd
‑
l1蛋白的表达水平。
[0024]
图3为traf6抑制剂对黑色素瘤细胞的杀伤效应(体外)。a为利用western blot检测不同浓度硼替佐米(0nm,20nm,30nm,40nm)处理a2058黑色素瘤细胞12h后traf6和pd
‑
l1的蛋白水平变化;b为利用激光共聚焦检测对照和30nm硼替佐米处理12h的a2058细胞与pd
‑
1因子的结合情况;c和d为利用流式分析对照、加入30nm硼替佐米或者0.5μg/ml anti
‑
pd
‑
1单抗的a2058黑色素瘤细胞与t细胞共孵育12h后cd8
+
t细胞的比例以及ifnγ
+
cd8
+
t细胞的水平。e为a2058黑色素瘤细胞的凋亡流式分析图。
[0025]
图4为traf6抑制剂对黑色素瘤的杀伤效应(体内)。a为小鼠的造模和给药模式图;b为小鼠造模后第18天解剖时肺脏组织的代表性图像。对照组为不种瘤组(normal control,nc),实验组为:造瘤组(pbs组)、硼替佐米组(bor组)、anti
‑
pd
‑
1单抗组。c为各组小鼠肺脏组织的苏木精
‑
伊红(h&e)染色和细胞增殖核抗原(ki67)组化染色,标尺:200μm;d为各组小鼠的瘤结节分数统计图;e为从造模到第18天的各组小鼠体重记录;f和g为western blot检测肺脏组织中traf6和pd
‑
l1蛋白的表达水平;h和i为各组小鼠肺脏的traf6和pd
‑
l1的免疫组化染色。标尺:200μm。j为流式分析各组小鼠肺脏组织的cd8
+
t细胞比例和granzyme b、ifnγ占cd8
+
t细胞的比例,以及其流式统计图。k为流式分析各组小鼠颈部淋巴,脾脏和外周淋巴cd8
+
t细胞的比例以及其流式统计图。
具体实施方式
[0026]
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
[0027]
实施例1 geo数据库分析得出traf6为潜在调控pd
‑
l1的分子
[0028]
1、在geo数据库(https://www.ncbi.nlm.nih.gov/geo/)中检索pd
‑
l1,编号gse129968为pd
‑
l1相关的高通量遗传文库筛选数据,此项分析是将人类全基因组crispr/cas9敲除(genome
‑
scale crispr knock
‑
out,gecko)慢病毒文库导入肺癌细胞中,用1μg嘌呤霉素筛选两周后,与apc
‑
pd
‑
l1流式抗体孵育进行流式分选,富集pd
‑
l1
high
和pd
‑
l1
low
的细胞。然后分别提取未经分选细胞对照组、pd
‑
l1
low
细胞实验组、pd
‑
l1
high
细胞实验组的基因组dna,两轮pcr扩增含有sgrna的基因组dna,最后进行illumina测序筛选出实验组中明显富集sgrna所对应的基因,以此得出与正调控或负调控pd
‑
l1的分子。因此我们下载gse129968的pd
‑
l1 total norm.txt文件,选取其中未经分选细胞对照组和pd
‑
l1
low
细胞实验组数据。用pd
‑
l1
low
细胞实验组除以对照组得到倍数差异值(fold change),以2为底数将倍数差异值进行对数标准化,将log2fc设置为大于1得到3244个基因,去掉其中无意义的数据后得到2474个基因,同时计算其p值(p value),以10为底数将p值进行负对数标准化,用microsoft excel 2010进行作图分析。结果如图1a所示,
‑
log
10
(p value)大于2即为187个高度显著性差异的基因,也是潜在调控pd
‑
l1的最可能分子。
[0029]
2、由于上述基因均是基于肺癌细胞所得到的数据,我们希望能够借助黑色素瘤的
相关临床数据来分析黑色素瘤中这187个基因与pd
‑
l1表达的关系。因此我们下载了geo数据库黑色素瘤基因芯片数据gse15605中已标准化的文件series matrix file。如果一个基因对应多项基因探针,则取其平均值。图1a中得到的187个基因里有144个基因在此项数据中被检测到,包括pd
‑
l1。接下来我们利用基因芯片中12例转移黑色素瘤组织中的表达值来计算143个基因与pd
‑
l1表达的相关性,用皮尔森系数(pearson correlation,r)表示,将相关系数导入到graphpad prism 8进行作图分析。结果如图1b所示,将相关系数设置为大于0.4得到与pd
‑
l1中等及强度正相关的分子,总共26个基因。
[0030]
3、将相关系数大于0.4的基因和pd
‑
l1于16例正常皮肤组织和12例转移黑色素瘤组织的表达矩阵(gse15605)输入到tb tool软件中绘制热图,将row scale设置为normalized,进行行内正态标准化,比较基因表达趋势。结果如图1c所示,红色代表高表达,蓝色代表低表达,从图中可以观察到前8个基因在正常组织中多数为红色,在转移黑色素瘤组织中多数为蓝色,即在转移黑色素瘤中低表达。后18个基因在转移黑色素瘤中多数为红色,即为高表达。而且pd
‑
l1在转移黑色素瘤中也呈现高表达的趋势,提示pd
‑
l1本身于转移黑色素瘤中的表达也存在重要意义。其中我们观察到一个特殊的e3泛素酶traf6在转移黑色素瘤中多数高表达,且图1b的分析中得出其与pd
‑
l1正相关,我们合理怀疑traf6在黑色素瘤细胞中可能起着调控pd
‑
l1的作用,是一个潜在与临床治疗和预后相关又与pd
‑
l1调控相关的靶点。
[0031]
实施例2 traf6可正向调控pd
‑
l1
[0032]
1、通过慢病毒包装感染的方式构建敲低或过表达traf6的黑色素瘤细胞系,首先将2
×
106hek 293t细胞铺板于6cm细胞培养皿中,加入5ml dmem(含10%fbs和1%p/s)完全培养基后,置于5%co2,37℃的细胞培养箱中进行培养。18~24h后,hek 293t细胞达到60%~70%的汇合度,将细胞培养基换为3ml5%fbs dmem完全培养基。将475μl hbs溶液加入1.5ml离心管中,再将5μg包装质粒、5μg目标质粒(人traf6空载对照质粒,traf6基因cdna慢病毒表达质粒、人traf6敲低shrna空载对照质粒,人traf6敲低shrna慢病毒表达质粒#1和#2)依次加入,最后滴加进25μl 2.5mol/l cacl2溶液,室温避光20min,将混合液滴加到hek 293t细胞的培养基中,继续培养细胞。
[0033]
12h后,去除混有复合物的培养基将旧培养基弃去,加入4ml含有30%fbs的dmem培养基,继续培养。48h后,将1
×
106黑色素瘤细胞提前铺板于6孔板中,过18~24h待细胞到达40%~50%的汇合度,去除细胞原有培养基,将收获的约72h病毒悬液加入到黑色素瘤细胞并加入终浓度为8μg/ml聚凝胺,混合均匀后继续培养细胞。24h后,去除病毒悬液,更换为10%fbs的完全培养基继续培养。再过48~96h收集细胞样本用于后续分析。
[0034]
2、用trizol法提取慢病毒感染后的黑色素瘤细胞样本的总rna,使用all
‑
in
‑
one first strand cdna synthesis supermix逆转录试剂盒按照20μl的体系将逆转录试剂与1μg rna充分混匀后置于pcr仪进行逆转录得到cdna。以10μl体系进行实时荧光定量pcr反应,以β
‑
actin作为内参对照,检测pd
‑
l1 mrna的水平。β
‑
actin内参基因的引物序列为:正向引物f:ccacactgtgcccatctac;反向引物r:aggatcttcatgaggtagtcagtc;pd
‑
l1的引物序列为:正向引物f:ggcatttgctgaacgcat;反向引物r:caattagtgcagccaggt。荧光定量pcr结果如图2a和和2d所示,在a2058和sk
‑
mel黑色素瘤细胞系中,敲低或过表达traf6均可不同程度下调或上升pd
‑
l1的mrna表达水平。
[0035]
3、将100μl ripa裂解液加入约2
×
106的黑色素瘤细胞样本,充分吹打置于冰上裂解30min,12000rpm离心10分钟后收集蛋白上清。蛋白溶液稀释10倍后用braford染色液进行蛋白浓度定量。根据蛋白浓度用超纯水和5
×
loading buffer定量至1μg/μl,然后于100℃煮沸20min。10%sds
‑
page凝胶,电泳,60v,1.5h,然后进行转膜,330ma,90min,用5%脱脂奶粉封闭1h后加入traf6、pd
‑
l1和β
‑
actin抗体(按照说明书稀释比例),4℃孵育过夜。tbst清洗3次后用对应二抗孵育1h。tbst清洗3次在膜上加入显影液,将膜放到化学发光仪进行显影。结果如图2b和2e所示,当在a2058和sk
‑
mel黑色素瘤细胞系中敲低或过表达traf6时,pd
‑
l1的蛋白水平可以发生显著的下调或上升。
[0036]
4、将不同组别的黑色素瘤细胞消化并制成细胞悬液,pbs清洗后,每管加入100μlapc
‑
pd
‑
l1流式抗体(抗体:染色液比例为1:100)并混匀,冰上共孵育15min,1000rpm,4℃,5min离心去除染色液,300μl~500μl pbs每管重悬。通过流式细胞仪分析pd
‑
l1的膜蛋白水平,图2c表示与阳性对照组相比,traf6降低时pd
‑
l1的峰明显往左移,即呈现下降的水平。图2f显示traf6过表达时pd
‑
l1的峰明显往右移,即有上升的趋势。上述结果均表明traf6可以正向调控pd
‑
l1。
[0037]
实施例3 traf6抑制剂可通过下调pd
‑
l1表达从而增强cd8
+
t细胞活性(体外)
[0038]
1、上述结果已证明traf6可正向调控pd
‑
l1,因此抑制traf6有望降低内源性pd
‑
l1从而削弱肿瘤免疫逃逸。由于traf6在天然免疫和获得性免疫中也有扮演着重要的角色,因此需要选择合适的traf6抑制剂在发挥肿瘤杀伤效应的同时又不会对机体正常免疫造成显著影响。据文献报道,小白菊内酯或奎宁等能够有效抑制traf6活性从而抑制癌细胞增殖,蛋白酶体抑制剂mg132可以通过抑制traf6的表达使肿瘤细胞增殖减慢。此外,可逆性蛋白酶体抑制剂硼替佐米能够抑制蛋白酶体26s亚基活性,减少nf
‑
κb的抑制因子iκb降解,促进iκb与nf
‑
κb的结合抑制nf
‑
κb的活性,减少il
‑
6等骨髓瘤细胞生长因子的分泌,因而被批准用于治疗多发性骨髓瘤,有其他研究证明硼替佐米可以促进traf6自噬介导的溶酶体降解从而降低traf6。硼替佐米作为临床用药,安全性比其他报道的药物更有保障,因此我们选择硼替佐米作为traf6抑制剂,观察其是否能够下调内源性pd
‑
l1。我们分别用dmso和20nm,30nm,40nm的硼替佐米处理a2058细胞,12h后收集蛋白样本,western blot检测相应蛋白水平,如图3a所示,当用30nm的硼替佐米处理细胞12h后可以有效降低a2058细胞的traf6和pd
‑
l1的蛋白水平,证明30nm作用12h是合适的浓度和时间。
[0039]
2、为了继续验证硼替佐米降低pd
‑
l1后,是否减少与pd
‑
1的结合,我们先用pbs清洗对照和30nm硼替佐米处理12h的黑色素瘤细胞,再与5μg/ml重组人pd
‑1‑
mfc嵌合蛋白(1:50)于37℃共孵育15min,经固定封闭后与羊抗鼠的cy3二抗共同于室温孵育30min,dapi染色后封片,用激光共聚焦显微镜进行拍照检测。图3b证明用30nm的硼替佐米处理a2058细胞12h后,也能有效降低与pd
‑
1的结合,与上述结果是一致的。
[0040]
3、接下来,我们从正常健康人收集的血液中提取t细胞与黑色素瘤细胞共培养。首先我们提前一天将10μg cd3抗体加入到1ml pbs中制成cd3抗体稀释液,将抗体稀释液加入到6cm细胞培养皿中,放入生物安全柜中通风过夜。第二天将ficoll分离液加入至50ml离心管中,离心管45
°
倾斜,再将收集到的血液沿着离心管壁缓慢加入(血液:ficoll分离液=2:1),1000rpm,24℃,40min离心,血液可被分为四层。小心吸取中间的云雾层到新的50ml离心管中,即为pbmc细胞(外周单核血细胞),加入rmpi 1640培养基(培养基:pbmc细胞=2:1),
1000rpm,4℃,离心10min后去掉上清,pbs清洗后计数。按照mojosorttm t细胞提取试剂盒提取t细胞,提取完成的t细胞重悬于5ml含有10%fbs的rmpi 1640培养基,置于已包被cd3抗体的6cm细胞培养皿中,同时加入终浓度为5ng/μl的il
‑
2细胞因子,于二氧化碳培养箱中继续培养活化72h后按照12:1的比例与a2058细胞共培养,同时加入30nm硼替佐米或者0.5μg/ml的pd
‑
1抗体共同孵育,收样时小心收集每孔的t细胞上清液于1.5ml ep管中,1000rpm,4℃,5min离心去掉上清,pbs清洗两次,与抗人fitc
‑
cd3,抗人bv421
‑
cd4,抗人percp/cyanine5.5
‑
cd8流式抗体于冰上共同孵育15min完成流式表面染色。
[0041]
pbs清洗后,每管加入150μl固定液混匀,于室温下共同孵育20min。pbs清洗,每管加入150μl破膜液混匀,1000rpm,4℃,5min离心去除破膜液。每管继续加入100μl抗人apc/cyanine7
‑
ifnγ流式抗体(抗体:破膜液=1:100),于室温下共同孵育20min,1000rpm,4℃,5min离心弃去上清。pbs清洗后将样品重悬于300μl~500μl pbs,流式分析cd8
+
t细胞的比例以及ifnγ占cd8
+
t细胞的比例。图3c实验结果证明,硼替佐米处理组与对照组相比,cd4
+
t细胞和cd8
+
t细胞比例并没有发生显著变化,anti
‑
pd
‑
1单抗处理组略有上升。但图3d表示硼替佐米处理组和anti
‑
pd
‑
1抗体处理组可以显著加强ifnγ
+
cd8
+
t细胞比例,提示我们30nm的硼替佐米可以有效激活杀伤性cd8
+
t细胞。
[0042]
4、除了检测t细胞的活化水平,我们还检测了a2058细胞的杀伤情况。按凋亡流式试剂盒说明书对收集的黑色素瘤细胞样本进行染色,如图3e所示,30nm硼替佐米和anti pd
‑
1单抗晚期凋亡比例均高于对照组,说明硼替佐米可以有效杀伤黑色素瘤细胞,且与anti
‑
pd
‑
1有类似的杀伤效应。综上所述,硼替佐米可通过抑制traf6下调肿瘤内源性的pd
‑
l1,从而加强t细胞活性和更好的清除黑色素瘤细胞。
[0043]
总之,硼替佐米虽然是一种广谱药物,但在30nm浓度测试出可以同时降低traf6和pd
‑
l1的蛋白水平,证明硼替佐米可以通过该通路从而下调pd
‑
l1。在黑色素瘤细胞与t细胞共培养的体系中,30nm也能有效激活cd8
+
t细胞以及更有效的杀伤肿瘤,提示硼替佐米可通过抑制traf6下调pd
‑
l1,促使杀伤性cd8
+
t细胞活化,抑制肿瘤免疫逃逸。因此抑制traf6从而下调肿瘤内源性pd
‑
l1可以作为肿瘤免疫治疗的潜在新策略。
[0044]
实施例4 traf6抑制剂可有效杀伤黑色素瘤(体内)
[0045]
1、我们希望进一步研究在体内的生理环境中抑制traf6是否能够升高肿瘤浸润杀伤性cd8
+
t细胞的比例及有效杀伤黑色素瘤细胞,同时准备anti
‑
pd
‑
1单抗治疗作为阳性对照。因此我们从北京维通利华实验技术有限公司购买6~8周龄的spf级c57bl/6小鼠,饲养于中山大学东校区实验动物中心无菌环境中。通过尾静脉将2
×
106个b16f10小鼠黑色素瘤细胞注射进c57bl/6小鼠中,构建小鼠黑色素瘤肺转移模型。造瘤第二天,将小鼠随机分为3组,每组5只,分别是造瘤组(pbs组)、硼替佐米组(bor组)、anti
‑
pd
‑
1单抗组,同时准备不造瘤的小鼠5只作为空白对照(normal control,nc组)。从造瘤当天开始记录体重,之后隔天记录体重。造瘤后第二天开始给药,bor组剂量为0.2mg/kg,anti
‑
pd
‑
1单抗组剂量为150μg/只,之后每三天给药一次。造模后的第18天准备取样。给药曲线如图4a所示。
[0046]
从造模当天到解剖期间我们记录了小鼠的体重曲线,图4e显示四组小鼠的体重均有小幅度的上升趋势,表明0.2mg/kg的硼替佐米和150μg/只的anti
‑
pd
‑
1单抗药物剂量对小鼠的体重没有明显影响。
[0047]
造模后的第18天我们将小鼠麻醉后解剖,我们拍摄小鼠肺部照片以便直接观察黑
色素瘤的生长情况,图4b显示,与pbs组相比,bor组与anti
‑
pd
‑
1单抗组能够有效抑制黑色素瘤的生长。
[0048]
然后我们于解剖显微镜下计算小鼠肺部的黑色素瘤结节,并做好分级,黑色素瘤瘤结节分为4级:ⅰ级<0.5mm,0.5mm≤ⅱ级<1mm,1mm≤ⅲ级<2mm,ⅳ级≥2mm,小鼠黑色素瘤结节分数=ⅰ级
×
1+ⅱ级
×
2+ⅲ级
×
3+ⅳ级
×
4,通过此公式我们计算了各组小鼠的黑色素瘤结节分数,如图4d,pbs组的瘤结节分数远远大于bor组和anti
‑
pd
‑
1单抗组,且bor组与anti
‑
pd
‑
1单抗组则无显著性差异。
[0049]
接下来我们将小鼠解剖的部分肺脏组织进行苏木精
‑
伊红染色以及ki67染色,初步观察肺脏组织的病理情况,结果如图4c所示,nc组即正常小鼠的肺脏组织细胞核较小,且组织较为疏松,而在pbs组中,肿瘤部分的细胞核较大,且非常致密,与瘤旁的正常组织形成鲜明对比。而bor组和anti
‑
pd
‑
1单抗组的肿瘤部分明显小于造瘤组,表示硼替佐米和anti
‑
pd
‑
1单抗均能有效抑制黑色素瘤。ki67染色表示pbs组中肿瘤部分ki67的免疫组化染色为深棕黄色,面积远远大于bor组和anti
‑
pd
‑
1单抗组,与苏木精
‑
伊红染色情况一致。实验结果证明0.2mg/kg的硼替佐米可以有效阻止小鼠黑色素瘤的进展,且可以起到与anti
‑
pd
‑
1单抗治疗类似的疗效。
[0050]
2、我们需要进一步知道硼替佐米是否能够通过抑制traf6内源性下调黑色素瘤细胞pd
‑
l1的表达,加强体内抗肿瘤免疫,有效杀伤黑色素瘤。因此我们通过western blot检测小鼠肺脏组织的traf6和pd
‑
l1的蛋白表达水平。图4f和4g显示,pbs组中traf6和pd
‑
l1蛋白水平与nc组相比明显升高,而bor组显著降低这两种蛋白水平,anti
‑
pd
‑
1单抗组中traf6虽稍有降低,但不如bor组明显,而pd
‑
l1水平明显下调。曾有文献报道anti
‑
pd
‑
1单抗可以清除pd
‑
l1过度表达并具有低甲基化pd
‑
l1水平的肿瘤细胞或者通过表观遗传调节抑制pd
‑
l1的表达,这可能可以解释anti
‑
pd
‑
1单抗治疗导致的pd
‑
l1下调效应。但此结果说明硼替佐米可以有效抑制traf6表达以及pd
‑
l1的表达。此外,我们同时将小鼠的部分肺脏组织进行traf6和pd
‑
l1的免疫组织化学染色,棕黄色代表蛋白表达,颜色深浅代表蛋白表达的强弱,图4h和图4i结果与western blot检测结果一致。皆说明硼替佐米可以抑制黑色素瘤中的traf6降低内源性pd
‑
l1的表达,从而有效杀伤黑色素瘤细胞。
[0051]
3、内源性的pd
‑
l1降低是否能够激活机体内的抗肿瘤免疫从而杀伤黑色素瘤细胞需要我们进一步探讨。我们将解剖的部分肺脏组织制成细胞悬液,4℃,1500rpm,离心5min;去除上清后每份加2ml红细胞裂解液混匀,冰上孵育5min,离心去除上清,pbs重悬后将每份样本的肺脏组织细胞悬液分为三份,离心去除上清,其中一份每管与抗鼠fitc
‑
cd3抗体,抗鼠apc
‑
cd4抗体、抗鼠bv421
‑
cd8流式抗体共孵育后进行流式检测。图4j研究结果显示,与pbs组相比,bor组和anti
‑
pd
‑
1组可以显著升高肺脏组织中肿瘤浸润cd8
+
t细胞的比例,并有显著性差异,且bor组和anti
‑
pd
‑
1组没有显著性差异。
[0052]
4、其余两份肺脏组织细胞悬液离心去除上清,先与fitc
‑
cd3抗体和抗鼠bv421
‑
cd8流式抗体共孵育,经固定破膜后与抗鼠apc
‑
ifnγ或抗鼠af647
‑
granzyme b流式抗体于室温下共同孵育20min,pbs清洗后将样品重悬于300μl~500μl pbs进行流式分析。结果如图4j显示,bor组的granzyme b和ifnγ占cd8
+
t细胞比例与pbs组相比显著升高,且有显著性差异;而anti
‑
pd
‑
1单抗组中granzyme b水平极为显著地升高,ifnγ水平上调但没有显著性差异,但也能说明激活cd8
+
t细胞;且bor组和anti
‑
pd
‑
1单抗组无显著性差异。上述结
果表明,硼替佐米可以升高肺脏肿瘤浸润cd8
+
t细胞的比例和活性,加强机体内的抗肿瘤免疫,从而更好的杀伤黑色素瘤细胞,且可以起到与anti
‑
pd
‑
1单抗相似的疗效。
[0053]
5、此外,我们需要测试硼替佐米治疗是否对于小鼠体内其他部位产生负面影响,因此我们又解剖了小鼠的颈部淋巴结,脾脏和外周淋巴结,与抗鼠fitc
‑
cd3抗体,抗鼠apc
‑
cd4抗体、抗鼠bv421
‑
cd8流式抗体共同孵育后流式分析检测其cd4
+
和cd8
+
t细胞占比。结果显示,pbs组与nc组相比,颈部淋巴结,脾脏和外周淋巴结cd8
+
t细胞比例有所下降,但只有颈部淋巴结有显著性差异;bor组中这三个部位的cd8
+
t细胞比例与pbs组相比没有显著性变化,提示低剂量的硼替佐米不会影响到体内的其他免疫;anti
‑
pd
‑
1单抗组中颈部和外周淋巴结的cd8
+
t细胞比例上升明显且有显著性差异,但脾脏的变化不明显。综合上述结果,说明低剂量的硼替佐米不影响机体内正常的免疫功能,可以升高肿瘤浸润部位的t细胞从而更有效的杀伤黑色素瘤。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1