木犀草素在抑制NLRP3炎症小体活化中的应用的制作方法
木犀草素在抑制nlrp3炎症小体活化中的应用
技术领域
1.本发明属于生物医药领域,具体涉及木犀草素在抑制nlrp3炎症小体活化中的应用。
背景技术:
2.炎症小体是一种先天免疫结构,主要在髓系细胞(如巨噬细胞)中被激活,并诱导依赖性细胞因子的产生以保护宿主免受微生物感染。然而,炎症小体经常被宿主来源的刺激因子和环境刺激物错误地激活,引起大量的炎症因子释放,从而导致炎症性疾病的发展。nlrp3炎症小体是由天然免疫感受器nlrp3、接头蛋白asc和caspase
‑
1前体组成的多聚蛋白复合物,其组装可导致caspase
‑
1的激活,活化的caspase
‑
1随后促进il
‑
1β前体和il
‑
18前体裂解,从而产生成熟的、有功能的il
‑
1β和il
‑
18。目前,研究已表明,nlrp3炎症小体的异常激活与多种疾病有关,包括溃疡性结肠炎、阿尔茨海默病、2型糖尿病和其他炎症性疾病。因此,nlpr3炎症小体被认为是治疗炎症性疾病的潜在药物靶点。
3.木犀草素是一种黄酮类化合物,存在多种药用植物中,具有抗氧化、抗微生物、心脏保护、抗糖尿病、神经保护和抗过敏特性。目前,木犀草素在炎症方面的具体作用机制及靶点尚未见报道。
技术实现要素:
4.本发明的目的在于提供了木犀草素在抑制nlrp3炎症小体活化中的应用,以及木犀草素在制备用于预防或治疗nlrp3炎症小体相关疾病的药物中的应用。
5.本发明所采取的技术方案是:
6.本发明的第一方面,提供木犀草素在制备nlrp3炎症小体抑制剂中的应用。
7.本发明人在研究中发现木犀草素可以有效抑制nlrp3炎症小体激活,从而抑制炎症细胞因子il
‑
1β的成熟和分泌,说明木犀草素可以用于nlrp3炎症小体抑制剂的制备。
8.在本发明的一些实施方式中,所述木犀草素浓度为10~50μm。
9.在本发明的一些优选实施方式中,所述木犀草素浓度为25~50μm。
10.本发明的第二方面,提供木犀草素在制备预防和/或治疗nlrp3炎症小体相关疾病的药物中的应用。
11.本发明人发现木犀草素可抑制nlrp3炎症小体的组装以及细胞内ros和钙离子的产生,并对nlrp3炎症小体相关疾病模型具有良好的防治作用。木犀草素可作为nlrp3炎症小体活化抑制剂以及作为预防或治疗nlrp3炎症小体相关疾病的药物。
12.在本发明的一些实施方式中,所述nlrp3炎症小体相关疾病为nlrp3炎症小体异常活化引起的疾病。
13.在本发明的一些实施方式中,所述nlrp3炎症小体相关疾病为肠炎、肝炎、硅肺、石棉肺和矽肺、白塞病、关节炎、紫外线所诱导的皮肤晒伤、接触性超敏反应、帕金森病、抑郁症、ⅰ型糖尿病、ii型糖尿病、动脉粥样硬化、痛风、非酒精性脂肪肝病、酒精性肝病、肾病、家
族性冷自发炎综合征、muckle
‑
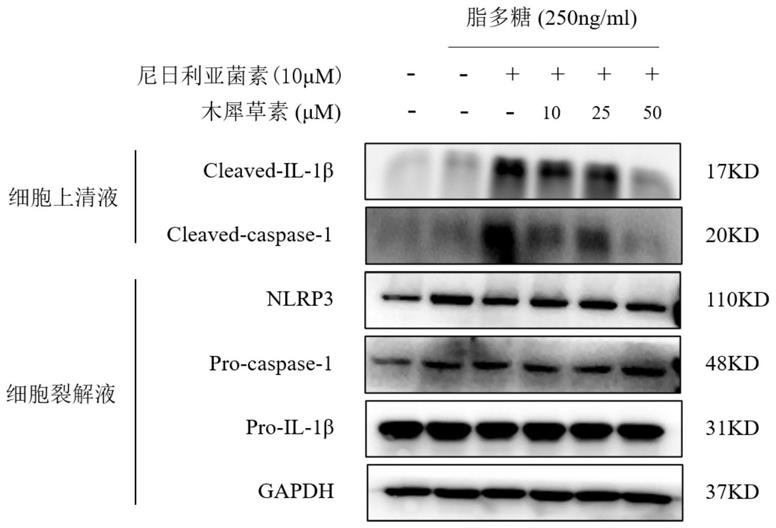
wells综合征、慢性婴儿神经皮肤和关节综合征、新生儿发作多系统炎性疾病、多发性硬化症、肌萎缩侧索硬化、哮喘、急性呼吸窘迫综合征、败血症、老年性黄斑变性、阿尔兹海默病、乳糜泻或牛皮癣。
14.在本发明的一些实施方式中,所述肠炎为结肠炎。
15.在本发明的一些实施方式中,所述结肠炎为dss诱导的急性结肠炎。
16.本发明人为了进一步验证木犀草素可以通过抑制nlrp3炎症小体显著改善dss诱导的急性结肠炎,具体表现为木犀草素可以显著改善小鼠的体重减轻、dai评分和结肠缩短。组织学分析显示,dss引起结肠组织隐窝消失、杯状细胞严重破坏和黏膜损伤,而木犀草素能有效改善这些症状。
17.在本发明的一些实施方式中,所述木犀草素浓度为10~50μm。
18.在本发明的一些优选实施方式中,所述木犀草素浓度为25~50μm。
19.本发明的第三方面,提供木犀草素在制备具有(i)~(vi)中的任意一种功能的产品中的应用:
20.(i)抑制caspase
‑
1的活化;
21.(ii)抑制il
‑
1β的成熟和分泌;
22.(iii)抑制asc寡聚体的产生;
23.(iv)抑制ros的产生;
24.(v)抑制mtros的产生;
25.(vi)抑制细胞内ca
2+
的产生。
26.在本发明的一些实施方式中,所述木犀草素浓度为10~50μm。
27.在本发明的一些优选实施方式中,所述木犀草素浓度为25~50μm。
28.在本发明的一些实施方式中,所述产品为药物或试剂。
29.本发明的第四方面,提供一种产品,包含木犀草素。
30.在本发明的一些实施方式中,所述产品为药物或试剂。
31.在本发明的一些实施方式中,所述药物还包含药学上可接受的辅料或者载体。
32.在本发明的一些实施方式中,所述药物的剂型为注射剂、散剂、胶囊剂、片剂、膏剂、栓剂、气雾剂、口服剂、丸剂、滴剂、缓释片、混悬剂、颗粒剂、口含剂、冲剂、滴剂、丹剂、粉剂、溶液剂、霜剂、贴剂、锭剂或膜剂。
33.本发明的第五方面,提供木犀草素和本发明第四方面所述产品在体外非治疗目的的抑制nlrp3炎症小体活化中的应用。
34.本发明的有益效果是:
35.本发明公开了一种黄酮类化合物木犀草素(luteolin)在抑制nlrp3炎症小体激活中的应用。木犀草素可以有效抑制nlrp3炎症小体激活,从而抑制炎症细胞因子il
‑
1β的成熟和分泌。此外,本发明还发现木犀草素可抑制nlrp3炎症小体的组装以及细胞内ros和钙离子的产生,并对nlrp3炎症小体相关疾病模型具有良好的防治作用,可以通过抑制nlrp3炎症小体改善dss诱导的剂型结肠炎。因此,木犀草素可作为nlrp3炎症小体活化抑制剂以及作为预防或治疗nlrp3炎症小体相关疾病的潜在药物。
附图说明
36.图1为木犀草素(luteolin)阻断thp
‑
1细胞中nlrp3炎症小体激活,抑制炎症活化信号分子caspase
‑
1(p20)和炎症细胞因子il
‑
1β的成熟和分泌。
37.图2为木犀草素(luteolin)抑制nlrp3炎症小体活化过程中asc寡聚体的产生。
38.图3为木犀草素(luteolin)处理抑制thp
‑
1细胞内ros。其中图3a为流式细胞检测图;图3b为统计图。
39.图4为木犀草素(luteolin)处理抑制thp
‑
1细胞内mtros。其中图4a为流式细胞检测图;图4b为统计图。
40.图5为木犀草素(luteolin)抑制细胞内ca
2+
的产生。其中图5a为流式细胞检测图;图5b为统计图。
41.图6为在野生型小鼠中木犀草素(luteolin)可以显著缓解dss诱导的野生型小鼠结肠炎。其中图6a为dss诱导的小鼠结肠炎模型的构建过程;图6b为木犀草素可以显著改善小鼠的体重减轻;图6c为木犀草素可以显著改善小鼠的疾病活动指数(dai)评分;图6d为木犀草素对野生型小鼠的结肠影响;图6e为木犀草素可以显著改善小鼠的结肠缩短。
42.图7为在野生型小鼠中木犀草素(luteolin)能有效改善dss引起结肠组织隐窝消失、杯状细胞严重破坏和黏膜损伤。
43.图8为在nlrp3敲除小鼠中木犀草素(luteolin)未能改善dss诱导的野生型小鼠结肠炎。其中图8a为dss诱导的小鼠结肠炎模型的构建过程;图8b为木犀草素不能改善dss诱导的体重减轻;图8c为木犀草素不能改善小鼠的疾病活动指数(dai)评分;图8d为木犀草素对nlrp3敲除小鼠的结肠影响;图8e为木犀草素不能改善nlrp3敲除小鼠的结肠缩短。
44.图9为在nlrp3敲除小鼠nlrp3
‑
/
‑
中木犀草素(luteolin)能有效改善dss引起结肠组织隐窝消失、杯状细胞严重破坏和黏膜损伤。
具体实施方式
45.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
46.材料与方法:
47.1)木犀草素的结构式如下所示:
[0048][0049]
2)木犀草素储存液配置:
[0050]
用分析天平称取木犀草素粉末放置于无菌离心管中,然后加入二甲基亚砜(dmso)进行溶解,配制成浓度为20mm的储存液。
[0051]
3)thp
‑
1细胞的培养及nlrp3炎症小体刺激:
[0052]
thp
‑
1细胞悬浮培养在含10%胎牛血清和1%青霉素/链霉素的1640培养基中,并
置于5%co2的37℃培养箱中。为诱导nlrp3炎症小体激活,将thp
‑
1细胞以1
×
106个/ml的密度接种于6孔板中。进行nlrp3炎症小体刺激前,先用50nm佛波醇12
‑
十四酸酯13
‑
乙酸酯(pma)诱导thp
‑
1细胞分化3h。3h后弃去培养板中的培养基上清,将每孔更换为500μl含250ng/ml脂多糖(lps)的1640培养基(含1%fbs),刺激时间为4h。4h后加入不同浓度的木犀草素(10μм,25μм,50μм)刺激30min,随后用尼日利亚菌素(nigericin,10μм)刺激细胞30min,以诱导典型的nlrp3炎症小体活化。
[0053]
实施例1木犀草素阻断thp
‑
1细胞中nlrp3炎症小体激活
[0054]
nlrp3炎症小体刺激及蛋白样品收集:将thp
‑
1细胞以1
×
106个/ml的密度接种于6孔板中。进行nlrp3炎症小体刺激前,先用50nm佛波醇12
‑
十四酸酯13
‑
乙酸酯(pma)诱导thp
‑
1细胞分化3h。3h后弃去培养板中的培养基上清,将每孔更换为500μl含250ng/ml脂多糖(lps)的1640培养基(含1%fbs),刺激时间为4h。4h后加入不同浓度的木犀草素(10μм,25μм,50μм)刺激30min,随后用尼日利亚菌素(nigericin,10μм)刺激细胞30min,以诱导典型的nlrp3炎症小体活化。刺激结束后,收集细胞培养上清至1.5ml ep管中,并将上清中的蛋白通过甲醇氯仿的方法抽提出来:首先将上清12000r/min离心5min去除死细胞,然后转移至新的离心管中,每个离心管中加入等体积的甲醇和四分之一体积的氯仿,涡旋混匀,12000r/min室温离心5min。离心后的液体会分为三层,中间一层为蛋白层,将上层液体去掉,再加入等体积的甲醇,混匀后离心5min,尽可能弃尽上清。然后55℃金属浴干燥5min。最后加入35μl 2
×
sds上样缓冲液,100℃金属浴10min。培养板上的细胞则加入40μl ripa裂解液裂解10min,12000r/min 4℃离心10min,然后将上清转移至新的ep管中,最后加入10μl 5
×
sds上样缓冲液,100℃金属浴5min。
[0055]
western blot检测细胞培养上清液中il
‑
1β,caspase
‑
1(p20)和细胞裂解物中pro
‑
il
‑
1β,pro
‑
caspase
‑
1和nlrp3的表达:将收集的蛋白样品进行sds
‑
page电泳,置于转膜仪转膜。转膜后分别孵育一抗,4℃孵育过夜。第二天洗膜后加入稀释(1:4000)的二抗,室温孵育1h。二抗孵育完成后,显影仪显影。最后使用image j软件通过光密度法对印迹进行定量分析。
[0056]
结果如图1所示,从图中可以看出,木犀草素可阻断thp
‑
1细胞中nlrp3炎症小体激活,抑制炎症活化信号分子caspase
‑
1(p20)和炎症细胞因子il
‑
1β的成熟和分泌。
[0057]
实施例2木犀草素通过抑制asc寡聚从而抑制nlrp3炎症小体的组装
[0058]
化学交联法检测asc寡聚:将thp
‑
1细胞以2
×
106个/ml的密度接种于6孔板中。第二天进行nlrp3炎症小体活化刺激,收样时去除细胞培养基,每孔加入300μl预冷的细胞裂解液(np
‑
40:pmsf=100:1,pmsf终浓度1mm),并在4度摇床上孵育30min。随后用细胞刮刀将细胞收集至1.5ml离心管中,并反复吹打细胞裂解液20次。每个样品取50μl作为input样品,加入12.5μl 5
×
loading buffer混匀后于100℃金属浴加热变性10min后待用。其余样品则在4℃340g离心10min,随后弃上清,并加入500μl pbs洗沉淀,于4℃340g离心3min,弃上清。重复上述pbs清洗步骤一次。之后加入含有2~4mm dss(disuccinimidyl suberate,双琥珀酰亚胺辛二酸酯,sigma,s1885)的pbs溶液(现配现用)重悬沉淀,并于室温旋转摇床孵育30min。30min后于4℃340g离心10min,弃上清。最后每个1.5m1离心管中加入30μl 2
×
loading buffer混匀后于100℃金属浴加热变性10min后待用。使用westem blot检测asc单体和寡聚体。
[0059]
结果如图2所示,从图中可以看出,木犀草素可以抑制nlrp3炎症小体活化过程中asc寡聚体的产生,表明木犀草素可抑制nlrp3炎症小体的组装。
[0060]
实施例3木犀草素通过抑制ros和mtros的产生抑制nlrp3炎症小体的激活
[0061]
流式细胞术检测细胞内ros和线粒体ros的产生:
[0062]
荧光探针dcfh
‑
da(碧云天,上海)检测细胞内ros的形成。thp
‑
1细胞以每孔5
×
105的密度接种在12孔板中。第二天进行nlrp3炎症小体活化刺激后,将细胞与终浓度为10μm/l的dcfh
‑
da在37℃孵育30min。最后用pbs清洗细胞,重悬细胞后在流式细胞仪上检测荧光,激发波长为488nm,发射波长为525nm。
[0063]
荧光探针mitoros
tm 580(aat bioquest,美国)检测线粒体ros(mtros)的形成。thp
‑
1细胞以每孔5
×
105的密度接种在12孔板中。进行nlrp3炎症小体活化刺激后,将细胞与1x mitoros
tm 580在37℃孵育30min。最后用pbs清洗细胞,重悬细胞后在流式细胞仪上检测荧光,激发波长为540nm,发射波长为590nm。
[0064]
ros和mtros是nlrp3炎症小体活化过程中的一个重要中间产物,参与一系列机体炎症相关反应。本实施例结果如图3和图4所示,从图中可以看出,木犀草素处理可抑制thp
‑
1细胞内ros(图3)以及mtros(图4)的产生,表明木犀草素可通过调节nlrp3炎症小体活化过程中ros和mtros的产生而影响nlrp3炎症小体激活。
[0065]
实施例4木犀草素通过抑制细胞内ca
2+
的产生抑制nlrp3炎症小体的激活
[0066]
钙离子荧光探针fluo
‑
4 am(艾博抗)检测细胞内钙离子浓度。thp
‑
1细胞以每孔5
×
105的密度接种在12孔板中。第二天进行nlrp3炎症小体活化刺激后,将细胞与终浓度为2μm的fluo
‑
4 am探针在37℃孵育30min。最后用pbs清洗细胞,重悬细胞后在流式细胞仪上检测荧光,激发波长为488nm,发射波长为512
‑
520nm。
[0067]
结果如图5所示,从图中可以看出,木犀草素处理可抑制thp
‑
1细胞内ca
2+
的产生,ca
2+
动员是nlrp3炎症小体激活的一个重要的上游事件。因此,从图5可以看出木犀草素可以抑制细胞内ca
2+
的产生,从而达到抑制nlrp3炎症通路的效果。
[0068]
实施例5木犀草素抑制nlrp3炎症小体作用的体内探究
[0069]
dss诱导小鼠结肠炎模型的建立及治疗:用溶于饮用水的3%(w/v)dss连续饲喂雌性野生型(wt)或nlrp3敲除(nlrp3
‑
/
‑
)c57小鼠(6周龄)8d诱导急性结肠炎。wt或nlrp3
‑
/
‑
小鼠均随机分为3组:对照组、dss组、木犀草素(50mg/kg)+dss组;木犀草素(50mg/kg)在dss处理前经口灌胃给药7d,在dss处理期间经口灌胃给药8d,每天1次,木犀草素溶于生理盐水中,其他组小鼠灌胃生理盐水(图6a)。每天记录小鼠的直肠出血,体重,并计算便血、大便稠度、体重下降情况,评价实验过程中结肠炎疾病活动指数(dai)评分。15天后,对小鼠进行人道安乐死,并切除结肠,测量并切片进行进一步分析。
[0070]
he(苏木精
‑
伊红)染色:小鼠组织用pbs洗涤3次,然后固定在4%多聚甲醛(pfa)中,并在石蜡包埋后切片。使用标准程序制备切片并用h&e染色,最后在显微镜拍摄图像。
[0071]
本实施例结果如图6
‑
图9所示,从图6和图7可以看出,给予木犀草素(50mg/kg)可以显著缓解dss诱导的野生型小鼠结肠炎。与dss组相比,木犀草素可以显著改善小鼠的体重减轻(图6b),dai评分(图6c)和结肠缩短(图6d和图6e)。组织学分析显示,dss引起结肠组织隐窝消失、杯状细胞严重破坏和黏膜损伤,而木犀草素能有效改善这些症状(图7)。然而,在nlrp3
‑
/
‑
小鼠中,木犀草素(50mg/kg)未能改善dss诱导的体重减轻(图8b),dai评分(图
8c),结肠缩短(图8d和图8e)以及隐窝损伤和杯状细胞破坏(图9)。这些结果表明木犀草素通过抑制nlrp3炎症小体改善dss诱导的急性结肠炎。
[0072]
上述具体实施方式对本发明作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1