肌酸在制备抑制白色脂肪细胞分化的组合物中的应用的制作方法
1.本发明涉及天然药物领域,尤其涉及一种肌酸在制备抑制白色脂肪细胞分化的组合 物中的应用。
背景技术:
2.据文献报道截止2030年,全世界约有57.8%(33亿)的成年人可能是肥胖或超重的, 肥胖的全球流行可能会导致各种疾病,包括肝病、糖尿病、心血管疾病和癌症。研究发 现任何因素只要能够使能量摄入多于能量消耗,都有可能引起肥胖,这些因素包括年龄、 进食过多、体力活动过少,社会心理因素,遗传因素、及脂肪组织特征等。肥胖发生的 病因复杂,具体机制尚不完全清楚,因此针对脂肪细胞及组织展开病因及机制研究,对 肥胖的发生及其并发症的预防有重要意义。
3.脂肪组织主要包括白色脂肪组织和棕色脂肪组织,而白色脂肪组织的主要功能是将 机体中过剩的能量以过剩的能量以中性脂肪的形式储存起来,以供机体需要时利用,棕 色脂肪组织的主要功能是促进机体产热。随着对肥胖和相关代谢疾病的深入研究,发现 棕色脂肪组织具有高机体能量代谢的特殊功能,在维持体温和调控能量平衡方面发挥着 重要作用。白色脂肪组织在受到某些刺激(如冷刺激、运动及β3
‑
肾上腺素激动剂等), 会呈现典型棕色脂肪细胞的特征,如胞内出现许多散在的小脂滴、线粒体数目增多、棕 色脂肪的标志物(如ucp
‑
1)表达增多,这一过程称为“脂肪棕色化”。由此,白色脂 肪细胞像棕色化发展可能是肥胖治疗的新靶点。
4.近年来,随肥胖病因分子机制研究的深入开展,代谢组学在肥胖中的作用逐渐受到 关注,细胞内许多生命活动是发生在代谢物层面的,如细胞信号释放,能量传递,细胞 间通信等都是受代谢物调控的。因此,针对脂肪细胞开展肥胖代谢组学研究,从细胞水 平寻找差异表达代谢物可为肥胖及其并发症的发病机制研究提供全新的线索及潜在靶 标。
5.另外,国内外的口服减肥产品主要分为食欲抑制剂、排泄剂、促进代谢剂和阻断脂 肪吸收剂。其可能引起中风、血压升高、心率加快、厌食、失眠、肝功能异常等危害严 重的副作用,具有减肥作用的中药制品多是一些具有渲泄作用的中成药,长期饮用,不 利于身体健康。因此,寻找新型的无副作用的减肥产品依然是目前的研究的热点。
技术实现要素:
6.有鉴于此,本发明要解决的技术问题在于提供一种安全无副作用的物质,从而可达 到减肥的效果。
7.本发明公开了一种如式i所示结构的可抑制白色脂肪细胞分化的肌酸及其应用,同 时肌酸为人体代谢产物,安全可靠,可避免传统减肥类产品对人体造成的副作用;
8.其中,式i具体为:
[0009][0010]
其中,具有式i所示结构的肌酸可以为市售。
[0011]
本发明还提供了一种含如式i所示结构的肌酸作为脂肪抑制剂的应用。
[0012]
本发明还提供了一种具有如式i所示结构的肌酸在制备治疗和/或预防肥胖的药物 和/或食品中的应用。
[0013]
本发明意料之外的发现,在肌酸浓度为50μm到10mm时,在不影响细胞增殖、细 胞周期及凋亡的前提下,可以显著抑制人内脏及前体脂肪细胞在诱导分化过程中的成 脂。
[0014]
优选地,本发明提供的肌酸用量为:500μm。
[0015]
肌酸具有抑制白色脂肪分化的功能,从而可以抑制体内脂肪的积累避免肥胖的产 生。同时,由于肌酸为人体代谢产物,可以避免传统减肥类产品对人体引起的副作用。
[0016]
有益效果:
[0017]
1)本发明中的肌酸为人体代谢产物,相比市售的减肥产品更加安全。
[0018]
2)肌酸作为生产成本低廉,易于转化推广。
[0019]
3)当肌酸用量为500μm时,可显著抑制人内脏及前体脂肪细胞在诱导分化过程中 的成脂。
附图说明
[0020]
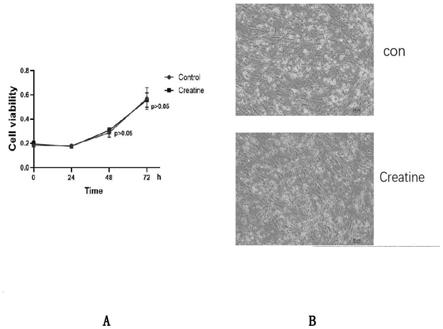
附图1a和1b为实施例1所示的肌酸对细胞增殖影响结果图。
[0021]
附图2为实施例2所示的肌酸对细胞周期影响结果图。
[0022]
附图3为实施例3中细胞油红染色结果图。
[0023]
附图4为实施例4中利用rt
‑
pcr法检测分化密切相关基因在分化过程中表达水平 结果图。
[0024]
附图5为实施例6中的肌酸对细胞线粒体ros的影响结果图。
具体实施方式
[0025]
本发明提供了一种肌酸在制备抑制人体内脏白色脂肪细胞分化的组合物中的应用, 表现为可减少脂滴的形成,及其在制备治疗或预防肥胖的化合物中的应用。本领域技术 人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换 和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方 法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神 和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技 术。
[0026]
本发明提供了一种具有如式i所示结构的肌酸作为胰脂肪酶抑制剂的应用。
[0027]
本发明提供的肌酸在制备抑制人体内脏白色脂肪细胞分化的组合物中的所用原料 及试剂均可由市场购得。
[0028]
下面结合实施例,进一步阐述本发明。
[0029]
实施例1肌酸对人白色脂肪细胞增殖的影响实验
[0030]
本实施例为肌酸(creatine)对细胞增殖的影响实验,如图1a所示,结果显示在500μm 浓度下对细胞的增殖无影响。
[0031]
利用cck8法检测细胞增殖,96孔板每孔3000个细胞左右,加含药培养基,37度 孵育24小时、48小时和72小时检测细胞增殖情况,检测前每孔加入10微升cck8,37 度孵育1h,利用酶标仪测吸光度值,计算细胞增殖情况。
[0032]
用显微镜观察不同浓度的肌酸对细胞增殖,结果如图1b所示,发现细胞形态、数 目及大小无明显改变,视野下未见明显凋亡细胞。
[0033]
实施例2肌酸对细胞周期的影响实验
[0034]
肌酸对细胞周期的影响,结果如图2所示,浓度500μm以下对细胞周期的变化无 影响。收集加药后的细胞,利用细胞周期检测试剂盒,染色,之后用流式细胞仪检测细 胞周期。
[0035]
具体步骤如下:细胞接种于10cm的培养皿中,待细胞生长至密度为50
‑
60%时,更 换为不含血清的培养基(dmem),孵箱中培养24小时,然后更换培养基(pam)含有 血清、青链霉素及生长因子,实验组中加入500μm肌酸。
[0036]
(1)细胞收集:培养24小时后,胰酶消化细胞,待细胞变圆,收缩后加入含有血 清的pam培养基,终止消化,收集细胞,离心1000xg,5min,收集细胞并用1mlpbs 重悬,再次离心1000xg,5min,重复这一步骤一次,离心后的细胞弃去pbs,加入75% 的冰乙醇,放在
‑
20℃待检;
[0037]
(2)碘化丙啶染色液的配制:参考表1,根据待检测样品的数量配制适量的碘化丙 啶染色液:
[0038]
表1
[0039][0040]
(3)细胞染色:每管细胞样品中加入0.5毫升碘化丙啶染色液,缓慢并充分重悬细 胞沉淀,37℃避光温浴30分钟,随后可以4℃或冰浴避光存放;
[0041]
(4)染色完成后宜在24小时内完成流式检测,用流式细胞仪在激发波长488nm波 长处检测红色荧光,同时检测光散射情况,采用适当分析软件进行细胞dna含量分析和 光散射分析。
[0042]
实施例3肌酸对人内脏前体脂肪细胞分化的影响
[0043]
收集诱导分化成熟的人内脏白色脂肪细胞,利用油红o染色试剂盒染色,观察油红 染色效果,并利用酶标仪检测油红定量结果,本实施例发现蛋氨酸干预浓度为500μm 时可
以显著抑制脂肪细胞的成脂及分化,如图3所示细胞油红o染色(图a,图b)及 油红o定量图c;其中,油红o染色具体步骤如下:
[0044]
1)分化成熟的脂肪细胞弃去培养基,pbs洗2遍,4%多聚甲醛1ml/孔固定30min;
[0045]
2)油红染色液配置:按油红:异丙醇=150mg:50ml比例配置储备液;工作液 按储备液:ddh2o=3:2比例配置;65℃水浴锅加热溶解;
[0046]
3)过滤:配置溶解好的油红,先用滤纸过滤,再用0.22um滤膜过滤,注意轻柔 操作;
[0047]
4)染色:固定好的细胞,吸弃固定液,pbs洗两遍,加入油红工作液室温避光, 染色30min;
[0048]
5)染色完成后弃去染色液,pbs清洗5遍,最后再加入适量pbs,显微镜下拍照;
[0049]
油红o定量步骤:
[0050]
1)细胞染色固定及清洗后,加入150μl细胞裂解液,500μl异丙醇反复吹打混匀;
[0051]
2)1000x g,离心3分钟,去除细胞碎片等;
[0052]
3)小心吸取上面的上清,加入96孔板,每孔100μl,然后用酶联免疫机检测其在 520nm波长处检测吸光度值。
[0053]
实施例4肌酸人内脏前体脂肪细胞分化相关基因表达量的影响
[0054]
分别收集分化第1、4和7天细胞,利用rna抽提试剂盒提取rna,并利用反转 录试剂盒反转录,利用rt
‑
pcr法检测分化密切相关基因在分化过程中表达水平有不同 程度下调如pgc1α、pparγ、pparα,fabp4如图4所示;
[0055]
(1)细胞总rna抽提(trizol一步法)
[0056]
1)从
‑
70℃冰箱中取出标本(溶解在trizol中的细胞悬液,1ml/管)解冻,吹打 混匀后,室温静置5min;
[0057]
2)加1/5体积的氯仿,颠倒混匀10次,室温静置5min后,4℃,12000g,离心15min;
[0058]
3)转移上层水相至新的去核酸酶处理的1.5ml eppendorf管中(约400μl),加入等 体积异丙醇,室温静置10min后,4℃,12000g,离心10min;
[0059]
4)弃上清,加冰预冷的75%乙醇1ml,4℃,7500g,离心5min;
[0060]
5)弃上清,空气干燥5
‑
10min,溶于适量depc水中;
[0061]
6)使用nanodrop nd
‑
1000分光光度计检测提取的rna样品浓度、od260/280 以及od230/260。
[0062]
(2)逆转录反应(逆转录试剂盒,takara bio tnc.)
[0063]
1)去除基因组dna:
[0064]
将试剂盒内相关试剂于冰上溶解后,在rnase
‑
free的八连排离心管(八连排)中配 制如表2混合液;
[0065]
用移液器轻轻吹打混匀并短暂离心,42℃,2min。
[0066]
2)逆转录反应:
[0067]
按如下表3顺序配制逆转录反应体系,在上一步反应管中直接加入5
×
hiscript ii qrt supermix ii;
[0068]
表3
去除未进入细胞内的dcfh
‑
da;
[0088]
(4)激光共聚焦显微镜下拍照。
[0089]
膜电位具体操作步骤:
[0090]
(1)对于六孔板大小的一个孔,吸除培养液,根据具体实验如有必要可以用pbs或 其它适当溶液洗涤细胞一次,加入1ml细胞培养液。细胞培养液中可以含有血清和酚红;
[0091]
(2)加入1ml罗丹明染色工作液,充分混匀。细胞培养箱中37℃孵育45分钟;
[0092]
(3)染色完成后,用pbs清洗5遍,加入细胞固定液1ml,固定30min,加入含有0.2% 的triton通透15min,注意避光,放置37℃孵箱;
[0093]
(4)37℃孵育结束后,吸除上清,用pbs(1x)洗涤3次;
[0094]
(5)加入100μl细胞培养液,并在激光共聚焦的小皿中加入100μl的dapi含荧光 防淬灭剂,荧光显微镜或激光共聚焦显微镜下观察。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1