奇异变形杆菌外膜囊泡在制备预防或治疗骨溶解性疾病药物中的应用
1.本发明属于骨疾病治疗技术领域,具体涉及奇异变形杆菌外膜囊泡在制备预防或治疗骨溶解性疾病药物中的应用。
背景技术:
2.生物体内的骨骼时刻进行着骨吸收和骨新生过程,这一过程称为骨重建,骨重建的平衡对骨骼稳态有着重要作用。破骨细胞与成骨细胞都参与到骨重建过程,破骨细胞的功能是吸收旧的骨组织,成骨细胞的功能是产生新生骨,两者处于平衡状态以维持骨重建的平衡。破骨细胞增殖和活性的异常增加导致骨吸收的速度远远超过骨形成的速度,打破骨重建的平衡,导致骨组织被破坏、侵蚀,从而引起骨骼疾病,如骨质疏松症、类风湿性关节炎、强直性脊柱炎、骨硬化病、系统性红斑狼疮、阿尔茨海默症、糖尿病、乳腺癌及前列腺癌等。
3.破骨细胞分化的途径可以分为核因子nf
‑
κb配体受体激活剂介导的经典途径(如:traf6/rankl/nf
‑
κb、traf6/rankl/mapk)和一些炎性细胞因子(如:il
‑
1、il
‑
6、inf
‑
α)参与的非经典途径。疾病发生时,成骨细胞谱系细胞或骨细胞产生激活核因子nf
‑
κb配体受体激活剂(rankl),rankl与其受体rank相结合,激活衔接蛋白traf6活化的traf6并启动nf
‑
κb和mapk等通路,引起nfatc1的活化,从而激活并诱导破骨细胞特异性基因,如破骨细胞分化融合(dc
‑
stamp,atp6v0d2)和功能(ctsk,trap,mmp9)相关基因的表达,促进破骨细胞分化和发挥骨吸收功能。
4.诱导破骨细胞过度活化从而导致患者骨密度下降的因素有很多,包括内源性因素(激素水平和自身免疫)和外源性因素(细菌感染)。既往研究显示,变形杆菌溶血素和hla
‑
dr4之间以及变形杆菌脲酶和透明软骨之间具有同源序列,这些序列能够与滑膜组织中存在的某些自身抗原发生交叉反应产生相关分子影响,这可能与类风湿性关节炎的发病机理有关。此外,金黄色葡萄球菌是骨髓炎的常见病因,并可增加体内存在于骨表面的破骨细胞的丰度。
5.目前,主要通过调节激素水平和抗炎改善骨骼疾病,而靶向破骨细胞的药物较少,主要为双膦酸盐和地诺单抗。(1)糖皮质激素类药物(地塞米松)和甲氨蝶呤能够抑制类风湿性关节炎中炎症因子如tnf
‑
α的释放,但长期使用均会引起骨丢失。如地塞米松在体外能够促进破骨细胞生成,在体内引起动物和病人发生骨质疏松;甲氨蝶呤使用后也会促进破骨细胞形成从而引起骨破坏。(2)双膦酸盐可以抑制破骨细胞活性和骨吸收。其中,氨基双膦酸盐通过抑制法尼基焦磷酸合酶发挥其对破骨细胞功能的抑制作用,但由于其促炎作用并不经常使用。另一方面,非氨基双膦酸盐在代谢为不可水解的atp类似物后可抑制atp依赖性酶导致破骨细胞凋亡增加,但它们在调节骨侵蚀方面基本上无效。(3)地诺单抗(denosumab)用于抑制rank配体(rankl)导致破骨细胞介导的骨吸收和转换减少。树突状细胞和活化的t淋巴细胞大量表达rankl,denosumab引起的拮抗作用可能会影响免疫系统,从
而导致不良反应,包括皮肤湿疹、肠胃气胀、蜂窝织炎和颌骨坏死。此外,rank和rankl的相互作用对denosumab治疗后的免疫细胞和低钙血症的发展是必不可少的,因此,严重肾功能不全可能是治疗的主要危险因素之一。阻断rank信号或破骨细胞的受体激活剂尽管可能不会干扰滑膜炎,但可以保护骨骼。而阻断tnf
‑
α或il
‑
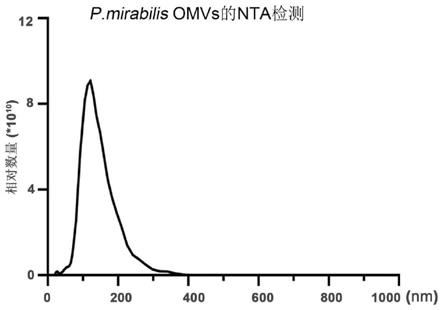
1等上游细胞因子可减少滑膜炎症及软骨和骨骼破坏。滑膜炎症不可能被完全抑制,因此通过添加药物进一步阻断破骨细胞数量和活化来保护关节可能是最佳治疗方法。
6.人体内的菌群失衡与许多疾病有关,将益生菌lactobacillus casei移植到关节炎小鼠中能够显著改善关节炎症状,而e.coli则与ibd的发展有关,牙龈卟啉单胞菌不仅能够引起牙周炎还能够加剧关节炎的发生。虽然细菌本身无法完成远距离传输,但其分泌和产生的代谢物可进行远距离传输,如scfas、分泌的毒素及出芽形成的外膜囊泡均能够逃避宿主免疫,穿过人体内层层屏障到达合适的部位后发挥作用进而影响宿主健康。
7.细菌衍生的外膜囊泡(omvs)来自于革兰氏阴性菌细胞膜,直径在20到450nm之间并包含内膜和外膜蛋白、周质蛋白、脂多糖(lps)、毒力因子、dna、rna和母代细菌的其他生物分子,并可远距离传输运送和保护这些分子免受外部环境的影响。研究表明omvs不仅能够与巨噬细胞、中性粒细胞、树突状细胞等免疫细胞相互作用,还能够与上皮细胞、成骨细胞、滑膜细胞等宿主细胞直接相互作用,如kingellakingae omvs可以被成骨细胞和滑膜细胞内在化,从而导致gm
‑
csf和il
‑
6产生增加。此外,其还能够调节宿主免疫系统从而影响疾病的发病,研究表明omvs可诱导树突状细胞成熟,从而增强抗原分子的摄取和呈递以发展适应性免疫反应。临床上,用于侵袭性脑膜炎球菌疾病的b型脑膜炎omvs疫苗已通过i,ii期和多项临床研究。但细菌omvs对破骨细胞的影响尚未有报道。
技术实现要素:
8.为了解决现有技术中的不足,本发明的目的是提供奇异变形杆菌外膜囊泡在制备预防或治疗骨溶解性疾病药物中的应用。具体技术方案如下:
9.病理性骨吸收主要是由于破骨细胞数量的增加,这取决于破骨细胞分化和凋亡的速度。因此,在许多溶骨性疾病中防止骨质流失的一个关键因素是抑制破骨细胞的数量和功能。
10.本发明第一方面提供奇异变形杆菌外膜囊泡在制备预防或治疗骨溶解性疾病药物中的应用。
11.本发明的上述技术方案中,所述骨溶解性疾病包括骨质疏松症、骨质溶解、类风湿性关节炎、骨关节炎、强直性脊柱炎、成骨不全、骨硬化病、多发性骨髓瘤、骨转移性癌、恶性肿瘤的高钙血症、系统性红斑狼疮、阿尔茨海默症、糖尿病、乳腺癌、前列腺癌、免疫抑制治疗引起的骨丢失、糖皮质激素类药物治疗引起的骨丢失、甲氨蝶呤治疗引起的骨丢失、卵巢切除诱导的骨丢失和ii型胶原诱导的骨侵蚀。
12.本发明的上述技术方案中,所述骨溶解性疾病包括骨质疏松症、骨质溶解、类风湿性关节炎、骨关节炎、强直性脊柱炎、成骨不全、骨硬化病、免疫抑制治疗引起的骨丢失、糖皮质激素类药物治疗引起的骨丢失、甲氨蝶呤治疗引起的骨丢失、卵巢切除诱导的骨丢失和ii型胶原诱导的骨侵蚀;
13.优选地,所述骨溶解性疾病包括骨质疏松症、骨质溶解、类风湿性关节炎、免疫抑
制治疗引起的骨丢失、糖皮质激素类药物治疗引起的骨丢失、甲氨蝶呤治疗引起的骨丢失、卵巢切除诱导的骨丢失和ii型胶原诱导的骨侵蚀。
14.本发明的上述技术方案中,所述奇异变形杆菌外膜囊泡预防或治疗骨溶解性疾病的机制为,
15.所述奇异变形杆菌外膜囊泡抑制mir96
‑
5p表达而促进abca1表达,从而抑制mapk/erk通路,导致破骨细胞分化受阻;
16.所述奇异变形杆菌外膜囊泡诱导mpt相关细胞色素c的释放导致线粒体结构被破坏,增加活性氧产生,导致破骨细胞凋亡增加。
17.所述奇异变形杆菌外膜囊泡抑制mir96
‑
5p表达而促进abca1表达,从而抑制mapk/erk通路,而mapk通路激活引起nfatc1的活化激活从而诱导破骨细胞的分化和特异性基因的表达,因此mapk/erk通路的抑制会导致破骨细胞分化受阻。
18.破骨细胞生成和骨溶解都需要大量的能量供应和消耗,研究证明破骨细胞分化所需的能量主要来自线粒体的氧化代谢。因此当线粒体结构被破坏时atp合成减少,使破骨细胞因能量供应不足而无法完成融合和成熟过程。p.m omvs处理后线粒体结构被破坏导致atp的产生显著减少,mpt相关细胞色素c的释放,活性氧(ros)水平增加,使线粒体膜电位显著降低从而诱导细胞凋亡。
19.本发明第二方面提供一种预防或治疗骨溶解性疾病的药物组合物,包括奇异变形杆菌外膜囊泡。
20.本发明的上述技术方案中,所述药物组合物还包括药学上可接受的辅料。
21.本发明第三方面提供奇异变形杆菌外膜囊泡在制备抑制破骨细胞的形成和/或活化的试剂或药物中的应用。
22.本发明第四方面提供一种抑制破骨细胞形成和/或活化的药物组合物,包括奇异变形杆菌外膜囊泡;
23.优选地,所述药物组合物还包括药学上可接受的辅料。
24.本发明第五方面提供一种破骨细胞形成和/或活化抑制剂,包括奇异变形杆菌外膜囊泡。
25.本发明第六方面提供一种抑制破骨细胞形成和/或活化的试剂盒,包括上述的抑制剂。进一步地,所述试剂盒还可以包括缓冲剂、稀释剂、ph调节剂等。
26.本发明中所述药学上可接受的辅料包括药学上可接受的载体、赋形剂、润滑剂、着色剂等。本发明中的药物组合物可经口或非经口地给药,非经口给药方式,例如可以是静脉注射、肌肉注射、口腔内给药等。
27.本发明的有益效果:
28.1、本发明首次发现奇异变形杆菌外膜囊泡不仅在体外显著抑制rankl诱导的破骨细胞的分化和功能,也能够在体内改善ovx引起的骨代谢失衡和cii引起的骨侵蚀,为预防或治疗骨溶解性疾病提供了新思路。
29.2、奇异变形杆菌外膜囊泡一方面通过mir96
‑
abca1
‑
mapk途径实现对骨的保护,奇异变形杆菌外膜囊泡抑制mir96
‑
5p表达而促进abca1表达,从而抑制mapk/erk通路,导致破骨细胞分化受阻。另一方面,奇异变形杆菌外膜囊泡诱导mir96
‑
5p表达的显著抑制,引起参与线粒体功能的atp结合盒亚家族a成员1(abca1)上调,进而下调erk磷酸化,这对破骨细胞
活化至关重要。abca1能促进线粒体胆固醇降低并参与细胞色素c(cyto c)的释放,导致线粒体结构被破坏且数量减少,同时显著减少破骨细胞形成过程中atp的产生。omv通过诱导细胞内ros引起线粒体破坏,线粒体膜电位降低,并调节bax,bcl
‑
2,caspase
‑
3和cyto c水平导致线粒体依赖性细胞凋亡增加,从而导致atp产生减少最终导致破骨细胞分化和功能受到破坏。
附图说明
30.图1为p.m omvs的tem图。
31.图2为p.m omvs的大小和数量统计结果。实验结果经三个独立重复的实验获得。
32.图3为p.m omvs对破骨细胞分化和功能的影响。(a)不同浓度p.m omvs及p.m lps分别处理bmms 48,72,96h后的细胞活力;(b)0.15,0.3μg/ml p.m omvs,p.m lps处理rankl诱导的来源的破骨细胞分化的代表图片及细胞核大于三个的trap+细胞数目统计;(c)0.15,0.3μg/ml的p.m omvs及p.m lps刺激炎症来源的rankl诱导的破骨细胞形成的代表图片及细胞核大于三个的trap
+
细胞数目统计;(d)p.m omvs对rankl诱导的破骨细胞相关基因表达的影响;(e)p.m omvs对rankl诱导的破骨细胞f
‑
肌动蛋白环形成影响的共聚焦代表图片;(f)p.m omvs对rankl诱导的破骨细胞相关基因表达的影响;(g)p.m omvs刺激后骨吸收的代表图,代表图片的3d图像呈现以及每μm2的凹坑面积的统计信息(n=6)。(e)比例尺=50μm;(b),(c)和(g)比例尺=200μm。实验结果经三个独立重复实验获得,并表示为平均值
±
sd。*,p<0.05;**,p<0.01;***,p<0.001;****,p<0.0001。
33.图4为p.m omvs对ovx引起的骨丢失有保护作用。(a)实验流程;(b)sham和ovx的microct图像(有或没有p.m omv治疗);(c)小鼠子宫与体重比;(d
‑
h)小鼠骨参数bmd,tb.bv/tv,tb.n,tb.th,tb.sp;血清(i)ctx
‑
1和(j)ocn水平(n=5/组);(k)he(n=5)和(l trap(n=5)染色股骨切片和(m)n.oc/b.pm比值。bmd:骨密度,tb.bv/tv:每组织体积的小梁骨体积,tb.n:骨小梁数量,tb.th:骨小梁厚度,tb.sp:骨小梁间隙。假手术组(n=5),ovx组,其余组n=5,分别为ovx+pbs组和ovx+p.m omv组。实验结果经三个独立重复实验获得,并表示为平均值
±
sd。#,p<0.05;##,p<0.01;###,p<0.001;####,p<0.0001与假手术组相比。*,p<0.05;**,p<0.01;***,p<0.001;****,p<0.0001与ovx相比。
34.图5为p.m omvs对cia炎症和骨侵蚀的影响。(a)实验流程;(b)不同组小鼠后爪代表性图片;(c
‑
d)第二次免疫后各组的平均关节炎和后足关节炎评分;(e
‑
f)第107天小鼠后爪切片的he染色;(g)第0,21,75和107天各组血清中抗cii抗体水平(正常组n=3,其他组n=7);血清(h)ctx
‑
1和(i)ocn水平;(j)μct代表性图像(正常组n=3,其他组n=5);(k
‑
o)不同组的骨参数。bmd:骨密度,tb.bv/tv:每组织体积的小梁骨体积,tb.n:骨小梁数量,tb.th:骨小梁厚度,tb.sp:骨小梁间隙。关节炎评分用平均值
±
sem表示,其余数据用平均值
±
sd表示。#,p<0.05;##,p<0.01,###,p<0.001,####,p<0.0001与正常组相比;*,p<0.05;**,p<0.01;***,p<0.001;****,p<0.0001与cia组相比。
35.图6为p.m omvs处理后degs的火山图,kegg富弦图及mcode聚类分析图。(a)p.m omvs处理后差异表达基因火山图;(b)与(c)分别表示p.m omvs引起的上调和下调基因的kegg富集弦图;(d)和(e)表示p.m omvs引起的上调差异基因的mcode聚类分析图;(f),(g)表示p.m omvs下调差异基因的mcode聚类分析图。mcode聚类分析图中颜色越深代表该基因
与其他基因的作用越强烈,发挥的作用也越大。每组三个生物学重复。
36.图7为p.m omvs处理后差异表达microrna的火山图,热图及预测靶基因的kegg富集通路图。(a)p.m omvs引起的microrna差异表达的火山图;(b)和(c)分别表示p.m omvs中,前20个差异表达microrna的热图;(d)和(e)分别表示上调和下调microrna预测靶基因的kegg富集通路图。每组三个生物学重复。
37.图8为microrna转染后对破骨细胞形成和相关基因表达的影响。(a)和(b)分别表示nc,mirna mimics及inhibitors转染后破骨细胞trap染色后的代表图片,右侧分别表示nc,mirna mimics及inhibitors转染后trap
+
破骨细胞数量;(c)
‑
(e)nc及三种microrna mimics转染后对破骨细胞相关基因的影响;(f)
‑
(h)nc及三种microrna inhibitors转染后对破骨细胞相关基因的影响。实验结果经三个独立重复的实验获得,并表示为平均值
±
sd。比例尺=200μm.*,p<0.05,**,p<0.01,***,p<0.001,****,p<0.0001。
38.图9为mmu
‑
mir
‑
96
‑
5p对abca1表达的影响。(a)targetscan,rna22和mirdb预测mmu
‑
mir
‑
96
‑
5p靶基因的韦恩图;(b)mmu
‑
mir
‑
96
‑
5p靶基因与mrna测序中上调或下调mrna交集的韦恩图;(c)和(d)分别代表p.m omvs处理后,rt
‑
qpcr及wb检测abca1的表达;(e)abca1 mrna 3'utr中mir
‑
96
‑
5p靶位点及其突变序列示意图;(f)将含有abca1wt或mut 3'utr的报告基因构建体与nc或mir
‑
96
‑
5p mimic共转染hek293t细胞48小时后的相对荧光活性;(g)和(h)rt
‑
qpcr和wb分别检测mir
‑
96
‑
5p mimic和inhibitor转染后abca1基因和蛋白的表达。实验结果经三个独立重复的实验获得,并表示为平均值
±
sd。*,p<0.05,**,p<0.01,***,p<0.001,****,p<0.0001。
39.图10为p.m omvs对线粒体和破骨细胞凋亡的影响。(a)线粒体的tem图像;(b)在含或不含0.15μg/ml p.m omv的m
‑
csf+rankl培养基中培养bmms后的atp水平;(c
‑
d)在含有m
‑
csf+rankl(含或不含0.15/0.3μg/ml p.m omv)的培养基中刺激5天后,破骨细胞内ros和dcf平均荧光强度(mfi);(e)线粒体膜电位和(f)jc
‑
1聚集体/单体荧光比率的变化;(g
‑
h)破骨细胞凋亡流式图,(i)caspase
‑
3,bcl
‑
2和bax的总蛋白western blot分析;(j
‑
k)细胞质和线粒体中细胞色素c的表达。实验结果经三个独立重复的实验获得,并表示为平均值
±
sd。#,p<0.05;##,p<001;###,p<0.001与m
‑
csf相比,*,p<0.05,**,p<0.01,***,p<0.001,****,p<0.0001与m
‑
csf+rankl相比。
40.附图中,cia评分数据用平均值
±
sem来表示,其余统计学数据均采用平均值
±
sd来表示,在graphpad prism 8.0上作图并对数据进行统计分析,student’s t检验对两组间进行比较,p<0.05时认为具有统计学意义。
41.图1~10,实验结果由三次生物学重复获得,*p<0.05,**p<0.01,***p<0.001。
具体实施方式
42.为了更清楚地理解本发明,现参照下列实施例及附图进一步描述本发明。实施例仅用于解释而不以任何方式限制本发明。实施例中,各原始试剂材料均可商购获得,未注明具体条件的实验方法为所属领域熟知的常规方法和常规条件,或按照仪器制造商所建议的条件。
43.一、材料与试剂
44.奇异变形杆菌(p.mirabilis)购自atcc(美国)。bhi肉汤,mrs培养基购自广东环凯
微生物科技有限公司。lb固体培养基invitrogen公司。α
‑
mem购自trap染色试剂盒购自sigma(美国)。96孔羟基磷灰石板购自康宁公司(corning osteoassay)。nfatc1购自cst公司,c
‑
fos,ctsk购自abcam公司(美国),mmp9购自武汉三鹰生物技术有限公司(武汉),iκb
‑
α购自signalwayantibody公司(美国),gapdh,β
‑
actin购自北京博奥森生物技术有限公司(北京),bax,bcl
‑
2,caspase
‑
3,erk,p
‑
erk购自江苏亲科生物研究中心有限公司(江苏)。茜素红和alp染色试剂盒购自碧云天生物有限公司(上海)。
45.本发明中所用引物的名称及序列如表1所示。
46.表1基因引物名称及序列
[0047][0048]
二、缩略词
[0049]
m
‑
csf,macrophage
‑
colony stimulating factor,巨噬细胞集落刺激因子
[0050]
rankl,receptor activator of nuclear factor κb ligand,核因子nf
‑
κb配体受体激活剂
[0051]
bmms,bone marrow derived monocytes/macrophages,骨髓源性单核/巨噬细胞
[0052]
lps,lipopolysaccharide,脂多糖
[0053]
ros,reactive oxygen species,活性氧
[0054]
abca1,atp结合盒亚家族a成员1
[0055]
cyto c,细胞色素c
[0056]
实施例1:奇异变形杆菌外膜囊泡(p.m omvs)的提取与鉴定
[0057]
1.细菌培养
[0058]
挑取奇异变形杆菌(p.mirabilis)的单克隆菌落,将其放入bhi肉汤培养基中,在有氧,37℃下培养16
‑
18小时。培养结束后,酶标仪检测其在波长为600nm处的吸光度(od),od值在0.6
‑
0.8时,收集细菌。
[0059]
2.细菌外膜囊泡的提取、鉴定与定量
[0060]
将收集的细菌在4℃,8000rpm条件下离心三次后,收集上清,0.22μm过滤器过滤,取200μl菌液于过滤前后涂在lb琼脂培养板上并放入恒温培养箱中37℃培养12小时,待过滤后的上清在培养板上无细菌生长,过滤前的细菌在培养板上有细菌生长时,收集的上清放入4℃冰箱中留待使用。上述细菌清经超速离心(150,000g,1.5h,4℃)后得到的沉淀即为外膜囊泡(omv)。pbs溶解沉淀后使用0.22μm针头过滤器对得到的囊泡在无菌操作台进行过滤,并将将过滤后得到的omv装到多个ep管中并储存在
‑
80℃下直至使用。
[0061]
经细菌培养,前处理及超速离心后得到白色沉淀,将其使用pbs溶解,纳米颗粒追踪分析仪(nanoparticle tracking analysis,nta)在11个位置捕获用pbs(1:5000)稀释的omv样品并使用内置的zetaview 8.02.31软件分析数据来确定omv的大小和数量。透射电子显微镜(transmission electron microscope,tem)观察omv形态。tem显示其为双层膜结构(图1a&b),nta表明得到沉淀的粒径大小在50
‑
450nm之间(图2),这些结果表明得到的沉淀为omv。
[0062]
bca法对p.m omvs进行蛋白定量,p.m omvs的初始浓度为475.6
±
56.7μg/ml,使用前计算终浓度为0.15μg/ml时所需加入的p.m omvs的体积。
[0063]
实施例2:p.m omvs抑制rankl诱导的破骨细胞的分化、融合和吸收活性
[0064]
1.显色内毒素定量(lal)试剂盒测定p.m omvs中lps含量为每0.15g蛋白含有2.64eu内毒素。通过cck8检测经不同浓度p.m omvs和标准p.m lps处理48、72和96小时后对bmms的影响。具体操作如下:
[0065]
将bmms细胞分别以5
×
104/ml的密度接种在96孔板中,每孔100μl体系,将配制好的各浓度梯度的omvs和lps加入到细胞中孵育48、72和96小时,每孔加入10μl cck
‑
8,5%co2,37℃下孵育3小时后在450nm下测量od值。实验重复三次,细胞活力百分比以不加刺激作为阳性对照。
[0066]
细胞活力百分比(%)=[(实验组od值
–
空白对照组od值)/(阳性对照组od值
–
空白对照组od值)]
×
100%
[0067]
p.m omvs在较高浓度下显著降低bmms的细胞活力,而在0.15和0.3μg/ml蛋白质浓度以及不同浓度的p.m lps(0
‑
1000ng/ml)下,对bmm活力有轻微影响(图3a)。
[0068]
2. 0.15,0.3μg/ml p.m omvs和5,10ng/ml p.m lps分别处理rankl诱导的来源的破骨细胞分化和炎症来源(cia诱导的关节炎的dba/1雄鼠)的rankl诱导的破骨细胞分化,进行trap染色、相关基因表达的检测和相关蛋白表达的检测,相关基因表达通过rt
‑
qpcr实验检测,相关蛋白表达通过蛋白免疫印迹实验检测。相关基因的rna引物序列如表1所示。
[0069]
实验分为三组:m
‑
csf,m
‑
csf+rankl,m
‑
csf+rankl+omvs,分别使用0.15μg/ml p.m omvs和5,10ng/ml p.m lps刺激rankl诱导的破骨细胞,观察到破骨细胞形成进行trap染色。同时,通过rt
‑
qpcr测定0.15μg/ml p.m omvs对破骨细胞相关基因acp5,mmp9,ctsk,itgβ3,nfatc1和c
‑
fos表达的影响。具体操作如下:
[0070]
1)rankl诱导的破骨细胞分化:将贴壁的bmms用0.25%胰酶消化5分钟,800rpm离心5分钟,3ml完全培养基重悬后对细胞进行计数,按照4
×
105个/ml铺板同时加入25ng/ml的m
‑
csf,37℃,5%co2孵箱中培养24小时后加入50ng/ml的rankl和/或p.m omvs,对照组仅加入25ng/ml m
‑
csf,放入孵箱继续培养,每两天更换一次培养基和诱导剂(m
‑
csf和rankl)和p.m omvs,连续诱导3
‑
5天,出现的较多融合且体积较大,有可见空泡的多核细胞即为破骨细胞。
[0071]
2)trap染色:将96孔板中的旧培养基吸弃,每孔缓慢加入配制好的固定剂80μl(配置方法按照说明书进行操作)37℃固定15分钟;弃去固定液并使用双蒸水清洗后,每孔加入80μl染色液,37℃避光染色60分钟;染色结束后,双蒸水清洗1次,每孔加入50μl苏木素染色液,染色45秒到1分钟后洗净苏木素染液,双蒸水清洗三遍,将染色的细胞放于倒置荧光显
微镜下拍照,并统计细胞核数目大于3个的细胞数量。
[0072]
图3b为0.15,0.3μg/ml p.m omvs刺激rankl诱导的来源的bmma分化为破骨细胞,trap染色的代表性图像及trap
+
多核细胞的数目统计。图3c为0.15,0.3μg/ml p.m omvs刺激rankl诱导的炎症来源的bmms分化为破骨细胞,trap染色的代表性图像及trap
+
多核细胞的数目统计。
[0073]
3)rna提取与rt
‑
qpcr测定
[0074]
使用trizol裂解细胞,并依次使用氯仿,异丙醇,75%乙醇,无酶水得到rna后,使用酶标仪检测样品rna的浓度,按照总质量1μg将rna逆转录为cdna,按照试剂盒说明将rna逆转录为cdna(dbi,德国),使用promega荧光定量试剂盒(美国)在light cycler480仪器中进行rt
‑
qpcr反应获得统计数据数据并计算2
‑
δδct
值计算变化差异。破骨细胞相关基因acp5,mmp9,ctsk和itgβ3的rna引物序列如表1所示。
[0075]
图3d为0.15,0.3μg/ml p.m omvs对破骨细胞相关基因表达的影响,qpcr结果表明p.m omvs显著下调rankl诱导的破骨细胞相关基因acp5,mmp9,ctsk,itgβ3,nfatc1和c
‑
fos的表达。
[0076]
蛋白免疫印迹实验,操作步骤如下:
[0077]
使用150μl含有pmsf的ripa蛋白裂解液,冰上裂解破骨细胞30分钟,4℃,12000g离心10分钟,获取上清,bca法对其进行蛋白定量,计算蛋白上样总质量为20μg时所需要的体积,按蛋白:5
×
loading buffer=4:1的比例加入蛋白上样缓冲液,于金属浴中100℃加热5分钟,将蛋白加入10%sds
‑
page凝胶中120v电泳80分钟后,将pvdf膜在甲醇中活化2分钟并将其放在胶的上面,恒流200ma电泳90分钟,之后将pvdf膜放于5%脱脂奶粉中,摇床上室温封闭2小时,4℃在摇床上孵育过夜,将一抗取出后加入适量的tbst,5分钟
×
6次洗膜,加入相对应的二抗,水平摇床上孵育1小时,二抗孵育完成后,使用tbst在水平摇床上清洗10分钟
×
3次,ecl发光液的a液与b液按照1:1的比例进行配制,选择化学发光模式进行曝光,image j软件对条带的灰度值进行分析,graphpad prism对数据进行分析。
[0078]
图3f为0.15μg/ml p.m omvs对破骨细胞相关蛋白mmp9,ctsk,nfatc1和c
‑
fos的表达,但不抑制iκbα蛋白。
[0079]
3.成熟的破骨细胞在rankl诱导后具有完整的f
‑
actin环和多个细胞核。分别使用0.15μg/ml p.m omvs刺激rankl诱导的破骨细胞,观察p.m omvs对破骨细胞f
‑
肌动蛋白环形成的影响,通过破骨细胞f
‑
actin环成像检测。同时,对破骨细胞骨吸收活性进行检测。具体操作步骤如下:
[0080]
(1)破骨细胞f
‑
actin环成像
[0081]
1)诱导破骨细胞:按2
×
105个/ml将bmms在共聚焦皿上培养诱导,并按照实施例2中的方法使用p.m omvs刺激rankl诱导的破骨细胞,诱导5天;
[0082]
2)固定,通透及封闭细胞:诱导成功的破骨细胞经pbs清洗后用4%多聚甲醛固定15分钟后,使用0.1%tritonx
‑
100通透30分钟,并用含有5%bsa封闭1h;
[0083]
3)染色及成像:将鬼笔环肽:pbs=1:40稀释后变为鬼笔环肽工作液,用该工作液避光染色60分钟后,pbs清洗三次,加入50μl含有dapi的抗荧光淬灭剂,室温避光孵育15分钟后染色结束,使用倒置激光共聚焦显微镜拍照。
[0084]
(2)破骨细胞骨吸收活性检测
[0085]
将bmms铺在osteoassay stripwell板中使用m
‑
csf,m
‑
csf+rankl诱导,并在rankl诱导的同时使用omv处理细胞。5天后观察到有破骨细胞形成,在此基础上延长培养5
‑
7天使破骨细胞的骨吸收功能得以充分发挥。培养结束后pbs清洗三次,加入0.3%次氯酸,静置10分钟以去除孔中粘附的细胞,用蒸馏水洗涤孔三次充分去脱落下来的细胞,将蒸馏水尽量吸干净,之后将板置于室温晾干,最后用倒置荧光显微镜观察破骨细胞的骨吸收情况。使用image
‑
pro plus软件分析骨吸收面积。对于3d可视化,使用image j软件重建了吸收区域的地形。
[0086]
图3e为p.m omvs对rankl诱导的破骨细胞f
‑
肌动蛋白环形成影响的共聚焦代表图片。图3g为p.m omvs刺激后骨吸收的代表图,代表图片的3d图像呈现以及每μm2的凹坑面积的统计信息(n=6)。结果表明p.m omvs减少f
‑
actin环的形成(图3e)且显着减少了破骨细胞的吸收面积(图3g)。f
‑
肌动蛋白环能维持破骨细胞的形态便于破骨细胞发生其骨吸收功能,因此当该结构损伤或无法形成时,就会影响破骨细胞的形成和骨吸收功能,实施例2的数据表明p.m omv具有抑制破骨细胞分化和功能的作用。
[0087]
实施例3:p.m omv可改善ovx引起的骨质疏松症的骨质流失
[0088]8‑
10周的c57雌鼠腹腔注射4%水合氯醛的体积(水合氯醛体积(μl)=小鼠体重(g)
×
10),10分钟后小鼠进行深麻状态即可开始手术,于背部判断小鼠卵巢位置,剪开小鼠皮肤,脂肪和肌肉层后,找到小鼠卵巢,结扎并摘除卵巢,缝合小鼠的肌肉层,脂肪层及皮肤层,并用酒精棉球止血,相同的方法摘除另一侧卵巢,假手术(sham)组不摘除卵巢,摘除卵巢后将小鼠放在红外治疗灯下保暖,12小时后常规饲养小鼠,卵巢摘除两周后,开始向关节腔内注射pbs和omvs,每周一次,共分为三组:sham+pbs组,ovx+pbs组,ovx+p.m omvs组,8周后,收集小鼠血清,子宫和股骨样本,股骨样本于4%多聚甲醛中固定48h行microct扫描,并于摇床上脱钙30天后进行he和trap染色。
[0089]
实验流程和结果如图4所示。ovx组的小梁骨变得稀疏,p.m omv处理后有所改善(图4b)。通过子宫/体重比值证实成功切除卵巢,在ovx手术后该比值显着降低(图4c)。如图4d
‑
h所示pbs处理的ovx小鼠中,骨矿物质密度(bmd)和其他小梁骨参数tb.bv/tv,tb.n,tb.th显着降低,但经p.m omv治疗后得到改善。ctx
‑
1是血清骨吸收的标志物,p.m omvs处理后ctx
‑
1水平显著降低(图4i),而骨钙素(ocn)水平无差异(图4j),he染色显示小梁骨的数量和厚度减少(图4k)。trap染色显示p.m omvs处理后n.oc/b.pm显著减少(图4l和m)。这些数据表明p.m omvs对ovx诱导的骨丢失具有保护作用。
[0090]
实施例4:p.m omvs可减轻ii型胶原诱导的关节炎(cia)的骨侵蚀
[0091]9‑
11周的dba/1小鼠注射100μl 1mg/ml的cii乳化剂,计算出需要的冰乙酸cii和cfa的体积后将冰乙酸cii和弗氏完全佐剂溶液按照1:1体积比加入预冷的研钵中,冰上研磨乳化成功后,将小鼠放在固定架上露出尾根部以上约3cm的位置,100μl的乳化剂经尾根部皮内注射,21天后进行二次免疫,免疫的浓度为每只鼠注射100μl 0.5mg/ml的cii乳化剂,佐剂为弗氏不完全佐剂,免疫方法相同,二次免疫后的第3天开始在小鼠关节腔内注射pbs和omvs,每周一次,共分为3组:normal,cia+pbs,cia+p.m omvs,二次免疫后的第5天开始评分,关节肿胀和发红定义为关节炎症,评分标准如下:每个发炎的脚趾或指关节为1分,根据手腕或脚踝发炎的严重程度,给1
‑
5分。每只小鼠每只爪子的得分为0到15,每只小鼠的总得分为0到60分;二次免疫14周后开始收集血清和小鼠的后传样本,爪子放入4%多聚甲
醛中固定48h后,进行microct扫描,摇床上脱钙30天后进行he染色。
[0092]
实验流程和结果如图5。图5a显示了该实验的简要过程,p.m omv仅在初始阶段影响关节炎症(图5b
‑
d),关节切片的he染色证实了本发明的结果(图5e和f)。p.m.omv治疗后抗cii抗体水平在炎症后期降低(图5g)。与增加血清ocn水平相反,p.m omv明显降低ctx
‑
1水平(图5h和i)。μct分析结果如图5j
‑
o所示,p.m omv显着改善了cia引起的bmd,tb.n,tb.th降低,但对tb.bv/tv和tb.sp没有影响。
[0093]
实施例5:p.m omvs调节mapk通路
[0094]
p.m omv显著影响破骨细胞体内外的功能,本发明将p.m omvs与rankl组进行比较分别得到上调和下调的差异基因(图6a),将他们分别进行kegg富集分析,由图6b kegg富集弦图可知上调的差异基因主要集中在细胞因子相互作用,病毒感染和nod样受体信号通路中,而下调的基因主要集中在ecm受体相互作用,蛋白消化和吸收及mapk通路上(图6c),利用string绘制蛋白
‑
蛋白互作网络图,将所得结果导入cytoscape后利用mcode分别找出p.m omvs中上调和下调的关键基因,结果显示上调的关键基因为ccl5和il
‑
1β(图6d,e),而下调的关键基因有pdgfb,egfr,pgf,fos,acp5,nfatc1,dc
‑
stamp(图6f,g),其中pdgfb,egfr,pgf,nfatc1,fos参与mapk通路。从测序结果可知rankl诱导破骨细胞形成时mapk通路被激活,但p.m omvs处理后mapk通路被抑制,表明p.m omvs可能通过干扰mapk通路而影响破骨细胞的形成。
[0095]
通过对rankl和p.m omvs组mirna测序结果分析,差异表达倍数大于2以火山图展示在图7a,结果显示p.m omvs中有44个microrna上调,48个下调,图7b,c分别显示上下调变化倍数在前20的microrna名称,使用miranda,targetscan及rnahybrid预测上调和下调microrna的靶基因并分别对靶基因进行kegg通路富集分析,如图7d,e所示,microrna靶基因富集最显著的通路均为mapk通路,表明p.m omvs能够影mapk通路,这与mrna测序结果一致。
[0096]
本实施例中转录组测序分析,具体操作如下:
[0097]
1)mrna测序:提取rna后,nanodrop2000琼脂糖凝胶电泳分别检测rna的纯度和完整性,符合要求后,使用illuminanovaseq6000进行mrna测序获得配对末端读数。seqprep和sickle对原始配对末端读数进行修剪以进行质量控制。tophat2用于序列比对分析,获得mapping reads,利用cufflinks根据已有的参考基因组对mapping reads进行组装和拼接。使用每百万读取的转录本(tpm)和deseq2对样本进行差异表达分析,|log2fc|>2和padjust<0.05被认为是差异表达基因(deg)。对deg进行kegg通路分析,并利用cytoscape寻找关键基因;
[0098]
2)mirna测序:illumina truseq小rna库制备试剂盒构建mirna库,对富集到的18
‑
32nt的小rna片段利用illuminanovaseq6000平台进行高通量测序,获得mapped data后使用mirdeep2软件包,通过tpm和deseq2得到差异表达的mirna,|log2fc|>1和padjust<0.05作为deg,使用miranda,targetscan和rnahybrid预测差异mirna的靶基因后,对靶基因进行kegg富集分析,得到靶基因富集通路。
[0099]
实施例6:microrna mimics和inhibitors对破骨细胞形成和相关基因的影响
[0100]
microrna可通过与靶基因结合而影响靶基因的表达及功能,因此研究microrna的作用对于了解其下游的基因和通路具有重要作用。本发明中选择mir
‑
155
‑
5p,mir
‑
96
‑
5p,
mir
‑
653
‑
5p进行研究。将nc,mir
‑
155
‑
5p,mir
‑
96
‑
5p,mir
‑
653
‑
5p mimics及inhibitor转染到rankl诱导的破骨细胞中,并分别检测3种microrna mimics转染后破骨细胞的形成及其相关基因的表达,结果显示,mir
‑
96
‑
5p mimic转染后破骨细胞形成的数量基本无变化(图8a)但显著上调acp5和mmp9的表达(图8c)。mir
‑
155
‑
5p mimic转染后减少破骨细胞的数量(图8a),且能够显著下调acp5,ctsk和c
‑
fos的表达且(图8d)。mir
‑
653
‑
5p mimic转染后抑制破骨细胞的形成(图8a)明显降低acp5,mmp9,ctsk,c
‑
fos的表达但显著上调itgβ3的表达(图8e)。mir inhibitors转染后的结果表明mir
‑
96
‑
5p inhibitor转染后显著抑制破骨细胞的形成(图8b)且明显抑制acp5和ctsk的表达(图8f),mir
‑
155
‑
5p inhibitor对破骨细胞的形成没有影响(图8b)但显著上调破骨细胞中acp5,mmp9,ctsk,itgβ3,nfatc1,c
‑
fos的表达(图8g),而mir
‑
653
‑
5p inhibitor明显抑制破骨细胞形成(图8b)但增强c
‑
fos,itgβ3的表达(图8h)。这些结果表明mir
‑
155
‑
5p上调能够抑制破骨细胞的形成,这与之前的研究结果一致,而减少mir
‑
96
‑
5p与靶基因的相互作用可导致破骨细胞形成受到抑制,而mir
‑
653
‑
5p的表达上调或抑制其作用均能够抑制破骨细胞的形成,因此本发明选择mir
‑
96
‑
5p进行研究。
[0101]
实施例7:mmu
‑
mir
‑
96
‑
5p可靶向并调节abca1表达
[0102]
targetscan,rna22以及mirdb对mmu
‑
mir
‑
96
‑
5p的靶基因进行预测,取交集后得到200个靶基因(图9a),之后将这200个靶基因与rna测序结果中上调或下调的degs分别取交集,上调基因中共有13个共同基因,下调基因中有6个,最终确定感兴趣基因为abca1(图9b)。rt
‑
qpcr及wb检测p.m omvs处理后abca1基因和蛋白表达显著上调(图9c和d),与测序结果一致。双荧光素酶报告验证mmu
‑
mir
‑
96
‑
5p是否能直接靶向abca1,首先构建野生型(wt)/突变型(mut)abca1
‑
psicheck2载体(图9e)并分别将其与mmu
‑
mir
‑
96
‑
5p转染进hek293t细胞,如图9f显示abca1 wt的荧光素酶活性在mir
‑
96
‑
5p mimic处理后显着降低,而abca1
‑
mut的荧光素酶活性变化基本无变化,这表明mir
‑
96
‑
5p可以靶向abca1。为进一步验证mir
‑
96
‑
5p mimic与abca1的靶向关系,分别将mir
‑
96
‑
5p mimic和inhibitor转染进破骨细胞中,结果表明mimic转染后abca1基因及蛋白表达受到显著抑制(图9g),而inhibitor转染后abca1基因及蛋白表达明显上调(图9h)。
[0103]
本实施例中双荧光素酶报告实验和mirna对破骨细胞分化的影响,具体操作如下:
[0104]
(1)双荧光素酶报告实验
[0105]
构建abca1 wt 3’utr和abca1 mut 3’utr质粒载体,将生长状态良好的hek293t细胞消化计数后以5
×
104/孔种到24孔板中,细胞长至80%左右时按照说明书对细胞进行转染,将报告基因细胞裂解液充分混匀后,加入100μl于24孔板中,充分裂解后,12,000g离心5分钟,取样品100μl并加入100μl荧光素酶检测试剂,测定rlu(relative light unit),完成测定后,加入等量海肾荧光素酶检测工作液测定rlu,计算两种萤光素酶比值,并比较不同组别的比值差异。
[0106]
(2)mirna对破骨细胞分化的影响
[0107]
将bmms细胞铺在96孔板中,待细胞贴壁后按照上述方法将nc mimic及inhibitor,mirna mimics和inhibitors分别转染到细胞中,24小时后加入rankl,48小时后换液,48小时后观察破骨细胞形成情况并进行trap染色,倒置荧光显微镜拍照,细胞核数目大于三个定义为破骨细胞,统计数目。
[0108]
将bmms铺到12孔板中,24小时后将50nm nc及mirna mimics,100nm nc inhibitor及mirna inhibitors按照说明书的步骤分别转染到细胞中,检测mirna mimics及inhibitosr转染后破骨细胞相关基因的表达变化。
[0109]
实施例8:p.m omvs通过线粒体依赖性凋亡抑制破骨细胞的形成
[0110]
abca1促进线粒体胆固醇降低并参与细胞色素c(cyto c)的释放,这可能导致线粒体结构的破坏。破骨细胞分化所需的能量主要来自线粒体氧化代谢。为了研究p.m omvs对线粒体的影响,首先用透射电镜观察线粒体结构,如图10a所示,p.m omv破坏rankl诱导的破骨细胞的线粒体结构,并在第1天和第5天显著降低了atp的生成(图10b),表明p.m omv不仅破坏线粒体结构,而且减少atp生成。线粒体是细胞内活性氧(ros)的主要来源,ros的过度产生可能导致线粒体膜电位(mmp)的丧失和atp合成受损,进而导致细胞凋亡,因此,进一步检测了p.m omvs处理后ros水平和细胞凋亡。如图10c所示,使用两种不同浓度的p.m omvs治疗5天后,dcfh
‑
da荧光百分比和平均荧光强度(mfi)显著增加(图10d)。ros的积累会破坏线粒体膜电位(δψm),因此测量了细胞线粒体膜电位变化(图10e&f)。p.m omvs显著提高细胞内ros但降低δψm的水平。如图10g&h所示,p.m omvs处理后细胞凋亡率以浓度依赖性方式明显增加,且p.m omvs处理后bax/bcl
‑
2比率和cleaved caspase
‑
3显著增强(图10i)并促进线粒体cyto c的释放(图10j&k),表明p.m omvs可通过线粒体依赖性途径显著促进破骨细胞凋亡。
[0111]
本实施例中线粒体结构观察、细胞内活性氧和细胞凋亡检测,具体操作如下:
[0112]
(1)线粒体结构
[0113]
将bmms按照6
×
105个/ml均匀铺到6孔板中,24小时后50ng/ml rankl诱导破骨细胞,与此同时加或不加p.m omvs,诱导三天后收集细胞,1500rpm离心5分钟,使细胞成为0.5
‑
1mm高的细胞沉淀,沿管壁缓慢加入500μl 2.5%戊二醛,室温静置1小时后放入4℃冰箱静置3小时,吸出戊二醛,向ep管中加满pbs放入4℃冰箱中静置过夜,将样本送入电镜室,将细胞制备成超薄切片后,在透射电镜下观察线粒体的超微结构,每个样品选取5
‑
6个视野进行拍照。
[0114]
(2)细胞内活性氧和细胞凋亡检测
[0115]
1)在有/无omv刺激下rankl诱导破骨细胞分化5天,在收集细胞前1小时,阳性对照组加入rosup,预冷的pbs清洗细胞两次,每孔加入400μl无血清培养基稀释的dcfh
‑
da避光孵育20分钟后,用无血清的培养基清洗两次,收集细胞1500rpm离心5分钟保留沉淀,200μl pbs重悬后转移至流式管中上机检测,flowjo v10软件对结果进行处理分析。
[0116]
2)在有/无omv刺激下,rankl诱导破骨细胞分化5天,预冷的pbs清洗后收集细胞,1500rpm离心5分钟后收集沉淀,向沉淀中加入100μl的1
×
binding buffer重悬细胞,并依次加入5μl fitc annexin v和5μl pi,室温避光孵育15分钟,加入200μl的1
×
binding buffer重悬并将其转移至流式管中上机检测,检测完成后用flowjo v10软件对结果进行处理分析。
[0117]
实施例9:
[0118]
本实施例提供一种预防或治疗骨溶解性疾病的药物组合物,其主要活性成分包括奇异变形杆菌外膜囊泡。
[0119]
本发明中的药物组合物可经口或非经口地给药,非经口给药方式,例如可以是静
脉注射、肌肉注射、口腔内给药等。制剂形式选自口服制剂、注射制剂、粘膜给药制剂、吸入剂、外用制剂,并可根据制剂形式进一步选择药学上可接受的辅料。
[0120]
在一个具体实施方式中,药物组合物的剂型为口服液,口服液常用辅料有溶剂、芳香剂、矫味剂、澄清剂、防腐剂等,可同时加入,也可择其一加入,其中溶剂为必需辅料,溶剂可以采用水。
[0121]
在一个具体实施方式中,药物组合物的剂型为颗粒剂,颗粒剂常用辅料有填充剂、粘合剂、润湿剂、崩解剂、润滑剂和薄膜包衣材料中的一种或多种。
[0122]
实施例10:
[0123]
本实施例提供一种破骨细胞形成和/或活化抑制剂,其主要成分包括奇异变形杆菌外膜囊泡。
[0124]
在一个具体实施方案中,可以将奇异变形杆菌外膜囊泡、缓冲剂、稀释剂、ph调节剂等组装成试剂盒,用于抑制破骨细胞的形成和/或活化。
[0125]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1