一种注射用环磷腺苷冻干制剂及其制备方法与流程
1.本发明涉及药物制剂技术领域,尤其是涉及一种注射用环磷腺苷冻干制剂及其制备方 法。
背景技术:
2.环磷腺苷为参与调节细胞功能的第二信使物质,其作用非常广泛,注射大剂量的环磷 腺苷,能使心肌收缩力增强,引起血压升高,心输出量增高。并能舒张平滑肌、扩张冠状动 脉血管、改善肝功能、抑制皮肤外层上皮细胞分裂及转化异常细胞的功能、促进呼吸链氧化 酶的活性及改善心肌缺氧等。
3.由于环磷腺苷的溶解性不足,因此现有的注射液中通常将其与葡甲胺混合增加其溶解 性,例如,一种在中国专利文献上公开的“环磷腺苷葡胺注射液及其制备方法”,公开号 cn102283804a,其制备工艺是取适量注射用水,加入氯化钠、环磷腺苷、葡甲胺,搅拌使完 全溶解,按体积加入0.05~0.2%(w/v)针用活性炭,搅拌15~30分钟,过滤除炭,补加注射用 水至近全量,用磷酸盐缓冲液调ph值至6.0~6.5之间,补加注射用水至全量,检测半成品合 格后,过滤,灌封(全过程充氮气),灭菌,灯检、包装即得。然而,在现有的环磷腺苷葡胺 溶液中,随着保存时间的延长,环磷腺苷会逐渐析出,使药液发生变质、浑浊,从而影响药 品的疗效,同时影响用药的安全性;并且环磷腺苷葡胺溶液在溶液状态保存过程中,易遇光 降解,使药物结构发生变化,引起临床过敏反应或疗效下降。
4.因此,目前一般将注射用环磷腺苷制成冻干制剂,以提高其储存稳定性,例如,一种 在中国专利文献上公开的“注射用环磷腺苷葡胺及其制备工艺”,公开号cn1579413,其组成 包括:环磷腺苷,所述的环磷腺苷与葡甲胺及赋形剂制成冻干粉针剂,其重量份数为环磷腺 苷1.7~63、葡甲胺1.0~37、赋形剂0.675~90,所述的环磷腺苷与所述的葡甲胺的重量份数比 为1.7∶1,ph值为3.5-9.0。然而现有技术中制备出的注射用环磷腺苷冻干粉溶解性不佳,使 用不便,重新溶解后容易析出,不但使主药的含量下降,而且会影响药品的安全性。
技术实现要素:
5.本发明是为了克服现有技术中制备出的注射用环磷腺苷冻干粉溶解性不佳,使用不 便,重新溶解后容易析出,不但使主药的含量下降,而且会影响药品的安全性的问题,提供 一种注射用环磷腺苷冻干制剂及其制备方法,用包合剂对环磷腺苷进行包合,可有效提高制 成的环磷腺苷冻干制剂的溶解性及稳定性,保证了药品的疗效及用药安全性。
6.为了实现上述目的,本发明采用以下技术方案:一种注射用环磷腺苷冻干制剂,由环磷腺苷包合物溶液冻干后制得,以重量份计,所述环磷 腺苷包合物溶液的组分包括:环磷腺苷
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
20~40份;包合剂
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
30~60份;
水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1000~2000份。
7.本发明利用包合剂对环磷腺苷进行包合,制成环磷腺苷包合物,可有效提高环磷腺苷 在水中的溶解性,防止环磷腺苷在冻干前析出结晶导致冷冻干燥后难以重新溶解,同时也提 高了冻干制剂在重新溶解时的溶解性,避免出现挂壁现象,保证了输注后的安全性;并且, 包合剂可以对环磷腺苷进行保护,避免环磷腺苷在外界环境的影响下药物结构发生变化,提 高了药品的稳定性。
8.作为优选,所述包合剂的制备方法为:将羟丙基-β-环糊精加入氢氧化钠和羧甲基纤 维素钠的混合溶液中;搅拌均匀后加入环氧氯丙烷,85~95℃下搅拌反应30~40min;然后再 加入甘氨酸和环氧氯丙烷,所述羟丙基-β-环糊精、羧甲基纤维素钠和甘氨酸的添加质量之 比为4~6:0.5~1:1;继续保温搅拌反应2~3h,调节体系ph至中性,加入dmf沉淀,过滤后 将产物干燥得到所述包合剂。
9.本发明利用羟丙基-β-环糊精对环磷腺苷进行包合,将环磷腺苷包合在其空腔结构内, 以提高环磷腺苷的水溶性;但由于羟丙基-β-环糊精与环磷腺苷之间的范德华力较弱,包合 稳定性不佳,环磷腺苷易从羟丙基-β-环糊精的空腔中脱出,因此仅用羟丙基-β-环糊精作为 包合剂时,对冻干制剂溶解性的提升作用有限。为了提高包合剂对环磷腺苷的包合稳定性, 本发明用羧甲基纤维素钠对羟丙基-β-环糊精进行改性,通过环氧氯丙烷的交联作用将羧甲 基纤维素钠与羟丙基-β-环糊精连接,增大了包合剂的空间位阻,可以使包合后的环磷腺苷 不易从羟丙基-β-环糊精的空腔中脱出,提高了环磷腺苷的包合稳定性,从而提高了冻干制 剂的溶解性及稳定性。但用羧甲基纤维素钠对羟丙基-β-环糊精改性后由于位阻增大、溶液 粘度较高,同样也会不利于环磷腺苷的包合,因此本发明又加入了甘氨酸,与羧甲基纤维素 钠共同对羟丙基-β-环糊精进行改性,通过控制羧甲基纤维素钠与甘氨酸的用量,可以有效 提高包合剂对环磷腺苷的包合作用及其包合稳定性,从而使环磷腺苷冻干制剂可以有效复溶。
10.作为优选,所述氢氧化钠和羧甲基纤维素钠的混合溶液中,氢氧化钠的质量分数为 3~5%,氢氧化钠与羧甲基纤维素钠的质量比为0.1~0.2:1。
11.作为优选,第一次加入的环氧氯丙烷与羟丙基-β-环糊精的质量比为1:5~6;第二次加 入的环氧氯丙烷与羟丙基-β-环糊精的质量比为1:4~6。
12.作为优选,所述环磷腺苷包合物溶液的ph为5.2~6.2。
13.本发明还提供了一种上述注射用环磷腺苷冻干制剂的制备方法,包括如下步骤:(1)配液:将包合剂溶于96~98℃的水中,搅拌均匀后加入环磷腺苷,保温搅拌至澄清后得 到环磷腺苷包合物溶液;(2)除热源:向环磷腺苷包合物溶液中加入活性炭,搅拌10~20min后静置30~40min;(3)粗滤去除活性炭;(4)除菌过滤;(5)灌装;(6)冷冻干燥。
14.作为优选,步骤(3)中粗滤时采用0.22和/或0.45μm的聚醚砜滤芯。
15.作为优选,步骤(4)中除菌过滤时采用0.2μm聚醚砜滤膜。
16.作为优选,步骤(1)~(4)在4h内完成,步骤(5)在10h内完成。
17.作为优选,步骤(6)中的冷冻干燥步骤为:a)预冻:在≤-40℃下预冻3~7h;b)升华干燥:-5℃保温2~3h;升温至0℃保温4~6h;再升温至5℃保温3~10h;最后升温至 10℃保温1~2h;c)再干燥:在1~2h内从10℃升温至35℃,然后在35℃恒温3~4h。
18.本发明通过预冻、升华干燥和再干燥三步对环磷腺苷包合物溶液进行冷冻干燥。采用 适当的参数进行预冻,可以将溶液中的自由水固化,赋予干后产品与干燥前相同的形态,防 止抽空干燥时起泡、浓缩和溶质移动等不可逆变化发生。升华干燥是冻干的关键阶段,大部 分的水在这一阶段被升华,若控制不好,会直接影响产品的外观质量和冻干时间,并影响产 品的溶解性。预冻及升华干燥条件与包合剂的种类及用量有关,本发明根据所使用的包合剂, 选择恰当的预冻和升华干燥方法,使得制备出的环磷腺苷冻干制剂具有良好的溶解性,且重 新溶解后不易析出,方便了产品的使用,提高了产品的使用安全性。升华干燥后的产品内还 存在一部分水分吸附在干燥物质的毛细管壁和极性基团上未被冻结,从而为微生物的生长繁 殖及某些化学反应提供条件,从而降低产品的贮存稳定性和保质期。因此本发明在升华干燥 后再进行再干燥,进一步去除残余水分,提高产品的保质期。
19.因此,本发明具有如下有益效果:(1)用包合剂对环磷腺苷进行包合,有效提高了制成的环磷腺苷冻干制剂的溶解性及稳定性, 保证了药品的疗效及用药安全性;(2)用羧甲基纤维素钠及甘氨酸改性的羟丙基-β-环糊精作为包合剂,可以有效提高包合剂 对环磷腺苷的包合作用及其包合稳定性,从而使环磷腺苷冻干制剂可以有效复溶;(3)根据包合剂种类采用恰当的预冻、升华干燥和再干燥方法,使得制备出的注射用棓丙酯 产品具有较长的保质期和良好的溶解性,且重新溶解后不易析出,方便了产品的使用,提高 了产品的使用安全性。
具体实施方式
20.下面结合具体实施方式对本发明做进一步的描述。
21.在本发明中,若非特指,所有设备和原料均可从市场购得或是本行业常用的,所有方 法如无特别说明,均为本领域常规方法。
22.实施例1:一种注射用环磷腺苷冻干制剂,由ph为5.2~6.2的环磷腺苷包合物溶液冻干后制得,以重量 份计,环磷腺苷包合物溶液的组分包括:环磷腺苷20g,包合剂30g,注射用水1000g。
23.其中,包合剂的制备方法为:将羟丙基-β-环糊精加入氢氧化钠和羧甲基纤维素钠的 混合溶液中,混合溶液中氢氧化钠的质量分数为4%,氢氧化钠与羧甲基纤维素钠的质量比为 0.15:1;搅拌均匀后加入与羟丙基-β-环糊精的质量比为1:5.5的环氧氯丙烷,90℃下搅拌反 应35min;然后再加入甘氨酸和与羟丙基-β-环糊精的质量比为1:5的环氧氯丙烷,所述羟丙 基-β-环糊精、羧甲基纤维素钠和甘氨酸的添加质量之比为5:0.8:1;继续保
温搅拌反应2.5h,调节体系ph至中性,加入dmf沉淀,过滤后将产物干燥得到所述包合剂。
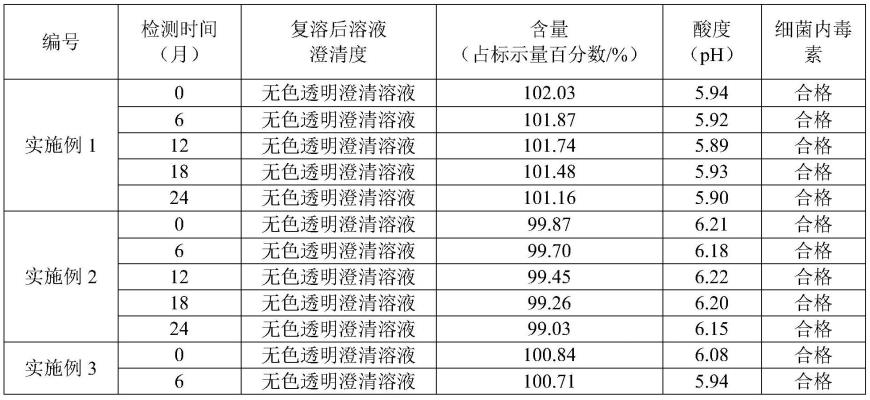
24.上述注射用环磷腺苷冻干制剂的制备方法为:(1)配液:将包合剂溶于97℃的注射用水中,搅拌均匀后加入环磷腺苷,保温搅拌至澄清后得到环磷腺苷包合物溶液,取样测量ph值应为5.2~6.2,若不在工艺范围内则用1.0mol/lnaoh或1.0mol/lhcl进行调整;(2)除热源:向环磷腺苷包合物溶液中加入活性炭,搅拌15min后静置35min;取样检测ph值应为5.2~6.2,若不在工艺范围内则用1.0mol/lhcl或1.0mol/lnaoh溶液进行调整;(3)粗滤去除活性炭:依次用0.45μm和0.22μm的聚醚砜10英寸滤芯(圆筒过滤器)对环磷腺苷包合物溶液进行过滤;(4)除菌过滤:用0.2μm聚醚砜滤膜过滤器对粗滤后的溶液再进行过滤;(5)立即灌装、半加塞;(6)冷冻干燥:a)预冻:将冻干机内搁板温度设置在-40℃,预冻3h;b)升华干燥:将板层温度设定在-5℃,保温2h;升温至0℃保温4h;再升温至5℃保温3h;最后升温至10℃保温1h;c)再干燥:在1h内从10℃升温至35℃,然后在35℃恒温3h;(7)轧盖、目检、外包装后入待检库,灯检后入成品库。
25.实施例2:一种注射用环磷腺苷冻干制剂,由ph为5.2~6.2的环磷腺苷包合物溶液冻干后制得,以重量份计,环磷腺苷包合物溶液的组分包括:环磷腺苷30g,包合剂45g,注射用水1500g。
26.其中,包合剂的制备方法为:将羟丙基-β-环糊精加入氢氧化钠和羧甲基纤维素钠的混合溶液中,混合溶液中氢氧化钠的质量分数为3%,氢氧化钠与羧甲基纤维素钠的质量比为0.1:1;搅拌均匀后加入与羟丙基-β-环糊精的质量比为1:5的环氧氯丙烷,85℃下搅拌反应40min;然后再加入甘氨酸和与羟丙基-β-环糊精的质量比为1:6的环氧氯丙烷,所述羟丙基-β-环糊精、羧甲基纤维素钠和甘氨酸的添加质量之比为4:0.5:1;继续保温搅拌反应2h,调节体系ph至中性,加入dmf沉淀,过滤后将产物干燥得到所述包合剂。
27.上述注射用环磷腺苷冻干制剂的制备方法为:(1)配液:将包合剂溶于96℃的注射用水中,搅拌均匀后加入环磷腺苷,保温搅拌至澄清后得到环磷腺苷包合物溶液,取样测量ph值应为5.2~6.2,若不在工艺范围内则用1.0mol/lnaoh或1.0mol/lhcl进行调整;(2)除热源:向环磷腺苷包合物溶液中加入活性炭,搅拌10min后静置40min;取样检测ph值应为5.2~6.2,若不在工艺范围内则用1.0mol/lhcl或1.0mol/lnaoh溶液进行调整;(3)粗滤去除活性炭:依次用0.45μm和0.22μm的聚醚砜10英寸滤芯(圆筒过滤器)对环磷腺苷包合物溶液进行过滤;(4)除菌过滤:用0.2μm聚醚砜滤膜过滤器对粗滤后的溶液再进行过滤;(5)立即灌装、半加塞;
(6)冷冻干燥:a)预冻:将冻干机内搁板温度设置在-40℃,预冻6h;b)升华干燥:将板层温度设定在-5℃,保温2.5h;升温至0℃保温5h;再升温至5℃保温4h;最后升温至10℃保温1.5h;c)再干燥:在1.5h内从10℃升温至35℃,然后在35℃恒温3.5h;(7)轧盖、目检、外包装后入待检库,灯检后入成品库。
28.实施例3:一种注射用环磷腺苷冻干制剂,由ph为5.2~6.2的环磷腺苷包合物溶液冻干后制得,以重量份计,环磷腺苷包合物溶液的组分包括:环磷腺苷40g,包合剂60g,注射用水2000g。
29.其中,包合剂的制备方法为:将羟丙基-β-环糊精加入氢氧化钠和羧甲基纤维素钠的混合溶液中,混合溶液中氢氧化钠的质量分数为5%,氢氧化钠与羧甲基纤维素钠的质量比为0.2:1;搅拌均匀后加入与羟丙基-β-环糊精的质量比为1:6的环氧氯丙烷,95℃下搅拌反应30min;然后再加入甘氨酸和与羟丙基-β-环糊精的质量比为1:4的环氧氯丙烷,所述羟丙基-β-环糊精、羧甲基纤维素钠和甘氨酸的添加质量之比为6:1:1;继续保温搅拌反应3h,调节体系ph至中性,加入dmf沉淀,过滤后将产物干燥得到所述包合剂。
30.上述注射用环磷腺苷冻干制剂的制备方法为:(1)配液:将包合剂溶于98℃的注射用水中,搅拌均匀后加入环磷腺苷,保温搅拌至澄清后得到环磷腺苷包合物溶液,取样测量ph值应为5.2~6.2,若不在工艺范围内则用1.0mol/lnaoh或1.0mol/lhcl进行调整;(2)除热源:向环磷腺苷包合物溶液中加入活性炭,搅拌20min后静置30min;取样检测ph值应为5.2~6.2,若不在工艺范围内则用1.0mol/lhcl或1.0mol/lnaoh溶液进行调整;(3)粗滤去除活性炭:依次用0.45μm和0.22μm的聚醚砜10英寸滤芯(圆筒过滤器)对环磷腺苷包合物溶液进行过滤;(4)除菌过滤:用0.2μm聚醚砜滤膜过滤器对粗滤后的溶液再进行过滤;(5)立即灌装、半加塞;(6)冷冻干燥:a)预冻:将冻干机内搁板温度设置在-40℃,预冻7h;b)升华干燥:将板层温度设定在-5℃,保温3h;升温至0℃保温6h;再升温至5℃保温10h;最后升温至10℃保温2h;c)再干燥:在2h内从10℃升温至35℃,然后在35℃恒温4h;(7)轧盖、目检、外包装后入待检库,灯检后入成品库。
31.对比例1(采用羟丙基-β-环糊精作为包合剂):对比例1中的环磷腺苷包合物溶液中,包合剂采用羟丙基-β-环糊精,其余均与实施例1中相同。
32.对比例2(采用羧甲基纤维素钠改性的羟丙基-β-环糊精作为包合剂):对比例2中的包合剂的制备方法为:将羟丙基-β-环糊精加入氢氧化钠和羧甲基纤维素钠的混合溶液中,混合溶液中氢氧化钠的质量分数为4%,氢氧化钠与羧甲基纤维素
钠的质量比为 0.15:1,加入的羟丙基-β-环糊精和羧甲基纤维素钠质量之比为5:0.8;搅拌均匀后加入与羟丙 基-β-环糊精的质量比为1:5.5的环氧氯丙烷,90℃下搅拌反应3h,调节体系ph至中性,加 入dmf沉淀,过滤后将产物干燥得到所述包合剂。其余均与实施例1中相同。
33.对比例3(采用甘氨酸改性的羟丙基-β-环糊精作为包合剂):对比例3中的包合剂的制备方法为:将羟丙基-β-环糊精加入氢氧化钠和甘氨酸的混合溶液 中,混合溶液中氢氧化钠的质量分数为4%,氢氧化钠与甘氨酸的质量比为0.15:1;加入的羟 丙基-β-环糊精和甘氨酸的质量比为5:1;搅拌均匀后加入与羟丙基-β-环糊精的质量比为 1:5.5的环氧氯丙烷,90℃下搅拌反应3h,调节体系ph至中性,加入dmf沉淀,过滤后将 产物干燥得到所述包合剂。其余均与实施例1中相同。
34.对比例4(羧甲基纤维素钠和甘氨酸同时与羟丙基-β-环糊精反应):对比例4中的包合剂的制备方法为:将羟丙基-β-环糊精加入氢氧化钠和羧甲基纤维素钠的 混合溶液中,混合溶液中氢氧化钠的质量分数为4%,氢氧化钠与羧甲基纤维素钠的质量比为 0.15:1;搅拌均匀后加入甘氨酸和与羟丙基-β-环糊精的质量比为2:5的环氧氯丙烷,所述羟 丙基-β-环糊精、羧甲基纤维素钠和甘氨酸的添加质量之比为5:0.8:1;90℃下搅拌反应3h, 调节体系ph至中性,加入dmf沉淀,过滤后将产物干燥得到所述包合剂。其余均与实施例 1中相同。
35.对上述实施例和对比例中制得的注射用棓丙酯在25℃下保藏并进行性能测试,其中, 复溶后溶液澄清度测试时,将40mg冻干制剂溶于250ml注射用水中,其余各参数的测试参 照《中国药典》2020年版二部中的方法,结果如表1所示。
36.表1:环磷腺苷冻干制剂性能测试结果。
37.从表1中可以看出,实施例1~3中采用本发明中的配方和方法制得的环磷腺苷冻干制 剂两年内稳定性良好,且具有良好的复溶性能,复溶后无晶体析出。而对比例1中采用未经 改性的羟丙基-β-环糊精作为包合剂,包合稳定性不佳,部分环磷腺苷易在后续过滤、冻干 过程中从包合剂中脱出,导致冻干制剂的存放稳定性及复溶性能与实施例1中相比有所下降。 对比例2中使用的包合剂中,仅用羧甲基纤维素钠对羟丙基-β-环糊精改性,冻干制剂的存 放稳定剂及复溶性能同样有所降低,可能是由于羧甲基纤维素钠对羟丙基-β-环糊精改性后 包合剂位阻增大、溶液粘度较高,不利于环磷腺苷的包合,部分环磷腺苷无法进入β-环糊精 的空腔内。对比例3的包合剂中仅用甘氨酸对羟丙基-β-环糊精进行改性,不足以阻止环磷 腺苷从β-环糊精的空腔内脱出,冻干制剂的稳定性及复溶性也有所下降。对比例4中的包合 剂制备时,将羧甲基纤维素钠和甘氨酸同时与羟丙基-β-环糊精进行反应,会导致羧甲基纤 维素钠与羟丙基-β-环糊精的接枝率降低,也会影响冻干制剂的稳定性及复溶性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1