用于药物递送的自组装丝素/聚乳酸类嵌段共聚物的制备方法及其应用
1.本发明属于高分子材料的加工方法,具体涉及一种用于药物递送的自组装丝素/聚乳酸类嵌段共聚物的制备方法及其应用。
背景技术:
2.丝素蛋白(sf)来源于自然界中的节肢动物纺成的蛋白质纤维,具有环保、低成本、无毒、可再生、可降解性和生物相容性以及最小的炎症反应等优点,是生产可持续材料的最好选择之一,特别适合在生物技术和生物医用领域的应用。然而,单一组分的丝素蛋白膜分子构象主要为不稳定的无定形结构,导致其在在干燥状态下易脆,不适合实际应用。同样,来源于谷物的聚乳酸(pla)也是一种无毒、无刺激性、可生物降解的脂肪族聚酯,具有良好生物相容性和可生物降解性,它被认为是减少环境和生态问题的一种很有前途的材料。但由于它的疏水性和缺乏能特异性增强细胞粘附和活性的表面基团,抑制了其在生物医学领域的广泛应用。
3.最近许多研究表明,基于丝素蛋白(sf)和合成聚合物(pla)的共混材料具有研究前景。共混材料可以有效克服单一组分材料的缺点,同时,发挥单组分材料的各自优势,获得理想的复合材料。因此,丝素和聚乳酸已被用来制备能够在机械和生物方面提供良好性能的生物复合材料。然而,丝素蛋白由分子间和分子内氢键组成,内部结晶结构的耐溶剂性导致其难溶于一般溶剂。目前,一般采用强酸、强碱、高浓度的盐溶液如libr
‑
h2o溶液、cacl2‑
c2h5oh
‑
h2o溶液、cacl2‑
fa溶液等对丝素蛋白溶解,这些溶剂存在毒性大、挥发性强、不易回收和容易破坏蛋白结构等缺陷,容易导致原生材料的各种力学和生物学性质下降。
技术实现要素:
4.发明目的:针对现有技术存在的问题,本发明提供一种采用全新的绿色离子液体二元溶剂体系制备混合良好的自组装丝素/聚乳酸类嵌段共聚物的方法,解决了现有技术中使用的溶剂大多存在毒性强、挥发性强、不易回收等缺陷,避免对环境造成严重污染,同时,在这一溶剂体系下能获得具有独特的类似于嵌段结构的生物复合材料。
5.本发明还提供所制备的制备出了一种具有独特的类似于嵌段结构的用于药物递送的自组装丝素/聚乳酸类嵌段共聚物以及这种类嵌段共聚物材料在药物包合和递送等中的应用。
6.技术方案:为了实现是上述目的,本发明提供一种用于药物递送的自组装丝素/聚乳酸类嵌段共聚物的制备方法,包括以下步骤:
7.(1)将脱胶处理后的丝素纤维加入离子液体中,加热溶解,得到丝素蛋白溶液;
8.(2)将聚乳酸加入n
‑
n二甲基甲酰胺中溶解,得到聚乳酸溶液;
9.(3)将丝素蛋白溶液与聚乳酸溶液在冷凝回流的条件下混合搅拌,得到均匀的丝素/聚乳酸溶液;
10.(4)将丝素/聚乳酸溶液冷冻干燥,目的是使溶液固化,然后浸入乙醇中凝固形成复合膜,用去离子水连续冲洗去除表面残留的离子液体,真空干燥,得到丝素/聚乳酸类嵌段共聚物复合材料。
11.进一步的,所述步骤(1)中,丝素纤维与离子液体的质量比为1:11.5~1:19,优选质量比为1:11.5;其中,所述离子液体包括1
‑
丁基
‑3‑
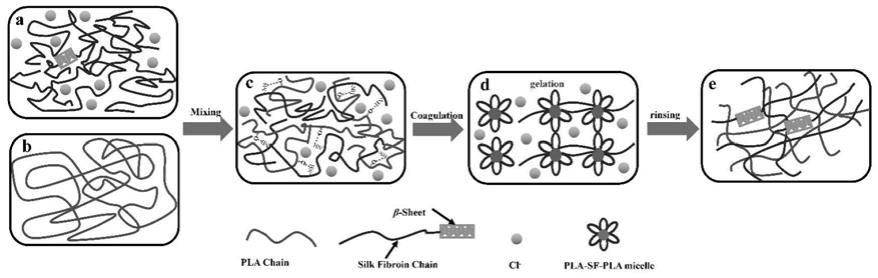
甲基咪唑氯盐,1
‑
烯丙基
‑3‑
甲基咪唑氯盐、1
‑
乙基
‑3‑
甲基咪唑氯盐、1
‑
丁基
‑3‑
甲基咪唑醋酸盐和1
‑
丁基
‑3‑
甲基咪唑溴盐中的任意一种。
12.进一步的,所述步骤(1)中,恒温条件的温度为95~100℃,加热时间为24~36h。
13.进一步的,步骤(2)中的聚乳酸与步骤(1)中的丝素纤维的质量比为1:5~5:1;其中,聚乳酸溶液中聚乳酸的质量浓度为5.0wt.%。
14.进一步的,所述步骤(3)中,冷凝回流的温度为90~95℃,混合搅拌时间为6
‑
8h,搅拌的转速为10~20r/s。
15.进一步的,所述步骤(4)中,冷冻干燥的时间为24~48h,冷冻温度为
‑
45~
‑
50℃;浸入乙醇凝固的时间为5~7h,真空干燥温度为20~25℃,干燥时间为12~24h
16.进一步的,所述步骤(1)中,脱胶处理具体是指:将桑蚕茧放入煮沸的碳酸氢钠水溶液中去除丝胶及少量油脂、蜡质、毛发、草屑等杂物。采用脱胶处理的目的在于得到更利于人体吸收的丝素蛋白,有利于丝纤维的后续工艺加工;优选的,碳酸氢钠水溶液的浓度为0.21wt.%;脱胶时间为30~50min。
17.本发明所述方法制备的得到具有独特的类似于嵌段结构的用于药物递送的自组装丝素/聚乳酸类嵌段共聚物。
18.本发明所述的用于药物递送的自组装丝素/聚乳酸类嵌段共聚物在药物包合和递送系统、组织工程或伤口敷料中的应用。
19.本发明的制备方法中,采用特定的离子液体和n,n
‑
二甲基甲酰胺(dmf)的二元溶剂体系,其中离子液体溶解丝素蛋白(sf),关于离子液体溶解丝素蛋白主要是通过离子液体中的卤素、羧酸、醋酸等阴离子通过与丝素蛋白中的羟基发生相互作用,破坏分子间和分子内氢键。同时,阴、阳离子的亲核性、亲电性和电荷极性的协同作用也会加速破坏β
‑
折叠结构间氢键,最终达到溶解其的效果。本发明中将聚乳酸(pla)溶解于n,n
‑
二甲基甲酰胺(dmf)中形成溶液,随后将得到的sf溶液和pla溶液在冷凝回流的条件下进行搅拌混合,在混合过程中,n,n
‑
二甲基甲酰胺(dmf)溶剂一方面可以作为稀释剂降低离子液体的粘度,使整个共混体系具有更好的流动性和可混性;另一方面,离子液体与n
‑
n二甲基甲酰胺产生协同作用,使两种聚合物之间发生的氢键、静电以及疏水
‑
疏水相互作用会加速sf/pla共混溶液的形成。共混物的最终性能一般取决于聚合物之间的混溶性,在本发明中采用离子液体和n,n
‑
二甲基甲酰胺(dmf)可以得到特定的sf/pla共混溶液,离子液体与n
‑
n二甲基甲酰胺产生协同作用,促进共混体系两组分之间的混溶性,得到没有分层现象的sf/pla共混溶液。在回流加热和冷冻干燥处理中,可结晶区域和不结晶区域之间会发生微相分离。进一步地,将混合均匀的sf/pla溶液通过冷冻干燥和乙醇处理形成凝固完全的薄膜。而这个处理过程中,体系冷冻干燥的作用是形成丝素和聚乳酸的共混溶液以后,将溶液冷冻干燥成固态,再加入乙醇,避免直接加乙醇,溶液和乙醇发生互溶现象,保证整个共混溶液完全凝固成膜。而加入乙醇诱导β
‑
折叠结构的形成的同时移除共混膜中的阴阳离子(离子液体是由阴离子
和阳离子组成的溶剂)。同时,分子链的疏水效应和分子的自组装能力增强了。因此,在它们缺失的情况下聚合物链就会发生聚集。此时,乙醇会迅速取代聚合物链段上或周围的阴离子,与聚合物链段作用形成氢键。最终导致丝素与聚乳酸共混获得的复合材料呈现出物理交联的类似于嵌段式的结构。此外,将离子液体溶解于乙醇中,可以进行回收再利用。
20.本发明形成类似于嵌段式的结构是因为发生了相分离,乙醇的加入,使分子链的疏水效应和分子的自组装能力增强了。同时,sf与pla相互作用,可以形成物理交联以帮助促进嵌段共聚物结构的形成。乙醇目的一方面诱导膜中β
‑
折叠结构的形成,一方面是去除离子液体,还有一个最重要的作用就是使溶液凝固成膜,离子液体溶解到乙醇中以后,膜周围和内部均不存离子液体,此时,乙醇会迅速取代聚合物链段上或周围的阴离子,与聚合物链段作用形成氢键。因此,乙醇分子与不同聚合物之间存在一种形成氢键的竞争,同时,sf与pla之间的物理交联最终形成了类似于嵌段式的结构。
21.本发明中通过离子液体和n
‑
n二甲基甲酰胺作用让丝素和聚乳酸混合在一起形成宏观均匀的溶液,进一步加热和冷冻干燥,可结晶区域和不结晶区域之间会发生微相分离。通过乙醇处理和去离子水洗涤,复合膜中的阴离子被去除并形成强氢键诱导位于其相分离域内的β
‑
折叠晶体的形成。同时,分子链的疏水效应和分子的自组装能力增强了。此外,sf与pla相互作用,可以形成物理交联以帮助促进嵌段共聚物结构的形成。
22.本发明所述的制备方法所采用的离子液体/n,n
‑
二甲基甲酰胺(dmf)二元溶剂体系制备丝素/聚乳酸共混物是一种全新的方法。
23.本发明所述的制备方法在离子液体/n,n
‑
二甲基甲酰胺(dmf)二元溶剂体系下对丝素和聚乳酸共混,才会形成具有独特的类似于嵌段结构的自组装丝素/聚乳酸类嵌段共聚物。本发明所述的自组装丝素/聚乳酸类嵌段共聚物,采用绿色溶剂离子液体和n,n
‑
二甲基甲酰胺(dmf)二元溶剂体系,将天然丝素蛋白与合成聚合物聚乳酸按一定比例复合,改善了聚乳酸材料的疏水性与细胞亲和性及再生丝素蛋白力学性能,通过改变丝素和聚乳酸的质量比,可以得到具有不同形貌、结构、物理性能的丝素/聚乳酸材料。
24.本发明所述的自组装丝素/聚乳酸类嵌段共聚物,由于嵌段共聚物其化学结构上不同嵌段相互作用和亲疏水性程度不同,在水溶液中会发生微相分离自组装形成球状胶束。在此过程中,疏水药物可以通过疏水相互作用、静电相互作用、金属离子络合及氧键等非共价相互作用自动结合到胶束疏水核中;同时,在亲水性链段的保护下,避免了人体内生物酶及其他人体内环境(血浆)与药物的作用,延长药物在体内的循环实践,并且能够使药物在病变部位缓慢地进行释放。说明本发明中的材料在药物包合和递送系统中存在重要的潜力。
25.本发明提出了一种自组装蛋白质
‑
合成聚合物材料的方法,其整体机制如图1所示。第一步是溶解丝素蛋白,离子液体bmimcl的作用是削弱丝素蛋白分子间和分子内β
‑
折叠中的氢键网络,改变了它们的二级构象。一般地,丝素分子在溶液中主要为无规线团和α
‑
螺旋结构,但这种结构又可以通过溶剂、热处理或物理剪切等方法转换为β
‑
折叠结构。本发明中,丝素蛋白溶解在离子液体中,形成了无定形结构链和部分晶体结构(图1a)。随后,与非晶结构的pla进行共混(图1b),本发明首次提出离子液体与n
‑
n二甲基甲酰胺二元溶剂体系可以获得宏观均相的sf/pla共混溶液(图1c)。但可结晶区域和不结晶区域之间存在微相分离。而聚合共混物各组分间的混溶性(相容性)很大程度上依赖于分子间的相互作用。本
发明中丝素和聚乳酸存在有氢键、静电以及疏水
‑
疏水相互作用,氢键以及静电作用主要来源于焓驱动,而疏水
‑
疏水相互作用是由熵驱动,但相分离特性(例如,在dsc中两个玻璃化转变)从热力学上显示出来。由于聚合物链之间的强相互作用将克服微相分离的影响,并在宏观尺度上保持热力学混溶体系。在这种情况下,在宏观尺度上仍然可以显示均匀的形态,并且可以提供很好的均匀性质(见图2的sem结果)。本发明的结果表明,sf和pla在混合物中建立一些相互作用,这导致与纯聚合物相比改善了物理以及生物性能。进一步地,通过乙醇处理形成凝胶薄膜。而这个处理过程中,乙醇诱导β
‑
折叠的形成的同时移除共混膜中的阴阳离子,同时,增强了分子链的疏水效应和分子的自组装能力。因此,在它们缺失的情况下聚合物链就会发生聚集。此时,乙醇会迅速取代聚合物链段上或周围的阴离子,与聚合物链段作用形成氢键。因此,乙醇分子与不同聚合物之间存在一种形成氢键的竞争,最终导致形成由疏水区域和亲水区域组成的稳定球形胶束(图1d),正是由于乙醇与阴阳离子之间的交换作用,以及sf与pla之间的物理交联作用,诱导最终形成这种类似于嵌段蛋白质
‑
合成聚合物结构(图1e)。本发明图8的sem图也证实了制备出的sf/pla共混膜具有类似于嵌段的结构。这种类嵌段共聚物可以通过疏水相互作用、静电相互作用、金属离子络合及氧键等非共价相互作用将药物连接到不溶链段或包埋于共聚物胶束的疏水核中,在亲水性链段的保护下,避免了人体内生物酶及其他人体内环境(血浆)与药物的作用,延长药物在体内的循环实践,并且能够使药物在病变部位缓慢地进行释放。其在药物包合和递送系统中具有重要的作用。
26.有益效果:与现有技术相比,本发明的具有如下显著优点:
27.(1)本发明采用环境友好型离子液体和n,n
‑
二甲基甲酰胺二元溶剂体系,克服了传统溶剂毒性强、挥发性强、不易回收等缺陷,实现了环境友好型的绿色制备工艺;
28.(2)本发明制备过程操作简便、无有害气体排放,可以通过改变丝素与聚乳酸的共混比例,调控丝素/聚乳酸复合材料的形貌、微尺寸结构、二级结构以及物理和生物性能(亲疏水性能)等,以满足对材料不同性能的需求,不同的微尺度结构可能提供有利于细胞附着、生长以及增殖的表面性质;
29.(3)本发明在丝素和聚乳酸混合成溶液后,利用乙醇作为凝固剂,使混合溶液凝固形成水凝胶,同时将离子液体溶解于乙醇中,可以进行回收再利用,符合节能环保的理念;
30.(4)本发明采用特定的离子液体/n,n
‑
二甲基甲酰胺(dmf)二元溶剂可得到具有独特的类似于嵌段结构的自组装丝素/聚乳酸类嵌段共聚物。
31.(5)本发明得到的具有独特的类似于嵌段结构的自组装丝素/聚乳酸类嵌段共聚物,其在药物包合和递送系统中能发挥重要的作用。
附图说明
32.图1为本发明制备过程机制示意图,包括溶解和再生过程,其中a.sf溶解于离子液体中形成无定形结构链和部分残余的晶体结构;b.pla溶解于dmf中形成无定形结构链;c.sf和pla在氢键、疏水
‑
疏水、静电相互作用下的共混过程;d.在乙醇的作用下,共混物内部自组装形成胶束结构;e.形成具有类似于嵌段结构的sf/pla共混材料;
33.图2为实施例中不同质量比的sf/pla类嵌段共聚物的sem图像;
34.图3为实施例中采用tmdsc模式在加热速率2℃/min下测得的不同质量比的sf/pla
类嵌段共聚物的可逆热容曲线;
35.图4为不同质量比的sf/pla类嵌段共聚物在加热速率10℃/min下从室温加热到550℃的tg曲线;
36.图5为不同质量比的sf/pla类嵌段共聚物在加热速率10℃/min下从室温加热到550℃的dtg曲线;
37.图6为不同质量比sf/pla类嵌段共聚物的水接触角;
38.图7为采用mtt法分别测定小鼠成纤细胞在不同质量比的sf/pla类嵌段共聚物上培养6、24和48h的存活率;
39.图8为不同质量比例下制备的sf/pla类嵌段共聚物上酶降解24h后的典型sem形貌。
具体实施方式
40.下面结合附图和实施例对本发明的技术方案做进一步详细说明。
41.以下实施例中所用的原料均为以下要求:
42.所使用的桑蚕茧购自丹东七月贸易有限公司;聚乳酸为外消旋聚乳酸,分子量为10000;1
‑
丁基
‑3‑
甲基咪唑氯盐(cas:79917
‑
90
‑
1)等离子液体购自上海成捷化学有限公司;n
‑
n二甲基甲酰胺购自国药集团化学试剂有限公司;其余各溶剂为分析纯。
43.实施例1
44.(1)将5.00g剪碎的桑蚕茧放入煮沸的2000ml浓度为0.21wt.%的碳酸氢钠水溶液中处理30min,去除蚕茧中的丝胶,然后用去离子水充分洗涤三次,放在通风处干燥得到脱胶后的丝素纤维。
45.(2)将11.5g离子液体1
‑
丁基
‑3‑
甲基咪唑氯盐加入规格50ml离心管中,加热融化后,将1g脱胶丝素纤维剪碎,分多次加入离子液体中,在100℃的恒温水浴锅中加热溶解36h,得到8wt.%清澈的琥珀色丝素蛋白溶液。
46.(3)根据脱胶丝素纤维与聚乳酸的质量比为1:5,则称取5g外消旋聚乳酸,分子量为1万,溶于n
‑
n二甲基甲酰胺中,室温机械震荡5min,配置成浓度为5wt.%的聚乳酸溶液。将配制好的丝素蛋白溶液和聚乳酸溶液全部倒入250ml的圆底烧瓶中,在冷凝回流的条件下,加热温度为95℃,磁力搅拌混合7h,转速为20r/s,得到混合均匀的丝素/聚乳酸溶液。
47.(4)将丝素/聚乳酸混合溶液浇铸在玻璃培养皿中,在真空冷冻干燥箱中冷冻干燥48h,冷冻温度为
‑
45℃,得到类固态的丝素/聚乳酸复合材料,在乙醇中浸泡6h,达到完全凝固,用去离子水连续冲洗2
‑
3次去除表面残留的离子液体,真空干燥温度控制在25℃,干燥时间为12h,得到自组装丝素/聚乳酸类嵌段共聚物复合膜材料。
48.实施例2
49.(1)将5.00g剪碎的桑蚕茧放入煮沸的2000ml浓度为0.21wt.%的碳酸氢钠水溶液中处理30min,去除蚕茧中的丝胶,然后用去离子水充分洗涤三次,放在通风处干燥得到脱胶后的丝素纤维。
50.(2)将11.5g离子液体1
‑
丁基
‑3‑
甲基咪唑氯盐加入规格50ml离心管中,加热融化后,将1g脱胶丝素纤维剪碎,分多次加入离子液体中,在100℃的恒温水浴锅中加热溶解36h,得到8wt.%清澈的琥珀色丝素蛋白溶液。
51.(3)根据丝素纤维与聚乳酸的质量比为5:5,则称取1g外消旋聚乳酸,分子量为1万,溶于n
‑
n二甲基甲酰胺中,室温机械震荡5min,配置成浓度为5wt.%的聚乳酸溶液。将配制好的丝素蛋白溶液和聚乳酸溶液全部倒入250ml的圆底烧瓶中,在冷凝回流的条件下,加热温度为95℃,磁力搅拌混合7h,转速为20r/s,得到混合均匀的丝素/聚乳酸溶液。
52.(4)将丝素/聚乳酸混合溶液浇铸在玻璃培养皿中,在真空冷冻干燥箱中冷冻干燥48h,冷冻温度为
‑
45℃,得到类固态的丝素/聚乳酸复合材料,在乙醇中浸泡6h,达到完全凝固,用去离子水连续冲洗2
‑
3次去除表面残留的离子液体,真空干燥温度控制在25℃,干燥时间为12h,得到自组装丝素/聚乳酸类嵌段共聚物复合膜材料。
53.实施例3
54.(1)将5.00g剪碎的桑蚕茧放入煮沸的2000ml浓度为0.21wt.%的碳酸氢钠水溶液中处理30min,去除蚕茧中的丝胶,然后用去离子水充分洗涤三次,放在通风处干燥得到脱胶后的丝素纤维。
55.(2)将11.5g离子液体1
‑
丁基
‑3‑
甲基咪唑氯盐加入规格50ml离心管中,加热融化后,将1g脱胶丝素纤维剪碎,分多次加入离子液体中,在100℃的恒温水浴锅中加热溶解36h,得到8wt.%清澈的琥珀色丝素蛋白溶液。
56.(3)根据丝素纤维与聚乳酸的质量比为5:1,则称取0.2g外消旋聚乳酸,分子量为1万,溶于n
‑
n二甲基甲酰胺中,室温机械震荡5min,配置成浓度为5wt.%的聚乳酸溶液。将配制好的丝素蛋白溶液和聚乳酸溶液全部倒入250ml的圆底烧瓶中,在冷凝回流的条件下,加热温度为95℃,磁力搅拌混合7h。转速为20r/s,得到混合均匀的丝素/聚乳酸溶液。
57.(4)将丝素/聚乳酸混合溶液浇铸在玻璃培养皿中,在真空冷冻干燥箱中冷冻干燥48h,冷冻温度为
‑
45℃,得到类固态的丝素/聚乳酸复合材料,在乙醇中浸泡6h,达到完全凝固,用去离子水连续冲洗2
‑
3次去除表面残留的离子液体,真空干燥温度控制在25℃,干燥时间为12h,得到自组装丝素/聚乳酸类嵌段共聚物复合膜材料。
58.实施例4
59.实施例4与实施例1制备方法相同,不同之处在于:步骤(1)脱胶时间为50min。
60.步骤(2)中丝素纤维与离子液体的质量比为1:19;离子液体为1
‑
烯丙基
‑3‑
甲基咪唑氯盐;加热溶解为95℃,加热时间为36h。
61.步骤(4)中冷凝回流的温度为95℃,混合搅拌时间为6h,搅拌的转速为20r/s。冷冻干燥的时间为48h,冷冻温度为
‑
45℃;浸入乙醇凝固的时间为7h,真空干燥温度为25℃,干燥时间为12h。
62.实施例5
63.实施例5与实施例1制备方法相同,不同之处在于:步骤(2)中丝素纤维与离子液体的质量比为1:15;离子液体为1
‑
乙基
‑3‑
甲基咪唑氯盐;加热溶解为100℃,加热时间为24h。
64.步骤(4)中冷凝回流的温度为90℃,混合搅拌时间为8h,搅拌的转速为10r/s。冷冻干燥的时间为24h,冷冻温度为
‑
50℃;浸入乙醇凝固的时间为7h,真空干燥温度为20℃,干燥时间为24h。
65.对比例1
66.(1)将5.00g剪碎的桑蚕茧放入煮沸的2000ml浓度为0.21wt.%的碳酸氢钠水溶液中处理30min,去除蚕茧中的丝胶,然后用去离子水充分洗涤三次,放在通风处干燥得到脱
胶后的丝素纤维。
67.(2)将11.5g离子液体1
‑
丁基
‑3‑
甲基咪唑氯盐加入规格50ml离心管中,加热融化后,将1g脱胶丝素纤维剪碎,分多次加入离子液体中,在100℃的恒温水浴锅中加热溶解36h,得到8wt.%清澈的琥珀色丝素蛋白溶液。
68.(3)称取5g外消旋聚乳酸,分子量为1万,溶于离子液体1
‑
丁基
‑3‑
甲基咪唑氯盐,配置成浓度为5wt.%的聚乳酸溶液,在100℃的恒温水浴锅中加热溶解36h。最终发现聚乳酸不能溶解于离子液体中。
69.对比例2
70.(1)将5.00g剪碎的桑蚕茧放入煮沸的2000ml浓度为0.21wt.%的碳酸氢钠水溶液中处理30min,去除蚕茧中的丝胶,然后用去离子水充分洗涤三次,放在通风处干燥得到脱胶后的丝素纤维。
71.(2)将11.5g离子液体1
‑
丁基
‑3‑
甲基咪唑氯盐加入规格50ml离心管中,加热融化后,将1g脱胶丝素纤维剪碎,分多次加入离子液体中,在100℃的恒温水浴锅中加热溶解36h,得到8wt.%清澈的琥珀色丝素蛋白溶液。
72.(3)根据丝素纤维与聚乳酸的质量比为1:5,则称取5g外消旋聚乳酸,分子量为1万,溶于二氯甲烷中,室温机械震荡5min,配置成浓度为5wt.%的聚乳酸溶液。将配制好的丝素蛋白溶液和聚乳酸溶液全部一起倒入250ml的圆底烧瓶中,在冷凝回流的条件下,加热温度为95℃,磁力搅拌混合7h。转速为20r/s,会出现分层现象,无法得到混合均匀的丝素/聚乳酸溶液。
73.对比例3
74.(1)将5.00g剪碎的桑蚕茧放入煮沸的2000ml浓度为0.21wt.%的碳酸氢钠水溶液中处理30min,去除蚕茧中的丝胶,然后用去离子水充分洗涤三次,放在通风处干燥得到脱胶后的丝素纤维。
75.(2)以无水氯化钙为溶质,甲酸为溶剂,配置成4.00wt%的氯化钙
‑
甲酸溶液。称取该溶液11.5g,然后称取1g脱胶后的丝素纤维溶解到氯化钙
‑
甲酸溶液,由于氯化钙
‑
甲酸对丝素蛋白的溶解能力很强,这一盐
‑
酸溶解体系在常温条件下就能快速溶解丝素蛋白,所以溶解在常温下进行。
76.(3)根据丝素纤维与聚乳酸的质量比为1:5,称取5g外消旋聚乳酸,分子量为1万,溶于n
‑
n二甲基甲酰胺中,室温机械震荡5min,得到5wt.%的聚乳酸溶液。将配制好的丝素蛋白溶液和聚乳酸溶液全部一起倒入250ml的圆底烧瓶中,在冷凝回流的条件下,因为甲酸极易挥发,所以选择加热温度为45℃,磁力搅拌混合1.5h,转速为20r/s。
77.将丝素/聚乳酸混合溶液浇铸在玻璃培养皿中,真空干燥,温度45℃,干燥时间48h,形成丝素蛋白/聚乳酸复合膜。用去离子水反复洗涤2
‑
3次,以去除残余的溶剂,移至通风干燥处自然风干,然后通过乙醇处理膜诱导β
‑
折叠结构的形成(一般浸泡20min),最终制备的复合膜不具有类似于嵌段结构的特征。
78.对比例4
79.(1)将5.00g剪碎的桑蚕茧放入煮沸的2000ml浓度为0.21wt.%的碳酸氢钠水溶液中处理30min,去除蚕茧中的丝胶,然后用去离子水充分洗涤三次,放在通风处干燥得到脱胶后的丝素纤维。
80.(2)以无水氯化钙为溶质,甲酸为溶剂,配置成4.00wt%的氯化钙
‑
甲酸溶液。称取该溶液11.5g,然后称取1g脱胶蚕丝溶解到氯化钙
‑
甲酸溶液,配置成8.00wt%的丝素蛋白溶液。
81.(3)根据丝素纤维与聚乳酸的质量比为1:5,称取5g外消旋聚乳酸,分子量为1万,溶于二氯甲烷中,室温机械震荡5min,得到5wt.%的聚乳酸溶液。将配制好的丝素蛋白溶液和聚乳酸溶液全部一起倒入250ml的圆底烧瓶中,在冷凝回流的条件下,加热温度为45℃,磁力搅拌混合1.5h,转速为20r/s。
82.(4)将丝素/聚乳酸混合溶液浇铸在玻璃培养皿中,真空干燥,温度45℃,干燥时间48h,形成丝素蛋白/聚乳酸复合膜。用去离子水反复洗涤2
‑
3次,以去除残余的溶剂,移至通风干燥处自然风干,然后通过乙醇处理膜诱导β
‑
折叠结构的形成(一般浸泡20min),最终制备的复合膜不具有类似于嵌段结构的特征。
83.本发明的实施例1中是在制备过程中,加入乙醇使共混溶液完全凝固成膜,并可以诱导β
‑
折叠结构的形成,同时去除离子液体,在离子液体的去除过程中,离子液体中阴阳离子与乙醇发生离子交换作用,同时乙醇加入增强了分子链的疏水效应和分子的自组装能力。此外,sf与pla的物理交联相互作用共同促进了类嵌段结构的产生。而对比例3和4是先制备得到了膜,然后再用乙醇处理单纯的是为了诱导β
‑
折叠结构的形成,无法形成类嵌段结构。实际上对比例3和4的溶剂体系得不到凝胶状或者类固态的丝素/聚乳酸复合材料,对比例3和4用的溶剂都极易挥发,只需要将溶剂挥发就可形成膜,在乙醇处理前就已经形成干燥好的膜,乙醇处理作用只是诱导β
‑
折叠形成,无法形成类嵌段结构。
84.试验例1
85.丝素/聚乳酸类嵌段共聚物复合膜材料形貌结构的比较
86.丝素/聚乳酸类嵌段共聚物的sem图像如图2所示:a~c:分别为实施例1
‑
3中,丝素与聚乳酸质量比分别为1:5,5:5和5:1的丝素/聚乳酸类嵌段共聚物的表面形貌。
87.通过图2中实施例1
‑
3中丝素/聚乳酸类嵌段共聚物复合材料的电镜图比较,可以清楚的看到,所有复合材料在宏观尺度上都显示出其均匀性和相容性。复合材料在拓扑形貌上表现出差异,对于样品a(sp1
‑
5,即实施例1中脱胶丝素纤维与聚乳酸的质量比为1:5),可以看到致密的纳米球状颗粒结构,随着丝素含量的增加,复合材料呈现出更纤维状的结构表面,样品b(sp5
‑
5,即实施例2中脱胶丝素纤维与聚乳酸的质量比为5:5)复合材料表面显示出纳米颗粒凸起的条状形貌。继续增加丝素含量,样品c(sp5
‑
1,即实施例3中脱胶丝素纤维与聚乳酸的质量比为5:5)呈现出均匀的条状拓扑结构。各种独特形态主要是通过改变丝素和聚乳酸的比例,使得到的类嵌段共聚物中亲/疏水区域之间的链长比不同。而不同的微尺度结构可以为复合材料提供其他表面性质,例如改善细胞附着和繁殖等。因此,可以通过调节丝素和聚乳酸之间的质量比来灵活的控制复合材料的表面形貌和结构,以满足不同的应用领域。
88.试验例2
89.丝素/聚乳酸嵌段共聚物复合膜材料的相态分析
90.采用rv差示扫描量热仪(rvdsc,dsc7000x,日本jeol公司)在温度调制dsc(tmdsc)模式下对不同比例sf/pla类嵌段共聚物复合材料进行了测试。在加热速率2℃/min条件下进行,将干燥的sf/pla复合材料封装在铝盘中,在氮气气氛下,流速为30ml/min,调制频率
为0.02hz,调制温度振幅为3℃,以加热速率2℃/min从
‑
20℃加热至220℃。
91.图3显示了样品在
‑
20℃到220℃之间可逆热容曲线。对于复合材料(sp1
‑
5~sp5
‑
1),玻璃化温度均分别出现在40℃
‑
50℃和100
‑
200℃温度范围内,且随着丝素在复合材料中比例的增加,其贡献的玻璃化转变台阶(δc
p
)逐渐明显,并向高温偏移,从143.5℃移动至168.9℃,不过,40℃
‑
50℃区域归属于聚乳酸的t
g
温度则会向低温发生略微移动。从以上dsc结果中可以看出,sf与pla发生了相互作用。然而,tmdsc曲线上出现的2个特征热转变又暗示了两相分子链可能发生有微相分离,并具有类似于典型的嵌段共聚物所具有的特征。这种类嵌段共聚物内部的亲水壳可减少亲水蛋白吸附,使血液中各种免疫细胞逃避免疫识别,导致血液循环时间长,而疏水核可以通过疏水或静电相互作用来包含药物,在药物包合和递送系统中具有重要的作用。
92.试验例3
93.丝素/聚乳酸类嵌段共聚物复合膜材料热稳定性的比较
94.使用pyris 1 tga(美国perkin
‑
elmer公司)进行热重分析(tg),n2气氛作为保护气,在氮气流速为50ml
·
min
‑1的情况下,以10℃
·
min
‑1的升温速率将样品由20℃加热到550℃。
95.通过图4和图5为实施例1
‑
3中sf/pla复合材料的tg和dtg图,从图4中,可以看出sf/pla复合材料的热失重过程主要发生在200℃
‑
400℃之间,并且有且只有一个明显的失重台阶,这表明sf/pla复合材料的分解过程是一步完成的,说明在这一新型二元溶剂体系下丝素与聚乳酸两种组分具有良好的热力学相容性。在这个阶段中,样品降解的起始分解温度t
onset
随着丝素含量的增加而逐渐向低温偏移,从335.21℃(sp=1
‑
5)降低到287.23℃(sp=5
‑
1)。同时,从图5中可以看出,在主要降解阶段,所有样品的质量损失很快,一旦达到起始分解温度,sp1
‑
5样品质量显著下降,其分解速率最快,达到约19.57%/min。说明添加丝素可以减慢共混材料在较高温度下的分解速率。最大降解速率对应的温度t
p
从364.45℃(sp=1
‑
5)降低到305.75℃(sp=5
‑
1)。最后,随着丝素含量的增加,在550℃下的残留量也随之增加。例如,样品sp1
‑
5在550℃处有7.57%左右的残留物,sp5
‑
1样品约为35.68%。这表明,残留量随着sf含量的增加而增加。这些结果再次证实两种材料的热力学相容性。
96.试验例4
97.丝素/聚乳酸类嵌段共聚物复合膜材料亲疏水性能的比较
98.采用座滴法对不同比例的sf/pla类嵌段共聚物复合膜材料的亲水性能进行了测试。针头向复合膜材料上滴加超纯水,水滴在膜上停留5s后,用光学接触角测量仪对水滴形状进行拍摄并计算静态接触角,每个试样测3次,取平均值。
99.通常,材料表面的静态水接触角是评价材料的亲/疏水性的重要指标之一。在本发明中,如图6所示,质量比为1:5、5:5、5:1的sf
‑
pla复合膜的水接触角分别为83.68
°
、73.48
°
和68.52
°
。随着sf组分的增加,复合膜的水接触角逐渐减小,表明复合膜的亲水性能逐渐提升,这说明sf的加入提高了复合膜的亲水性。对于理想的组织工程材料而言,除了具备一定的力学性能、良好的可塑性和生物降解性之外,最重要的一点是必须具有良好的生物相容性和良好的材料
‑
细胞界面,而良好的亲水性能更有利于细胞的黏附、生长和增殖。
100.试验例6
101.丝素/聚乳酸类嵌段共聚物复合膜材料细胞毒性研究
102.采用小鼠成纤细胞(l929)进行体外细胞毒性实验,评价了不同质量比例sf/pla类嵌段共聚物复合膜材料的生物相容性和细胞活性。在细胞培养前,所有sf/pla复合膜材料都用紫外线(uv)灭菌1h,然后在75%乙醇中浸泡10min,最后用无菌磷酸盐缓冲溶液(pbs)清洗样品3次。将胎牛血清(fbs)与改良的eagle培养基(dmem,sigma,usa)按体积比1:9混合,制成培养液。用无菌pbs简单冲洗细胞,胰蛋白酶化,在培养基中以大约1
×
104个细胞/ml的浓度重悬。将不同试样(实施例1
‑
3制备复合膜)放置在96孔培养板(tcp)底部。然后将成纤细胞置于复合膜上,同时在没有细胞的孔板中加入空白对照,在37℃下用5%的co2孵育,直到细胞融合达到80%。采用mtt法(3
‑
[4,5
‑
二甲基噻唑0
‑
基]0,5
‑
二苯基四唑溴化)检测不同压力下复合膜中的细胞活性。在细胞培养的过程中,每日更换培养基并添加四唑盐(mtt)溶液(5mg/ml,20μl)。再孵育4h后,取上清液,加入150μl二甲基亚砜(dmso)替代,然后水平震荡10min。最后,去除试样,用酶联免疫吸附测定仪测得在570nm波长处的吸光值。对每个样品进行至少测量3次。
[0103]
图7显示了小鼠成纤细胞在不同质量比的sf/pla复合材料上培养6、24和48h的存活率。随着培养时间的增加,所有复合膜的细胞活性都显示出增加的趋势。具体地,样品sp5
‑
5培养6、24和48h的细胞活力分别为106.4%,109.7%,111.8%。样品的细胞活力与丝素含量相关,丝素含量多的样品(sp5/1)的细胞活力明显优于低丝素含量的复合膜样品(sp1
‑
5,sp5
‑
5)。例如,培养24h后,当sf与pla质量比为5:1时,细胞活性为114.4%。而样品sp1
‑
5和sp5
‑
5的细胞活力分别为101.8%和109.7%。细胞增殖48h后,显示出与培养24h的结果相同的规律。综上所述,sf/pla复合膜中sf的存在有助于细胞的粘附和生长的能力。复合sf/pla表面增殖改善和细胞毒性的消失,可能归因于sf和细胞之间的相互作用。同时,由于sf的亲水性以及它与细胞膜的负电荷表面相互作用的能力。相反,聚乳酸亲水性差,缺乏生物活性和细胞亲和力。因此,将sf加入到sf/pla复合膜中,相对于纯pla无疑提高了亲水性。一般来说,亲水性表面相比疏水性表面具有更好的亲和力。
[0104]
试验例7
[0105]
丝素/聚乳酸类嵌段共聚物复合膜材料酶降解
[0106]
首先,称取实施例1
‑
3制备复合膜材料约10mg,保持每个样品的初始质量相同。然后,将薄膜浸入含有3.1u ml
–1糜蛋白酶(来自麦克林公司,中国)的10ml pbs缓冲液中(ph7.4),在37℃的热环境中处理24h。最后将标本取出,用蒸馏水轻轻漂洗三次,以完全去除酶和pbs残基,置于真空冷冻干燥箱中干燥,以便进一步研究。
[0107]
为了检查本发明中sf/pla共混膜中的晶体和非晶体结构,将实施例1
‑
3不同质量比例的样品在糜蛋白酶/pbs缓冲溶液中处理24h。糜蛋白酶是胰腺分泌的一种蛋白水解酶,可以应用于降解生物高分子材料的非晶区域,得到高度结晶的材料结构。经过酶降解24h后,利用sem观察样品的表面形貌发现,共混膜呈现出不同的裂隙和多孔结构(图8)。经过24h酶降解后,剩余的复合膜主要是晶体支架,非晶域受到攻击。这种通过酶处理的多孔结构证明了无定形
‑
结晶嵌段共聚物的特性,证明本发明的复合膜材料是具有独特的类似于嵌段结构的生物复合材料。此外,在复合膜材料制备过程中,两组分sf/pla中的非晶态和晶态会在小的微域内发生自组装,导致微相分离,从而驱动晶体的大小和形貌的改变。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1