一种化合物在制备抗黄曲霉毒素B1毒性的药物中的应用
一种化合物在制备抗黄曲霉毒素b1毒性的药物中的应用
技术领域
1.本发明属于制药领域,涉及一种化合物在制备抗黄曲霉毒素b1毒性的药物中的应用。
背景技术:
2.黄曲霉毒素由黄曲霉和寄生曲霉等某些菌株产生的真菌毒素,是一种广泛存在的真菌毒素,它有多种衍生物,其中以黄曲霉毒素b1(aflatoxin b1,afb1)的毒性、致癌性最强。黄曲霉毒素主要存在于大豆、玉米、花生等粮油产品,在坚果和中药材中也有发现。黄曲霉毒素在我国主要粮食作物中均有污染的情况,对于花生玉米大豆粮油作物污染较严重,在动物饲料中尤为严重,动物饲料所用的植物性原料容易因为存储堆积不当操作造成霉变,容易导致黄曲霉毒素产生。afb1的毒性作用极强,具有遗传毒性以及导致肝细胞癌的能力,afb1与乙型肝炎病毒(hbv)具有协同作用,能够增加肝癌发生的风险并加速肝癌的发展。除此之外afb1也可以促进包括hcv、酒精导致的肝硬化疾病发展为肝癌。除了遗传毒性与致癌作用外,afb1还可能造成营养不良、生长迟缓和免疫功能下降,严重影响着人类的身体健康状况。
3.黄曲霉毒素b1当前的防控主要依靠控制黄曲霉毒素的来源来进行,比如通过改良种植技术、改良储存方法防止afb1的产生,通过物理、化学、生物方式降解afb1。此外,对于摄入黄曲霉毒素后的治疗也有一定的进展,如一些已知药物或化合物能抵抗afb1毒性作用,但是无特效治疗药物,因此研究并开发新型的针对afb1毒性作用的治疗药物对于养殖业及人畜健康极为重要。
4.申请人使用计算机辅助药物设计(computer aided drug design,cadd),通过分子模拟对接筛选,发现一种已知的人工合成小分子化合物具有抗黄曲霉毒素b1毒性的作用,目前尚未有相关研究报道。
技术实现要素:
5.本发明的目的在于一种化合物在制备抗黄曲霉毒素b1毒性的药物中的应用,旨在为临床提供一种潜在的治疗afb1中毒的药物。
6.本发明中的化合物其结构式如下式(ⅰ)所示:
[0007][0008]
式(ⅰ)中,r1代表氧原子或烷氧基;r2代表h、烷基、苯烷基、苯、烷氧基取代的苯。
[0009]
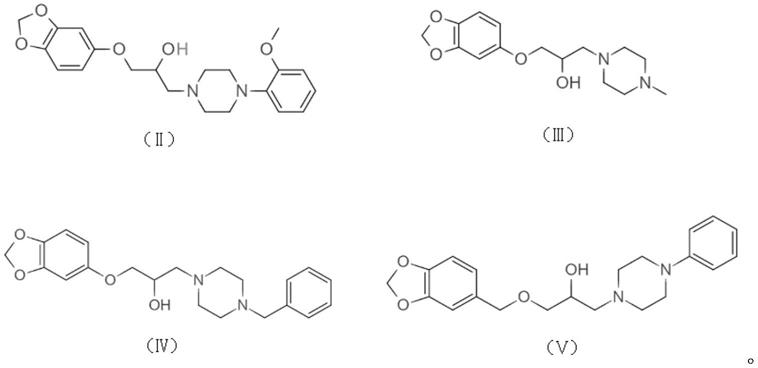
进一步地,所述化合物的结构式如式(ⅱ)
‑
(
ⅴ
)所示:
[0010][0011]
最佳的,所述化合物的结构式如式(ⅱ)所示,该化合物的名称为1
‑
(1,3
‑
苯并二恶醇
‑5‑
酰氧基)
‑3‑
[4
‑
(2
‑
甲氧基苯基)
‑1‑
哌嗪基]
‑2‑
丙醇;英文名(1
‑
(1,3
‑
benzodioxol
‑5‑
yloxy)
‑3‑
[4
‑
(2
‑
methoxyphenyl)
‑1‑
piperazinyl]
‑2‑
propanol);cas号:380192
‑
64
‑
3。
[0012]
本发明在多种细胞上验证了上述化合物的功能,结果表明:
[0013]
化合物对正常细胞(猪肾细胞)没有显著的毒性作用,也不会影响细胞的生长,但是能降低黄曲霉毒素b1对正常细胞产生的毒性,提高细胞的存活率,降低黄曲霉毒素b1导致的细胞氧自由基水平和脂质过氧化产物丙二醛水平的提升,从而抵抗黄曲霉毒素b1的细胞毒性。
附图说明
[0014]
图1:化合物m2处理pk
‑
15细胞后对细胞活性的影响。
[0015]
图2:化合物m2对afb1细胞毒性的抵制能力。
[0016]
图3:化合物m2对afb1致死pk
‑
15细胞ic
50
值的影响。
[0017]
图4:化合物m2对afb1导致的pk
‑
15细胞氧自由基ros水平上升的影响。
[0018]
图5:化合物m2对afb1导致的pk
‑
15细胞脂质过氧化产物丙二醛(mda)水平上升的影响。图中,**p<0.05。
[0019]
图6:8种化合物抵抗afb1对人肝癌细胞系huh7毒性的作用。图中,****p<0.001;***p<0.01。
[0020]
图7:芝麻酚对afb1细胞毒性的抵制能力。图中,***p<0.01。
具体实施方式
[0021]
下面通过具体实施例对本发明进行详细说明。
[0022]
试验材料:
[0023]
1.化合物
[0024]
试验中共使用了8种化合物,申请人将其命名为m1
‑
8,这些化合物均为已知化合物,可通过合成或商业途径获得。本实验购自specs公司。
[0025]
芝麻酚购自阿拉丁。
[0026][0027]
2.细胞
[0028]
猪肾细胞系(pig kidney 15,pk
‑
15)购自美国菌种保藏中心(atcc),并由本实验室保存使用。
[0029]
人肝癌细胞系(huh
‑
7)来源于武汉大学中国典型培养物保藏中心。
[0030]
3.试剂
[0031]
aflatoxin b1:购自sigama。
[0032]
dmem培养基:gibico。
[0033]
胎牛血清:德国pan。
[0034]
cck
‑
8试剂盒:上海碧云天生物技术有限公司。
[0035]
ros试剂盒:江苏凯基生物技术股份有限公司。
[0036]
实施例1:m2对pk
‑
15细胞的毒性作用
[0037]
1.野生型pk
‑
15细胞的培养
[0038]
将对数生长期的pk
‑
15细胞从t25的细胞培养瓶消化下来后,根据细胞密度用含10%胎牛血清的dmem完全培养基稀释至106个/ml的细胞悬浮液,将细胞混合均匀后用排枪接种到96孔板中,每个孔中加入100μl细胞悬浮液,在周围孔加入相同体积的pbs,轻轻拍打培养板的周围,使细胞分布均匀,待细胞沉淀到培养板底部后放入37℃,5%co2的细胞培养箱中;待细胞长至50%
‑
60%,吸去培养基,用无菌pbs将细胞洗一遍,后加入无血清dmem培养基,12h后待细胞周期同步化后吸去培养基。
[0039]
2.细胞给药
[0040]
m2用dmso溶解,后用dmem完全培养基进一步稀释成浓度为2、4、8、16、20、24、28、32μg/ml,96孔板中每孔加入100μl,每个剂量组设置6个平行孔,同时设空白组(不加细胞只加培养基)和对照组(加入与20μg/ml药物组同体积的dmso),在周围孔加入相同体积的pbs,放入培养箱中培养;加药后36h取出进行细胞毒性检测。
[0041]
3.cck
‑
8检测m2的细胞毒性
[0042]
将cck
‑
8试剂与培养基以1:10比例配好后加到各个孔中。放入37℃,5%co2的细胞
培养箱中培养1h;酶标仪读取450nm波长的吸光值(od450)。计算得到试验组相对于对照组的细胞存活率。细胞存活率=(实验组od450
‑
空白组od450)/(对照组od450
‑
空白组od450)。
[0043]
结果如图1所示,m2在2
‑
32μg/ml时对于pk
‑
15细胞的影响较小,没有明显的细胞毒性。
[0044]
实施例2:m2抗afb1毒性能力的检测
[0045]
1.afb1毒素与m2共处理细胞后的存活率曲线
[0046]
(1)将pk
‑
15细胞接种到96孔板中,每孔约105个细胞,培养24h待细胞生长至50
‑
60%后加药处理,afb1毒素浓度设置为每组均为2μg/ml,m2浓度设置为0.5
‑
40μg/ml间9个浓度梯度,稀释于10%胎牛血清的dmem培养基中。
[0047]
(2)加药处理细胞,设置空白组、dmso对照、afb1毒素对照、m2处理组(9个浓度),每组6个平行孔,孵育36h后cck
‑
8检测细胞存活情况,检测方法与实施例1相同。
[0048]
得到不同浓度m2与afb1毒素共处理细胞后的存活率曲线,如图2所示,细胞存活率随着m2浓度的增加而增加,说明m2有抵抗afb1致死细胞的作用。
[0049]
2.m2对afb1毒素ic
50
值的影响
[0050]
(1)将pk
‑
15细胞接种到96孔板中,每孔约105个细胞,培养24h待细胞生长至50
‑
60%后加药处理,设置afb1毒素浓度梯度为0、1、2、4、6、8、12、16、20μg/ml。根据图2结果选定m2最佳浓度为24μg/ml,稀释于10%胎牛血清的dmem培养基中。
[0051]
(2)加药处理细胞,设置afb1组、m2+afb1组,每个浓度6个平行孔,孵育36h后cck
‑
8检测细胞存活情况,检测方法与实施例1相同,测定afb1的ic5曲线,以及m2作用下afb1的ic50曲线。
[0052]
结果如图3所示,未加入m2时,afb1毒素对pk
‑
15细胞的半数致死浓度为1.215μg/ml;加入m2时,afb1毒素对pk
‑
15细胞的半数致死浓度增加到4.149μg/ml,进一步说明m2有抵抗afb1毒性的作用。
[0053]
实施例3:m2降低afb1导致pk
‑
15细胞氧自由基(ros)水平的提升
[0054]
1.afb1毒素与m2处理细胞。
[0055]
(1)将pk
‑
15细胞接种到12孔板中,培养24h待细胞生长至40
‑
50%后加药处理。afb1毒素浓度固定为0.1μg/ml,m2浓度设置为2μg/ml,稀释于10%胎牛血清的dmem培养基中。
[0056]
(2)加药处理细胞,设置调零组、空白组、afb1组、m2组、afb1+m2组,每组2个平行孔,处理48h后进行荧光染色处理。
[0057]
2.ros检测试剂处理
[0058]
(1)利用荧光探针dcfh
‑
da进行活性氧检测,细胞内的活性氧可以氧化无荧光的dcfh生成有荧光的dcf,发出绿色荧光。
[0059]
(2)按照1:1000用无血清培养液稀释dcfh
‑
da,使终浓度为10微摩尔/升。
[0060]
(3)弃去培养基,pbs清洗2遍,使用胰酶将细胞消化,加入基础培养基充分吹散制成细胞悬液,离心得细胞沉淀,细胞收集后悬浮于稀释好的dcfh
‑
da中,细胞浓度为一百万至二千万/毫升,37℃细胞培养箱内孵育20分钟。每隔3
‑
5分钟颠倒混匀一下,使探针和细胞充分接触。用无血清细胞培养液洗涤细胞三次,以充分去除未进入细胞内的dcfh
‑
da。
[0061]
3.流式细胞仪检测ros阳性率
[0062]
使用分析型流式细胞仪检测,使用fitc通道下检测绿色荧光,带有绿色荧光的细胞比例代表ros阳性率。以对照组细胞fitc峰值处的荧光强度作为中位数作为标准线,右侧fitc
‑
a+代表ros阳性,下方数值代表高于中位数荧光强度的细胞比例,数值升高代表ros阳性率的提升,表明细胞ros水平上升。
[0063]
结果如图4。afb1组细胞fitc
‑
a+数值由51上升至78.1,表明afb1导致细胞ros水平上升,细胞氧化应激水平提升,而添加m2组细胞在afb1作用下仅由42.7上升至55.5,且与空白组阳性率相近,表明m2可以有效防止afb1导致的细胞ros水平上升。afb1导致pk
‑
15细胞活性氧(ros)水平的上升,而m2缓解了afb1导致的ros水平上升。
[0064]
实施例4:m2降低afb1导致pk
‑
15细胞脂质过氧化产物丙二醛(mda)水平的提升
[0065]
1.afb1毒素与m2处理细胞
[0066]
(1)将pk
‑
15细胞接种到6孔板中,培养24h待细胞生长至60
‑
70%后加药处理。afb1毒素浓度固定为2μg/ml,m2浓度设置为10μg/ml,稀释于10%胎牛血清的dmem培养基中。
[0067]
(2)加药处理细胞,设置空白组、afb1组、m2组、afb1+m2组,处理36h后提取细胞蛋白质。
[0068]
2.提取细胞蛋白质
[0069]
(1)将细胞从培养箱中取出,弃去培养基,使用pbs清洗细胞两次后弃去。
[0070]
(2)配制细胞裂解液,添加磷酸酶抑制剂、蛋白酶抑制剂、edta溶液于细胞酶裂解液中,配置为细胞蛋白提取液。
[0071]
(3)每孔细胞加入细胞蛋白提取液100μl,冰上放置10min后吹打下细胞移入1.5ml ep管中,冰上裂解40min,随后使用离心机4℃12000g/min离心10min使细胞碎片沉淀,吸取上清即为细胞全蛋白。
[0072]
(4)使用bca试剂盒测定蛋白浓度。
[0073]
2.检测细胞mda水平
[0074]
使用微量丙二醛(mda)测定试剂盒检测细胞mda水平,试剂盒购自江苏凯基生物技术股份有限公司,货号kgt004
‑
1。
[0075]
以空白组细胞mda水平作为基准,比较afb1、m2、afb1+m2组,发现m2能下调afb1导致的细胞mda水平上升,见图5。
[0076]
实施例5:化合物在其它细胞(人肝癌细胞系)上抗afb1的表现
[0077]
将huh7细胞6孔板中,每孔约105个细胞,培养24h待细胞生长至50
‑
60%后加药处理,afb1毒素浓度设置为每组均为4μg/ml,m1
‑
8等8种化合物浓度均为10μg/ml。
[0078]
加药处理细胞,设置空白组、afb1毒素对照、化合物处理组,每组6个平行孔,孵育36h后cck
‑
8检测细胞存活情况。
[0079]
得到8种化合物抵抗afb1致死huh7细胞作用的能力,如图6所示,m2、m4、m5、m6四种化合物对afb1毒素的细胞毒性具有较强的抵抗作用。这四个化合物都具有1,3
‑
苯并二恶茂、哌嗪、丙醇基团,说明这三个基团是化合物的官能团,对化合物的功能产生重要作用。
[0080]
实施例6:芝麻酚在pk
‑
15细胞上抵抗afb1的表现
[0081]
已有文献报道芝麻酚(3,4
‑
亚甲二氧基苯酚)具有抗氧化的能力,我们推测其可能具有抵抗afb1细胞毒性的能力,因此我们还对芝麻酚的功能进行了检测,试验方法如下:
[0082]
将pk
‑
15细胞接种到96孔板中,每孔约105个细胞,培养24h待细胞生长至50
‑
60%
后加药处理,afb1毒素浓度设置为每组均为2μg/ml,芝麻酚浓度设置为32
‑
1024μg/ml间6个浓度梯度,稀释于10%胎牛血清的dmem培养基中。
[0083]
加药处理细胞,设置空白组、afb1毒素对照、afb1毒素加芝麻酚(6个浓度)处理组,每组6个平行孔,孵育36h后检测细胞存活情况。
[0084]
结果如图7所示,芝麻酚浓度在512μg/ml时pk
‑
15细胞的存活率才达到80%,而本发明化合物在浓度为20
‑
30μg/ml时pk
‑
15细胞的存活率接近100%,说明本发明化合物的活性远高于芝麻酚。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1