一种JO蛋白锚定的载药免疫细胞及其制备方法和应用
peg-nhs、dmpe-peg-oh、dspe-peg-oh、dppe-peg-oh、dlpe-peg-oh、dmpe-peg-cooh、dspe-peg-cooh、dppe-peg-cooh、dlpe-peg-cooh、dmpe-nhs、dspe-nhs、dppe-nhs、dlpe-nhs、dmpe-oh、dspe-oh、dppe-oh、dlpe-oh、dmpe-cooh、dspe-cooh、dppe-cooh、dlpe-cooh以及类似的脂质中间体。
13.进一步地,所述活性药物为具有抗肿瘤作用的化学药物、蛋白、多肽、细胞因子或放疗制剂,例如、紫杉醇、多西他赛、阿霉素、顺铂、喜树碱、柔红霉素、对甲氨喋呤、肿瘤坏死因子、多烯紫杉醇、丝裂霉素、氟尿嘧啶、吉西他滨、环磷酰胺、长春碱、白介素18。
14.本发明另一个方面提供了一种jo蛋白锚定的载药脂质体或纳米颗粒,所述脂质体或纳米颗粒表面上通过化学键偶联jo蛋白,或者在脂质体或纳米颗粒表面引入偶联jo蛋白的连接剂,将jo蛋白插嵌在脂质体或纳米颗粒上;
15.其中所述的连接剂为包含磷脂或磷脂类似物和活性基团的缀合物。
16.进一步地,所述脂质体或纳米颗粒负载有活性成分。
17.进一步地,所述活性成分为具有抗肿瘤作用的化学药物、蛋白、多肽、细胞因子或放疗制剂。
18.进一步地,所述化学键偶联jo蛋白的方法为将jo蛋白表面的羧基活化后与脂质体或纳米颗粒表面上的氨基或羟基进行偶联。
19.进一步地,引入连接剂的方法为将连接剂与jo蛋白偶联后,将偶联物通过相似相容插嵌在脂质体或纳米颗粒表面或双分子层中。
20.进一步地,所述羧基活化所使用的活化剂选自1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)、n-羟基琥珀酰亚胺(nhs)中的至少一种。
21.进一步地,所述连接剂选自dmpe-peg-nhs、dspe-peg-nhs、dppe-peg-nhs、dlpe-peg-nhs、dmpe-peg-oh、dspe-peg-oh、dppe-peg-oh、dlpe-peg-oh、dmpe-peg-cooh、dspe-peg-cooh、dppe-peg-cooh、dlpe-peg-cooh、dmpe-nhs、dspe-nhs、dppe-nhs、dlpe-nhs、dmpe-oh、dspe-oh、dppe-oh、dlpe-oh、dmpe-cooh、dspe-cooh、dppe-cooh、dlpe-cooh以及类似的脂质中间体。
22.本发明又一个方面提供了jo蛋白锚定的载药免疫细胞的制备方法,所述制备方法包括以下步骤:
23.1)采用活化剂对jo蛋白进行活化;或者通过连接剂先与jo蛋白连接,然后室温存放72小时-168小时进行稳定;
24.2)将活化后的jo蛋白与免疫细胞进行反应,使jo蛋白偶联在免疫细胞表面;或者将偶联连接剂的jo蛋白与免疫细胞进行反应,使偶联连接剂的jo蛋白嵌入免疫细胞膜表面;
25.3)分离纯化后将获得的免疫细胞与活性药物共同孵育,获得jo蛋白锚定的载药免疫细胞。
26.进一步地,所述活化剂为edc、nhs中的至少一种。
27.进一步地,所述连接剂选自dmpe-peg-nhs、dspe-peg-nhs、dppe-peg-nhs、dlpe-peg-nhs、dmpe-peg-oh、dspe-peg-oh、dppe-peg-oh、dlpe-peg-oh、dmpe-peg-cooh、dspe-peg-cooh、dppe-peg-cooh、dlpe-peg-cooh、dmpe-nhs、dspe-nhs、dppe-nhs、dlpe-nhs、dmpe-oh、dspe-oh、dppe-oh、dlpe-oh、dmpe-cooh、dspe-cooh、dppe-cooh、dlpe-cooh以及类
似的脂质中间体。
28.进一步地,分离纯化的方法为离心分离,并通过体积为细胞悬液50倍及以上体积的pbs清洗至少3遍。
29.进一步地,步骤1)中活化剂与jo蛋白的摩尔比为50-200:1。例如60:1、70:1、80:1、90:1、100:1、110:1、120:1、130:1、140:1、150:1、160:1、170:1、180:1、190:1。
30.进一步地,步骤2)中连接剂与jo蛋白的摩尔比为1-500:1。例如10:1、20:1、30:1、40:1、50:1、60:1、70:1、80:1、90:1、100:1、110:1、120:1、130:1、140:1、150:1、160:1、170:1、180:1、190:1、200:1、250:1、300:1、350:1、400:1、450:1、500:1。
31.进一步地,步骤2)中反应的时间为24-108小时。例如36小时、48小时、60小时、72小时、84小时、96小时。
32.进一步地,步骤3)中孵育的方法为将细胞分散在含有活性药物的溶液中进行孵育。
33.进一步地,所述溶液中活性药物的浓度为1-150μg/ml,孵育时间为1-6小时。
34.本发明又一个方面提供了上述jo蛋白锚定的载药脂质体或纳米颗粒的制备方法,其包括以下步骤,将偶联jo蛋白的连接剂与作为双分子层的磷脂或制备纳米颗粒的聚合物混合,并制备载药脂质体或纳米颗粒。
35.本发明再一个方面提供了jo蛋白锚定的载药免疫细胞、载药脂质体或载药纳米颗粒的应用,所述应用为在制备抗肿瘤药物中的用途。
36.进一步地,所述的肿瘤为实体瘤、血液肿瘤或淋巴瘤。例如为肺腺癌、肝癌、肺癌、胆管癌、头颈肿瘤、乳癌、宫颈癌、卵巢癌、前列腺癌,胃癌、肠癌、血癌、胰腺癌。
37.有益效果
38.1、本发明的细胞使用为人体来源的免疫细胞,安全性高;且由于肿瘤归巢效应,可以主动聚集到肿瘤部位,这种向肿瘤部位的聚集速度非常迅速,进入血液后15分钟即可完成。同时,载药后细胞会在24小时内失去活性,这会降低t细胞的输入可能引发的免疫风暴等副作用。
39.2、jo蛋白和edc或者dmpe-peg-nhs,dspe-peg-nhs等类似的脂质中间体生物安全性高。
40.3、本发明提供的促渗策略可以改善纳米药物或者细胞制剂在实体瘤的渗透难题。首次将jo蛋白的促渗功能直接与治疗细胞连接,治疗效果远远高于游离药物以及未修饰jo蛋白的载药细胞。
41.4、该制备方法简便易行,便于操作推广。
42.5、本发明首次证明jo蛋白对免疫细胞的促渗效果,将jo蛋白通过一步法连接到免疫细胞jurkat细胞,在实现jo促渗效果的同时,减少化药与jo蛋白连用时的给药次数。
43.6、本发明利用了细胞膜的脂质成分,根据相似相溶原理以及多氨基的特点,通过edc法或者一步法将jo蛋白通过连接剂,快捷高效的将其修饰在细胞膜表面,并在24小时内不会被细胞内吞。
附图说明
44.图1.cy5标记的jo蛋白修饰到jurkat细胞的激光共聚焦显微镜图(蓝色是cy5标记
的jo蛋白)
45.图2.激光共聚焦显微镜观察jurkat细胞和与jo蛋白修饰的jurkat细胞在a549球型组织中的渗透情况。第一行代表对照组(未修饰jo蛋白)的实验结果,第二组代表jo蛋白修饰的jurkat细胞实验结果。(绿色表示a549细胞,红色是dii染料,用于jurkat细胞的标记)。
46.图3.激光共聚焦显微镜观察jo蛋白修饰的jurkat细胞在a549球型组织中的渗透情况。(绿色表示a549细胞,蓝色表示cy5,用于jo蛋白的标记)。
47.图4激光共聚焦显微镜观察jo蛋白修饰和非修饰的jurkat细胞在a549原位癌动物模型中的渗透情况。其中a显示did标记的jurkat细胞修饰jo得到jurkat-jo-did的结果,b显示did标记的jurkat细胞jurkat-did的结果。
48.图5为jurkat-jo-dox对肿瘤细胞杀伤结果。
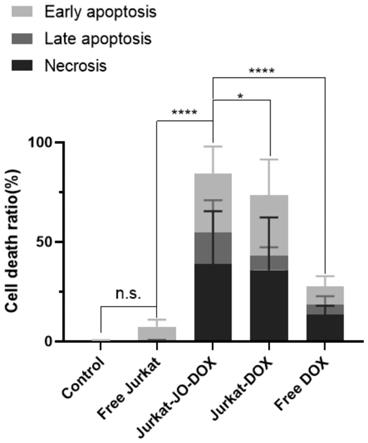
49.图6为jurkat-jo-dox诱导细胞凋亡结果。
50.图7为不同浓度的jo蛋白对于肿瘤细胞毒性研究结果。
51.图8为jurkat细胞对肿瘤的趋化能力测试结果。
52.图9为给药之后肺部肿瘤在癌症进展中期的肿瘤大小micro-ct结果。
53.图10为给药之后肺部肿瘤在癌症进展晚期的肿瘤大小micro-ct结果。
具体实施方式
54.为了使本发明的上述目的、特征和优点能够更加明显易懂,下面对本发明的具体实施方式做详细的说明,但不能理解为对本发明的可实施范围的限定。
55.实施例1jo蛋白锚定的t细胞的制备
56.①
jo蛋白溶于水中,浓度范围为1-200mg/ml;
57.②
jo蛋白、edc以1:100溶于pbs中,室温下反应72小时;
58.③
将
②
中得到的羧基活化后的jo蛋白加入jurkat细胞中,37度摇床孵育4小时。1000转,离心3分钟,pbs洗三遍。即得,jo蛋白锚定的t细胞。
59.实施例2渗透性实验
60.1)cy5标记的jo蛋白修饰jurkat细胞渗透实验
61.实验方法:将cy5标记的jo蛋白(jo-cy5)按上述方法修饰到jurkat细胞表面,24小时之后用共聚焦显微镜观察。
62.实验结果见图1,随着jo-cy5浓度增加,jurkat细胞表面的蓝色越明显,表明jo-cy5成功修饰到jurkat细胞表面,并于jo-cy5浓度成正相关。
63.2)jo蛋白修饰和非修饰的jurkat细胞在a549-gfp肿瘤类器官渗透深度实验
64.实验方法:用表达gfp的a549构建a549-gfp肿瘤类器官;通过上述方法将jo锚定到jurkat细胞,jurkat细胞用红色染料dii标记,具体方法见dii说明书。以jo浓度定量,以jo终浓度为5μg/ml加入a549-gfp类器官中。24小时后用激光共聚焦显微镜观察。用dii标记的jurkat细胞,不修饰jo蛋白(jurkat alone),作为对照组。
65.实验结果见图2,从多层扫描结果来看,随着类器官逐渐深入内核,对于jurkat-jo组,在20μm和30μm时可以明显看到dii的分布,而对照组(jurkat细胞未连接jo蛋白)的dii分布则明显弱于jurkat-jo组。随着扫描的进一步深入40μm和50μm,jurkat-jo组的红色分
布虽然有所变弱,但仍然强于对照组,表明jo修饰的jurkat细胞与对照组相比可以到达类器官的更深部位,具有更优的渗透效果。
66.3)jo蛋白修饰的jurkat细胞在a549-gfp肿瘤类器官渗透实验
67.实验方法:用表达gfp的a549构建a549-gfp肿瘤类器官;通过实施例1方法将jo锚定到jurkat细胞,jo蛋白用cy5标记。以jo浓度定量,以jo终浓度为5μg/ml加入a549-gfp类器官中。2小时后用激光共聚焦显微镜观察。
68.实验结果见图3,jo修饰的jurkat细胞在2小时内可以分布到a549类器官的50μm处,表明jo修饰的jurkat细胞可以渗透到类器官的中心部位。
69.4)did标记的裸鼠实验
70.实验方法:建立a549原位癌模型,具体参考文献:doi:10.1016/j.biomaterials.2018.08.035。
71.jurkat细胞用did标记(蓝色),具体方法见did说明书(thermo)。设置两组实验,a,did标记的jurkat细胞修饰jo得到jurkat-jo-did;b,did标记的jurkat细胞作为对照组(jurkat-did)。尾静脉分别注射jurkat-jo-did和jurkat-did,24小时后,牺牲裸鼠,取肿瘤做冷冻切片,并用cd31染肿瘤血管,dapi染细胞核。用激光共聚焦显微镜观察。
72.实验结果如图4所示。由a可知,jurkat-jo-did广泛分布于肿瘤中,并且在血管分布较少的部位仍然有分布,而对于jurkat-did组则集中分布于血管周围。表明,jurkat-jo-did在到达肿瘤血管之后可以进一步渗透到周围的肿瘤组织,具有更深的肿瘤分布效果。
73.实施例3jo蛋白锚定的载药t细胞的制备
74.①
将阿糖胞苷(dox)溶于dmso中,浓度为1-20mg/ml;
75.②
将实施例1制备获得的jo蛋白锚定的t细胞加入步骤(1)得到的溶液,使dox的浓度控制在1-150μg/ml,37℃孵育1-6小时;
76.③
1000转,离心3分钟,磷酸盐缓冲溶液(pbs)洗三遍。即得负载阿霉素的jo蛋白锚定的jurkat细胞jurkat-jo-dox。
77.实施例4jurkat-jo-dox的抗肿瘤测试实验
78.cck-8法分别以jurkat和jurkat-jo作为药物递送的载体,探讨其负载dox之后的抗肿瘤能力。实验分别对比了在细胞水平上不同浓度下(以dox浓度计),游离dox(free dox),未增加jo修饰但载药细胞jurkat-dox,以及修饰jo且载药细胞jurkat-jo-dox对于肿瘤细胞的杀伤能力。
79.实验结果见图5,证明了jurkat细胞负载了dox,在肺腺癌细胞系a549 jurkat负载dox(jurkat-dox)和修饰jo蛋白负载dox(jurkat-jo-dox)均表现出一定的抗肿瘤效果。且在相同dox的浓度下(0.5μm),尤其是低浓度下(2μm以下),jurkat-jo-dox杀伤肿瘤能力明显优于jurkat-dox,且其抗肿瘤效果均明显高于游离dox。
80.实施例5jurkat-jo-dox对肿瘤细胞凋亡的影响
81.以细胞凋亡检测试剂盒annexin v-647/pi考察以jurkat和jurkat-jo作为药物递送的载体,探讨其负载dox之后的抗肿瘤能力。
82.实验结果见图6,细胞凋亡的结果与图5一致,jurkat-jo-dox和jurkat-dox的抗肿瘤效果优于游离dox,且jurkat-jo-dox的抗肿瘤效果更加,其抗肿瘤的机制源于使细胞产生凋亡。单独的jurkat细胞并不能杀伤肿瘤,排除了t细胞本身的作用效果。
83.实施例6考察jo蛋白是否对a549有毒性
84.采用jo蛋白与细胞进行共同孵育,实验结果见图7,实验结果显示不同浓度的jo蛋白(5μg/ml-40μg/ml)不会造成细胞毒性,同时jurkat细胞负载dox之后的抗肿瘤效果明显优于free dox组。
85.实施例7考察jurkat的肿瘤趋向性
86.transwell实验验证jurkat细胞对培养了a549细胞48小时培养基的趋化能力。以新鲜不含血清的培养基作为阴性对照,含20%血清的培养基作为阳性对照。
87.以48小时的a549培养基模拟体内肿瘤环境,以transwell实验探讨jurkat细胞对肿瘤的趋化能力,实验结果见图8,结果显示,jurkat对a549培养基为对照组的1.2倍。即jurkat细胞有一定的肿瘤趋化能力。
88.实施例8jurkat-jo-dox和jurka-dox在体内抗肿瘤效果
89.在肺部肿瘤动物模型中分别使用jurkat-jo-dox和jurka-dox给药后,用micro-ct观察给药之后肺部肿瘤在癌症进展中期及晚期的肿瘤大小情况。实验结果见图9-10,其中,图9为给药之后肺部肿瘤在癌症进展中期的肿瘤大小情况;图10为给药之后肺部肿瘤在癌症进展晚期的肿瘤大小情况。
90.从实验结果来看,以jurkat细胞为药物递送载体可以增强药物载体在实体瘤的渗透能力,为了进一步优化药物递送体系,在jurkat细胞上引入了jo蛋白(jurkat-jo),其在实体瘤得渗透能力优于不加修饰的jurkat细胞。
91.分别以jurkat和jurkat-jo作为药物载体,负载dox,得到jurkat-dox和jurkat-jo-dox,在相同dox浓度下,jurkat-dox和jurkat-jo-dox的体内体外抗肿瘤(a549)效果明显优于游离dox组。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1