一种艾叶提取物及其制备方法与应用与流程
1.本发明属于植物源抗菌制剂技术应用领域,特别涉及一种基于艾叶提取物的天然抗菌剂及其制备方法与应用。
背景技术:
2.皮肤癣菌病是由亲胶质蛋白的皮肤癣菌侵染人体或动物的皮肤、皮毛、甲板而引起的皮肤感染疾病,头部、手部、足部等均可感染。皮肤癣菌病在全世界广为流行,在热带和亚热带地区更为普遍,在我国的发病率也相当高,临床主要表现为红斑、水疱、脓疱等皮损,瘙痒明显,且因发病部位的不同而呈现不同程度的症状,困扰了大量人群。目前大量研究表明,体股癣、手足癣等皮肤癣菌病的致病菌大致相同,主要包括毛癣菌属、表皮癣菌属和小孢子菌属等,最常见的为红色毛癣菌,其他包括须癣毛癣菌、石膏样小孢子菌等。
3.临床常用局部治疗皮肤癣菌病药物以咪唑类、丙烯胺类抗真菌药为主,但这些制剂副作用多,不良反应较多,且由于广谱高效抗菌药、糖皮质激素等药物的滥用,导致皮肤癣菌耐药性增强,容易复发,不易根治。
4.众所周知,我国药用植物资源丰富,中药植物中的多种次生代谢产物具有良好的抗真菌活性,诸多中草药在民间应用或本草著作中很早就被认为具有抗菌、止痒的功效。同时,中药资源因其种类丰富,副作用小,配方多元,不易产生耐药性等优点而有着明显的优势。因此,挖掘具有高效抑菌活性的中药材,对开发新型的天然抗真菌药物具有重要意义。
5.艾叶为菊科蒿属植物艾artemisia argyi levl.et vant.的干燥叶片,在全国分布广泛。2020版《中国药典》记载艾叶主要功效为温经止血,散寒止痛,外用可祛湿止痒。现代药理学研究表明,艾叶主要富含挥发油、黄酮、酚酸、萜类等多种化学成分,具有显著的抗菌、抗病毒作用。目前已有研究显示艾叶挥发油对多种临床细菌、真菌有良好的抑制或杀灭作用,而关于艾叶提取物的抑菌活性报道较少,尤其是对皮肤癣菌的抑制未见报道。
6.专利(cn 110585378 a)公布了一种以苦参、土荆皮、大黄、黄柏、黄连等数十种药材以重量配比制得的组合物来治疗皮肤癣菌病。该组合物对手癣、脚癣、甲癣等多种皮肤癣菌有良好的治疗作用,且复发率低;但仍然存在着配方复杂,需添加众多辅料的问题。
7.因此,随着皮肤癣菌病发病率的逐年升高,亟需研发一种能够高效抑制皮肤癣菌,且原料来源广泛、制备简单、不产生抗药性、生产成本低的纯天然抗菌剂,从而有效治疗由皮肤癣菌引起的众多皮肤癣菌病。
技术实现要素:
8.为了解决现有技术中存在的问题,本发明提供了一种艾叶提取物,并将其用作皮肤癣菌的抗菌剂,该抗菌剂原料来源广泛,提取方法简单,抑菌效果良好。
9.为实现上述技术目的,本发明采用的技术方案如下:
10.在本发明的第一方面,提供一种艾叶提取物,所述艾叶提取物为艾叶超声提取物或回流提取物,提取溶剂为5
‑
75%乙醇溶液。
11.在本发明的第二方面,提供上述艾叶提取物的制备方法,具体地,将艾叶置于乙醇溶液中超声提取,超声提取条件为:提取功率为240~250w,温度为20~30℃,提取时间1~2h,提取次数为2~3次;
12.或,将艾叶置于乙醇溶液中回流提取,回流提取条件为:提取温度为70~80℃,提取时间1~2h,提取次数为2~3次。
13.本发明的第三个方面,提供一种艾叶精制提取物,所述艾叶精制提取物为上述艾叶提取物经大孔吸附树脂分离纯化后,取40~95%乙醇分离组分所得。
14.所述艾叶精制提取物,其组分包括异泽兰黄素、大黄素甲醚、蔓荆子黄素、棕矢车菊素等黄酮类和蒽醌类化合物。
15.本发明的第四个方面,提供上述艾叶精制提取物的制备方法。
16.本发明得到第五个方面,提供一种包含上述艾叶提取物或艾叶精制提取物的药物组合物。
17.本发明的第六个方面,提供上述艾叶提取物或艾叶精制提取物或药物组合物在制备抑制皮肤癣菌制品中的应用。
18.具体的,所述皮肤癣菌包括但不限于红色毛癣菌、须癣毛癣菌和石膏样小孢子菌。
19.本发明的有益效果至少在于:
20.(1)本发明的艾叶提取物及艾叶精制提取物对红色毛癣菌、须癣毛癣菌和石膏样小孢子菌等皮肤癣菌具有抑制作用,扩大了以艾叶为原料的产品的应用范围。
21.(2)本发明的艾叶提取物及艾叶精制提取物对皮肤癣菌的抑制作用相较于之前报道的有抑菌效果的中药提取物,抑菌活性高效显著。
22.(3)本发明提供的艾叶提取物来源广泛,制备简单,不易产生抗药性,可直接用于制备新型的天然抗真菌药物。
附图说明:
23.构成本技术的一部分的说明书附图用来提供对本技术的进一步理解,本技术的示意性实施例及其说明用于解释本技术,并不构成对本技术的不当限定。
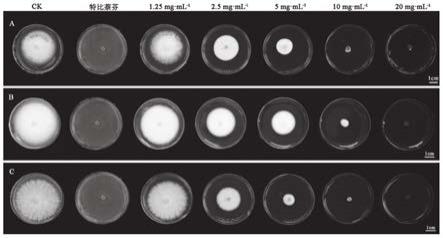
24.图1为不同浓度艾叶提取物对三种皮肤癣菌的抑制作用,a
‑
红色毛癣菌,b
‑
须癣毛癣菌,c
‑
石膏样小孢子菌;
25.图2为艾叶提取物40~95%乙醇分离组分对三种皮肤癣菌的抑制作用,a
‑
红色毛癣菌,b
‑
须癣毛癣菌,c
‑
石膏样小孢子菌;
26.图3为不同浓度95%乙醇分离组分对三种皮肤癣菌的抑制作用,a
‑
红色毛癣菌,b
‑
须癣毛癣菌,c
‑
石膏样小孢子菌;
27.图4为艾叶提取物95%乙醇分离组分的化学成分分析,a
‑
uv色谱图(330nm),b
‑
基峰离子流图谱(bpi)。
具体实施方式:
28.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本技术使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
29.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
30.本发明提供了艾叶提取物,并将其用作皮肤癣菌的抗菌剂。
31.本发明的一个典型的实施例,提供一种艾叶提取物,所述艾叶提取物为艾叶超声提取物或回流提取物,提取溶剂为5
‑
75%乙醇溶液。
32.本发明的又一典型的实施例,提供上述艾叶提取物的制备方法,将艾叶置于乙醇溶液中超声提取,超声提取条件为:提取功率为240~250w,温度为20~30℃,提取时间1~2h,提取次数为2~3次;
33.或,将艾叶置于乙醇溶液中回流提取,回流提取条件为:提取温度为70~80℃,提取时间1~2h,提取次数为2~3次。
34.本发明的又一典型的实施例,提供一种基于上述艾叶提取物的艾叶精制提取物,其是由上述艾叶提取物经大孔吸附树脂分离纯化后,取40~95%乙醇分离组分所得,优选取40%、60%或95%乙醇水溶液分离组分,更优选取95%乙醇水溶液分离组分。
35.上述艾叶精制提取物,其组分包括至少11种成分,主要为黄酮类和蒽醌类化合物,其中异泽兰黄素、大黄素甲醚、蔓荆子黄素、棕矢车菊素为可能为提取物发挥抗菌活性的主要活性物质。
36.本发明的又一典型的实施例,提供上述艾叶精制提取物的制备方法,包括以下步骤:
37.(1)将上述艾叶提取物上大孔吸附树脂,依次用水、10%(v/v)乙醇、20%(v/v)乙醇进行洗脱,以去除多糖、蛋白及酚酸类成分;大孔吸附树脂可选自d101、ab
‑
8、ads
‑
4、ads
‑
8、spd
‑
100、lsa
‑
20、xad
‑
5,优选为d101;
38.(2)依次使用40%~95%的乙醇水溶液进行洗脱;优选的,依次使用40%、60%、95%的乙醇水溶液进行洗脱,分别洗至接近无色;
39.(3)分别收集各浓度洗脱液,除去洗脱溶剂,冷冻干燥后即得艾叶精制提取物;优选地,采用在40~50℃下减压旋转蒸法除去洗脱溶剂。
40.本发明的又一典型的实施例,提供一种药物组合物,其含上述叶提取物或艾叶精制提取物。
41.进一步的,所述药物组合物为片剂、胶囊、颗粒剂、粉针或注射剂。
42.本发明的又一典型的实施例,提供上述艾叶提取物、艾叶精制提取物或药物组合物在制备抑制皮肤癣菌制品中的应用。
43.优选的,皮肤癣菌选自红色毛癣菌、须癣毛癣菌和石膏样小孢子菌等常见皮肤癣菌;
44.进一步的,所述艾叶提取物对红色毛癣菌、须癣毛癣菌和石膏样小孢子菌的最小抑菌浓度(mic)分别为2.5、5、5mg
·
ml
‑1,最小杀菌浓度(mfc)分别为10、20、20mg
·
ml
‑1;
45.或,所述艾叶精制提取物对红色毛癣菌、须癣毛癣菌和石膏样小孢子菌最小抑菌浓度(mic)分别为0.3125、0.625、0.3125mg
·
ml
‑1,最小杀菌浓度(mfc)分别为2.5、5、2.5mg
·
ml
‑1。
46.为了使得本领域技术人员能够更加清楚地了解本技术的技术方案,以下将结合具体的实施例详细说明本技术的技术方案。
47.1.供试菌株:红色毛癣菌tr(trichophyton rubrum)、石膏样小孢子菌mg(microsporumgypseum)、须癣毛癣菌tm(trichonphytonmentagrophyton)购于北纳创联生物技术研究院微生物质控中心。
48.2.菌株活化:将菌株从
‑
80℃冰箱取出,活化,接种在pda培养基中,每隔24h观察菌株生长状况,挑选长势良好的皮肤癣菌,打孔器打孔传代,保证菌种活力,后封口置28℃恒温培养。
49.3.菌悬液的制备:将三种供试菌(红色毛癣菌、须癣毛癣菌、石膏样小孢子菌)接种在pda培养基中,28℃培养12
‑
14d,每种供试菌培养皿取10ml生理盐水冲洗菌落表面,振摇片刻,取菌悬液过滤于试管中。取15μl菌悬液于血球计数板计数,镜检调整至菌悬液浊度至1
‑5×
105cfu
·
ml
‑1。
50.4.抑制率及毒力测定:抑菌活性采用菌丝生长速率法进行测定。在无菌条件下,选取生长速率相近的三种供试菌种,用5mm打孔器在长势均一的纯菌落边缘打孔切取菌饼,挑取菌饼至空白对照培养基(ck)、含药培养基和阳性药(5μg
·
ml
‑1的特比萘芬)培养基的中央,封口后置于28℃生化培养箱中培养,每24h观察并记录菌丝生长直径。计算各组药物对三种供试菌的抑制率,计算毒力方程和ec
50
值,直到ck组接近长满培养基为止。各处理组三次生物学重复。抑制率=[(对照组菌丝生长直径
‑
处理组菌丝生长直径)/(对照组菌丝生长直径
‑
菌饼直径)]
×
100%。
[0051]
5.最小抑菌浓度(mic)和最小杀菌浓度测定(mfc):参考美国国家标准化委员会(clsi)制定m
‑
38a2方法。取96孔培养板,在第1
‑
9孔依次加入100μl用rpmil1640培基梯度稀释的供试药液,第10孔加入100μl5μg
·
ml
‑1的特比萘芬对照溶液,第11孔设为生长对照不加药液,第12孔设为阴性对照,只有培养基。将配置好的菌悬液加入相应各孔,每孔100μl,轻轻摇匀后放置于28℃生化培养箱中培养。96h后两人同时肉眼观察,无菌丝生长的最低浓度即为药物的最小抑菌浓度(mic)。取100μl无菌丝生长孔中的菌液接种到空白pda培养基,28℃恒温培养7d,培养基上菌落数小于5个或无菌丝生长的最低药物浓度即为药物的最小杀菌浓度(mfc)。
[0052]
应用实例1:本发明的艾叶提取物抑菌活性测定
[0053]
以抗真菌药物特比萘芬为阳性对照,采用菌丝生长速率法测定艾叶提取物对皮肤癣菌的抑制活性
[0054]
艾叶提取物的制备:
[0055]
1)超声提取法:
[0056]
将艾叶置于10倍量的75%(v/v)乙醇溶液中,于提取容器中充分搅拌均匀静置过夜,超声提取,超声提取条件为:提取功率为250w,提取温度为25℃,提取时间为1h,过滤,再对艾叶重复提取一次,合并滤液,减压浓缩至浓稠状,冷冻干燥,即得艾叶提取物。
[0057]
2)回流提取法:
[0058]
将艾叶置于10倍量75%(v/v)乙醇溶液中回流提取,回流提取条件为:提取温度为75℃,提取时间1h,提取次数为2次。
[0059]
含药培养基的制备:在pda培养基中加入艾叶提取物样品适量,配置成1.25、2.5、
5、10、20mg
·
ml
‑1浓度梯度的含药培养基。用5μg
·
ml
‑1的特比奈芬作为阳性对照制得阳性药培养基。
[0060]
艾叶提取物对皮肤癣菌抑制率及毒力影响的测定:按照上述【抑制率及毒力测定】中所述方法,选取生长速率相近的三种供试菌种,用5mm打孔器在长势均一的纯菌落边缘打孔切取菌饼,挑取菌饼至空白对照培养基(ck)、含药培养基和阳性药培养基的中央,封口后置于28℃生化培养箱中培养,每24h观察并记录菌丝生长直径,直到ck组接近长满培养基为止(红色毛癣菌10d,须癣毛癣菌7d,石膏样小孢子菌7d)。计算艾叶提取物对三种供试菌的抑制率、毒力方程、ec
50
值。各处理组三次生物学重复。抑制率=[(对照组菌丝生长直径
‑
处理组菌丝生长直径)/(对照组菌丝生长直径
‑
菌饼直径)]
×
100%。结果见表1,表2,图1。
[0061]
艾叶提取物对皮肤癣菌mic和mfc的测定:参照上述【最小抑菌浓度(mic)和最小杀菌浓度测定(mfc)】中所述方法,第1
‑
9孔艾叶提取物浓度依次为20、10、5、2.5、1.25、0.625、0.3125、0.15625、0.078125mg
·
ml
‑1,其余操作与上述相同,测定艾叶提取物对红色毛癣菌、须癣毛癣菌、石膏样小孢子菌的mic和mfc,结果见表2。
[0062]
表1不同浓度艾叶提取物对三种皮肤癣菌的抑制率
[0063]
菌名1.25mg
·
ml
‑12.5mg
·
ml
‑15mg
·
ml
‑110mg
·
ml
‑120mg
·
ml
‑1特比奈芬红色毛癣菌22.10%40.31%79.01%98.90%99.44%100%须癣毛癣菌21.18%31.77%62.56%81.32%100%100%石膏样小孢子菌13.19%54.46%87.23%100%100%100%
[0064]
表2艾叶提取物对三种皮肤癣菌抗菌指标测定
[0065][0066]
以上结果表明,艾叶提取物对三种皮肤癣菌的抑制效果为红色毛癣菌>石膏样小孢子菌>须癣毛癣菌,对红色毛癣菌有最低的mic和mfc,分别为2.5、10mg
·
ml
‑1。
[0067]
应用实例2:艾叶提取物的分离纯化及最佳活性组分筛选
[0068]
艾叶精制提取物的制备方法:称取一定量的艾叶提取物样品适量,利用d101型大孔吸附树脂进行分离纯化,依次用水和低浓度的乙醇水溶液(10%,20%)去除多糖、蛋白及酚酸类成分后,依次用40%、60%、95%乙醇进行洗脱,各浓度洗脱液均洗至接近无色,将洗脱所得的各分离组分在40~50℃下采用减压旋转蒸发浓缩后,置于冷冻干燥机中冷冻干燥,制得艾叶提取物40~95%乙醇分离组分样品。
[0069]
含药培养基的制备:称取上述各分离组分样品适量,加2ml乙醇溶解后加入到98ml pda培养基中,配置成2.5mg
·
ml
‑1的各分离组分含药培养基。以相同浓度的乙醇作为空白对照组(ck),用5μg
·
ml
‑1的特比奈芬作为阳性对照制得阳性药培养基。
[0070]
最佳活性组分筛选:按照上述【抑制率及毒力测定】中所述方法,选取生长速率相近的三种供试菌种,用5mm打孔器在长势均一的纯菌落边缘打孔切取菌饼,挑取菌饼至空白
对照培养基(ck)、各分离组分含药培养基和阳性药培养基的中央,封口后置于28℃生化培养箱中培养,每24h观察并记录菌丝生长直径,直到ck组接近长满培养基为止(红色毛癣菌10d,须癣毛癣菌7d,石膏样小孢子菌7d)。计算艾叶提取物各分离组分对三种供试菌的抑制率,结果见表3,图2。
[0071]
表3艾叶提取物各分离组分对三种供试菌的抑制率
[0072]
菌名40%乙醇60%乙醇95%乙醇特比萘芬红色毛癣菌18.09%91.49%100%100%须癣毛癣菌10.48%77.94%92.93%100%石膏样小孢子菌74.58%100%100%100%
[0073]
以上结果表明,艾叶提取物经大孔吸附树脂用水和低浓度乙醇除去多糖、蛋白及酚酸类成分后,40%、60%、95%乙醇分离组分对三种皮肤癣菌均有不同程度的抑制活性;60%、95%乙醇分离组分对三种皮肤癣菌抑制作用较强,其中95%乙醇分离组分对红色毛癣菌、须癣毛癣菌、石膏样小孢子菌的抑制率高达100%、92.93%、100%,与阳性对照相当,表明95%乙醇分离组分为艾叶提取物的最佳活性组分。
[0074]
应用实例3:95%乙醇分离组分抑菌活性测定
[0075]
以抗真菌药物特比萘芬为阳性对照,采用菌丝生长速率法测定95%乙醇分离组分对皮肤癣菌的抑制活性。
[0076]
含药培养基的制备:称取95%乙醇分离组分样品适量,加2ml乙醇溶解后加入到98ml pda培养基中,配置成0.039、0.078、0.156、0.3125、0.625、1.25mg
·
ml
‑1浓度梯度的的95%乙醇分离组分含药培养基。以相同浓度的乙醇作为空白对照组(ck),用5μg
·
ml
‑1的特比奈芬作为阳性对照制得阳性药培养基。
[0077]
95%乙醇分离组分对皮肤癣菌抑制率及毒力影响的测定:按照上述【抑制率及毒力测定】中所述方法,选取生长速率相近的三种供试菌种,用5mm打孔器在长势均一的纯菌落边缘打孔切取菌饼,挑取菌饼至空白对照培养基(ck)、含药培养基和阳性药培养基的中央,封口后置于28℃生化培养箱中培养,每24h观察并记录菌丝生长直径,直到ck组接近长满培养基为止(红色毛癣菌10d,须癣毛癣菌7d,石膏样小孢子菌7d)。计算95%乙醇分离组分对三种供试菌的抑制率、毒力方程、ec
50
值。各处理组三次生物学重复。抑制率=[(对照组菌丝生长直径
‑
处理组菌丝生长直径)/(对照组菌丝生长直径
‑
菌饼直径)]
×
100%。结果见表4,表5,图3。
[0078]
95%乙醇分离组分对皮肤癣菌mic和mfc的测定:参照最小抑菌浓度(mic)和最小杀菌浓度测定(mfc)】中所述方法,第1
‑
9孔95%乙醇分离组分浓度依次为5、2.5、1.25、0.625、0.3125、0.156、0.078、0.039、0.0195mg
·
ml
‑1,其余操作与上述相同,测定95%乙醇分离组分对红色毛癣菌、须癣毛癣菌、石膏样小孢子菌的mic和mfc,结果见表5。
[0079]
表4不同浓度95%乙醇分离组分对三种皮肤癣菌的抑制率
[0080][0081]
表5 95%乙醇分离组分对三种皮肤癣菌抗菌指标测定
[0082][0083]
以上结果表明,艾叶提取物大孔吸附树脂95%乙醇分离组分相较于粗提物对3种皮肤癣菌有更为显著的抑制作用,1.25mg
·
ml
‑1的浓度下对红色毛癣菌、须癣毛癣菌、石膏样小孢子菌的抑制率分别为91.89%、60.12%、100%;95%乙醇分离组分对红色毛癣菌、须癣毛癣菌、石膏样小孢子菌的mic分别为0.3125、0.625、0.3125mg
·
ml
‑1,mfc分别为2.5、5、2.5mg
·
ml
‑1,对三种皮肤癣菌具有良好的抑制生长作用。
[0084]
应用实例4:95%乙醇分离组分的成分分析
[0085]
应用实例2中“艾叶提取物分离纯化”下制备95%乙醇分离组分,采用waters高效液相色谱
‑
质谱联用进行成分分析,分析条件如下:
[0086]
色谱条件:采用waters acquity uplc hss t3色谱柱(2.1
×
100mm,1.8μm),pda检测器,柱温40℃,以含0.1%甲酸水为流动相a,以乙腈为流动相b,流速为0.5ml
·
min
‑1,进样量为1μl,流动相梯度洗脱程序如下,
[0087]
0~0.3min:2%
‑
5%b,0.3~1.0min:5%b,1.0~10.0min:5%
‑
28%b,10.0~16.0min:28%
‑
45%b,16.0~19.0min:45%
‑
70%b,19.0~20.5min:70%
‑
98%b,20.5~24.0min,98%b,24.0~24.2min:98%
‑
2%b,24.2~27.0min:2%b。
[0088]
质谱条件:采用esi负离子模式,ms
e
采集模式。毛细管电压为2000v,锥孔电压为40v,除溶剂气体为氮气,900l
·
h
‑1,除溶剂温度为450℃,离子源温度为100℃,扫描范围为50至1200质荷比,碰撞气体为氩气。低能量扫描时trap电压为6ev,高能量扫描时trap电压为50
‑
70ev。准确质量数用亮氨酸脑啡肽作校正液(554.2621)。masslynx为操作系统。
[0089]
95%乙醇分离组分的基峰离子流图谱(bpi)和uv色谱图见图4。根据各化合物的相对分子质量、二级质谱碎片信息及国内外参考文献和数据库,对95%乙醇分离组分的主要化学组成进行了分析鉴定,结果见表6。
[0090]
表6 95%乙醇分离组分的化学成分分析
[0091][0092][0093]
上述结果显示,从95%乙醇分离组分中鉴定所得11个成分,其中10个黄酮类成分,1个蒽醌类化合物,表明黄酮类成分为该组分中的主要化学物质。由uv色谱图可知,经鉴定含量较高的化学成分有异泽兰黄素、大黄素甲醚、蔓荆子黄素及棕矢车菊素,可能是该组分发挥抗菌活性的主要活性物质。
[0094]
应注意的是,以上实例仅用于说明本发明的技术方案而非对其进行限制。尽管参照所给出的实例对本发明进行了详细说明,但是本领域的普通技术人员可根据需要对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1