一种用于化妆品的苦参提取物及其制备方法与流程
1.本发明涉及化妆品生产技术领域,具体涉及一种用于化妆品的苦参提取物及其制备方法。
背景技术:
2.苦参为豆科植物苦参(sophoraflavescenes)的干燥根,广泛分布于我国南北各省,是贵州苗药的常用药材,具有悠久的药用历史。《神农本草经》记载,苦参,味苦寒,归心、肝、胃、大肠和膀胱经。主心腹结气,症瘕积聚、黄疸、溺有余沥,逐水。除痈肿,补中,明目,止泪。现代大量药理研究发现,苦参具有抗肿瘤、抗病毒、抑菌、抗炎、抗心律失常等药理作用,越来越广泛应用于肿瘤科、肝病科,妇科、皮肤科、肛肠科及心血管科疾病的治疗,且效果显著,安全性高。
3.痤疮是一种常见的累及毛囊皮脂腺的慢性炎症性皮肤病,其发病机制目前尚未完全清楚,但多数学者认为其发病因素主要包括皮脂分泌过多、毛囊漏斗部过度角化并形成角栓、痤疮丙酸杆菌过度增殖和炎症反应。痤疮丙酸杆菌被认为是致病的关键环节,最早是从痤疮患者皮损处分离而来的嗜脂性胞内寄生杆菌,常寄生在人类皮肤毛囊皮脂腺漏斗部。痤疮丙酸杆菌在代谢活动中产生的许多酶类和活性物质对皮肤细胞和组织具有损伤作用,导致毛囊漏斗壁屏障被破坏,引发痤疮炎症反应。当人体免疫细胞在受到致炎因子作用时,一些小分子量的、能在细胞间传递信息的、并且具有特异性免疫调节功能的可溶性蛋白质或多肽通过机体本身分泌出来,并能参与或引起炎症反应,这些物质被称为炎症因子,包括no、tnf
‑
α、il
‑
6、pge
‑
2、il
‑
1等。因此做好抗炎和抑菌工作,能够更有效的协助预防并控制痤疮和脂溢性皮炎等皮肤疾病。
4.传统的中药提取方法包括水煎煮法、浸渍法、渗漉法、醇提法等,并且为了提高提取率,现有技术常常采用较高的提取温度来提取。然而,较高的提取温度容易导致苦参中低熔点的生物活性物质分解,进而使其生物活性能以进一步提高。
技术实现要素:
5.为了解决上述问题,本发明旨在提供一种能够有效降低提取温度、提高活性成分含量进而提升抗炎抑菌活性的用于化妆品的苦参提取物的制备方法,包括以下步骤:
6.步骤一、对苦参进行酶解处理,获得苦参酶解物;
7.步骤二、向苦参酶解物中加入质量浓度70%~80%的乙醇,于55
‑
65℃下加热提取2
‑
6h,同时脱色,重复提取2
‑
3次后合并滤液过滤,获得苦参粗提物;
8.步骤三、将苦参粗提物过滤除杂,浓缩除溶剂,获得所述苦参提取物。
9.进一步地,所述步骤一中,酶解的步骤具体包括:向苦参中加入基于其质量2
‑
3倍的水后,加入基于苦参质量3%~5%的复合酶液,控制ph值为4.5
‑
6.5,于40
‑
45℃下搅拌酶解90
‑
180min。
10.进一步地,所述复合酶液包括酶活比例为(3
‑
9):(0.5
‑
3):(0.5
‑
2):(0.8
‑
1.5)的
木聚糖酶、淀粉酶、果胶酶和蛋白酶,所述复合酶液中总酶活为10
‑
12万u/g。
11.优选的,所述复合酶液由酶活比例为(4
‑
6):(1
‑
1.5):(0.8
‑
1):(1
‑
1.2)的木聚糖酶、淀粉酶、果胶酶和蛋白酶组成。
12.进一步地,所述步骤二中,每100g苦参制得的酶解物中,加入基于苦参质量2
‑
3倍质量的乙醇溶液。
13.优选的,所述步骤二中,采用水浴加热。
14.进一步地,所述步骤二中,脱色采用活性炭进行脱色。
15.进一步地,所述步骤三中,过滤除杂包括利用含有硅藻土和edta
‑
2na的滤饼对苦参粗提物进行真空抽滤的步骤,所述硅藻土和edta
‑
2na的质量比为(2
‑
5):(1
‑
4)。
16.优选的,真空抽滤步骤为:将不同提取次数的苦参粗提物合并冷却至约40℃进行真空抽滤,滤液减压浓缩回收乙醇,提取液浓缩至浸膏状称重。
17.进一步地,所述滤饼采用如下方法制备:将硅藻土和edta
‑
2na置于水中,搅拌均匀后真空抽滤,再用水冲洗即得。
18.优选的,制备硅藻土滤饼的步骤具体为:在烧杯里铺(硅藻土5%+edta
‑
2na 1%)先用纯水搅拌均匀真空抽滤,获得硅藻土滤饼,再用500ml纯水洗脱冲洗硅藻土滤饼,除去金属离子降底电导率,备用。
19.进一步地,所述方法还包括:将苦参提取物和1,3
‑
丙二醇、水、硅藻土搅拌混合,静置过夜后过滤,滤液用1,3
‑
丙二醇溶解,灭菌灌装。
20.另一方面,本技术还提供了采用上述制备方法制备获得的苦参提取物。
21.另一方面,本技术还提供了采用上述制备方法制备获得的苦参提取物在制备化妆品中的应用,所述化妆品包括抗炎抑菌的化妆品。
22.可选的,所述抗敏抑菌的化妆品的剂型包括但不限于水剂、乳液、霜、精华液、凝胶。
23.其中,植物复合酶预处理可以减少溶剂提取时来自细胞壁和细胞间质的阻力,加快有效成分溶出细胞的速率,提高提取效率,缩短提取时间,而且,在中药提取中酶法可作用于目标产物,改善目标产物的理化性质,提高其在提取溶剂中的溶解度,减少溶剂的用量,降低成本。"仿生化提取"是近几年提出的中药成分提取的构想,为了克服传统的高温煎煮对活性成分药效的影响,这一构想提出把提取温度降至接近人体温度,低温提取不利于植物药细胞壁的破坏,本技术中植物复合酶能担此重任,能在低温下迅速有效地破坏植物细胞壁,有助于实现中药有效成分的低温提取。
24.本发明具有如下有益效果:
25.1、本技术提供的苦参提取物的制备方法,采用特定种类和酶活比例的复合酶进行酶解后再采用特定浓度的乙醇提取,使得苦参中如苦参碱等生物碱的活性物质能够实现低温提取,降低了提取温度,显著提升提取物中抑菌有效成分的含量,进一步提高苦参提取物的抗炎抑菌活性。
26.2、本技术提供的苦参提取物的制备方法,所得产物能有效抑制痤疮丙酸杆菌的生长,同时能抑制因皮肤毛囊中的厌氧菌痤疮杆菌滋生而过度表达的il
‑
1β、tnf
‑
α和no炎症因子,一方面能够实现标本兼治,另一方面能够抗炎和抑菌作用,为其在化妆品领域的应用奠定了基础具有天然性好、无毒副作用等优势,利用简单的制备方法,提取效率高、纯度好,
提取过程中无污染,提取溶剂乙醇可回收,工艺简单。
具体实施方式
27.为了更清楚的阐释本技术的整体构思,下面以实施例的方式进行详细说明,在下文的描述中,给出了大量具体的细节以便提供对本发明更为彻底的理解。然而,对于本领域技术人员来说显而易见的是,本发明可以无需一个或多个这些细节而得以实施。在其他的例子中,为了避免与本发明发生混淆,对于本领域公知的一些技术特征未进行描述。
28.以下实施例中所采用的材料和仪器均为市售,如未特殊说明,以下实施例中的原料等级均为化妆品级,且均可通过商业途径购得。
29.另外,本发明中所述“水”包含去离子水、蒸馏水、离子交换水、双蒸水、高纯水、纯净水等化妆品领域能够使用的任何可行的水。
30.实施例1
31.该实施例提供了一种用于化妆品的苦参提取物的制备方法,具体步骤如下:
32.d1:称取的药材苦参500g,向苦参中加入基于其质量3倍的水,加入基于苦参质量3%的复合酶液,复合酶液中总酶活约为10万u/g,由酶活比例为5:1.2:0.9:1.1的木聚糖酶、淀粉酶、果胶酶和蛋白酶组成,用草酸调控ph值为5.0,于40℃下搅拌酶解100min,获得苦参酶解物;
33.d2:提取脱色除杂质,苦参酶解物无需过滤,连同液和渣直接加基于苦参质量5倍量60%乙醇加热提取,提取温度83℃,第一次提取时间1小时加入活性炭80g搅拌均匀水浴加热30min后脱色趁热过滤,第二次提取1h加入活性炭10g搅拌均匀水浴加热30min后脱色趁热过滤,除去活性炭及其他杂质,获得澄清透明溶液;
34.d3:制备硅藻土滤饼,在烧杯里铺(硅藻土2%+edta
‑
2na 4%)先用纯水搅拌均匀真空抽滤,获得硅藻土滤饼,再用300ml纯水洗脱冲洗硅藻土滤饼,除去金属离子降底电导率,备用;
35.d4:真空抽滤,将两次提取液进行冷却至30℃真空抽滤,两次滤液合并减压浓缩回收乙醇,提取液浓缩至浸膏状称重;
36.d5:称取苦参提取物(醇提取物)10%加入5%去离子水、80%的1,3丙二醇搅拌溶解,加5%硅藻土搅拌2h静至过夜;
37.d6:将样品液进行真空抽滤,抽滤完的样品液补1,3丙二醇至全重的50%,搅拌至澄清透明;
38.d7:70℃加热灭菌0.5h冷却至20℃灌装。
39.实施例2
40.该实施例提供了一种用于化妆品的苦参提取物的制备方法,具体步骤如下:
41.d1:称取的药材苦参500g,向苦参中加入基于其质量3倍的水,加入基于苦参质量3%的复合酶液,复合酶液中总酶活约为10万u/g,由酶活比例为5:1.2:0.9:1.1的木聚糖酶、淀粉酶、果胶酶和蛋白酶组成,用草酸调控ph值为5.0,于40℃下搅拌酶解100min,获得苦参酶解物;
42.d2:提取脱色除杂质,苦参酶解物无需过滤,连同液和渣直接加基于苦参质量10倍量70%乙醇回流提取,提取温度61℃,第一次提取时间3h加入活性炭60g搅拌均匀水浴加热
60min后脱色趁热过滤,第二次提取2h加入活性炭30g搅拌均匀水浴加热60min后脱色趁热过滤,除去活性炭及其他杂质,获得澄清透明溶液;
43.d3:制备硅藻土滤饼,在烧杯里铺(硅藻土5%+edta
‑
2na 1%)先用纯水搅拌均匀真空抽滤,获得硅藻土滤饼,再用500ml纯水洗脱冲洗硅藻土滤饼,除去金属离子降底电导率,备用;
44.d4:真空抽滤,将两次提取液进行冷却至40℃真空抽滤,两次滤液合并减压浓缩回收乙醇,提取液浓缩至浸膏状称重;
45.d5:称取苦参提取物(醇提取物)5%加入25%去离子水、70%的1,3丙二醇搅拌溶解,加10%硅藻土搅拌2h静至过夜;
46.d6:将样品液进行真空抽滤,抽滤完的样品液补1,3丙二醇至全重的100%,搅拌至澄清透明;
47.d7:70℃加热灭菌2h冷却至40℃灌装。
48.实施例3
49.该实施例提供了一种用于化妆品的苦参提取物的制备方法,具体步骤如下:
50.d1:称取的药材苦参500g,向苦参中加入基于其质量3倍的水,加入基于苦参质量3%的复合酶液,复合酶液中总酶活约为10万u/g,由酶活比例为5:1.2:0.9:1.1的木聚糖酶、淀粉酶、果胶酶和蛋白酶组成,用草酸调控ph值为5.0,于40℃下搅拌酶解100min,获得苦参酶解物;
51.d2:提取脱色除杂质,苦参酶解物无需过滤,连同液和渣直接加基于苦参质量15倍量75%乙醇回流提取,提取温度58℃,第一次提取时间1.5h加入活性炭70g搅拌均匀水浴加热40min后脱色趁热过滤,第二次提取2h加入活性炭20g搅拌均匀水浴加热40min后脱色趁热过滤,除去活性炭及其他杂质,获得澄清透明溶液;
52.d3:制备硅藻土滤饼,在烧杯里铺(硅藻土3%+edta
‑
2na 3%)先用纯水搅拌均匀真空抽滤,获得硅藻土滤饼,再用400ml纯水洗脱冲洗硅藻土滤饼,除去金属离子降底电导率,备用;
53.d4:真空抽滤,将两次提取液进行冷却至40℃真空抽滤,两次滤液合并减压浓缩回收乙醇,提取液浓缩至浸膏状称重;
54.d5:称取苦参提取物(醇提取物)15%加入10%去离子水、65%的1,3丙二醇搅拌溶解,加10%硅藻土搅拌2h静至过夜;
55.d6:将样品液进行真空抽滤,抽滤完的样品液补1,3丙二醇至全重的60%,搅拌至澄清透明;
56.d7:70℃加热灭菌1h冷却至30℃灌装。
57.实施例4
58.该实施例提供了一种用于化妆品的苦参提取物的制备方法,具体步骤如下:
59.d1:称取的药材苦参500g,向苦参中加入基于其质量3倍的水,加入基于苦参质量3%的复合酶液,复合酶液中总酶活约为10万u/g,由酶活比例为5:1.2:0.9:1.1的木聚糖酶、淀粉酶、果胶酶和蛋白酶组成,用草酸调控ph值为5.0,于40℃下搅拌酶解100min,获得苦参酶解物;
60.d2:提取脱色除杂质,苦参酶解物无需过滤,连同液和渣直接加基于苦参质量20倍
量80%乙醇回流提取,提取温度58℃,第一次提取时间3.5h加入活性炭50g搅拌均匀水浴加热50min后脱色趁热过滤,第二次提取1h加入活性炭30g搅拌均匀水浴加热50min后脱色趁热过滤,除去活性炭及其他杂质,获得澄清透明溶液;
61.d3:制备硅藻土滤饼,在烧杯里铺(硅藻土4%+edta
‑
2na 2%)先用纯水搅拌均匀真空抽滤,获得硅藻土滤饼,再用600ml纯水洗脱冲洗硅藻土滤饼,除去金属离子降底电导率,备用;
62.d4:真空抽滤,将两次提取液进行冷却至70℃真空抽滤,两次滤液合并减压浓缩回收乙醇,提取液浓缩至浸膏状称重;
63.d5:称取苦参提取物(醇提取物)5%加入5%去离子水、75%的1,3丙二醇搅拌溶解,加15%硅藻土搅拌2h静至过夜;
64.d6:将样品液进行真空抽滤,抽滤完的样品液补1,3丙二醇至全重的70%,搅拌至澄清透明;
65.d7:100℃加热灭菌3h冷却至20℃灌装。
66.实施例5
67.该实施例提供了一种用于化妆品的苦参提取物的制备方法,具体步骤如下:
68.d1:称取的药材苦参500g,向苦参中加入基于其质量3倍的水,加入基于苦参质量3%的复合酶液,复合酶液中总酶活约为10万u/g,由酶活比例为5:1.2:0.9:1.1的木聚糖酶、淀粉酶、果胶酶和蛋白酶组成,用草酸调控ph值为5.0,于40℃下搅拌酶解100min,获得苦参酶解物;
69.d2:提取脱色除杂质,苦参酶解物无需过滤,连同液和渣直接加基于苦参质量15倍量85%乙醇回流提取,提取温度42℃,第一次提取时间4h加入活性炭40g搅拌均匀100℃水浴加热70min后脱色趁热过滤,第二次提取2h加入活性炭20g搅拌均匀100℃水浴加热70min后脱色趁热过滤,除去活性炭及其他杂质,获得澄清透明溶液;
70.d3:制备硅藻土滤饼,在烧杯里铺(硅藻土3%+edta
‑
2na 3%)先用纯水搅拌均匀真空抽滤,获得硅藻土滤饼,再用350ml纯水洗脱冲洗硅藻土滤饼,除去金属离子降底电导率,备用;
71.d4:真空抽滤,将两次提取液进行冷却至80℃真空抽滤,两次滤液合并减压浓缩回收乙醇,提取液浓缩至浸膏状称重;
72.d5:称取苦参提取物(醇提取物)15%加入20%去离子水、60%的1,3丙二醇搅拌溶解,加5%硅藻土搅拌2h静至过夜;
73.d6:将样品液进行真空抽滤,抽滤完的样品液补1,3丙二醇至全重的80%,搅拌至澄清透明;
74.d7:70℃加热灭菌1h冷却至25℃灌装。
75.实施例6
‑876.实施例6
‑
8和实施例2的制备方法大致相同,区别仅在于,在第一步中所使用的复合酶中酶的种类和比例,或者第二步中的乙醇质量浓度不同,具体见表1。
77.对比例1
78.该对比例与实施例2的制备方法大致相同,区别仅在于,未采用第一步,直接用乙醇对苦参进行提取。
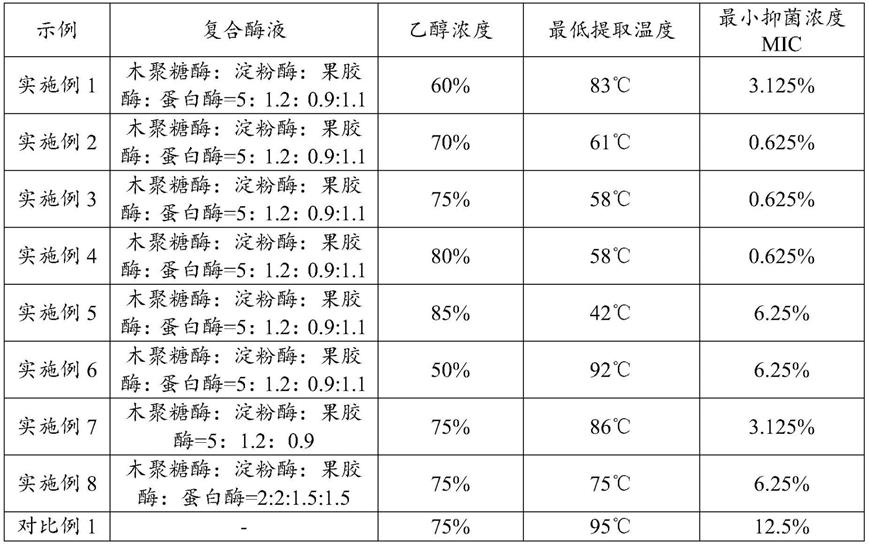
79.对上述各实施例和对比例制备获得的苦参提取物进行针对痤疮丙酸杆菌进行最小抑菌浓度的测试,具体测试方法见下文。同时,以获得的浸膏克重为指标,控制各实施例获得约100g左右(即提取率约20%)的浸膏,获得最低提取温度,所得结果见表1:
80.表1
[0081][0082]
由表1中的数据可知,在同样能够达到约20%左右的提取率的条件下,当采用复合酶液进行酶解后再用乙醇水溶液进行提取,能够在降低提取温度的同时,获得明显提升的抑菌活性。其中,实施例2
‑
4能够将提取温度降低至60℃左右,并且获得的苦参提取物中抑菌活性成分较高,最小抑菌浓度可达0.625%。
[0083]
以实施例2获得的苦参提取物为最优实施例,对其进行进一步的功效实验。
[0084]
一、抑菌试验
[0085]
1.测试依据
[0086]
参照ws/t639
‑
2018《抗菌药物敏感性试验的技术要求》4.2.1琼脂稀释法,对实例2中所得的样品进行抑菌试验。
[0087]
2.试验方法
[0088]
2.1样品配置
[0089]
a)将实例2样品加入已高压灭菌完毕且温度在40℃~50℃的tsa中,浓度分别为0.625%、0.125%、0.025%、3.125%、6.25%、12.5%、25%、50%。
[0090]
b)待琼脂和样品充分混匀后,倾注平皿。
[0091]
2.2制备菌悬液浓度为1
×
108cfu/ml~2
×
108cfu/ml,作为初始接种物。初始接种物做1:10稀释,待用。
[0092]
2.3用无菌接种环取1μl菌悬液至无样品的生长对照平皿、含样品的tsa平皿表面(低浓度到高浓度)和第二块生长对照平皿。最终菌液接种量为1
×
104cfu/点。
[0093]
2.4置于厌氧罐中36℃培养72h。
[0094]
3.抑菌效果评价
[0095]
将平皿置于黑色、无反光背景上读取结果。以抑制细菌肉眼可见生长的最低浓度为mic。若无菌落生长,则该浓度样品对痤疮丙酸杆菌有抑菌作用,若有菌落生长,则该浓度样品对痤疮丙酸杆菌无抑菌作用。
[0096]
4.试验结果
[0097]
试验设计的生长对照组平板菌苔生长正常,表明本试验系统正常,符合试验标准。样品在不同浓度下对痤疮丙酸杆菌的菌落生长抑制结果汇总如下:
[0098]
表2样品在不同浓度范围内对痤疮丙酸杆菌的菌落生长抑制结果
[0099][0100][0101]
基于痤疮丙酸杆菌,样品苦参在0.025%~0.625%浓度范围内的最小抑菌浓度(mic)为0.625%,在3.125%~50%浓度范围内未检出最小抑菌浓度(mic)。说明实施例制备获得的苦参提取物对对痤疮丙酸杆菌的菌落生长具有明显的抑制作用,进而具有改善痤疮功效。
[0102]
二、抑制炎症因子实验
[0103]
1.实验原理
[0104]
本实验通过使用lps诱导的raw264.7细胞作为体外炎症细胞模型,通过elisa试剂盒检测细胞上清液中分泌的炎症因子(il
‑
6,tnf
‑
α,no),从而评估待测3号样本的抗炎作用。
[0105]
2.试验步骤:
[0106]
2.1细胞抗炎测试
[0107]
2.1.1常规培养细胞,将细胞以密度为2.0~3.0
×
105个/孔接种于12孔板,返回培养箱培养18
‑
24h。
[0108]
2.1.2取出培养板,弃去孔中原培养液,样品组每孔加入1ml含不同浓度的3号样品和lps(1μg/ml)的培养液,模型组加入以lps(1μg/ml)作为刺激物的培养液,阳性对照加入1ml地塞米松(0.5μg/ml)和lps(1μg/ml)的培养液,对照组加入培养液,培养24
±
1h。
[0109]
2.1.3收集上清液,
‑
80℃保存,细胞因子采用elisa试剂盒进行测定。
[0110]
3.数据分析
[0111]
数据采用spss进行分析,并以均值
±
标准差表示,如果p<0.05考虑差异具有统计学意义。
[0112]
3.1细胞活性以阴性对照组(nt)细胞活性为100%,计算各组相对细胞活性(viability)。
[0113][0114]
3.2il
‑
6、tnf
‑
α、no水平以模型对照组(m)为100%,计算各组的相对含量。
[0115]
表3样品在不同组别il
‑
6差异比较
[0116][0117]
#表示与阴性对照组(nt)进行对比,差异具有统计学意义(p<0.05)
[0118]
*表示与模型对照组(m)进行对比,差异具有统计学意义(p<0.05)
[0119]
由表3中的数据可知,阴性对照组(nt)与模型组(m)相比,il
‑
6含量明显降低35.07%(p<0.05);阳性对照组(pc)与模型组相比,il
‑
6相对含量明显降低37.03%(p<0.05),提示造模成功;在3号样本组(ta)苦参提取物0.195%的浓度下,与模型组相比il
‑
6相对含量显著降低29.42%(p<0.05)。
[0120]
表4样品在不同组别tnf
‑
α差异比较
[0121][0122]
#表示与阴性对照组(nt)进行对比,差异具有统计学意义(p<0.05)
[0123]
*表示与模型对照组(m)进行对比,差异具有统计学意义(p<0.05)
[0124]
由表4中的数据可知,阴性对照组(nt)与模型组(m)相比,tnf
‑
α含量明显降低75.89%(p<0.05);阳性对照组(pc)与模型组相比,tnf
‑
α相对含量明显降低77.77%(p<0.05),提示造模成功;在3号样本组(ta)苦参提取物0.106%的浓度下,与模型组相比tnf
‑
α相对含量显著降低70.81%(p<0.05)。
[0125]
表5样品在不同组别no差异比较
[0126][0127]
#表示与阴性对照组(nt)进行对比,差异具有统计学意义(p<0.05)
[0128]
*表示与模型对照组(m)进行对比,差异具有统计学意义(p<0.05)
[0129]
由表5中的数据可知,阴性对照组(nt)与模型组(m)相比,no含量明显降低78.64%(p<0.05);阳性对照组(pc)与模型组相比,no相对含量明显降低44.48%(p<0.05),提示造模成功;在3号样本组(ta)苦参提取物”0.195%、0.120%和0.106%的浓度下,与模型组相比no相对含量分别显著降低69.79%、66.34%和72.48%(p<0.05)。
[0130]
苦参提取物样品在此次测试中表现出抗炎活性。通过抑制上述三种促炎症因子,可以起到防治或改善因厌氧菌痤疮杆菌滋生所造成的肌肤炎症的问题。
[0131]
综上所述,本技术提供的植物提取物,采用中药植物来源,具有天然性好、无毒副作用、温和不刺激的优势。并且经实验室测试可知,酶解与醇提结合,实现了较低温度下高产率的提取高生物活性的苦参提取物的效果,且所得产物能有效抑制痤疮丙酸杆菌的生长,同时能抑制因皮肤毛囊中的厌氧菌痤疮杆菌滋生而过度表达的il
‑
1β、tnf
‑
α和no炎症因子,一方面能够实现标本兼治,另一方面能够抗炎和抑菌作用,为其在制备痤疮抑制药物或抗炎护肤品领域的应用奠定了基础。
[0132]
以上所述仅为本技术的实施例而已,并不用于限制本技术。对于本领域技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原理之内所作的任何修改、等同替换、改进等,均应包含在本技术的权利要求范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1