羟基红花黄色素A口服半固体胶囊及其制备方法和应用与流程
羟基红花黄色素a口服半固体胶囊及其制备方法和应用
技术领域
1.本发明涉及药物制剂技术领域,尤其涉及羟基红花黄色素a口服半固体胶囊及其制备方法和应用。
背景技术:
2.羟基红花黄色素a(hydroxysafflor yellow a)是从中药红花中分离出的黄酮类天然产物,其是红花的水溶性成分,具有抑制血小板聚集、抗氧化、抗炎等多种药理学活性。羟基红花黄色素a为生物药剂学分类系统(biopharmaceutics classification system,bcs)中的第ⅲ类药物,即高溶解性、低渗透性药物,其透膜吸收机理主要为被动扩散。因此,为提高生物利用度,很多研究都着眼于改善脂溶性,从而提高跨膜吸收。然而,其logp=2.98,表明其已经具有一定的膜通透性。因此,单纯从改善脂溶性来提高生物利用度有一定的局限性,并且这类制剂开发比较复杂,研发成本高。
3.由于羟基红花黄色素a属于高溶低渗药物,因此口服生物利用度较低,多被开发为注射剂。由于注射剂自身使用的便捷性、安全性、患者耐受性等限制因素,使得羟基红花黄色素a口服制剂的开发具有更好的市场前景。羟基红花黄色素a的现有制剂研究包括:固体脂质纳米粒、自微乳、磷脂复合物、纳米乳等方法,如现有技术中公开了使用了peg400,泊洛沙姆188等,来改善羟基红花黄色素a生物利用度,但提升吸收的效果有限。另外,固体脂质纳米粒、自微乳、纳米乳等多适用于非胃肠道给药,和口服给药方式差别很大。目前常用于提高bcs第ⅲ类药物口服生物利用度的常规辅料多为油脂类辅料,其生产放大难度大,产品稳定性差,生物利用度提升效果有限。目前本领域仍然存在开发具有改善的生物利用度的羟基红花黄色素a口服制剂的需求。
技术实现要素:
4.为了解决上述技术问题,本发明提供一种羟基红花黄色素a口服半固体胶囊及其制备方法和应用,本发明提供的羟基红花黄色素a口服半固体胶囊具有改善的生物利用度,具有很好的应用前景。
5.具体的,本发明首先提供一种羟基红花黄色素a口服半固体胶囊,包括:羟基红花黄色素a和载体;其中,所述载体包含质量比为15~25:1~5的gelucire 44/14和gelucire 50/13。本发明首次将应用于水溶性差的药物的gelucire 50/13和gelucire 44/14以一定质量比应用于水溶性强的羟基红花黄色素a能提高羟基红花黄色素a的生物利用度。
6.根据本发明提供的所述的羟基红花黄色素a口服半固体胶囊,所述载体包含质量比为15~25:5~15:1~5的gelucire 44/14、gelucire 43/01和gelucire 50/13;优选为20:10~15:2。本发明中,相比于单个载体gelucire 44/14,使用由gelucire 44/14、gelucire 43/01和gelucire 50/13组成的载体组合制备的羟基红花黄色素a半固体口服胶囊能显著地提高羟基红花黄色素a的生物利用度,具有促进吸收的协同增效作用。与之相比,其他载体的组合,例如gelucire 50/13和captex 8000对于羟基红花黄色素a的吸收并
未起到协同增效作用。
7.根据本发明提供的所述的羟基红花黄色素a口服半固体胶囊,所述载体还包含labrafil m1944cs、labrafil m2125cs、captex 8000中的一种或多种。本发明中,除这上述三种gelucire载体组合之外,添加labrafil m1944cs、labrafil m2125cs、captex 8000中的一种或多种,能进一步提高羟基红花黄色素a的生物利用度。其中,labrafil m2125cs与gelucire 44/14、gelucire 43/01、gelucire 50/13在促进羟基红花黄色素a的吸收过程中起到了协同增效作用。
8.根据本发明提供的所述的羟基红花黄色素a口服半固体胶囊,所述载体包含质量比为15~25:5~15:1~5:2~10:0~5gelucire 44/14、gelucire 43/01、gelucire 50/13、labrafil m1944cs和captex 8000。
9.根据本发明提供的所述的羟基红花黄色素a口服半固体胶囊,所述羟基红花黄色素a与所述载体的质量比为1:2~30。
10.根据本发明提供的羟基红花黄色素a口服半固体胶囊,与非脂基的传统口服固体制剂相比,本发明还能显著提高羟基红花黄色素a的透膜吸收,并且此口服制剂具备缓释作用。本发明方法还具有制备简便、成本较低、生物利用度高、安全性好以及适合工业放大生产要求等特点。
11.本发明还提供一种所述的羟基红花黄色素a口服半固体胶囊的制备方法,包括以下步骤:
12.1)将上述羟基红花黄色素a与所述载体混和,得到液体状态共熔物;
13.2)将所述液体状态共熔物放入硬胶囊体中,室温冷却,合并囊帽,得到羟基红花黄色素a口服半固体胶囊。
14.根据本发明提供的所述的羟基红花黄色素a口服半固体胶囊的制备方法,步骤1)中,将所述载体中的各组分进行第一混合,制备所述载体的熔融混合物,将所述羟基红花黄色素a与所述熔融混合物进行第二混合,得到所述液体状态共熔物;或,将所述载体中的部分组分与所述羟基红花黄色素a进行第一混合,得到部分共融物,然后将所述部分共融物与所述载体中剩余组分共同或分步混合熔融,得到所述液体状态共熔物。
15.根据本发明提供的所述的羟基红花黄色素a口服半固体胶囊的制备方法,所述第一混合为通过溶剂法或加热共熔融法进行混合;和/或,所述第二混合在恒温水浴中混合,任选地,所述第二混合在搅拌下进行的。
16.本发明还提供所述的羟基红花黄色素a半固体口服胶囊在制备心脑血管疾病的药物的用途。
17.根据本发明提供的所述的羟基红花黄色素a半固体口服胶囊在制备药物的用途,所述心脑血管疾病选自心肌缺血、脑缺血、冠心病和脑血栓中的一种或多种。
18.本发明的有益效果至少在于:本发明使用特定种类的gelucire、labrafil和/或captex等辅料产品作为载体制备的羟基红花黄色素a半固体口服胶囊能显著地提高羟基红花黄色素a的生物利用度。与非脂基的传统口服固体制剂相比,本发明能显著提高羟基红花黄色素a的透膜吸收,并且具备缓释作用。本发明制备的口服半固体胶囊能够使药物在体内较长时间维持有效浓度,也使得本发明的制剂策略对生物利用度的提升更加有效,为该药物临床应用的安全性和有效性奠定了基础。本发明方法具有制备简便、成本较低、生物利用
度高、安全性好以及适合工业放大生产要求等特点,具有非常好的应用前景。
附图说明
19.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中需要使用的附图作简单介绍,显而易见,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
20.图1为本发明实施例中用于处方高通量筛选的体外franz-pampa透膜吸收模型的franz-chamber图。
21.图2为本发明实施例中评价羟基红花黄色素a固体分散体肠吸收率的大鼠外翻肠囊模型示意图。
22.图3为本发明实施例中评价大鼠外翻肠囊活性和完整性的葡萄糖转运实验结果图。
23.图4为本发明实施例中羟基红花黄色素a固体分散体的外翻肠囊法吸收测定结果图(*p《0.05,***p《0.0001,ns:不显著)。
具体实施方式
24.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,以下实施例用于说明本发明,但不用来限制本发明的范围。
25.实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。除非另外说明,否则百分比和份数按重量计算。
26.根据本发明提供的实施例,固体分散体是指将药物高度分散于固体载体中形成的一种以固体形式存在的分散系统。药物的粒径在1~100微米。常用的固体分散体载体有聚维酮、羟丙甲纤维素、聚乙二醇、聚乙烯吡咯烷酮、泊洛沙姆等。新型的固体分散体辅料如:gelucire等属于非离子型水分散性表面活性剂,它是由确定比例的脂肪酸甘油单酯、二酯、三酯和脂肪酸聚乙二醇单酯、二酯组成的混合物,平均相对分子质量在300~1500之间。gelucire 44/14在室温下外观呈蜡状半固体,熔点为44℃。同时,也是一种混合辅料,在胃肠道中接触胃肠道粘液层后可以产生自乳化效果。而gelucire 50/13性质与gelucire 44/14上述特性类似,但其熔点更高,水分散速度慢。gelucire 43/01是一种缓释骨架材料,可延长药物在体内的半衰期,进而提高药效。labrafil m1944cs、labrafil m2125cs在常温下为液体状。captex 8000为吸收促进剂,其hlb值为7,可促进药物的透膜吸收,同时其熔点为9-10℃,常温下为液态,可用于调节处方的整体流动性。本发明首次将现有技术中应用于水溶性差的药物的gelucire 50/13和gelucire 44/14应用于水溶性强的羟基红花黄色素a,以提高其生物利用度。本发明首次发现相比于单个载体gelucire 44/14,使用由gelucire 44/14、gelucire 43/01和gelucire 50/13组成的载体组合制备的羟基红花黄色素a半固体口服胶囊能显著地提高羟基红花黄色素a的生物利用度。另外,除这三种载体组合之外,辅料中添加labrafil m1944cs、labrafil m2125cs、captex 8000中的一种或多种,能进一步
提高羟基红花黄色素a的生物利用度。本发明使用的gelucire 44/14和现有技术中应用的labrasol性质差异很大。例如,labrasol除本身具有p-糖蛋白的外排作用外,作为制剂载体并不适用于高极性药物(例如:羟基红花黄色素a),因为labrasol属于o/w型表面活性剂。并且labrasol的hlb值为12,并不利于跨膜转运。
27.根据本发明提供的实施例,对于制剂研发而言,多种辅料的添加是需要进行工艺及处方优化的,以期达到最优的药效。对于难溶性药物,通常以溶出度为处方优化指标。然而对于水溶性药物而言,其限制药效的关键点在于吸收转运。其优化工具按照由体外至体内的级别大致可划分为,in silica,in vitro(cell culture lines细胞,artificial membranes人造膜),离体(excised tissues离体器官),和in vivo(动物体内)等方法。in silica方法缺乏实践基础,且结果输出并不稳定。in vivo的方法虽能够最真实的体现药物的吸收情况,但研究过程复杂,且涉及试验动物的伦理要求,不适用于大量的处方筛选过程。因此,in vitro和离体便成为了处方筛选的有利工具。尽管人造膜和细胞(例如:caco2)在化合物筛选方面均有大量的应用,但细胞培养周期长成本高,对于药物制剂处方的模拟体内吸收而言,无法模拟体内的肠蠕动,因此并不适合高通量的处方筛选。人造膜虽然是相对低成本的高通量筛选方法,但其并不能完全模拟肠道的真实环境,因为其缺乏肠道特有的生物酶,其与细胞模型相比有劣势。然而,对于大多数以被动扩散为主要转运方式的药物而言,人造膜完全可以满足进行初步高通量筛选的要求。
28.根据本发明提供的实施例,人造膜的品种类型较多,但与细胞模型情况类似,大多预制于多孔板上,其缺乏模拟体内的肠蠕动的效果和适宜的温度控制。为了改善这一问题,利用将人造膜安装于franz chamber的方法来进行处方筛选(见图1),尤其是bcs3类药物处方的筛选将成为有益的尝试。也是本发明的创新点之一。其具体方法为:
29.人工膜的制备,其组成为:e80(1.70%),正丁醇(96.2%)和胆固醇(2.10%)浸渍于millipore滤纸(醋酸-硝酸纤维素酯,0.025μm孔径,70%孔隙率,105μm厚度,47mm直径),(膜重增加95-105%)。将人工膜插入franz扩散池,使其连接供体和受体室,两者均充满100ml ph 7.4磷酸盐缓冲溶液,温度控制在37
±
0.5℃,并通过循环水泵维持温度稳定及franz扩散池的蠕动。每一种被检测的药物处方以固定的浓度加入供体室,并在确定的时间间隔内,从受体室中提取样品,在最大吸收λmax(uv-vis 1601shimadzu)处进行光谱定量。在扩散实验中,膜的成分不干扰药物的测定。每个实验至少重复三次,并将结果取平均值。最后,筛选后的优化处方,可使用离体模型进行吸收效果的验证和确认,因为该方法能够更好地表征药物处方的体内吸收效果的同时,极大地减少试验动物用量,是高通量药物处方研究的有益实践。
30.实施例1
31.本实施例提供一种羟基红花黄色素a口服半固体胶囊,其制备包括以下步骤:
32.(1)将gelucire 44/14、gelucire 43/01、gelucire 50/13按照100g:75g:10g的投料量(质量比为20:15:2)加入烧杯中,加热至52℃共熔,然后持续搅拌30min,其比例的确定是通过franz-pampa透膜吸收模型进行筛选的。
33.(2)将羟基红花黄色素a富集片段68.57g(含68%羟基红花黄色素a)加入至步骤(1)的熔融混合物中(羟基红花黄色素a富集片段重量占比30%),搅拌10min使其充分混合熔融,并恒温水浴下搅拌平衡10min。
34.(3)将步骤(2)的熔融混合物分装至400粒的0号空心明胶胶囊中,室温冷却并关闭囊帽。
35.实施例2
36.本实施例提供一种羟基红花黄色素a口服半固体胶囊,其制备包括以下步骤:
37.(1)将gelucire 44/14、gelucire 50/13、captex 8000按照100g:10g:10g的投料量(质量比为20:2:2)加入烧杯中,加热至52℃共熔,然后持续搅拌30min,其比例的确定是通过franz-pampa透膜吸收模型进行筛选的。
38.(2)将羟基红花黄色素a富集片段51.43g(含68%羟基红花黄色素a)加入至步骤(1)的熔融混合物中(羟基红花黄色素a富集片段重量占比30%),搅拌10min使其充分混合熔融,并恒温水浴下搅拌平衡10min。
39.(3)将步骤(2)的熔融混合物分装至300粒的0号空心明胶胶囊中,室温冷却并关闭囊帽。
40.实施例3
41.本实施例提供一种羟基红花黄色素a口服半固体胶囊,其制备包括以下步骤:
42.(1)将gelucire 44/14、gelucire 43/01、gelucire 50/13、labrafil m2125cs按照100g:75g:10g:25g的投料量(质量比为20:15:2:5)加入烧杯中,加热至52℃共熔,然后持续搅拌30min,其比例的确定是通过franz-pampa透膜吸收模型进行筛选的。
43.(2)将羟基红花黄色素a富集片段90.00g(含68%羟基红花黄色素a)加入至步骤(1)的熔融混合物中(羟基红花黄色素a富集片段重量占比30%),搅拌10min使其充分混合熔融,并恒温水浴下搅拌平衡10min。
44.(3)将步骤(2)的熔融混合物分装至500粒的0号空心明胶胶囊中,室温冷却并关闭囊帽。
45.实施例4
46.本实施例提供一种羟基红花黄色素a口服半固体胶囊,其制备包括以下步骤:
47.(1)将gelucire 44/14、gelucire 43/01、gelucire 50/13、labrafilm1944cs按照100g:75g:10g:25g的投料量(质量比为20:15:2:5)加入烧杯中,加热至52℃共熔,然后持续搅拌30min,其比例的确定是通过franz-pampa透膜吸收模型进行筛选的。
48.(2)将羟基红花黄色素a富集片段90.00g(含68%羟基红花黄色素a)加入至步骤(1)的熔融混合物中(羟基红花黄色素a富集片段重量占比30%),搅拌10min使其充分混合熔融,并恒温水浴下搅拌平衡10min。
49.(3)将步骤(2)的熔融混合物分装至500粒的0号空心明胶胶囊中,室温冷却并关闭囊帽。
50.实施例5
51.本实施例提供一种羟基红花黄色素a口服半固体胶囊,其制备包括以下步骤:
52.(1)将gelucire 44/14、gelucire 43/01、gelucire 50/13、captex 8000按照100g:75g:10g:25g的投料量(质量比为20:15:2:5)加入烧杯中,加热至52℃共熔,然后持续搅拌30min,其比例的确定是通过franz-pampa透膜吸收模型进行筛选的。
53.(2)将羟基红花黄色素a富集片段90.00g(含68%羟基红花黄色素a)加入至步骤(1)的熔融混合物中(羟基红花黄色素a富集片段重量占比30%),搅拌10min使其充分混合
熔融,并恒温水浴下搅拌平衡10min。
54.(3)将步骤(2)的熔融混合物分装至500粒的0号空心0号明胶胶囊中,室温冷却并关闭囊帽。
55.实施例6
56.本实施例提供一种羟基红花黄色素a口服半固体胶囊,其制备包括以下步骤:
57.(1)将gelucire 44/14、gelucire 43/01、gelucire 50/13、labrafil m2125cs、captex 8000按照100g:75g:10g:25g:10g的投料量(质量比为20:15:2:5:2)加入烧杯中,加热至52℃共熔,然后持续搅拌30min,其比例的确定是通过franz-pampa透膜吸收模型进行筛选的。
58.(2)将羟基红花黄色素a富集片段94.29g(含68%羟基红花黄色素a)加入至步骤(1)的熔融混合物中(羟基红花黄色素a富集片段重量占比30%),搅拌10min使其充分混合熔融,并恒温水浴下搅拌平衡10min。
59.(3)将步骤(2)的熔融混合物分装至500粒的0号空心明胶胶囊中,室温冷却并关闭囊帽。
60.对比例1
61.将100g gelucire 44/14加热至50℃熔融,持续搅拌30min。
62.(2)将羟基红花黄色素a富集片段42.86g(含68%羟基红花黄色素a)加入至步骤(1)的熔融混合物中(羟基红花黄色素a富集片段重量占比30%),其比例的确定是通过franz-pampa透膜吸收模型进行筛选的。然后,搅拌10min使其充分混合熔融,并恒温水浴下搅拌平衡10min。
63.(3)将步骤(2)的熔融混合物分装至200粒的0号空心明胶胶囊中,室温冷却并关闭囊帽。
64.实验例1(肠吸收试验对比)
65.本发明所制备的羟基红花黄色素a对比例1和具体实施例1、2、3、6制得的产品,通过体外翻肠法进行了吸收率的比较研究和讨论。
66.按实施例中所述的羟基红花黄色素a固体分散体的制备方法,制得的羟基红花黄色素a固体分散体处方1、2、3、6。处方中羟基红花黄色素a富集片段与载体的含量比例为3:7(w/w)。采用如图2所示的大鼠外翻肠囊模型进行吸收测定。详细方法如下:
67.选取体重200g
±
20g的雄性大鼠(sprague dawley)三只,实验前禁食12小时。处死大鼠,沿腹中线剪开大鼠皮肤和肌肉。分离大鼠回肠部分,去除肠系膜,并清洗内容物(用预冷含氧生理盐水),将肠段成3-5cm,用细玻璃棒将肠内外翻转使小肠粘膜侧向外。然后,用棉线结扎一端,另一端用棉线固定于空心管上。
68.在该实验进行前,对孵育条件下肠囊的完整性进行了葡萄糖转运实验。其方法为:使用葡萄糖测定试剂盒(sigma,glucose(go)assay kit,usa)测量浆膜侧和粘膜侧的d-葡萄糖浓度。在37℃的krebs-ringer缓冲液中孵育0,30,60,90min后取样检测。结果如图3所示,粘膜侧的葡萄糖经肠壁转运进入浆膜侧,使浆膜侧葡萄糖浓度增加。60min后,浆膜侧的葡萄糖浓度水平下降,表明肠囊的活性降低。因此,60min被确定为后续实验的孵育时长。
69.新制备的肠囊外侧加入50ml,37℃的krebs-ringer缓冲液,用1ml注射器从空心管口向囊内注入200μl,37℃的krebs-ringer缓冲液,并持续通入95%氧气供氧。将上述对比
例1和具体实施例1、2、3、6中的处方制剂各加入到肠囊中孵育60min。每个处方重复制备6个肠囊进行实验。
70.孵育60min后用1ml注射器从细软空心管口吸取囊内样品液400μl,加200μl甲醇,涡旋后,9000rpm离心5min并取上清。采用hplc-uv分析方法进行定量分析。简要概括为:色谱条件agilent sb-c18色谱柱(250
×
4.6mm,5μm);流动相:甲醇-乙腈-0.05m kh2po4(23-2-75);检测波长403nm;流速1m l
·
min-1,柱温40℃;进样量100μl。
[0071][0072]
实验结束后测量并按式(1)计算肠道的吸收率。式(1)所示公式计算反映肠道吸收率的表观渗透系数(p
app
)。式中,p
app
单位为
×
10-6
cm/s,q是整个孵育时间羟基红花黄色素a的渗透的总量(μg),a是肠面积(cm2),c是药物初始浓度μg/cm3,t是外翻肠囊法研究的时间(s)。外翻肠囊法测试结果详见图4。其中(a)为对比例1制备的制剂产品。(b)、(c)、(d)、(e)分别为实施例1、2、3、6制备的产品。五组p
app
值进行了one way-anova检测并进行tukey
′
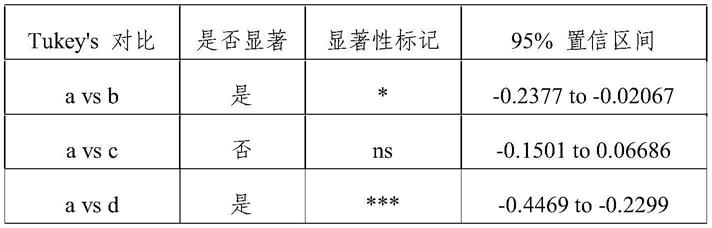
s post hoc对比。发现,与(a)相比,(b)的吸收率具有显著性增长,具有促进吸收的协同增效作用,推测gelucire 44/14、gelucire 43/01、gelucire 50/13在羟基红花黄色素a的吸收过程中起到了增加透膜吸收和(或)抑制p-gp外排的作用。(c)与(a)相比,(c)的吸收有一定增长,但增长较小,表明gelucire 44/14、gelucire 50/13和captex 8000对于羟基红花黄色素a的吸收协同增效作用不显著。与制剂(b)相比,制剂(d)和(e)的肠道吸收率分别提高了2.66和3.13倍,表明labrafil m2125cs的加入不仅进一步抑制了p-gp外排的作用,也从hlb值上增加了药物的透膜吸收,同时labrafil m2125cs与gelucire 44/14、gelucire 43/01、gelucire 50/13在促进羟基红花黄色素a的吸收过程中起到了协同增效作用。处方(d)和(e)的吸收率相比,(e)进一步提高了1.18倍。e更有利于工艺的生产放大,然而,该提高相对来讲并不具有统计学显著性。这说明captex 8000的加入对吸收提高并不显著,同时,captex 8000并不具有和其他四种组分gelucire 44/14、gelucire 43/01、gelucire 50/13、labrafil m2125cs的协同增效作用。captex8000作为脂基辅料,其加入处方虽然可能对吸收有所影响,但其功能更主要的体现为助流,便于生产制备工艺的实现。
[0073]
表1五组制剂的翻肠吸收率测定结果统计分析。
[0074]
[0075][0076]
其中:*:p《0.05,***:p《0.0001,ns:不显著。
[0077]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1