一种CLP257在制备防治焦虑的药物中的应用
一种clp257在制备防治焦虑的药物中的应用
技术领域
1.本发明涉及一种clp257在制备防治焦虑的药物中的应用。
背景技术:
2.全身麻醉具有镇痛、镇静、缓解焦虑等优点,全球有越来越多的婴幼儿在接受全身麻醉的情况下进行手术。近年随着研究的深入,人们发现由于发育大脑的特殊性(神经元分裂分化、突触发生和神经元成熟率较低等),发育期麻醉暴露可能会导致神经功能受损。氯胺酮(ketamine,ktm)作为临床上常用的麻醉药,由于成本低、起效快,作用时间长和对呼吸和循环系统影响较小等特性,在儿科患者的麻醉、镇痛和镇静中应用广泛。随着氯胺酮在临床上广泛应用,多项研究发现发育期氯胺酮暴露可能会导致焦虑。
3.焦虑症是临床常见的精神心理性疾病,在精神障碍类疾病中患病率居首位,主要表现为广泛和持续性的焦虑状态,反复发作的惊恐以及自主神经功能紊乱和运动性不安等,适度的焦虑使人能够对可能出现的危险做出快速反应,但持续性的、与实际危险不成比例的焦虑可能会造成正常功能的紊乱,并导致重大的社会和个人负担。目前治疗焦虑症的药物较少,作用靶点主要集中于儿茶酚胺系统、五羟色胺(serotonin,5
‑
ht)系统以及去甲肾上腺素(norepinephrine,ne)系统等,而且针对上述靶点的药物的治疗效果并不理想,且长期服用后会产生一系列不良反应。为了改进焦虑症的治疗策略,需要彻底了解焦虑情绪的潜在机制。
4.海马位于大脑丘脑与内侧颞叶之间,属于中脑边缘系统的一部分,海马根据细胞形态和纤维联系可以分为ca1、ca2、ca3和齿状回。按照海马背腹轴可将海马分为背侧海马(dh)和腹侧海马(vh),之前的解剖学研究表明,背侧海马和腹侧海马的输入和输出神经投射差异较大,背侧海马广泛投射到联合皮质区,而腹侧海马投射到与自主神经、神经内分泌和情绪调节有关的脑区,如前额皮质、杏仁核和下丘脑等,多项研究证明腹侧海马ca1(vca1)锥体神经元和焦虑成正相关。
5.na
+
‑
k
+
‑
2cl
‑
协同转运蛋白1(na
+
–
k
+
–
2cl
‑
cotransporter isoform1,nkcc1)则广泛分布于多种组织中,包括胃、心脏、骨骼肌、肺、脑以及肾脏,介导na
+
、k
+
和cl
‑
向细胞内的转运。k
+
‑
cl
‑
协同转运蛋白2(k
+
–
cl
‑
cotransporter isoform 2,kcc2)在大多数成熟的哺乳动物中枢神经元中大量表达,介导k
+
和cl
‑
向细胞外的转运。多项研究发现nkcc1和kcc2共同调节中枢神经系统gaba的功能。gaba
a
受体(gaba
a
rs)广泛分布于神经受体,是中枢神经系统主要的抑制性受体。gaba
a
受体是配体门控的cl
‑
通道,gaba激动该受体引起cl
‑
通道开放。nkcc1激活可致胞内cl
‑
浓度升高,而kcc2激活可致胞内cl
‑
浓度降低。正常成熟中枢神经元nkcc1/kcc2比值较少,神经元胞内cl
‑
浓度较低,gaba
a
受体调节的cl
‑
通道开放引起cl
‑
内流(神经元超极化),gaba作为为抑制性神经递质。当nkcc1/kcc2比值较大时,胞内cl
‑
浓度较高,gaba
a
受体调节的cl
‑
通道开放时cl
‑
外流(神经元去极化),gaba转变兴奋性神经递质,有研究发现nkcc1/kcc2增加时可导致海马锥体神经元兴奋性增加。
6.发育期氯胺酮多次暴露可引起腹侧海马nkcc1/kcc2增加,nkcc1/kcc2通过增加
vca1锥体神经元的兴奋性而导致焦虑。
技术实现要素:
7.针对上述现有技术存在的问题,本发明提供一种clp257在制备防治焦虑的药物中的应用。
8.为了实现上述目的,本发明采用的一种clp257在制备防治焦虑的药物中的应用。
9.作为改进,所述防治焦虑的药物是防治发育期氯胺酮多次暴露所导致的焦虑的药物。
10.作为改进,所述药物是以clp257为活性成分,加上药学上可接受的辅料制备而成的药剂。
11.作为改进,所述药剂是注射制剂。
12.作为改进,所述注射制剂含有clp257溶液。
13.作为改进,所述clp257溶液的浓度为500μm。
14.作为改进,采用的辅料为生理盐水与二甲基亚砜按体积比10:1混合。
15.本发明的原理:发育期氯胺酮多次暴露可引起腹侧海马nkcc1/kcc2增加,nkcc1/kcc2通过增加vca1锥体神经元的兴奋性而导致焦虑。kcc2激动剂clp257通过抑制vca1锥体神经元而缓解发育期氯胺酮多次暴露所致的焦虑。
16.与现有技术相比,本发明通过抑制发育期氯胺酮多次暴露小鼠腹侧海马ca1(vca1)锥体神经元的兴奋性,从而发挥缓解焦虑的作用,且clp257能够缓解焦虑行为是采用行为学实验、细胞学和分子生物学实验相结合的方法得到充分证明的。
附图说明
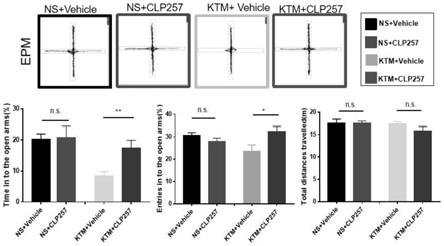
17.图1显示vca1脑区给予kcc2激动剂clp257对发育期氯胺酮多次暴露小鼠焦虑样行为的影响;
18.图2为westernblot检测发育期氯胺酮多次暴露小鼠腹侧海马nkcc1/kcc2变化;
19.图3为发育期氯胺酮多次暴露小鼠vca1锥体神经元兴奋性变化;
20.图4显示化学遗传抑制vca1锥体神经元对发育期氯胺酮多次暴露小鼠焦虑样行为的影响;
21.图5为kcc2激动剂clp257对发育期氯胺酮多次暴露小鼠vca1锥体神经元兴奋性的影响。
具体实施方式
22.为使本发明的目的、技术方案和优点更加清楚明了,下面对本发明进行进一步详细说明。但是应该理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限制本发明的范围。
23.实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
24.研究动物:成年昆明小鼠,由徐州医科大学实验动物中心提供。按照雌雄比例2:1~3:1合笼交配使母鼠受孕,合笼后第2~6天上午检查有无阴道栓子;母鼠受孕后阴道口可
见乳白色阴道栓,此时记为孕0.5(embryonic 0.5,e0.5);孕鼠自然分娩即新生小鼠出生当日记为出生后第0天(postnatal day 0,p0),新生小鼠断奶前(即p21~p24)由母鼠喂养,断奶后普通饲料喂养。
25.发育期多次氯胺酮暴露给药方法:将p6天同窝昆明小鼠按随机数字表法随机分为生理盐水组和氯胺酮组,氯胺酮组采用腹腔注射(i.p)给药,单次剂量为100mg/kg;生理盐水组每次腹腔注射与氯胺酮组相同体积的生理盐水,每日于12:00~14:00pm注射一次,连续注射六天。两组动物每次注射完毕后,分别用单独的鼠笼饲养,放置在安静的空调房内,加强保温,室温保持在25
±
1℃,注意观察小鼠皮肤颜色变化,防止发生低氧血症,待小鼠翻正反射恢复后放回原来的鼠笼。
26.脑区置管:氯胺酮组与生理盐水组小鼠p32天时,麻醉后将其快速固定于stoelting立体定位仪上。判断固定完成的标准为提尾或适度摆动小鼠脑袋不能移动且颅顶水平。以前囟为标准确定零点,根据p32天昆明小鼠vca1区坐标(ap:
‑
2.90,ml:
±
3.25,dv:
‑
4.20)进行定位植入给药套管。
27.高架十字迷宫实验:脑区置管7天后进行高架十字迷宫实验,实验前1h经套管给予kcc2激动剂clp257(400nl,500μm,100μl/min)。实验在距离地面75cm的高架十字迷宫中进行,迷宫由一对开臂(30cm长
×
5cm宽
×
18cm高)、一对闭臂(30cm长
×
5cm宽
×
18cm高)及两臂交叉的中央区(5cm长
×
5cm宽)组成。实验时间为测试日上午08:00~12:00am,实验前将小鼠置于安静的实验环境中适应30~60分钟。测试时将小鼠放置于中央区,面朝开臂,让其自由活动,测试时间为5分钟。记录小鼠进入开放臂次数(要求两只前爪进入其中)、进入闭臂次数、开臂停留时间和距离、闭臂停留时间及距离,以此来评估小鼠的焦虑样情绪。每只小鼠结束后用75%酒精擦拭迷宫底面与箱壁,避免其残留气味影响下一只小鼠的测试结果。如图1所示,与ktm+vehicle组相比,ktm+clp257组小鼠在开放臂的探索时间百分比增加107.14%(p<0.01),进入次数百分比增加38.19%(p<0.05),提示kcc2激动剂clp257起到缓解焦虑的作用。
28.western blot检测按常规步骤进行:p35提取小鼠腹侧海马脑组织蛋白,检测结果如图2所示,与生理盐水组相比,氯胺酮组小鼠腹侧海马kcc2表达下调(p<0.05),nkcc1无明显变化(p>0.05),nkcc1/kcc2增加(p<0.01)。
29.免疫荧光检测信号分子完整操作流程:p35天小鼠使用水合氯醛(350mg/kg)腹腔注射麻醉,固定四肢、开胸暴露心脏,由左室心尖部插入头皮针至升主动脉、剪开右心耳、灌注生理盐水(约10ml),直至肝脏变白,右心耳流出的液体透明,再以4%多聚甲醛灌注直至下肢、鼠尾变硬(约20ml)。随即断头、开颅、取全脑,将全脑置于4℃的4%多聚甲醛后固定6~8h,后将脑组织放置在4℃。将全脑依次移入含20%和30%蔗糖的磷酸盐缓冲液中进行梯度脱水,置于4℃冰箱中至组织块沉底,此操作可减少快速冷冻时冰晶的形成,提高切片质量。将沉糖后脑组织修剪好放置在预冷切片底座上,用oct包埋胶包埋后,置于
‑
20℃冷冻固定(约30min),调整切片厚度为30μm,采取冠状位连续切片。选取一张切片后间隔两张再选取一张切片,收集全脑切片并放置在0.01mol/l的pbs中。将切好的脑片用0.01m的pbs在摇床上洗三遍(5min/遍);封闭过夜。再用0.01m pbs洗三遍(5min/遍)。加一抗,4℃,48
‑
72h。用0.01m pbs洗三遍(5min/遍)。加二抗,室温,2h。0.01mpbs洗三遍(5min/遍)。封片,拍照。结果如图3a所示:与生理盐水组相比,氯胺酮组小鼠锥体神经元中c
‑
fos表达阳性神经元增
加83.33%(p<0.0001),发育期氯胺酮多次暴露导致小鼠远期vca1区锥体神经元激活比例增加。
30.离体膜片钳记录:p35天小鼠麻醉后断头取脑,将剥离的脑组织置于冰冷的高糖切片液中,冰冻5min。使用振动切片机将含有vca1区的脑组织切成300μm的薄片,将切好的脑片置于通有95%o2+5%co2混合气的高糖切片液中,在37℃的水浴锅里孵育15min后,换至acsf中于室温下平衡30min备用。用拉制好的玻璃微电极(7
‑
12mω)靠近vca1区锥体细胞层的神经细胞(封接电阻80
‑
120mω),在i=0记录模式下神经元自发放电频率。采用multiclamp 700b膜片钳放大器进行信号的滤波与采集,数据采集和分析用digidata 1440a数模转换器以及pclamp 10.2软件。结果如图3b所示:与生理盐水组相比,氯胺酮组小鼠vca1区锥体神经元自发放电频率增加92.25%(p<0.001),发育期氯胺酮多次暴露导致小鼠远期vca1区锥体神经元兴奋性增加。
31.化学遗传抑制:氯胺酮组小鼠p25天时,麻醉后将其快速固定于stoelting立体定位仪上。判断固定完成的标准为提尾或适度摆动小鼠脑袋不能移动且颅顶水平。以前囟为标准确定零点,根据p25天昆明小鼠vca1区坐标(ap:
‑
2.90,ml:
±
3.20,dv:
‑
4.15)进行定位注射化学遗传抑制病毒(raav2/9
‑
camkⅱα
‑
hm4di
‑
mcherry)或对照病毒(raav2/9
‑
camkⅱα
‑
mcherry)。小鼠饲养至p46天(病毒充分表达需3周时间)进行高架十字迷宫实验,实验前30分钟小鼠单次腹腔注射cno 1mg/kg。结果如图4所示,化学遗传抑制vca1区锥体神经元,发育期氯胺酮多次暴露小鼠进入开放臂探索的时间百分比增加143.36%(p<0.01),进入次数百分比增加57.21%(p<0.05),小鼠焦虑行为减少,提示vca1区锥体神经元兴奋性和焦虑成正相关。
32.氯胺酮组p35天离体膜片钳记录vca1区锥体神经元自发放电频率,记录前给予kcc2激动剂clp257(50μm,1h)孵育,结果如图5所示,kcc2激动剂clp257导致发育期氯胺酮多次暴露小鼠vca1区锥体神经元自发放电频率减少42.26%(p<0.01),clp257可逆转发育期氯胺酮多次暴露所致小鼠远期vca1区锥体神经元兴奋性增加。
33.综上所述kcc2激动剂clp257通过抑制发育期氯胺酮多次暴露小鼠vca1脑区锥体神经元兴奋性发挥缓解焦虑的作用。
34.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换或改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1