一种细胞膜锚定的核酸药物、制备方法及其应用
1.本发明属于分子生物学技术领域,具体涉及一种细胞膜锚定的核酸药物、制备方法及其应用。
背景技术:
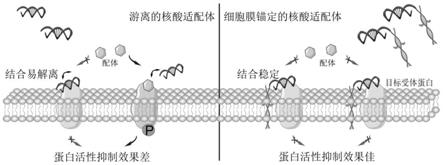
2.细胞膜表面的受体蛋白是维持细胞正常生理功能的重要信号蛋白。这些受体蛋白的表达异常或功能失调与许多疾病进程密切相关,包括癌症,糖尿病和神经退行性疾病等。近年来,许多研究以细胞膜受体蛋白作为药物靶点,开发各种单克隆抗体或小分子抑制剂等实现蛋白活性的抑制。但是,由于这些制剂的生产耗时耗力且成本高昂,质量控制艰难且容易引起免疫反应,限制了进一步的应用。近年来,得益于其易于合成与修饰、质量可控、易于储存、免疫原性低的优点,核酸适配体药物在开发具有疾病治疗功能的核酸药物研究中逐渐崭露头角。一些特异性的核酸适配体被报道可以直接作为抗肿瘤药物,通过阻止目标蛋白与其他信号蛋白的相互作用,比如受体与配体的结合,表现出抑制目标蛋白活性的应用潜能。尽管核酸适配体药物能起到一定治疗作用,但仍存在一些局限。第一方面,核酸适配体药物通常是利用结合目标后的自身位阻来抑制原有的受体-配体相互作用介导的蛋白激活过程。在复杂的细胞微环境中,游离的核酸适配体药物由于尺寸较小,与目标分子结合后易发生解离,导致通常需要较大剂量的核酸适配体药物才能发挥抑制功能。第二方面,由于细胞的内吞作用,以细胞膜受体蛋白为靶点的核酸适配体药物被肿瘤细胞内吞后就无法持续发挥抑制功能,导致核酸适配体药物的抑制作用时间短。因此,提高核酸适配体药物结合的稳定性以及延长核酸适配体药物在细胞膜上的停留时间,能够提高核酸适配体药物的抑制效果,在制备用于疾病治疗的核酸药物的应用前景更加广阔。
3.为了解决上述技术问题,现在亟需研发出一种稳定、高效的细胞膜锚定的核酸药物、制备方法及其应用。
技术实现要素:
4.本发明目的是提供一种细胞膜锚定的核酸药物、制备方法及其应用,要解决的技术问题包括但不限于以下任一技术问题:第一方面,如何提高核酸适配体药物与目标受体蛋白的结合稳定性;第二方面,如何实现核酸适配体药物高效抑制细胞膜受体蛋白活性,降低核酸适配体药物的使用剂量;第三方面,如何实现核酸适配体药物长效的细胞膜受体蛋白活性抑制等。
5.为解决以上任一个或多个技术问题,本发明采用如下技术方案:
6.提供一种细胞膜锚定的核酸药物,由第一锚定核酸序列和调控核酸序列组装形成,所述调控核酸序列包括两段功能序列:核酸适配体序列和第二锚定核酸序列;其中,在所述核酸适配体序列的5’端连接所述第二锚定核酸序列,所述核酸适配体序列特异性靶向细胞膜受体蛋白,所述核酸适配体序列为seq id no.1所示,所述第二锚定核酸序列与第一锚定核酸序列完全互补杂交形成双链结构的细胞膜锚定序列,且所述细胞膜锚定序列上修
饰有一个或两个细胞膜锚定基团。本方案中,一个细胞膜锚定基团修饰在第二锚定核酸序列或第一锚定核酸序列的端部或其它位置;两个细胞膜锚定基团分别修饰在第二锚定核酸序列和第一锚定核酸序列的端部或其它位置。
7.在上述方案的基础上,在另一改进的技术方案中,所述核酸适配体序列与所述第二锚定核酸序列之间设置1-5个随机碱基序列。通过在核酸适配体序列和其它序列之间设置1-5个随机碱基序列,目的是为了将两段功能序列分隔开,保持核酸适配体序列的构型,不影响核酸适配体序列发挥作用。
8.在上述方案的基础上,在另一改进的技术方案中,所述细胞膜锚定基团为疏水性分子中的一种,所述疏水性分子包括胆固醇分子、生育酚分子和二酰基脂质体。
9.在上述方案的基础上,在另一改进的技术方案中,所述第一锚定核酸序列和所述第二锚定核酸序列互补杂交形成长度为18-24bp的双链结构。
10.在上述方案的基础上,在另一改进的技术方案中,两个所述细胞膜锚定基团均修饰在所述第一锚定核酸序列与所述第二锚定核酸序列的中间位置;所述中间位置是指:所述第一锚定核酸序列与所述第二锚定核酸序列为n个碱基,当n为偶数时,两个所述细胞膜锚定基团分别修饰在所述第一锚定核酸序列(方向为5
’‑3’
)和所述第二锚定核酸序列(方向为3
’‑5’
)的第n/2与第(n/2)+1个碱基中间;当n为奇数时,两个所述细胞膜锚定基团分别修饰在所述第一锚定核酸序列(方向为5
’‑3’
)和第二锚定核酸序列(方向为3
’‑5’
)的第(n/2)-0.5与第(n/2)+0.5碱基中间。这样设置可以进一步提高细胞膜锚定序列锚定在细胞膜上的稳定性。
11.在上述方案的基础上,在另一改进的技术方案中,所述细胞膜受体蛋白为间质表皮转化因子(c-met受体蛋白),所述间质表皮转化因子能通过其配体肝细胞生长因子(hgf)介导的受体二聚化激活。
12.在上述方案的基础上,在另一改进的技术方案中,所述核酸适配体与所述细胞膜受体蛋白的结合位点以及所述配体与所述细胞膜受体蛋白的结合位点部分重叠或相同。
13.本发明还提供上述细胞膜锚定的核酸药物的制备方法,具体方法步骤为,
14.s1.合成第一锚定核酸序列;
15.s2.合成调控核酸序列;
16.s3.将步骤s1至s2中的两条核酸序列按照摩尔浓度1:1进行混合,混合后于95℃加热5分钟进行退火相互杂交,缓慢冷却至室温。
17.本发明还提供上述的细胞膜锚定的核酸药物在核酸适配体药物中的应用。
18.本发明还提供上述的细胞膜锚定的核酸药物在调控c-met受体蛋白活性与细胞功能相关研究中的应用。
19.本发明的技术方案至少具有以下的有益效果:本发明提出一种细胞膜锚定的核酸药物、制备方法及其应用。采用本发明中细胞膜锚定的核酸药物,能够显著提高核酸适配体药物与目标蛋白结合的稳定性。本发明中细胞膜锚定的核酸药物可应用于调控细胞膜受体蛋白活性和细胞功能。
20.(1)一些核酸适配体本身可以直接作为抗肿瘤药物,通过利用结合目标后的自身位阻来阻止目标蛋白与其他信号蛋白的相互作用,比如受体与配体的结合,表现出抑制目标蛋白活性的应用潜能。但是,在复杂的细胞微环境中,游离的核酸适配体由于尺寸较小,
与目标分子结合后易发生解离,导致通常需要较大剂量的核酸适配体才能发挥抑制功能。与游离的核酸适配体相比,本发明的核酸药物,通过双链结构的细胞膜锚定序列使更多的核酸适配体富集到细胞膜表面,同时增加了结合稳定性,因此在更低浓度时就能够显著地抑制c-met受体蛋白活性,增强了核酸适配体药物的抑制效果。
21.(2)由于细胞的内吞作用,以细胞膜受体蛋白为靶点的核酸适配体药物被肿瘤细胞内吞后就无法持续发挥抑制功能,导致核酸适配体药物的抑制作用时间短。本发明的核酸药物,利用细胞膜锚定序列减缓核酸适配体序列被内吞的过程,针对c-met受体蛋白这类细胞膜上的靶标,延长了抑制作用的时间。也即本发明能够有效延长核酸适配体在细胞膜表面的作用时间,减少由于细胞内吞作用导致的药效损失。因此,本发明的细胞膜锚定的核酸药物为开发高效的核酸药物提供了新的平台,进一步拓展核酸药物在生物医学中的应用前景。
附图说明
22.图1为本发明实施例1和实施例2中细胞膜锚定的核酸药物增强抑制目标受体蛋白活性的示意图;
23.图2为本发明实施例1和实施例2中(a)-(e)表示经不同的细胞膜锚定序列处理后的hela细胞在含有10%fbs培养基中的共聚焦图像,(f)各组细胞的荧光强度定量分析;标尺:20μm;
24.图3为本发明实施例1和实施例2中第一锚定核酸序列和调控核酸序列组装后的凝胶电泳图像;
25.图4为本发明实施例1和实施例2中200nm 2ch-ab:b*或2ch-ad:d*与hela细胞在室温条件下孵育10分钟的共聚焦图像;标尺:20μm;
26.图5为本发明实施例1和实施例2中验证2ch-ab:b*在细胞膜上锚定方向性的共聚焦图像;标尺:20μm;
27.图6为本发明实施例1和实施例2中对比2ch-ab:b*和free a与c-met受体蛋白结合稳定性的共聚焦图像。标尺:20μm;
28.图7为本发明实施例1和对比例1中免疫印迹分析对比2ch-ab:b*和ab:b*对c-met受体蛋白活性的调控效果;
29.图8为本发明对比例1和对比例2中免疫印迹分析free a对c-met受体蛋白活性的调控效果;
30.图9本发明实施例2和对比例2中免疫印迹分析对比2ch-ad:d*和ad:d*对c-met受体蛋白活性的调控效果;
31.图10为本发明实施例1和实施例2中细胞划痕实验分析不同条件下du145细胞的迁移能力,标尺:100μm;
32.图11为本发明实施例1和实施例2中免疫印迹分析对比2ch-ab:b*和ab:b*与du145细胞孵育24小时后调控c-met受体蛋白活性的效果。
具体实施方式
33.以下,使用实施例和对比例更加详细地说明本发明的具体实施示例,本发明的技
术范围不限于以下实施例。
34.参见附图1的示意,本发明实施例中的细胞膜锚定的核酸药物,由第一锚定核酸序列和调控核酸序列组装形成,调控核酸序列包括两段功能序列:核酸适配体序列和第二锚定核酸序列;其中,核酸适配体靶向细胞膜受体蛋白,核酸适配体序列为seq id no.1所示,第二锚定核酸序列与第一锚定核酸序列完全互补杂交形成双链结构的细胞膜锚定序列,且第二锚定核酸序列与第一锚定核酸序列上均修饰有细胞膜锚定基团。
35.本实施例中,核酸适配体序列与第二锚定核酸序列之间设置1个随机碱基序列。这样不会影响核酸适配体序列与第二锚定核酸序列的连接,同时能将二者分隔开,且不影响核酸适配体序列的构型。在其它实施例中,也可以设置5个及以下的整数个随机碱基序列。但本方案中的随机碱基序列的数量不宜过多,核酸适配体序列的长度为50个碱基,随机碱基序列是为了保证核酸适配体序列的构型不受影响,若设置数量太多一方面浪费dna,另一方面过长的随机碱基序列可能影响核酸适配体序列的构型。
36.在上述实施例的基础上,在另一改进的技术实施例中,细胞膜锚定基团为疏水性分子中的一种,疏水性分子为胆固醇分子,胆固醇分子是修饰在dna骨架的磷酸基上,通过胆固醇分子上脱保护后的羟基和磷酸基反应形成酯键。在其它实施例中,疏水性分子为生育酚分子或二酰基脂质体。由于胆固醇分子、生育酚分子和二酰基脂质体均为常用的细胞膜锚定基团、且均可修饰在dna序列中,因此这三个分子均可将dna序列锚定在细胞膜上。本说明书中实验部分均以胆固醇分子作为细胞膜锚定基团,根据本领域的常识,可知采用生育酚分子或二酰基脂质体代替胆固醇分子,也同样能实现相应的实验结果。
37.在上述实施例的基础上,在另一改进的技术实施例中,第一锚定核酸序列和第二锚定核酸序列互补杂交形成长度为18-24bp的双链结构。第二锚定核酸序列与第一锚定核酸序列完全互补杂交形成双链结构的细胞膜锚定序列,若细胞膜锚定序列长度太长的话,会增加修饰疏水性分子的难度,且浪费dna原料增加成本。
38.在上述实施例的基础上,在另一改进的技术实施例中,细胞膜锚定基团均修饰在第一锚定核酸序列与第二锚定核酸序列的中间的位置;中间位置是指:第一锚定核酸序列与第二锚定核酸序列为n个碱基,当n为偶数时,两个细胞膜锚定基团分别修饰在第一锚定核酸序列(方向为5
’‑3’
)和第二锚定核酸序列(方向为3
’‑5’
)的第n/2与第(n/2)+1个碱基中间;当n为奇数时,两个细胞膜锚定基团分别修饰在第一锚定核酸序列(方向为5
’‑3’
)和第二锚定核酸序列(方向为3
’‑5’
)的第(n/2)-0.5与第(n/2)+0.5碱基中间。这样设置可以进一步提高细胞膜锚定序列锚定在细胞膜上的稳定性。
39.在上述实施例的基础上,在另一改进的技术实施例中,细胞膜受体蛋白为间质表皮转化因子(c-met受体蛋白),间质表皮转化因子能通过其配体肝细胞生长因子(hgf)介导的受体二聚化激活。本实施例中的核酸适配体序列与c-met受体蛋白结合的位置,部分重叠配体hgf与c-met受体蛋白结合的位置,这样就形成了竞争的关系。即核酸适配体序列先结合了c-met受体蛋白之后,hgf就不容易再与c-met蛋白结合。游离的核酸适配体序列与c-met蛋白结合后还是容易发生解离,以及发生细胞内吞等,所以hgf还是有部分能结合到c-met受体蛋白就把c-met受体蛋白激活了。通过在核酸适配体序列上带上双链结构的细胞膜锚定序列后,使更多的核酸适配体富集到细胞膜表面,锚定作用增加了结合稳定性,核酸适配体序列的抑制效果变得更好了。因此在更低浓度时就能够显著地抑制c-met受体蛋白活
性,增强了核酸适配体药物的抑制效果;同时利用细胞膜锚定序列减缓核酸适配体序列被细胞内吞的过程,针对c-met受体蛋白这类细胞膜上的靶标,有效延长核酸适配体序列在细胞膜表面的作用时间,减少由于细胞内吞作用导致的药效损失。
40.在上述实施例的基础上,在另一改进的技术实施例中,核酸适配体与细胞膜受体蛋白的结合位点以及配体与细胞膜受体蛋白的结合位点部分重叠或相同。
41.本发明还提供上述核酸药物的制备方法,具体方法步骤为,
42.s1.合成第一锚定核酸序列;
43.s2.合成调控核酸序列;
44.s3.将步骤s1至s2中的两条dna序列按照摩尔浓度1:1进行混合,混合后于95℃加热5分钟进行退火相互杂交,缓慢冷却至室温。
45.本发明还提供上述的核酸药物在核酸适配体药物中的应用。
46.本发明还提供上述的核酸药物在调控c-met受体蛋白活性与细胞功能相关研究中的应用。
47.本发明通过在第一锚定核酸序列和第二锚定核酸序列的中间位置均修饰有疏水性细胞膜锚定基团,所组装后形成的核酸适配体可稳定地锚定在细胞膜的表面。和游离的核酸适配体药物相比,当采用本发明的细胞膜锚定的核酸药物作为核酸适配体药物时,在更低浓度时就能够显著抑制蛋白活性,且能够延长核酸适配体药物抑制作用时间。因此,利用细胞膜锚定序列将核酸适配体药物锚定在细胞膜表面,能够降低核酸适配体药物的使用剂量,增强了核酸适配体药物的抑制效果。
48.本具体实施方式中所用到的主要仪器为:
49.milli-q integarl纯水/超纯水一体化系统(millipore公司,美国);cary eclipse荧光光谱仪(agilent technologies公司,美国);小垂直电泳槽(bio-rad公司,美国);chemidoctm touch凝胶成像系统(bio-rad公司,美国);sh-1000uv-vis分光光度计(corona electric公司,日本);a1共聚焦激光扫描显微镜(尼康公司,日本);ti-s倒置显微镜(尼康公司,日本);chb 202恒温金属浴(杭州博日科技公司,中国)。
50.本具体实施方式中所用到的主要试剂为:
51.本实验中所用的dna序列(表1)均由中国上海生工生物工程技术有限公司合成并进行hplc纯化。重组人hgf购自美国peprotech公司。抗c-met抗体,抗p-met抗体,抗akt抗体,抗p-akt抗体,抗erk1/2抗体,抗p-erk1/2抗体以及hrp标记的二抗购自美国cell signaling technology公司。mem培养基、细胞培养用双抗和胎牛血清(fbs)购自美国gibco公司。ripa细胞裂解液、蛋白浓度定量试剂盒、蛋白酶抑制剂和磷酸酶抑制剂购自中国上海碧云天生物技术有限公司。dnase i购自美国thermo公司。磷酸盐缓冲液(pbs)购自美国gibco公司。
52.实施例1
53.本实施例中的细胞膜锚定的核酸药物,由第一锚定核酸序列和调控核酸序列组装形成,调控核酸序列包括两段功能序列:核酸适配体序列和第二锚定核酸序列;其中,核酸适配体序列为seq id no.1所示的序列,第二锚定核酸序列与第一锚定核酸序列完全互补杂交形成双链结构的细胞膜锚定序列,且第二锚定核酸序列与第一锚定核酸序列上均修饰有细胞膜锚定基团。第二锚定核酸序列与第一锚定核酸序列退火互补杂交后形成细胞膜锚
定序列。
54.参见下表1所示的寡核苷酸序列,本实施例1中选用在肿瘤细胞活动中起到重要作用的一种细胞膜受体蛋白——间质表皮转化因子(c-met受体蛋白)作为目标受体蛋白,选用18个碱基长度的双链互补核酸序列作为细胞膜锚定序列。ch-b*为修饰有细胞膜锚定基团(本实施例中为疏水性分子胆固醇分子)的第一锚定核酸序列,b*的序列如seq id no.2所示。a为特异性靶向c-met受体蛋白的核酸适配体序列,ch-b为修饰有胆固醇分子的第二锚定核酸序列,在核酸适配体序列a的5’端添加第二锚定核酸序列ch-b形成ch-ab,为保证不影响核酸适配体序列的构型,本实施例1中在核酸适配体序列a和第二锚定核酸序列b之间设置有一个随机碱基序列t,其中b的序列见下表1所示,ab的序列如seq id no.3所示。第二锚定核酸序列ch-b中的b与第一锚定核酸序列ch-b*中的b*完全互补。将ch-b*和ch-ab这二者按摩尔浓度1:1混合后于95℃加热5分钟进行退火相互杂交,ch-ab和ch-b*形成双链结构,缓慢冷却至室温,形成细胞膜锚定的核酸药物2ch-ab:b*。在另一实施例中,核酸适配体序列a和第二锚定核酸序列b之间设置的一个随机碱基序列可以为a或c或g;在其它随机碱基序列的数量可以为不超过5个碱基,只要不影响到影响核酸适配体序列的构型即可。
55.对比例1
56.以未修饰细胞膜锚定基团的ab:b*和c-met受体蛋白的核酸适配体a代替实施例1中的2ch-ab:b*,其余实验条件均相同。
57.表1实施例1中所用的寡核苷酸序列
[0058][0059][0060]
上表1中的
“‑
ch
‑”
表示胆固醇分子。
[0061]
实施例2
[0062]
本实施例2选用在肿瘤细胞活动中起到重要作用的间质表皮转化因子(c-met受体蛋白)作为目标受体蛋白,选用24个碱基长度的双链互补核酸序列作为细胞膜锚定序列。ch-d*为修饰有细胞膜锚定基团(本实施例中为疏水性分子胆固醇分子)的第一锚定核酸序
列,d*的序列如seq id no.4所示;a为特异性靶向c-met受体蛋白的核酸适配体,ch-d为修饰有胆固醇分子的第二锚定核酸序列,在c-met受体蛋白的核酸适配体a的末端添加第二锚定核酸序列ch-d形成ch-ad,为保证不影响核酸适配体序列的构型,本实施例2中在核酸适配体序列a和第二锚定核酸序列d之间设置有一个随机碱基序列t,其中ad的序列如seq id no.5所示,其中d和d*的序列完全互补。相应的核酸序列制备步骤同实施例1,本实施例2中ch-ad和ch-d*的序列参见表2。
[0063]
对比例2
[0064]
以未修饰细胞膜锚定基团的ad:d*代替实施例2中的2ch-ad:d*,其余实验条件均相同。
[0065]
表2实施例2和对比例2中所用的寡核苷酸序列
[0066][0067]
上表2中的
“‑
ch
‑”
表示胆固醇分子。
[0068]
(一)实施例1、对比例1、实施例2、对比例2的相关实验过程
[0069]
将实施例1、对比例1、实施例2、对比例2中的核酸探针进行以下实验:
[0070]
a.细胞膜锚定序列的锚定稳定性优化
[0071]
对胆固醇分子修饰个数和位置的优化:将200nm的不同细胞膜锚定序列(2ch-b:b*、2ch-c:c*、ch-b:b*、ch-b和ch-c)与hela细胞孵育10分钟后,用pbs洗去多余的探针,进行共聚焦荧光成像。再将细胞与含有10%胎牛血清的培养基孵育30分钟,pbs洗涤3次,再次进行共聚焦荧光成像。
[0072]
b.锚定效果以及锚定方向性验证
[0073]
将200nm 2ch-ab:b*与hela细胞孵育10分钟,pbs洗涤3次后进行共聚焦荧光成像,验证其锚定效果。为了验证其锚定方向性,随后加入dnase i(0.5u/μl)与细胞共孵育5分钟,pbs洗涤3次后再次进行共聚焦荧光成像。
[0074]
c.核酸适配体竞争实验
[0075]
将10μm ch-ab与10μm ch-b*混合,95℃退火5分钟,冷却至室温2小时以上,4℃保存。为了表征核酸适配体结合的稳定性,先用400nm标记cy3荧光基团的a(cy3-free a)或标记cy3荧光基团的2ch-ab:b*(cy3-2ch-ab:b*)与hela细胞孵育10分钟,用pbs洗涤3次,进行第一次共聚焦荧光成像。然后,用400nm标记cy5荧光基团的a(cy5-free a)孵育细胞15分钟,用pbs洗涤3次后进行第二次成像。
[0076]
d.免疫印迹实验
[0077]
du145细胞接种于6孔板中(每孔3
×
105细胞)培养24小时后,将培养液更换为含有0.5%bsa的mem培养基饥饿24小时,进行实验:
[0078]
(1)细胞膜锚定的核酸药物增强抑制蛋白活性效果的性能考察:将du145细胞分别与不同浓度的核酸探针(2ch-ab:b*、ab:b*或a)孵育15分钟后,加入20ng/ml hgf与细胞孵育30分钟,用冷的pbs洗涤细胞3次后,用添加蛋白酶抑制剂(1
×
)和磷酸酶抑制剂(1
×
)的ripa裂解缓冲液将细胞裂解,提取蛋白并测定浓度后进行免疫印迹实验。
[0079]
为了验证该策略的通用性,将30nm不同的核酸探针(2ch-ad:d*或ad:d*或2ch-d:d*)孵育15分钟后,加入20ng/ml hgf与细胞孵育30分钟,用冷的pbs洗涤细胞3次后,用添加蛋白酶抑制剂(1
×
)和磷酸酶抑制剂(1
×
)的ripa裂解缓冲液将细胞裂解,提取蛋白并测定浓度后进行免疫印迹实验。
[0080]
(2)细胞膜锚定的核酸药物延长抑制作用时间的性能考察:将250nm2ch-ab:b*或ab:b*加入du145细胞后,在细胞培养箱内孵育24小时。再加入20ng/ml hgf与细胞孵育30分钟,用冷的pbs洗涤细胞3次后,裂解细胞提取蛋白,测定蛋白浓度后进行免疫印迹实验。以只加入20ng/ml hgf孵育30分钟的细胞作为阳性对照组。
[0081]
e.细胞迁移能力分析
[0082]
du145细胞接种在12孔板中长至铺满整个孔板。将完全培养液更换为含有0.5%bsa的mem培养基饥饿细胞24小时后进行实验。用无菌的200μl枪头在孔板中央制造划痕,在倒置显微镜下记录划痕宽度。细胞迁移实验分为四组。第一组:空白对照组;第二组:仅加入20ng/ml hgf作为阳性对照组;第三组:30nm ab:b*;第四组:30nm 2ch-ab:b*。第三组和第四组加入核酸探针孵育15分钟后,再加入20ng/ml hgf进行孵育。将各组细胞置于培养箱中继续培养24小时后,在倒置显微镜下记录划痕宽度。利用image j软件定量细胞在24小时内的迁移距离。
[0083]
(二)相关实验结果
[0084]
a.细胞膜锚定序列的锚定稳定性优化
[0085]
首先,为了达到最佳的锚定效果,我们对修饰在锚定核酸序列上的胆固醇分子的个数和位置进行了优化,分别构建了5种细胞膜锚定序列,包括2ch-b:b*、2ch-c:c*、ch-b:b*、ch-b和ch-c,考察它们各自锚定在细胞膜上的稳定性。其中,2ch-b:b*为双链细胞膜锚定序列,在两条锚定核酸序列(第一锚定核酸序列和第二锚定核酸序列)的中间位置各修饰一个胆固醇分子;2ch-c:c*为双链细胞膜锚定序列,在一条锚定核酸序列的3’端和另一条锚定核酸序列的5’端各修饰一个胆固醇分子;ch-b:b*为双链细胞膜锚定序列,在其中一条锚定核酸序列的中间位置修饰一个胆固醇分子;ch-b为单链的锚定核酸序列,在序列的中间位置修饰一个胆固醇分子;ch-c为单链的锚定核酸序列,在序列的5’端修饰一个胆固醇分子。我们在这些锚定核酸序列上都标记了cy3荧光。如附图2a-2e的共聚焦图像所示,这些细胞膜锚定核酸序列都可以成功锚定在细胞膜表面。在10%胎牛血清存在的条件下,在细胞膜锚定核酸序列的中间位置修饰两个胆固醇分子的双链核酸序列(也即2ch-b:b*)表现出更稳定的细胞膜锚定性能。与ch-b:b*相比,通过增加细胞膜锚定分子(也即细胞膜锚定基团)的数量,可以获得更好的锚定稳定性。与2ch-c:c*相比,当将细胞膜锚定分子修饰在双链锚定核酸序列的中间位置,能将双链结构的细胞膜锚定核酸序列插入细胞膜更深的位
置,提高了锚定稳定性。因此,选择2ch-b:b*作为细胞膜锚定序列进行后续实验。
[0086]
从上述实验结果可知:(1)两个胆固醇分子分别修饰在第一锚定核酸序列和第二锚定核酸序列上的中间位置,第一锚定核酸序列和第二锚定核酸序列杂交后胆固醇分子位于双链的对称位置;(3)胆固醇为疏水性分子的一种,通过其疏水性插进细胞膜的磷脂层,类推至其他疏水性分子如生育酚分子和二酰基脂质体,也是修饰在双链锚定核酸序列的中间位置效果较佳。
[0087]
b.细胞膜锚定的核酸药物的构建和表征
[0088]
实施例1、对比例1、实施例2、对比例2中选择了c-met受体蛋白作为目标受体蛋白模型,选用靶向c-met受体蛋白的核酸适配体,即a,来验证我们的设计。c-met受体蛋白是一个重要的药物靶点,它的过度激活导致肿瘤细胞的迁移和侵袭。在核酸适配体a的末端延长第二锚定核酸序列,即ch-ab,并将其与第一锚定核酸序列ch-b*进行杂交,形成2ch-ab:b*。我们首先验证了该核酸药物在pbs缓冲溶液中的杂交情况。如附图3所示,从左至右,第1泳道为ch-ab的条带,第2泳道为ch-b*条带,由于ch-ab与ch-b*的杂交,第3泳道在更高的位置出现了新的条带,证明了2ch-ab:b*的成功组装,证明了胆固醇分子的修饰不影响ch-ab与ch-b*的杂交。接着,如附图4a所示,我们在探针ch-ab的3’端标记了cy3荧光,在探针ch-b*的5’端标记了cy5荧光。将组装好的2ch-ab:b*与hela细胞孵育十分钟,可以在细胞膜上同时观察到cy3和cy5荧光,证明2ch-ab:b*成功锚定在hela细胞的细胞膜表面。
[0089]
实施例2中,为了验证该方法的通用性,我们设计了24个碱基长度的第一锚定核酸序列和第二锚定核酸序列,设计核酸药物2ch-ad:d*。如附图4b所示,2ch-ad:d*成功锚定在hela细胞的细胞膜表面。
[0090]
核酸适配体药物与目标蛋白的识别与结合能力是其发挥抑制功效的关键,因此要求核酸适配体要位于细胞膜的外侧。为了考察2ch-ab:b*在细胞膜上锚定的方向性,我们在探针ch-ab的3’端标记了cy3荧光,在探针ch-b*的3’端标记了cy5荧光。如附图5所示,将组装好的探针2ch-ab:b*锚定在hela细胞膜上,能够同时观察到一圈明亮的cy3和cy5荧光。dnase i是一种能够水解单链或双链dna的核酸内切酶。由于dnase i无法穿过细胞膜,我们利用它来考察2ch-ab:b*锚定的方向性。dnase i处理后的细胞膜上的cy3荧光明显下降,而cy5荧光基本保持不变,指示核酸适配体a是位于细胞膜外侧的。接着,我们通过核酸适配体竞争实验考察了2ch-ab:b*与目标c-met受体蛋白结合的稳定性。如附图6a所示,cy3-2ch-ab:b*锚定的细胞膜上几乎没有出现cy5荧光信号。然而施加cy3-free a孵育的细胞膜上出现一圈明显的cy5荧光信号,表明cy5-free a的结合(附图6b)。由此验证了细胞膜锚定的2ch-ab:b*与游离的核酸适配体a相比,能够更稳定地结合目标c-met受体蛋白。
[0091]
c.细胞膜锚定的核酸药物增强抑制蛋白活性和细胞功能
[0092]
实施例1、对比例1、实施例2、对比例2中选择了c-met受体蛋白作为目标受体蛋白模型,考察细胞膜锚定的核酸药物能否提高抑制由hgf引起的c-met受体磷酸化。我们还将探针2ch-ab:b*、ab:b*与free a抑制c-met受体活性的效果进行比较。如附图7a和附图7b,从免疫印迹分析实验的结果上看到,2ch-ab:b*的抑制能力明显优于ab:b*,在更低的浓度就能够高效抑制磷酸化c-met(p-met)的蛋白表达。同时,ab:b*与free a表现出类似的抑制能力(附图7b和附图8),进一步验证了能够锚定在细胞膜上的2ch-ab:b*显著增强核酸适配体药物的抑制功效,能够降低核酸适配体药物的使用剂量。
[0093]
实施例2中,为了验证该方法的通用性,我们设计了24个碱基长度的第一锚定核酸序列和第二锚定核酸序列作为另一组细胞膜锚定序列,然后设计核酸药物2ch-ad:d*。用30nm 2ch-ad:d*处理过的细胞几乎检测不到p-met的蛋白表达,而同样浓度游离的ad:d*处理过的细胞表现出与仅由hgf处理的阳性对照组相似的p-met表达水平,未能起到明显的抑制作用。同时,细胞膜锚定序列(2ch-d:d*)不会影响c-met受体蛋白的活性。实验结果证明了细胞膜锚定的核酸药物2ch-ad:d*能够更加高效地抑制c-met受体蛋白活性(参见附图9的结果),说明了该策略的通用性。
[0094]
从实施例1和实施例2的对比可以得知,第一锚定核酸序列和第二锚定核酸序列不限于上述实施例1和实施例2中所列的具体序列,只要第一锚定核酸序列与第二锚定核酸序列满足形成18-24bp稳定杂交的双链结构的细胞膜锚定序列,且第一锚定核酸序列与第二锚定核酸序列上均修饰有细胞膜锚定基团即可。由于本方案中的核酸适配体序列长度为50个碱基,细胞膜锚定序列的长度不宜太长,太长的话会一方面增加修饰胆固醇分子的难度,且浪费dna原料,增加合成dna的成本;另一方面过长的细胞膜锚定序列会影响到核酸适配体序列发挥作用。实施例1和实施例2的实验结果显示,通过让核酸适配体序列上带上合适长度(18-24bp)的双链结构的细胞膜锚定序列,且细胞膜锚定序列上带有细胞膜锚定基团时,双链结构的细胞膜锚定核酸序列结合到细胞膜上,可以将核酸适配体富集到细胞膜表面,同时增加了其与细胞膜受体蛋白的结合稳定性,在更低浓度时就能够显著地抑制c-met受体蛋白活性,增强了核酸适配体药物的抑制效果。
[0095]
c-met受体蛋白的活化与细胞迁移行为密切相关。因此,我们利用细胞划痕实验考察2ch-ab:b*对细胞行为的调控效果。和预期的效果一致,如附图10所示,施加2ch-ab:b*孵育的细胞愈合划痕的速度减慢,表现出其抑制细胞迁移行为的能力更佳。
[0096]
d.细胞膜锚定的核酸药物延长抑制作用时间
[0097]
尽管在较短时间内(15分钟)250nm的探针2ch-ab:b*和ab:b*都能表现出良好的抑制作用(附图7)。如附图11所示,只有2ch-ab:b*在与细胞孵育24小时后能够抵抗hgf刺激介导的c-met受体活化,依然保持良好的抑制效果。而ab:b*在与细胞孵育24小时后已经基本没有抑制作用,其p-met蛋白表达水平已经与仅由hgf处理的阳性对照组相当。实验结果指示了2ch-ab:b*在长效抑制蛋白活性中的可行性。
[0098]
上述实验结果分析表明,本发明构建的双链结构的细胞膜锚定序列,能使更多的核酸适配体药物富集到细胞膜表面,增加了结合稳定性(参见附图6的结果),因此只要更小剂量就能实现更好的抑制效果(参见附图7至附图10的结果),同时细胞膜锚定序列能减缓核酸适配体药物被细胞内吞的过程,针对c-met受体蛋白这种细胞膜上的靶标,延长了抑制时间(参见附图11的结果)
[0099]
本发明构建的细胞膜锚定的核酸药物能够显著提高核酸适配体药物与目标蛋白结合的稳定性,在较低浓度时就能够显著地抑制c-met受体蛋白活性,大大增强了核酸适配体药物的抑制效果。此外,该策略能有效延长核酸适配体药物在细胞膜表面的作用时间,减少由于细胞内吞作用导致的药效损失。我们设计的细胞膜锚定的核酸药物简单可控,为开发高效的核酸药物提供了新的平台,进一步拓展其在生物医学中的应用前景。
[0100]
最后应当说明的是,以上实施例仅用于说明本技术的技术方案而非对其保护范围的限制,尽管参照上述实施例对本技术进行了详细的说明,所述领域的普通技术人员应当
理解:本领域技术人员阅读本技术后依然可对申请的具体实施方式进行种种变更、修改或等同替换,但以上变更、修改或等同替换,均在本技术的待授权或待批准之权利要求保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1