用于心脏再同步治疗中的手术辅助系统及手术机器人系统的制作方法
1.本技术涉及医疗系统领域,具体而言,涉及一种心脏再同步治疗中的手术辅助系统、设备及及手术机器人系统。
背景技术:
2.传导系统中的一些缺陷导致心脏收缩不同步,其有时被称为传导障碍。因此,心脏收缩不同步,无法泵出足够血液,最终导致心力衰竭。传导障碍可能具有多种原因,包含年龄、心脏(肌肉)损伤、药物及遗传。心脏再同步治疗能改善心力衰竭患者心脏收缩不同步,提高心脏射血功能。
3.目前,心脏再同步化治疗(crt)作为一种有效的非药物治疗手段,通过双心室起搏方式治疗心室收缩不同步心力衰竭,其能显著改善患者心衰症状,提高心脏射血功能,纠正心脏收缩不同步。但研究表明约30%患者对crt反应性低,甚至无反应,对心力衰竭治疗效果不佳。因此,需要改善的技术方案。
技术实现要素:
4.本技术的实施例提供了一种用于心脏再同步治疗中的手术辅助系统、设备及手术机器人系统。通过该手术辅助系统能够获得适配的心室电极间直接距离,进而能够精确指导医生将电极植入在心脏中的目标位置,从而提高心力衰竭治疗效果。
5.本技术的其他特性和优点将通过下面的详细描述变得显然,或部分地通过本技术的实践而习得。
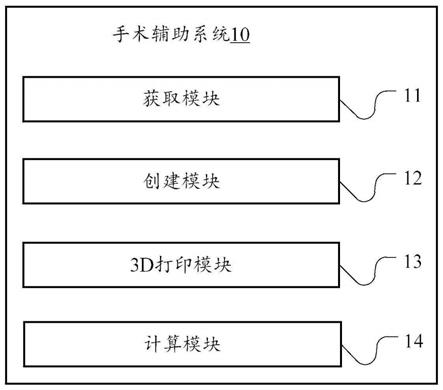
6.根据本技术实施例的一个方面,提供了一种用于心脏再同步治疗中的手术辅助系统,其特征在于,包括:获取模块,被配置成获取患者心脏的ct图像数据集;创建模块,与所述获取模块连接,接收所述获取模块发送来的图像数据集,所述创建模块被配置成根据所述图像数据集建立包含冠状静脉分支及右心室的心脏结构三维解剖模型;3d打印模块,与所述创建模块连接,接收所述创建模块发送来的心脏结构三维解剖模型,所述3d打印模块被配置成根据所述心脏结构的三维解剖模型获得患者的心脏3d打印模型;计算模块,与所述3d打印模块连接,所述计算模块被配置成基于所述心脏3d打印模型,获得适配的心室电极间直接距离。
7.在本技术的一些实施例中,基于前述方案,所述创建模块具体包括:
8.分割单元,将所述ct图像数据集中的心脏增强ct图像转化为预定格式的图像,并对所述预定格式的图像进行阈值分割;第一建立单元,基于阈值分割后的结果建立包括心脏的心房、心室的三维模型;第二建立单元,在心房、心室的三维模型上增加心脏冠状窦及其分支血管;重建单元,对心脏的心房、心室、心脏冠状窦及其分支血管进行三维重建,得到心脏结构的三维解剖模型。
9.在本技术的一些实施例中,基于前述方案,所述重建单元包括:标识单元,根据ct成像原理确定心脏的心房、心室、心脏冠状窦及其分支血管中的心脏造影剂、心肌及脂肪的
阀值范围并进行显示;编辑单元,利用编辑功能对显示的结构进行分割,获得心脏的解剖结构,所述解剖结构包括:左心房、右心房、左心室和右心室、冠状动脉和冠状静脉。
10.在本技术的一些实施例中,基于前述方案,所述3d打印模块具体包括:格式转换单元,将所述心脏结构的三维解剖模型转化为打印模块能够识别的文件格式;模型输入单元,将转化后的所述心脏结构的三维解剖模型输入到打印模块;3d打印单元,被配置为根据输入的心脏结构的三维解剖模型打印出1:n的心脏3d打印模型,其中,n为大于等于1的正整数。
11.在本技术的一些实施例中,基于前述方案,所述计算模块包括:第一测量单元,基于所述心脏3d打印模型,获得正前位心脏横径c、第一水平距离v1和正侧位左右心室间电极直接距离l2;第一计算单元,基于预设的第一计算函数,根据所述第一水平距离v1和所述正侧位左右心室间电极直接距离l2得到左右心室直接距离最大值dd,其中第一计算函数为dd2=v12+l22;第二计算单元,计算左、右心室电极植入位置间dd/c,获得适配的心室电极间直接距离。
12.在本技术的一些实施例中,基于前述方案,所述计算模块包括:第二测量单元,基于所述心脏3d打印模型,获得正前位心脏横径c、第二水平距离v2及正位片左右心室间电极距离l1;第三计算单元,基于预设的第二计算函数,根据v2和l1得到左右心室直接距离最大值dd,其中第二计算函数为dd2=v22+l12;第四计算单元,用于计算左、右心室电极植入位置间dd/c,获得适配的心室电极间直接距离。
13.在本技术的一些实施例中,基于前述方案,所述计算模块还包括:比较单元,将按照所述第一计算函数和第二计算函数得到的dd的数值大小进行比较,确定数值较大的dd作为最终值。
14.根据本技术实施例的一个方面,提供了一种心脏再同步治疗中的手术机器人系统,包括:接收模块,用于接收所述心脏结构的三维解剖模型;识别模块,用于对所述三维解剖模型进行识别,得到心脏的解剖结构信息,解剖结构信息包括:左心房、右心房、左心室和右心室、冠状动脉和冠状静脉的信息;确定模块,用于基于解剖结构信息,根据预设算法确定获得适配的心室电极间直接距离。
15.在本技术的一些实施例中,基于前述方案,所述心脏再同步治疗中的手术机器人系统还包括:转换模块,用于将所述解剖结构信息根据预设的算法转换得到多维导航因子向量;导航路径确定模块,用于根据所述多维导航因子向量获得至少一条导航路径,并计算每条导航路径的优选概率,基于优选概率及导航路径的安全因子,确定导航路径;导航模块,用于根据所述导航路径对电极的目标安装位置进行导航。
16.在本技术的一些实施例中,基于前述方案,所述心脏再同步治疗中的手术机器人系统还包括:第一显示模块,将所述导航路径进行3d显示,在接收到选择指令后,响应于所述选择指令,显示对应的导航路径的3d线路走向图;第二显示模块,根据所述3d线路走向图进行导航,确定并显示左室冠状窦电极定位于冠状静脉左室外膜面分支的第一状态;第三显示模块,显示右室螺旋电极定位于右室心尖部,心房电极定位于右心耳的第二状态。
17.根据本技术实施例的一个方面,提供了一种用于心脏再同步治疗中的手术辅助设备,包括:电极,用于感测心脏活动;操作设备,被配置为根据适配的心室电极间直接距离调整电极植入心血管的位置;其中,所述适配的心室电极间直接距离根据获取模块、创建模
块、3d打印模块和计算模块获得:获取模块,被配置成获取患者心脏的ct图像数据集;创建模块,与所述获取模块连接,接收所述获取模块发送来的图像数据集,所述创建模块被配置成根据所述图像数据集建立包含冠状静脉分支及右心室的心脏结构三维解剖模型;3d打印模块,与所述创建模块连接,接收所述创建模块发送来的心脏结构三维解剖模型,所述3d打印模块被配置成根据所述心脏结构的三维解剖模型获得患者的心脏3d打印模型;计算模块,与所述3d打印模块连接,所述计算模块被配置成基于所述心脏3d打印模型,获得适配的心室电极间直接距离。
18.在本技术的一些实施例所提供的用于心脏再同步治疗中的手术辅助系统,该手术辅助系统包括获取模块、创建模块、3d打印模块和计算模块。其中,获取模块被配置成获取患者心脏的ct图像数据集;创建模块,与所述获取模块连接,接收所述获取模块发送来的图像数据集,所述创建模块被配置成根据所述图像数据集建立包含冠状静脉分支及右心室的心脏结构三维解剖模型;3d打印模块,与所述创建模块连接,接收所述创建模块发送来的心脏结构三维解剖模型,所述3d打印模块被配置成根据所述心脏结构的三维解剖模型获得患者的心脏3d打印模型;计算模块,与所述3d打印模块连接,所述计算模块被配置成基于所述心脏3d打印模型,获得适配的心室电极间直接距离。本方案通过对ct图像数据集构建包含冠状静脉分支及右心室的心脏结构三维解剖模型并通过3d打印模块打印出来,从而立体展示冠状静脉各分支以及心腔的空间结构,重建带有冠状静脉分支的心脏立体模型,基于该心脏立体模型精确计算出适配的心室电极间直接距离,从而精确指导左、右心室电极、心房电极植入位置。
19.应当理解的是,以上的一般描述和后文的细节描述仅是示例性和解释性的,并不能限制本技术。
附图说明
20.此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本技术的实施例,并与说明书一起用于解释本技术的原理。显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
21.图1示出了根据本技术的一个实施例的用于心脏再同步治疗中的手术辅助系统的示意图;
22.图2示出了根据本技术的一个实施例的创建模块的示意图;
23.图3示出了根据本技术的一个实施例的3d打印模块的示意图;
24.图4示出了根据本技术的一个实施例的计算模块的示意图;
25.图5示出了根据本技术的另一个实施例的计算模块的示意图;
26.图6示出了根据本技术的再一个实施例的计算模块的示意图;
27.图7示出了根据本技术的一个实施例的一种心脏再同步治疗中的手术机器人系统的示意图;
28.图8示出了根据本技术的另一个实施例的一种心脏再同步治疗中的手术机器人系统的示意图;
29.图9示出了根据本技术的再一个实施例的一种心脏再同步治疗中的手术机器人系
统的示意图;
30.图10示出了根据本技术的一个实施例的一种用于心脏再同步治疗中的手术辅助设备的示意图。
具体实施方式
31.现在将参考附图更全面地描述示例实施方式。然而,示例实施方式能够以多种形式实施,且不应被理解为限于在此阐述的范例;相反,提供这些实施方式使得本技术将更加全面和完整,并将示例实施方式的构思全面地传达给本领域的技术人员。
32.此外,所描述的特征、结构或特性可以以任何合适的方式结合在一个或更多实施例中。在下面的描述中,提供许多具体细节从而给出对本技术的实施例的充分理解。然而,本领域技术人员将意识到,可以实践本技术的技术方案而没有特定细节中的一个或更多,或者可以采用其它的方法、组元、装置、步骤等。在其它情况下,不详细示出或描述公知方法、装置、实现或者操作以避免模糊本技术的各方面。
33.附图中所示的方框图仅仅是功能实体,不一定必须与物理上独立的实体相对应。即,可以采用软件形式来实现这些功能实体,或在一个或多个硬件模块或集成电路中实现这些功能实体,或在不同网络和/或处理器装置和/或微控制器装置中实现这些功能实体。
34.附图中所示的流程图仅是示例性说明,不是必须包括所有的内容和操作/步骤,也不是必须按所描述的顺序执行。例如,有的操作/步骤还可以分解,而有的操作/步骤可以合并或部分合并,因此实际执行的顺序有可能根据实际情况改变。
35.以下对本技术实施例的技术方案的实现细节进行详细阐述:
36.图1示出了根据本技术的一种用于心脏再同步治疗中的手术辅助系统10,具体包括获取模块11,创建模块12,3d打印模块13和计算模块14。获取模块11,被配置成获取患者心脏的ct图像数据集;创建模块12,与获取模块11连接,接收获取模块11发送来的图像数据集,创建模块12被配置成根据所述图像数据集建立包含冠状静脉分支及右心室的心脏结构三维解剖模型;3d打印模块13,与创建模块12连接,接收创建模块12发送来的心脏结构三维解剖模型,3d打印模块13被配置成根据所述心脏结构的三维解剖模型获得患者的心脏3d打印模型;计算模块14,与3d打印模块13连接,计算模块14被配置成基于所述心脏3d打印模型,获得适配的心室电极间直接距离。
37.作为本发明的实施例,所述手术辅助系统还包括数据分析模块,被配置为分析crt效果与左、右心室电极植入位置间距离之间的关系,并确定crt效果与左、右心室电极植入位置间距离相关,具体为电极植入位置直接距离越大,crt效果越佳。然而,crt技术难点为如何将电极导线植入到最佳静脉分支,从而使左右心室起搏电极间距离达到最大,使心脏收缩达到最大限度的同步化。crt通过冠状静脉将导线送入左心室后侧方的侧静脉、心大静脉、心中静脉,远端起搏左心室,虽然在植入冠状静脉窦电极导线前首先会进行冠状静脉窦造影,了解冠状静脉窦及其分支血管的走形,但并不能获得直观的立体解剖结构及三维空间关系。
38.在本技术的一些实施例所提供的用于心脏再同步治疗中的手术辅助系统,该手术辅助系统包括获取模块、创建模块、3d打印模块和计算模块。其中,获取模块被配置成获取患者心脏的ct图像数据集;创建模块,与所述获取模块连接,接收所述获取模块发送来的图
像数据集,所述创建模块被配置成根据所述图像数据集建立包含冠状静脉分支及右心室的心脏结构三维解剖模型;3d打印模块,与所述创建模块连接,接收所述创建模块发送来的心脏结构三维解剖模型,所述3d打印模块被配置成根据所述心脏结构的三维解剖模型获得患者的心脏3d打印模型;计算模块,与所述3d打印模块连接,所述计算模块被配置成基于所述心脏3d打印模型,获得适配的心室电极间直接距离。本方案通过对ct图像数据集构建包含冠状静脉分支及右心室的心脏结构三维解剖模型并通过3d打印模块打印出来,从而立体展示冠状静脉各分支以及心腔的空间结构,重建带有冠状静脉分支的心脏立体模型,基于该心脏立体模型精确计算出适配的心室电极间直接距离,从而精确指导左、右心室电极、心房电极植入位置。其中,上述计算出的适配的心室电极间直接距离为crt植入心室最佳间距,从而使得患者对crt反应性的得到提高至95%以上,因此解决了患者对crt反应性低,甚至无反应,对心力衰竭治疗效果不佳的技术问题。
39.参考图2,在本技术的一些实施例中,基于前述方案,创建模块12具体包括:
40.分割单元121,将所述ct图像数据集中的心脏增强ct图像转化为预定格式的图像,并对所述预定格式的图像进行阈值分割;第一建立单元122,基于阈值分割后的结果建立包括心脏的心房、心室的三维模型;第二建立单元123,在心房、心室的三维模型上增加心脏冠状窦及其分支血管;重建单元124,对心脏的心房、心室、心脏冠状窦及其分支血管进行三维重建,得到心脏结构的三维解剖模型。
41.在本技术中,可以使用预设的图像转化模型对所述心脏增强ct图像进行处理,生成与所述心脏增强ct图像对应的预定格式的图像。
42.所述图像转化模型共包括第一处理模块、第二处理模块和第三处理模块,具体的处理过程可以包括如下步骤:
43.步骤s101、使用所述第一处理模块对所述心脏增强ct图像进行卷积和下采样处理,得到第一处理结果。
44.此处将所述第一处理模块的层数记为processn,processn的具体取值可以根据实际情况进行设置。
45.在本实施例中,优选设置processn=3,并将这三层依次记为moduleone1、moduleone2和moduleone3。其中,moduleone1为所述第一处理模块的第一层,其输入为所述心脏增强ct图像,输出为所述心脏增强ct图像经过moduleone1中的卷积和下采样处理所得到的结果,此处将moduleone1的输出记为moduleone1_res;moduleone2为所述第一处理模块的第二层,其输入为moduleone1_res,输出为moduleone1_res经过moduleone2中的卷积和下采样处理所得到的结果,此处将moduleone2的输出记为moduleone2_res;moduleone3为所述第一处理模块的第三层,其输入为moduleone2_res,输出为moduleone2_res经过moduleone3中的卷积和下采样处理所得到的结果。
46.以moduleone1中的具体处理过程为例详细说明如下:心脏增强ct图像的通道数为3个,即r(红色分量)、g(绿色分量)、b(蓝色分量)这三个通道,moduleone1中的卷积核对心脏增强ct图像进行卷积处理,得到心脏增强ct图像的特征图(feature map),moduleone1中的卷积核个数可以根据实际情况进行设置,在本实施例中,优选将其设置为8个,则心脏增强ct图像经过moduleone1的卷积处理后,可以得到8通道的特征图,再采用激活函数(例如,可以采用线性整流函数(rectified linear unit,relu)作为激活函数)对特征图进行处
理,将特征图中的值限定在[0,1]的范围内,然后对特征图进行下采样处理,缩小特征图的尺度,例如,可以通过下采样处理将特征图的长度和宽度均缩小为原来的一半,经过moduleone1的下采样处理后的特征图将作为moduleone2的输入。
[0047]
moduleone2和moduleone3的处理过程与moduleone1类似,此处不再赘述。但是,需要注意的是,moduleone2中的卷积核个数为moduleone1中的卷积核个数的2倍,moduleone3中的卷积核个数为moduleone2中的卷积核个数的2倍,这样,moduleone1、moduleone2、moduleone3所输出的特征图的通道数依次为8个、16个和32个。最后,moduleone3输出的特征图即为所述第一处理结果。
[0048]
步骤s102、使用所述第二处理模块中预设的残差模块对所述第一处理结果进行处理,得到第二处理结果。
[0049]
所述第二处理模块中包括残差模块,在所述残差模块的结构中包括两条支线,其中,第一条支线用于对所述第一处理结果进行更深层特征的提取,而第二条支线则用于保持所述第一处理结果,在第一条支线中所述第一处理结果可以依次经过卷积处理、relu函数处理、卷积处理等过程,第一条支线中进行卷积处理的卷积核的个数与moduleone3中的卷积核个数相同,因此,整个处理过程中,特征图的通道数保持不变;而第二条支线中,通过跳跃连接的方式,使得所述第一处理结果可以跳过在第一条支线中的处理过程,两条支线上的数据加权叠加得到所述第二处理结果。通过这样的处理方式,能够有效保持数据的高频特性,解决了由于网络深度的加深而可能导致的梯度消失和梯度爆炸问题,使得在训练更深的神经网络的同时,又能保证良好的性能。
[0050]
步骤s103、使用所述第三处理模块对所述第二处理结果进行卷积和上采样处理,得到与所述心脏增强ct图像对应的预定格式的图像。
[0051]
所述第三处理模块的层数与所述第一处理模块的层数相同,以下仍以层数为3的情况为例进行说明,将这三层依次记为moduletr1、moduletr2和moduletr3。其中,moduletr1为所述第三处理模块的第一层,其输入为所述第二处理结果,输出为所述第二处理结果经过moduletr1中的卷积和上采样处理所得到的结果,此处将moduletr1的输出记为moduletr1_res;moduletr2为所述第三处理模块的第二层,其输入为moduletr1_res,输出为moduletr1_res经过moduletr2中的卷积和上采样处理所得到的结果,此处将moduletr2的输出记为moduletr2_res;moduletr3为所述第三处理模块的第三层,其输入为moduletr2_res,输出为moduletr2_res经过moduletr3中的卷积和上采样处理所得到的结果。
[0052]
以moduletr1中的具体处理过程为例详细说明如下:moduletr1中的卷积核个数与moduleone2中的卷积核个数相同,则所述第二处理结果经过moduletr1的卷积处理后,可以得到16通道的特征图,再采用激活函数(例如,可以采用relu作为激活函数)对特征图进行处理,将特征图中的值限定在[0,1]的范围内,然后对特征图进行上采样处理,扩展特征图的尺度,例如,可以通过上采样处理将特征图的长度和宽度均扩展为原来的一倍,经过moduletr1的上采样处理后的特征图将作为moduletr2的输入。
[0053]
moduletr2和moduletr3的处理过程与moduletr1类似,此处不再赘述。但是,需要注意的是,moduletr2中的卷积核个数为moduletr1中的卷积核个数的一半,moduletr3中的卷积核个数为3,这样,moduletr1、moduletr2、moduletr3所输出的特征图的通道数依次为
16个、8个和3个。最后,可以对moduletr3所输出的特征图再进行1次卷积处理(卷积核个数为3)和1次激活函数(例如,可以采用sigmoid作为激活函数)处理,得到与所述心脏增强ct图像对应的预定格式的图像。需要注意的是,在所述第一处理模块和所述第三处理模块之间还引入了跳跃连接,在所述第三处理模块中的每一次卷积处理之前,均将待进行卷积处理的数据与所述第一处理模块中相同通道数的输出结果进行叠加,并将叠加结果作为紧接着的下一次卷积处理的输入。
[0054]
在本实施例中,将心脏增强ct图像保存为预定的格式,并在三维重建坐标系统中进行优化处理,能够减少呼吸、心跳产生的噪声。
[0055]
在本技术的一些实施例中,基于前述方案,重建单元124包括:标识单元1241,根据ct成像原理确定心脏的心房、心室、心脏冠状窦及其分支血管中的心脏造影剂、心肌及脂肪的阀值范围并进行显示;编辑单元1242,利用编辑功能对显示的结构进行分割,获得心脏的解剖结构,所述解剖结构包括:左心房、右心房、左心室和右心室、冠状动脉和冠状静脉。
[0056]
参考图3,在本技术的一些实施例中,基于前述方案,3d打印模块13具体包括:格式转换单元131,将所述心脏结构的三维解剖模型转化为打印模块能够识别的文件格式;模型输入单元132,将转化后的所述心脏结构的三维解剖模型输入到打印模块;3d打印单元133,被配置为根据输入的心脏结构的三维解剖模型打印出1:n的心脏3d打印模型,其中,n为大于等于1的正整数。当n=1时,打印出来的是1:1的心脏3d打印模型,一方面节省了3d打印的打印材料,另一方面使得测量出来的相关数据不需要进行二次换算,便于后续的计算,因此提高了计算的效率。
[0057]
参考图4,在本技术的一些实施例中,基于前述方案,计算模块14包括:第一测量单元141,基于所述心脏3d打印模型,获得正前位心脏横径c、第一水平距离v1和正侧位左右心室间电极直接距离l2;第一计算单元142,基于预设的第一计算函数,根据所述第一水平距离v1和所述正侧位左右心室间电极直接距离l2得到左右心室直接距离最大值dd,其中第一计算函数为dd2=v12+l22;第二计算单元143,计算左、右心室电极植入位置间dd/c,获得适配的心室电极间直接距离。
[0058]
参考图5,在本技术的一些实施例中,基于前述方案,计算模块14包括:第二测量单元144,基于所述心脏3d打印模型,获得正前位心脏横径c、第二水平距离v2及正位片左右心室间电极距离l1;第三计算单元145,基于预设的第二计算函数,根据v2和l1得到左右心室直接距离最大值dd,其中第二计算函数为dd2=v22+l12;第四计算单元146,用于计算左、右心室电极植入位置间dd/c,获得适配的心室电极间直接距离。
[0059]
参考图6,在本技术的一些实施例中,基于前述方案,计算模块14包括:
[0060]
第一测量单元141,基于所述心脏3d打印模型,获得正前位心脏横径c、第一水平距离v1和正侧位左右心室间电极直接距离l2;第一计算单元142,基于预设的第一计算函数,根据所述第一水平距离v1和所述正侧位左右心室间电极直接距离l2得到左右心室直接距离最大值dd,其中第一计算函数为dd2=v12+l22;第二计算单元143,计算左、右心室电极植入位置间dd/c,获得适配的心室电极间直接距离;第二测量单元144,基于所述心脏3d打印模型,获得正前位心脏横径c、第二水平距离v2及正位片左右心室间电极距离l1;第三计算单元145,基于预设的第二计算函数,根据v2和l1得到左右心室直接距离最大值dd,其中第二计算函数为dd2=v22+l12;比较单元147,将按照所述第一计算函数和第二计算函数得到
的dd的数值大小进行比较,确定数值较大的dd作为最终值;第四计算单元146,用于计算左、右心室电极植入位置间dd/c,获得适配的心室电极间直接距离。
[0061]
根据本技术实施例的一个方面,参考图7,提供了一种心脏再同步治疗中的手术机器人系统20,包括:接收模块21、识别模块22和确定模块23。
[0062]
具体地,接收模块21,用于接收所述心脏结构的三维解剖模型;识别模块22,用于对所述三维解剖模型进行识别,得到心脏的解剖结构信息,解剖结构信息包括:左心房、右心房、左心室和右心室、冠状动脉和冠状静脉的信息;确定模块23,用于基于解剖结构信息,根据预设算法确定获得适配的心室电极间直接距离。
[0063]
需要说明的是,在本实施例中,基于解剖结构信息,根据预设算法确定获得适配的心室电极间直接距离,与图4、图5和图6对应的实施例类似,在此不再赘述。
[0064]
作为本发明的实施例,通过一种心脏再同步治疗中的手术机器人系统,接收并识别三维解剖模型,对所述三维解剖模型进行识别,得到心脏的解剖结构信息,并用于基于解剖结构信息,根据预设算法确定获得适配的心室电极间直接距离,因此在用于心脏再同步治疗中的手术辅助系统的基础上,进一步提高了自动化水平,使得获取左、右心室电极、心房电极植入位置的更为智能化和自动化。
[0065]
参考图8,在本技术的一些实施例中,基于前述方案,所述心脏再同步治疗中的手术机器人系统还包括:转换模块24、导航路径确定模块25和导航模块26.
[0066]
其中,转换模块24,用于将所述解剖结构信息根据预设的算法转换得到多维导航因子向量。
[0067]
可以理解的是,解剖结构信息包括:左心房、右心房、左心室和右心室、冠状动脉和冠状静脉的信息。将解剖结构信息先转化为信息矩阵,该信息矩阵包括左心房、右心房、左心室和右心室、冠状动脉和冠状静脉的信息。由于信息矩阵中左心房、右心房、左心室和右心室、冠状动脉和冠状静脉的信息的不同,需要不同的导航方式,因此信息矩阵与导航存在一定的对应关系。将信息矩阵乘以基向量得到解剖结构信息向量,将该解剖结构信息向量根据预设的算法转换得到多维导航因子向量,该多维导航因子向量反应的是解剖结构信息的多样性。
[0068]
导航路径确定模块25,用于根据所述多维导航因子向量获得至少一条导航路径,并计算每条导航路径的优选概率,基于优选概率及导航路径的安全因子,确定导航路径。
[0069]
可以理解的是,由于解剖结构信息的不同,对应的导航路径可能不同,对于给定的一种解剖结构,需要确定最适合的导航路径,可以通过对多条导航路径的优选概率进行排序,同时确定每条导航路径的安全因子,根据优选概率以及安全因子两个维度的权衡,确定最优的导航路径作为导航路径。需要说明的是,最优的导航路径可能是优选概率排名第二且安全因子排名第一的路径,优选概率排名第一且安全因子排名第二的不一定是最优的导航路径,因为这个导航是在心脏里面进行的,安全是重要的考量因素,安全因子的权重和优选概率的权重存在一定的权衡,需要根据实际情况进行设置和调整。
[0070]
导航模块26,用于根据所述导航路径对电极的目标安装位置进行导航。
[0071]
参考图9,在本技术的一些实施例中,基于前述方案,所述心脏再同步治疗中的手术机器人系统还包括:第一显示模块26、第二显示模块27和第三显示模块28.
[0072]
其中,第一显示模块26,将所述导航路径进行3d显示,在接收到选择指令后,响应
于所述选择指令,显示对应的导航路径的3d线路走向图。
[0073]
可以理解的是,3d线路走向图便于在显示端对导航路径进行全方位的展示。
[0074]
其中,第二显示模块27,根据所述3d线路走向图进行导航,确定并显示左室冠状窦电极定位于冠状静脉左室外膜面分支的第一状态。
[0075]
可以理解的是,第二显示模块便于对定位于冠状静脉左室外膜面分支的左室冠状窦电极的状态进行显示和监控。
[0076]
其中,第三显示模块28,显示右室螺旋电极定位于右室心尖部,心房电极定位于右心耳的第二状态。
[0077]
可以理解的是,第二显示模块便于对定位于右室心尖部的右室螺旋电极以及定位于右心耳的心房电极的状态进行显示和监控。
[0078]
因此,通过第一显示模块、第二显示模块和第三显示模块,实现了对对导航路径、左室冠状窦电极、右室螺旋电极以及心房电极的全方位的监控。
[0079]
参考图10,示出了根据本技术的一种用于心脏再同步治疗中的手术辅助设备100,具体包括:电极101,用于感测心脏活动;操作设备102,被配置为根据适配的心室电极间直接距离调整电极植入心血管的位置。具体地,操作设备102,被配置为基于适配的心室电极间直接距离,先通过左心室四极导线上的四个电极环构成多维的起搏向量组合配置,然后通过测量四个电极起搏和膈神经刺激阈值来调整植入血管位置,使得左心室多个部位同时起搏,扩大心室起搏面积,增加心室起搏协调性。其中,所述适配的心室电极间直接距离根据获取模块、创建模块、3d打印模块和计算模块获得:获取模块11,被配置成获取患者心脏的ct图像数据集;创建模块12,与所述获取模块连接,接收所述获取模块发送来的图像数据集,所述创建模块被配置成根据所述图像数据集建立包含冠状静脉分支及右心室的心脏结构三维解剖模型;3d打印模块13,与所述创建模块连接,接收所述创建模块发送来的心脏结构三维解剖模型,所述3d打印模块被配置成根据所述心脏结构的三维解剖模型获得患者的心脏3d打印模型;计算模块14,与所述3d打印模块连接,所述计算模块被配置成基于所述心脏3d打印模型,获得适配的心室电极间直接距离。
[0080]
在本技术的一些实施例所提供的用于心脏再同步治疗中的手术辅助设备包括电极和操作设备,其中电极用于感测心脏活动,操作设备被配置为根据适配的心室电极间直接距离调整电极植入心血管的位置;其中,所述适配的心室电极间直接距离根据获取模块、创建模块、3d打印模块和计算模块获得:获取模块,被配置成获取患者心脏的ct图像数据集;创建模块,与所述获取模块连接,接收所述获取模块发送来的图像数据集,所述创建模块被配置成根据所述图像数据集建立包含冠状静脉分支及右心室的心脏结构三维解剖模型;3d打印模块,与所述创建模块连接,接收所述创建模块发送来的心脏结构三维解剖模型,所述3d打印模块被配置成根据所述心脏结构的三维解剖模型获得患者的心脏3d打印模型;计算模块,与所述3d打印模块连接,所述计算模块被配置成基于所述心脏3d打印模型,获得适配的心室电极间直接距离。本方案通过对ct图像数据集构建包含冠状静脉分支及右心室的心脏结构三维解剖模型并通过3d打印模块打印出来,从而立体展示冠状静脉各分支以及心腔的空间结构,重建带有冠状静脉分支的心脏立体模型,基于该心脏立体模型精确计算出适配的心室电极间直接距离,从而精确指导左、右心室电极、心房电极植入位置。基于上述基础,操作设备被配置为基于适配的心室电极间直接距离,先通过左心室四极导线
上的四个电极环构成多维的起搏向量组合配置,然后通过测量四个电极起搏和膈神经刺激阈值来调整植入血管位置。从而使得左心室多个部位同时起搏,扩大心室起搏面积,增加心室起搏协调性。
[0081]
附图中的流程图和框图,图示了按照本技术各种实施例的系统、方法和计算机程序产品的可能实现的体系架构、功能和操作。其中,流程图或框图中的每个方框可以代表一个模块、程序段、或代码的一部分,上述模块、程序段、或代码的一部分包含一个或多个用于实现规定的逻辑功能的可执行指令。也应当注意,在有些作为替换的实现中,方框中所标注的功能也可以以不同于附图中所标注的顺序发生。例如,两个接连地表示的方框实际上可以基本并行地执行,它们有时也可以按相反的顺序执行,这依所涉及的功能而定。也要注意的是,框图或流程图中的每个方框、以及框图或流程图中的方框的组合,可以用执行规定的功能或操作的专用的基于硬件的系统来实现,或者可以用专用硬件与计算机指令的组合来实现。
[0082]
描述于本技术实施例中所涉及到的单元可以通过软件的方式实现,也可以通过硬件的方式来实现,所描述的单元也可以设置在处理器中。其中,这些单元的名称在某种情况下并不构成对该单元本身的限定。
[0083]
应当注意,尽管在上文详细描述中提及了用于动作执行的设备的若干模块或者单元,但是这种划分并非强制性的。实际上,根据本技术的实施方式,上文描述的两个或更多模块或者单元的特征和功能可以在一个模块或者单元中具体化。反之,上文描述的一个模块或者单元的特征和功能可以进一步划分为由多个模块或者单元来具体化。
[0084]
通过以上的实施方式的描述,本领域的技术人员易于理解,这里描述的示例实施方式可以通过软件实现,也可以通过软件结合必要的硬件的方式来实现。因此,根据本技术实施方式的技术方案可以以软件产品的形式体现出来,该软件产品可以存储在一个非易失性存储介质(可以是cd-rom,u盘,移动硬盘等)中或网络上,包括若干指令以使得一台计算设备(可以是个人计算机、服务器、触控终端、或者网络设备等)执行根据本技术实施方式的方法。
[0085]
本领域技术人员在考虑说明书及实践这里公开的实施方式后,将容易想到本技术的其它实施方案。本技术旨在涵盖本技术的任何变型、用途或者适应性变化,这些变型、用途或者适应性变化遵循本技术的一般性原理并包括本技术未公开的本技术领域中的公知常识或惯用技术手段。
[0086]
应当理解的是,本技术并不局限于上面已经描述并在附图中示出的精确结构,并且可以在不脱离其范围进行各种修改和改变。本技术的范围仅由所附的权利要求来限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1