以高用量含有四环性化合物的制剂的制作方法
以高用量含有四环性化合物的制剂
1.本技术是国际申请日为2015年4月24日、国际申请号为pct/jp2015/062520、进入中国国家阶段的申请号为201580020724.5、发明名称为“以高用量含有四环性化合物的制剂”的pct申请的分案申请。
技术领域
2.本发明涉及作为具有alk抑制作用的物质的四环性化合物的医药组合物,特别涉及经口给药用制剂等。
背景技术:
3.间变性淋巴瘤激酶(anaplastic lymphoma kinase,alk)是属于胰岛素受体家族的受体型酪氨酸激酶之一(非专利文献1、非专利文献2),已报告的是,alk的基因异常会引发与其它基因融合而生成的异常激酶。
4.作为与alk的异常相伴的疾病,已知例如癌症和癌症转移(非专利文献1、专利文献1)、抑郁、认知功能障碍(非专利文献2)等,提供alk抑制剂会提供这些疾病的有效治疗和预防药。
5.作为具有alk抑制作用的化合物,已知式(i)所表示的化合物(化合物名:9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5h-苯并[b]咔唑-3-甲腈)等(专利文献2、专利文献3、专利文献4)。
[0006]
[化1]。
[0007]
所述药剂期望开发为能够经口给药的剂型,但是否能够开发出经口给药制剂取决于药物的生物利用度的高低。作为影响生物利用度的因素之一,可以举出药物的水溶性,一般而言,将水难溶性或不溶性化合物进行经口给药时,生物利用度低。提高有效成分的生物利用度、改善经口吸收性对于稳定地发挥有效成分的药效而言也是重要的。
[0008]
另一方面,为了提高水难溶性或不溶性化合物的药物的血中浓度、提高治疗效果,可以考虑以高用量使用药物。但是,针对经口给药制剂的服用,期望减少每一次的服用个数和服用次数、改善患者的方便性。因此,需要在每1单位的制剂中包含高含量药物的制剂。
[0009]
已报告有使式(i)所表示的化合物或其盐与溶解辅助剂共存的组合物(专利文献4)。此外,以改善难溶性物质的溶解性和经口吸收性为目的,已报告有包含类固醇等水难溶
性成分、表面活性剂和有机高分子且在水的存在下进行湿式造粒而得到的组合物(专利文献5)。
[0010]
现有技术文献专利文献专利文献1:jp2009100783(a)专利文献2:日本特许4588121号专利文献3:日本特许4918630号专利文献4:日本特开2012-126711专利文献5:日本特开2008-280352非专利文献非专利文献1:nature,第448卷,第561-566页,2007年非专利文献2:neuropsychopharmacology,第33卷,第685-700页,2008年。
技术实现要素:
[0011]
本发明人等发现,在以高用量包含式(i)所表示的化合物或其盐的制剂的溶出过程中,该化合物或其盐会凝集而不崩解,其结果是溶出性降低。本发明人等反复进行为解决该问题的深入研究,结果发现,通过形成包含水难溶性或不溶性的式(i)所表示的化合物或其盐的颗粒、并使该颗粒与崩解剂共存,从而可以得到以高用量含有式(i)所表示的化合物或其盐且溶出性良好的制剂。
[0012]
此外,本发明人等发现,作为表面活性剂的月桂基硫酸钠的制造方法会对水难溶性或不溶性化合物的溶出性造成影响。
[0013]
本发明人等基于这些见解而进一步进行研究,从而完成了本发明。
[0014]
用于解决问题的手段即,本发明如下所述。
[0015]
(1-1) 医药组合物,其包含:(i)含有式(i)所表示的化合物或其盐的颗粒、以及(ii)崩解剂,[化2]。
[0016]
(1-2) 根据(1-1)所述的组合物,其中,相对于组合物整体,含有5重量%以上的前述(ii)的崩解剂。
[0017]
(1-3) 根据(1-1)或(1-2)所述的组合物,其中,相对于组合物整体,含有5重量%以上且30重量%以下的前述(ii)的崩解剂。
[0018]
(1-4) 根据(1-1)~(1-3)中任一项所述的组合物,其中,相对于组合物整体,含有7.5重量%以上的前述(ii)的崩解剂。
[0019]
(1-5) 根据(1-1)~(1-4)中任一项所述的组合物,其中,相对于组合物整体,含有7.5重量%以上且30重量%以下的前述(ii)的崩解剂。
[0020]
(1-6) 根据(1-1)~(1-5)中任一项所述的组合物,其中,前述(ii)的崩解剂选自淀粉乙醇酸钠、低取代羟丙基纤维素、羧甲基纤维素钙、碳酸氢钠、α化淀粉、氯化钠、玉米淀粉、交联羧甲基纤维素钠、结晶纤维素、硅酐和羧甲基纤维素。
[0021]
(1-7) 根据(1-1)~(1-6)中任一项所述的组合物,其中,前述(ii)的崩解剂是对每1.0g崩解剂添加20ml第十六版修订日本药典溶出试验第1液时其体积达到2.5倍以上的崩解剂。
[0022]
(1-8) 根据(1-1)~(1-6)中任一项所述的组合物,其中,前述(ii)的崩解剂选自低取代羟丙基纤维素、羧甲基纤维素钙、碳酸氢钠和α化淀粉。
[0023]
(1-9) 根据(1-1)~(1-8)中任一项所述的组合物,其中,前述(ii)的崩解剂为羧甲基纤维素钙。
[0024]
(1-10) 根据(1-1)~(1-9)中任一项所述的组合物,其中,前述颗粒在颗粒内含有崩解剂。
[0025]
(1-11) 根据(1-1)~(1-9)中任一项所述的组合物,其包含:(i)含有崩解剂和式(i)所表示的化合物或其盐的颗粒、以及(ii)崩解剂。
[0026]
(1-12) 根据(1-10)或(1-11)中任一项所述的组合物,其中,前述颗粒内包含的崩解剂选自淀粉乙醇酸钠、低取代羟丙基纤维素、羧甲基纤维素钙、碳酸氢钠、α化淀粉、氯化钠、玉米淀粉、交联羧甲基纤维素钠、结晶纤维素、硅酐和羧甲基纤维素。
[0027]
(1-13) 根据(1-10)或(1-11)中任一项所述的组合物,其中,前述颗粒内包含的崩解剂是对每1.0g崩解剂添加20ml第十六版修订日本药典溶出试验第1液时其体积达到2.5倍以上的崩解剂。
[0028]
(1-14) 根据(1-10)~(1-13)中任一项所述的组合物,其中,前述颗粒内包含的崩解剂选自羧甲基纤维素钙、低取代羟丙基纤维素、淀粉乙醇酸钠和α化淀粉。
[0029]
(1-15) 根据(1-10)~(1-14)中任一项所述的组合物,其中,前述颗粒内包含的崩解剂为羧甲基纤维素钙。
[0030]
(1-16) 根据(1-1)~(1-15)中任一项所述的组合物,其中,前述颗粒在颗粒内含有溶解辅助剂。
[0031]
(1-17) 根据(1-1)~(1-15)中任一项所述的组合物,其包含:(i)含有崩解剂、溶解辅助剂和式(i)所表示的化合物或其盐的颗粒、以及(ii)崩解剂。
[0032]
(1-18) 根据(1-16)或(1-17)所述的组合物,其中,前述溶解辅助剂选自下述组:柠檬酸、羟丙基纤维素、羟丙基甲基纤维素、硬脂富马酸钠、甲基丙烯酸共聚物ld、甲基纤维素、月桂基硫酸钠、聚氧乙烯(40)硬脂酸酯、精制虫胶、脱氢乙酸钠、富马酸、dl-苹果酸、l-抗坏血酸硬脂酸酯、l-天冬氨酸、己二酸、甲基丙烯酸氨基烷基酯共聚物e、藻酸丙二醇酯、酪蛋白、酪蛋白钠、羧基乙烯基聚合物、羧甲基乙基纤维素、琼脂粉、瓜尔胶、丁二酸、共聚维酮、乙酸邻苯二甲酸纤维素、酒石酸、磺基丁二酸钠二辛酯、玉米蛋白、脱脂奶粉、脱水山梨糖醇三油酸酯、乳酸、乳酸铝、抗坏血酸棕榈酸酯、羟乙基甲基纤维素、羟丙基甲基
纤维素乙酸酯丁二酸酯、聚氧乙烯(105)聚氧丙烯(5)二醇、聚氧乙烯氢化蓖麻油60、聚氧乙烯(35)蓖麻油、聚(4-苯乙烯磺酸钠)、聚乙烯醇乙缩醛二乙氨基乙酸酯、聚乙烯醇、马来酸、甲基丙烯酸共聚物s、聚桂醇、硫酸、硫酸铝、磷酸、磷酸二氢钙、十二烷基苯磺酸钠、乙烯基吡咯烷酮
·
乙酸乙烯酯共聚物、月桂酰肌氨酸钠、乙酰色氨酸、甲基硫酸钠、乙基硫酸钠、丁基硫酸钠、辛基硫酸钠、癸基硫酸钠、十四烷基硫酸钠、十六烷基硫酸钠、十八烷基硫酸钠。
[0033]
(1-19) 根据(1-16)~(1-18)中任一项所述的组合物,其中,前述溶解辅助剂为月桂基硫酸钠。
[0034]
(1-20) 根据(1-19)所述的组合物,其中,月桂基硫酸钠为通过晶析而得到。
[0035]
(1-21) 根据(1-19)或(1-20)所述的组合物,其中,月桂基硫酸钠为nikkol sls。
[0036]
(1-22) 根据(1-19)~(1-21)中任一项所述的组合物,其中,月桂基硫酸钠为1/8水合物的晶体。
[0037]
(1-23) 根据(1-16)~(1-22)中任一项所述的组合物,其中,式(i)所表示的化合物与溶解辅助剂的重量比为100:2~100:60。
[0038]
(1-24) 根据(1-16)~(1-23)中任一项所述的组合物,其中,式(i)所表示的化合物与溶解辅助剂的重量比为100:2~100:30。
[0039]
(1-25) 根据(1-1)~(1-24)中任一项所述的组合物,其中,前述颗粒在颗粒内含有结合剂。
[0040]
(1-26) 根据(1-25)所述的组合物,其中,前述结合剂为羟丙基纤维素。
[0041]
(1-27) 根据(1-1)~(1-26)中任一项所述的组合物,其中,前述颗粒为通过湿式造粒而得到。
[0042]
(1-28) 根据(1-1)~(1-27)中任一项所述的组合物,其中,前述颗粒的平均粒径为150μm以上。
[0043]
(1-29) 根据(1-1)~(1-28)中任一项所述的组合物,其中,前述颗粒的平均粒径为180μm以上。
[0044]
(1-30) 根据(1-1)~(1-29)中任一项所述的组合物,其中,前述颗粒的平均粒径为200μm以上。
[0045]
(1-31) 根据(1-1)~(1-30)中任一项所述的组合物,其中,前述颗粒的平均粒径为250μm以上。
[0046]
(1-32) 根据(1-1)~(1-31)中任一项所述的组合物,其中,前述颗粒的平均粒径为1mm以下。
[0047]
(1-33) 根据(1-1)~(1-32)中任一项所述的组合物,其中,前述颗粒的堆密度为0.5g/ml以上,且振实密度为0.6g/ml以上。
[0048]
(1-34) 根据(1-1)~(1-33)中任一项所述的组合物,其中,相对于组合物整体,含有换算为游离体计20~70重量%的式(i)所表示的化合物或其盐。
[0049]
(1-35) 根据(1-1)~(1-34)中任一项所述的组合物,其中,相对于组合物整体,含有换算为游离体计35~60重量%的式(i)所表示的化合物或其盐。
[0050]
(1-36) 根据(1-1)~(1-35)中任一项所述的组合物,其中,式(i)所表示的化合物或其盐为式(i)所表示的化合物的单盐酸盐。
[0051]
(1-37) 根据(1-36)所述的组合物,其中,式(i)所表示的化合物的单盐酸盐是特
征在于在粉末x射线衍射图案中在8.4
°
、14.0
°
、16.7
°
、18.8
°
、23.3
°
附近的衍射角(2θ)处具有峰的晶体。
[0052]
(1-38) 医药制剂,其含有(1-1)~(1-37)中任一项所述的组合物。
[0053]
(1-39) 根据(1-38)所述的医药制剂,其为经口给药制剂。
[0054]
(1-40) 根据(1-39)所述的医药制剂,其中,经口给药制剂为固体制剂。
[0055]
(1-41) 根据(1-40)所述的医药制剂,其中,固体制剂为片剂、胶囊剂或颗粒剂。
[0056]
(1-42) 胶囊剂,其填充有(1-1)~(1-37)中任一项所述的组合物。
[0057]
(1-43) 根据(1-38)~(1-42)中任一项所述的制剂,其中,每单位制剂含有换算为游离体计60mg~240mg的式(i)所表示的化合物或其盐。
[0058]
(1-44) 根据(1-38)~(1-43)中任一项所述的制剂,其中,每单位制剂含有换算为游离体计140mg~190mg的式(i)所表示的化合物或其盐。
[0059]
(2-1) 医药制剂,其包含:(i)含有式(i)所表示的化合物或其盐的颗粒、以及(ii)崩解剂。
[0060]
(2-2) 根据(2-1)所述的制剂,其中,相对于制剂整体,含有5重量%以上的前述(ii)的崩解剂。
[0061]
(2-3) 根据(2-1)或(2-2)所述的制剂,其中,相对于制剂整体,含有5重量%以上且30重量%以下的前述(ii)的崩解剂。
[0062]
(2-4) 根据(2-1)或(2-2)所述的制剂,其中,相对于制剂整体,含有7.5重量%以上的前述(ii)的崩解剂。
[0063]
(2-5) 根据(2-1)~(2-4)中任一项所述的制剂,其中,相对于制剂整体,含有7.5重量%以上且30重量%以下的前述(ii)的崩解剂。
[0064]
(2-6) 根据(2-1)~(2-5)中任一项所述的制剂,其中,前述(ii)的崩解剂选自淀粉乙醇酸钠、低取代羟丙基纤维素、羧甲基纤维素钙、碳酸氢钠、α化淀粉、氯化钠、玉米淀粉、交联羧甲基纤维素钠、结晶纤维素、硅酐和羧甲基纤维素。
[0065]
(2-7) 根据(2-1)~(2-6)中任一项所述的制剂,其中,前述(ii)的崩解剂选自低取代羟丙基纤维素、羧甲基纤维素钙、碳酸氢钠、α化淀粉。
[0066]
(2-8) 根据(2-1)~(2-7)中任一项所述的制剂,其中,前述(ii)的崩解剂为羧甲基纤维素钙。
[0067]
(2-9) 根据(2-1)~(2-8)中任一项所述的制剂,其中,前述颗粒在颗粒内含有崩解剂。
[0068]
(2-10) 根据(2-1)~(2-9)中任一项所述的制剂,其包含:(i)含有崩解剂和式(i)所表示的化合物或其盐的颗粒、以及(ii)崩解剂。
[0069]
(2-11) 根据(2-10)所述的制剂,其中,前述颗粒内包含的崩解剂选自淀粉乙醇酸钠、低取代羟丙基纤维素、羧甲基纤维素钙、碳酸氢钠、α化淀粉、氯化钠、玉米淀粉、交联羧甲基纤维素钠、结晶纤维素、硅酐和羧甲基纤维素。
[0070]
(2-12) 根据(2-9)~(2-11)中任一项所述的制剂,其中,前述颗粒内包含的崩解剂选自羧甲基纤维素钙、低取代羟丙基纤维素和淀粉乙醇酸钠。
[0071]
(2-13) 根据(2-9)~(2-12)中任一项所述的制剂,其中,前述颗粒内包含的崩解剂为羧甲基纤维素钙。
[0072]
(2-14) 根据(2-1)~(2-13)中任一项所述的制剂,其中,前述颗粒在颗粒内含有溶解辅助剂。
[0073]
(2-15) 根据(2-1)~(2-14)中任一项所述的制剂,其包含:(i)含有崩解剂、溶解辅助剂和式(i)所表示的化合物或其盐的颗粒、以及(ii)崩解剂。
[0074]
(2-16) 根据(2-14)或(2-15)中任一项所述的制剂,其中,前述溶解辅助剂选自下述组:柠檬酸、羟丙基纤维素、羟丙基甲基纤维素、硬脂富马酸钠、甲基丙烯酸共聚物ld、甲基纤维素、月桂基硫酸钠、聚氧乙烯(40)硬脂酸酯、精制虫胶、脱氢乙酸钠、富马酸、dl-苹果酸、l-抗坏血酸硬脂酸酯、l-天冬氨酸、己二酸、甲基丙烯酸氨基烷基酯共聚物e、藻酸丙二醇酯、酪蛋白、酪蛋白钠、羧基乙烯基聚合物、羧甲基乙基纤维素、琼脂粉、瓜尔胶、丁二酸、共聚维酮、乙酸邻苯二甲酸纤维素、酒石酸、磺基丁二酸钠二辛酯、玉米蛋白、脱脂奶粉、脱水山梨糖醇三油酸酯、乳酸、乳酸铝、抗坏血酸棕榈酸酯、羟乙基甲基纤维素、羟丙基甲基纤维素乙酸酯丁二酸酯、聚氧乙烯(105)聚氧丙烯(5)二醇、聚氧乙烯氢化蓖麻油60、聚氧乙烯(35)蓖麻油、聚(4-苯乙烯磺酸钠)、聚乙烯醇乙缩醛二乙氨基乙酸酯、聚乙烯醇、马来酸、甲基丙烯酸共聚物s、聚桂醇、硫酸、硫酸铝、磷酸、磷酸二氢钙、十二烷基苯磺酸钠、乙烯基吡咯烷酮
·
乙酸乙烯酯共聚物、月桂酰肌氨酸钠、乙酰色氨酸、甲基硫酸钠、乙基硫酸钠、丁基硫酸钠、辛基硫酸钠、癸基硫酸钠、十四烷基硫酸钠、十六烷基硫酸钠、十八烷基硫酸钠。
[0075]
(2-17) 根据(2-14)~(2-16)中任一项所述的制剂,其中,前述溶解辅助剂为月桂基硫酸钠。
[0076]
(2-18) 根据(2-17)所述的制剂,其中,月桂基硫酸钠为通过晶析而得到。
[0077]
(2-19) 根据(2-17)或(2-18)所述的制剂,其中,月桂基硫酸钠为1/8水合物的晶体。
[0078]
(2-20) 根据(2-14)~(2-19)中任一项所述的制剂,其中,式(i)所表示的化合物与溶解辅助剂的重量比为100:2~100:60。
[0079]
(2-21) 根据(2-14)~(2-20)中任一项所述的制剂,其中,式(i)所表示的化合物与溶解辅助剂的重量比为100:2~100:30。
[0080]
(2-22) 根据(2-1)~(2-21)中任一项所述的制剂,其中,前述颗粒为通过湿式造粒而得到。
[0081]
(2-23) 根据(2-1)~(2-22)中任一项所述的制剂,其中,前述颗粒的平均粒径为150μm以上。
[0082]
(2-24) 根据(2-1)~(2-23)中任一项所述的制剂,其中,前述颗粒的平均粒径为180μm以上。
[0083]
(2-25) 根据(2-1)~(2-24)中任一项所述的制剂,其中,前述颗粒的平均粒径为200μm以上。
[0084]
(2-26) 根据(2-1)~(2-25)中任一项所述的制剂,其中,前述颗粒的平均粒径为250μm以上。
[0085]
(2-27) 根据(2-1)~(2-26)中任一项所述的制剂,其中,前述颗粒的平均粒径为1mm以下。
[0086]
(2-28) 根据(2-1)~(2-27)中任一项所述的制剂,其中,前述颗粒的堆密度为
0.5g/ml以上,且振实密度为0.6g/ml以上。
[0087]
(2-29) 根据(2-1)~(2-28)中任一项所述的制剂,其中,式(i)所表示的化合物或其盐为式(i)所表示的化合物的单盐酸盐。
[0088]
(2-30) 根据(2-29)所述的制剂,其中,式(i)所表示的化合物的单盐酸盐是特征在于在粉末x射线衍射图案中在8.4
°
、14.0
°
、16.7
°
、18.8
°
、23.3
°
附近的衍射角(2θ)处具有峰的晶体。
[0089]
(2-31) 根据(2-1)~(2-30)中任一项所述的制剂,其为经口给药制剂。
[0090]
(2-32) 根据(2-31)所述的制剂,其中,经口给药制剂为固体制剂。
[0091]
(2-33) 根据(2-32)所述的制剂,其中,固体制剂为片剂、胶囊剂或颗粒剂。
[0092]
(2-34) 根据(2-33)所述的制剂,其中,固体制剂为胶囊剂。
[0093]
(2-35) 根据(2-1)~(2-34)中任一项所述的制剂,其中,相对于制剂整体,含有换算为游离体计20~70重量%式(i)所表示的化合物或其盐。
[0094]
(2-36) 根据(2-34)所述的医药制剂,其中,相对于填充于胶囊剂中的成分整体,含有换算为游离体计35~60重量%的式(i)所表示的化合物或其盐。
[0095]
(2-37) 根据(2-1)~(2-36)中任一项所述的制剂,其中,每单位制剂含有换算为游离体计60mg~240mg的式(i)所表示的化合物或其盐。
[0096]
(2-38) 根据(2-1)~(2-37)中任一项所述的制剂,其中,每单位制剂含有换算为游离体计140mg~190mg的式(i)所表示的化合物或其盐。
[0097]
(3-1) 式(i)所表示的化合物或其盐的溶出性得以改善的制剂的制造方法,其特征在于,(i)对含有式(i)所表示的化合物或其盐的颗粒进行造粒;(ii)作为外加剂(後末,external additives),配合崩解剂和其它添加剂,。
[0098]
(3-2) 根据(3-1)所述的方法,其中,前述(ii)的崩解剂选自淀粉乙醇酸钠、低取代羟丙基纤维素、羧甲基纤维素钙、碳酸氢钠、α化淀粉、氯化钠、玉米淀粉、交联羧甲基纤维素钠、结晶纤维素、硅酐和羧甲基纤维素。
[0099]
(3-3) 根据(3-1)或(3-2)所述的方法,其中,前述(ii)的崩解剂是对每1.0g崩解剂添加20ml第十六版修订日本药典溶出试验第1液时其体积达到2.5倍以上的崩解剂。
[0100]
(3-4) 根据(3-1)~(3-3)中任一项所述的方法,其中,相对于制剂整体,含有7.5重量%以上且30重量%以下的前述(ii)的崩解剂。
[0101]
(3-5) 根据(3-1)~(3-4)中任一项所述的方法,其中,颗粒的平均粒径为150μm以上且1mm以下。
[0102]
(3-6) 根据(3-1)~(3-5)中任一项所述的方法,其中,颗粒的平均粒径为180μm以
上且1mm以下。
[0103]
(3-7) 根据(3-1)~(3-6)中任一项所述的方法,其中,前述颗粒的堆密度为0.5g/ml以上,且振实密度为0.6g/ml以上。
[0104]
(3-8) 根据(3-1)~(3-7)中任一项所述的方法,其中,前述(i)的颗粒在颗粒内含有崩解剂。
[0105]
(3-9) 根据(3-8)所述的方法,其中,前述颗粒内包含的崩解剂选自淀粉乙醇酸钠、低取代羟丙基纤维素、羧甲基纤维素钙、碳酸氢钠、α化淀粉、氯化钠、玉米淀粉、交联羧甲基纤维素钠、结晶纤维素、硅酐和羧甲基纤维素。
[0106]
(3-10) 根据(3-8)或(3-9)中任一项所述的方法,其中,前述颗粒内包含的崩解剂是对每1.0g崩解剂添加20ml第十六版修订日本药典溶出试验第1液时其体积达到2.5倍以上的崩解剂。
[0107]
(3-11) 根据(3-1)~(3-10)中任一项所述的方法,其中,前述颗粒在颗粒内含有溶解辅助剂。
[0108]
(3-12) 根据(3-1)~(3-11)中任一项所述的方法,其中,前述溶解辅助剂选自下述组:柠檬酸、羟丙基纤维素、羟丙基甲基纤维素、硬脂富马酸钠、甲基丙烯酸共聚物ld、甲基纤维素、月桂基硫酸钠、聚氧乙烯(40)硬脂酸酯、精制虫胶、脱氢乙酸钠、富马酸、dl-苹果酸、l-抗坏血酸硬脂酸酯、l-天冬氨酸、己二酸、甲基丙烯酸氨基烷基酯共聚物e、藻酸丙二醇酯、酪蛋白、酪蛋白钠、羧基乙烯基聚合物、羧甲基乙基纤维素、琼脂粉、瓜尔胶、丁二酸、共聚维酮、乙酸邻苯二甲酸纤维素、酒石酸、磺基丁二酸钠二辛酯、玉米蛋白、脱脂奶粉、脱水山梨糖醇三油酸酯、乳酸、乳酸铝、抗坏血酸棕榈酸酯、羟乙基甲基纤维素、羟丙基甲基纤维素乙酸酯丁二酸酯、聚氧乙烯(105)聚氧丙烯(5)二醇、聚氧乙烯氢化蓖麻油60、聚氧乙烯(35)蓖麻油、聚(4-苯乙烯磺酸钠)、聚乙烯醇乙缩醛二乙氨基乙酸酯、聚乙烯醇、马来酸、甲基丙烯酸共聚物s、聚桂醇、硫酸、硫酸铝、磷酸、磷酸二氢钙、十二烷基苯磺酸钠、乙烯基吡咯烷酮
·
乙酸乙烯酯共聚物、月桂酰肌氨酸钠、乙酰色氨酸、甲基硫酸钠、乙基硫酸钠、丁基硫酸钠、辛基硫酸钠、癸基硫酸钠、十四烷基硫酸钠、十六烷基硫酸钠、十八烷基硫酸钠。
[0109]
(3-13) 根据(3-1)~(3-12)中任一项所述的方法,其中,前述溶解辅助剂是通过晶析而得到的月桂基硫酸钠。
[0110]
(3-14) 根据(3-11)~(3-13)中任一项所述的方法,其中,前述溶解辅助剂为nikkol sls。
[0111]
(3-15) 根据(3-11)~(3-14)中任一项所述的方法,其中,式(i)所表示的化合物与溶解辅助剂的重量比为100:2~100:60。
[0112]
(3-16) 根据(3-1)~(3-15)中任一项所述的方法,其中,前述颗粒在颗粒内含有结合剂。
[0113]
(3-17) 根据(3-16)所述的方法,其中,前述结合剂为羟丙基纤维素。
[0114]
(3-18) 根据(3-1)~(3-17)中任一项所述的方法,其中,相对于制剂整体,含有换算为游离体计20~70重量%的式(i)所表示的化合物或其盐。
[0115]
(3-19) 根据(3-1)~(3-18)中任一项所述的方法,其中,每单位制剂含有换算为游离体计60mg~240mg的式(i)所表示的化合物或其盐。
[0116]
(3-20) 根据(3-1)~(3-19)中任一项所述的方法,其中,前述制剂是37℃下的溶出试验开始75分钟后的式(i)所表示的化合物或其盐的溶出率为65%以上的制剂。
[0117]
(3-21) 制剂,其为通过(3-1)~(3-20)中任一项所述的方法而制造。
附图说明
[0118]
图1是i型晶体的粉末x射线衍射的测定结果的图。
[0119]
图2是实施例1~4和7的通过日本药典溶出试验桨法(每分钟旋转100次)得到的溶出曲线的图。
[0120]
图3是实施例1和4~7的通过日本药典溶出试验桨法(每分钟旋转100次)得到的溶出曲线的图。
[0121]
图4是实施例8和9的通过日本药典溶出试验桨法(每分钟旋转100次)得到的溶出曲线的图。
[0122]
图5是实施例10~14的通过日本药典溶出试验桨法(每分钟旋转100次)得到的溶出曲线的图。
[0123]
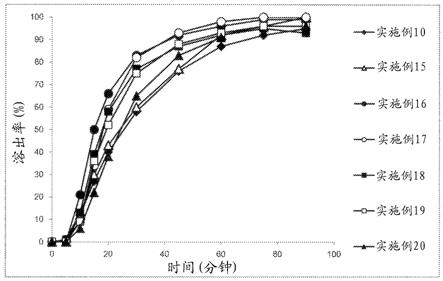
图6是实施例10和15~20(图6-1)、实施例10和21~25(图6-2)的通过日本药典溶出试验桨法(每分钟旋转100次)得到的溶出曲线的图。
[0124]
图7是实施例26和27的通过日本药典溶出试验桨法(每分钟旋转100次)得到的溶出曲线的图。
[0125]
图8是实施例28和29的通过日本药典溶出试验桨法(每分钟旋转100次)得到的溶出曲线的图。
具体实施方式
[0126]
本发明中,“颗粒”是指通过湿式造粒法、干式造粒法或加热造粒法等对粉状、块状、溶液或熔融液状等的原料进行造粒而得到的、具有大致均匀形状和尺寸的粒。作为造粒时使用的机器,从溶出性的观点出发,高速搅拌造粒机与乳钵相比更优选。应予说明,该颗粒在用于获得本发明制剂的制剂化过程(例如压片步骤)中,其尺寸、形状可以变化。
[0127]
本发明的颗粒的平均粒径例如为150μm以上,优选为180μm以上,更优选为200μm以上,进一步优选为250μm以上,特别优选为300μm以上。颗粒的平均粒径的上限没有特别限定,例如为1mm。
[0128]
平均粒径通过实施以下步骤而得到:(i)将孔径不同的筛(孔径:850、500、355、250、180、106、75、53、0μm)重叠,并在其上添加取样得到的造粒物;(ii)将前述筛振荡3分钟;(iii)测定残留在前述各筛上的造粒物的重量;(iv)由各筛的孔径和筛下累积率,使用对数正态分布近似,算出累积率50%所对应的粒径。粒径大于850μm的颗粒存在10重量%以上时,由各筛的孔径和筛上累积率,使用rosin-rammler分布,算出累积率50%所对应的粒径。
[0129]
本发明的颗粒优选堆密度为0.5g/ml以上且振实密度为0.6g/ml以上,更优选堆密度为0.6g/ml以上且振实密度为0.7g/ml以上。堆密度和振实密度的上限没有特别限定,优选为1.0g/ml。在此,堆密度和振实密度按照第十六版修订日本药典记载的方法来测定。
[0130]
本发明中,“湿式造粒”是指在将水或水与醇等的混合液作为造粒用溶剂进行添加、喷雾或散布的同时进行造粒,由此对粉体进行造粒的方法。
[0131]
粒径的尺寸可以通过增减在湿式造粒时使用的水或混合液的量来调整。
[0132]
本发明的医药组合物或医药制剂是包含(i)含有式(i)所表示的化合物或其盐的颗粒、以及(ii)崩解剂的溶出性良好的组合物或制剂。(ii)的崩解剂是指以外加剂的形式添加的物质。本发明中的“崩解剂”是指用于促进内服固体制剂后的固体制剂的快速崩解的成分。本发明中,“外加剂”和“外加剂成分”是指添加于造粒得到的颗粒的外侧的添加剂。作为该添加剂,除了崩解剂之外,还可以任选添加润滑剂、流动化剂等添加剂。
[0133]
作为(ii)中的崩解剂,可以举出淀粉乙醇酸钠、低取代羟丙基纤维素、羧甲基纤维素钙、碳酸氢钠、α化淀粉、氯化钠、玉米淀粉、交联羧甲基纤维素钠、结晶纤维素、硅酐、羧甲基纤维素等,更优选为对每1.0g崩解剂添加20ml第十六版修订日本药典溶出试验第1液时其体积达到2.5倍以上的崩解剂,进一步优选为其体积达到5倍以上的崩解剂。作为崩解剂的优选具体例,可以举出低取代羟丙基纤维素、羧甲基纤维素钙、碳酸氢钠和α化淀粉等。
[0134]
(ii)中的崩解剂的使用量相对于本发明的组合物整体或制剂整体例如为5重量%以上,优选为7.5重量%以上,进一步优选为8.5重量%以上,特别优选为10重量%以上。使用量的上限没有特别限定,例如为30重量%、25重量%。应予说明,本发明的制剂为胶囊剂、包衣片等之类的具有覆膜的制剂时,前述使用量是指相对于被该覆膜覆盖的成分整体(填充于胶囊的成分整体、被包衣覆盖的成分整体)的使用量。
[0135]
本发明中的(i)颗粒除了含有式(i)所表示的化合物或其盐之外,还可以包含多种添加剂。
[0136]
在本发明的一个方式中,(i)的颗粒含有式(i)所表示的化合物或其盐、崩解剂、溶解辅助剂、赋形剂和结合剂。该颗粒还可以包含选自润滑剂、包衣剂、稳定化剂、矫味矫臭剂和稀释剂中的一种以上的添加剂。
[0137]
作为本发明中的(i)的颗粒中包含的崩解剂,可以举出淀粉乙醇酸钠、低取代羟丙基纤维素、羧甲基纤维素钙、碳酸氢钠、α化淀粉、氯化钠、玉米淀粉、交联羧甲基纤维素钠、结晶纤维素、硅酐、羧甲基纤维素等,优选为对每1.0g崩解剂添加20ml第十六版修订日本药典溶出试验第1液时其体积达到2.5倍以上的崩解剂,进一步优选为其体积达到5倍以上的崩解剂。作为崩解剂的优选具体例,可以举出低取代羟丙基纤维素、羧甲基纤维素钙、碳酸氢钠和α化淀粉等。
[0138]
本发明中的(i)颗粒中包含的“溶解辅助剂”是指表面活性剂、有机高分子或ph调节剂。
[0139]“表面活性剂”是指分子内兼具亲水性基团和疏水性基团的物质。表面活性剂包括离子性表面活性剂和非离子性表面活性剂。
[0140]
离子性表面活性剂是指溶解于水时发生电离而成为离子(具备电荷的原子或原子团)的离子性表面活性剂。离子性表面活性剂根据生成的离子电荷而进一步被分类为阴离子性表面活性剂、阳离子性表面活性剂和两性表面活性剂。本发明中,优选为非离子性表面活性剂和阴离子性活性剂。
[0141]
作为非离子性表面活性剂,可以举出脱水山梨糖醇脂肪酸酯(c12~18)、poe脱水山梨糖醇脂肪酸酯(c12~18)、蔗糖脂肪酸酯等糖酯型表面活性剂;poe脂肪酸酯(c12~18)、poe树脂酸酯、poe脂肪酸二酯(c12~18)等脂肪酸酯型;poe烷基醚(c12~18)等醇型;poe烷基(c8~12)苯基醚、poe二烷基(c8~12)苯基醚、poe烷基(c8~12)苯基醚甲醛缩合物等烷基酚型表
面活性剂;聚氧乙烯
·
聚氧丙烯嵌段聚合物、烷基(c12~18)聚氧乙烯
·
聚氧丙烯嵌段聚合物醚等聚氧乙烯
·
聚氧丙烯嵌段聚合物型表面活性剂;poe烷基胺(c12~18)、poe脂肪酸酰胺(c12~18)等烷基胺型;poe脂肪酸双苯基醚等双酚型表面活性剂;poa苯甲基苯基(或苯基苯基)醚、poa苯乙烯基苯基(或苯基苯基)醚等多芳环型表面活性剂;poe醚和酯型硅和氟系表面活性剂;poe蓖麻油、poe氢化蓖麻油等植物油型表面活性剂等。可以优选地举出聚氧乙烯(40)硬脂酸酯、脱水山梨糖醇三油酸酯、聚氧乙烯(105)聚氧丙烯(5)二醇、聚氧乙烯氢化蓖麻油60、聚氧乙烯(35)蓖麻油、聚桂醇等。
[0142]
作为阴离子性表面活性剂,可以举出烷基硫酸盐(c12~18、na、nh4、烷醇胺)、poe烷基醚硫酸盐(c12~18、na、nh4、烷醇胺)、poe烷基苯基醚硫酸盐(c12~18、nh4、烷醇胺、ca)、poe苯甲基(或苯乙烯基)苯基(或苯基苯基)醚硫酸盐(na、nh4、烷醇胺)、聚氧乙烯-聚氧丙烯嵌段聚合物硫酸盐(na、nh4、烷醇胺)等硫酸盐型表面活性剂;石蜡(烷烃)磺酸盐(c12~22、na、ca、烷醇胺)、aos(c14~16、na、烷醇胺)、磺基丁二酸盐二烷基酯(c8~12、na、ca、mg)、烷基苯磺酸盐(c12、na、ca、mg、nh4、烷基胺、烷醇、胺、环己胺)、单烷基或二烷基(c3~6)萘磺酸盐(na、nh4、烷醇胺、ca、mg)、萘磺酸盐
·
甲醛缩合物(na、nh4)、烷基(c8~12)二苯基醚二磺酸盐(na、nh4)、木质素磺酸盐(na、ca)、poe烷基(c8~12)苯基醚磺酸盐(na)、poe烷基(c12~18)醚磺基丁二酸半酯(na)等磺酸盐型表面活性剂;脂肪酸盐(c12~18、na、k、nh4、烷醇胺)、n-甲基-脂肪酸肌氨酸盐(c12~18、na)、树脂酸盐(na、k)等羧酸型表面活性剂;poe烷基(c12~18)醚磷酸盐(na、烷醇胺)、poe单烷基或二烷基(c8~12)苯基醚磷酸盐(na、烷醇胺)、poe苯甲基(或苯乙烯基)化苯基(或苯基苯基)醚磷酸盐(na、烷醇胺)、聚氧乙烯
·
聚氧丙烯嵌段聚合物(na、烷醇胺)、磷脂酰胆碱
·
磷脂酰基乙醇亚胺(卵磷脂)、烷基(c8~12)磷酸盐等磷酸盐型表面活性剂等。可以优选地举出月桂基硫酸钠、十四烷基硫酸钠、十六烷基硫酸钠、十八烷基硫酸钠等单烷基硫酸盐、磺基丁二酸钠二辛酯、月桂酰肌氨酸钠、十二烷基苯磺酸钠等。
[0143]
有机高分子是指主要以碳作为骨架的分子量为1万以上的物质。有机高分子包括源自动植物的蛋白质、多糖类和合成树脂等。
[0144]
作为有机高分子,具体而言,可以举出羟丙基纤维素(以下也称为hpc)、羟丙基甲基纤维素、甲基纤维素、藻酸丙二醇酯、琼脂粉、瓜尔胶、玉米蛋白、羟乙基甲基纤维素等多糖类;羧基乙烯基聚合物、聚乙烯醇、或者乙酸乙烯酯树脂、聚苯乙烯磺酸钠等合成树脂;酪蛋白、酪蛋白钠等磷蛋白质等。
[0145]
将有机高分子之中对水而言的溶解度为1g/100g以上的高分子称为水溶性高分子。具体而言,可以举出羟丙基纤维素、羟丙基甲基纤维素、甲基纤维素、藻酸丙二醇酯、酪蛋白钠、羧基乙烯基聚合物、琼脂粉、瓜尔胶、共聚维酮、羟乙基甲基纤维素、聚乙烯醇等。
[0146]
将有机高分子之中在胃液的ph、即1.2~3.5的酸性条件下溶解的物质称为胃溶性高分子,将在肠内的ph6~8下迅速溶解的物质称为肠溶性高分子。作为胃溶性高分子,可以举出甲基丙烯酸氨基烷基酯共聚物e或聚乙烯醇乙缩醛二乙氨基乙酸酯等,作为肠溶性高分子,可以举出甲基丙烯酸共聚物ld(乳浊液)、甲基丙烯酸共聚物s、精制虫胶、羧甲基乙基纤维素、乙酸邻苯二甲酸纤维素(纤维醋法酯)、羟丙基甲基纤维素乙酸酯丁二酸酯、酪蛋白、玉米蛋白等。
[0147]
ph调节剂是指通过添加酸剂或碱剂来调节溶液的ph,从而使水难溶性或不溶性化
合物的溶解性提高的物质。ph调节剂可以根据所溶解的物质的性质来适当选择,例如在碱性的水难溶性或不溶性化合物的情况下,有时可以通过添加酸剂而使ph为酸性来改善溶解性。
[0148]
作为ph调节剂,可以举出己二酸、柠檬酸、柠檬酸三钠、葡萄糖酸、葡萄糖酸钠、葡萄糖酸δ-内酯、葡萄糖酸钾、丁二酸、丁二酸一钠、丁二酸二钠、乙酸钠、l-酒石酸、l-酒石酸氢钾、l-酒石酸钠、dl-酒石酸、dl-酒石酸氢钾、dl-酒石酸钠、碳酸氢钠、碳酸钾(无水)、碳酸钠、二氧化碳、乳酸、乳酸钠、冰醋酸、焦磷酸二氢二钠、富马酸、富马酸一钠、dl-苹果酸、dl-苹果酸钠、磷酸、磷酸二氢钾、磷酸二氢钠、磷酸氢二钾、磷酸氢二钠等。
[0149]
优选为己二酸、柠檬酸、葡萄糖酸、葡萄糖酸δ-内酯、丁二酸、l-酒石酸、dl-酒石酸、二氧化碳、乳酸、冰醋酸、富马酸、dl-苹果酸、磷酸等酸剂。
[0150]
本发明中,溶解辅助剂可以以适当的比例组合使用两种以上。
[0151]
本发明中,溶解辅助剂优选为以下记载的物质:柠檬酸、羟丙基纤维素、羟丙基甲基纤维素、硬脂富马酸钠、甲基丙烯酸共聚物ld、甲基纤维素、月桂基硫酸钠、聚氧乙烯(40)硬脂酸酯、精制虫胶、脱氢乙酸钠、富马酸、dl-苹果酸、l-抗坏血酸硬脂酸酯、l-天冬氨酸、己二酸、甲基丙烯酸氨基烷基酯共聚物e、藻酸丙二醇酯、酪蛋白、酪蛋白钠、羧基乙烯基聚合物、羧甲基乙基纤维素、琼脂粉、瓜尔胶、丁二酸、共聚维酮、乙酸邻苯二甲酸纤维素、酒石酸、磺基丁二酸钠二辛酯、玉米蛋白、脱脂奶粉、脱水山梨糖醇三油酸酯、乳酸、乳酸铝、抗坏血酸棕榈酸酯、羟乙基甲基纤维素、羟丙基甲基纤维素乙酸酯丁二酸酯、聚氧乙烯(105)聚氧丙烯(5)二醇、聚氧乙烯氢化蓖麻油60、聚氧乙烯(35)蓖麻油、聚(4-苯乙烯磺酸钠)、聚乙烯醇乙缩醛二乙氨基乙酸酯、聚乙烯醇、马来酸、甲基丙烯酸共聚物s、聚桂醇、硫酸、硫酸铝、磷酸、磷酸二氢钙、十二烷基苯磺酸钠、乙烯基吡咯烷酮
·
乙酸乙烯酯共聚物、月桂酰肌氨酸钠、乙酰色氨酸、甲基硫酸钠、乙基硫酸钠、丁基硫酸钠、辛基硫酸钠、癸基硫酸钠、十四烷基硫酸钠、十六烷基硫酸钠、十八烷基硫酸钠。
[0152]
本发明中,溶解辅助剂更优选为以下记载的物质:柠檬酸、羟丙基纤维素、羟丙基甲基纤维素、甲基丙烯酸共聚物ld、甲基纤维素、月桂基硫酸钠、精制虫胶、脱氢乙酸钠、富马酸、dl-苹果酸、l-抗坏血酸硬脂酸酯、l-天冬氨酸、己二酸、藻酸丙二醇酯、酪蛋白、酪蛋白钠、羧甲基乙基纤维素、丁二酸、共聚维酮、磺基丁二酸钠二辛酯、乳酸、乳酸铝、抗坏血酸棕榈酸酯、羟乙基甲基纤维素、羟丙基甲基纤维素乙酸酯丁二酸酯、聚氧乙烯氢化蓖麻油60、聚氧乙烯(35)蓖麻油、聚(4-苯乙烯磺酸钠)、聚乙烯醇乙缩醛二乙氨基乙酸酯、聚乙烯醇、甲基丙烯酸共聚物s、聚桂醇、硫酸、硫酸铝、十二烷基苯磺酸钠、乙烯基吡咯烷酮
·
乙酸乙烯酯共聚物、乙酰色氨酸、癸基硫酸钠、十四烷基硫酸钠、十八烷基硫酸钠。
[0153]
本发明中,溶解辅助剂进一步优选为以下记载的物质:柠檬酸、羟丙基纤维素、羟丙基甲基纤维素、甲基丙烯酸共聚物ld、甲基纤维素、月桂基硫酸钠、精制虫胶、脱氢乙酸钠、富马酸、dl-苹果酸、l-天冬氨酸、己二酸、藻酸丙二醇酯、酪蛋白钠、羧甲基乙基纤维素、丁二酸、共聚维酮、磺基丁二酸钠二辛酯、乳酸、乳酸铝、羟乙基甲基纤维素、羟丙基甲基纤维素乙酸酯丁二酸酯、聚(4-苯乙烯磺酸钠)、聚乙烯醇乙缩醛二乙氨基乙酸酯、甲基丙烯酸共聚物s、硫酸、硫酸铝、乙烯基吡咯烷酮
·
乙酸乙烯酯共聚物。
[0154]
本发明的组合物或制剂中包含的溶解辅助剂相对于式(i)所表示的化合物(游离体)优选为2重量%~60重量%,进一步优选为20重量%~60重量%。
[0155]
本发明中,使用月桂基硫酸钠时,对于其晶体而言,通过晶析而得到的晶体比通过喷雾干燥而得到的晶体更优选。应予说明,作为月桂基硫酸钠的多晶型,已知有1水合物、1/2水合物、1/8水合物以及非溶剂合物(文献名:journal of crystal growth 263 (2004) 480-490),任意晶体均能够用于本发明的组合物或制剂。
[0156]
作为本发明中的(i)的颗粒中任选包含的赋形剂,可以举出例如玉米淀粉、马铃薯淀粉、小麦淀粉、大米淀粉、部分α化淀粉、α化淀粉、多孔淀粉等淀粉类;乳糖水合物、果糖、葡萄糖、甘露糖、山梨糖醇等糖或糖醇类;无水磷酸氢钙、结晶纤维素、沉淀碳酸钙、硅酸钙等。作为优选的赋形剂,可以举出淀粉、马铃薯淀粉、玉米淀粉等淀粉、乳糖水合物、结晶纤维素、无水磷酸氢钙等,进一步优选为乳糖水合物。赋形剂的使用量相对于100重量份的组合物或制剂优选为5~60重量份,进一步优选为5~45重量份。
[0157]
应予说明,本发明的制剂为胶囊剂、包衣片等之类的具有覆膜的制剂时,前述使用量是指相对于被该覆膜覆盖的成分整体(填充于胶囊中的成分整体、被包衣覆盖的成分整体)的使用量。
[0158]
作为本发明中的(i)的颗粒中任选包含的结合剂,可以举出例如羟丙基纤维素、聚乙烯基吡咯烷酮、聚乙二醇以及与前述赋形剂相同的化合物。作为结合剂的具体例,可以举出例如羟丙基纤维素、羟丙基甲基纤维素、甲基纤维素、聚维酮(聚乙烯基吡咯烷酮)、阿拉伯胶粉等,可以优选地举出羟丙基纤维素。该结合剂的使用量相对于100重量份的组合物或制剂优选为0.1~50重量份,进一步优选为0.5~40重量份,更进一步优选为0.5~10重量份。
[0159]
应予说明,本发明的制剂为胶囊剂、包衣片等之类的具有覆膜的制剂时,前述使用量是指相对于被该覆膜覆盖的成分整体(填充于胶囊中的成分整体、被包衣覆盖的成分整体)的使用量。
[0160]
作为本发明中的(i)的颗粒中任选包含的润滑剂的适合例,可以举出例如硬脂酸镁、硬脂酸钙、滑石、蔗糖脂肪酸酯、硬脂富马酸钠等。
[0161]
作为本发明中的(i)的颗粒中任选包含的稳定剂,可以举出例如尼泊金甲酯、尼泊金丙酯之类的对羟基苯甲酸酯类;氯丁醇、苯甲醇、苯乙醇之类的醇类;苯扎氯铵;苯酚、甲酚之类的酚类;硫柳汞;脱氢乙酸;以及山梨酸。
[0162]
作为本发明的颗粒中任选包含的矫味矫臭剂,可以举出例如通常使用的甜味料、酸味料、香料等。
[0163]
本发明中的(i)的颗粒可以通过对包含式(i)所表示的化合物或其盐、以及任选的崩解剂、溶解辅助剂、赋形剂、润滑剂、包衣剂、结合剂、稳定剂、矫味矫臭剂、稀释剂等添加剂的组合物进行造粒而制造。
[0164]
本发明中,“医药组合物”是指用于治疗
·
预防疾病等的两种以上物质的混合物。作为本发明的一个方式,该医药组合物可以用于制造医药制剂。
[0165]
本发明中,“医药制剂”是指用于治疗
·
预防疾病等的制剂。
[0166]
本发明中,“经口给药制剂”是指可以经口给药的制剂。经口给药是指咽下制剂从而使其进入胃肠道,活性成分主要由肠道吸收。
[0167]
作为经口给药制剂,具体而言,包括片剂、胶囊剂、液剂、散剂、含剂、咀嚼剂、颗粒
剂、凝胶剂、膜剂、喷雾剂等固体制剂以及液状制剂。作为液状制剂,可以举出例如悬浊剂、液剂、糖浆剂和酏剂等。这样的制剂可以用作软质或硬质胶囊剂中的填充剂,一般来说,作为载体,可以使用例如水、乙醇、聚乙二醇、丙二醇、甲基纤维素、或者适当的油、以及一种或多种乳化剂和/或悬浊化剂等。此外,液状制剂可以通过将固体状的例如经分包的本发明的医药组合物溶解于水等载体来制备。
[0168]
本发明中,“alk”是指“间变性淋巴瘤激酶,anaplastic lymphoma kinase”,是指属于胰岛素受体家族的受体型酪氨酸激酶。
[0169]
本发明中,作为式(i)所表示的化合物的盐,优选为盐酸盐,更优选为单盐酸盐。
[0170]
式(i)所表示的化合物或其盐可以通过专利文献2~4记载的方法等来制造。
[0171]
本发明中,式(i)所表示的化合物或其盐包括水合物、制药学上可允许的各种溶剂合物、多晶型。
[0172]
本发明的一个方式中,式(i)所表示的化合物的单盐酸盐是特征在于在粉末x射线衍射图案中在8.4
°
、14.0
°
、16.7
°
、18.8
°
、23.3
°
的衍射角(2θ)处具有峰的晶体(以下称为i型晶体)。
[0173]
i型晶体可以通过向乙醇与盐酸的混合液(相对于式(i)的化合物,包含1摩尔当量以上的盐酸)中在将混合液的温度保持为约35℃以上的同时滴加式(i)所表示的化合物来获得。
[0174]
将i型晶体的粉末x射线衍射的测定结果的一例示于图1,以下示出粉末x射线衍射图案中的峰的一例。
[0175]
[表1]
[0176]
本发明中,通过粉末x射线衍射进行的分析例如可以按照日本药典(第十五版修订)中记载的“粉末x射线衍射测定方法”等常规方法来进行。此外,日本药典中记载了,对于相同晶形而言衍射角2θ通常在
±
0.2度的范围内一致。因此,本发明中不仅包括粉末x射线衍射中的峰的衍射角完全一致的晶体,还包括峰的衍射角在
±
0.2度左右的误差内一致的晶体。
[0177]
以下示出粉末x射线衍射分析的测定条件的一例:测定装置:x'pert-pro mpd(panalytical公司制)对阴极:cu管电压:45kv管电流:40ma步宽:0.017扫描轴:2θ每步的取样时间:43秒扫描范围:3~40
°
。
[0178]
本发明的医药组合物和医药制剂是包含(i)含有式(i)所表示的化合物或其盐的颗粒、以及(ii)崩解剂的溶出性良好的组合物或制剂。
[0179]
本发明中,“溶出性良好的组合物或制剂”、“溶出性得以改善的制剂”是例如药物溶出率为下述情况的组合物或制剂:37℃下的溶出试验开始75分钟后的药物溶出率为65%以上,优选37℃下的溶出试验开始75分钟后的药物溶出率为70%以上,进一步优选37℃下的溶出试验开始30分钟后的药物溶出率为40%以上且75分钟后的药物溶出率为65%以上,特别优选37℃下的溶出试验开始30分钟后的药物溶出率为40%以上且75分钟后的药物溶出率为70%以上。前述溶出试验中,试验液使用包含4%聚氧乙烯(10)辛基苯基醚的第十六版修订日本药典溶出试验第1液900ml,通过第十六版修订日本药典溶出试验桨法,以每分钟旋转100次进行试验。
[0180]
本发明的制剂可以在将本发明中的(i)的颗粒与崩解剂和任选的添加剂一同混合后,通过通用的制造方法来制造。优选按照以下的制造方法来制造。
[0181]
1)将式(i)所表示的化合物与崩解剂、溶解辅助剂、赋形剂和结合剂等添加剂一同混合后,在将溶剂(例如精制水、乙醇或其混合液等)进行添加或喷雾的同时进行造粒。向所得到的造粒物(颗粒)添加(ii)崩解剂、任选适量的润滑剂、流动化剂等添加剂并混合后,填充于胶囊中、或者进行压缩成型等,由此制造本发明的制剂。
[0182]
2)将式(i)所表示的化合物与崩解剂、溶解辅助剂、赋形剂等添加剂一同混合后,将结合剂和根据需要的其它添加剂分散或溶解于溶剂(例如精制水、乙醇或其混合液等)中,在添加或喷雾所得到的液体的同时进行造粒。向所得到的造粒物(颗粒)添加(ii)崩解剂、任选适量的润滑剂、流动化剂等添加剂并混合后,填充于胶囊中、或者进行压缩成型等,由此制造本发明的制剂。
[0183]
在上述1)和2)的方法中,也可以使用通过用干式造粒法或加热造粒法等来代替湿式造粒法而造粒得到的颗粒。
[0184]
本发明的组合物和制剂中,除(ii)的崩解剂之外,作为外加剂,还可以包含润滑剂或流动化剂。作为润滑剂和流动化剂的例子,可以举出硬脂酸镁、硬脂酸钙、滑石、蔗糖脂肪酸酯、硬脂富马酸钠等,可以优选地举出硬脂酸镁。该润滑剂和流动化剂的使用量相对于100重量份的组合物或制剂优选为0.01~20质量份,进一步优选为0.05~15重量份。应予说明,本发明的制剂为胶囊剂、包衣片等之类的具有覆膜的制剂时,前述使用量是指相对于被该覆膜覆盖的成分整体(填充于胶囊中的成分整体、被包衣覆盖的成分整体)的使用量。
[0185]
也可以进一步使用适当的包衣剂,由片剂得到糖衣包衣片或薄膜包衣片。
[0186]
作为糖衣基剂,可以使用例如白糖、赤藓醇等糖或糖醇,进一步,可以使用选自滑石、沉淀碳酸钙、明胶、阿拉伯胶、普鲁兰多糖、巴西棕榈蜡等中的一种或者组合使用两种以上。
[0187]
作为包衣剂,可以举出例如乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、虫胶、滑石、巴西棕榈蜡、石蜡等。
[0188]
作为肠溶性薄膜包衣基剂,可以举出例如羟丙基甲基纤维素邻苯二甲酸酯、羟丙基甲基纤维素乙酸酯丁二酸酯、羧甲基乙基纤维素、乙酸邻苯二甲酸纤维素等纤维素系高分子;甲基丙烯酸共聚物l[
オイドラギット
l(商品名),
エボニックデグサ
公司]、甲基丙烯酸共聚物ld[
オイドラギット
l-30d55(商品名),
エボニックデグサ
公司]、甲基丙烯酸共聚物s
[
オイドラギット
s(商品名),
エボニックデグサ
公司]等丙烯酸系高分子;虫胶等天然物等。
[0189]
作为缓释性薄膜包衣基剂,可以举出例如乙基纤维素等纤维素系高分子;甲基丙烯酸氨基烷基酯共聚物rs[
オイドラギット
rs(商品名),
エボニックデグサ
公司]、丙烯酸乙酯
·
甲基丙烯酸甲酯共聚物悬浊液[
オイドラギット
ne(商品名),
エボニックデグサ
公司]等丙烯酸系高分子;乙酸纤维素等。
[0190]
上述包衣基剂可以将其中的两种以上以适当的比例进行混合使用。
[0191]
包衣剂中可以根据需要添加用于调节溶出速度的水溶性物质、增塑剂等。作为水溶性物质,可以使用选自羟丙基甲基纤维素等水溶性高分子类;甘露醇等糖醇类;白糖、无水麦芽糖等糖类;蔗糖脂肪酸酯;聚氧乙烯聚氧丙烯二醇、聚山梨醇酯、月桂基硫酸钠等表面活性剂类等中的一种以上。作为增塑剂,可以使用选自乙酰化甘油单酯、柠檬酸三乙酯、三乙酸甘油酯、癸二酸二丁酯、癸二酸二甲酯、中链脂肪酸甘油三酯、柠檬酸乙酰基三乙酯、柠檬酸三丁酯、柠檬酸乙酰基三丁酯、己二酸二丁酯、油酸、油醇等中的一种以上。
[0192]
此外,作为用前述包衣层对片剂进行包衣的方法,可以使用通常的方法,可以举出例如锅包衣法、流动包衣法、转动包衣法、流动转动包衣法。进一步,这样的方法中使用的包衣液可以通过将前述包衣基剂、前述滑石和溶剂(优选为乙醇或者乙醇与水的混合物)进行混合来得到。并且,作为这样的包衣液的固体成分浓度,相对于这样的包衣液的整体质量优选为5~15质量%的范围。
[0193]
式(i)所表示的化合物或其盐具有优异的alk抑制作用,在体内的稳定性优异,作为增殖性疾病的预防剂或治疗剂(特别是治疗剂)是有用的。此外,式(i)所表示的化合物或盐作为白血病(急性骨髓性白血病、慢性骨髄性白血病、急性淋巴性白血病、慢性淋巴性白血病等)、恶性淋巴瘤(霍奇金淋巴瘤、非霍奇金淋巴瘤等)、脑瘤、神经母细胞瘤、神经胶质瘤、甲状腺癌、骨髓增生异常综合征、头颈部癌、食道癌、胃癌、大肠癌、结肠直肠癌、乳癌、卵巢癌、肺癌、胰腺癌、肝癌、胆囊癌、皮肤癌、恶性黑色素瘤、肾癌、肾盂尿道癌、膀胱癌、卵巢癌、子宫癌、睾丸癌、前列腺癌之类的各种癌症等疾病的预防剂或治疗剂(特别是治疗剂)是有用的。进一步,本发明的化合物或其盐作为实体癌的渗透
·
转移的预防剂或治疗剂(特别是治疗剂)是有用的。进一步,作为与alk相关的其它疾病、例如抑郁或认知功能障碍的预防剂或治疗剂也是有效的。
[0194]
将本发明的组合物用作alk抑制剂、增殖性疾病的治疗剂或预防剂、或者抑郁或认知功能障碍的治疗剂或预防剂时,其给药方法可以举出经口的、直肠的、非经口的(静脉内的、肌肉内的、皮下的)、脑池内的、阴道内的、腹腔内的、膀胱内的、局部的(点滴、散剂、软膏、凝胶或膏)给药、以及吸入(口腔内或鼻喷雾)等。作为其给药形态,可以举出例如片剂、胶囊剂、颗粒剂、散剂、丸剂、水性和非水性的经口用溶液和悬浊液、以及填充于对应于分装成各给药量的容器中的非经口用溶液。此外,给药形态也可以适用于包括皮下移植之类的控制释放的处方物的各种给药方法。
[0195]
优选为通过片剂、胶囊剂、颗粒剂或散剂进行的经口给药。
[0196]
将本发明的组合物或制剂用作alk抑制剂或增殖性疾病的治疗剂或预防剂、或者抑郁或认知功能障碍的治疗剂或预防剂时,有效成分(式(i)所表示的本发明的化合物或其盐)的给药量因症状、年龄、体重、相对的健康状态、其它投药的存在、给药方法等而异。例如,对于患者(温血动物,特别是人),通常的有效量以有效成分(式(i)所表示的本发明的化
合物或其盐)计,在经口制剂的情况下,每日每1kg体重优选为0.001~1000mg,进一步优选每1kg体重为0.01~300mg,每日的给药量相对于普通体重的成人患者优选处于1~1500mg的范围。在非经口制剂的情况下,每日每1kg体重优选为0.001~1000mg,进一步优选每1kg体重为0.01~300mg。期望将其以1日1次或分成多次,根据症状进行给药。
[0197]
本发明的组合物相对于组合物整体含有换算为游离体计例如20~70%、优选为30~60%、进一步优选为35~60重量%的式(i)所表示的化合物或其盐。
[0198]
本发明的制剂相对于制剂整体含有换算为游离体计例如20~70%、优选为30~60%、进一步优选为35~60重量%的式(i)所表示的化合物或其盐。应予说明,本发明的制剂为胶囊剂、包衣片等之类的具有覆膜的制剂时,前述含量是指相对于被该覆膜覆盖的成分整体(填充于胶囊中的成分整体、被包衣覆盖的成分整体)的含量。即,本发明的制剂为胶囊剂时,相对于填充于胶囊剂中的成分整体,含有换算为游离体计例如20~70重量%、优选为30~60%、进一步优选为35~60重量%的式(i)所表示的化合物或其盐。
[0199]
本发明的制剂优选每单位制剂含有换算为游离体计例如60~240mg、优选为100mg~200mg、进一步优选为140mg~190mg的式(i)所表示的化合物或其盐。
[0200]
根据本发明的另一侧面,提供以下的发明(4-1)~(4-7)的发明。
[0201]
(4-1) 制剂,其为含有月桂基硫酸钠以及水难溶性或不溶性化合物的医药制剂,前述月桂基硫酸钠为通过晶析而得到。
[0202]
(4-2) 根据(4-1)所述的制剂,其中,月桂基硫酸钠为1/8水合物的晶体。
[0203]
(4-3) 水难溶性或不溶性化合物的溶出性得以改善的医药制剂的制造方法,其特征在于,将晶析得到的月桂基硫酸钠以及任选的其它添加剂配合于前述化合物。
[0204]
(4-4) 水难溶性或不溶性化合物的溶出性得以改善的医药制剂的制造方法,其特征在于,将作为月桂基硫酸钠的nikkol sls以及任选的其它添加剂配合于前述化合物。
[0205]
(4-5) 针对含有水难溶性或不溶性化合物的医药制剂改善该化合物的溶出性的方法,其特征在于,将通过晶析而得到的月桂基硫酸钠以及任选的其它添加剂配合于前述化合物。
[0206]
(4-6) 针对含有水难溶性或不溶性化合物的医药制剂改善该化合物的溶出性的方法,其特征在于,将作为月桂基硫酸钠的nikkol sls以及任选的其它添加剂配合于前述化合物。
[0207]
(4-7) 根据(4-3)~(4-6)中任一项所述的方法,其中,月桂基硫酸钠为1/8水合物的晶体。
[0208]
在(4-1)~(4-7)的发明中,“水难溶性或不溶性”是指在25℃下对水而言的溶解度低于100μg/ml。作为本发明的一个方式,“水难溶性或不溶性”是指在25℃下对水而言的溶解度低于10μg/ml。溶解度可以按照常规方法来测定。作为水难溶性或不溶性化合物的例子,可以举出9-乙基-6,6-二甲基-8-(4-吗啉)-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5h-苯并[b]咔唑-3-甲腈及其盐。
[0209]
在(4-1)~(4-7)的发明中,“晶析”是指由包含月桂基硫酸钠的溶液或悬浊液析出月桂基硫酸钠的晶体。
[0210]
在(4-1)~(4-7)的发明中,术语“改善溶出性”和“溶出性得以改善的医药制剂”是例如37℃下的溶出试验开始75分钟后的药物溶出率为65%以上、优选37℃下的溶出试验开
始75分钟后的药物溶出率为70%以上、以及具有这样的溶出曲线的制剂。前述溶出试验中,试验液使用包含4%聚氧乙烯(10)辛基苯基醚的第十六版修订日本药典溶出试验液第1液900ml,通过第十六版修订日本药局溶出试验桨法,以每分钟旋转100次进行试验。
[0211]
(4-1)~(4-7)中的术语“医药制剂”的意义如先前记载。
[0212]
(4-1)~(4-7)记载的制剂可以使用水难溶性或不溶性化合物和月桂基硫酸钠、以及任选的赋形剂、崩解剂、结合剂、润滑剂、包衣剂、稳定剂、矫味矫臭剂、稀释剂等添加剂,通过公知的方法来制造。或者,可以基于本技术说明书记载的方法来制造。
[0213]
作为前述赋形剂,可以举出例如玉米淀粉、马铃薯淀粉、小麦淀粉、大米淀粉、部分α化淀粉、α化淀粉、多孔淀粉等淀粉类;乳糖水合物、果糖、葡萄糖、甘露糖、山梨糖醇等糖或糖醇类:无水磷酸氢钙、结晶纤维素、沉淀碳酸钙、硅酸钙等。作为前述崩解剂,可以举出例如与前述赋形剂相同的化合物和交联羧甲基纤维素钠、淀粉乙醇酸钠、交联聚乙烯基吡咯烷酮之类的经化学修饰的淀粉
·
纤维素类。作为崩解剂的具体例,可以使用例如淀粉乙醇酸钠、羧甲基纤维素、羧甲基纤维素钙、羧甲基淀粉钠、交联羧甲基纤维素钠、交联聚维酮、低取代度羟丙基纤维素、羟丙基淀粉等。作为前述结合剂,可以举出例如聚乙烯基吡咯烷酮、聚乙二醇以及与前述赋形剂相同的化合物。作为结合剂的具体例,可以举出例如羟丙基纤维素、羟丙基甲基纤维素、甲基纤维素、聚维酮(聚乙烯基吡咯烷酮)、阿拉伯胶粉等。作为前述润滑剂,可以举出例如硬脂酸镁、硬脂酸钙、滑石、蔗糖脂肪酸酯、硬脂富马酸钠等。
[0214]
作为月桂基硫酸钠的多晶型,已知1水合物、1/2水合物、1/8水合物和非溶剂合物(文献名:journal of crystal growth 263 (2004) 480-490),任意晶体均可以用于(4-1)~(4-7)的技术方案。
实施例
[0215]
以下举出实施例来进一步详细地说明本发明,但本发明不受它们的限定。应予说明,实施例1~27中,月桂基硫酸钠使用nikkol sls(商品名,日光
ケミカルズ
公司)。
[0216]
实施例1~7:sls的添加和处方量与原药的溶解性的关系(1) 制剂的制造按照表2记载的各成分量,制备改变月桂基硫酸钠(sls)的量而得到的6个处方的制剂。将各颗粒处方成分投入至高速搅拌造粒机并进行预混合,喷洒适当量的精制水并搅拌造粒后,进行真空干燥从而得到干燥粉末。将干燥粉末用整粒机进行整粒,将所得到的整粒粉末与外加剂成分(羧甲基纤维素钙、硬脂酸镁)用混合机进行混合,从而得到配合粉末。将该配合粉末填充于胶囊中,从而制造胶囊剂。
[0217]
[表2]表2:实施例1~7(每1个胶囊的处方量,mg)
[0218]
(2) 制剂评价和结果针对实施例1~4和7,试验液使用包含5%聚氧乙烯(10)辛基苯基醚的日本药典溶出试验第1液900ml,通过日本药典溶出试验桨法以37℃、每分钟旋转100次进行试验时的溶出曲线示于图2。针对实施例1和4~7,试验液使用包含4%聚氧乙烯(10)辛基苯基醚的日本药典溶出试验第1液900ml,通过日本药典溶出试验桨法以37℃、每分钟旋转100次进行试验时的溶出曲线示于图3。
[0219]
(3) 结论如图2和图3的溶出曲线所示,相对于制剂中不含sls的实施例7,包含sls的实施例1~6的溶出均提高。具体而言,存在制剂中的sls量越多则溶出性越改善的倾向,特别地,如由图3的实施例6和7的对比可知的,通过在制剂处方中包含即使微量的sls,可以确认到溶出性显著改善。
[0220]
实施例8和9:颗粒的粒径与原药的溶解性的关系(1) 制剂的制造按照表3记载的各成分量,通过调整精制水量,从而制备颗粒的粒径不同的2个处方的制剂。将各颗粒处方成分投入至高速搅拌造粒机并进行预混合,喷洒表2所示的精制水并搅拌造粒后,进行真空干燥从而得到干燥粉末。将干燥粉末用整粒机进行整粒,将所得到的整粒粉末与外加剂成分(羧甲基纤维素钙、硬脂酸镁)用混合机进行混合,从而得到配合粉末。将该配合粉末填充于胶囊中,从而制造胶囊剂。
[0221]
[表3]表3:实施例8和9(每1个胶囊的处方量,mg)
[0222]
(2) 制剂评价和结果测定整粒粉末的粒度分布时,实施例8的平均粒径为172μm、实施例9的平均粒径为300μm。针对实施例8和9,试验液使用包含5%聚氧乙烯(10)辛基苯基醚的日本药典溶出试验第1液900ml,通过日本药典溶出试验桨法以37℃、每分钟旋转100次进行试验时的溶出曲线示于图4。
[0223]
应予说明,平均粒径通过下述方式获得:将孔径不同的筛(孔径:850、500、355、250、180、106、75、53、0μm)重叠,并在其上添加取样得到的造粒物6g,振荡3分钟后,测定残留在各筛上的造粒物的重量,由各筛的孔径和筛下累积率,使用对数正态分布近似,算出累积率50%所对应的粒径。
[0224]
(3) 结论如图3所示,显示出颗粒的粒径大的实施例9的溶出性提高。
[0225]
已报告的是,如果颗粒的粒径大,则溶出性降低(大野育正,“涉及对医药品的溶出特性造成影响的造粒步骤的制造参数的制剂学研究”,http://mitizane.ll.chiba-u.jp/metadb/up/irwg10/iy-k-y-049.pdf,internatinal journal of pharmaceutics 338 (2007)79-86)。含有粒径大的颗粒的制剂时溶出性提高是完全出乎意料的。
[0226]
实施例10~14:崩解剂的添加方法和添加量与原药的溶解性的关系(1) 制剂的制造按照表4记载的各成分量,制备改变添加至外加剂成分中的羧甲基纤维素钙的量而得到的5个处方的制剂。将各颗粒处方成分投入至高速搅拌造粒机并进行预混合,喷洒适当量的精制水并搅拌造粒后,进行真空干燥从而得到干燥粉末。将干燥粉末用整粒机进行整粒,将所得到的整粒粉末与外加剂成分(羧甲基纤维素钙)进行混合,从而得到配合粉末。将该配合粉末填充于胶囊中,从而制造胶囊剂。
[0227]
[表4]表4:实施例10~14(每1个胶囊的处方量,mg)
[0228]
(2) 制剂评价和结果针对实施例10~14,试验液使用包含7%聚氧乙烯(10)辛基苯基醚的日本药典溶出试验第1液900ml,通过日本药典溶出试验桨法以37℃、每分钟旋转100次进行试验时的溶出曲线示于图5。
[0229]
(3) 结论如图5所示,将添加外加剂的处方进行对比的结果是,在作为外加剂量为3-5重量%的情况中,与不添加外加剂的情况相比,可以确认到溶出略微改善,通过添加10重量%以上,可以确认到溶出性显著改善。
[0230]
实施例15~25:包含羧甲基纤维素钙的特定崩解剂与原药的溶解性的关系(1) 制剂的制造对在实施例10中制备的颗粒,分别添加表5记载的外加剂成分(共计11种,实施例15~25)并混合,从而得到配合粉末。关于配合比例,以实施例10中得到的颗粒达到9重量份、外加剂达到1重量份的比例的方式进行配合。将该配合粉末填充于胶囊中,从而制造胶囊剂。
[0231]
[表5]表5:外加剂成分的种类(实施例15~25)实施例15淀粉乙醇酸钠实施例16低取代羟丙基纤维素实施例17羧甲基纤维素钙实施例18碳酸氢钠实施例19α化淀粉实施例20氯化钠实施例21玉米淀粉实施例22交联羧甲基纤维素钠实施例23结晶纤维素实施例24硅酐实施例25羧甲基纤维素
[0232]
(2) 制剂评价和结果针对实施例10和15~25,试验液使用包含7%聚氧乙烯(10)辛基苯基醚的日本药典溶出试验第1液900ml,通过日本药典溶出试验桨法以37℃、每分钟旋转100次进行试验时的溶出曲线示于图6-1和图6-2。
[0233]
(3) 结论如图6所示,显示出溶出性高的崩解剂为低取代羟丙基纤维素(实施例16)、羧甲基纤维素钙(实施例17)、碳酸氢钠(实施例18)、α化淀粉(实施例19)。
[0234]
每1.0g崩解剂添加20ml日本药典溶出试验第1液时,确认到的是,低取代羟丙基纤维素和羧甲基纤维素钙的体积达到5倍以上,而交联羧甲基纤维素钠、淀粉乙醇酸钠和α化淀粉的体积达到2.5倍以上。
[0235]
实施例26和27:崩解剂的对比(1)制剂的制造作为崩解剂,使用低取代羟丙基纤维素和羧甲基纤维素钙,按照表6记载的各成分量,制备改变崩解剂的种类而得到的2个处方的制剂。将各颗粒处方成分投入至高速搅拌造粒机并进行预混合,喷洒适当量的精制水并搅拌造粒后,进行真空干燥从而得到干燥粉末。将干燥粉末用整粒机进行整粒,将所得到的整粒粉末和外加剂成分用混合机进行混合,从而得到配合粉末。将该配合粉末填充于胶囊中,从而制造胶囊剂。应予说明,实施例26是与实施例1相同的处方成分。
[0236]
[表6]表6:实施例26和27(每1个胶囊的处方量,mg)
[0237]
(2) 制剂评价和结果针对实施例26和27,试验液使用包含5%聚氧乙烯(10)辛基苯基醚的日本药典溶出
试验第1液900ml,通过日本药典溶出试验桨法以37℃、每分钟旋转100次进行试验时的溶出曲线示于图7。
[0238]
如图7所示,显示出崩解剂是低取代羟丙基纤维素和羧甲基纤维素钙中的任一者时,溶出性均良好,如果考虑到各自的偏差,则显示出羧甲基纤维素钙更良好。
[0239]
实施例28和29:月桂基硫酸钠的各商品的对比(1)制剂的制造作为月桂基硫酸钠而使用不同的商品,按照表7记载的各成分量,制备2个处方的制剂。将各颗粒处方成分投入至高速搅拌造粒机并进行预混合,喷洒适当量的精制水并搅拌造粒后,进行真空干燥从而得到干燥粉末。将干燥粉末用整粒机进行整粒,将所得到的整粒粉末与外加剂成分用混合机进行混合,从而得到配合粉末。将该配合粉末填充于胶囊中,从而制造胶囊剂。应予说明,通过粉末x射线衍射对这些实施例中使用的月桂基硫酸钠的晶形进行分析时,确认为1/8水合物。
[0240]
[表7]表7:实施例28和29(每1个胶囊的处方量,mg)
[0241]
(2) 制剂评价和结果针对实施例28和29,试验液使用包含4%聚氧乙烯(10)辛基苯基醚的日本药典溶出试验第1液900ml,通过日本药典溶出试验桨法以37℃、每分钟旋转100次进行试验时的溶出曲线示于图8。
[0242]
如图8所示,显示出与使用由kolliphor (r) sls fine(basf)得到的月桂基硫酸钠的制剂相比,使用nikkol sls(日光
ケミカルズ
公司)的制剂的溶出性出人意料地高。
[0243]
通过光学显微镜等观察在这些实施例中使用的月桂基硫酸钠的性状,其结果是可以认为nikkol sls(日光
ケミカルズ
公司)为通过晶析而得到,kolliphor (r) sls fine(basf)为通过喷雾干燥而得到。由此可以认为,月桂基硫酸钠的制造方法会对制剂的溶出
性造成影响。
[0244]
实施例30:颗粒的堆密度和振实密度的测定通过第十六版修订日本药典第2法测定实施例1~9、26和27的制剂处方中的颗粒的堆密度和振实密度。将结果示于表8。
[0245]
[表8]
[0246]
参考例1:9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5h-苯并[b]咔唑-3-甲腈的单盐酸盐的i型晶体在室温下将9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5h-苯并[b]咔唑-3-甲腈400g溶解于甲乙酮4.8l、乙酸1.44l和蒸馏水1.68l的混合溶剂中,将该溶液在60℃下滴加至乙醇12l和2n盐酸0.8l的混合物中。滤取所析出的固体,用乙醇2l进行洗涤干燥,从而得到标题化合物的单盐酸盐的i型晶体357g。
[0247]
参考例2:粉末x射线衍射分析针对9-乙基-6,6-二甲基-8-(4-吗啉-4-基-哌啶-1-基)-11-氧代-6,11-二氢-5h-苯并[b]咔唑-3-甲腈单盐酸盐的i型晶体,通过下述条件测定粉末x射线衍射。将i型晶体的测定结果示于图1。
[0248]
测定装置:x'pert-pro mpd(panalytical公司制)对阴极:cu管电压:45kv管电流:40ma步宽:0.017扫描轴:2θ每步的取样时间:43秒
扫描范围:3~40
°
。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1