包含肽变异体的药物组合物及其使用方法与流程
包含肽变异体的药物组合物及其使用方法
1.本技术是申请日为2015年10月22日、申请号为201580070309.0、名称为“包含肽变异体的药物组合物及其使用方法”的发明申请的分案。
2.相关申请的交叉引用
3.本技术要求2014年10月23日申请的美国系列号62/067,824的优先权的权益,其在此通过全文引用并入本发明。
4.1.领域
5.本文提供的是药物组合物、制剂和剂型,其包含成纤维细胞生长因子19(fgf19)蛋白质和肽序列(和肽模拟物(peptidomimetics))的变异体(variants)和fgf19和/或成纤维细胞生长因子21(fgf21)蛋白质和肽序列(和肽模拟物)的融合体(fusions),和fgf19和/或fgf21蛋白质和肽序列(和肽模拟物)的融合体的变异体。本文还提供的是使用所述药物组合物、制剂和剂型的方法。
6.2.背景
7.药物物质通常作为制剂的一部分与起多样化和专业化药物功能作用的一种或多种其他药剂联合给药。各种类型的剂型可以通过选择性使用药用赋形剂来制备。因为药用赋形剂具有各种不同的功能并且以许多不同的方式(例如,增溶、稀释、增稠、稳定化、防腐、着色、调味等)对药用制剂作出贡献。在配制活性药物物质时最常考虑的性质包括剂型的生物利用度、易于制造、易于给药和稳定性。由于待配制的活性药物物质的性质各异,因此剂型通常需要针对该活性药物物质独特定制的药用赋形剂以便达到优异的物理和药剂学性质。
8.本文提供的是包含以下成分的制剂和剂型:成纤维细胞生长因子19(fgf19)蛋白质和肽序列(和肽模拟物)的变异体和fgf19和/或成纤维细胞生长因子21(fgf21)蛋白质和肽序列(和肽模拟物)的融合体,和fgf19和/或fgf21蛋白质和肽序列(和肽模拟物)的融合体的变异体。这样的蛋白质和肽序列可用于治疗、预防和/或处理各种疾病或紊乱,包括但不限于胆汁酸有关或相关紊乱(bile acid-related or associated disorder)、高血糖症、胰岛素抵抗、高胰岛素血症、葡萄糖不耐症(glucose intolerance)、代谢综合征和代谢疾病,以及某些癌症。因此,存在对具有优异的物理和药剂学性质的这类蛋白质和肽序列的药物组合物和剂型的需求。本发明满足了这种需要并且提供了有关的益处。
9.3.概述
10.在一个方面,本文提供的是一种药物组合物,其包含肽或肽序列,及药学上可接受的载体。在某些实施方式中,所述药学上可接受的载体包含tris、海藻糖或聚山梨酯-20(tween-20),或其任何组合。
11.在有些实施方式中,所述药物组合物包含具有一种或多种活性诸如胆汁酸体内稳态(bile acid homeostasis)调节活性的肽,该肽选自fgf19肽序列的变异体、fgf19和/或fgf21肽序列的融合体和fgf19和/或fgf21肽序列的融合体(嵌合体)(fusions(chimeras))的变异体。这样的fgf19和/或fgf21肽序列的变异体和融合体(嵌合体)包括用于治疗胆汁酸有关或相关紊乱的序列。这样的fgf19和/或fgf21肽序列的变异体和融合体(嵌合体)也
包括不实质性地或显著地增加或诱发肝细胞癌(hcc)形成或hcc肿瘤发生的序列。这样的fgf19和/或fgf21肽序列的变异体和融合体(嵌合体)还包括不诱发血脂分布(lipid profile)明显升高或增加的序列。
12.在一个实施方式中,所述肽是嵌合肽(chimeric peptide),其包含:a)包含至少七个氨基酸残基的n-末端区,该n-末端区具有第一氨基酸位置和最后氨基酸位置,其中所述n-末端区包含dsspl(seq id no:121)或dasph(seq id nol122);和b)包含seq id no:99(fgf19)的一部分的c-末端区,该c-末端区具有第一氨基酸位置和最后氨基酸位置,其中所述c-末端区包含seq id no:99(fgf19)的氨基酸残基16-29(wgdpirlrhlytsg;seq id no:169),其中所述w残基对应于所述c-末端区的第一氨基酸位置,从而调节胆汁酸体内稳态或治疗所述胆汁酸有关或相关紊乱。
13.在另一个实施方式中,所述肽是嵌合肽,其包含:a)包含seq id no:100(fgf21)的一部分的n-末端区,该n-末端区具有第一氨基酸位置和最后氨基酸位置,其中所述n-末端区包含氨基酸残基gqv,和其中所述v残基对应于所述n-末端区的最后氨基酸位置;和b)包含seq id no:99(fgf19)的一部分的c-末端区,该c-末端区具有第一氨基酸位置和最后氨基酸位置,其中所述c-末端区包含seq id no:99(fgf19)的氨基酸残基21-29,rlrhlytsg(seq id no:185),和其中所述r残基对应于所述c-末端区的第一位置,从而调节胆汁酸体内稳态或治疗所述胆汁酸有关或相关紊乱。
14.在一个进一步的实施方式中,所述肽是嵌合肽,其包含:a)包含seq id no:100(fgf21)的一部分的n-末端区,该n-末端区具有第一氨基酸位置和最后氨基酸位置,其中所述n-末端区包含seq id no:100(fgf21)的至少5个毗连氨基酸(包括氨基酸残基gqv),和其中所述v残基对应于所述n-末端区的最后氨基酸位置;和b)包含seq id no:99(fgf19)的一部分的c-末端区,该c-末端区具有第一氨基酸位置和最后氨基酸位置,其中所述c-末端区包含seq id no:99(fgf19)的氨基酸残基21-29,rlrhlytsg(seq id no:185),和其中所述r残基对应于所述c-末端区的第一位置,从而调节胆汁酸体内稳态或治疗所述胆汁酸有关或相关紊乱。
15.在一个另外的实施方式中,所述肽包含以下序列中的任一个或由其组成:a)与参比或野生型fgf19相比,具有一个或多个氨基酸取代、插入或缺失的fgf19序列变异体;b)与参比或野生型fgf21相比,具有一个或多个氨基酸取代、插入或缺失的fgf21序列变异体;c)与fgf21序列的一部分融合的fgf19序列的一部分;或d)与fgf21序列的一部分融合的fgf19序列的一部分,其中与参比或野生型fgf19和/或fgf21相比,所述fgf19和/或fgf21序列部分具有一个或多个氨基酸取代、插入或缺失,从而调节胆汁酸体内稳态或治疗所述胆汁酸有关或相关紊乱。
16.在各种特别的实施方式中,嵌合肽序列具有n-末端区,该n-末端区具有seq id no:100(fgf21)的包括氨基酸残基gq的至少6个毗连氨基酸(contiguous amino acid);或具有n-末端区,该n-末端区具有seq id no:100(fgf21)的包括氨基酸残基gqv的至少7个毗连氨基酸。
17.在有些实施方式中,所述肽包含i)与参比或野生型fgf19相比,具有一个或多个氨基酸取代、插入或缺失的fgf19序列变异体;ii)与参比或野生型fgf21相比,具有一个或多个氨基酸取代、插入或缺失的fgf21序列变异体;iii)与fgf21序列的一部分融合的fgf19序
列的一部分;或iv)与fgf21序列的一部分融合的fgf19序列的一部分,其中与参比或野生型fgf19和/或fgf21相比,所述fgf19和/或fgf21序列部分具有一个或多个氨基酸取代、插入或缺失。
18.在各种另外的实施方式中,肽序列具有与seq id no:99(fgf19)的羧基-末端氨基酸21-194融合的seq id no:100(fgf21)的氨基-末端氨基酸1-16,或该肽序列具有与seq id no:100(fgf21)的羧基-末端氨基酸147-181融合的seq id no:99(fgf19)的氨基-末端氨基酸1-147(m41),或该肽序列具有与seq id no:100(fgf21)的羧基-末端氨基酸17-181融合的seq id no:99(fgf19)的氨基-末端氨基酸1-20(m44),或该肽序列具有与seq id no:99(fgf19)的羧基-末端氨基酸148-194融合的seq id no:100(fgf21)的氨基-末端氨基酸1-146(m45),或该肽序列具有与seq id no:100(fgf21)的内部氨基酸17-146融合的或与seq id no:99(fgf19)的羧基-末端氨基酸148-194融合的seq id no:99(fgf19)的氨基-末端氨基酸1-20(m46)。
19.在各种进一步的实施方式中,肽序列具有对seq id no:99(fgf19)的氨基酸残基125-129eirpd的至少一个氨基酸取代;对seq id no:99(fgf19)的氨基酸残基126-128 irp的至少一个氨基酸取代;或对seq id no:99(fgf19)的氨基酸残基127-128rp的至少一个氨基酸取代,或对seq id no:99(fgf19)的氨基酸残基1-124和/或对seq id no:99(fgf19)的氨基酸残基130-194的至少一个氨基酸取代。更具体地说,例如,具有对seq id no:99(fgf19)的氨基酸残基127-128 irp中的一个的取代的肽序列,其中至少一个氨基酸取代是r127l或p128e。
20.本文提供的方法和用途可以使用包含如本文所阐述的肽或嵌合序列的任何药物组合物来实践。举例来说,包括本文中阐述为m1-m98、m101至m160或m200至m207或seq id no:1至98或101至135或138至212的任何肽序列或由其组成的序列。在其他的实施方式中,所述肽序列包括表1中所列出的任何序列或由其组成。在还有其他的实施方式中,所述肽序列包括本发明的序列表中所列出的任何序列或由其组成。在某些实施方式中,所述肽的氨基酸序列包含在fgf19的环-8区(loop-8 region)中的至少一个氨基酸取代,或在本文提供的变异体肽中其相应的fgf19序列。在某些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的eirpd(seq id no:190的氨基酸2-6)氨基酸序列的一个氨基酸取代。在有些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的eirpd(seq id no:190的氨基酸2-6)氨基酸序列的两个氨基酸取代。在其他的实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的eirpd(seq id no:190的氨基酸2-6)氨基酸序列的三个氨基酸取代。在某些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的eirpd(seq id no:190的氨基酸2-6)氨基酸序列的四个氨基酸取代。在有些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的eirpd(seq id no:190的氨基酸2-6)氨基酸序列的五个氨基酸取代。在某些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的irp(seq id no:190的氨基酸3-5)氨基酸序列的一个氨基酸取代。在有些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的irp(seq id no:190的氨基酸3-5)氨基酸序列的两个氨基酸取代。在其他的实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的irp(seq id no:190的氨基酸3-5)氨基酸序列的三个氨基酸取代。在某些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的rp(seq id no:190的氨基酸4-5)氨基酸序列的一个氨基酸取代。在
有些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的rp(seq id no:190的氨基酸4-5)氨基酸序列的两个氨基酸取代。在某些实施方式中,所述对fgf19的环-8区中的rp(seq id no:190的氨基酸4-5)氨基酸序列的氨基酸取代是用arg(r)取代leu(l)。在其他的实施方式中,所述对fgf19的环-8区中的rp(seq id no:190的氨基酸4-5)氨基酸序列的取代是用pro(p)取代glu(e)。在有些实施方式中,所述对fgf19的环-8区中的rp(seq id no:190的氨基酸4-5)氨基酸序列的取代是用arg(r)取代leu(l)和用pro(p)取代glu(e)。在具体的实施方式中,在fgf19的环-8区中的上述取代(含多个取代)在本文提供的变异体肽中是在其相应的fgf19序列中。也就是说,在本文提供的肽变异体的相应的fgf19序列(例如,eirpd、irp或rp)里面的所述取代也给予了考虑。
21.本文提供的方法和用途可以使用包含任何合适长度的肽或嵌合序列的药物组合物来实践。在特别的实施方式中,所述肽或嵌合序列的n-末端区或c-末端区是长度约20至约200个氨基酸残基。在其他特别的方面,肽或嵌合序列具有自氨基末端、羧基-末端或内部的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个或更多个氨基酸缺失。在进一步特别的实施方式中,肽或嵌合序列具有包括约5至10、10至20、20至30、30至40、40至50、50至60、60至70、70至80、80至90、90至100个或更多个氨基酸的氨基酸序列或由其组成的n-末端区或c-末端区。在另外的更特别的实施方式中,肽或嵌合序列具有包括fgf19或fgf21的约5至10、10至20、20至30、30至40、40至50、50至60、60至70、70至80、80至90、90至100个或更多个氨基酸的氨基酸序列或由其组成的fgf19序列部分或fgf21序列部分。
22.在还有另外的实施方式中,肽序列或嵌合肽序列具有wgdpi(seq id no:170)序列基序,其对应于seq id no:99(fgf19)的氨基酸16-20的wgdpi(seq id no:170)序列;具有取代的、突变的或不存在的wgdpi(seq id no:170)序列基序,其对应于fgf19的氨基酸16-20的fgf19 wgdpi(seq id no:170)序列;具有含一个或多个氨基酸取代的、突变的或不存在的wgdpi(seq id no:170)序列。在各种其他进一步的方面,所述肽序列区别于fgf19变异体序列,该fgf19变异体序列具有在氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代fgf19 wgdpi(seq id no:170)序列。
23.在还有进一步的实施方式中,肽序列或嵌合肽序列具有包含氨基酸残基vhyg(seq id no:101)的n-末端区,其中所述n-末端区包含氨基酸残基dasphvhyg(seq id no:102),或所述n-末端区包含氨基酸残基dssplvhyg(seq id no:103)。更特别地,在一个方面,所述g对应于所述n-末端区的最后位置。
24.在各种另外的方面,所述n-末端区包含氨基酸残基dsspllq(seq id no:104),其中所述q残基是所述n-末端区的最后氨基酸位置,或包含氨基酸残基dsspllqfggqv(seq id no:105),其中所述v残基对应于所述n-末端区的最后位置。
25.在某些实施方式中,n-末端区包含以下一项或由其组成(或还包含以下序列或还由其组成):rhpip(seq id no:106),其中r是所述n-末端区的第一氨基酸位置;或hpip(seq id no:107),其中h是所述n-末端区的第一氨基酸位置;或rplaf(seq id no:108),其中r是
所述n-末端区的第一氨基酸位置;或plaf(seq id no:109),其中p是所述n-末端区的第一氨基酸位置;或r,其中r是所述n-末端区的第一氨基酸位置。
26.在各种其他的方面,肽或嵌合序列具有:氨基酸残基hpip(seq id no:107),其是所述n-末端区的前4个氨基酸残基。在各种再进一步的方面,肽或嵌合序列具有:在所述n-末端区的第一位置的r残基,或所述n-末端区的第一位置是m残基,或所述n-末端区的第一和第二位置是mr序列,或所述n-末端区的第一和第二位置是rm序列,或所述n-末端区的第一和第二位置是rd序列,或所述n-末端区的第一和第二位置是ds序列,或所述n-末端区的第一和第二位置是md序列,或所述n-末端区的第一和第二位置是ms序列,或所述n-末端区的从第一到第三位置是mds序列,或所述n-末端区的从第一到第三位置是rds序列,或所述n-末端区的从第一到第三位置是msd序列,或所述n-末端区的从第一到第三位置是mss序列,或所述n-末端区的从第一到第三位置是dss序列,或所述n-末端区的从第一到第四位置是rdss(seq id no:115),序列,或所述n-末端区的从第一到第四位置是mdss(seq id no:116),序列,或所述n-末端区的从第一到第五位置是mrdss(seq id no:117),序列,或所述n-末端区的从第一到第五位置是msspl(seq id no:113)序列,或所述n-末端区的从第一到第六位置是mdsspl(seq id no:110)序列,或所述n-末端区的从第一到第七位置是msdsspl(seq id no:111)序列。
27.在各种其他特别的方面,肽或嵌合序列具有在所述n-末端区第一氨基酸位置的“m”残基、“r”残基、“s”残基、“h”残基、“p”残基、“l”残基或“d”残基。在各种备选的特别的方面,肽或嵌合序列肽序列不具有在所述n-末端区的第一氨基酸位置的“m”残基或“r”残基。
28.在进一步各种其他的实施方式中,肽或嵌合序列具有n-末端区,该n-末端区具有以下序列中的任一个:mdsspl(seq id no:110)、msdsspl(seq id no:111)、sdsspl(seq id no:112)、msspl(seq id no:113)或sspl(seq id no:114)。
29.在各种仍然另外的方面,肽或嵌合序列具有在所述c-末端区的最后位置的对应于seq id no:99(fgf19)的大约残基194的一个残基。在仍然其他的实施方式中,肽序列或嵌合肽序列在所述c-末端具有seq id no:99(fgf19)的氨基酸残基30-194的添加,导致产生在所述c-末端区的最后位置具有对应于seq id no:99(fgf19)的大约残基194的嵌合多肽。在进一步其他的实施方式中,嵌合肽序列或肽序列包含fgf19序列(例如,seq id no:99)的全部或一部分,位于该肽的c-末端,或其中所述氨基末端的“r”残基从所述肽缺失。
30.在更特别的实施方式中,嵌合肽序列或肽序列包含m1-m98变异体肽序列中的任一个或该m1-m98变异体肽序列中的任一个的子序列(subsequence)或片段,或由其组成。本文提供的方法和用途也可以使用如本文所阐述的肽或嵌合序列来实践。举例来说,包含本文阐述为m1至m98、m101至m160或m200至m207或seq id no:1至98、101至135、138至212的任何肽序列或由其组成的序列,或包含表1中所列出的任何序列或由其组成的肽序列,或包含本发明的序列表中所列出的任何序列或由其组成的肽序列。
31.在各种更特别的实施方式中,肽序列包含以下序列中的任一个或由其组成:
32.rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m3)(seq id no:3);
33.rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtv
aikgvhsvrylcmgadgkmqgllqyseedcafeeeiredgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m140)(seq id no:194);
34.rplafsdagphvhygwgdpirqrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m160)(seq id no:196);
35.rdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m69)(seq id no:69);
36.rdsspllqwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m52)(seq id no:52);
37.rhpipdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m5)(seq id no:5);
38.hpipdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m5-r)(seq id no:160);
39.hpipdsspllqfggqvrqrylytddaqqteahleiredgtvggaadqspesllqlkalkpgviqilgvktsrflcqrpdgalygslhfdpeacsfrellledgynvyqseahslplhlpgnksphrdpaprgparflplpglppalpeppgilapqppdvgssdplsmvgpsqgrspsyas(m71)(seq id no:71);hpipdsspllqfggqvrqrylytddaqqteahleiredgtvggaadqspesllqlkalkpgviqilgvktsrflcqrpdgalygslhfdpeacsfrellledgynvyqseahglplhlpgnksphrdpaprgparflplpglppappeppgilapqppdvgssdplsmvgpsqgrspsyas(m72)(seq id no:72);
40.hpipdsspllqfggqvrqrylytddaqqteahleiredgtvggaadqspesllqlkalkpgviqilgvktsrflcqrpdgalygslhfdpeacsfrellledgynvyqseahglplhlpgnksphrdpaprgparflplpglppalpeppgilapqppdvgssdplsmvvqdelqgvggegchmhpencktlltdidrthtekpvwdgitge(m73)(seq id no:73);
41.rplafsdasphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m1)(seq id no:1或139);
42.rplafsdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m2)(seq id no:2或140);
43.rdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m48)(seq id no:48或6或148);
44.rplafsdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m49)(seq id no:49或7或149);
45.rhpipdsspllqfgdqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m50)(seq id no:50);
46.rhpipdsspllqfggnvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m51)(seq id no:51或36或155);
47.mdsspllqwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m53)(seq id no:192);
48.mrdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m70)(seq id no:70);
49.rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeilpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m139)(seq id no:193);或
50.rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeilcdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m141)(seq id no:195);rplafsdagphvhygwgdpirqrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m160)(seq id no:196);
51.或上述肽序列中的任一个的子序列或其片段。在上述肽序列中的任一个的某些实施方式中,所述r末端残基(在所述n-末端的r残基)缺失。
52.在其他的实施方式中,所述肽包含以下一项或由其组成:
53.rdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m200)(seq id no:197);或其子序列或片段。在一个实施方式中,所述n-末端的r残基缺失。
54.在有些实施方式中,所述肽包含以下一项或由其组成:
55.rplafsdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m201)(seq id no:198);或其子序列或片段。在一个实施方式中,所述n-末端的r残基缺失。
56.在某些实施方式中,所述肽包含以下一项或由其组成:
57.rplafsdasphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m202)(seq id no:199);或其子序列或片段。在一个实施方式中,所述n-末端的r残基缺失。
58.在其他的实施方式中,所述肽包含以下一项或由其组成:
59.rdsspllqwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m203)(seq id no:200);或其子序列或片段。在一个实施方式中,所述n-末端的r残基缺失。
60.在有些实施方式中,所述肽包含以下一项或由其组成:
61.rhpipdsspllqfgdqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m204)(seq id no:201);或其子序列或片段。在一个实施方式中,所述n-末端的r残基缺失。
62.在某些实施方式中,所述肽包含以下一项或由其组成:
63.rdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m205)(seq id no:202);或其子序列或片段。在一个实施方式中,所述n-末端的r残基缺失。
64.在有些实施方式中,所述肽包含以下一项或由其组成:
65.rhpipdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m206)(seq id no:203);或其子序列或片段。在一个实施方式中,所述n-末端的r残基缺失。
66.在其他的实施方式中,所述肽包含以下一项或由其组成:
67.mrdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m207)(seq id no:204);或其子序列或片段。
68.在有些实施方式中,所述肽是被命名为m139的变异体肽。在一个实施方式中,所述肽包含seq id no:193中所阐述的氨基酸序列。在其他的实施方式中,所述肽由seq id no:193中所阐述的氨基酸序列组成。在有些实施方式中,所述肽是被命名为m140的变异体肽。在一个实施方式中,所述肽包含seq id no:194中所阐述的氨基酸序列。在其他的实施方式中,所述肽由seq id no:194中所阐述的氨基酸序列组成。在有些实施方式中,所述肽是被命名为m141的变异体肽。在一个实施方式中,所述肽包含seq id no:195中所阐述的氨基酸序列。在其他的实施方式中,所述肽由seq id no:195中所阐述的氨基酸序列组成。在有些实施方式中,所述肽是被命名为m160的变异体肽。在一个实施方式中,所述肽包含seq id no:196中所阐述的氨基酸序列。在其他的实施方式中,所述肽由seq id no:196中所阐述的氨基酸序列组成。在有些实施方式中,所述肽是被命名为m200的变异体肽。在一个实施方式中,所述肽包含seq id no:197中所阐述的氨基酸序列。在其他的实施方式中,所述肽由seq id no:197中所阐述的氨基酸序列组成。在有些实施方式中,所述肽是被命名为m201的变异体肽。在一个实施方式中,所述肽包含seq id no:198中所阐述的氨基酸序列。在其他的实施方式中,所述肽由seq id no:198中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽是被命名为m202的变异体肽。在有些实施方式中,所述肽包含seq id no:199中所阐述
的氨基酸序列。在其他的实施方式中,所述肽由seq id no:199中所阐述的氨基酸序列组成。在某些实施方式中,所述肽是被命名为m203的变异体肽。在一个实施方式中,所述肽包含seq id no:200中所阐述的氨基酸序列。在其他的实施方式中,所述肽由seq id no:200中所阐述的氨基酸序列组成。在有些实施方式中,所述肽是被命名为m204的变异体肽。在一个实施方式中,所述肽包含seq id no:201中所阐述的氨基酸序列。在其他的实施方式中,所述肽由seq id no:201中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽是被命名为m205的变异体肽。在有些实施方式中,所述肽包含seq id no:202中所阐述的氨基酸序列。在其他的实施方式中,所述肽由seq id no:202中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽是被命名为m206的变异体肽。在有些实施方式中,所述肽包含seq id no:203中所阐述的氨基酸序列。在其他的实施方式中,所述肽由seq id no:203中所阐述的氨基酸序列组成。在还有其他的实施方式中,所述肽是被命名为m207的变异体肽。在有些实施方式中,所述肽包含seq id no:204中所阐述的氨基酸序列。在其他的实施方式中,所述肽由seq id no:204中所阐述的氨基酸序列组成。
69.在各种另外的特别的方面,所述肽序列的n-末端包括以下序列中的任一个或由其组成:
70.hpipdsspllqfggqvrlrhlytsg(m5-r)(seq id no:160的氨基酸1-25);
71.dsspllqfggqvrlrhlytsg(m6-r)(seq id no:6的氨基酸2-22);
72.rplafsdsspllqfggqvrlrhlytsg(m7)(seq id no:7的氨基酸1-27);
73.hpipdsspllqwgdpirlrhlytsg(m8-r)(seq id no:8的氨基酸2-26);
74.hpipdsspllqfgwgdpirlrhlytsg(m9-r)(seq id no:9的氨基酸2-28);
75.hpipdssphvhygwgdpirlrhlytsg(m10-r)(seq id no:10的氨基酸2-28);
76.rplafsdagpllqwgdpirlrhlytsg(m11)(seq id no:11的氨基酸1-27);
77.rplafsdagpllqfgwgdpirlrhlytsg(m12)(seq id no:12的氨基酸1-29);
78.rplafsdagpllqfggqvrlrhlytsg(m13)(seq id no:13的氨基酸1-27);
79.hpipdssphvhyggqvrlrhlytsg(m14-r)(seq id no:14的氨基酸2-26);
80.rplafsdagphvhyggqvrlrhlytsg(m15)(seq id no:15的氨基酸1-27);
81.rplafsdagphvhwgdpirlrhlytsg(m16)(seq id no:16的氨基酸1-27);
82.rplafsdagphvgwgdpirlrhlytsg(m17)(seq id no:17的氨基酸1-27);
83.rplafsdagphygwgdpirlrhlytsg(m18)(seq id no:18)的氨基酸1-27;
84.rplafsdagpvygwgdpirlrhlytsg(m19)(seq id no:19的氨基酸1-27);
85.rplafsdagpvhgwgdpirlrhlytsg(m20)(seq id no:20的氨基酸1-27);
86.rplafsdagpvhywgdpirlrhlytsg(m21)(seq id no:21的氨基酸1-27);
87.rplafsdagphvhgwgdpirlrhlytsg(m22)(seq id no:22的氨基酸1-27);
88.rplafsdagphhgwgdpirlrhlytsg(m23)(seq id no:23的氨基酸1-27);
89.rplafsdagphhywgdpirlrhlytsg(m24)(seq id no:24的氨基酸1-27);
90.rplafsdagphvywgdpirlrhlytsg(m25)(seq id no:25的氨基酸1-27);
91.rplafsdssplvhwgdpirlrhlytsg(m26)(seq id no:26的氨基酸1-27);
92.rplafsdssphvhwgdpirlrhlytsg(m27)(seq id no:27的氨基酸1-27);
93.rplafsdagphvwgdpirlrhlytsg(m28)(seq id no:28的氨基酸1-26);
94.rplafsdagphvhywgdpirlrhlytsg(m29)(seq id no:29的氨基酸1-28);
95.rplafsdagphvhyawgdpirlrhlytsg(m30)(seq id no:30的氨基酸1-29);
96.rhpipdsspllqfgaqvrlrhlytsg(m31)(seq id no:31的氨基酸1-26);
97.rhpipdsspllqfgdqvrlrhlytsg(m32)(seq id no:32的氨基酸1-26);
98.rhpipdsspllqfgpqvrlrhlytsg(m33)(seq id no:33的氨基酸1-26);
99.rhpipdsspllqfggavrlrhlytsg(m34)(seq id no:34的氨基酸1-26);
100.rhpipdsspllqfggevrlrhlytsg(m35)(seq id no:35的氨基酸1-26);
101.rhpipdsspllqfggnvrlrhlytsg(m36)(seq id no:36的氨基酸1-26);
102.rhpipdsspllqfggqarlrhlytsg(m37)(seq id no:37的氨基酸1-26);
103.rhpipdsspllqfggqirlrhlytsg(m38)(seq id no:38的氨基酸1-26);
104.rhpipdsspllqfggqtrlrhlytsg(m39)(seq id no:39的氨基酸1-26);
105.rhpipdsspllqfgwgqpvrlrhlytsg(m40)(seq id no:40的氨基酸1-28);
106.dagphvhygwgdpirlrhlytsg(m74-r)(seq id no:74的氨基酸2-24);
107.vhygwgdpirlrhlytsg(m75-r)(seq id no:75的氨基酸2-19);
108.rlrhlytsg(m77-r)(seq id no:77的氨基酸2-10);
109.rhpipdsspllqfgwgdpirlrhlytsg(m9)(seq id no:9的氨基酸1-28);
110.rhpipdsspllqwgdpirlrhlytsg(m8)(seq id no:8的氨基酸1-26);
111.rplafsdagpllqfgwgdpirlrhlytsg(m12)(seq id no:12的氨基酸1-29);
112.rhpipdssphvhygwgdpirlrhlytsg(m10)(seq id no:10的氨基酸1-28);
113.rplafsdagpllqfggqvrlrhlytsg(m13)(seq id no:13的氨基酸1-27);
114.rhpipdssphvhyggqvrlrhlytsg(m14)(seq id no:14的氨基酸1-26);
115.rplafsdagphvhyggdirlrhlytsg(m43)seq id no:43的氨基酸1-27);或
116.rdsspllqfggqvrlrhlytsg(m6)(seq id no:6的氨基酸1-22);
117.或上述肽序列中的任一个,其中所述氨基末端的r残基缺失。
118.在某些实施方式中,所述肽包含以下序列中的任一个或由其组成:
119.hpipdsspllqfggqvrlrhlytsg(m5-r)(seq id no:160的氨基酸1-25);
120.dsspllqfggqvrlrhlytsg(m6-r)(seq id no:6的氨基酸2-22);
121.rplafsdsspllqfggqvrlrhlytsg(m7)(seq id no:7的氨基酸1-27);
122.hpipdsspllqwgdpirlrhlytsg(m8-r)(seq id no:8的氨基酸2-26);
123.hpipdsspllqfgwgdpirlrhlytsg(m9-r)(seq id no:9的氨基酸2-28);
124.hpipdssphvhygwgdpirlrhlytsg(m10-r)(seq id no:10的氨基酸2-28);
125.rplafsdagpllqwgdpirlrhlytsg(m11)(seq id no:11的氨基酸1-27);
126.rplafsdagpllqfgwgdpirlrhlytsg(m12)(seq id no:12的氨基酸1-29);
127.rplafsdagpllqfggqvrlrhlytsg(m13)(seq id no:13的氨基酸1-27);
128.hpipdssphvhyggqvrlrhlytsg(m14-r)(seq id no:14的氨基酸2-26);
129.rplafsdagphvhyggqvrlrhlytsg(m15)(seq id no:15的氨基酸1-27);
130.rplafsdagphvhwgdpirlrhlytsg(m16)(seq id no:16的氨基酸1-27);
131.rplafsdagphvgwgdpirlrhlytsg(m17)(seq id no:17的氨基酸1-27);
132.rplafsdagphygwgdpirlrhlytsg(m18)(seq id no:18的氨基酸1-27);
133.rplafsdagpvygwgdpirlrhlytsg(m19)(seq id no:19的氨基酸1-27);
134.rplafsdagpvhgwgdpirlrhlytsg(m20)(seq id no:20的氨基酸1-27);
135.rplafsdagpvhywgdpirlrhlytsg(m21)(seq id no:21的氨基酸1-27);
136.rplafsdagphvhgwgdpirlrhlytsg(m22)(seq id no:22的氨基酸1-27);
137.rplafsdagphhgwgdpirlrhlytsg(m23)(seq id no:23的氨基酸1-27);
138.rplafsdagphhywgdpirlrhlytsg(m24)(seq id no:24的氨基酸1-27);
139.rplafsdagphvywgdpirlrhlytsg(m25)(seq id no:25的氨基酸1-27);
140.rplafsdssplvhwgdpirlrhlytsg(m26)(seq id no:26的氨基酸1-27);
141.rplafsdssphvhwgdpirlrhlytsg(m27)(seq id no:27的氨基酸1-27);
142.rplafsdagphvwgdpirlrhlytsg(m28)(seq id no:28的氨基酸1-26);
143.rplafsdagphvhywgdpirlrhlytsg(m29)(seq id no:29的氨基酸1-28);
144.rplafsdagphvhyawgdpirlrhlytsg(m30)(seq id no:30的氨基酸1-29);
145.rhpipdsspllqfgaqvrlrhlytsg(m31)(seq id no:31的氨基酸1-26);
146.rhpipdsspllqfgdqvrlrhlytsg(m32)(seq id no:32的氨基酸1-26);
147.rhpipdsspllqfgpqvrlrhlytsg(m33)(seq id no:33的氨基酸1-26);
148.rhpipdsspllqfggavrlrhlytsg(m34)(seq id no:34的氨基酸1-26);
149.rhpipdsspllqfggevrlrhlytsg(m35)(seq id no:35的氨基酸1-26);
150.rhpipdsspllqfggnvrlrhlytsg(m36)(seq id no:36的氨基酸1-26);
151.rhpipdsspllqfggqarlrhlytsg(m37)(seq id no:37的氨基酸1-26);
152.rhpipdsspllqfggqirlrhlytsg(m38)(seq id no:38的氨基酸1-26);
153.rhpipdsspllqfggqtrlrhlytsg(m39)(seq id no:39的氨基酸1-26);
154.rhpipdsspllqfgwgqpvrlrhlytsg(m40)(seq id no:40的氨基酸1-28);
155.dagphvhygwgdpirlrhlytsg(m74-r)(seq id no:74的氨基酸2-24);
156.vhygwgdpirlrhlytsg(m75-r)(seq id no:75的氨基酸2-19);
157.rlrhlytsg(m77-r)(seq id no:77的氨基酸2-10);
158.rhpipdsspllqfgwgdpirlrhlytsg(m9)(seq id no:9的氨基酸1-28);
159.rhpipdsspllqwgdpirlrhlytsg(m8)(seq id no:8的氨基酸1-26);
160.rplafsdagpllqfgwgdpirlrhlytsg(m12)(seq id no:12的氨基酸1-29);
161.rhpipdssphvhygwgdpirlrhlytsg(m10)(seq id no:10的氨基酸1-28);
162.rplafsdagpllqfggqvrlrhlytsg(m13)(seq id no:13的氨基酸1-27);
163.rhpipdssphvhyggqvrlrhlytsg(m14)(seq id no:14的氨基酸1-26);
164.rplafsdagphvhyggdirlrhlytsg(m43)seq id no:43的氨基酸1-27);或
165.rdsspllqfggqvrlrhlytsg(m6)(seq id no:6的氨基酸1-22)。在有些实施方式中,所述肽包含上述序列中的一个。在另一个实施方式中,所述肽由上述序列中的一个组成。在有些实施方式中,所述肽包含包含seq id no:99(fgf19)的一部分的c-末端区,该c-末端区具有第一氨基酸位置和最后氨基酸位置,其中所述c-末端区包含seq id no:99(fgf19)的氨基酸残基16-29,wgdpirlrhlytsg(seq id no:169),其中所述w残基对应于所述c-末端区的第一氨基酸位置。
166.在各种进一步特别的方面,肽序列包括以下各项或由其组成:
167.hpipdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:160);
168.dsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:138或161);
169.rplafsdasphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:1或139);
170.rplafsdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:2或140);或
171.dssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:141);
172.或上述肽序列中的任一个的子序列或其片段。在上述肽序列中的任一个的某些实施方式中,所述r末端残基缺失。
173.在进一步的实施方式中,肽序列包含以下各项或由其组成:
174.mrdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m70)(seq id no:70),或其子序列或片段。
175.在进一步的实施方式中,肽序列包含以下各项或由其组成:
176.rdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m69)(seq id no:69),或其子序列或片段。
177.在某些实施方式中,肽序列包括在c-末端添加seq id no:99(fgf19)的氨基酸残基30-194,导致产生嵌合多肽。在有些实施方式中,肽序列具有对seq id no:99(fgf19)的氨基酸残基125-129eirpd的至少一个氨基酸取代。在其他的实施方式中,所述肽序列具有对seq id no:99(fgf19)的氨基酸残基126-128 irp的至少一个氨基酸取代。在其他的实施方式中,所述肽序列具有对seq id no:99(fgf19)的氨基酸残基127-128rp的至少一个氨基酸取代。在其他的实施方式中,所述肽序列具有对seq id no:99(fgf19)的氨基酸残基1-124和/或对seq id no:99(fgf19)的氨基酸残基130-194的至少一个氨基酸取代。例如,在某些实施方式中,肽序列包含对seq id no:99(fgf19)的氨基酸残基127-128rp中的一个的取代,其中至少一个氨基酸取代是r127l或p128e。在本文提供的肽变异体的相应的fgf19序列(例如,eirpd、irp或rp)里面的所述取代也给予了考虑。在某些实施方式中,所述肽包含对seq id no:99(fgf19)或在本文提供的变异体肽中其相应的fgf19序列的氨基酸残基127-128rp的r127l和p128e取代二者。在某些实施方式中,所述肽的氨基酸序列包含在
fgf19的环-8区中或在本文提供的变异体肽中其相应的fgf19序列的至少一个氨基酸取代。在某些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的eirpd(seq id no:190的氨基酸2-6)氨基酸序列的一个氨基酸取代。在有些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的eirpd(seq id no:190的氨基酸2-6)氨基酸序列的两个氨基酸取代。在其他的实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的eirpd(seq id no:190的氨基酸2-6)氨基酸序列的三个氨基酸取代。在某些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的eirpd(seq id no:190的氨基酸2-6)氨基酸序列的四个氨基酸取代。在有些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的eirpd(seq id no:190的氨基酸2-6)氨基酸序列的五个氨基酸取代。在某些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的irp(seq id no:190的氨基酸3-5)氨基酸序列的一个氨基酸取代。在有些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的irp(seq id no:190的氨基酸3-5)氨基酸序列的两个氨基酸取代。在其他的实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的irp(seq id no:190的氨基酸3-5)氨基酸序列的三个氨基酸取代。在某些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的rp(seq id no:190的氨基酸4-5)氨基酸序列的一个氨基酸取代。在有些实施方式中,所述肽的氨基酸序列包含对fgf19的环-8区中的rp(seq id no:190的氨基酸4-5)氨基酸序列的两个氨基酸取代。在某些实施方式中,所述对fgf19的环-8区中的rp(seq id no:190的氨基酸4-5)氨基酸序列的氨基酸取代是用arg(r)取代leu(l)。在其他的实施方式中,所述对fgf19的环-8区中的rp(seq id no:190的氨基酸4-5)氨基酸序列的取代是用pro(p)取代glu(e)。在有些实施方式中,所述对fgf19的环-8区中的rp(seq id no:190的氨基酸4-5)氨基酸序列的取代是用arg(r)取代leu(l)和用pro(p)取代glu(e)。在具体的实施方式中,上述在fgf19的环-8区中的取代(含多个取代)是在本文提供的变异体肽中在其相应的fgf19序列中。也就是说,在本文提供的肽变异体的相应的fgf19序列(例如,eirpd、irp或rp)里面的所述取代也给予了考虑。
178.本文提供的肽或嵌合序列可以属于任何合适的长度。在特别的实施方式中,所述肽或嵌合序列的n-末端区或c-末端区是长度约20至约200个氨基酸残基。在进一步特别的实施方式中,嵌合肽序列或肽序列具有至少一个氨基酸缺失。在其他特别的方面,肽或嵌合序列具有自氨基末端、羧基-末端或内部的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个或更多个氨基酸缺失。在一个实施方式中,所述氨基酸取代或缺失是在fgf19的氨基酸位置8-20(agphvhygwgdpi)(seq id no:187)中的任一个。在进一步特别的实施方式中,肽或嵌合序列具有包含约5至10、10至20、20至30、30至40、40至50、60至70、70至80、80至90、90至100个或更多个氨基酸的氨基酸序列或由其组成的n-末端区或c-末端区。在另外的更特别的实施方式中,肽或嵌合序列具有包含fgf19或fgf21的约5至10、10至20、20至30、30至40、40至50、50至60、60至70、70至80、80至90、90至100个或更多个氨基酸的氨基酸序列或由其组成的fgf19序列部分或fgf21序列部分。
179.在各种进一步的实施方式中,肽或嵌合序列具有氨基酸取代、添加、插入或是具有至少一个氨基酸缺失的子序列。这样的肽序列的氨基酸取代、添加、插入和缺失可以是1、2、3、4、5、6、7、8、9、10个或更多个氨基酸残基(10-20、20-30、30-40、40-50个,等等),例如,在n-末端或c-末端,或内部。例如,具有自氨基末端、羧基-末端或内部的1、2、3、4、5、6、7、8、9、
10、11、12、13、14、15、16、17、18、19、20个或更多个氨基酸缺失的子序列。在一个特别的方面,所述氨基酸取代或缺失是在fgf19的氨基酸位置8-20(agphvhygwgdpi)(seq id no:187)中的任一个。
180.在各种再更特别的实施方式中,肽或嵌合序列包括如下所述的fgf19序列的全部或一部分:
181.phglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:188),位于该肽的c-末端,或所述氨基末端的“r”残基从该序列缺失。
182.在各种实施方式中,肽或嵌合序列具有大于或小于对比序列的功能或活性。在进一步特别的实施方式中,嵌合肽序列和肽序列具有特殊的功能或活性。在一个方面,嵌合肽序列或肽序列维持或增加成纤维细胞生长因子受体4(fgfr4)介导的活性。在另外的方面,嵌合肽序列或肽序列与fgfr4结合或激活fgfr4,或不可检测地与fgfr4结合或激活fgfr4,或以小于、相当于或大于fgf19对fgfr4的结合亲和力的亲和力与fgfr4结合,或以小于、相当于或大于fgf19激活fgfr4的程度或量激活fgfr4。在有些实施方式中,本文提供的嵌合肽序列或肽序列以小于fgf19激活fgfr4的程度或量激活fgfr4。在一个实施方式中,本文提供的嵌合肽序列或肽序列以相当于fgf19激活fgfr4的程度或量的程度或量激活fgfr4。在一个实施方式中,本文提供的嵌合肽序列或肽序列以大于fgf19激活fgfr4的程度或量的程度或量激活fgfr4。
183.在一个实施方式中,本文提供的嵌合肽序列或肽序列维持fgfr4介导的活性。在一个实施方式中,本文提供的嵌合肽序列或肽序列增加fgfr4介导的活性。在有些实施方式中,本文提供的嵌合肽序列或肽序列以小于fgf19对fgfr4的结合亲和力的亲和力与fgfr4结合。在一个实施方式中,本文提供的嵌合肽序列或肽序列以相当于fgf19对fgfr4的结合亲和力的亲和力与fgfr4结合。在有些实施方式中,本文提供的嵌合肽序列或肽序列以大于fgf19对fgfr4的结合亲和力的亲和力与fgfr4结合。在一个实施方式中,本文提供的嵌合肽序列或肽序列不可检测地与fgfr4结合。
184.在进一步的方面,嵌合肽序列或肽序列与fgf19或fgf19变异体序列相比具有减少的hcc形成,该fgf19变异体序列具有在fgf19的氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代wgdpi(seq id no:170)序列;或与fgf19或fgf19变异体序列相比具有更大的葡萄糖降低活性,该fgf19变异体序列具有在fgf19的氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代wgdpi(seq id no:170)序列;与fgf19或fgf19变异体序列相比具有较少的脂质增加活性,该fgf19变异体序列具有在
fgf19的氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代wgdpi(seq id no:170)序列;或与fgf19或fgf19变异体序列相比具有较少的甘油三酯、胆固醇、非hdl或hdl增加活性,该fgf19变异体序列具有在fgf19的氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代wgdpi(seq id no:170)序列;或所述肽序列与fgf21相比具有较少的瘦体质量减少活性。这样的功能和活性可以在体外或体内确定,例如,在db/db小鼠中。
185.在一个实施方式中,肽或嵌合序列具有大于或小于对比序列的功能或活性。在有些实施方式中,所述对比序列是fgf19。在另一个实施方式中,所述对比序列是fgf19变异体序列,该fgf19变异体序列具有在fgf19的氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代wgdpi(seq id no:170)序列。在一个实施方式中,本文提供的肽或嵌合肽序列与对比序列相比具有更大的葡萄糖降低活性。在另一个实施方式中,本文提供的肽或嵌合肽序列与对比序列相比具有较少的脂质增加活性。在其他的实施方式中,本文提供的肽或嵌合肽序列与对比序列相比具有较低的或减少的脂质(例如,甘油三酯、胆固醇、非hdl)活性。在其他的实施方式中,本文提供的肽或嵌合肽序列与对比序列相比具有更多的hdl增加活性。在其他的实施方式中,本文提供的肽或嵌合肽序列与对比序列或fgf21相比具有较少的瘦体质量减少活性。
186.在进一步另外的各种实施方式中,肽或嵌合序列包括一个或多个l-氨基酸、d-氨基酸、非天然存在的氨基酸或氨基酸模拟物、衍生物或类似物。在再进一步各种实施方式中,肽或嵌合序列具有由接头(linker)或间隔区(spacer)连接的n-末端区、或c-末端区、或fgf19序列部分、或fgf21序列部分。
187.在某些实施方式中,本文提供的药物组合物是呈液体剂型。在有些实施方式中,所述肽的浓度为1至10mg/ml。在一个实施方式中,所述肽的浓度为1mg/ml。在另一个实施方式中,所述肽的浓度为5mg/ml。在有些实施方式中,所述肽的浓度为10mg/ml。在一个实施方式中,所述肽包含seq id no:70的氨基酸序列。在有些实施方式中,所述肽由seq id no:70的氨基酸序列组成。在一个实施方式中,所述肽包含seq id no:204的氨基酸序列或由其组成。
188.在本文提供的药物组合物的有些实施方式中,tris是在5和50mm、15和40mm、20和35mm、20和30mm或20和25mm的范围内存在。在一个实施方式中,所述tris以20mm存在。在有些实施方式中,1000ml的制剂体积包含2.0、2.1、2.2.、2.3.、2.4、2.5、2.6、2.7、2.8、2.9或
3.0g的tris,或其任何范围。在一个实施方式中,所述1000ml的制剂体积包含2.4至2.5g的tris。
189.在本文提供的各种药物组合物的有些实施方式中,海藻糖是在1%和20%、2%和15%、3%和10%、4%和9.5%、5%和9.25%、6%和9%、7%和8.5%、8%和8.4%或8.1%和8.3%的范围内存在。在一个实施方式中,所述海藻糖以8.2%、8.3%或8.4%存在。在有些实施方式中,1000ml的制剂体积包含92.0、92.1、92.2、92.3、92.4、92.5、92.6、92.7、92.8、92.9或93.0g的海藻糖二水合物。在一个实施方式中,1000ml的制剂体积包含92.4至92.5g的海藻糖二水合物(trehalose dihydrate)。在有些实施方式中,海藻糖脱水物(trehalose dehydrate)的摩尔浓度为240至300mm、240至290mm、250至290mm、260至290mm、270至290mm或244至245mm。在一个实施方式中,海藻糖脱水物的摩尔浓度为约280mm。
190.在本文提供的各种药物组合物的有些实施方式中,tween-20的浓度是在0.001至0.1%(v/v)、0.0025至0.075%(v/v)、0.005至0.05%(v/v)或0.0075至0.025%(v/v)的范围内。在一个实施方式中,tween-20的浓度为0.01%(v/v)。
191.在本文提供的各种药物组合物的有些实施方式中,所述药物组合物的ph在6.5和9.5、6.8和9.3、7.0和9.0、7.3和8.7、7.5和8.5或7.7和8.2的范围内。在一个实施方式中,所述药物组合物的ph为7.3、7.5、8.0或8.5。在有些实施方式中,在4℃下,取ph值。在一个实施方式中,在25℃下,取ph值。
192.在本文提供的各种药物组合物的有些实施方式中,所述组合物包含20mm tris、8.37%(w/v)海藻糖和0.01%tween-20。在本文提供的各种药物组合物的一个实施方式中,所述组合物包含20mm tris、8.3%(w/v)海藻糖和0.01%tween-20。在本文提供的各种药物组合物的一个实施方式中,所述组合物包含20mm tris、8.2%(w/v)海藻糖和0.01%tween-20。在本文提供的各种药物组合物的有些实施方式中,所述组合物包含20mm tris、280mm海藻糖和0.01%tween-20。在一个实施方式中,在25℃下,ph为8.0。在有些实施方式中,所述多肽包含seq id no:70。在其他的实施方式中,所述多肽由seq id no:70组成。在有些实施方式中,所述多肽包含seq id no:69。在其他的实施方式中,所述多肽由seq id no:69组成。在有些实施方式中,所述多肽与人抗体fc片段融合。
193.本文还提供的是一种药物组合物,其包含:(a)包含seq id no:70或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris,(ii)8.2%至8.4%(w/v)海藻糖,和(iii)0.01%tween-20。本文还提供的是一种药物组合物,其包含:(a)包含seq id no:69或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris、(ii)8.2%至8.4%(w/v)海藻糖,和(iii)0.01%tween-20。本文还提供的是一种药物组合物,其包含:(a)包含seq id no:70或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris,(ii)8.37%(w/v)海藻糖,和(iii)0.01%tween-20。本文还提供的是一种药物组合物,其包含:(a)包含seq id no:69或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris,(ii)8.37%(w/v)海藻糖,和(iii)0.01%tween-20。本文还提供的是一种药物组合物,其包含:(a)包含seq id no:70或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris,(ii)8.3%(w/v)海藻糖,和(iii)0.01%tween-20。本文还提供的是一种药物组合物,其包含:(a)包含seq id no:69或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris,(ii)8.3%(w/v)海藻糖,和(iii)0.01%tween-20。本文还提供的是一种药物组合物,
其包含:(a)包含seq id no:70或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris,(ii)8.2%(w/v)海藻糖,和(iii)0.01%tween-20。本文还提供的是一种药物组合物,其包含:(a)包含seq id no:69或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris,(ii)8.2%(w/v)海藻糖,和(iii)0.01%tween-20。在有些实施方式中,所述多肽包含seq id no:70。在其他的实施方式中,所述多肽由seq id no:70组成。在有些实施方式中,所述多肽包含seq id no:69。在其他的实施方式中,所述多肽由seq id no:69组成。在有些实施方式中,所述多肽与人抗体fc片段融合。
194.本文还提供的是一种药物组合物,其包含:(a)包含seq id no:70或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris,(ii)8.2%至8.4%(w/v)海藻糖,和(iii)0.01%tween-20;其中在25℃下,ph为8.0。本文还提供的是一种药物组合物,其包含:(a)包含seq id no:69或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris,(ii)8.2%至8.4%(w/v)海藻糖,和(iii)0.01%tween-20;其中在25℃下,ph为8.0。本文还提供的是一种药物组合物,其包含:(a)包含seq id no:70或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris,(ii)8.37%(w/v)海藻糖,和(iii)0.01%tween-20;其中在25℃下,ph为8.0。本文还提供的是一种药物组合物,其包含:(a)包含seq id no:69或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris,(ii)8.37%(w/v)海藻糖,和(iii)0.01%tween-20;其中在25℃下,ph为8.0。本文还提供的是一种药物组合物,其包含:(a)包含seq id no:70或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris,(ii)8.3%(w/v)海藻糖,和(iii)0.01%tween-20;其中在25℃下,ph为8.0。本文还提供的是一种药物组合物,其包含:(a)包含seq id no:69或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris,(ii)8.3%(w/v)海藻糖,和(iii)0.01%tween-20;其中在25℃下,ph为8.0。本文还提供的是一种药物组合物,其包含:(a)包含seq id no:70或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris,(ii)8.2%(w/v)海藻糖,和(iii)0.01%tween-20;其中在25℃下,ph为8.0。本文还提供的是一种药物组合物,其包含:(a)包含seq id no:69或由其组成的肽,和(b)药学上可接受的载体,包含:(i)20mm tris,(ii)8.2%(w/v)海藻糖,和(iii)0.01%tween-20;其中在25℃下,ph为8.0。在有些实施方式中,所述多肽包含seq id no:70。在其他的实施方式中,所述多肽由seq id no:70组成。在有些实施方式中,所述多肽包含seq id no:69。在其他的实施方式中,所述多肽由seq id no:69组成。在有些实施方式中,所述多肽与人抗体fc片段融合。
195.在本文提供的各种药物组合物的有些实施方式中,所述药物组合物不包含盐。在一个实施方式中,所述药物组合物不包含nacl。
196.在本文提供的各种药物组合物的有些实施方式中,所述药物组合物是呈液体形式。在某些实施方式中,所述药物组合物为冻干的。
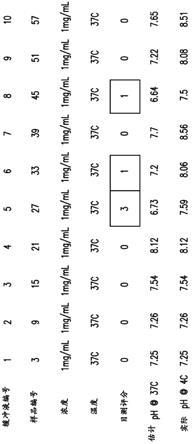
197.在本文提供的各种药物组合物的一个实施方式中,在一段时间周期以后,所述组合物包含小于20%、小于15%、小于10%、小于5%或小于2%的肽聚集物(peptide aggregate)。在有些实施方式中,所述聚集物使用本文提供的测定法来测量(例如,在实验部分中)。在一个实施方式中,在一段时间周期以后,所述组合物包含小于20%的肽聚集物。在一个实施方式中,在一段时间周期以后,所述组合物包含小于15%的肽聚集物。在一个实施方式中,在一段时间周期以后,所述组合物包含小于10%的肽聚集物。在一个实施方式
中,在一段时间周期以后,所述组合物包含小于5%的肽聚集物。在一个实施方式中,在一段时间周期以后,所述组合物包含小于2%的肽聚集物。在本文提供的各种药物组合物的一个实施方式中,在一段时间周期以后,所述组合物包含小于20%、小于15%、小于10%、小于5%或小于2%的肽沉淀物。在有些实施方式中,所述沉淀物使用本文提供的测定法来测量(例如,在实验部分中)。在一个实施方式中,在一段时间周期以后,所述组合物包含小于20%的肽沉淀物。在一个实施方式中,在一段时间周期以后,所述组合物包含小于15%的肽沉淀物。在一个实施方式中,在一段时间周期以后,所述组合物包含小于10%的肽沉淀物。在一个实施方式中,在一段时间周期以后,所述组合物包含小于5%的肽沉淀物。在一个实施方式中,在一段时间周期以后,所述组合物包含小于2%的肽沉淀物。在某些实施方式中,所述时间周期为1天、7天、14天、28天、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11,个月、12个月、18个月、24个月或更长时间。在一个实施方式中,所述时间周期为1天。在一个实施方式中,所述时间周期为7天。在一个实施方式中,所述时间周期为14天。在一个实施方式中,所述时间周期为21天。在一个实施方式中,所述时间周期为1个月。在一个实施方式中,所述时间周期为2个月。在一个实施方式中,所述时间周期为3个月。在一个实施方式中,所述时间周期为4个月。在一个实施方式中,所述时间周期为5个月。在一个实施方式中,所述时间周期为6个月。在一个实施方式中,所述时间周期为7个月。在一个实施方式中,所述时间周期为8个月。在一个实施方式中,所述时间周期为9个月。在一个实施方式中,所述时间周期为10个月。在一个实施方式中,所述时间周期为11个月。在一个实施方式中,所述时间周期为12个月。在一个实施方式中,所述时间周期为18个月。在一个实施方式中,所述时间周期为24个月。在有些实施方式中,所述药物组合物贮存在-80℃。在一个实施方式中,所述药物组合物贮存在4℃。在有些实施方式中,所述药物组合物贮存在25℃。在一个实施方式中,所述药物组合物贮存在37℃。
198.在某些实施方式中,本文提供的药物组合物的货架期为至少约12个月、至少约24个月或至少约36个月。在某些实施方式中,本文提供的药物组合物的货架期为至少约12个月。在某些实施方式中,本文提供的药物组合物的货架期为至少约24个月。在某些实施方式中,本文提供的药物组合物的货架期为至少约36个月。在有些实施方式中,所述药物组合物贮存在-80℃。在一个实施方式中,所述药物组合物贮存在4℃。在有些实施方式中,所述药物组合物贮存在25℃。在一个实施方式中,所述药物组合物贮存在37℃.
199.在仍然另外的实施方式中,所述嵌合肽或肽序列包括在药物组合物中,该药物组合物进而可以用于实践本文提供的方法和用途。这样的组合物包括无活性或其他活性成分的组合。在一个实施方式中,组合物(如药物组合物)包括嵌合肽序列或肽序列和药剂,例如,改善胆汁酸体内稳态的药剂。
200.在一个实施方式中,本文提供的是预防患有通过本文提供的肽序列可预防的疾病或紊乱或处于患上该疾病或紊乱的风险之中的对象的方法,包括向对象以对预防该疾病或紊乱有效的量给予包含本文提供的肽的药物组合物。在另一个实施方式中,本文提供的是治疗患有通过本文提供的肽序列可治疗的疾病或紊乱或处于患上该疾病或紊乱的风险之中的对象的方法,包括向对象以对治疗该疾病或紊乱有效的量给予包含本文提供的肽的药物组合物。在还有另一个实施方式中,本文提供的是处理患有通过本文提供的肽序列可处理的疾病或紊乱或处于患上该疾病或紊乱的风险之中的对象的方法,包括向对象以对处理
该疾病或紊乱有效的量给予包含本文提供的肽的药物组合物。在一个实施方式中,所述疾病或紊乱是胆汁酸-有关疾病或相关紊乱。在另一个实施方式中,所述疾病或紊乱是代谢疾病或紊乱。在其他的实施方式中,所述疾病或紊乱是癌症或肿瘤。
201.根据本文提供的方法和用途所述的可预防、可治疗或可处理的非限制性示例性的胆汁酸有关或相关紊乱包括:胆汁淤积症(cholestasis),包括例如肝内胆汁淤积的疾病(例如,原发性胆汁性肝硬化(pbc)、原发性家族性肝内胆汁淤积症(pfic)(例如,进行性pfic)、原发性硬化性胆管炎(choangitis)(psc)、妊娠期肝内胆汁淤积症(pic)、新生儿胆汁淤积症和药物诱发的胆汁淤积症(例如,雌激素)),以及肝外胆汁淤积的疾病(例如,肿瘤所致的胆汁切向压缩(bile cut compression from tumor)、胆结石所致的胆管堵塞);胆汁酸吸收不良和累及远端小肠的其他紊乱,包括回肠切除、炎症性肠疾病(例如,克罗恩氏病(crohn’s disease)和溃疡性结肠炎)、短肠综合征,损害胆汁酸的吸收(不另表征(特发性的))而导致腹泻(例如,胆汁酸性腹泻(bad))和gi症状的紊乱,以及gi、肝脏和/或胆汁性癌症(例如,结肠癌和肝细胞癌);和/或胆汁酸合成异常,诸如促进非酒精性脂肪性肝炎(nash)、肝硬化和门静脉高压的那些;例如,在哺乳动物(如人类)中。另外的胆汁酸有关或相关紊乱包括代谢综合征;脂质或葡萄糖紊乱;胆固醇或甘油三酯代谢;2型糖尿病。在一个特别的实施方式中,所述胆汁酸有关或相关紊乱是胆汁酸吸收不良。在另一个特别的实施方式中,所述胆汁酸有关或相关紊乱是腹泻。在一个再进一步特别的实施方式中,所述胆汁酸有关或相关紊乱是胆汁淤积症(例如,肝内或肝外胆汁淤积症)。在另一个进一步的特别的实施方式中,所述胆汁酸有关或相关紊乱是原发性胆汁性肝硬化(pbc)。在其他特别的实施方式中,所述胆汁酸有关或相关紊乱是原发性硬化性胆管炎。在另一个实施方式中,所述胆汁酸有关或相关紊乱是pfic(例如,进行性pfic)。在另一个实施方式中,所述胆汁酸有关或相关紊乱是nash。在另一个实施方式中,所述胆汁酸有关或相关紊乱是高血糖症。在一个具体的实施方式中,所述胆汁酸有关或相关紊乱是2型糖尿病。
202.在有些实施方式中,所述药物组合物还包含至少一种另外的在调节胆汁酸体内稳态或治疗胆汁酸有关或相关紊乱中有效的药剂,其中所述另外的药剂是:糖皮质激素;cdca;udca;胰岛素、胰岛素促分泌素、胰岛素模拟物、磺酰脲和美格列奈(meglitinide);双胍类(biguanide);α-葡萄糖苷酶抑制剂;dpp-iv抑制剂、glp-1、glp-1激动剂和glp-1类似物;dpp-iv-抗性类似物;pparγ激动剂、双重作用ppar激动剂、泛作用ppar激动剂(pan-acting ppar agonist);ptp1b抑制剂;sglt抑制剂;rxr激动剂;糖原合酶激酶-3抑制剂;免疫调节剂;β-3肾上腺素能受体激动剂;11β-hsd1抑制剂;胰岛淀粉样多肽(amylin)和胰岛淀粉样多肽类似物;胆汁酸螯合剂;或sglt-2抑制剂。在某些实施方式中,所述至少一种另外的在调节pbc中有效的药剂是udca、fxr激动剂、oca、asbt抑制剂、自身免疫剂(autoimmune agent)、抗il-12剂、抗cd80剂、抗cd20剂、cxcl10中和抗体、针对cxcr3的配体、贝特类(fibrate)、鱼油、秋水仙碱、甲氨蝶呤、硫唑嘌呤、环孢菌素或抗逆转录病毒的疗法。在特别的实施方式中,所述至少一种另外的在调节pbc中有效的药剂是udca、oca、asbt抑制剂、抗il-12剂、抗cd20剂或贝特类。
203.用本文提供的肽制剂、方法及其用途可预防、可治疗或可处理的非限制性示例性的紊乱或病症包括代谢疾病和紊乱。疾病和紊乱的非限制性实例包括:代谢综合征;脂质-或葡萄糖-相关紊乱;胆固醇或甘油三酯代谢;2型糖尿病;胆汁淤积症,包括例如肝内胆汁
淤积的疾病(例如,pbc、pfic、psc、pic、新生儿胆汁淤积症和药物诱发的胆汁淤积症(例如,雌激素)),以及肝外胆汁淤积的疾病(例如,肿瘤所致的胆汁切向压缩、胆结石所致的胆管堵塞);胆汁酸吸收不良和累及远端小肠的其他紊乱,包括回肠切除、炎症性肠疾病(例如,克罗恩氏病和溃疡性结肠炎),损害胆汁酸的吸收(不另表征(特发性的))而导致腹泻(例如,bad)和gi症状的紊乱,以及gi、肝脏和/或胆汁性癌症(例如,结肠癌和肝细胞癌);和/或胆汁酸合成异常,诸如促进nash、肝硬化和门静脉高压的那些。对于治疗,可以将本文提供的肽给予需要调节胆汁酸体内稳态或患有胆汁酸有关或相关紊乱的对象。本文提供的肽也可以用于其他高血糖相关紊乱,包括肾损伤(例如,肾小管损伤或肾病变)、肝脏变性、眼损伤(例如,糖尿病性视网膜病变或白内障)和糖尿病足紊乱(diabetic foot disorder);血脂异常(dyslipidemia)及它们的后遗症,诸如,例如,动脉粥样硬化、冠状动脉疾病、脑血管紊乱等。
204.可能与代谢综合征相关的其他病症,诸如肥胖症和升高的体重质量(包括其共同病态病症(co-morbid condition),例如但不限于非酒精性脂肪性肝病(nafld)、非酒精性脂肪性肝炎(nash)和多囊卵巢综合征(pcos),并且也包括血栓形成、高凝状态及血栓前状态(动脉和静脉)、高血压(包括门静脉高压(定义为肝脏的静脉压力梯度(hvpg)大于5mm hg)、心血管疾病、中风与心力衰竭;其中涉及炎症反应的紊乱或病症,包括动脉粥样硬化、慢性炎症性肠疾病(例如,克罗恩氏病和溃疡性结肠炎)、哮喘、红斑狼疮、关节炎或其他炎症性风湿性紊乱;细胞周期或细胞分化过程的紊乱,诸如脂肪细胞肿瘤、脂肪瘤性癌,包括例如脂肪肉瘤、实体肿瘤和赘生物;神经变性性疾病和/或中枢神经系统和周围神经系统的脱髓鞘紊乱和/或涉及神经炎症过程的神经科疾病和/或其他外周神经病变,包括阿尔茨海默氏病(alzheimer's disease)、多发性硬化、帕金森氏病(parkinson's disease)、进行性多病灶脑白质病变和格林-巴利综合征(guillian-barre syndrome);皮肤和皮肤科紊乱(skin and dermatological disorders)和/或伤口愈合过程的紊乱,包括红斑-鳞状皮肤病(erythemato-squamous dermatoses);和其他紊乱,诸如x综合征(syndrome x)、骨关节炎和急性呼吸窘迫综合征。
205.在有些实施方式中,所述疾病或紊乱是癌症或肿瘤。在某些实施方式中,所述癌症或肿瘤是fgf19依赖性癌症或肿瘤。在一个实施方式中,所述fgf19依赖性癌症或肿瘤是肝细胞癌。在有些实施方式中,所述fgf19癌症或肿瘤不是肝细胞癌。在一个实施方式中,所述癌症或肿瘤是结肠癌或肿瘤。在有些实施方式中,所述癌症或肿瘤是前列腺癌或肿瘤。在一个实施方式中,所述癌症或肿瘤是肺癌或肿瘤。在有些实施方式中,所述方法导致了肿瘤数量、肿瘤大小或肿瘤重量的减少。
206.在本文提供的各种方法的一个实施方式中,所述对象是人。在某些实施方式中,所述对象是有其需要的对象。
207.在有些实施方式中,对本文描述的嵌合肽序列或肽序列单用或与至少一种另外的治疗剂或治疗方式(treatment modality)进行评估以确保在所述对象中不会引起不良副作用。在一个特别的方面,对本文描述的嵌合肽序列或肽序列与至少一种另外的治疗剂或治疗方式的组合进行评估以确保在所述对象中不会诱发hcc。这样的评估可以在疗法开始之前(例如,在剂量递升研究中)、在疗法期间(例如,通过评价与hcc活性相关的标志物)或在疗法结束之后(例如,通过进行肝脏活组织检查)进行。在有些方面,所述评估在合适的试
验环境(例如,经验证的动物模型)中进行。本领域普通技术人员熟悉另外的手段以确保本文描述的联合疗法对于具体对象或代表具体对象的对象群体是合适的,同时考虑了所有相关的因素,包括例如对象的胆汁酸有关或相关紊乱(例如,pbc)的严重程度和对象所服用的其他药物。
208.4.附图描述
209.图1描绘十种不同的制剂缓冲液在下列条件下的肉眼观察结果:活性成分的浓度1mg/ml;温度37℃;4周后。在目视评分之前将样品重新悬浮并拍照。评分系统:0
–
清亮;1
–
轻微模糊;2
–
轻微混浊;3
–
混浊;4
–
非常混浊;5
–
极度混浊。
210.图2描绘十种不同的制剂缓冲液在下列条件下的肉眼观察结果:活性成分的浓度10mg/ml;温度37℃;4周后。在目视评分之前将样品重新悬浮并拍照。评分系统:0
–
清亮;1
–
轻微模糊;2
–
轻微混浊;3
–
混浊;4
–
非常混浊;5
–
极度混浊。
211.图3描绘基于1mg/ml样品在a
210
下吸光度的sec auc的hplc分析结果,显示在各时间点单体的百分比(%)。
212.图4描绘基于1mg/ml样品在缓冲液7中在a
210
下吸光度的sec auc的hplc分析结果。
213.图5描绘基于10mg/ml样品在a
210
下吸光度的sec auc的hplc分析结果,显示在各时间点单体的百分比(%)。
214.图6描绘基于10mg/ml样品在制剂缓冲液7中在a
210
下吸光度的sec auc的hplc分析结果。
215.图7a-7b描绘对于(a)1mg/ml和(b)10mg/ml的浓度在4周时制剂(a)缓冲液7的sds-page凝胶电泳。
216.图8描绘在t=0周、1周、2周和4周时,在37℃、1mg/ml的浓度下缓冲液7的iec-hplc。
217.图9描绘在t=0周、1周、2周和4周时,在37℃、10mg/ml的浓度下缓冲液7的iec-hplc。
218.图10描绘在t=0周、1周、2周和4周时,在37℃、1mg/ml的浓度下缓冲液7的rp-hplc。
219.图11描绘在t=0周、1周、2周和4周时,在37℃、10mg/ml的浓度下缓冲液7的rp-hplc。
220.图12描绘在包含20mm tris ph 8.0(25℃)、8.3%(w/v)海藻糖、0.01%聚山梨酯-20(tween-20)(“ttp缓冲液”)的m70制剂的冻/融循环之后的稳定性数据。
221.5.详述
222.在本公开作进一步描述之前,必须明确本公开并不局限于本文所阐述的具体实施方式,还必须明确本文中使用的术语仅用于描述具体实施方式的目的,决不是限制性的。
223.5.1定义
224.术语“患者”或“对象”可互换使用,是指人或非人动物(例如,哺乳动物)。
225.术语“治疗”及其各种变体是指在疾病、紊乱或病症或其症状已经确诊、观察等之后开始的作用过程(如给予多肽或包含多肽的药物组合物)以便消除、减少、阻抑(suppress)、缓解(mitigate)或减轻(或暂时地或永久地)折磨对象的疾病、紊乱或病症的基础病因中的至少一种或与折磨对象的疾病、紊乱、病症相关的症状中的至少一种。因此,
治疗包括抑制(即,使疾病、紊乱或病症或与其相关的临床症状的发展或进一步发展停止)活动性疾病。
226.如本文使用的术语“需要治疗的”是指由主治医师或其他医学专业人员作出的判断对象需要治疗或者将受益于治疗。
227.术语“预防”及其各种变体是指在某一种方式(例如,在疾病、紊乱、病症或其症状发作之前)开始的作用过程(如给予多肽或包含多肽的药物组合物)以便预防、阻抑、抑制或减少(或暂时地或永久地)对象发生疾病、紊乱、病症等的风险(根据临床症状确定,例如不存在临床症状)或延迟其发作,一般在倾向于患有特定疾病、紊乱或病症的对象的情况下。在某些情况下,该术语也指减缓疾病、紊乱或病症的进展或者抑制其进展以消除有害的或相反不希望有的状态。
228.如本文使用的术语“需要预防的”是指由主治医师或其他医学专业人员作出的判断对象需要预防保健或者将受益于预防保健。
229.短语“治疗有效量”是指向对象给予药剂,或者单独或者作为药物组合物的一部分,并且或在单次剂量中或者作为系列剂量的一部分,以向患者给予时对疾病、紊乱或病症的任何症状、方面或特征能够具有任何可检测的积极作用的量。所述治疗有效量可以通过测量相关的生理效果来确定。例如,就高血糖症而论,降低或减少血糖或在葡萄糖耐量试验中的改善可以用于确定药剂的量对治疗高血糖症是否有效。例如,治疗有效量是足以降低或减少空腹血浆葡萄糖(fpg)的任何水平(例如,基线水平)的量,其中,例如,该量足以使大于200mg/dl的fpg水平降低至小于200mg/dl,其中所述量足以使介于175mg/dl和200mg/dl之间的fpg水平降低至低于开始水平,其中所述量足以使介于150mg/dl和175mg/dl之间的fpg水平降低至低于开始水平,其中所述量足以使介于125mg/dl和150mg/dl之间的fpg水平降低至低于开始水平,以此类推(例如,使fpg水平降低至小于125mg/dl,至小于120mg/dl,至小于115mg/dl,至小于110mg/dl,等等)。此外,就hbaic水平而论,所述有效量是足以使该水平降低或减少超过约10%至9%、超过约9%至8%、超过约8%至7%、超过约7%至6%、超过约6%至5%等的量。更特别地,本公开考虑了hbaic水平的降低或减少约0.1%、0.25%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1%、1.5%、2%、3%、4%、5%、10%、20%、30%、33%、35%、40%、45%、50%或50%以上。所述治疗有效量可以结合对象的病症的给药方案和诊断分析等作出调整。
230.短语“以足够量以影响变化”意指在给予特定疗法之前(例如,基线水平)和之后测量的指标的水平之间存在可检测的差异。指标包括任何客观参数(例如,葡萄糖或胰岛素的水平)或主观参数(例如,对象的良好感觉)。
231.如本文使用的短语“葡萄糖耐量”是指当葡萄糖摄入波动时对象控制血浆葡萄糖和/或血浆胰岛素的水平的能力。例如,葡萄糖耐量包括对象在约120分钟以内降低血浆葡萄糖的水平以回到在葡萄糖摄入之前确定的水平的能力。
232.从广义上讲,术语“糖尿病”和“糖尿病的”是指涉及胰岛素的不适当产生或利用的碳水化合物代谢的一种进行性疾病,常常以血糖过高和糖尿为特征。术语“糖尿病前期”和“糖尿病前期的”是指其中对象不具有通常在糖尿病中观测到的特征、症状等但是的确具有如果不及时治疗可以进展至糖尿病的特征、症状等的一种状态。这些病症的存在可以利用例如空腹血浆葡萄糖(fpg)试验或口服葡萄糖耐量试验(ogtt)来确定。在开始该试验之前,
之间的成年人被认为是过重(肥胖前期);和bmi为~30kg/m2或更高的成年人被认为是肥胖。增强的食欲常常导致体重过重。有一些病症与增强的食欲相关,包括例如夜食综合征,夜食综合征以早上厌食和晚上多食为特征,通常与失眠症相关,但也可能与对下丘脑造成损伤有关。
239.术语“多肽”、“肽”和“蛋白质”在本文中可互换使用,是指任何长度的氨基酸的多聚体形式,可以包括遗传编码的和非遗传编码的氨基酸、化学或生物化学修饰的或衍生的氨基酸和具有修饰多肽骨架的多肽。这些术语包括融合蛋白,包括但不限于具有异源氨基酸序列的融合蛋白、具有异源和同源前导序列的融合蛋白,有或没有n-末端甲硫氨酸残基;带有免疫标记的蛋白质;等等。应当理解,通过本公开,根据单字母或三字母密码对氨基酸进行编码。
240.如本文使用的,术语“变异体(variant)”涵盖天然存在的变异体(例如,同源物(homologs)和等位基因变异体)和非天然存在的变异体(例如,突变蛋白(muteins))。天然存在的变异体包括同源物,即在种与种之间分别在核苷酸或氨基酸序列不同的核酸和多肽。天然存在的变异体包括等位基因变异体,即在种内的不同个体之间分别在核苷酸或氨基酸序列不同的核酸和多肽。非天然存在的变异体包括分别在核苷酸或氨基酸序列中包含变化的核酸和多肽,其中序列中的变化是人工引入的,例如,这种变化在实验室或其他场所通过人为干预(“人的手(hand of man)”)来产生。
241.术语“天然的”,当提及fgf19时,是指生物活性的、天然存在的fgf19,包括生物活性的、天然存在的fgf19变异体。该术语包括194个氨基酸的人fgf19成熟序列。
242.术语“标记物”、“标记”和类似术语,当在本公开的多肽或核酸(或抗体,视情况而定)的情形下使用时,在广义上是指可用于例如多肽纯化、鉴定、分离和合成的任何手段。标记物一般与感兴趣的多肽共价结合,并且可以以本领域已知的任何方式引入,包括连接至成熟多肽(一般在n-末端或c-末端)、在固相肽合成期间掺入或通过重组方式。实例包括但不限于荧光、生物素酰化和放射性同位素。多肽和核酸分子可以通过体外和体内两种方法来标记。标记试剂和试剂盒可以从许多商业来源获得(例如,thermo fischer scientific,rockford,il;和molecular probes/life technologies;grand island,ny)。
243.如本文使用的术语“突变蛋白”在广义上是指突变的重组蛋白,即,包含氨基酸序列中的人工引入的变化的多肽,例如,在实验室或其他场所通过人为干预(“人的手(hand of man)”)产生的氨基酸序列中的变化。这些蛋白质通常携带单个或多个氨基酸取代并且频繁地来源于实施了定点或随机诱变的克隆基因,或来源于完全合成的基因。
244.如本文使用的,当涉及天然人fgf19或fgf19突变蛋白时,术语“修饰的”、“修饰”等是指提高人fgf19、天然存在的fgf19变异体或fgf19突变蛋白的所需特性的一个或多个变化,其中所述变化(含多个变化)不改变fgf19的一级氨基酸序列。这样的所需性质包括例如提高溶解度、延长循环半寿期、增加稳定性、降低清除率、改变免疫原性或变应原性、改进可制造性(例如,成本和效率)的方面和能够产生特定抗体(例如,通过引入独特表位)用于检测测定。可以实现的针对人fgf19、天然存在的fgf19变异体或fgf19突变蛋白的变化包括但不限于聚乙二醇化(共价连接聚乙二醇(peg)或其衍生物的一个或多个分子);糖基化(例如,n-糖基化)、聚唾液酸化和hes化(hesylation);白蛋白融合;白蛋白结合,通过例如缀合的脂肪酸链(酰基化);fc-融合;和与peg模拟物融合。有些特别的实施方式涉及采用聚乙二
醇的修饰,其他特别的实施方式涉及采用白蛋白的修饰,和再有其他特别的修饰涉及采用糖基化的修饰。
245.术语“dna”、“核酸”、“核酸分子”、“多核苷酸”等在本文中可互换使用,是指任何长度的核苷酸(或者脱氧核糖核苷酸或者核糖核苷酸)或其类似物的聚合体形式。多核苷酸的非限制性实例包括线性和环状核酸、信使rna(mrna)、互补dna(cdna)、重组多核苷酸、载体、探针、引物等。
246.术语“探针”是指对应于感兴趣的基因或序列的dna或rna的片段,其中所述片段已经进行了放射性标记(例如,通过掺入
32
p或
35
s)或带有一些其他可检测的分子,诸如生物素、洋地黄毒苷(digoxygen)或荧光素。当dna或rna的序列段与互补序列将会杂交时,可以使用探针,例如,以标记含有感兴趣的基因的病毒噬斑、细菌菌落或凝胶上的条带。探针可以是克隆的dna或者它可以是合成的dna链,后者可以用于从经分离的蛋白质中获得cdna或基因组的克隆,例如通过对一部分蛋白质进行微测序、推导出编码蛋白质的核酸序列、合成出携带该序列的寡核苷酸、对该序列进行放射性标记和用它作为探针来筛选cdna文库或基因组文库。
247.术语“异源的”是指根据结构定义的从不同来源获得的两种组分。例如,在多肽的上下文中,“异源的”多肽可以包括来源于不同多肽的可操作性连接的氨基酸序列。类似地,在编码嵌合多肽的多核苷酸的上下文中,“异源的”多核苷酸可以包括可以来源于不同基因的可操作性连接的核酸序列。示例性的“异源的”核酸包括表达构建体,其中包含编码序列的核酸与调节元件(例如,启动子)可操作性连接,调节元件的遗传来源与编码序列的不同(例如,以提供在感兴趣的宿主细胞中表达,其可以属于与启动子、编码序列或它们二者不同的遗传来源)。在重组细胞的上下文中,“异源的”可以是指存在与在其所存在的宿主细胞不同的遗传来源的核酸(或基因产物,诸如多肽)。
248.术语“可操作性连接的”是指分子之间的连接方式以提供所需的功能。例如,“可操作性连接的”在核酸的上下文中是指核酸序列之间的功能性连接。作为实例,核酸表达控制序列(诸如启动子、信号序列,或转录因子结合位点的阵列)可以与第二多核苷酸可操作性连接,其中所述表达控制序列影响第二多核苷酸的转录和/或翻译。在多肽的上下文中,“可操作性连接的”是指氨基酸序列(例如,不同的结构域)之间的功能性连接以给所述多肽提供所描述的活性。
249.如本文使用的在多肽的结构的上下文中,“n-末端”(或“氨基末端”)和“c-末端”(或“羧基末端”)分别是指多肽的极端的氨基和羧基末端,而术语“n-末端的”和“c-末端的”分别是指多肽的氨基酸序列朝向n-末端和c-末端的相对位置,并且可以分别包括在n-末端和c-末端的残基。“立即n-末端”或“立即c-末端”是指第一个氨基酸残基相对于第二个氨基酸残基的位置,其中第一个和第二个氨基酸残基共价结合以提供毗连的氨基酸序列。
[0250]“来源于”,在氨基酸序列或多核苷酸序列的上下文中(例如,“来源于”fgf19多肽的氨基酸序列),意指多肽或核酸具有基于参比多肽或核酸(例如,天然存在的fgf19多肽或编码fgf19的核酸)的序列,而不是意指局限于其中制备蛋白质或核酸的来源或方法。作为实例,术语“来源于”包括参比氨基酸或dna序列的同源物或变异体。
[0251]
在多肽的上下文中,术语“分离的”是指感兴趣的多肽如果天然存在的话是在与它可以天然存在的环境不同的环境中。“分离的”意指包括这样的多肽,其是在对感兴趣的多
肽基本上富集的样品中和/或其中感兴趣的多肽部分地或基本上纯化。如果多肽不是天然存在的,“分离的”表示多肽已经通过合成或重组手段从制备它的环境中分离出来。
[0252]“富集的”意指样品进行了非天然操作(例如,由科学家或临床医师)致使与起始样品(例如生物样品(例如,其中多肽天然存在的样品或其中它在给药后存在的样品))中的多肽的浓度相比,感兴趣的多肽以a)更高的浓度(例如,高至少3倍、高至少4倍、高至少8倍、高至少64倍或更高浓度)存在,或以b)大于其中制备所述多肽的环境中的浓度存在(例如,像在细菌细胞中一样)。
[0253]“基本上纯的”表示组分(例如,多肽)占到组合物总含量的约50%以上和典型地占到总的多肽含量的约60%以上。更典型地,“基本上纯的”是指其中总组合物的至少75%、至少85%、至少90%或更高为感兴趣的组分的组合物。在有些情况下,多肽将占到组合物总含量的约90%以上或约95%以上。
[0254]
术语“测量”或“测定”及其语法变体在本文中可互换使用,是指定性或定量确定,或者定性和定量确定二者。当该术语在提及检测时使用时,考虑了评估相对量的任何手段,包括本文所阐述的和本领域已知的各种方法。例如,基因表达可以通过rna印迹(northern blot)、蛋白质印迹(western blot)、免疫沉淀测定(immunoprecipitation assay)或者通过测量已表达蛋白质的活性、功能或数量进行测定或测量。
[0255]
术语“抗体”(ab)和“免疫球蛋白”(ig)是指具有相同结构特征的糖蛋白。尽管抗体表现出对特定抗原的结合特异性,但是免疫球蛋白包括抗体和缺乏抗原特异性的其他抗体样分子二者。
[0256]
术语“单克隆抗体”是指从基本上同质抗体的群体获得的抗体,即包含该群体的个体抗体是完全相同的,除了可能天然存在的突变(可少量存在)以外。单克隆抗体针对单一抗原位点是高度特异性的。与多克隆抗体制备物(它可以包括针对不同决定簇(表位)的不同抗体)相反,每个单克隆抗体都针对抗原上的单一抗原决定簇。
[0257]
在抗体的上下文中,术语“分离的”是指从其天然环境的污染组分中分开和/或回收的抗体;这样的污染组分包括可能会干扰抗体的诊断或治疗应用的材料,并且可以包括酶、激素和其他蛋白质性或非蛋白质性溶质。
[0258]
如本文使用的,术语“fgf19依赖性”和类似术语,当在疾病、紊乱或病症的上下文中使用时,是指全部或部分地由fgf19的表达引起的疾病、紊乱或其他病症。在某些实施方式中,fgf19的表达与对照相比是扩大的。在有些实施方式中,fgf19的表达扩大5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或95%以上,或其任何数字范围。在有些实施方式中,fgf19的表达的扩大直接导致了疾病、紊乱或病症,或其症状。在其他的实施方式中,gf19的表达的扩大间接导致了疾病、紊乱或病症,或其症状。
[0259]
5.2药物组合物
[0260]
在一个方面,本文提供的是“药物组合物”,其包括本文提供的一种或多种肽序列,包括所例示的肽序列的子序列、变异体和修饰形式(例如,在序列表或表1中列出的序列),及一种或多种药学上可接受的或生理学上可接受的稀释剂、载体或赋形剂。在某些实施方式中,所述肽序列与一种或多种另外的药剂一起或分开提供。还提供的是包含这样的一种或多种另外的药剂和一种或多种药学上可接受的或生理学上可接受的稀释剂、载体或赋形
剂的组合物。在特别的实施方式中,一种或多种肽序列和一种或多种另外的药剂均以治疗上可接受的量存在。所述药物组合物可以按照本文提供的方法和用途来使用。因此,例如,所述药物组合物可以以先体外再体内(ex vivo)或体内(in vivo)的方式给予对象以便实施本文提供的治疗方法和用途。本文提供的药物组合物可配制成与期望的给药方法或给药途径相容;示例性的给药途径如本文所述。
[0261]
在一个实施方式中,提供的是调节胆汁酸体内稳态并且能够治疗胆汁酸有关或相关紊乱的嵌合体和肽序列的药物组合物和剂型。在另一个实施方式中,提供的是调节高血糖症、胰岛素抵抗、高胰岛素血症、葡萄糖不耐症、代谢综合征或相关紊乱的嵌合体和肽序列的药物组合物和剂型。在另一个实施方式中,提供的是调节癌症或肿瘤的嵌合体和肽序列的药物组合物和剂型。
[0262]
在有些方面,所述药物组合物可能还包含本文公开的或技术人员已知的其他治疗活性剂或化合物,其可以用于治疗或预防如本文所阐述的各种疾病和紊乱。如上所述,所述另外的治疗活性剂或化合物可以存在于独立的一种或多种药物组合物中。示例性的给药参数和给药方案如本文所描述。
[0263]
药物组合物典型地包含治疗有效量的本文提供的肽序列中的至少一种,包括所例示的肽序列的子序列、变异体和修饰形式(例如,在序列表或表1中列出的序列),及一种或多种药学上和生理学上可接受的配方剂。在某些实施方式中,所述药物组合物还包含一种或多种另外的本文描述的药剂。
[0264]
在一个实施方式中,药物组合物包含本文提供的肽。在有些实施方式中,药物组合物包含治疗有效量的本文提供的肽。在某些实施方式中,所述药物组合物包含药学上可接受的或生理学上可接受的稀释剂、载体或赋形剂。在一个具体的实施方式中,所述肽包含seq id no:70的氨基酸序列。在另一个实施方式中,所述肽由seq id no:70的氨基酸序列组成。在一个具体的实施方式中,所述肽包含seq id no:204的氨基酸序列。在另一个实施方式中,所述肽由seq id no:204的氨基酸序列组成。在某些实施方式中,所述药物组合物还包含一种或多种另外的本文描述的药剂。
[0265]
在某些实施方式中,所述药物组合物包含浓度为0.1-100mg/ml的所述肽。在有些实施方式中,所述药物组合物包含浓度为1至10mg/ml的所述肽。在某些实施方式中,所述药物组合物包含浓度为1mg/ml的所述肽。在另一个实施方式中,所述肽的浓度为5mg/ml。在某些实施方式中,所述药物组合物包含浓度为10mg/ml的所述肽。
[0266]
合适的药学上可接受的或生理学上可接受的稀释剂、载体或赋形剂包括但不限于抗氧化剂(例如,抗坏血酸和硫酸氢钠)、防腐剂(例如,苯甲醇,对羟苯甲酸甲酯、乙酯或正丙酯,对羟基苯甲酸酯)、乳化剂、悬浮剂、分散剂、溶剂、填充剂、增量剂(bulking agent)、缓冲剂、溶媒、稀释剂和/或助剂。例如,对于胃肠外给药,合适的溶媒可以是生理盐水溶液或柠檬酸盐缓冲的盐水,在药物组合物中还可能补加其他常规材料。中性缓冲盐水或与血清白蛋白混合的盐水是进一步示例性的溶媒。本领域技术人员将容易地识别可以用于本文使用的药物组合物和剂型的各种缓冲剂。典型的缓冲剂包括但不限于药学上可接受的弱酸、弱碱或其混合物。缓冲剂组分也包括水溶性材料如磷酸、酒石酸、乳酸、琥珀酸、柠檬酸、乙酸、抗坏血酸、天冬氨酸、谷氨酸及其盐。
[0267]
在一个具体的实施方式中,所述药物组合物包含磷酸钾。在一个实施方式中,所述
药物组合物包含氯化钠。在另一个实施方式中,所述药物组合物包含氨丁三醇(tris)。在其他的实施方式中,所述药物组合物包含海藻糖二水合物。在另一个实施方式中,所述药物组合物包含tween-20(聚山梨酯-20)。在还有另一个实施方式中,所述药物组合物包含盐酸。在某个实施方式中,所述药物组合物包含水。上述组分的二、三、四、五、六种或所有七种的任何组合也予以考虑。
[0268]
因此,在一个实施方式中,所述药物组合物包含磷酸钾、氯化钠、氨丁三醇(tris)、海藻糖脱水物、tween-20、盐酸、水或其任何组合。在一个具体的实施方式中,所述药物组合物包含磷酸钾、氯化钠、氨丁三醇(tris)、海藻糖二水合物、tween-20、盐酸和水。
[0269]
在一个实施方式中,可用于本文提供的药物组合物中的tris的摩尔浓度是在介于5和50mm之间的范围内。在另一个实施方式中,tris的摩尔浓度是在10和45mm的范围内。在另一个实施方式中,tris的摩尔浓度是在15和40mm的范围内。在另一个实施方式中,tris的摩尔浓度是在20和35mm的范围内。在另一个实施方式中,tris的摩尔浓度是在20和30mm的范围内。在另一个实施方式中,tris的摩尔浓度是在20和25mm的范围内。在一个特别的实施方式中,tris的摩尔浓度为20mm。在某些实施方式中,1000ml的制剂体积包含2至3g的tris。在有些实施方式中,1000ml的制剂体积包含2.1、2.2.、2.3.、2.4、2.5、2.6、2.7、2.8、2.9或3.0g的tris。在有些实施方式中,1000ml的制剂体积包含2.1g的tris。在有些实施方式中,1000ml的制剂体积包含2.2g的tris。在有些实施方式中,1000ml的制剂体积包含2.3g的tris。在有些实施方式中,1000ml的制剂体积包含2.4g的tris。在有些实施方式中,1000ml的制剂体积包含2.5g的tris。在有些实施方式中,1000ml的制剂体积包含2.6g的tris。在有些实施方式中,1000ml的制剂体积包含2.7g的tris。在有些实施方式中,1000ml的制剂体积包含2.8g的tris。在有些实施方式中,1000ml的制剂体积包含2.9g的tris。在有些实施方式中,1000ml的制剂体积包含3.0g的tris。在有些实施方式中,1000ml的制剂体积包含2.4至2.5g的tris。
[0270]
在一个实施方式中,可用于本文提供的药物组合物中的海藻糖二水合物的浓度是在介于1%和20%(w/v)之间的范围内。在另一个实施方式中,海藻糖二水合物的浓度是在2%和15%(w/v)的范围内。在一个实施方式中,海藻糖二水合物的浓度是在3%和10%(w/v)的范围内。在另一个实施方式中,海藻糖二水合物的浓度是在4%和9.5%(w/v)的范围内。在一个实施方式中,海藻糖二水合物的浓度是在5%和9.25%(w/v)的范围内。在另一个实施方式中,海藻糖二水合物的浓度是在6%和9%(w/v)的范围内。在一个实施方式中,海藻糖二水合物的浓度是在7%和8.5%(w/v)的范围内。在另一个实施方式中,海藻糖二水合物的浓度是在8%和8.4%(w/v)的范围内。在一个实施方式中,海藻糖二水合物的浓度是在8.1%和8.3%(w/v)的范围内。在一个特别的实施方式中,海藻糖二水合物的浓度为8.2%。在一个特别的实施方式中,海藻糖二水合物的浓度为8.3%(w/v)。在某些实施方式中,1000ml的制剂体积包含92至93g的海藻糖二水合物。在有些实施方式中,1000ml的制剂体积包含92.0、92.1、92.2、92.3、92.4、92.5、92.6、92.7、92.8、92.9或93.0g的海藻糖二水合物。在有些实施方式中,1000ml的制剂体积包含92.0g的海藻糖二水合物。在有些实施方式中,1000ml的制剂体积包含92.1g的海藻糖二水合物。在有些实施方式中,1000ml的制剂体积包含92.2g的海藻糖二水合物。在有些实施方式中,1000ml的制剂体积包含92.3g的海藻糖二水合物。在有些实施方式中,1000ml的制剂体积包含92.4g的海藻糖二水合物。在有些实施
方式中,1000ml的制剂体积包含92.5g的海藻糖二水合物。在有些实施方式中,1000ml的制剂体积包含92.6g的海藻糖二水合物。在有些实施方式中,1000ml的制剂体积包含92.7g的海藻糖二水合物。在有些实施方式中,1000ml的制剂体积包含92.8g的海藻糖二水合物。在有些实施方式中,1000ml的制剂体积包含92.9g的海藻糖二水合物。在有些实施方式中,1000ml的制剂体积包含93.0g的海藻糖二水合物。在有些实施方式中,1000ml的制剂体积包含92.4至92.5g的海藻糖二水合物。在某些实施方式中,海藻糖脱水物的摩尔浓度为240至300mm。在其他的实施方式中,海藻糖脱水物的摩尔浓度为240至290mm。在有些实施方式中,海藻糖脱水物的摩尔浓度为250至290mm。在其他的实施方式中,海藻糖脱水物的摩尔浓度为260至290mm。在有些实施方式中,海藻糖脱水物的摩尔浓度为270至290mm。在某些实施方式中,海藻糖脱水物的摩尔浓度为244至245mm。在其他的实施方式中,海藻糖脱水物的摩尔浓度为约280mm。
[0271]
在一个实施方式中,可用于本文提供的药物组合物中的盐酸的浓度是在0.01至1%(v/v)的范围内。在另一个实施方式中,盐酸的浓度是在0.025至0.75%(v/v)的范围内。在另一个实施方式中,盐酸的浓度是在0.05至0.5%(v/v)的范围内。在另一个实施方式中,盐酸的浓度是在0.075至0.25%(v/v)的范围内。在一个特别的实施方式中,盐酸的浓度为0.1%(v/v)。在某些实施方式中,1000ml的制剂体积包含0.8至1.1ml的盐酸。在一个具体的实施方式中,1000ml的制剂体积包含0.9至1.0ml的盐酸。在某些实施方式中,1000ml的制剂体积包含0.90、0.91、0.92、0.93、0.94、0.95、0.96、0.97、0.98、0.99或1.00ml的盐酸。在某些实施方式中,1000ml的制剂体积包含0.90ml的盐酸。在某些实施方式中,1000ml的制剂体积包含0.91ml的盐酸。在某些实施方式中,1000ml的制剂体积包含0.92ml的盐酸。在某些实施方式中,1000ml的制剂体积包含0.93ml的盐酸。在某些实施方式中,1000ml的制剂体积包含0.94ml的盐酸。在某些实施方式中,1000ml的制剂体积包含0.95ml的盐酸。在某些实施方式中,1000ml的制剂体积包含0.96ml的盐酸。在某些实施方式中,1000ml的制剂体积包含0.97ml的盐酸。在某些实施方式中,1000ml的制剂体积包含0.98ml的盐酸。在某些实施方式中,1000ml的制剂体积包含0.99ml的盐酸。在某些实施方式中,1000ml的制剂体积包含1.00ml的盐酸。
[0272]
在一个实施方式中,可用于本文提供的药物组合物中的tween-20的浓度是在0.001至0.1%(v/v)的范围内。在另一个实施方式中,tween-20的浓度是在0.0025至0.075%(v/v)的范围内。在一个实施方式中,tween-20的浓度是在0.005至0.05%(v/v)的范围内。在另一个实施方式中,tween-20的浓度是在0.0075至0.025%(v/v)的范围内。在一个特别的实施方式中,tween-20的浓度为0.01%(v/v)。在某些实施方式中,1000ml的制剂体积包含0.1ml tween-20。
[0273]
在一个实施方式中,可用于本文提供的药物组合物中的磷酸钾的摩尔浓度是在介于5和50mm之间的范围内。在一个实施方式中,磷酸钾的摩尔浓度是在10和40mm的范围内。在另一个实施方式中,磷酸钾的摩尔浓度是在10和35mm的范围内。在一个实施方式中,磷酸钾的摩尔浓度是在10和30mm的范围内。在另一个实施方式中,磷酸钾的摩尔浓度是在10和25mm的范围内。在一个实施方式中,磷酸钾的摩尔浓度是在10和20mm的范围内。在一个特别的实施方式中,磷酸钾的摩尔浓度为10mm。在一个特别的实施方式中,磷酸钾的摩尔浓度为20mm。
[0274]
在具体的实施方式中,所述药物组合物不包含磷酸钾。
[0275]
在一个实施方式中,可用于本文提供的药物组合物中的氯化钠的摩尔浓度是在介于50和250mm之间的范围内。在另一个实施方式中,氯化钠的摩尔浓度是在75和225mm的范围内。在一个实施方式中,氯化钠的摩尔浓度是在100和200mm的范围内。在另一个实施方式中,氯化钠的摩尔浓度是在125和175mm的范围内。在一个实施方式中,氯化钠的摩尔浓度是在130和160mm的范围内。在另一个实施方式中,磷酸钾的摩尔浓度是在140和150mm的范围内。在一个特别的实施方式中,氯化钠的摩尔浓度为125mm。在一个特别的实施方式中,氯化钠的摩尔浓度为140mm。在一个特别的实施方式中,氯化钠的摩尔浓度为150mm。
[0276]
在具体的实施方式中,所述药物组合物不包含盐。在其他具体的实施方式中,所述药物组合物不包含氯化钠。
[0277]
在一个实施方式中,所述药物组合物的ph是在6.5和9.5的范围内。在另一个实施方式中,所述药物组合物的ph是在6.8和9.3的范围内。在一个实施方式中,所述药物组合物的ph是在7.0和9.0的范围内。在另一个实施方式中,所述药物组合物的ph是在7.3和8.7的范围内。在一个实施方式中,所述药物组合物的ph在7.5和8.5的范围内。在另一个实施方式中,所述药物组合物的ph是在7.7和8.2的范围内。在一个特别的实施方式中,所述药物组合物的ph为7.3。在一个特别的实施方式中,所述药物组合物的ph为7.5。在一个特别的实施方式中,所述药物组合物的ph为8.0。在一个特别的实施方式中,所述药物组合物的ph为8.5。在4℃的温度下,取该ph的测量值。
[0278]
在一个实施方式中,本文提供的药物组合物包含20mm tris(例如,2.423g,在1000ml溶液中)。在另一个实施方式中,本文提供的药物组合物包含8.2%(w/v)海藻糖二水合物(例如,92.55g,在1000ml溶液中)。在另一个实施方式中,本文提供的药物组合物包含0.01%(v/v)tween-20(例如,0.1ml,在1000ml溶液中)。在还有另一个实施方式中,本文提供的药物组合物包含盐酸n.f.(例如,0.94ml,在1000ml溶液中),并且,在某些实施方式中,还包含水wfi质量(加至999ml)。上述组分的二、三、四、五种或所有六种的任何组合也予以考虑。在有些实施方式中,本文提供的药物组合物的ph为7.7至8.2,诸如超过7.7、超过7.8、超过7.9、超过8.0或超过8.1,当在25℃下测量时。在有些实施方式中,本文提供的药物组合物的ph超过7.7,当在25℃下测量时。在有些实施方式中,本文提供的药物组合物的ph超过7.8,当在25℃下测量时。在有些实施方式中,本文提供的药物组合物的ph超过7.9,当在25℃下测量时。在有些实施方式中,本文提供的药物组合物的ph超过8.0,当在25℃下测量时。在有些实施方式中,本文提供的药物组合物的ph超过8.1,当在25℃下测量时。在一个实施方式中,本文提供的药物组合物的ph为7.9至8.1,例如,当在25℃下测量时。在某些实施方式中,本文提供的药物组合物的ph为8.0,例如,当在25℃下测量时。在有些实施方式中,本文提供的药物组合物的ph为8.5,例如,当在4℃下测量时。
[0279]
因此,在一个实施方式中,所述药物组合物包含磷酸钾、氯化钠、氨丁三醇(tris)、海藻糖二水合物、tween-20、盐酸、水或其任何组合。在一个具体的实施方式中,所述药物组合物包含磷酸钾、氯化钠、氨丁三醇(tris)、海藻糖二水合物、tween-20、盐酸和水。
[0280]
在一个具体的实施方式中,本文提供的药物组合物包含20mm tris(2.423g,在1000ml溶液中)、8.2%(w/v)海藻糖二水合物(92.55g,在1000ml溶液中)、0.01%(v/v)tween-20(0.1ml,在1000ml溶液中)、盐酸、n.f.(0.94ml,在1000ml溶液中)和水wfi质量(加
至999ml),并且ph为8.5(在4℃下测量时)。
[0281]
在具体的实施方式中,本文提供的药物组合物不包含盐。在某些实施方式中,本文提供的药物包含糖,诸如海藻糖。在具体的实施方式中,本文提供的药物组合物包含糖,但是不包含盐。在有些实施方式中,本文提供的药物组合物的ph为7.7至8.2,当在25℃下测量时。
[0282]
在有些实施方式中,所述药物组合物的重量摩尔渗透压浓度(osmolality)为250至350osmol/l。在有些实施方式中,所述药物组合物的重量摩尔渗透压浓度为275至325osmol/l。在有些实施方式中,所述药物组合物的重量摩尔渗透压浓度为295至305osmol/l。在有些实施方式中,所述药物组合物的重量摩尔渗透压浓度为295osmol/l。在有些实施方式中,所述药物组合物的重量摩尔渗透压浓度为296osmol/l。在有些实施方式中,所述药物组合物的重量摩尔渗透压浓度为297osmol/l。在有些实施方式中,所述药物组合物的重量摩尔渗透压浓度为298osmol/l。在有些实施方式中,所述药物组合物的重量摩尔渗透压浓度为299osmol/l。在有些实施方式中,所述药物组合物的重量摩尔渗透压浓度为300osmol/l。在有些实施方式中,所述药物组合物的重量摩尔渗透压浓度为301osmol/l。在有些实施方式中,所述药物组合物的重量摩尔渗透压浓度为302osmol/l。在有些实施方式中,所述药物组合物的重量摩尔渗透压浓度为303osmol/l。在有些实施方式中,所述药物组合物的重量摩尔渗透压浓度为304osmol/l。在有些实施方式中,所述药物组合物的重量摩尔渗透压浓度为305osmol/l。
[0283]
虽然提供了某些数值(和其数值范围),但是应当理解,在某些实施方式中,在例如所述数值(或数值范围)的2%、5%、10%、15%或20%以内的数值也予以考虑。其他示例性的药物组合物在下面的实验部分中提供。
[0284]
溶媒中的主要溶剂可以是性质上为水性或非水性的。另外,溶媒可以含有其他药学上可接受的赋形剂用于改变或维持药物组合物的ph、渗透压、粘度、无菌性(sterility)或稳定性。在某些实施方式中,药学上可接受的溶媒是水性缓冲剂。在其他的实施方式中,溶媒包含例如氯化钠和/或柠檬酸钠。
[0285]
本文提供的药物组合物可以含有仍然其他药学上可接受的配方剂用于改变或维持肽和/或另外药剂的释放速率,如本文所描述。这样的配方剂包括技术人员已知的制备缓释制剂中的那些物质。对于涉及药学上和生理学上可接受的配方剂的进一步参考文献,参见例如,remington’s pharmaceutical sciences,第18版(1990,mack publishing co.,easton,pa.18042)第1435-1712页,the merck index,第12版(1996,merck publishing group,whitehouse,nj);和pharmaceutical principles of solid dosage forms(1993,technonic publishing co.,inc.,lancaster,pa.)。适合给药的另外的药物组合物是本领域已知的并且适用于本文提供的方法和组合物。
[0286]
药物组合物可以作为溶液剂、混悬剂、凝胶剂、乳液剂、固体制剂或脱水或冻干的粉针剂贮存于无菌小瓶中。这样的组合物可以以即用形式、冻干形式(临用前需要复原)、液体形式(临用前需要稀释)或其他可接受的形式贮存。在有些实施方式中,药物组合物在单次使用容器(例如,单次使用小瓶、安瓿、注射器或自我注射器(类似于例如))中提供,而多次使用容器(例如,多次使用小瓶)在其他的实施方式中提供。任何药物递送器可以用于递送本文描述的肽和其他药剂,包括植入物(例如,可植入泵)和导管系统,它们两者都
是技术人员已知的。贮库注射剂(depot injections)(一般经皮下或肌内给予)也可以用于在一段规定的时间周期内释放本文描述的肽和/或其他药剂。贮库注射剂通常是固体基的或油基的并且一般包含本文所阐述的制剂组分中的至少一种。技术人员熟悉贮库注射剂的可能配方和用途。在某些实施方式中,考虑了nano precision medical的贮库递送技术(nano precision medical’s depot delivery technology)(nano precision medical;emeryville,ca)的应用。该技术采用了二氧化钛纳米管膜(titania nanotube membrane),该膜产生大分子(如蛋白质和肽治疗剂)的零级释放速率。生物相容性膜置于小的皮下植入物中,该植入物提供治疗大分子的长期(例如,长达1年)、恒定速率递送。该技术目前正在对例如递送glp-1激动剂用于治疗ii型糖尿病进行评价。
[0287]
药物组合物可配制成与其期望的给药途径相容。因此,药物组合物包括适合于经由包括以下的途径给药的载体、稀释剂或赋形剂:胃肠外(例如,皮下(s.c.)、静脉内、肌内或腹膜内)、真皮内、口服(例如,吞服)、吸入、腔内、颅内和经皮(局部)。其他示例性的给药途径如本文所述。
[0288]
药物组合物可以呈无菌的注射用水性或油性混悬剂的形式。这种混悬剂可以使用本文公开的或技术人员已知的合适分散剂或润湿剂和悬浮剂进行配制。无菌的注射制剂也可是在无毒的胃肠外可接受的稀释剂或溶剂中的无菌的注射用溶液剂或混悬剂,例如,作为1,3-丁二醇中的溶液剂。可以使用的可接受的稀释剂、溶剂和分散介质包括水、林格氏液(ringer’s solution)、等渗氯化钠溶液、cremophor el
tm
(basf,parsippany,nj)或磷酸盐缓冲的盐水(pbs)、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇),及其合适的混合物。另外,无菌的固定油(fixed oils)按照惯例用作溶剂或悬浮介质。为此目的,可以使用任何温和的固定油,包括合成的甘油单酯或甘油二酯。此外,脂肪酸(油酸)可用于注射剂的制备。特定注射制剂的延长吸收可以通过包括延长吸收的试剂(例如,单硬脂酸铝或明胶)来实现。
[0289]
在一个实施方式中,本文提供的药物组合物可以通过注射、输注或植入经胃肠外给予,用于局部或系统给药。如本文使用的胃肠外给药包括静脉内、动脉内、腹膜内、鞘内、心室内、尿道内、胸骨内、颅内、肌内、滑膜腔内和皮下给药。
[0290]
在一个实施方式中,本文提供的药物组合物可配制在适合胃肠外给药的任何剂型包括溶液剂、混悬剂、乳液剂、胶束、脂质体、微球体、纳米体系和固体形式(对于注射前液体中的溶液剂或混悬剂是适合的)中。这样的剂型可以按照药剂科学领域技术人员已知的常规方法来制备(参见例如,remington,the science and practice of pharmacy,参见上文)。
[0291]
在一个实施方式中,旨在用于胃肠外给药的药物组合物可以包括一种或多种药学上可接受的载体和赋形剂,包括但不限于水性溶媒、水混溶性溶媒、非水性溶媒、抵抗微生物生长的抗微生物剂或防腐剂、稳定剂、溶解度增强剂、等渗剂、缓冲剂、抗氧化剂、局部麻醉剂、悬浮和分散剂、润湿或乳化剂、络合剂、螯合剂(sequestering or chelating agents)、冷冻保护剂、冻干保护剂、增稠剂、ph调节剂和惰性气体。
[0292]
在一个实施方式中,合适的水性溶媒包括但不限于水、盐水、生理盐水或磷酸盐缓冲的盐水(pbs)、氯化钠注射液、林格氏注射液、等渗右旋糖注射液、无菌水注射液、右旋糖和乳酸盐林格氏注射液。非水性溶媒包括但不限于植物来源的固定油、蓖麻油、玉米油、棉
籽油、橄榄油、花生油、薄荷油、红花油、芝麻油、大豆油、氢化植物油、氢化大豆油和椰子油的中链甘油三酯和棕榈仁油。水混溶性溶媒包括但不限于乙醇、1,3-丁二醇、液体聚乙二醇(例如,聚乙二醇300和聚乙二醇400)、丙二醇、甘油、n-甲基-2-吡咯烷酮、n,n-二甲基乙酰胺和二甲亚砜。
[0293]
在一个实施方式中,合适的抗微生物剂或防腐剂包括但不限于苯酚、甲酚、汞制剂(mercurials)、苯甲醇、氯丁醇、对羟基苯甲酸甲酯和丙酯、硫柳汞、苯扎氯铵(例如,苄索氯铵)、对羟苯甲酸甲酯和丙酯、和山梨酸。合适的等渗剂包括但不限于氯化钠、甘油和右旋糖。合适的缓冲剂包括但不限于磷酸盐和柠檬酸盐。合适的抗氧化剂是如本文描述的那些,包括亚硫酸氢盐和偏亚硫酸氢钠。合适的局部麻醉剂包括但不限于盐酸普鲁卡因。合适的悬浮和分散剂如本文描述的那些,包括羧甲基纤维素钠、羟丙基甲基纤维素和聚乙烯吡咯烷酮。合适的乳化剂包括本文描述的那些,包括聚氧乙烯脱水山梨糖醇单月桂酸酯、聚氧乙烯脱水山梨糖醇单油酸酯80和三乙醇胺油酸酯。合适的螯合剂(sequestering or chelating agents)包括但不限于edta。合适的ph调节剂包括但不限于氢氧化钠、盐酸、柠檬酸和乳酸。合适的络合剂包括但不限于环糊精,包括α-环糊精、β-环糊精、羟丙基-β-环糊精、磺基丁基醚-β-环糊精和磺基丁基醚7-β-环糊精(cydex,lenexa,ks)。
[0294]
在一个实施方式中,本文提供的药物组合物可配制成用于单剂量或多剂量给药。单剂量制剂包装在安瓿、小瓶或注射器中。多剂量胃肠外制剂可以含有抑制细菌或抑制真菌浓度的抗微生物剂。所有胃肠外制剂必须是无菌的,这是本领域和实践的。
[0295]
在一个实施方式中,所述药物组合物作为即用型无菌溶液剂提供。在另一个实施方式中,所述药物组合物作为无菌干燥的可溶性制品提供,包括冻干粉针剂和皮下注射用片剂,以在临用前用溶媒复原。在还有另一个实施方式中,所述药物组合物作为即用型无菌混悬剂提供。在还有另一个实施方式中,所述药物组合物作为无菌干燥的不溶性制品提供,以在临用前用溶媒复原。在再另一个实施方式中,所述药物组合物作为即用型无菌乳液剂提供。
[0296]
在一个实施方式中,本文提供的药物组合物可配制成速释或缓释释放剂型,包括延迟的-、持续的、脉冲的-、控制的、靶向的-和程序化的-释放形式。
[0297]
在一个实施方式中,所述药物组合物可配制成混悬剂,固体、半固体或触变性液体,充当植入贮库制剂进行给药。在一个实施方式中,本文提供的药物组合物是分散在固体内层骨架中,该骨架被外层聚合物膜包裹住,该聚合物膜在体液中不溶解但允许药物组合物中的活性成分扩散开。
[0298]
在一个实施方式中,合适的内层骨架包括聚甲基丙烯酸甲酯、聚甲基丙烯酸丁酯、增塑的或未增塑的聚氯乙烯、增塑的尼龙、增塑的聚对苯二甲酸乙二酯、天然橡胶、聚异戊二烯、聚异丁烯、聚丁二烯、聚乙烯、乙烯-乙酸乙烯酯共聚物、硅橡胶、聚二甲基硅氧烷、硅酮碳酸酯共聚物、亲水性聚合物,例如丙烯酸酯和甲基丙烯酸酯的水凝胶、胶原、交联聚乙烯醇和交联的部分水解的聚乙酸乙烯酯.
[0299]
在一个实施方式中,合适的外层聚合物膜包括聚乙烯、聚丙烯、乙烯/丙烯共聚物、乙烯/丙烯酸乙酯共聚物、乙烯/乙酸乙烯酯共聚物、硅橡胶、聚二甲基硅氧烷、氯丁二烯橡胶、氯化聚乙烯、聚氯乙烯、氯乙烯与乙酸乙烯酯共聚物、偏氯乙烯、乙烯和丙烯、离聚物聚对苯二甲酸乙二酯(ionomer polyethylene terephthalate)、丁基橡胶环氧氯丙烷橡胶
类、乙烯/乙烯醇共聚物、乙烯/乙烯氧基乙醇共聚物和乙烯/乙酸乙烯酯/乙烯醇三元共聚物。
[0300]
药物组合物可以呈适合口服使用的形式,例如片剂、胶囊剂、口含片(troch)、锭剂(lozenge)、水性或油性混悬剂、可分散粉剂或颗粒剂(dispersible powders or granules)、乳液剂、硬或软胶囊剂、或糖浆剂、溶液剂、微珠(microbeads)或酏剂。旨在供口服使用的药物组合物可以按照药物组合物制造领域已知的任何方法来制备。这样的组合物可以含有一种或多种试剂,例如甜味剂、调味剂、着色剂和防腐剂,以便提供药学上优美和可口的制剂。含有本文提供的肽的片剂可以与适合片剂制造的无毒的药学上可接受的赋形剂相混合。这些赋形剂包括例如稀释剂,例如碳酸钙、碳酸钠、乳糖、磷酸钙或磷酸钠;造粒剂和崩解剂,例如玉米淀粉或海藻酸;粘合剂,例如淀粉、明胶或阿拉伯树胶;和润滑剂,例如硬脂酸镁、硬脂酸或滑石粉。
[0301]
适合口服给药的片剂、胶囊剂等可以是未包衣的或它们可以通过已知的技术进行包衣以延迟在胃肠道内的崩解和吸收,从而在一段较长的时期内提供持续的作用。例如,可以使用时间延迟材料,例如单硬脂酸甘油酯或二硬脂酸甘油酯。它们也可以通过本领域已知的技术进行包衣以形成用于控制释放的渗透性治疗片剂。另外的试剂包括生物可降解的或生物相容的颗粒或高分子物质,例如聚酯类、聚胺酸类、水凝胶、聚乙烯基吡咯烷酮、聚酐类、聚羟基乙酸、乙烯-乙酸乙烯酯、甲基纤维素、羧甲基纤维素、硫酸鱼精蛋白、或丙交酯/乙交酯共聚物、聚丙交酯/乙交酯共聚物、或乙烯乙酸乙烯酯共聚物,以便控制所给予的组合物的递送。例如,口服制剂可以包封在使用羟甲基纤维素或明胶-微胶囊或聚(甲基丙烯酸甲酯)微胶囊,分别通过凝聚技术或通过界面聚合制备的微胶囊中,或者包封在胶体药物递送系统中。胶体分散体系包括大分子络合物、纳米胶囊、微球体、微珠和脂质基体系(包括水包油乳液)、胶束、混合胶束和脂质体。脂质体的制备方法描述于例如美国专利号4,235,871、4,501,728和4,837,028。上述制剂的制备方法对于本领域技术人员来说将是显而易见的。
[0302]
供口服使用的制剂也可以作为硬明胶胶囊剂存在,其中活性成分与惰性固体稀释剂(例如,碳酸钙、磷酸钙、高岭土或微晶纤维素)混合;或者作为软明胶胶囊剂存在,其中活性成分与水或油介质(例如,花生油、液体石蜡或橄榄油)混合。
[0303]
水性混悬剂含有活性材料以及与其混合的适合制造的赋形剂。这样的赋形剂是悬浮剂,例如羧甲基纤维素钠、甲基纤维素、羟基-丙基甲基纤维素、海藻酸钠、聚乙烯基-吡咯烷酮、西黄蓍胶和阿拉伯树胶;分散剂或润湿剂可以是天然存在的磷脂(例如卵磷脂)、或环氧烷与脂肪酸的缩合产物(例如聚氧乙烯-硬脂酸酯)、或环氧乙烷与长链脂肪族醇的缩合产物(例如十七碳乙烯氧基十六烷醇(heptadecaethyleneoxycetanol))、或环氧乙烷与衍生自脂肪酸和己糖醇的偏酯的缩合产物(诸如聚氧乙烯山梨糖醇单油酸酯)、或环氧乙烷与衍生自脂肪酸和己糖醇酐的偏酯的缩合产物(例如聚乙烯脱水山梨糖醇单油酸酯)。水性混悬剂也可以含有一种或多种防腐剂。
[0304]
油性混悬剂可以通过将活性成分悬浮在植物油(例如花生油、橄榄油、芝麻油或椰子油)中或在矿物油(例如液体石蜡)中来配制。油性混悬剂可以含有增稠剂,例如蜂蜡、硬石蜡或鲸蜡醇。也可添加甜味剂(例如如上文所述的那些)和调味剂以提供可口的口服制剂。
[0305]
适于通过加水制备水性混悬剂的分散性粉剂和颗粒剂提供活性成分及与其混合的分散剂或润湿剂、悬浮剂和一种或多种防腐剂。合适的分散剂或润湿剂和悬浮剂在本文中有举例说明。
[0306]
本文提供的药物组合物也可以呈水包油乳液的形式。油相可以是植物油(例如,橄榄油或花生油)或矿物油(例如,液体石蜡)或其混合物。合适的乳化剂可以是天然存在的树胶,例如阿拉伯树胶或西黄蓍胶;天然存在的磷脂,例如大豆、卵磷脂和衍生自脂肪酸的酯或偏酯;己糖醇酐,例如脱水山梨糖醇单油酸酯;和偏酯与环氧乙烷的缩合产物,例如聚氧乙烯脱水山梨糖醇单油酸酯。
[0307]
药物组合物也可以包括载体以保护组合物免于在身体内被快速降解或消除,例如控释制剂,包括植入物、脂质体、水凝胶、前药和微胶囊化递送系统。例如,时间延迟材料(例如单硬脂酸甘油酯或硬脂酸甘油酯)可以单独使用或者与蜡混合使用。注射用药物组合物的延长吸收可以通过包括延迟吸收的试剂(例如,单硬脂酸铝或明胶)来实现。防止微生物的作用可以通过各种各样的抗细菌剂和抗真菌剂(例如,尼泊金酯(parabens)、氯丁醇、苯酚、抗坏血酸、硫柳汞(thimerosal)等)来实现。
[0308]
本文还提供的是用于直肠给药的呈栓剂形式的本文描述的肽和/或一种或多种另外的试剂。栓剂可以通过将本文描述的肽和/或一种或多种另外的试剂与合适的非刺激性赋形剂混合来制备,其在常温下是固体但在直肠温度下是液体,因此将在直肠内融化以释放药物。这样的材料包括但不限于可可脂和聚乙二醇。
[0309]
5.3肽
[0310]
在某些实施方式中,本文提供的药物组合物、制剂和剂型包含一种或多种本文提供的肽或肽序列。在某些实施方式中,本文提供的药物组合物、制剂和剂型包含fgf19肽序列的一种或多种变异体、fgf19和/或fgf21肽序列的融合体和fgf19和/或fgf21肽序列的融合体(嵌合体)的变异体,其具有与胆汁酸有关或相关紊乱(例如,pbc)、代谢紊乱或癌症或肿瘤的治疗和/或预防相关的一种或多种活性。在某些实施方式中,所述活性是葡萄糖降低活性。这样的fgf19和/或fgf21肽序列的变异体和融合体(嵌合体)包括不是实质性地增加或诱发hcc形成或hcc肿瘤发生和/或不诱发血脂分布明显升高或增加的序列。
[0311]
在一个实施方式中,嵌合肽序列包括以下n-末端区和c-末端区或由其组成:具有至少七个氨基酸残基的n-末端区和具有第一氨基酸位置和最后氨基酸位置的n-末端区,其中所述n-末端区具有dsspl(seq id no:121)或dasph(seq id no:122)序列;和具有fgf19的一部分的c-末端区和具有第一氨基酸位置和最后氨基酸位置的c-末端区,其中所述c-末端区包括fgf19的氨基酸残基16-29(wgdpirlrhlytsg;seq id no:169)和所述w残基对应于所述c-末端区的第一氨基酸位置。在特别的实施方式中,所述变异体是m70:
[0312]
mrdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletds16mdpfglvtgleavrspsfek(seq id no:70)。在特别的实施方式中,所述变异体是m69:
[0313]
rdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m69)(seq id no:69)。
5)氨基酸序列的取代是用arg(r)取代leu(l)和用pro(p)取代glu(e)。在具体的实施方式中,在fgf19的环-8区中的上述取代(含多个取代)是在本文提供的变异体肽中在其相应的fgf19序列中。也就是说,在本文提供的肽变异体的相应的fgf19序列(例如,eirpd、irp或rp)里面的所述取代也给予了考虑。
[0317]
在有些实施方式中,所述环-8修饰的变异体是m70:
[0318]
mrdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletds16mdpfglvtgleavrspsfek(seq id no:70),包含fgf19环-8区中的取代(下画线)。在某些实施方式中,所述环-8修饰的m70变异体包含fgf19环-8区中的取代(下画线),其对应于(i)r127l取代,(ii)p128e取代,或(iii)r127l取代和p128e取代(seq.id no:204)。在某些实施方式中,所述环-8修饰的m70变异体进一步包含或进一步包含fgf19核心区域中的取代。在有些实施方式中,所述环-8修饰的m70变异体包含l18q取代。
[0319]
在有些实施方式中,所述环-8修饰的变异体是m69:
[0320]
rdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m69)(seq id no:69),包含fgf19环-8区中的取代(下画线)。在某些实施方式中,所述环-8修饰的m69变异体包含fgf19环-8区中的取代(下画线),其对应于(i)r100l取代,(ii)p101e取代,或(iii)r100l取代和p101e取代。在某些实施方式中,所述环-8修饰的m69变异体进一步包含或进一步包含fgf19核心区域中的取代。在有些实施方式中,所述环-8修饰的m69变异体包含l17q取代。
[0321]
在有些实施方式中,所述环-8修饰的变异体包含fgf19环-8区中的取代,其对应于seq id no:3的氨基酸127-129。在某些实施方式中,所述环-8修饰的变异体包含fgf19环-8区中的取代,其对应于(i)r127l取代,(ii)p128e取代,或(iii)r127l取代和p128e取代。在有些实施方式中,所述fgf19变异体包含或进一步包含核心区域中的取代,其对应于seq id no:3的氨基酸21-29。在某些实施方式中,所述fgf19变异体包含或进一步包含核心区域中的取代,其对应于l22q取代。
[0322]
在进一步的实施方式中,肽序列包括与参比或野生型fgf19相比,具有一个或多个氨基酸取代、插入或缺失的fgf19变异体;或由其组成。在另外的实施方式中,肽序列包括与参比或野生型fgf21相比,具有一个或多个氨基酸取代、插入或缺失的fgf21序列变异体;或由其组成。在还有另外的实施方式中,肽序列包括与fgf21序列的一部分融合的fgf19序列的一部分,或由其组成。在仍然另外的实施方式中,肽序列包括与fgf21序列的一部分融合的fgf19序列的一部分,或由其组成,其中所述fgf19和/或fgf21序列部分与参比或野生型fgf19和/或fgf21相比,具有一个或多个氨基酸取代、插入或缺失。这样的序列的实例公开于pct公开号wo 2013/006486和美国专利公布号2013/0023474,以及于2014年6月5日公布的pct公开号wo 2014/085365。表1和序列表也列出了可用于本文提供的方法中的代表性序列。
[0323]
在有些实施方式中,本文提供的治疗肽包括fgf19和/或fgf21肽序列的变异体和融合体。在一个实施方式中,所述治疗肽包括一种或多种变异或融合fgf19和/或fgf21肽。在其他的实施方式中,本文提供的方法包括将编码fgf19和/或fgf21肽序列的变异体或融
合体的一种或多种核酸分子(例如,与编码所述肽序列的核酸以可操作性连接的表达控制元件,任选地包括载体)以对治疗胆汁酸有关或相关紊乱有效的量接触或给予对象。
[0324]
一个代表性的参比或野生型fgf19序列如下所述:
[0325]
rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:99).
[0326]
一个代表性的参比或野生型fgf21序列如下所述:
[0327]
hpipdsspllqfggqvrqrylytddaqqteahleiredgtvggaadqspesllqlkalkpgviqilgvktsrflcqrpdgalygslhfdpeacsfrellledgynvyqseahglplhlpgnksphrdpaprgparflplpglppalpeppgilapqppdvgssdplsmvgpsqgrspsyas(seq id no:100)。fgf21等位基因变异体包括例如m70、m71和m72。
[0328]
术语“肽”、“蛋白质”和“多肽”序列在本文中可互换使用,是指通过酰胺键或等价物共价连接的两个或两个以上氨基酸或“残基”,包括氨基酸的化学修饰和衍生物。构成肽的全部或一部分的氨基酸可以来自已知的21种天然存在的氨基酸,这21种天然存在的氨基酸用它们的单字母缩写或常用的三字母缩写来表示。在本文提供的肽序列中,常规氨基酸残基具有它们的常规含义。因此,“leu”是亮氨酸,“ile”是异亮氨酸,“nle”是正亮氨酸,以此类推。
[0329]
在各种特别的方面,本文提供的肽或嵌合序列具有在n-末端区的第一氨基酸位置的“m”残基、“r”残基、“s”残基、“h”残基、“p”残基、“l”残基或“d”残基。在各种备选的特别的方面,肽或嵌合序列肽序列不具有在所述n-末端区的第一氨基酸位置的“m”残基或“r”残基。
[0330]
本文还提供的是所例示的肽序列的子序列、变异体和修饰形式(包括在序列表或表1中列出的fgf19和fgf21变异体和子序列),只要它们至少保留可检测或可测量的活性或功能。另外,某些所例示的变异体肽(例如,在氨基-末端具有fgf21序列的全部或一部分的那些)具有位于n-末端的“r”残基,该“r”残基可以省略。类似地,某些所例示的变异体肽包括位于n-末端的“m”残基,该“m”残基可以附加至或进一步取代省略的残基(如“r”残基)。更特别地,在各种实施方式中,位于n-末端的肽序列包括rdss(seq id no:115)、dss、mdss(seq id no:116)或mrdss(seq id no:117)中的任一个。此外,当“m”残基毗邻“s”残基时,“m”残基可以被裂解使得该“m”残基从肽序列缺失,而当“m”残基毗邻“d”残基时,“m”残基可以不被裂解。因此,作为实例,在各种实施方式中,肽序列包括具有位于n-末端的以下残基的那些:mdsspl(seq id no:119)、msdsspl(seq id no:120)(裂解为sdsspl(seq id no:112))和msspl(seq id no:113)(裂解为sspl(seq id no:114))。
[0331]
在本文中所例示的是肽序列,其区别于本文所阐述的参比fgf19和fgf21多肽,并且在体内调节胆汁酸体内稳态、高血糖症、胰岛素抵抗、高胰岛素血症、葡萄糖不耐症、代谢综合征或相关紊乱(例如,表1和序列表)。非限制性特别的实例是具有fgf21的氨基-末端氨基酸1-16与fgf19的羧基-末端氨基酸21-194融合的肽序列;具有fgf19的氨基-末端氨基酸1-147与fgf21的羧基-末端氨基酸147-181融合的肽序列;具有fgf19的氨基-末端氨基酸1-20与fgf21的羧基-末端氨基酸17-181融合的肽序列;具有fgf21的氨基-末端氨基酸1-146与fgf19的羧基-末端氨基酸148-194融合的肽序列;和具有fgf19的氨基-末端氨基酸1-20
与fgf21的内部氨基酸17-146融合的然后与fgf19羧基-末端氨基酸148-194融合的肽序列。
[0332]
另外的特别的肽序列具有wgdpi(seq id no:170)序列基序,其对应于fgf19(seq id no:99)的氨基酸16-20的wgdpi序列;缺乏wgdpi(seq id no:170)序列基序,其对应于fgf19(seq id no:99)的氨基酸16-20的wgdpi序列;或具有取代的(即,突变的)wgdpi(seq id no:170)序列基序,其对应于fgf19(seq id no:99)的氨基酸16-20的fgf19 wgdpi序列。
[0333]
本文提供的特别的肽序列也包括区别于fgf19和fgf21的序列(例如,如本文所述)和fgf19变异体序列,该fgf 19变异体序列具有在氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代fgf19 wgdpi(seq id no:170)序列。因此,野生型fgf19和fgf21(例如,在本文中分别称之为seq id nos:99和100)可以是被排除的序列,以及具有在fgf19的氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代wgdpi(seq id no:170)序列的fgf19也可以被排除。然而,这种排除不适用于以下情况:序列具有例如与fgf19(具有例如gqv、gqv、gdi或gpi中的任一个)融合的3个fgf21残基,或与wgpi(seq id no:171)、wgdi(seq id no:173)、gdpi(seq id no:174)、wdpi(seq id no:181)、wgdi(seq id no:182)或wgdp(seq id no:183)中的任一个融合的2个fgf21残基。
[0334]
肽序列的特别的非限制性实例包括在本文中体现为m1-m98(分别是seq id no:1-52、192和54-98)的序列变异体的全部或一部分,或由其组成。肽序列的更特别的非限制性实例包括如下所述的序列的全部或一部分或由其组成:
[0335]
hpipdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m5-r)(seq id no:160)(fgf21序列也可以包括位于氨基末端的“r”残基);
[0336]
dsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:138和161);
[0337]
rplafsdasphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m1)(seq id no:1或139);
[0338]
rplafsdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m2)(seq id no:2或140);
[0339]
dssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmv
peepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:141);
[0340]
rdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m69)(seq id no:69);
[0341]
rdsspllqwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m52)(seq id no:52);
[0342]
hpipdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m5-r)(seq id no:160);
[0343]
hpipdsspllqfggqvrqrylytddaqqteahleiredgtvggaadqspesllqlkalkpgviqilgvktsrflcqrpdgalygslhfdpeacsfrellledgynvyqseahslplhlpgnksphrdpaprgparflplpglppalpeppgilapqppdvgssdplsmvgpsqgrspsyas(m71)(seq id no:71);
[0344]
hpipdsspllqfggqvrqrylytddaqqteahleiredgtvggaadqspesllqlkalkpgviqilgvktsrflcqrpdgalygslhfdpeacsfrellledgynvyqseahglplhlpgnksphrdpaprgparflplpglppappeppgilapqppdvgssdplsmvgpsqgrspsyas(m72)(seq id no:72);
[0345]
hpipdsspllqfggqvrqrylytddaqqteahleiredgtvggaadqspesllqlkalkpgviqilgvktsrflcqrpdgalygslhfdpeacsfrellledgynvyqseahglplhlpgnksphrdpaprgparflplpglppalpeppgilapqppdvgssdplsmvvqdelqgvggegchmhpencktlltdidrthtekpvwdgitge(m73)(seq id no:73);
[0346]
rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m3)(seq id no:3);
[0347]
rdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m48)(seq id no:48,6或148);
[0348]
rplafsdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m49)(seq id no:49,7或149);
[0349]
rhpipdsspllqfgdqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m50)(seq id no:50);
[0350]
rhpipdsspllqfggnvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m51)(seq id no:51、36或155);
[0351]
mdsspllqwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m53)(seq id no:192);
[0352]
mrdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikg
vhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m70)(seq id no:70);
[0353]
rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeilpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m139)(seq id no:193);
[0354]
rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiredgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m140)(seq id no:194);
[0355]
rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeilcdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m141)(seq id no:195);或
[0356]
rplafsdagphvhygwgdpirqrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m160)(seq id no:196);
[0357]
或上述肽序列中的任一个的子序列或其片段。在上述肽序列中的任一个的某些实施方式中,所述r末端残基缺失。
[0358]
肽序列的另外的特别的非限制性实例,具有在n-末端处,肽序列包括以下序列的全部或一部分或由其组成:
[0359]
hpipdsspllqfggqvrlrhlytsg(m5-r)(seq id no:160的氨基酸1-25);
[0360]
dsspllqfggqvrlrhlytsg(m6)(m6-r)(seq id no:6的氨基酸2-22);
[0361]
rplafsdsspllqfggqvrlrhlytsg(m7)(seq id no:7的氨基酸1-27);
[0362]
hpipdsspllqwgdpirlrhlytsg(m8-r)(seq id no:8的氨基酸2-26);
[0363]
hpipdsspllqfgwgdpirlrhlytsg(m9-r)(seq id no:9的氨基酸2-28);
[0364]
hpipdssphvhygwgdpirlrhlytsg(m10-r)(seq id no:10的氨基酸2-28);
[0365]
rplafsdagpllqwgdpirlrhlytsg(m11)(seq id no:11的氨基酸1-27);
[0366]
rplafsdagpllqfgwgdpirlrhlytsg(m12)(seq id no:12的氨基酸1-29);
[0367]
rplafsdagpllqfggqvrlrhlytsg(m13)(seq id no:13的氨基酸1-27);
[0368]
hpipdssphvhyggqvrlrhlytsg(m14-r)(seq id no:14的氨基酸2-26);
[0369]
rplafsdagphvhyggqvrlrhlytsg(m15)(seq id no:15的氨基酸1-27);
[0370]
rplafsdagphvhwgdpirlrhlytsg(m16)(seq id no:16的氨基酸1-27);
[0371]
rplafsdagphvgwgdpirlrhlytsg(m17)(seq id no:17的氨基酸1-27);
[0372]
rplafsdagphygwgdpirlrhlytsg(m18)(seq id no:18的氨基酸1-27);
[0373]
rplafsdagpvygwgdpirlrhlytsg(m19)(seq id no:19的氨基酸1-27);
[0374]
rplafsdagpvhgwgdpirlrhlytsg(m20)(seq id no:20的氨基酸1-27);
[0375]
rplafsdagpvhywgdpirlrhlytsg(m21)(seq id no:21的氨基酸1-27);
[0376]
rplafsdagphvhgwgdpirlrhlytsg(m22)(seq id no:22的氨基酸1-27);
[0377]
rplafsdagphhgwgdpirlrhlytsg(m23)(seq id no:23的氨基酸1-27);
[0378]
rplafsdagphhywgdpirlrhlytsg(m24)(seq id no:24的氨基酸1-27);
[0379]
rplafsdagphvywgdpirlrhlytsg(m25)(seq id no:25的氨基酸1-27);
id no:184)中的任一个取代wgdpi(seq id no:170)序列。此外,本文提供的肽序列包括与fgf19或fgf 19变异体序列相比具有更少脂质(例如,甘油三酯、胆固醇、非hdl或hdl)增加活性的那些,该fgf 19变异体序列具有在fgf19的氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代wgdpi(seq id no:170)序列。
[0408]
典型地,本文提供的肽序列中的氨基酸或残基数目总计将少于约250个(例如,氨基酸或其模拟物)。在各种特别的实施方式中,残基数目包含约20直至约200个残基(例如,氨基酸或其模拟物)。在另外的实施方式中,残基数目包含约50直至约200个残基(例如,氨基酸或其模拟物)。在进一步的实施方式中,残基数目包含长度约100直至约195个残基(例如,氨基酸或其模拟物)。
[0409]
氨基酸或残基可以通过酰胺或通过非天然和非酰胺化学键连接,包括例如与戊二醛、n-羟基琥珀酰亚胺酯、双官能马来酰亚胺或n,n
’‑
二环己基碳二亚胺(dcc)形成的那些。非酰胺键包括例如酮基亚甲基、氨基亚甲基、烯烃、醚、硫醚等(参见例如,spatola in chemistry and biochemistry of amino acids,peptides and proteins,第7卷,第267-357页(1983),“peptide and backbone modifications,”marcel decker,ny)。因此,当本文提供的肽包括fgf19序列的一部分和fgf21序列的一部分时,这两个部分都不需要通过酰胺键彼此连接,但是可以通过任何其他化学部分连接或者经由接头部分缀合在一起。
[0410]
在有些实施方式中,本文提供的治疗肽也包括所例示的肽序列的子序列、变异体和修饰形式(包括在表1和序列表中列出的fgf19和fgf21变异体和子序列),只要它们至少保留可检测或可测量的活性或功能。例如,某些所例示的变异体肽在c-末端部分处,例如在所述变异体的“tsg”氨基酸残基之后具有fgf19 c-末端序列,phglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:188)。
[0411]
另外,某些所例示的变异体肽(例如,在氨基-末端具有fgf21序列的全部或一部分的那些)具有位于n-末端的“r”残基,该“r”残基可以省略。类似地,某些所例示的变异体肽包括位于n-末端的“m”残基,该“m”残基可以附加至或进一步取代省略的残基(如“r”残基)。更特别地,在各种实施方式中,在n-末端的肽序列包括rdss(seq id no:115)、dss、mdss(seq id no:116)或mrdss(seq id no:117)中的任一个。此外,在细胞中,当“m”残基毗邻“s”残基时,该“m”残基可以被裂解使得该“m”残基从肽序列缺失,而当“m”残基毗邻“d”残基时,该“m”残基可以不被裂解。因此,作为实例,在各种实施方式中,肽序列包括具有位于n-末端的以下残基的那些:mdsspl(seq id no:119)、msdsspl(seq id no:120)(裂解为sdsspl(seq id no:112))和msspl(seq id no:113)(裂解为sspl(seq id no:114))。
[0412]
因此,在有些实施方式中,本文提供的“肽”、“多肽”和“蛋白质”序列包括在表1和序列表中列出的fgf19和fgf21变异体和子序列的子序列、变异体和修饰形式,以及在表1和序列表中列出的fgf19/fgf21融合体和嵌合体,只要所述子序列、变异体或修饰形式(例如,
融合体或嵌合体)至少保留可检测的活性或功能,例如葡萄糖降低活性和/或调节胆汁酸体内稳态。
[0413]
如本文使用的,术语“修饰”及其语法变体,意指相对于参考组成如肽序列,其组成发生偏离。这样的经修饰的肽序列、核酸和其他组成可具有更大或更小的活性或功能,或者与参考未修饰的肽序列、核酸或其他组成相比具有截然不同的功能或活性,或者在配制用于疗法的蛋白质中可具有理想的特性(例如,血清半寿期),以诱导产生抗体,用于检测测定和/或用于蛋白质纯化。例如,本文提供的肽序列可以经修饰以增加血清半寿期、增加蛋白质的体外和/或体内稳定性等。
[0414]
在本文中所例示的这样的肽序列的子序列、变异体和修饰形式(例如,在序列表或表1中列出的肽序列)的具体实例包括具有在氨基-末端、羧基-末端或内部或者自氨基-末端、羧基-末端或内部的一个或多个氨基酸的取代、缺失和/或插入/添加。一个实例是该肽序列内的一个氨基酸残基取代另一个氨基酸残基。另一个实例是从该肽序列缺失一个或多个氨基酸残基,或一个或多个氨基酸残基插入或添加到该肽序列中。
[0415]
取代的、缺失的或插入的/添加的残基数目是肽序列的一个或多个氨基酸(例如,1-3、3-5、5-10、10-20、20-30、30-40、40-50、50-60、60-70、70-80、80-90、90-100、100-110、110-120、120-130、130-140、140-150、150-160、160-170、170-180、180-190、190-200、200-225、225-250个或更多个)。因此,fgf19或fgf21序列可以具有很少或许多取代的、缺失的或插入的/添加的氨基酸(例如,1-3、3-5、5-10、10-20、20-30、30-40、40-50、50-60、60-70、70-80、80-90、90-100、100-110、110-120、120-130、130-140、140-150、150-160、160-170、170-180、180-190、190-200、200-225、225-250个或更多个)。另外,fgf19氨基酸序列可以包括来自fgf21的约1-3、3-5、5-10、10-20、20-30、30-40、40-50、50-60、60-70、70-80、80-90、90-100、100-110、110-120、120-130、130-140、140-150、150-160、160-170、170-180、180-190、190-200、200-225、225-250个或更多个氨基酸的氨基酸序列,或由其组成;或者fgf21氨基酸或序列可以包括来自fgf19的约1-3、3-5、5-10、10-20、20-30、30-40、40-50、50-60、60-70、70-80、80-90、90-100、100-110、110-120、120-130、130-140、140-150、150-160、160-170、170-180、180-190、190-200、200-225、225-250个或更多个氨基酸的氨基酸序列,或由其组成。
[0416]
取代的具体实例包括用d-残基取代l-残基。因此,虽然残基以l-异构体构型列举出来,但是在本文提供的肽序列任何特定的或所有的位置上的d-氨基酸包括在内,除非d-异构体导致不具有可检测或可测量的功能的序列。
[0417]
另外的具体实例是非保守取代和保守取代。“保守取代”是一个氨基酸被生物学上、化学上或结构上相似的另一个残基置换。生物学上相似的意指取代与生物学活性(例如改善pbc和/或其表现的活性)相容。结构上相似的意指氨基酸具有相似长度的侧链,如丙氨酸、甘氨酸和丝氨酸,或具有相似大小的侧链,或第一、第二或另外的肽序列的结构被保留。化学相似性意指残基具有相同的电荷或者既是亲水性的又是疏水性的。特别的实例包括一个疏水性残基(如异亮氨酸、缬氨酸、亮氨酸或甲硫氨酸)取代另一个疏水性残基,或一个极性残基取代另一个极性残基,如精氨酸取代赖氨酸、谷氨酸取代天冬氨酸、或谷氨酰胺取代天冬酰胺、丝氨酸取代苏氨酸,等等。可以使用常规测定来确定子序列、变异体或修饰形式是否具有活性,例如改善pbc和/或其表现的活性。
[0418]
在本文中所例示的肽序列的子序列、变异体和修饰形式的特别实例与参比肽序列具有50%-60%、60%-70%、70%-75%、75%-80%、80%-85%、85%-90%、90%-95%或96%、97%、98%或99%同一性。术语“同一性”和“同源性”及语法变体意指两个或两个以上被提及实体是相同的。因此,若两个氨基酸序列是完全相同的,那么它们具有完全相同的氨基酸序列。“同一性的面积、区域或结构域”意指两个或两个以上被提及实体的一部分是相同的。因此,若两个氨基酸序列在一个或多个序列区域内是完全相同的或同源的,那么它们在那些区域中共享同一性。
[0419]
两个序列之间的同一性程度可以使用本领域已知的计算机程序和数学算法来确定。这样的计算百分序列同一性(同源性)的算法一般会考虑待比较区域内的序列空位和错配。举例来说,blast(例如,blast2.0)检索算法(参见例如,altschul等人,j.mol.biol.215:403(1990),公众可通过ncbi获得)具有如下示例性的检索参数:错配(mismatch)-2;空位开放(gap open)5;空位延伸(gap extension)2。对于肽序列比较,blastp算法典型地结合评分矩阵(scoring matrix)如pam100、pam 250、blosum 62或blosum 50使用。fasta(例如,fasta2和fasta3)和ssearch序列比较程序也可以用于对同一性程度进行定量(pearson等人,proc.natl.acad.sci.usa 85:2444(1988);pearson,methods mol biol.132:185(2000);和smith等人,j.mol.biol.147:195(1981))。使用基于delaunay的拓扑映射作图(delaunay-based topological mapping)来定量蛋白质结构相似性的程序也已经开发出来(bostick等人,biochem biophys res commun.304:320(2003))。
[0420]
在所述肽序列(包括在本文中所例示的肽序列的子序列、变异体和修饰形式)中,“氨基酸”或“残基”包括常规的α-氨基酸以及β-氨基酸;α,α-二取代的氨基酸;和n-取代的氨基酸,其中至少一个侧链是如本文中定义的氨基酸侧链部分。“氨基酸”还包括n-烷基α-氨基酸,其中n-末端氨基基团具有c1至c6直链或支链烷基取代基。因此,术语“氨基酸”包括天然存在的蛋白质氨基酸的立体异构体和修饰、非蛋白质氨基酸、翻译后修饰的氨基酸(例如,通过糖基化、磷酸化、酯或酰胺裂解等)、酶促修饰的或合成的氨基酸、衍生的氨基酸、设计成模拟氨基酸的构建体或结构、其侧链部分具有修饰的、衍生自天然存在的部分的氨基酸、或合成或不是天然存在的氨基酸等。修饰的和非常规的氨基酸包括在本文提供的肽序列中(参见例如,载于synthetic peptides: a user’s guide;hruby等人.,biochem.j.268:249(1990);和toniolo c.,int.j.peptide protein res.35:287(1990))。
[0421]
另外,氨基酸的保护基和改性基团包括在内。如本文使用的术语“氨基酸侧链部分”包括任何氨基酸的任何侧链,正如术语“氨基酸”在本文中定义的一样。因此,这包括天然存在的氨基酸中的侧链部分。它还包括如本文所阐述的和本领域技术人员已知的修饰的天然存在的氨基酸中的侧链部分,例如天然存在的蛋白质氨基酸的立体异构体和修饰、非蛋白质氨基酸、翻译后修饰的氨基酸、酶促修饰的或合成的氨基酸、衍生的氨基酸、设计成模拟氨基酸的构建体或结构中的侧链部分等。举例来说,本文公开的或本领域技术人员已知的任何氨基酸的侧链部分包括在该定义中。
[0422]“氨基酸侧链部分的衍生物”包括在氨基酸侧链部分的定义中。衍生的氨基酸侧链部分的非限制性实例包括例如:(a)将一个或多个饱和或不饱和的碳原子添加到已有的烷基、芳基或芳烷基链上;(b)侧链中的碳被另一个原子(如氧或氮)取代;(c)将末端基团添加
到侧链(包括甲基(
‑‑
ch3)、甲氧基(
‑‑
och3)、硝基(
‑‑
no2)、羟基(
‑‑
oh)或氰基(
‑‑
c=n))的碳原子上;(d)对于包括羟基、巯基或氨基基团的侧链部分,添加合适的羟基、巯基或氨基保护基;或(e)对于包括环结构的侧链部分,添加一个或多个环取代基,包括直接或通过例如醚键连接的羟基、卤素、烷基或芳基基团。对于氨基基团,合适的保护基是技术人员已知的。前提是这样的衍生化在最终肽序列中提供所需要的活性(例如,改善pbc和/或其表现的活性)。
[0423]“氨基酸侧链部分”包括所有这样的衍生化,并且特别的非限制性实例包括:γ-氨基丁酸、12-氨基十二烷酸、α-氨基异丁酸、6-氨基己酸、4-(氨基甲基)-环己烷甲酸、8-氨基辛酸、联苯丙氨酸、boc-叔丁氧基羰基、苄基、苯甲酰基、瓜氨酸、二氨基丁酸、吡咯赖氨酸、二氨基丙酸、3,3-二苯丙氨酸、鸟氨酸(orthonine)、瓜氨酸、1,3-二氢-2h-异吲哚甲酸、乙基、fmoc—芴基甲氧基羰基、庚酰基(ch3‑‑
(ch2)5‑‑
c(=o)
‑‑
)、己酰基(ch3‑‑
(ch2)4‑‑
c(=o)
‑‑
)、高精氨酸、高半胱氨酸、高赖氨酸、高苯丙氨酸、高丝氨酸、甲基、甲硫氨酸亚砜、甲硫氨酸砜、正缬氨酸(nva)、苯基甘氨酸、丙基、异丙基、肌氨酸(sar)、叔丁基丙氨酸和苄氧基羰基。
[0424]
单个氨基酸,包括天然存在的蛋白质氨基酸的立体异构体和修饰、非蛋白质氨基酸、翻译后修饰的氨基酸、酶促-合成的氨基酸、非天然存在的氨基酸,包括衍生的氨基酸、衍生自前述中的任一种的α,α-二取代的氨基酸(即,α,α-二取代的氨基酸,其中至少一个侧链与其所衍生的残基的侧链相同)、衍生自前述中的任一种的β-氨基酸(即,β-氨基酸(其存在β-碳与来自其所衍生的残基相同)等,包括所有上述氨基酸,在本文中它们全都可以被称为“残基”。合适的取代基,除了α-氨基酸的侧链部分以外,还包括c1至c6直链或支链烷基。aib是α,α-二取代的氨基酸的一个实例。尽管α,α-二取代的氨基酸可以是指使用常规的l-和d-异构体参考,但是应当理解,这样的参考仅为了方便起见,并且在α-位置的取代基是不相同的情况下,这样的氨基酸可互换地称为衍生自l-或d-异构体的α,α-二取代的氨基酸,适当的时候,属于具有确定氨基酸侧链部分的残基。因此,(s)-2-氨基-2-甲基-己酸可以被称为衍生自l-nle(正亮氨酸)的α,α-二取代的氨基酸或者被称为衍生自d-ala的α,α-二取代的氨基酸。类似地,aib可以被称为衍生自ala的α,α-二取代的氨基酸。不论何时提供α,α-二取代的氨基酸,应当理解为包括其所有的(r)和(s)构型。
[0425]“n-取代的氨基酸”包括其中氨基酸侧链部分与骨架氨基基团共价结合的任何氨基酸,任选地其中除α-碳位置中的h以外没有取代基。肌氨酸是n-取代的氨基酸的一个实例。作为实例,肌氨酸可以被称为ala的n-取代的氨基酸衍生物,因为肌氨酸和ala的氨基酸侧链部分相同,即甲基。
[0426]
在某些实施方式中,提供肽序列,包括在本文中所例示的肽序列的子序列、变异体和修饰形式的共价修饰。共价修饰的一个示例性类型包括使被靶向的氨基酸残基与有机衍生化剂反应,该有机衍生化剂能够与该肽的选定侧链或n-末端或c-末端残基反应。用双官能剂衍生化可用于例如将肽与水不溶性支持基质(support matrix)或表面交联供在用于纯化抗肽抗体的方法中使用,反之亦然。常用的交联剂包括例如1,1-双(重氮基乙酰基)-2-苯基乙烷;戊二醛;n-羟基琥珀酰亚胺酯,例如与4-叠氮基水杨酸的酯,同型双官能亚氨酸酯,包括二琥珀酰亚胺酯,如3,3
’‑
二硫代双(琥珀酰亚胺基丙酸酯),双官能马来酰亚胺如双-n-马来酰亚胺基-1,8-辛烷和诸如3-[(对叠氮基苯基)二硫代]丙酰亚氨酸甲酯的试剂。
[0427]
其他修饰包括谷氨酰胺酰基和天冬酰胺酰基残基的脱酰胺化分别生成相应的谷氨酰基和天冬酰基残基,脯氨酸和赖氨酸的羟基化,丝氨酰基或苏氨酰基残基的羟基基团的磷酸化,赖氨酸、精氨酸和组氨酸侧链的α-氨基基团的甲基化(t.e.creighton,proteins:structure and molecular properties,w.h.freeman & co.,san francisco,第79-86页(1983)),n-末端胺的乙酰化,任何c-末端羧基基团的酰胺化等。
[0428]
所例示的肽序列,及在本文中所例示的肽序列的子序列、变异体和修饰形式也可以包括用于稳定性的骨架的改变,衍生物和肽模拟物。术语“肽模拟物(peptidomimetic)”包括是残基的模拟物的分子(称为“模拟物(mimetic)”),包括但不限于哌嗪核心分子、酮基-哌嗪(keto-piperazine)核心分子和二氮杂卓(diazepine)核心分子。除非另有说明,否则本文提供的肽序列的氨基酸模拟物既包括羧基基团又包括氨基基团,和对应于氨基酸侧链的基团,或者在甘氨酸的模拟物的情况下,除氢以外无侧链。
[0429]
作为实例,这些将包括这样的化合物:其模拟天然存在的氨基酸的空间排列(sterics)、表面电荷分布、极性等,但不需要是氨基酸,其将在生物学系统中赋予稳定性。例如,脯氨酸可以被合适的大小和取代的其他内酰胺或内酯取代;亮氨酸可以被烷基酮、n-取代的酰胺取代,以及使用烷基、烯基或其他取代基的氨基酸侧链长度中的变化,其他的对于技术人员来说可以是显而易见的。形成这样的取代的必要条件是提供大致相同大小和电荷与构型的分子作为用于设计该分子的残基。这些修饰的精修可以通过分析功能的(例如,葡萄糖降低)或其他测定中的化合物并且比较结构-活性关系来做出。这样的方法是在医药化学和药物开发中工作的技术人员的范围之内。
[0430]
术语“结合”及其变体,当提及肽序列使用时,意指肽序列在分子水平上相互作用。使用本领域已知的测定(例如,竞争性结合、免疫沉淀、elisa、流式细胞术、蛋白质印迹法(western blotting)),可以将特异性和选择性结合与非特异性结合区别开。
[0431]
肽和肽模拟物可以使用本领域已知的方法进行生产和分离。肽可以使用化学方法全部或部分地合成(参见例如,caruthers(1980).nucleic acids res.symp.ser.215;horn(1980);和banga,a.k.,therapeutic peptides and proteins,formulation,processing and delivery systems(1995)technomic publishing co.,lancaster,pa)。肽合成可以使用各种固相技术来进行(参见例如,roberge science 269:202(1995);merrifield,methods enzymol.289:3(1997))并且可以例如使用abi 431a肽合成仪(perkin elmer)按照生产商的说明书来实现自动化合成。肽和肽模拟物也可以使用组合方法来合成。掺入合成残基和多肽的模拟物可以使用本领域已知的各种各样的程序和方法来合成(参见例如,organic syntheses collective volumes,gilman等人(编著)john wiley & sons,inc.,ny)。修饰的肽可以通过化学修饰方法来生产(参见例如,belousov,nucleic acids res.25:3440(1997);frenkel,free radic.biol.med.19:373(1995);和blommers,biochemistry 33:7886(1994))。肽序列变异、衍生、取代和修饰也可以使用诸如寡核苷酸介导的(定点)诱变、丙氨酸扫描和基于pcr的诱变等方法来进行。定点诱变(carter等人,nucl.acids res.,13:4331(1986);zoller等人,nucl.acids res.10:6487(1987))、盒式诱变(cassette mutagenesis)(wells等人,gene 34:315(1985))、限制选择诱变(wells等人,philos.trans.r.soc.london sera 317:415(1986))和其他技术可以在克隆化dna上进行以产生本文提供的肽序列、变异体、融合体和嵌合体,及其变异、衍生、取代和修饰。
[0432]“合成的”或“制造的”肽序列是通过涉及经由人之手操作(manipulation by the hand of man)的任何方法制备的肽。这样的方法包括但不限于上述方法,如化学合成法、重组dna技术、较大分子的生物化学或酶促片段化,及上述方法的组合。
[0433]
本文提供的肽序列(包括所例示的肽序列的子序列、序列变异体和修饰形式)(例如,在序列表或表1中列出的序列)也可以被修饰以形成嵌合分子。在某些实施方式中,本文提供的是包括异源结构域的肽序列。这样的结构域可以添加到该肽序列的氨基-末端或在其羧基-末端上添加。异源结构域也可以位于所述肽序列内,和/或备选地由fgf19和/或fgf21衍生的氨基酸序列侧接。
[0434]
术语“肽”也包括肽的二聚体或多聚体(低聚体)。在某些实施方式中,本文提供的是所例示的肽序列的二聚体或多聚体(低聚体),以及所例示的肽序列的子序列、变异体和修饰形式,包括序列表或表1所列出的序列。
[0435]
在某些实施方式中,本文提供的肽序列包含表1中所列出的氨基酸序列。在其他的实施方式中,本文提供的肽序列由表1中所列出的氨基酸序列组成。
[0436]
表1
[0437]
[0438]
[0439]
[0440]
[0441]
[0442]
[0443]
[0444]
[0445]
[0446]
[0447]
[0448]
[0449]
[0450]
[0451]
[0452]
[0453][0454]
在一个实施方式中,所述肽序列包含seq id no:1中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:2中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:3中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:4中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:5中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:6中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:7中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:8中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:9中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:10中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:11中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:12中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:13中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:14中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:15中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:16中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:17中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:18中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:19中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:20中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:21中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:22中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:23中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:24中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:25中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:26中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:27中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:28中所阐述的氨基酸序列。在另一个
实施方式中,所述肽序列包含seq id no:29中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:30中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:31中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:32中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:33中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:34中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:35中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:36中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:37中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:38中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:39中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:40中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:41中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:42中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:43中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:44中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:45中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:46中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:47中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:48中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:49中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:50中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:51中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:52中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:53中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:54中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:55中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:56中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:57中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:58中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:59中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:60中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:61中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:62中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:63中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:64中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:65中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:66中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:67中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:68中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:69中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:70中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:71中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:72中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:73中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:74中
所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:75中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:76中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:77中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:78中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:79中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:80中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:81中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:82中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:83中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:84中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:85中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:86中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:87中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:88中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:89中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:90中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:91中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:92中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:93中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:94中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:95中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:96中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:97中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:98中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:138中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:139中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:140中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:141中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:142中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:143中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:144中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:145中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:146中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:147中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:148中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:149中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:150中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:151中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:152中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:153中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:154中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:155中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:156中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:157中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:158中所阐述的氨基酸序列。
在其他的实施方式中,所述肽序列包含seq id no:159中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:160中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:161中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:162中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:163中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:164中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:165中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:166中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:167中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:168中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:192中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:193中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:194中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:195中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:196中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:197中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:198中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:199中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:200中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:201中所阐述的氨基酸序列。在其他的实施方式中,所述肽序列包含seq id no:202中所阐述的氨基酸序列。在一个实施方式中,所述肽序列包含seq id no:203中所阐述的氨基酸序列。在另一个实施方式中,所述肽序列包含seq id no:204中所阐述的氨基酸序列。在本文提供的各种肽序列的某些实施方式中,该r残基在n-末端处缺失。
[0455]
在还有其他的实施方式中,所述肽序列由seq id no:1中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:2中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:3中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:4中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:5中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:6中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:7中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:8中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:9中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:10中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:11中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:12中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:13中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:14中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:15中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:16中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:17中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:18中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:19中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:20中所阐述的氨基酸序列组成。在其他的实施方式中,所
id no:65中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:66中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:67中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:68中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:69中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:70中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:71中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:72中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:73中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:74中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:75中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:76中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:77中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:78中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:79中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:80中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:81中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:82中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:83中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:84中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:85中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:86中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:87中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:88中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:89中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:90中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:91中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:92中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:93中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:94中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:95中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:96中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:97中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:98中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:138中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:139中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:140中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:141中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:142中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:143中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:144中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:145中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:146中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:147中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:
148中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:149中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:150中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:151中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:152中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:153中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:154中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:155中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:156中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:157中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:158中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:159中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:160中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:161中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:162中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:163中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:164中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:165中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:166中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:167中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:168中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:192中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:193中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:194中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:195中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:196中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:197中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:198中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:199中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:200中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:201中所阐述的氨基酸序列组成。在其他的实施方式中,所述肽序列由seq id no:202中所阐述的氨基酸序列组成。在一个实施方式中,所述肽序列由seq id no:203中所阐述的氨基酸序列组成。在另一个实施方式中,所述肽序列由seq id no:204中所阐述的氨基酸序列组成。在本文提供的各种肽序列的某些实施方式中,该r残基在n-末端处缺失。
[0456]
5.4特别的修饰以提高肽功能
[0457]
改善本文公开的治疗形态(treatment modalities)的一种或多种物理性质和/或给予它们的方式(manner)常常是有益的,并且有时是势在必行的。物理性质的改善包括例如调节免疫原性;增加溶解度、生物利用度、血清半寿期和/或治疗半寿期的方法;和/或调节生物学活性。某些修饰也可以用于例如产生抗体以用于检测测定(例如,表位标签)和以提供易于蛋白质纯化。这样的改善必须在没有负面影响治疗方式的生物活性和/或增加其免疫原性的条件下产生。
[0458]
聚乙二醇化是在本文中考虑的一种特殊修饰,而其他修饰包括但不限于糖基化
(n-联的和o-联的);聚唾液酸化;白蛋白融合分子(包含血清白蛋白(例如,人血清白蛋白(hsa)、氰基血清白蛋白或牛血清白蛋白(bsa)));通过例如缀合的脂肪酸链(酰基化)的白蛋白结合;和fc-融合蛋白。
[0459]
5.4.1聚乙二醇化
[0460]
蛋白质治疗剂的临床有效性通常受到血浆半寿期短和对蛋白酶降解的敏感性的限制。各种治疗性蛋白质(例如,非格司亭(filgrastim))的研究已经表明,这样的困难可以通过例如使蛋白质与各种非蛋白质性聚合物中的任何一种(例如聚乙二醇(peg)、聚丙二醇或聚氧烯烃)缀合或连接来克服。常常通过使连接部分与蛋白质和非蛋白质性聚合物(如peg)共价结合可以做到这一点。这样的peg-缀合的生物分子已经表明具备临床上有用的性质,包括更好的物理和热稳定性、针对酶促降解敏感性的保护作用、溶解度增加、更长的体内循环半寿期和清除率降低、免疫原性和抗原性降低及毒性降低。除了聚乙二醇化对药代动力学参数的有益效果以外,聚乙二醇化本身还可以提高活性。
[0461]
适用于与多肽序列缀合的聚乙二醇(pegs)一般在室温下可溶于水,并且具有通式r(o-ch
2-ch2)no-r,其中r为氢或保护基如烷基或链烷醇基团,和其中n为1到1000的整数。当r为保护基时,它一般具有1至8个碳。与多肽序列缀合的peg可以是直链的或支链的。本公开考虑了支链peg衍生物、“星形peg(star-pegs)”和多臂peg。本文提供的实施方式中使用的peg的分子量并不限于任何特定的范围,并且实例在本文中别处作了说明;作为实例,某些实施方式的分子量在5kda和20kda之间,而其他的实施方式的分子量在4kda和10kda之间。
[0462]
在其他的实施方式中,本文提供的是缀合物的组成,其中peg具有不同的n值,并且因此各种不同的peg以规定的比率存在。例如,有些组成包含其中n=1、2、3和4的缀合物的混合物。在有些组成中,其中n=1的缀合物的百分比为18-25%,其中n=2的缀合物的百分比为50-66%,其中n=3的缀合物的百分比为12-16%,和其中n=4的缀合物的百分比为至多5%。这样的组成可以通过本领域已知的反应条件和纯化方法来产生。可以使用阳离子交换色谱法来分离缀合物,然后鉴别出含有连接有所需数量的peg的缀合物的馏份,进行纯化以不含有未修饰的蛋白质序列和不含有连接有其他数量的peg的缀合物。
[0463]
聚乙二醇化最常发生在多肽n-末端的α氨基基团、赖氨酸残基的侧链上的ε-氨基基团和组氨酸残基的侧链上的咪唑基团上。由于大多数的重组多肽具备单个α和多个ε氨基和咪唑基团,因此根据接头化学可以产生大量位置异构体。
[0464]
本领域已知的通用聚乙二醇化策略可以适用于本文中。peg可以经由末端反应基团(“间隔区”或“接头”)与本文提供的多肽结合,该末端反应基团(“间隔区”或“接头”介导多肽序列中的一个或多个的游离氨基或羧基基团和聚乙二醇之间的键。具有可以与游离氨基基团结合的间隔区的peg包括n-羟基琥珀酰基亚胺聚乙二醇,其可以通过用n-羟基琥珀酰基亚胺活化聚乙二醇的琥珀酸酯来制备。可以与游离氨基基团结合的另一种活化的聚乙二醇是2,4-双(o-甲氧基聚乙二醇)-6-氯-s-三嗪,其可以通过使聚乙二醇一甲基醚与氰尿酰氯反应来制备。可以与游离羧基基团结合的活化的聚乙二醇包括聚氧乙烯二胺(polyoxyethylenediamine)。
[0465]
本文提供的多肽序列中的一个或多个与具有间隔区的peg的缀合可以通过各种常规方法来实现。例如,缀合反应可以在下列条件下完成:在溶液中,在5至10的ph下,在4℃至室温的温度下,持续30分钟至20小时,使用试剂与蛋白质的摩尔比为4:1至30:1。可以对反
应条件进行选择以使反应朝着占优势地产生所需取代程度的方向。一般而言,低温、低ph(例如,ph=5)和短反应时间趋于减少连接的peg数量,而高温、中性至高ph(例如,ph≥7)和较长反应时间趋于增加连接的peg数量。本领域已知的各种手段都可以用于终止反应。在有些实施方式中,反应通过使反应混合物酸化并且在例如-20℃下冷冻来终止。各种分子的聚乙二醇化在例如美国专利号5,252,714、5,643,575、5,919,455、5,932,462和5,985,263中有论述。
[0466]
在有些实施方式中,本文还提供的是peg模拟物的应用。保留peg属性(例如,提高的血清半寿期)并且同时还赋给予一些另外优异性质的重组peg模拟物已经开发出来。作为实例,能够形成类似于peg的延伸的构象的简单多肽链(包含例如ala、glu、gly、pro、ser和thr)可以重组产生,并且已经与感兴趣的肽或蛋白质药物融合(例如,xten technology;amunix;mountain view,ca)。这消除了在生产过程中对额外缀合步骤的需求。此外,已建立的分子生物学技术使得能够控制多肽链的侧链组成,允许免疫原性和生产性质的最优化。
[0467]
5.4.2糖基化
[0468]
如本文使用的,“糖基化”意味着在广义上是指使聚糖连接到蛋白质、脂质或其他有机分子上的酶促过程。在本文中术语“糖基化”的使用一般旨在意指添加或缺失一个或多个碳水化合物部分(或者通过移除基础糖基化位点或者通过经由化学和/或酶促方式缺失糖基化),和/或添加可能在天然序列中存在或不存在的一个或多个糖基化位点。另外,该短语还包括天然蛋白质的糖基化中的质变,其涉及存在的各种碳水化合物部分的性质和比例的变化。
[0469]
糖基化可显著地影响多肽的物理性质(例如,溶解度)并且在蛋白质稳定性、分泌和亚细胞定位方面也可以是重要的。糖基化多肽也可能表现出提高的稳定性或者可能改善一种或多种药代动力学性质(如半寿期)。另外,溶解度改善可以例如使得能够制备比包含非糖基化多肽的制剂更适合药物给药的制剂。
[0470]
糖基化位点的添加可以通过改变氨基酸序列来完成。可以对多肽进行改变,例如,通过添加一个或多个丝氨酸或苏氨酸残基(对于o-联糖基化位点)或天冬酰胺残基(对于n-联糖基化位点)或被其取代。n-联和o-联寡糖及在每种类型中发现的糖残基的结构可能是不同的。在两者中常见的一种糖类型是n-乙酰基神经氨酸(下文称之为唾液酸)。唾液酸通常是n-联和o-联寡糖二者的末端残基,并且借助于其负电荷,可对糖蛋白赋予酸性性质。一个特别的实施方式包含n-糖基化变异体的产生和应用。
[0471]
本文提供的多肽序列可任选地通过在核酸水平上的变化而改变,特别是通过使编码多肽的核酸在事先选定的碱基上发生突变致使产生将翻译成所需氨基酸的密码子。
[0472]
可以使用各种各样的细胞系来产生被糖基化的蛋白质。一个非限制性的实例二氢叶酸还原酶(dhfr)缺陷型中国仓鼠卵巢(chinese hamster ovary,cho)细胞,它是用于生产重组糖蛋白的一种常用的宿主细胞。这些细胞不表达β-半乳糖苷α-2,6-唾液酰基转移酶并因此不将α-2,6键(linkage)中的唾液酸添加到这些细胞中产生的糖蛋白的n-联寡糖上。
[0473]
5.4.3聚唾液酸化
[0474]
在某些实施方式中,本文还提供的是聚唾液酸化的应用,即使多肽与天然存在的、生物可降解的α-(2
→
8)联聚唾液酸(“psa”)缀合以便改善多肽的稳定性和体内药代动力学。
[0475]
白蛋白融合:用于缀合的另外合适的组分和分子包括白蛋白,诸如人血清白蛋白(hsa)、犬血清白蛋白和牛血清白蛋白(bsa)。
[0476]
在有些实施方式中,白蛋白与药物分子(例如,本文描述的多肽)在羧基端、氨基端、羧基和氨基两端及内部缀合(参见例如,美国专利号5,876,969和7,056,701)。
[0477]
在本文提供的hsa
–
药物分子缀合物实施方式中,可以使用各种形式的白蛋白,诸如白蛋白分泌前序列及其变异体、片段及其变异体和hsa变异体。这样的形式一般具备一种或多种所需要的白蛋白活性。在另外的实施方式中,融合蛋白是本文提供的,包含直接或间接地与白蛋白、白蛋白片段、白蛋白变异体等融合的多肽药物分子,其中所述融合蛋白与未融合的药物分子相比具有更高的血浆稳定性和/或所述融合蛋白保留未融合的药物分子的治疗活性。在有些实施方式中,间接融合通过接头(如肽接头或其修饰形式)来实现。
[0478]
综上所述,可以例如通过遗传操作使得编码has的核酸或其片段与编码一种或多种多肽序列的核酸连接,完成白蛋白与本文提供的一种或多种多肽的融合。
[0479]
5.4.4备选的白蛋白结合策略
[0480]
一些白蛋白
–
结合策略已经开发出来作为替代策略用于指导融合并且可以与本文描述的药剂一起使用。作为实例,在某些实施方式中,本文提供的是通过缀合的脂肪酸链(酰基化)和包含白蛋白结合结构域(abd)多肽序列和本文描述的多肽中的一种或多种的序列的融合蛋白的白蛋白结合策略。
[0481]
白蛋白与肽序列的融合可以例如通过遗传操作来实现,使得编码hsa(人血清白蛋白)的dna或其片段与编码肽序列的dna相连接。此后,合适的宿主可以用融合的核苷酸序列以例如合适质粒的形式转化或转染,以便表达融合多肽。该表达可以由例如原核或真核细胞在体外或由例如转基因生物体在体内来实现。在有些实施方式中,融合蛋白的表达在哺乳动物细胞系(例如,cho细胞系)中进行。
[0482]
用于将靶标蛋白质或肽与白蛋白以遗传方式融合的其他方式包括称为(novozymes biopharma a/s;denmark)的技术,并且该缀合的治疗用肽序列经常变得显著更有效,在体内具有更好的摄取。该技术已在商业上利用来生产(human genome sciences),一种用来治疗丙型肝炎感染的白蛋白和干扰素α-2b的组合。
[0483]
另一个实施方式涉及一种或多种人结构域抗体(dab)的应用。人结构域抗体(dabs)是人抗体(iggs)的最小功能性结合单元并且具有优异的稳定性和溶解度特征。该技术涉及dab缀合至hsa(由此形成“albudab”,参见例如,ep1517921b、wo2005/118642和wo2006/051288)和感兴趣的分子(例如,本文提供的肽序列)。与目前用于延长肽的血清半寿期的技术相比,albudabs通常更小并且更易于在微生物表达系统如细菌或酵母中生产。由于has的半寿期约为三周,因此所得到的缀合分子改善了半寿期。dab技术的应用也可以增强感兴趣的分子的效力。
[0484]
5.4.5与其他分子缀合
[0485]
用于缀合的另外的合适组分和分子包括例如甲状腺球蛋白;破伤风类毒素;白喉类毒素;聚氨基酸诸如聚(d-赖氨酸:d-谷氨酸);轮状病毒的vp6多肽;流感病毒血凝素、流感病毒核蛋白;匙孔戚血蓝素(keyhole limpet hemocyanin,klh);和乙型肝炎病毒核心蛋白和表面抗原;或上述组分和分子的任何组合。
[0486]
因此,在某些实施方式中,一种或多种另外的组分或分子在多肽序列诸如另一种
多肽(例如,其氨基酸序列对对象多肽来说异源的多肽)或载体分子的n-末端和/或c-末端的缀合也给予了考虑。因此,可以提供一个示例性的多肽序列作为与另一个组分或分子缀合。
[0487]
多肽也可以与大的、慢代谢的大分子(诸如蛋白质;聚糖,诸如琼脂糖凝胶(sepharose)、琼脂糖、纤维素或纤维素珠;聚合氨基酸,诸如聚谷氨酸或聚赖氨酸;氨基酸共聚物;失活的病毒颗粒;失活的细菌毒素;诸如来自白喉、破伤风、霍乱或白细胞毒素分子的类毒素;失活的细菌;和树突状细胞)缀合。这样的缀合的形式,如果需要,可以用于产生抗本文提供的多肽的抗体。
[0488]
5.4.6 fc-融合分子
[0489]
在某些实施方式中,本文提供的多肽序列的氨基端或羧基端与免疫球蛋白fc区融合以形成融合缀合物(或融合分子)。在一个具体的实施方式中,所述免疫球蛋白fc区是人fc区。融合缀合物已经表明能增加生物药物的系统性半寿期,并因此生物药物制品可能需要较少频次的给药。在某些实施方式中,与未融合到免疫球蛋白fc区的相同多肽相比,增加了半寿期。
[0490]
fc与衬在血管内的内皮细胞中的新生儿fc受体(fcrn)结合,并且在结合后,fc融合分子被保护起来免于降解并且再释放到循环中,使该分子在循环中保持更长时间。这种fc结合据信是内源性igg保持其长血浆半寿期的机制。最近,fc-融合技术将单拷贝的生物药物与抗体的fc区相连接,与传统的fc-融合缀合物相比,将生物药物的药代动力学和药效动力学性质进行了最优化。
[0491]
在有些实施方式中,本文提供的是m70与人抗体fc片段的融合体。在有些实施方式中,本文提供的是m69与人抗体fc片段的融合体。这样的融合体可以用于治疗胆汁酸相关紊乱和其他本文提供的代谢紊乱。在有些实施方式中,m70的fc-融合体具有更长的半寿期。在具体的实施方式中,m70的fc-融合体的更长的半寿期是与不是fc-融合体的m70相比较。在有些实施方式中,m69的fc-融合体具有更长的半寿期。在具体的实施方式中,m69的fc-融合体的更长的半寿期是与不是fc-融合体的m69相比较。这样的长半寿期使得这些融合体适合每周一次或更少频次用药。
[0492]
在有些实施方式中,所述fc-融合体包含接头。示例性的柔性接头包括甘氨酸聚合物(g)n、甘氨酸-丝氨酸聚合物、甘氨酸-丙氨酸聚合物、丙氨酸-丝氨酸聚合物和其他柔性接头。在某些实施方式中,所述接头是(g)4s。在有些实施方式中,所述接头是((g)4s)n,其中n为至少1的整数。在有些实施方式中,所述接头是((g)4s)2。甘氨酸和甘氨酸-丝氨酸聚合物是相对非结构化的,并因此可以用作组分之间的中性栓链(tether)。在有些实施方式中,所述甘氨酸-丝氨酸聚合物是(gs)n,其中n为至少1的整数。在有些实施方式中,所述甘氨酸-丝氨酸聚合物是gsggsn(seq id no:129),其中n为至少1的整数。在有些实施方式中,所述甘氨酸-丝氨酸聚合物是gggsn(seq id no:130),其中n为至少1的整数。在某些实施方式中,所述接头包含位于seq id no:130的n’端的另一个g残基。在一个实施方式中,所述接头是ggsg(seq id no:131)。在一个实施方式中,所述接头是ggsgg(seq id no:132)。在一个实施方式中,所述接头是gsgsg(seq id no:133)。在一个实施方式中,所述接头是gsggg(seq id no:134)。在一个实施方式中,所述接头是gggsg(seq id no:189)。在一个实施方式中,所述接头是gsssg(seq id no:135)。
[0493]
5.4.7纯化
[0494]
用于缀合的另外的合适组分和分子包括适合于分离或纯化的那些。特别的非限制性实例包括结合分子诸如生物素(生物素-抗生物素蛋白特异性结合对)、抗体、受体、配体、凝集素或包含固体载体的分子,包括例如塑料或聚苯乙烯珠、板或珠、磁珠、测试条和膜。
[0495]
纯化方法诸如阳离子交换色谱法可以用于根据电荷差异来分离缀合物,它将缀合物有效地分离成它们的各种分子量。例如,阳离子交换柱可以加载,然后用~20mm乙酸钠(ph~4)洗涤,接着用在ph为3至5.5,诸如在ph~4.5缓冲的线性(0m至0.5m)nacl梯度洗脱。通过阳离子交换色谱法获得的馏份的内容物可以使用常规方法例如质谱法、sds-page或其他已知的根据分子量分离分子实体的方法,通过分子量来鉴别。然后,相应鉴别这样的馏份,其含有连接有所需数量的peg的缀合物,进行纯化以不含有未修饰的蛋白质序列和不含具连接有其他数量的peg的缀合物。
[0496]
5.4.8其他修饰
[0497]
在某些实施方式中,本文还提供的是使用其他修饰(目前已知的或将来开发的)来改善一种或多种性质。实例包括hes化(hesylation),hes化的各个方面描述于例如美国专利申请号2007/0134197和2006/0258607;和包含sumo作为融合标签(fusion tag)的融合分子(lifesensors,inc.;malvern,pa)。
[0498]
在仍然其他的实施方式中,本文提供的肽序列与以下化学剂(例如,免疫毒素或化学治疗剂)缀合:包括但不限于细胞毒剂,包括紫杉醇(taxol)、细胞松驰素b(cytochalasin b)、短杆菌肽d(gramicidin d)、丝裂霉素(mitomycin)、依托泊苷(etoposide)、替尼泊苷(tenoposide)、长春新碱(vincristine)、长春碱(vinblastine)、秋水仙碱(colchicin)、多柔比星(doxorubicin)、道诺霉素(daunorubicin)及其类似物或同系物。其他化学剂包括例如抗代谢物(例如,甲氨蝶呤(methotrexate)、6-巯基嘌呤(6-mercaptopurine)、6-硫代鸟嘌呤(6-thioguanine)、阿糖胞苷(cytarabine)、5-氟尿嘧啶氨烯咪胺(5-fluorouracil decarbazine));烷化剂(例如,氮芥(mechlorethamine)、卡莫司汀(carmustine)和洛莫司汀(lomustine)、环磷酰胺(cyclothosphamide)、白消安(busulfan)、二溴甘露醇(dibromomannitol)、链脲佐菌素(streptozotocin)、丝裂霉素c(mitomycin c)和顺铂(cisplatin));抗生素(例如,博来霉素(bleomycin));和抗有丝分裂剂(例如,长春新碱和长春碱)。可以使用本领域已知的和本文描述的接头技术将细胞毒素与本文提供的肽缀合在一起。
[0499]
用于缀合的其他合适组分和分子包括适合于在测定中检测的那些。具体的非限制性实例包括可检测标志物,诸如放射性同位素(例如,
125
i;
35
s,
32
p;
33
p)、产生可检测产物的酶(例如,萤光素酶、β-半乳糖苷酶、辣根过氧化物酶和碱性磷酸酶)、荧光蛋白、生色蛋白、染料(例如,异硫氰酸荧光素);发荧光金属(例如,
152
eu);化学发光化合物(例如,鲁米诺和安吖啶鎓盐);生物发光化合物(例如,萤光素);和荧光蛋白。间接标志物包括与肽序列结合的标记的或可检测的抗体,其中抗体可以被检测。
[0500]
在某些实施方式中,本文提供的肽序列与放射性同位素缀合以产生可用作诊断剂或治疗剂的细胞毒放射性药物(放射性免疫缀合物)。这样的放射性同位素的实例包括但不限于碘
131
、铟
111
、钇
90
和镥
177
。用于制备放射性免疫缀合物的方法是技术人员已知的。商业上可获得的放射性免疫缀合物的实例包括替伊莫单抗(ibritumomab)、替坦(tiuxetan)和托
西莫单抗(tositumomab)。
[0501]
5.4.9接头
[0502]
接头及它们的应用在上文中已有描述。用来修饰本文提供的多肽序列的上述组分和分子中的任何一种可以任选地经由接头缀合。合适的接头包括“柔性接头(flexible linker)”,“柔性接头”一般足够长以允许在修饰的多肽序列和连接的组分和分子之间有一些移动。接头分子一般长约6-50个原子。接头分子也可以是例如芳基乙炔、含有2-10个单体单元的乙二醇低聚物、二胺、二酸、氨基酸或它们的组合。合适的接头可以易于选择并且可以是任何合适的长度,诸如1个氨基酸(例如,gly),2、3、4、5、6、7、8、9、10、10-20、20-30、30-50个或超过50个氨基酸。
[0503]
示例性的柔性接头包括甘氨酸聚合物(g)n、甘氨酸-丝氨酸聚合物(例如,(gs)n、gsggsn(seq id no:129)和gggsn(seq id no:130),其中n为至少1的整数)、甘氨酸-丙氨酸聚合物、丙氨酸-丝氨酸聚合物和其他柔性接头。甘氨酸和甘氨酸-丝氨酸聚合物是相对非结构化的,并因此可以用作组分之间的中性栓链(tether)。示例性的柔性接头包括但不限于ggsg(seq id no:131)、ggsgg(seq id no:132)、gsgsg(seq id no:133)、gsggg(seq id no:134)、gggsg(seq id no:189)和gsssg(seq id no:135)。在某些实施方式中,所述接头是(g)4s。在有些实施方式中,所述接头是((g)4s)n),其中n为至少1的整数。在有些实施方式中,所述接头是((g)4s)2)。在有些实施方式中,所述甘氨酸-丝氨酸聚合物是(gs)n,其中n为至少1的整数。在有些实施方式中,所述甘氨酸-丝氨酸聚合物是gsggsn(seq id no:129),其中n为至少1的整数。在有些实施方式中,所述甘氨酸-丝氨酸聚合物是gggsn(seq id no:130),其中n为至少1的整数。在某些实施方式中,所述接头包含位于seq id no:130的n’端处的另一个g残基。在一个实施方式中,所述接头是ggsg(seq id no:131)。在一个实施方式中,所述接头是ggsgg(seq id no:132)。在一个实施方式中,所述接头是gsgsg(seq id no:133)。在一个实施方式中,所述接头是gsggg(seq id no:134)。在一个实施方式中,所述接头是gggsg(seq id no:189)。在一个实施方式中,所述接头是gsssg(seq id no:135)。
[0504]
本文提供的肽序列,包括在表1和序列表中列出的fgf19和fgf21变异体和子序列及fgf19/fgf21融合体和嵌合体,以及表1和序列表中列出的序列的子序列、序列变异体和修饰形式具有如本文所阐述的一种或多种活性。活性的一个实例是调节胆汁酸体内稳态。活性的另一个实例是减少的hcc刺激或形成,例如,与fgf19相比较。活性的另外一个实例是较低的或减少的脂质(例如,甘油三酯、胆固醇、非hdl)或hdl增加活性,例如,与fgf21相比较。活性的一个进一步实例是较低的或减少的瘦肌肉质量减少活性,例如,与fgf21相比较。活性的还有另一个实例是与fgfr4结合或者激活fgfr4,例如,与fgfr4结合的肽序列具有相当于或大于fgf19对fgfr4的结合亲和力的亲和力;和激活fgfr4的肽序列的程度或量相当于或大于fgf19激活fgfr4。活性的再进一步实例包括治疗胆汁酸有关或相关紊乱。活性,诸如,例如胆汁酸体内稳态的调节、葡萄糖降低活性、胆汁酸有关或相关紊乱的分析、hcc形成或肿瘤发生、脂质增加活性或瘦体质量减少活性可以在动物诸如db/db小鼠中确定。与fgfr4结合或激活fgfr4的测量可以通过本文公开的或技术人员已知的测定来确定。
[0505]
各种不同的方法可以用于hcc的筛选和诊断,并且为技术人员所熟知。用于hcc的指标包括检测肿瘤标志物如升高的甲胎蛋白(afp)或脱γ羧基凝血西酶原(des-gamma carboxyprothrombin,dcp)水平。多种不同的扫描和成像技术也是有帮助的,包括超声成
像、ct扫描和mri。在某些实施方式中,对肽(例如,候选肽)是否表现出诱导hcc的证据的评价可以通过例如给予肽的动物模型(如db/db小鼠)中的定量hcc结节形成,将其与野生型fgf19的hcc结节形成相比较来体内确定。从宏观上看,肝癌可以是结节性的,其中肿瘤结节(其是圆形至椭圆形的,灰色或绿色的,良好划界的但不是有囊包着的)似乎为一个大团块或多个小团块。备选地,hcc可以作为浸润性肿瘤存在,浸润性肿瘤是弥散性的并且划界较差,常常浸润门静脉。肝脏组织样品的病理评估一般在一种或多种上述技术的结果指示可能存在hcc之后进行。因此,本文提供的方法可以还包括评估来自可用于hcc研究的体内动物模型(例如,db/db小鼠)的肝脏组织样品,以便确定肽序列是否表现出诱导hcc的证据。通过微观评估,病理学家可以确定hcc的四种常见构造(architectural)和细胞学类型(模式)之一是否存在(即,纤维板层型、假腺管型(腺体样)、多态性型(巨细胞型)和透明细胞型)。
[0506]
更特别地,本文提供的肽序列,包括在表1和序列表中列出的fgf19和fgf21变异体和子序列及fgf19/fgf21融合体和嵌合体,以及表1和序列表中列出的序列的子序列、变异体和修饰形式包括具有以下活性的那些:调节胆汁酸体内稳态或治疗胆汁酸有关或相关紊乱并且同时与fgf19或fgf 19变异体序列相比具有减少的hcc形成的肽序列,该fgf 19变异体序列具有在fgf19的氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代wgdpi(seq id no:170)序列;与fgf19或fgf 19变异体序列相比具有更大的胆汁酸调节活性的肽序列,该fgf 19变异体序列具有在fgf19的氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代wgdpi(seq id no:170)序列;与fgf19或fgf 19变异体序列相比具有较少的脂质增加活性(例如,较少的甘油三酯、胆固醇、非hdl)或较多的hdl增加活性的肽序列,该fgf 19变异体序列具有在fgf19的氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代wgdpi(seq id no:170)序列;和与fgf21相比具有较少的瘦体质量减少活性的肽序列。
[0507]
更特别地,本文提供的肽序列,包括在表1和序列表中列出的fgf19和fgf21变异体和子序列及fgf19/fgf21融合体和嵌合体,以及表1和序列表中列出的序列的子序列、变异体和修饰形式包括具有以下活性的那些:调节胆汁酸体内稳态的肽序列;治疗胆汁酸有关或相关紊乱的肽序列;与fgfr4结合或激活fgfr4的肽序列,诸如以相当于或大于fgf19对fgfr4的结合亲和力的亲和力与fgfr4结合的肽序列;以相当于或大于fgf19激活fgfr4的程度或量激活fgfr4的肽序列;例如与fgf19相比,下调或降低醛-酮还原酶基因表达的肽序
列;和与fgf21相比,上调或增加溶质载体家族1、成员2(slc1a2)基因表达的肽序列。
[0508]
正如本文所公开的,变异体包括fgf19的各种n-末端修饰和/或截短,包括其中一个或若干个n-末端fgf19氨基酸已经被来自fgf21的氨基酸取代的变异体。这样的变异体包括具有葡萄糖降低活性以及有利的血脂分布和不是可测量地或可检测地致肿瘤性的变异体。
[0509]
5.5剂量和给药
[0510]
本文提供的肽序列包括所例示的肽序列的子序列、序列变异体和修饰形式(例如,在序列表或表1中列出的序列),可以以单位剂量或单位剂型配制。在一个特别的实施方式中,肽序列是以对治疗需要治疗的对象有效的量,例如由于不正常或异常胆汁酸体内稳态,诸如代谢综合征;脂质-或葡萄糖-相关紊乱;胆固醇或甘油三酯代谢;2型糖尿病;胆汁淤积症,包括例如肝内胆汁淤积的疾病(例如,pbc、pfic、psc、pic、新生儿胆汁淤积症和药物诱发的胆汁淤积症(例如,雌激素))和肝外胆汁淤积的疾病(例如,肿瘤所致的胆汁切向压缩、胆结石所致的胆管堵塞);胆汁酸吸收不良和累及远端小肠的其他紊乱,包括回肠切除、炎症性肠疾病(例如,克罗恩氏病和溃疡性结肠炎),损害胆汁酸的吸收(不另表征(特发性的))而导致腹泻(例如,bad)和gi症状的紊乱,以及gi、肝脏和/或胆汁性癌症(例如,结肠癌和肝细胞癌);和/或胆汁酸合成异常,诸如促进nash、肝硬化和门静脉高压的那些。示例性的单位剂量范围为约25-250、250-500、500-1000、1000-2500或2500-5000、5000-25,000、25,000-50,000ng;约25-250、250-500、500-1000、1000-2500或2500-5000、5000-25,000、25,000-50,000μg;和约25-250、250-500、500-1000、1000-2500或2500-5000、5000-25,000、25,000-50,000mg。
[0511]
本文提供的肽序列包括所例示的肽序列的子序列、序列变异体和修饰形式(例如,在序列表或表1中列出的序列)可以作为单剂量或多剂量给予以提供所预期的效果,例如以有效量或足够量。示例性的剂量范围为约25-250、250-500、500-1000、1000-2500或2500-5000、5000-25,000、25,000-50,000pg/kg;约50-500、500-5000、5000-25,000或25,000-50,000ng/kg;和约25-250、250-500、500-1000、1000-2500或2500-5000、5000-25,000、25,000-50,000μg/kg。可以给予单剂量或多剂量,例如,每天多次,在连续多天、隔天(alternating days)、每周或间歇性(例如,每周两次,每1、2、3、4、5、6、7或8周一次,或每2、3、4、5或6个月一次)。
[0512]
可以给予本文提供的肽序列包括所例示的肽序列的子序列、变异体和修饰形式(例如,在序列表或表1中列出的序列),并且方法可以采用系统性、区域性或局部给药且通过任何途径来实践。例如,肽序列可以经由胃肠外(例如,皮下、静脉内、肌内或腹膜内)、口服(例如,吞服、含服(buccal)或舌下)、吸入、真皮内、腔内、颅内、经皮(局部)、经粘膜或直肠给予。本文提供的肽序列包括所例示的肽序列的子序列、变异体和修饰形式(例如,在序列表或表1中列出的序列)并且本文提供的方法(包括药物组合物)可以经由(微)胶囊化递送系统或包装成给药用的植入物来给予。
[0513]
胃肠外(例如,皮下)给药的一个特别的非限制性实例涉及使用intarcia皮下递送系统(intarcia therapeutics,inc.;hayward,ca)。该系统包含在所需时间周期内递送恒定量的治疗剂的微型渗透泵。除了将药物水平维持在恰当治疗范围内之外,该系统还可以与将蛋白质性治疗剂的稳定性在人体温度下维持延长的时间周期的制剂一起使用。
[0514]
胃肠外给药的另一个非限制性实例涉及使用型可植入渗透泵(得自例如durect corp.)。系统可以用于需要药物的系统性或位点特异性给药的疗法。为了系统性递送药物,将系统在门诊手术中恰好植入皮肤下,例如植入上臂内,门诊手术使用局部麻醉药在刚好几分钟内完成。为了将药物递送到规定位点,可以使用小型导管技术。导管可以与系统相连以指导药物流向靶器官、组织或合成医学结构(如移植物)。位点特异性递送使得待给予药物在所需靶标达到治疗浓度而无需将整个身体都达到类似浓度。系统的精确度、大小和性能将连续位点特异性递送到身体内的各种精确位置。
[0515]
胃肠外给药的还有另一个非限制性实例涉及使用on-body递送系统(例如,thedelivery kit by amgen)。这种on-body递送系统包括on-body注射器,其是一种在与医生访诊的同一天(如化学疗法的当天)使用的小型、轻量、注射系统。它设计成在第二天或者在医生访诊的不久的将来递送一剂治疗剂,使得患者不需要返回到医生办公室接受注射。
[0516]
5.6预防、治疗和处理疾病和紊乱的方法
[0517]
在一个实施方式中,本文提供的是预防患有通过本文提供的肽序列可预防的疾病或紊乱或处于患有该疾病或紊乱的风险之中的对象的疾病或紊乱的方法,包括将包含本文提供的肽的药物组合物以对预防该疾病或紊乱有效的量给予对象。在另一个实施方式中,本文提供的是治疗患有通过本文提供的肽序列可治疗的疾病或紊乱或处于患有该疾病或紊乱的风险之中的对象的疾病或紊乱的方法,包括将包含本文提供的肽的药物组合物以对治疗该疾病或紊乱有效的量给予对象。在还有另一个实施方式中,本文提供的是处理患有通过本文提供的肽序列可处理的疾病或紊乱或处于患有该疾病或紊乱的风险之中的对象的疾病或紊乱的方法,包括将包含本文提供的肽的药物组合物以对处理该疾病或紊乱有效的量给予对象。在一个实施方式中,所述疾病或紊乱是胆汁酸-有关疾病或相关紊乱。在另一个实施方式中,所述疾病或紊乱是代谢疾病或紊乱。在其他的实施方式中,所述疾病或紊乱是癌症或肿瘤。
[0518]
将各种fgf19和/fgf21变异体和融合肽序列给予小鼠成功地调节了胆汁酸体内稳态和高血糖症(数据未显示)。此外,与fgf19相反,某些肽序列在小鼠中不刺激或不诱导hcc形成或肿瘤发生(数据未显示)。因此,将本文提供的肽(包括所例示的肽序列的子序列、变异体和修饰形式(包括在表1和序列表中列出的fgf19和fgf21变异体和子序列,及表1和序列表中列出的fgf19/fgf21融合体和嵌合体)通过体内或者通过先体外再体内的方法直接或间接地向动物施用(例如,给予所述变异体或融合肽、编码所述变异体或融合肽的核酸或表达所述变异体或融合肽的转化细胞或基因疗法载体),可以用来治疗如本文所阐述的各种紊乱,诸如胆汁酸有关或相关紊乱和代谢紊乱(诸如与高糖水平有关的紊乱)、高血糖症、胰岛素抵抗、高胰岛素血症、葡萄糖不耐症、代谢综合征或相关紊乱。
[0519]
5.6.1预防、治疗和处理胆汁酸有关或相关紊乱的方法
[0520]
如本文使用的,短语“胆汁酸有关紊乱(bile acid-related disorder)”、“胆汁酸有关或相关紊乱(bile acid-related or associated disorder)”等,当提及对象的病症使用时,意指胆汁酸体内稳态的破坏,它本身可表现为例如一种胆汁酸或者一种或多种胆汁酸的急性、一过性或慢性异常水平。该病症可以因为胆汁酸合成、代谢或吸收的抑制、减
少或延迟而引起以使对象表现出在正常对象中不是典型地存在的胆汁酸水平。
[0521]
本文还提供的是体外(in vitro)、先体外再体内(ex vivo)和体内(in vivo)(例如,在对象身上或体内)方法和用途。这样的方法和用途可以使用本文所阐述的肽序列中的任何一种来实施。在各种实施方式中,所述方法将本文公开的肽序列如fgf19或fgf21变异体、融合体或嵌合体(例如,在序列表或表1中)或本文公开的fgf19或fgf21变异体、融合体或嵌合体的子序列、变异体或修饰形式(例如,序列表或表1)以对治疗胆汁酸有关或相关紊乱有效的量给予对象。
[0522]
在某些实施方式中,所述肽与另外的一种或多种治疗剂和/或治疗方式(例如,可用于治疗和/或预防pbc的药剂)联合给予。所述另外的一种或多种治疗剂可以在给予本文描述的肽之前、同时或之后给予。
[0523]
本文还提供的是相对于相仿年龄、性别、种族等的恰当匹配的对象,预防(例如,在倾向于患上特定紊乱的对象中)、延迟、减慢或抑制胆汁酸有关或相关紊乱的进展、发作,或者治疗(例如,减轻)胆汁酸有关或相关紊乱的方法。因此,在各种实施方式中,本文提供的用于例如调节胆汁酸体内稳态或治疗胆汁酸有关或相关紊乱的方法包括以对调节胆汁酸体内稳态或治疗胆汁酸有关或相关紊乱有效的量接触或给予一种或多种本文提供的肽(例如,如序列表或表1中所列出的fgf19和/或fgf21的变异体或融合体)。在某些实施方式中,所述方法还包括接触或给予至少另外一种可用于治疗或预防胆汁酸有关或相关紊乱(例如,pbc)的治疗剂或治疗方式。
[0524]
术语“对象”是指动物。典型地,所述动物是将受益于用本文提供的肽序列治疗的哺乳动物。具体的实例包括灵长类动物(例如,人类)、狗、猫、马、牛、猪和羊。
[0525]
对象包括患有以下紊乱的那些:例如,胆汁酸有关或相关紊乱,诸如胆汁淤积症,包括例如肝内胆汁淤积的疾病(例如,pbc、pfic、psc、pic、新生儿胆汁淤积症和药物诱发的胆汁淤积症(例如,雌激素)),及肝外胆汁淤积的疾病(例如,肿瘤所致的胆汁切向压缩、胆结石所致的胆管堵塞);胆汁酸吸收不良和累及远端小肠的其他紊乱,包括回肠切除、炎症性肠疾病(例如,克罗恩氏病和溃疡性结肠炎)、短肠综合征,损害胆汁酸的吸收(不另表征(特发性的))而导致腹泻(例如,bad)和gi症状的紊乱,以及gi、肝脏和/或胆汁性癌症(例如,结肠癌和肝细胞癌);和/或胆汁酸合成异常,诸如促进nash、肝硬化和门静脉高压的那些;或未患上紊乱但可能处于发生紊乱的风险之中的对象。
[0526]
根据本文提供的方法和用途可预防、可治疗或可处理的非限制性示例性胆汁酸有关或相关紊乱包括:胆汁淤积症,包括例如肝内胆汁淤积的疾病(例如,原发性胆汁性肝硬化(pbc)、原发性家族性肝内胆汁淤积症(pfic)(例如,进行性pfic)、原发性硬化性胆管炎(choangitis)(psc)、妊娠期肝内胆汁淤积症(pic)、新生儿胆汁淤积症和药物诱发的胆汁淤积症(例如,雌激素))和肝外胆汁淤积的疾病(例如,肿瘤所致的胆汁切向压缩、胆结石所致的胆管堵塞);胆汁酸吸收不良和累及远端小肠的其他紊乱,包括回肠切除、炎症性肠疾病(例如,克罗恩氏病和溃疡性结肠炎)、短肠综合征,损害胆汁酸的吸收(不另表征(特发性的))而导致腹泻(例如,胆汁酸性腹泻(bad))和gi症状的紊乱,以及gi、肝脏和/或胆汁性癌症(例如,结肠癌和肝细胞癌);和/或胆汁酸合成异常,诸如促进非酒精性脂肪性肝炎(nash)、肝硬化和门静脉高压的那些;例如在哺乳动物(例如,人类)中。另外的胆汁酸有关或相关紊乱包括代谢综合征;脂质或葡萄糖紊乱;胆固醇或甘油三酯代谢;2型糖尿病。在一
个特别的实施方式中,所述胆汁酸有关或相关紊乱是胆汁酸吸收不良。在另一个特别的实施方式中,所述胆汁酸有关或相关紊乱是腹泻。在一个再进一步特别的实施方式中,所述胆汁酸有关或相关紊乱是胆汁淤积症(例如,肝内或肝外胆汁淤积症)。在另一个进一步的特别的实施方式中,所述胆汁酸有关或相关紊乱是原发性胆汁性肝硬化(pbc)。在其他特别的实施方式中,所述胆汁酸有关或相关紊乱是原发性硬化性胆管炎。在另一个实施方式中,所述胆汁酸有关或相关紊乱是pfic(例如,进行性pfic)。在另一个实施方式中,所述胆汁酸有关或相关紊乱是nash。在另一个实施方式中,所述胆汁酸有关或相关紊乱是高血糖症。在一个具体的实施方式中,所述胆汁酸有关或相关紊乱是2型糖尿病。
[0527]
在有些实施方式中,所述药物组合物还包含至少另外一种在调节胆汁酸体内稳态或治疗胆汁酸有关或相关紊乱中有效的药剂,其中所述另外的药剂是:糖皮质激素;cdca;udca;胰岛素、胰岛素促分泌素、胰岛素模拟物、磺酰脲和美格列奈;双胍类;α-葡萄糖苷酶抑制剂;dpp-iv抑制剂、glp-1、glp-1激动剂和glp-1类似物;dpp-iv-抗性类似物;pparγ激动剂、双重作用ppar激动剂、泛作用ppar激动剂;ptp1b抑制剂;sglt抑制剂;rxr激动剂;糖原合酶激酶-3抑制剂;免疫调节剂;β-3肾上腺素能受体激动剂;11β-hsd1抑制剂;胰岛淀粉样多肽和胰岛淀粉样多肽类似物;胆汁酸螯合剂;或sglt-2抑制剂。在某些实施方式中,所述至少另外一种在调节pbc中有效的药剂是udca、fxr激动剂、oca、asbt抑制剂、自身免疫剂、抗il-12剂、抗cd80剂、抗cd20剂、cxcl10中和抗体、cxcr3的配体、贝特类、鱼油、秋水仙碱、甲氨蝶呤、硫唑嘌呤、环孢菌素或抗逆转录病毒的疗法。在特别的实施方式中,所述至少另外一种在调节pbc中有效的药剂是udca、oca、asbt抑制剂、抗il-12剂、抗cd20剂或贝特类。
[0528]
可以用本文提供的肽序列治疗或预防的另外的胆汁酸有关或相关紊乱包括代谢综合征、脂质或葡萄糖紊乱、胆固醇或甘油三酯代谢、糖尿病(例如,2型糖尿病)、其他高血糖相关紊乱,包括肾损伤(例如,肾小管损伤或肾病变)、肝脏变性、眼损伤(例如,糖尿病性视网膜病变或白内障)和糖尿病足紊乱,和血脂异常及它们的后遗症,诸如,例如,动脉粥样硬化、冠状动脉疾病、脑血管紊乱等。
[0529]
可能与代谢综合征(诸如肥胖症和升高的体重质量(包括其共同病态病症,例如但不限于非酒精性脂肪性肝病(nafld)、非酒精性脂肪性肝炎(nash)和多囊卵巢综合征(pcos)))相关的其他病症,并且也包括血栓形成、高凝状态及血栓前状态(动脉和静脉)、高血压(包括门静脉高压(定义为肝脏的静脉压力梯度(hvpg)大于5mm hg)、心血管疾病、中风与心力衰竭;其中涉及炎症反应的紊乱或病症,包括动脉粥样硬化、慢性炎症性肠疾病(例如,克罗恩氏病和溃疡性结肠炎)、哮喘、红斑狼疮、关节炎或其他炎症性风湿性紊乱;细胞周期或细胞分化过程的紊乱,诸如脂肪细胞肿瘤、脂肪瘤性癌包括例如脂肪肉瘤、实体肿瘤和赘生物;神经变性性疾病和/或中枢神经系统和周围神经系统的脱髓鞘紊乱和/或涉及神经炎症过程的神经科疾病和/或其他外周神经病变,包括阿尔茨海默氏病、多发性硬化、帕金森氏病、进行性多病灶脑白质病变和格林-巴利综合征;皮肤和皮肤科紊乱和/或伤口愈合过程的紊乱,包括红斑-鳞状皮肤病;和其他紊乱,诸如x综合征、骨关节炎和急性呼吸窘迫综合征。
[0530]
胆汁酸有关或相关紊乱(例如,nash)的治疗可具有减轻或消除其继发性紊乱的益处。作为实例,罹患nash的对象也可能患有由于nash所致的抑郁症或焦虑症;因此,治疗对
象的nash也可以间接地治疗该抑郁症或焦虑症。将本文公开的疗法应用于靶向这样的继发性紊乱也在某些实施方式中给予了考虑。
[0531]
在特别的实施方式中,所述对象患有pbc或者处于患有pbc的风险之中。在其他特别的实施方式中,所述对象患有nash或者处于患有nash的风险之中。
[0532]
处于发生胆汁酸有关或相关紊乱(诸如上述紊乱)的风险之中的对象包括例如可能具有发生这类紊乱的家族史或遗传倾向的那些,以及其膳食可能促进发生这类紊乱的那些。
[0533]
正如本文所公开的,治疗方法包括在对象中以达到所需成果或结果有效的量接触或给予如本文所阐述的肽(例如,如序列表或表1中所列出的fgf19和/或fgf21的变异体或融合体)。导致所需成果或结果的治疗包括在所述对象中降低、减少或预防所述病症的一种或多种症状的严重程度或频率,例如在所述对象的病症中的改善,或“有益效果”或“治疗效果”。因此,治疗可以降低或减少或预防所述紊乱的一种或多种症状的严重程度或频率,稳定或抑制所述紊乱的进展或恶化,并且在有些情况下,逆转所述紊乱,暂时性地(例如,持续1-6、6-12或12-24小时),持续中期(例如,1-6、6-12、12-24或24-48天)或长期(例如,持续1-6、6-12、12-24、24-48周或超过24-48周)。因此,就胆汁酸有关或相关紊乱而论,治疗可以降低或减少上述胆汁酸有关或相关紊乱的一种或多种症状或作用。
[0534]
在某些实施方式中,本文提供的各种方法还包括在对象中以达到所需成果或结果有效的量接触或给予另外的一种或多种可用于治疗或预防胆汁酸有关或相关紊乱的药剂或治疗方式,诸如本文描述的那些药剂或治疗方式。
[0535]
用于用途和/或用于治疗对象的“有效量”或“足够量”是指这样的量,其在单剂量或多剂量中,单独地或与一种或多种其他药剂、治疗、规程(protocols)或治疗方案(regimens)联合,对对象提供时间的任何持续期间(暂时性、中期或长期)的可检测反应、任何可测量或可检测程度或达到时间的任何持续期间(例如,持续数小时、数天、数月、数年,在缓解中或治愈后)的期望成果或客观或主观益处。这样的量典型地是在可测量的程度上有效减轻紊乱,或所述紊乱的一种、多种或所有不良症状、后果或并发症,虽然减少或抑制所述紊乱的进展或恶化也被认为是令人满意的成果。
[0536]
如本文使用的,术语“减轻”意指对象的紊乱的改善、所述紊乱的严重程度的降低、所述紊乱的进展或恶化的抑制(例如,使所述紊乱稳定)。就胆汁酸有关或相关紊乱诸如以上描述的那些(包括胆汁淤积症(例如,pbc)、损害胆汁酸的吸收而导致腹泻(例如,bad)和胆汁酸合成异常(例如,nash)的紊乱)而论,改善可以是所述紊乱的一种或多种症状或作用的降低或减少。
[0537]
因此,治疗益处或改善不需要完全消除与紊乱或疾病相关的任何一种、大多数或全部症状、并发症、结果或潜在的病因。因此,在一段时间的持续期间(数小时、数天、数周、数月等)内,当在对象的病症中存在暂时性、中期或长期不断改善,或在所述紊乱或疾病的出现、频率、严重程度、进展或持续期间,或一种或多种相关的不良症状或并发症或结果或潜在的病因、恶化或进展的抑制或逆转(例如,使病症、紊乱或疾病的一种或多种症状或并发症稳定)有部分减少时,就达到了令人满意的终点。
[0538]
因此,就通过本文提供的肽序列可治疗的紊乱而论,或者单独地或者与另外的药剂联用,足以减轻紊乱的肽(和任选地,另外的药剂)的量将取决于紊乱的类型、严重性和严
重程度、或持续期间、所期望的治疗效果或成果,并且可以由技术人员容易地确定。适当的量也将取决于个体对象(例如,对象体内的生物利用度、性别、年龄等)。例如,在对象中正常胆汁酸体内稳态的暂时性或部分恢复可以减少本文描述的肽和药剂的给药量和频次以治疗先前描述的甚至通过治疗未能实现完全消除的胆汁酸有关或相关紊乱。有效量可以例如通过测量一种或多种相关的生理效果来确定。
[0539]
用于治疗对象的本文提供的方法和用途可适用于预防以防止或减少对象的紊乱诸如胆汁酸有关或相关紊乱的可能性。因此,用于治疗患有胆汁酸有关或相关紊乱或处于发生胆汁酸有关或相关紊乱的风险之中的对象的本文提供的方法和用途,可以在另一种可用于治疗或预防胆汁酸有关或相关紊乱的药剂的给药或施药之前、基本上同时或之后实施,和/或可以辅以疗法的其他形式。补充疗法包括其他葡萄糖降低治疗,诸如胰岛素、胰岛素增敏剂和其他药物治疗,膳食中的改变(低糖、低脂等)、减体重手术-(经由胃旁路术、胃切除术减少胃容积)、胃束带术(gastric banding)、胃气球术(gastric balloon)、胃袖状切除术(gastric sleeve)等手术,例如,用于治疗高血糖或胰岛素抵抗紊乱的本文提供的方法和用途可以与在对象中降低葡萄糖或增加胰岛素敏感性的药物或其他药物组合物联合使用。
[0540]
在一个实施方式中,方法和用途包括使对象以对预防胆汁酸有关或相关紊乱有效的量接触或给予一种或多种变异或融合fgf19和/或fgf21肽序列。在一个实施方式中,方法和用途包括使对象以对治疗胆汁酸有关或相关紊乱有效的量接触或给予一种或多种变异或融合fgf19和/或fgf21肽序列。在一个实施方式中,方法和用途包括使对象以对处理胆汁酸有关或相关紊乱有效的量接触或给予一种或多种变异或融合fgf19和/或fgf21肽序列。
[0541]
5.6.1.1 pbc及使用在其治疗或预防中有效的药剂的疗法
[0542]
原发性胆汁性肝硬化(pbc),最常见的胆汁淤积性肝病,是主要由将胆汁酸转运至肝脏外面的胆管的自身免疫性破坏所致的一种进行性肝病。随着该疾病进展,胆汁酸的持久性有毒集结引起以慢性炎症和纤维化为标志的进行性肝脏损伤。因为患有pbc的患者具有hcc的风险增加,所以用本文描述的fgf19肽序列的变异体、fgf19和/或fgf21肽序列的融合体和fgf19和/或fgf21肽序列的融合体(嵌合体)的变异体的疗法具有特别重要的意义,因为这样的序列不诱发或不是实质性地增加hcc形成或hcc肿瘤发生。
[0543]
虽然患有pbc的患者在初步诊断的时间是通常无症状的,但是主要存在或随后发展以下疾病中的一种或多种:瘙痒;乏力;黄疸;黄瘤;与肝外自身免疫性紊乱相关的紊乱(例如,斯耶格伦综合征(syndrome)和类风湿性关节炎);和由肝硬化或门静脉高压所致的并发症(例如,腹水、食管静脉曲张和肝脑病变)。
[0544]
尽管pbc的明确的原因一直未能确认,但是大多数研究人员提出它是一种自身免疫性紊乱。似乎有遗传倾向,遗传研究已经表明il-12发信号级联的一部分(包括il-12a和i-12rb2多态性)在该疾病的病因学中是重要的。
[0545]
诊断pbc尚无明确的手段;反过来说,一般需要对众多因素进行评估。此外,pbc的诊断需要通过排除具有相似症状的其他病症(例如,自身免疫性肝炎和原发性硬化性胆管炎);作为实例,通常进行腹部超声波或ct扫描以排除胆管堵塞。
[0546]
诊断性血液检验包括组合的(deranged)肝功能试验(γ-谷氨酰基转移酶和碱性磷酸酶)和特别的抗体(抗线粒体抗体(ama),一种抗核抗体(ana))的存在。抗核抗体被认为
是pbc的预后指标。当其他试验和手术都预示着pbc时,频繁地进行肝脏活组织检查以确认疾病。内窥镜逆行性胆管胰管造影术(endoscopic retrograde cholangiopancreatography,ercp)(一种胆管内窥镜评价)也可以用来确认疾病。
[0547]
pbc分类为四个阶段,标明疾病的进程。第1期(门脉期)是以门脉炎症和轻度胆管损伤为特征。第2期(围门脉期)是以扩大的三联征(enlarged triads)、门脉周围纤维化或炎症为特征。第3期(隔膜期)是以主动和/或被动的纤维隔为特征。和第4期(胆汁性肝硬化)是以肝脏结节的存在为特征。需要做肝脏活组织检查以确定病期。
[0548]
血清胆红素是pbc进程和预后的一个指标。血清胆红素水平为2
–
6mg/dl的患者的平均生存时间为4.1年,血清胆红素水平为6
–
10mg/dl的患者的平均生存时间为2.1年,和血清胆红素水平超过10mg/dl的患者的平均生存时间为1.4年。肝脏移植是pbc的晚期病例的一个选择,虽然复发率在第5年时可能高达18%,在第10年高达30%。
[0549]
虽然疾病进程可以减慢,但是药物干预与目前使用的疗法在所有患者群体中既无法治愈也没有效果。为了改善药理学疗法的治疗结果,一方面涉及一种或多种当前疗法与fgf19肽序列的变异体、fgf19和/或fgf21肽序列的融合体和fgf19和/或fgf21肽序列的融合体(嵌合体)的变异体联合使用,具有与治疗和/或预防pbc和相关的疾病、紊乱和病症相关的一种或多种活性。对于联合疗法,最常用的和/或最有希望的药剂如下文所述,虽然必须明确这些药剂是说明性的而不是排除性的。
[0550]
pbc治疗最频繁地包括胆汁酸熊去氧胆酸(urosdiol,udca)。udca疗法在pbc患者中有助于减少胆汁淤积并且改善肝功能试验;然而,它未经证明改善症状并且对预后具有有问题的影响。udca已显示降低死亡率、不良事件并且在pbc中移植时有需求。虽然udca被认为是一线疗法,但是大约三分之一的患者可能是无反应的并且仍然处于进行性肝病的风险之中,仍然是替代疗法和相加疗法的候选者。
[0551]
有几种替代疗法和辅助疗法,其中一些目前正在临床开发中,它们可以与本文提供的fgf19肽序列的变异体、fgf19和/或fgf21肽序列的融合体和fgf19和/或fgf21肽序列的融合体(嵌合体)的变异体联合使用,具有与治疗和/或预防pbc和相关的疾病、紊乱和病症相关的一种或多种活性。
[0552]
类法尼醇-x-受体激动剂代表可用于联合疗法的一类很有希望的药剂。fxr(在肝脏和肠中以高水平表达的一种核受体)的激动剂的主要功能之一是抑制胆固醇7α羟化酶-1(cyp7a1),一种自胆固醇合成胆汁酸中的速率-限制酶。奥贝胆酸(obeticholic acid)(oca;intercept pharmaceuticals,ny)是衍生自初级人胆汁酸鹅去氧胆酸即cdca的一种胆汁酸类似物和fxr激动剂。oca目前正在对熊去氧胆酸(ursodiol)具有治疗响应不足或不能耐受熊去氧胆酸的患者进行评价。
[0553]
顶端钠依赖性胆汁酸转运蛋白(asbt)的抑制剂代表另一类可用于与本文描述的fgf19肽序列的变异体、fgf19和/或fgf21肽序列的融合体和fgf19和/或fgf21肽序列的融合体(嵌合体)的变异体组合的药剂组合,用于治疗和/或预防pbc及相关疾病。asbt(由基因slc10a2编码的钠/胆汁盐共转运家族的一个成员)目前认为是肠中胆汁酸再吸收的主要机制。abst抑制剂的实例包括lum001和sc-435,它们二者正在由lumena pharmaceuticals(san diego,ca)开发。
[0554]
胆汁酸螯合剂也用于pbc的治疗。消胆胺和考来替泊(colestipol)是已知的最佳
胆汁酸螯合剂。然而,它们的应用有时受到限制,因为它们仅可以粉剂形式提供并且许多患者不耐受,常常因为树脂粉末的质地和味道较差。胆汁酸螯合剂考来维仑(colesevelam)可以片剂形式提供并且通常耐受良好。所有的胆汁酸螯合剂都能够结合其他化合物,包括脂溶性维生素a、d、e和k,而这些维生素的缺乏许多必需补充。重要的是,pbc患者群体天生对维生素a、d、e和k的脂质依赖性吸收较差,因此服用胆汁酸螯合剂的患者对那些维生素的缺乏来说特别危险。
[0555]
与免疫和炎症功能相关的药剂是与fgf19肽序列的变异体、fgf19和/或fgf21肽序列的融合体和fgf19和/或fgf21肽序列的融合体(嵌合体)的变异体的联合疗法的候选者,其具有与治疗和/或预防pbc及相关的疾病、紊乱和病症的相关的一种或多种活性。
[0556]
白介素il-12与自身免疫力有联系。数据表明il-12发信号途径在导致胆汁性破坏的效应子机制中起到关键性作用。靶向il-12的p40亚基也已显示减轻实验性免疫介导的胆管病变。因此,抗il-12剂(例如,单克隆抗体抑制剂)提供了有希望的治疗。此外,因为cd80中的多态性已经鉴定为赋予对pbc增加的敏感性,所以,使用抗cd80剂通过cd80阻断t细胞和抗原呈递细胞之间的的共刺激可能代表用于治疗pbc的一种重要治疗方法。另外,使用抗cd20抗体利妥昔单抗(rituximab)(rituxan)使igm滴度的改善和肝内调节t细胞数的增加已显示前景广阔。
[0557]
在pbc中,尺寸很小胆管的免疫介导的破坏主要是细胞介导的,特征为表达cxcr3的th1细胞、cd8+t细胞、nk细胞和nkt细胞。因此,抗cxcl10的中和抗体(cxcr3的一种配体)对干扰关键炎症过程之一并且造成pbc中的免疫介导的胆汁性破坏提供了可能性。类似地,在表达cd28的t细胞和表达cd80的抗原呈递细胞之间的共刺激信号的阻断(例如,胆管细胞、分泌抗体的b细胞)对于自身免疫性疾病的治疗可能代表一种重要的方法。
[0558]
本文描述的fgf19肽序列的变异体、fgf19和/或fgf21肽序列的融合体和fgf19和/或fgf21肽序列的融合体(嵌合体)的变异体可以单独使用或者与其他用于治疗和/或预防那些在本文中提及的具有免疫和/或炎症性组分的胆汁酸有关或相关紊乱(包括但不限于pbc及相关的疾病、紊乱和病症)的药剂联合使用。这样的其他药剂的实例包括例如非类固醇抗炎药物(nsaid);类固醇药物;细胞因子抑制的抗炎药物(csaids);抗其他人细胞因子或生长因子(例如,il-2、il-6或pdgf)的抗体或其拮抗剂;tnf拮抗剂(例如,诸如remicade、p75tnfrigg(enbrel)或p55tnfr1gg(lenercept)的药剂);干扰素-β1a(avonex);干扰素-β1b(betaseron);和免疫检查点(checkpoint)抑制剂,包括pd1(包括抗体纳武单抗(nivolumab)和lambrolizumab在内的相关药剂)、pdl1、btla、ctla4(包括全人源化ctla4单克隆抗体伊匹木单抗(ipilimumab)(yervoy)、tim3、lag3和a2ar在内的相关药剂。
[0559]
贝特类已显示改善pbc的各个方面,包括肝功能试验,既作为单一疗法(monotherapy)又与udca非应答者组合。在某些实施方式中,贝特类是选自苯扎贝特(bezafibrate)(bezalip)、环丙贝特(ciprofibrate)(modalim)、吉非贝齐(gemfibrozil)(lopid)、氯贝特(clofibrate)和非诺贝特(fenofibrate)(tricor)的组的一个成员。鱼油表现出相似的益处。
[0560]
在活检时证明有肝炎的某些特征的pbc患者中,皮质类固醇(如布地奈德(budesonide))可改善肝脏组织学和生物化学,特别是当与udca联合使用时。秋水仙碱已显示改善肝功能试验(例如,ast和alp)并且代表对于pbc的另一种替代治疗。
[0561]
虽然不是详尽的清单,但是已显示有前景的其他药物包括甲氨蝶呤(作为免疫调节治疗剂)、硫唑嘌呤、环孢菌素和某些用于抗逆转录病毒疗法的药剂(例如,康比韦(combivir))。
[0562]
各种治疗都存在与pbc相关的后遗症。例如,瘙痒可以通过胆汁酸螯合剂消胆胺来缓解,或者纳曲酮(naltrexone)和利福平(rifampicin)来缓解。与pbc相关的乏力可用莫达非尼(modafinil)(provigil;teva(formerly cephalon))得到有效治疗而对肝脏不造成损害。由于患有pbc的患者与普通人群(和患有肝病的其他人)相比,具有发生骨质疏松症和食管静脉曲张的风险增加,所以对这些并发症的筛查和治疗是pbc处理的一个重要部分。如本文所提供的具有与pbc及相关的疾病、紊乱和病症的治疗和/或预防相关的一种或多种活性的fgf19肽序列的变异体、fgf19和/或fgf21肽序列的融合体和fgf19和/或fgf21肽序列的融合体(嵌合体)的变异体,或者单用或者与其他药剂联用,为这样的后遗症的处理提供了新颖的、有希望的替代药物。
[0563]
5.6.1.2 nash和nafld及使用在其治疗或预防中有效的药剂的疗法
[0564]
非酒精性脂肪性肝炎(nash),被认为是一系列非酒精性脂肪性肝病(nafld)的一部分,引起肝脏中的脂肪组织和纤维组织的炎症和累积。虽然nash的确切原因未知,但是风险因素包括腹部肥胖、2-型糖尿病、胰岛素抵抗(ir)和血脂异常;上述疾病的组合常常描述为代谢综合征。另外,某些药物已经与nash有联系,包括他莫西芬(tamoxifen)、胺碘酮(amiodarone)和类固醇药物(例如,泼尼松(prednisone)和氢化可的松(hydrocortisone))。在美国,非酒精性脂肪性肝病是慢性肝病最常见的原因,nafld的估计患病率为20-30%,而对于nash,据估计在3.5-5%。(参见例如,abrams,g.a.等人,hepatology,2004.40(2):475-83;moreira,r.k.,arch pathol lab med,2007.131(11):1728-34)。
[0565]
nash常常没有明显的症状存在,使其诊断复杂化。肝功能试验一般始于诊断过程,ast(天冬氨酸氨基转移酶)和alt(丙氨酸氨基转移酶)的水平在患有nash的个体中约90%有升高。其他血液试验常用于排除肝病的其他原因,诸如肝炎。影像试验(例如,超声波、ct扫描或mri)可揭示出肝脏中的脂肪累积,但是经常无法将nash和具有相似外观的肝病的其他原因区别开。需要肝脏活组织检查来确诊nash。
[0566]
罹患nash的个体的预后难以预测,虽然肝脏活组织检查中的特征可以是有帮助的。nash的最严重并发症是肝硬化,肝硬化当肝脏变成严重疤痕时发生。据报道,患有nash的个体中有8%~26%发展肝硬化,预测截止2020年,nash将是肝脏移植的首要适应症。
[0567]
目前,nash的治疗主要集中在对与其相关的那些医学病症(包括高脂血症、糖尿病和肥胖症)的药理学和非药理学处理。虽然无法治愈,但是nash本身的药理学干预包括用维生素e、匹格列酮、二甲双胍(metformin)、他汀类(statins)、ω-3脂肪酸和熊去氧胆酸(udca(熊二醇(ursodiol)))治疗。待评价的其他药剂,目前被批准用于不同的适应症,包括氯沙坦(losartan)和替利沙坦(telisartan)、艾塞那肽(exenatide)、glp-1激动剂、dpp iv抑制剂和卡马西平(carbamazepine)。
[0568]
鉴于以上目前疗法的缺陷,用具有不同作用机制的药剂的疗法为nash和nafld的治疗和预防提供了一种有希望的新途径。考虑了解决这样的缺陷,例如,通过使用如本文教导的fgf19肽序列的变异体、fgf19和/或fgf21肽序列的融合体和fgf19和/或fgf21肽序列
的融合体(嵌合体)的变异体。在某些实施方式中,所述肽与其他治疗剂和/或治疗方式联用。本文还提供的是这些fgf19肽序列的变异体、fgf19和/或fgf21肽序列的融合体和fgf19和/或fgf21肽序列的融合体(嵌合体)的变异体的预防和/或治疗用途,或者单独使用或者与将来开发用于治疗或预防nash和nafld的疗法联合使用。
[0569]
5.6.1.3用于治疗或预防其他胆汁酸-有关的紊乱和相关的疾病、紊乱和病症的疗法
[0570]
本文还提供的是具有与治疗和/或预防除pbc以外的其他胆汁酸-有关的紊乱和相关的疾病、紊乱和病症相关的一种或多种活性的fgf19肽序列的变异体、fgf19和/或fgf21肽序列的融合体和fgf19和/或fgf21肽序列的融合体(嵌合体)的变异体的用途。在某些实施方式中,所述肽与其他治疗剂和/或治疗方式联合使用。
[0571]
作为实例,患有克罗恩回肠炎(crohn’s ileitis)继发性胆汁酸性腹泻的患者利用糖皮质激素治疗将有帮助。显微结肠炎通过类固醇药也有帮助。在患有短肠综合征(胆汁酸缺乏在近侧小肠出现,导致受损的胶束增溶)的患者中,胆酰肌氨酸(胆酰基-n-甲基甘氨酸)(一种合成的胆汁酸类似物)已显示增加脂质吸收。
[0572]
初级胆汁酸鹅去氧胆酸(cdca)的给药已显示减少胆汁性胆固醇分泌并且将胆石逐渐溶解。因为cdca有轻微肝毒性,所以它逐渐被熊去氧胆酸(udca)替代。尽管udca给药对于胆固醇性胆石溶解的疗效和安全性,但是因为腹腔镜胆囊切除术的成功,如今其并不经常使用,腹腔镜胆囊切除术对症状性疾病提供了快速治愈。相反,医学疗法需要数月疗法,不总是将胆石溶解,并且以后在有些患者中会逐渐复发。
[0573]
胆汁酸置换用于胆汁酸生物合成的先天性错误,通常利用鹅去氧胆酸(cdca)或熊去氧胆酸(udca)和胆酸的混合物,来抑制细胞毒性胆汁酸前体的合成并恢复初级胆汁酸到肠肝循环的输入。
[0574]
除了以上阐述的药剂和治疗方式以外,也考虑了与许多另外的药剂(及其种类)的联合疗法,包括但不限于:1)胰岛素(例如推注(bolus)和基础类似物)、需要刺激胰岛素分泌的胰岛素模拟物和药剂,包括磺酰脲类(例如,氯磺丙脲(chlorpropamide)、妥拉磺脲(tolazamide)、醋磺己脲(acetohexamide)、甲苯磺丁脲(tolbutamide)、格列本脲(glyburide)、格列美脲(glimepiride)、格列吡嗪(glipizide))和美格列奈类(例如,瑞格列奈(repaglinide)(prandin)和那格列奈(nateglinide)(starlix));2)双胍类(例如,二甲双胍(glucophage))和通过促进葡萄糖利用、减少肝脏的葡萄糖产生和/或消除肠的葡萄糖输出而起作用的其他药剂;3)α-葡萄糖苷酶抑制剂(例如,阿卡波糖和米格列醇)及减慢碳水化合物消化并因此减慢从肠吸收和减少餐后高血糖症的其他药剂;4)噻唑烷二酮类(例如,罗格列酮(avandia)、曲格列酮(rezulin)、匹格列酮(actos)、格列吡嗪(glipizide)、巴格列酮(balaglitazone)、利格列酮(rivoglitazone)、奈格列酮(netoglitazone)、曲格列酮(troglitazone)、恩格列酮(englitazone)、环格列酮(ciglitazone)、阿达格列酮(adaglitazone)、达格列酮(darglitazone)(用以提高胰岛素作用)(例如,通过胰岛素增敏作用),并因此促进周围组织中的葡萄糖利用;5)胰高血糖素样肽,包括dpp-iv抑制剂(例如,维格列汀(vildagliptin)(galvus)和西格列汀(sitagliptin)(januvia))和胰高血糖素样肽-1(glp-1)和glp-1激动剂和类似物(例如,艾塞那肽(exenatide)(byetta和itca 650(置入皮下的在12个月的周期内递送艾塞那肽类似
物的渗透泵;intarcia,boston,ma));6)和dpp-iv-抗性类似物(肠降血糖素(incretin)模拟物)、pparγ激动剂、双重作用ppar激动剂、泛作用ppar激动剂、ptp1b抑制剂、sglt抑制剂、胰岛素促分泌素、rxr激动剂、糖原合酶激酶-3抑制剂、免疫调节剂、β-3肾上腺素能受体激动剂、11β-hsd1抑制剂和胰岛淀粉样多肽类似物。
[0575]
可以在某些实施方式中与本文提供的肽和方法联合使用的其他示例性的药剂包括二肽基肽酶-4(dpp-4)抑制剂、溴隐亭(bromocriptine)制剂(例如,和胆汁酸螯合剂(例如,考来维仑)和sglt-2抑制剂。食欲抑制药物也是众所周知的并且可以与本文提供的组合物和方法联合使用。补充疗法可以在本文提供的方法和用途之前、同时或之后给予。
[0576]
5.6.2预防、治疗和处理代谢紊乱的方法
[0577]
本文还提供的是体外、先体外再体内和体内(例如,在对象身上或体内)方法和用途。这样的方法和用途可以用本文所阐述的肽序列中的任何一种来实施。在各种实施方式中,所述方法包括将肽序列诸如本文公开的fgf19或fgf21变异体、融合体或嵌合体(例如,在序列表或表1中)或本文公开的fgf19或fgf21变异体、融合体或嵌合体的子序列、变异体或修饰形式(例如,序列表或表1)以对治疗代谢紊乱或相关紊乱有效的量给予对象。
[0578]
在某些实施方式中,所述肽与另外的治疗剂和/或治疗方式(例如,可用于治疗和/或预防pbc的药剂)联合给予。所述另外的治疗剂可以在给予本文描述的肽之前、同时或之后给予。
[0579]
本文还提供的是相对于相仿年龄、性别、种族等的恰当匹配的对象预防(例如,在倾向于患上特定紊乱的对象中)、延迟、减慢或抑制代谢紊乱或相关紊乱的进展、发作,或者治疗(例如,减轻)代谢紊乱或相关紊乱的方法。因此,在各种实施方式中,本文提供的用于例如调节胆汁酸体内稳态或治疗代谢紊乱或相关紊乱的方法包括以对调节胆汁酸体内稳态或治疗代谢紊乱或相关紊乱有效的量接触或给予一种或多种本文提供的肽(例如,如序列表或表1中所列出的fgf19和/或fgf21的变异体或融合体)。在某些实施方式中,所述方法还包括接触或给予至少一种另外的可用于治疗或预防代谢紊乱或相关紊乱(例如,pbc)的治疗剂或治疗方式。
[0580]
术语“对象”是指动物。典型地,所述动物是将受益于用本文提供的肽序列治疗的哺乳动物。具体的实例包括灵长类动物(例如,人类)、狗、猫、马、牛、猪和羊。
[0581]
对象包括患有紊乱(例如,代谢紊乱或相关紊乱)的那些或不患有紊乱但可能处于发生所述紊乱的风险之中的对象。
[0582]
用本文提供的肽制剂、方法及其用途可预防、可治疗或可处理的非限制性的示例性紊乱或病症包括代谢疾病和紊乱。疾病和紊乱的非限制性实例包括:代谢综合征;脂质-或葡萄糖-相关紊乱;胆固醇或甘油三酯代谢;2型糖尿病;胆汁淤积症,包括例如肝内胆汁淤积的疾病(例如,pbc、pfic、psc、pic、新生儿胆汁淤积症和药物诱发的胆汁淤积症(例如,雌激素)),及肝外胆汁淤积的疾病(例如,肿瘤所致的胆汁切向压缩、胆结石所致的胆管堵塞);胆汁酸吸收不良和累及远端小肠的其他紊乱,包括回肠切除、炎症性肠疾病(例如,克罗恩氏病和溃疡性结肠炎),损害胆汁酸的吸收(不另表征(特发性的))而导致腹泻(例如,bad)和gi症状的紊乱,以及gi、肝脏和/或胆汁性癌症(例如,结肠癌和肝细胞癌);和/或胆汁酸合成异常,诸如促进nash、肝硬化和门静脉高压的那些。对于治疗,本文提供的肽序列可以给予需要调节胆汁酸体内稳态或患有胆汁酸有关或相关紊乱的对象。本文提供的肽序
列也可以用于其他高血糖相关紊乱,包括肾损伤(例如,肾小管损伤或肾病变)、肝脏变性、眼损伤(例如,糖尿病性视网膜病变或白内障)和糖尿病足紊乱;血脂异常及其后遗症,诸如,例如,动脉粥样硬化、冠状动脉疾病、脑血管紊乱等。
[0583]
可能与代谢综合征相关的其他病症,诸如肥胖症和升高的体重质量(包括其共同病态病症,例如但不限于非酒精性脂肪性肝病(nafld)、非酒精性脂肪性肝炎(nash)和多囊卵巢综合征(pcos)),并且也包括血栓形成、高凝状态及血栓前状态(动脉和静脉)、高血压(包括门静脉高压(定义为肝脏的静脉压力梯度(hvpg)大于5mm hg)、心血管疾病、中风与心力衰竭;其中涉及炎症反应的紊乱或病症,包括动脉粥样硬化、慢性炎症性肠疾病(例如,克罗恩氏病和溃疡性结肠炎)、哮喘、红斑狼疮、关节炎或其他炎症性风湿性紊乱;细胞周期或细胞分化过程的紊乱,诸如脂肪细胞肿瘤、脂肪瘤性癌,包括例如脂肪肉瘤、实体肿瘤和赘生物;神经变性性疾病和/或中枢神经系统和周围神经系统的脱髓鞘紊乱和/或涉及神经炎症过程的神经科疾病和/或其他外周神经病变,包括阿尔茨海默氏病、多发性硬化、帕金森氏病、进行性多病灶脑白质病变和格林-巴利综合征;皮肤和皮肤科紊乱和/或伤口愈合过程的紊乱,包括红斑-鳞状皮肤病;和其他紊乱,诸如x综合征、骨关节炎和急性呼吸窘迫综合征。
[0584]
在一个实施方式中,对象患有高血糖症(例如,糖尿病,诸如胰岛素依赖性(i型)糖尿病、ii型糖尿病或妊娠期糖尿病)、胰岛素抵抗、高胰岛素血症、葡萄糖不耐症或代谢综合征,是肥胖的和/或具有不理想的体重质量。
[0585]
在所述方法和用途的多个特别的方面,将本文提供的肽序列或嵌合肽序列以对在对象中改善葡萄糖代谢有效的量给予对象。在多个更特别的方面,给药前,对象的空腹血浆葡萄糖水平大于100mg/dl或血红蛋白a1c(hba1c)水平超过6%。
[0586]
在进一步的实施方式中,对象的治疗用途或治疗方法旨在或导致葡萄糖水平降低、胰岛素敏感性增加、胰岛素抵抗降低、胰高血糖素降低、葡萄糖耐量或葡萄糖代谢或体内稳态的改善、胰腺功能改善或甘油三酯、胆固醇、idl、ldl或vldl水平降低或血压下降、血管内膜增厚的减少或身体质量或体重增加的减少。
[0587]
代谢紊乱或相关紊乱(例如,高血糖症)的治疗可能具有缓解或消除其继发性紊乱的益处。作为实例,罹患高血糖症的对象也可能患有高血糖症所致的抑郁症或焦虑症;因此,治疗所述对象的高血糖症也可能间接地治疗了所述抑郁症或焦虑症。本文公开的靶向这样的继发性紊乱的疗法的用途也在某些实施方式中予以考虑。
[0588]
在特别的实施方式中,所述对象患有高血糖症或处于患上高血糖症的风险之中。在其他特别的实施方式中,所述对象患有糖尿病(诸如2型糖尿病)或处于患上糖尿病(诸如2型糖尿病)的风险之中。
[0589]
处于发生代谢紊乱或相关紊乱(诸如以上描述的紊乱)的风险之中的对象包括例如可能具有发生这类紊乱的家族史或遗传倾向的那些,以及其膳食可能促进发生这类紊乱的那些。
[0590]
如本文所公开的,治疗方法包括在对象中以达到所需成果或结果有效的量接触或给予如本文所阐述的肽(例如,如序列表或表1中所列出的fgf19和/或fgf21的变异体或融合体)。导致所需成果或结果的治疗包括在所述对象中降低、减少或预防所述病症的一种或多种症状的严重程度或频率,例如所述对象的病症中的改善,或“有益效果”或“治疗效果”。
因此,治疗可以降低或减少或预防所述紊乱的一种或多种症状的严重程度或频率,稳定所述紊乱或抑制所述紊乱的进展或恶化,和在有些情况下,使所述紊乱逆转,暂时性地(例如,持续1-6、6-12或12-24小时),持续中期(例如,持续1-6、6-12、12-24或24-48天)或长期(例如,持续1-6、6-12、12-24、24-48周或超过24-48周)。因此,就代谢紊乱或相关紊乱而论,治疗可以降低或减少以上描述的代谢紊乱或相关紊乱的一种或多种症状或作用。
[0591]
在某些实施方式中,本文提供的各种方法还包括在对象中以对达到所需成果或结果有效的量接触或给予可用于治疗或预防代谢紊乱或相关紊乱的一种或多种另外的药剂或治疗方式,诸如本文描述的那些药剂或治疗方式。
[0592]
用于用途和/或用于治疗对象的“有效量”或“足够量”是指这样的量,其在单剂量或多剂量中,单独地或与一种或多种其他药剂、治疗、规程(protocols)或治疗方案(regimens)联合,对对象提供时间的任何持续期间(暂时性、中期或长期)的可检测反应、任何可测量或可检测程度或达到时间的任何持续期间(例如,持续数小时、数天、数月、数年,在缓解中或治愈后)的期望成果或客观或主观益处。这样的量典型地是在可测量的程度上有效减轻紊乱,或所述紊乱的一种、多种或所有不良症状、后果或并发症,虽然减少或抑制所述紊乱的进展或恶化也被认为是令人满意的成果。
[0593]
如本文使用的,术语“减轻”意指对象的紊乱的改善、所述紊乱的严重程度的降低或所述紊乱的进展或恶化的抑制(例如,使所述紊乱稳定)。就代谢紊乱或相关紊乱诸如以上描述的那些而论,改善可以是所述紊乱的一种或多种症状或作用的降低或减少。
[0594]
因此,治疗益处或改善不需要完全消除与所述紊乱或疾病相关的任何一种、大多数或全部症状、并发症、结果或潜在的病因。因此,在一段时间的持续期间(数小时、数天、数周、数月等)内,当在对象的病症中存在暂时性、中期或长期不断改善,或在所述紊乱或疾病的出现、频率、严重程度、进展或持续期间,或一种或多种相关的不良症状或并发症或结果或潜在的病因、恶化或进展的抑制或逆转(例如,使病症、紊乱或疾病的一种或多种症状或并发症稳定)有部分减少时,就达到了令人满意的终点。
[0595]
因此,就通过本文提供的肽序列可治疗的紊乱而论,或者单独地或者与另外的药剂联用,足以减轻紊乱的肽(和任选地,另外的药剂)的量将取决于紊乱的类型、严重性和严重程度、或持续期间、所期望的治疗效果或成果,并且可以由技术人员容易地确定。适当的量也将取决于个体对象(例如,对象体内的生物利用度、性别、年龄等)。例如,在对象中正常胆汁酸体内稳态的暂时性或部分恢复可以减少本文描述的肽和药剂的给药量和频次以治疗先前描述的甚至通过治疗未能实现完全消除的代谢紊乱或相关紊乱。有效量可以例如通过测量一种或多种相关的生理效果来确定。
[0596]
用于治疗对象的本文提供的方法和用途可适用于预防以防止或减少对象的紊乱诸如代谢紊乱或相关紊乱的可能性。因此,用于治疗患有代谢紊乱或相关紊乱或处于发生代谢紊乱或相关紊乱的风险之中的对象的本文提供的方法和用途,可以在另一种可用于治疗或预防代谢紊乱或相关紊乱的药剂的给药或施药之前、基本上同时或之后实施,和/或可以辅以疗法的其他形式。补充疗法包括其他葡萄糖降低治疗,诸如胰岛素、胰岛素增敏剂和其他药物治疗,膳食中的改变(低糖、低脂等)、减体重手术-(经由胃旁路术、胃切除术减少胃容积)、胃束带术、胃气球术、胃袖状切除术等手术,例如,用于治疗高血糖或胰岛素抵抗紊乱的本文提供的方法和用途可以与在对象中降低葡萄糖或增加胰岛素敏感性的药物或
其他药物组合物联合使用。
[0597]
在一个实施方式中,方法和用途包括在对象中以对预防代谢紊乱或相关紊乱有效的量接触或给予一种或多种变异或融合fgf19和/或fgf21肽序列。在一个实施方式中,方法和用途包括以在对象中对治疗代谢紊乱或相关紊乱有效的量接触或给予一种或多种变异或融合fgf19和/或fgf21肽序列。在一个实施方式中,方法和用途包括在对象中以对处理代谢紊乱或相关紊乱有效的量接触或给予一种或多种变异或融合fgf19和/或fgf21肽序列。
[0598]
5.6.3预防、治疗和处理癌症的方法
[0599]
本文还提供的是体外、先体外再体内和体内(例如,在对象身上或体内)方法和用途。这样的方法和用途可以用本文所阐述的肽序列中的任何一种来实施。在各种实施方式中,所述方法包括将肽序列诸如本文公开的fgf19或fgf21变异体、融合体或嵌合体(例如,在序列表或表1中)或本文公开的fgf19或fgf21变异体、融合体或嵌合体的子序列、变异体或修饰形式(例如,序列表或表1)以对治疗癌症、肿瘤或相关紊乱有效的量给予对象。
[0600]
在某些实施方式中,所述肽与另外的治疗剂和/或治疗方式(例如,可用于治疗和/或预防pbc的药剂)联合给予。所述另外的治疗剂可以在给予本文描述的肽之前、同时或之后给予。
[0601]
本文还提供的是相对于相仿年龄、性别、种族等的恰当匹配的对象预防(例如,在倾向于患上特定紊乱的对象中)、延迟、减慢或抑制癌症、肿瘤或相关紊乱的进展、发作,或者治疗(例如,减轻)癌症、肿瘤或相关紊乱的方法。因此,在各种实施方式中,本文提供的用于例如预防或治疗癌症、肿瘤或相关紊乱的方法包括以对预防或治疗癌症、肿瘤或相关紊乱有效的量接触或给予一种或多种本文提供的肽(例如,如序列表或表1中所列出的fgf19和/或fgf21的变异体或融合体)。在某些实施方式中,所述方法还包括接触或给予至少一种另外的可用于治疗或预防癌症、肿瘤或相关紊乱(例如,pbc)的治疗剂或治疗方式。
[0602]
术语“对象”是指动物。典型地,所述动物是将受益于用本文提供的肽序列治疗的哺乳动物。具体的实例包括灵长类动物(例如,人类)、狗、猫、马、牛、猪和羊。
[0603]
对象包括患有紊乱(例如,癌症、肿瘤或相关紊乱)的那些或不患有紊乱但可能处于发生所述紊乱的风险之中的对象。
[0604]
用本文提供的肽制剂、方法及其用途可预防、可治疗或可处理的非限制性的示例性紊乱或病症包括癌症、肿瘤及相关的疾病和紊乱。疾病和紊乱的非限制性实例包括:
[0605]
在某些实施方式中,所述癌症或肿瘤是结肠肿瘤或肝脏的肿瘤。
[0606]
癌症、肿瘤或相关紊乱的治疗可能具有缓解或消除其继发性紊乱的益处。作为实例,罹患癌症或肿瘤的对象可能也患有因所述癌症或肿瘤所致的抑郁症或焦虑症;因此,治疗所述对象的癌症或肿瘤也可能间接地治疗所述抑郁症或焦虑症。本文公开的靶向这样的继发性紊乱的疗法的用途也在某些实施方式中予以考虑。
[0607]
处于发生癌症、肿瘤或相关紊乱(诸如以上描述的紊乱)的风险之中的对象包括例如可能具有发生这类紊乱的家族史或遗传倾向的那些,以及其膳食可能促进发生这类紊乱的那些。
[0608]
在有些实施方式中,所述癌症或肿瘤是肝脏、结肠、前列腺或肺部的癌症或肿瘤。在有些实施方式中,所述癌症或肿瘤是良性的。在其他的实施方式中,所述癌症或肿瘤是恶性的。
[0609]
在某些实施方式中,所述对象患有fgf19依赖性疾病、紊乱或病症或处于发生fgf19依赖性疾病、紊乱或病症的风险之中。在有些实施方式中,所述fgf19依赖性疾病、紊乱或病症是肝脏(肝细胞)疾病、紊乱或病症,诸如肝硬化或胆汁淤积症。在有些实施方式中,所述肝脏疾病或紊乱是慢性肝脏疾病或紊乱。在有些实施方式中,所述fgf19依赖性疾病、紊乱或病症是癌症或肿瘤,诸如hcc。在其他的实施方式中,所述fgf19依赖性疾病、紊乱或病症不是肝脏疾病、紊乱或病症,诸如肝硬化或胆汁淤积症。在有些实施方式中,所述fgf19依赖性疾病、紊乱或病症不是癌症或肿瘤,诸如hcc。在有些实施方式中,所述fgf19依赖性疾病、紊乱或病症是结肠癌或肿瘤。在某些实施方式中,所述结肠癌或肿瘤是结肠腺癌。在有些实施方式中,所述fgf19依赖性疾病、紊乱或病症是前列腺癌或肿瘤。在还有其他的实施方式中,所述fgf19依赖性疾病、紊乱或病症是肺癌或肿瘤。在某些实施方式中,所述肺癌或肿瘤是肺鳞状细胞癌。在有些实施方式中,fgf19是在原发生或转移性癌症或肿瘤细胞中表达。在某些实施方式中,所述fgf19依赖性疾病、紊乱或病症是前驱癌症的。例如,肝硬化和胆汁淤积症(有时会导致肝癌,诸如hcc),以及治疗或预防这类肝脏疾病和紊乱的方法均予以考虑。在某些实施方式中,所述对象是需要其预防或治疗的对象。在有些实施方式中,所述fgf19变异体的给药在所述对象中维持胆汁酸体内稳态。
[0610]
本文还提供的是治疗对象的癌症或肿瘤(诸如fgf19依赖性癌症或肿瘤)或其症状的方法,包括向所述对象给予治疗有效量的fgf19变异体。在某些实施方式中,所述给药导致在所述对象中所述癌症、肿瘤或其症状的改善。在有些实施方式中,所述方法导致肿瘤数量、肿瘤大小或肿瘤重量的降低。本文还提供的是预防对象的癌症或肿瘤(诸如fgf19依赖性癌症或肿瘤)或其症状的方法,包括向所述对象给予治疗有效量的fgf19变异体。在有些实施方式中,所述给药导致在所述对象中所述癌症、肿瘤或其症状的预防。在有些实施方式中,所述方法导致肿瘤数量、肿瘤大小或肿瘤重量的降低。在一个具体的实施方式中,所述癌症或肿瘤是fgf19依赖性癌症或肿瘤。在某些实施方式中,所述癌症或肿瘤是肝细胞癌。在有些实施方式中,所述癌症或肿瘤不是肝细胞癌。在一个实施方式中,所述癌症或肿瘤是结肠癌或肿瘤。在有些实施方式中,所述癌症或肿瘤是前列腺癌或肿瘤。在某些实施方式中,所述癌症或肿瘤是肺癌或肿瘤。在某些实施方式中,所述fgf19变异体是包含seq id no:70中所阐述的氨基酸序列的多肽。在有些实施方式中,所述fgf19变异体是由seq id no:70中所阐述的氨基酸序列组成的多肽。在某些实施方式中,所述对象是有其需要的对象。
[0611]
如本文所公开的,治疗方法包括在对象中以达到所需成果或结果有效的量接触或给予如本文所阐述的肽(例如,如序列表或表1中所列出的fgf19和/或fgf21的变异体或融合体)。导致所需成果或结果的治疗包括在所述对象中降低、减少或预防所述病症的一种或多种症状的严重程度或频率,例如所述对象的病症中的改善,或“有益效果”或“治疗效果”。因此,治疗可以降低或减少或预防所述紊乱的一种或多种症状的严重程度或频率,稳定所述紊乱或抑制所述紊乱的进展或恶化,和在有些情况下,使所述紊乱逆转,暂时性地(例如,持续1-6、6-12或12-24小时),持续中期(例如,持续1-6、6-12、12-24或24-48天)或长期(例如,持续1-6、6-12、12-24、24-48周或超过24-48周)。因此,就癌症、肿瘤或相关紊乱而论,治疗可以降低或减少以上描述的癌症、肿瘤或相关紊乱的一种或多种症状或作用。
[0612]
在某些实施方式中,本文提供的各种方法还包括在对象中以对达到所需成果或结
果有效的量接触或给予可用于治疗或预防癌症、肿瘤或相关紊乱的一种或多种另外的药剂或治疗方式,诸如本文描述的那些药剂或治疗方式。
[0613]
用于用途和/或用于治疗对象的“有效量”或“足够量”是指这样的量,其在单剂量或多剂量中,单独地或与一种或多种其他药剂、治疗、规程(protocols)或治疗方案(regimens)联合,对对象提供时间的任何持续期间(暂时性、中期或长期)的可检测反应、任何可测量或可检测程度或达到时间的任何持续期间(例如,持续数小时、数天、数月、数年,在缓解中或治愈后)的期望成果或客观或主观益处。这样的量典型地是在可测量的程度上有效减轻紊乱,或所述紊乱的一种、多种或所有不良症状、后果或并发症,虽然减少或抑制所述紊乱的进展或恶化也被认为是令人满意的成果。
[0614]
如本文使用的,术语“减轻”意指对象的紊乱的改善、所述紊乱的严重程度的降低或所述紊乱的进展或恶化的抑制(例如,使所述紊乱稳定)。就癌症、肿瘤或相关紊乱诸如以上描述的那些而论,改善可以是所述紊乱的一种或多种症状或作用的降低或减少。
[0615]
因此,治疗益处或改善不需要完全消除与所述紊乱或疾病相关的任何一种、大多数或全部症状、并发症、结果或潜在的病因。因此,在一段时间的持续期间(数小时、数天、数周、数月等)内,当在对象的病症中存在暂时性、中期或长期不断改善,或在所述紊乱或疾病的出现、频率、严重程度、进展或持续期间,或一种或多种相关的不良症状或并发症或结果或潜在的病因、恶化或进展的抑制或逆转(例如,使病症、紊乱或疾病的一种或多种症状或并发症稳定)有部分减少时,就达到了令人满意的终点。
[0616]
因此,就通过本文提供的肽序列可治疗的紊乱而论,或者单独地或者与另外的药剂联用,足以减轻紊乱的肽(和任选地,另外的药剂)的量将取决于紊乱的类型、严重性和严重程度、或持续期间、所期望的治疗效果或成果,并且可以由技术人员容易地确定。适当的量也将取决于个体对象(例如,对象体内的生物利用度、性别、年龄等)。例如,在对象中正常胆汁酸体内稳态的暂时性或部分恢复可以减少本文描述的肽和药剂的给药量和频次以治疗先前描述的甚至通过治疗未能实现完全消除的癌症、肿瘤或相关紊乱。有效量可以例如通过测量一种或多种相关的生理效果来确定。
[0617]
用于治疗对象的本文提供的方法和用途可适用于预防以防止或减少对象的紊乱诸如癌症、肿瘤或相关紊乱的可能性。因此,用于治疗患有癌症、肿瘤或相关紊乱或处于发生癌症、肿瘤或相关紊乱的风险之中的对象的本文提供的方法和用途,可以在另一种可用于治疗或预防癌症、肿瘤或相关紊乱的药剂的给药或施药之前、基本上同时或之后实施,和/或可以辅以疗法的其他形式。补充疗法包括其他葡萄糖降低治疗,诸如胰岛素、胰岛素增敏剂和其他药物治疗,膳食中的改变(低糖、低脂等)、减体重手术-(经由胃旁路术、胃切除术减少胃容积)、胃束带术、胃气球术、胃袖状切除术等手术,例如,用于治疗高血糖或胰岛素抵抗紊乱的本文提供的方法和用途可以与在对象中降低葡萄糖或增加胰岛素敏感性的药物或其他药物组合物联合使用。
[0618]
在一个实施方式中,方法和用途包括在对象中以对预防癌症、肿瘤或相关紊乱有效的量接触或给予一种或多种变异或融合fgf19和/或fgf21肽序列。在一个实施方式中,方法和用途包括在对象中以对治疗癌症、肿瘤或相关紊乱有效的量接触或给予一种或多种变异或融合fgf19和/或fgf21肽序列。在一个实施方式中,方法和用途包括在对象中以对处理癌症、肿瘤或相关紊乱有效的量接触或给予一种或多种变异或融合fgf19和/或fgf21肽序
列。
[0619]
5.7核酸分子
[0620]
还提供的是编码本文提供的肽序列(包括在序列表中(和在pct公开号wo 2013/006486和美国公开号2013/0023474,以及pct公开号wo 2014/085365中)或在表1中列举出的序列的子序列、序列变异体和修饰形式)的核酸分子,及包括编码在本文描述的方法中使用的肽的核酸的载体。因此,“核酸”包括编码所例示的本文公开的肽序列的那些,以及编码所例示的肽序列的功能性子序列、序列变异体和修饰形式的那些,只要上述肽序列至少保留可用于治疗或预防胆汁酸有关或相关紊乱(例如,pbc)的可检测或可测量的活性或功能。
[0621]
核酸,在本文中也可以被称为基因、多核苷酸、核苷酸序列、引物、寡核苷酸或探针,是指任何长度的天然或修饰的含有嘌呤和嘧啶的多聚体,或为多聚核糖核苷酸或为多聚脱氧核糖核苷酸或混合的多聚核糖-多聚脱氧核糖核苷酸及其α-端基异构形式(α-anomeric form)。两种或更多种含有嘌呤和嘧啶的多聚体典型地通过磷酸酯键或其类似物连接。这些术语可互换使用,是指核酸的所有形式,包括脱氧核糖核酸(dna)和核糖核酸(rna)。这些核酸可以是单链的、双链的或三链的,线性的或环状的。核酸包括基因组dna和cdna。rna核酸可以是剪接的或未剪接的mrna、rrna、trna或反义的。核酸包括天然存在的、合成的以及核苷酸类似物和衍生物。
[0622]
作为遗传密码的简并性的结果,本文提供的核酸分子包括对编码在本文提供的方法中可使用的肽序列的核酸分子来说简并的序列。因此,提供编码肽序列包括在本文中所例示的子序列、变异体和修饰形式(例如,在序列表或表1中)的简并核酸序列。术语“互补的”,当提及核酸序列使用时,意指被提及的区域是100%互补的,即表现出100%碱基配对而没有错配。
[0623]
核酸可以使用多种已知的标准克隆方法和化学合成方法来产生,并且可以通过本领域技术人员已知的定点诱变或其他重组技术有意地改变。多核苷酸的纯度可以通过例如测序、凝胶电泳和紫外分光光度法(uv spectrometry)确定。
[0624]
核酸可以插入到核酸构建体中,其中核酸的表达受到“表达控制元件”(在本文中称为“表达盒(expression cassette)”)的影响或调控。术语“表达控制元件”是指调控或影响与其操作性连接的核酸序列的表达的一个或多个核酸序列元件。表达控制元件可以包括(视情况而定)启动子、增强子、转录终止子、基因沉默子、起始密码子(例如,atg)(位于蛋白质编码基因前),等等。
[0625]
与核酸序列操作性连接的表达控制元件控制核酸序列的转录,并且在适当的时候,控制核酸序列的翻译。术语“操作性连接的(operatively linked)”是指其中被提及组分处于允许它们以其预定方式发挥功能的一种关系的并列(juxtaposition)。典型地,表达控制元件并置于基因的5’或3’末端,但也可以是内含子的(intronic)。
[0626]
表达控制元件包括组成性地激活转录的元件,其是可诱导的(即,需要外部信号或刺激才能活化)或是去阻抑的(即,需要关闭转录的信号,当该信号不再存在时,转录被激活或“被去阻抑”)。在本文提供的表达盒中所包括的还有足以使基因表达控制在特定细胞类型或组织的控制元件(即,组织特异性控制元件)。典型地,这样的元件位于编码序列的上游或下游(即,5’或3’)。启动子一般位于编码序列的5’。启动子(其可通过重组dna或合成技术产生)可以用于提供本文提供的多核苷酸的转录。“启动子”典型地意指足以指导转录的最
小序列元件。
[0627]
核酸可以插入到质粒中,用于转化到宿主细胞中并且用于后续表达和/或遗传操作。质粒是可以在宿主细胞中稳定地繁殖的一种核酸;质粒可任选地含有表达控制元件以便驱动核酸的表达。如本文使用的,载体与质粒是同义的。质粒和载体一般至少含有复制起点(用于在细胞中繁殖)和启动子。质粒和载体也可以包括用于在宿主细胞中表达的表达控制元件,并且因此,例如,可用于编码肽序列的核酸的表达和/或遗传操作,在宿主细胞和生物体中表达肽序列,或产生肽序列。
[0628]
如本文使用的,术语“转基因”意指通过人工方法(artifice)导入到细胞或生物体中的多核苷酸。例如,在具有转基因的细胞中,转基因已通过细胞的遗传操作或“转化”而导入。导入了转基因的细胞或其后代被称为“转化的细胞”或“转化体”。典型地,转基因包括在转化体的后代中或者变成由细胞发育而来的生物体的一部分。转基因可以插入到染色体dna中或者作为自我复制质粒、yac、微型染色体等维持下来。
[0629]
细菌系统启动子包括t7和诱导型启动子,诸如噬菌体λ的pl、plac、ptrp、ptac(ptrp-lac杂合启动子)和四环素应答的启动子。昆虫细胞系统启动子包括组成型或诱导型启动子(例如,蜕皮素)。哺乳动物细胞组成型启动子包括sv40、rsv、牛乳头状瘤病毒(bpv)和其他病毒启动子;或来源于哺乳动物细胞的基因组的诱导型启动子(例如,金属硫蛋白iia启动子;热休克启动子)或来源于哺乳动物病毒的诱导型启动子(例如,腺病毒晚期启动子;诱导型小鼠乳腺肿瘤病毒长末端重复序列)。备选地,逆转录病毒的基因组可以经过遗传修饰用于导入到合适的宿主细胞中并且指导肽序列在其中的表达。
[0630]
因为本文提供的方法和用途包括体内递药,因此表达系统还包括设计用于体内使用的载体。特别的非限制性实例包括腺病毒载体(美国专利号5,700,470和5,731,172)、腺相关载体(美国专利号5,604,090)、单纯疱疹病毒载体(美国专利号5,501,979)、逆转录病毒的载体(美国专利号5,624,820、5,693,508和5,674,703)、bpv载体(美国专利号5,719,054)、cmv载体(美国专利号5,561,063)和细小病毒、轮状病毒、诺瓦克病毒(norwalk virus)和慢病毒载体(参见例如,美国专利号6,013,516)。载体包括将基因递送到肠道的细胞的那些,包括干细胞(croyle等人,gene ther.5:645(1998);s.j.henning,adv.drug deliv.rev.17:341(1997),美国专利号5,821,235和6,110,456)。这些载体中的许多已被批准用于人类研究。
[0631]
酵母载体包括组成型和诱导型启动子(参见例如,ausubel等人,in:current protocols in molecular biology,第2卷,第13章,greene publish.assoc.& wiley interscience,1988;grant等人,methods in enzymology,153:516(1987),eds.wu & grossman;bitter methods in enzymology,152:673(1987),eds.berger & kimmel,acad.press,n.y.;和strathern等人,the molecular biology of the yeast saccharomyces(1982)eds.cold spring harbor press,第i卷和第ii卷)。组成型酵母启动子(诸如adh或leu2)或诱导型启动子(诸如gal)都可以使用(r.rothstein in:dna cloning,a practical approach,第11卷,第3章,ed.d.m.glover,irl press,wash.,d.c.,1986)。促进外源核酸序列例如通过同源重组方法整合到酵母染色体中的载体是本领域已知的。酵母人工染色体(yac)典型地当所插入的多核苷酸对于更常规载体来说太大(例如,大于约12kb)使用。
[0632]
表达载体也可以含有对选择压力赋予抗性的选择标记或识别标记(例如,β-半乳糖苷酶),从而使得具有载体的细胞根据生长和扩增而被选择。或者,选择标记可以在第二载体上,第二载体与含有编码肽序列的核酸的第一载体一起共转染到宿主细胞中。选择系统包括但不限于单纯疱疹病毒胸苷激酶基因(wigler等人,cell 11:223(1977))、次黄嘌呤-鸟嘌呤磷酸核糖基转移酶基因(szybalska等人,proc.natl.acad.sci.usa 48:2026(1962))和腺嘌呤磷酸核糖基转移酶(lowy等人,cell 22:817(1980))基因,它们可分别用于tk-、hgprt-或aprt-细胞中。另外,抗代谢物抗性可以用作对以下基因选择的基础:dhfr基因,其对甲氨蝶呤赋予抗性(o’hare等人,proc.natl.acad.sci.usa 78:1527(1981));gpt基因,其对霉酚酸(mycophenolic acid)赋予抗性(mulligan等人,proc.natl.acad.sci.usa 78:2072(1981));新霉素基因,其对氨基糖苷g-418赋予抗性(colberre-garapin等人,j.mol.biol.150:1(1981));嘌呤霉素(puromycin);和潮霉素(hygromycin)基因,其对潮霉素赋予抗性(santerre等人,gene 30:147(1984))。另外的选择基因包括trpb,其允许细胞利用吲哚代替色氨酸;hisd,其允许细胞利用组氨醇(histinol)代替组氨酸(hartman等人,proc.natl.acad.sci.usa 85:8047(1988));和odc(鸟氨酸脱羧酶),其对鸟氨酸脱羧酶抑制剂2-(二氟甲基)-dl-鸟氨酸dfmo赋予抗性(mcconlogue(1987)in:current communications in molecular biology,cold spring harbor laboratory)。
[0633]
5.8细胞系和动物模型
[0634]
在某些实施方式中,还提供的是产生如本文所阐述的fgf19和/或fgf21的变异体或融合体的转化细胞(在体外(in vitro)、先体外再体内(ex vivo)和体内(in vivo))和宿主细胞,其中fgf19和/或fgf21的变异体或融合体的表达由编码fgf19和/或fgf21的变异体或融合体的核酸所赋予。如本文使用的,“转化细胞”或“宿主细胞”是其中导入了可以繁殖和/或转录以表达所编码肽序列的核酸的细胞。该术语也包括宿主细胞的任何后代或亚克隆。表达本文提供的肽序列的转化细胞和宿主细胞典型地包括编码所述肽序列的核酸。在一个实施方式中,转化细胞或宿主细胞是原核细胞。在另一个实施方式中,转化细胞或宿主细胞是真核细胞。在各个方面,所述真核细胞是酵母或哺乳动物(例如,人类、灵长类动物等)细胞。
[0635]
转化细胞和宿主细胞包括但不限于微生物诸如细菌和酵母;和植物细胞、昆虫细胞和哺乳动物细胞。例如,用重组的噬菌体核酸、质粒核酸或粘粒核酸表达载体转化的细菌;用重组酵母表达载体转化的酵母;用重组病毒表达载体(例如,花椰菜花叶病毒,camv;烟草花叶病毒,tmv)感染的或用重组质粒表达载体(例如,ti质粒)转化的植物细胞系统;用重组病毒表达载体(例如,杆状病毒)感染的昆虫细胞系统;和用重组病毒表达载体(例如,逆转录酶病毒、腺病毒、痘苗病毒)感染的动物细胞系统或经工程改造以瞬时或稳定繁殖或表达的转化动物细胞系统。
[0636]
对于基因疗法的用途和方法,转化细胞可以是在对象体内。对象体内的细胞可以用编码如本文所阐述的肽序列的核酸在体内转化。备选地,细胞可以用转基因或多核苷酸在体外转化并且然后将其移植到对象的组织中以便实施治疗。备选地,原代细胞分离物或已建立的细胞系可以用编码fgf19和/或fgf21的变异体或其融合/嵌合序列(或变异体)(诸如嵌合肽序列,包括fgf19的全部或一部分或者包括fgf21的全部或一部分)的转基因或多
核苷酸转化,并且然后任选地移植到对象的组织中。
[0637]
用于肽序列的表达、特别是用于体内表达的非限制性靶细胞包括胰腺细胞(胰岛细胞)、肌肉细胞、粘膜细胞和内分泌细胞。这样的内分泌细胞可以提供fgf19和/或fgf21的变异体或其融合/嵌合序列(或变异体)(诸如嵌合肽序列,包括fgf19的全部或一部分或者包括fgf21的全部或一部分)的可诱导产生(分泌)。用于转化的另外的细胞包括干细胞或其他多能(multipotent)或多潜能(pluripotent)细胞,例如分化成各种胰腺细胞(胰岛细胞)、肌肉细胞、粘膜细胞和内分泌细胞的祖细胞。靶向干细胞提供本文提供的肽序列的更长期表达。
[0638]
如本文使用的,术语“培养的”,当提及细胞使用时,意指细胞在体外生长。这样的细胞的一个特别的实例是从对象中分离的、在组织培养物中生长的并且适应在组织培养物中生长的细胞。另一个实例是经过在体外遗传操作并且再移植到相同或不同对象体内的细胞。
[0639]
术语“分离的”,当提及细胞使用时,意指从其天然存在的体内环境中分离的细胞。“培养的”和“分离的”细胞可以通过人工操作,诸如遗传转化。这些术语包括所述细胞的任何后代,包括由于在细胞分裂期间发生的突变所致的可能与亲代细胞不完全相同的后代细胞。该术语不包括完整的人体。
[0640]
可以导入编码本文提供的肽序列的核酸用于在整个生物体的细胞中稳定表达。这样的生物体(包括非人类转基因动物)可用于研究肽表达在完整动物中的作用和治疗益处。例如,正如本文所公开的,如本文所阐述的fgf19和/或fgf21的变异体或其融合/嵌合序列(或变异体)(诸如嵌合肽序列,包括fgf19的全部或一部分或者包括fgf21的全部或一部分)在小鼠中的产生。
[0641]
发生或因敏感而容易发生特定疾病(例如,糖尿病、退行性紊乱、癌症等)的小鼠品系也可用于引入如本文描述的治疗性蛋白质以便研究治疗性蛋白质表达在所述疾病易感小鼠中的作用。易感特定疾病或生理学病症的转基因和遗传动物模型(诸如链脲佐菌素(stz)-诱发的糖尿病性(stz)小鼠)是用于表达如本文所阐述的fgf19和/或fgf21的变异体、其融合/嵌合序列(或变异体)(诸如嵌合肽序列,包括fgf19的全部或一部分或者包括fgf21的全部或一部分)的恰当靶标。因此,在某些实施方式中,提供了产生fgf19和/或fgf21的变异体或其融合/嵌合序列(或变异体)(诸如嵌合肽序列,包括fgf19的全部或一部分或者包括fgf21的全部或一部分)的非人类转基因动物,其产生在所述动物中不是天然存在的,而是由所述动物的体细胞或生殖细胞中存在的转基因所赋予的。
[0642]
术语“转基因动物”是指这样的动物,其体细胞或种系细胞携带有直接地或间接地通过在亚细胞水平上有义(deliberate)遗传操作,诸如通过用重组病毒显微注射或感染而接受的遗传信息。术语“转基因的”还包括获自如本文描述的遗传操作的转基因动物的细胞或组织(即,“转基因细胞”、“转基因组织”)。在本文的上下文中,“转基因动物”不涵盖通过传统的杂交育种或体外受精生产的动物,而是指其中一个或多个细胞接受了核酸分子的动物。本文提供的转基因动物相对于转基因可以是杂合的或纯合的。用于生产转基因动物(包括小鼠、绵羊、猪和青蛙)的方法是本领域众所周知的(参见例如,美国专利号5,721,367、5,695,977、5,650,298和5,614,396),并且本身也被另外地包括在内。
[0643]
肽序列、编码肽序列的核酸、载体和表达肽序列的转化宿主细胞包括分离的和纯
化的形式。术语“分离的”,当作为本文提供的组合物的修饰语使用时,意指所述组合物实质性地、完全地或至少部分地与环境中的一种或多种组分分离开。一般而言,在自然界中存在的组合物,当分离时,实质上不含它们在自然界中与其正常缔合的一种或多种材料,例如,一种或多种蛋白质、核酸、脂质、碳水化合物或细胞膜。术语“分离的”不排除组合物的替代物理形式,诸如变异体、修饰或衍生形式、融合体和嵌合体、多聚体/寡聚物等,或者在宿主细胞中表达的形式。术语“分离的”也不排除其中有与其组合的形式(例如,药物组合物、联合组合物等),它们中的任一个都是通过人工生产的。当不含有一种或多种其他材料(诸如污染物或不需要的物质或材料)中的一些、相当数量或大多数或全部时,“分离的”组合物也可以是“纯化的”。
[0644]
如本文使用的,术语“重组的”,当作为肽序列、编码肽序列的核酸等的修饰语使用时,意指所述组合物已经以一般在自然界中不存在的方式操作(即,工程改造)(例如,在体外)。重组肽的一个特别的实例将是其中本文提供的肽序列由用编码所述肽序列的核酸转染的细胞表达。重组核酸的一个特别的实例将是其中编码肽序列的核酸(例如,基因组dna或cdna)克隆到质粒(有或无5’、3’或内含子区)中的情况,该基因在正常情况下在生物体的基因组内是毗连的。重组肽或核酸的另一个实例是杂合或融合序列,诸如包含fgf19的一部分和fgf21的一部分的嵌合肽序列。
[0645]
根据本文提供的方法所述,提供了本文提供的肽序列(包括所例示的肽序列的子序列、变异体和修饰形式(包括在表1和序列表中列出的fgf19和fgf21变异体和子序列,及在表1和序列表中列出的fgf19/fgf21融合体和嵌合体))的组合物和混合物。在一个实施方式中,混合物包括一种或多种肽序列和药学上可接受的载体或赋形剂。在另一个实施方式中,混合物包括一种或多种肽序列和辅助药物或治疗剂,诸如胆汁酸体内稳态调节或抗糖尿病的或葡萄糖降低的药物或治疗剂。还提供了联合药物,诸如在药学上可接受的载体或赋形剂中的一种或多种肽序列与一种或多种胆汁酸体内稳态调节或治疗胆汁酸有关或相关紊乱或抗糖尿病的或葡萄糖降低的药物或治疗剂的组合。这样的本文提供的肽序列与另一种药物或药剂,诸如胆汁酸体内稳态调节或酸相关紊乱治疗或葡萄糖降低药物或治疗剂的组合,例如可以根据本文提供的方法和用途所述来使用,例如,用于对象的治疗是有用的。
[0646]
联合药物也包括将本文提供的肽序列或核酸掺入到颗粒或聚合物质诸如聚酯类、碳水化合物、聚胺酸类、水凝胶、聚乙烯基吡咯烷酮、乙烯-乙酸乙烯酯、甲基纤维素、羧甲基纤维素、硫酸鱼精蛋白或丙交酯/乙交酯共聚物、聚丙交酯/乙交酯共聚物或乙烯乙酸乙烯酯共聚物中;包封在通过凝聚技术或通过界面聚合制备的微胶囊中,例如,通过分别使用羟甲基纤维素或明胶-微胶囊或聚(甲基丙烯酸甲酯)微胶囊;在胶体药物递送和分散系统诸如大分子复合物、纳米-胶囊、微球体、微珠和基于脂质的系统(例如,n-脂肪酰基基团诸如n-月桂酰基、n-油酰基、脂肪胺诸如十二烷胺、油酰胺等,参见美国专利号6,638,513),例如,包括水包油乳液剂、胶束、混合胶束和脂质体中掺入。
[0647]
本文提供的肽包括所例示的如本文所阐述的肽序列的子序列、变异体和修饰形式(包括在表1和序列表中列出的fgf19和fgf21变异体和子序列,及在表1和序列表中列出的fgf19/fgf21融合体和嵌合体)可以用来调节葡萄糖代谢并且促进葡萄糖从血液转运至关键代谢器官诸如肌肉、肝脏和脂肪。这样的肽序列可以以足以或有效恢复葡萄糖耐量和/或
改善或提供正常葡萄糖体内稳态的量产生。
[0648]
5.9试剂盒
[0649]
本文还提供的是试剂盒,其包括但不限于本文提供的肽序列和/或一种或多种另外的用于治疗疾病、紊乱或病症的药剂,或包含上述成分及一种或多种药学上可接受的或生理学上可接受的稀释剂、载体或赋形剂的组合物,并且任选地,与区别于以上描述的那些的一种或多种治疗剂、其组合物和药物组合物进一步组合,并且包装在合适的包装材料中。试剂盒可以包括标签或包装插页,包括各组分的描述或其中的各组分的体外、体内或先体外再体内的使用说明书。示例性的说明书包括对疾病或紊乱的治疗和/或预防的说明书。在一个实施方式中,所述疾病或紊乱是本文提供的胆汁酸有关或相关紊乱。在另一个实施方式中,所述疾病或紊乱是代谢紊乱或相关病症。在还有另一个实施方式中,所述疾病或紊乱是癌症或肿瘤。
[0650]
术语“包装材料”是指容纳试剂盒的组分的物理结构。包装材料可以保持组分无菌,并且可以由通常用于此目的的材料(例如,纸、波纹纤维(corrugated fiber)、玻璃、塑料、箔、安瓿、小瓶、管等)制成。
[0651]
本文提供的试剂盒可以包括标签或插页。标签或插页包括“印刷品”,例如,纸或纸板、单独的或粘贴在组分、试剂盒或包装材料(例如,箱子)上,或附在例如容纳试剂盒组分的安瓿、管或小瓶上。标签或插页还可另外包括计算机可读介质,诸如磁盘(例如,硬盘、卡片、存储器磁盘)、光盘诸如cd-或dvd-rom/ram、dvd、mp3、磁带;或电子存储介质,诸如ram和rom;或这些介质的混合物,诸如磁/光存储介质、flash介质或存储卡。在有些实施方式中,说明书上记载了本文提供的方法。
[0652]
标签或插页除了别的之外还可以包括其中的一种或多种组分的识别信息、用药参数和/或关于活性成分的临床药理学的信息,包括作用机制、药代动力学和药效动力学。标签或插页可以包括识别生产商信息、批号、生产商地址及日期的信息。
[0653]
标签或插页可以包括可以使用试剂盒组分的病症、紊乱、疾病或症状的信息。标签或插页可以包括对临床医师或对对象在方法、治疗规程或治疗方案中使用试剂盒组分中的一种或多种的说明书。说明书可以包括用药量、频率或持续期间或用于实践本文所阐述的方法、治疗规程或治疗方案中的任何一种的说明书。示例性的说明书包括如本文所阐述的肽序列的治疗或使用说明书和/或可用于治疗胆汁酸有关或相关紊乱或胆汁酸体内稳态的紊乱的另外的药剂或治疗方式的使用说明书。因此,本文提供的试剂盒另外还包括用于实践本文提供的方法和用途包括治疗方法和用途的标签或说明书。
[0654]
标签或插页可以包括关于组分可提供的任何益处如预防性或治疗性益处的信息。标签或插页可以包括关于潜在不良副作用的信息,如对对象或临床医生关于其中它将不适合使用特定组合物的情形的警告。不良副作用也可能在对象已经服用、将要服用或目前正在服用可能与该组合物不相容的一种或多种其他药物或者对象已经经历、将要经历或目前正在经历将会与该组合物不相容的另一种治疗规程或治疗方案时发生,并且因此,说明书可以包括关于这样的不相容性的信息。
[0655]
本文提供的试剂盒可以另外包括其他组分。所述试剂盒的各组分可以封装在个体容器内并且全部各种容器可以放置在单个包装里面。在某些实施方式中,试剂盒设计成供冷藏用。本文提供的试剂盒可以进一步设计成容纳本文提供的肽序列或容纳编码肽序列的
核酸。本文提供的试剂盒也可以设计成容纳(单独地或与本文提供的肽序列组合)可用于治疗或预防本文提供的疾病或紊乱的一种或多种另外的药剂。试剂盒中的任何细胞可以维持在恰当的储藏条件下直至备用。
[0656]
除非另有定义,否则在本文中使用的所有技术和科学术语都具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。虽然与本文描述的那些相似或等同的方法和材料可以用于本发明的实践或检验,但是在本文中描述了合适的方法和材料。
[0657]
在有冲突的情况下,应以说明书(包括定义)为准。如本文使用的和在所附权利要求书中使用的,单数形式(“a”、“an”和“the”)包括复数指代,除非上下文中另有明确指明。因此,例如,当提及“肽序列”或“治疗”时包括多个这样的序列、治疗等。还要注意的是,权利要求可以撰写成不包括任何任选元素。因此,这种声明旨在用作前置基础供与权利要求元素记载相关的这样的排他性术语(诸如“唯一地”、“仅仅”等)的使用或“负”限制的使用。
[0658]
当提供数值的范围时,应当理解介于该范围的上限和下限之间的各中间值,到下限单元的第十个(除非上下文中另有明确指明)和该陈述范围内的任何其他陈述值或中间值均包括在本发明内。这些更小范围的上限和下限可以独立地包括在所述更小范围内,并且也包括在本发明内,受到在陈述范围内的任何特定排除限制。若陈述范围包括限制中的一个或它们二者,那么排除那些所包括的限制的任一个或它们二者的范围也包括在本发明内。
[0659]
如本文使用的,在整个文件中数值通常以范围格式呈现。使用范围格式仅为了方便简洁而不应当解释为对本发明范围的刻板限制,除非上下文中另有明确指明。因此,范围的使用明确地包括所有可能的子范围(subrange)、该范围内的所有个体数值以及全部数值或数值范围,包括这样的范围内的整数和数值的分数或范围内的整数,除非上下文中另有明确指明。这种构成不管范围的宽度并且在本专利整个文件的所有内容中都适用。因此,例如,提及90-100%的范围时包括91-99%、92-98%、93-95%、91-98%、91-97%、91-96%、91-95%、91-94%、91-93%,等等。提及90-100%的范围时也包括91%、92%、93%、94%、95%、96%、97%等,以及91.1%、91.2%、91.3%、91.4%、91.5%等,92.1%、92.2%、92.3%、92.4%、92.5%等,诸如此类。另外,提及1-3、3-5、5-10、10-20、20-30、30-40、40-50、50-60、60-70、70-80、80-90、90-100、100-110、110-120、120-130、130-140、140-150、150-160、160-170、170-180、180-190、190-200、200-225、225-250的范围时包括1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20等。在一个进一步实例中,提及25-250、250-500、500-1000、1000-2500、2500-5000、5000-25,000或5000-50,000的范围时包括任何数值或这样的数值内的范围或涵盖这样的数值的范围,例如25、26、27、28、29
…
250、251、252、253、254
…
500、501、502、503、504
…
,等等。使用一系列的范围时包括上下范围的组合以提供另一个范围。这种构成不管范围的宽度并且在本专利整个文件的所有内容中都适用。因此,例如,提及一系列的范围诸如5-10、10-20、20-30、30-40、40-50、50-75、75-100、100-150时包括范围诸如5-20、5-30、5-40、5-50、5-75、5-100、5-150,和10-30、10-40、10-50、10-75、10-100、10-150,和20-40、20-50、20-75、20-100、20-150,等等。
[0660]
为了简洁起见,在本文中使用了某些缩写。一个实例是代表氨基酸残基的单字母缩写。氨基酸及其相应的三字母和单字母缩写如下:
[0661]
丙氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
ala
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(a)
[0662]
精氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
arg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(r)
[0663]
天冬酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀ
asn
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(n)
[0664]
天冬氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀ
asp
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(d)
[0665]
半胱氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀ
cys
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(c)
[0666]
谷氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
glu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(e)
[0667]
谷氨酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀ
gln
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(q)
[0668]
甘氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
gly
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(g)
[0669]
组氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
his
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(h)
[0670]
异亮氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀ
ile
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ(i)[0671]
亮氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
leu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(l)
[0672]
赖氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
lys
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(k)
[0673]
甲硫氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀ
met
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(m)
[0674]
苯丙氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀ
phe
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(f)
[0675]
脯氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
pro
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(p)
[0676]
丝氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
ser
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(s)
[0677]
苏氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
thr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(t)
[0678]
色氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
trp
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(w)
[0679]
酪氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
tyr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(y)
[0680]
缬氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
val
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(v)
[0681]
一般而言,本发明在本文中使用肯定的语言来描述大量实施方式予以公开。具体地说,本发明也包括这样的实施方式:其中特定的主题被排除,全部或部分地,诸如物质或材料、方法步骤和条件、方案、程序、测定或分析。因此,即使本发明一般在本文中不以根据本发明不包括什么来表述,但是在本发明中未明确包括的方面仍然在本文中被公开。
[0682]
本文中描述了本发明的特别的实施方式,包括对本发明人来说已知的用于实现本发明的最佳方式。在阅读完上面的描述之后,被公开的实施方式的各种变体对于在本领域工作的人员来说可能变得显而易见,因此,预期技术人员可视情况使用这样的变体。因此,预计本发明进行实践无需考虑在本文中所具体描述的,并且本发明包括所附权利要求书中记载的主题在适用法律许可范围内的所有修改及等同方案。此外,本发明涵盖了上述在其所有可能变化中的元素的任何组合,除非在本文中另有说明或者上下文中有明显的矛盾。
[0683]
本说明书中引用的所有出版物、专利申请、登记号及其他参考文献都在此通过全文引用并入本发明,正如每个单个出版物或专利申请具体地和单独地通过引用并入本发明一样。提供本文中讨论的出版物纯粹为了它们的公开在本技术的申请日之前。在本文中不应当解释为承认由于现有发明,本发明没有资格先于这样的出版物。此外,提供的出版物日期可能与实际的出版物日期不相同,这可能需要单独予以确认。
[0684]
已经描述了本发明的大量实施方式。尽管如此,应当理解,在不偏离本发明的精神和范围的情况下可以做出各种修改。因此,在实验部分中的描述旨在举例说明而不是限制权利要求书中所描述的发明范围。
[0685]
6.实验部分
[0686]
下面是在本研究中使用的各种方法和材料的描述,并且被发表以便为本领域普通
技术人员提供如何实现和使用本发明的完全公开和充分说明,并不意图限制本发明的发明人认为他们的发明的范围,也不意图代表进行了以下的实验并且是可能进行的所有实验。应当理解,用一般现在时撰写的示例性描述不一定做过,而是该描述可以实施以得出与本发明教导相关的数据等。关于所使用的数字(例如,量、温度等),已经作出了很多努力以确保其准确性,但是对一些实验误差和偏差应该加以考虑。
[0687]
除非另有说明,否则份是重量份,分子量是重均分子量,温度是以摄氏度(℃)表示,和压力是在大气压下或接近大气压。使用了标准缩写,包括如下:bp=碱基对;kb=千碱基;s或sec=秒;min=分钟;h或hr=小时;aa=氨基酸;kb=千碱基;nt=核苷酸;pg=皮克;ng=毫微克;μg=微克;mg=毫克;g=克;kg=千克;pl或pl=皮克升;dl或dl=分升;μl或μl=微升;ml或ml=毫升;l或l=升;μm=微摩尔浓度;mm=毫摩尔浓度;m=摩尔浓度;kda=千道尔顿;i.m.=肌内;i.p.=腹膜内;sc或sq=皮下;qd=每日;bid=每日两次;qw=每周;tiw=一周三次;qm=每月;hplc=高效液相色谱法;bw=体重;u=单位;ns=无统计学显著性;pbs=磷酸缓冲盐溶液;pcr=聚合酶链式反应;nhs=n-羟基琥珀酰亚胺;hsa=人血清白蛋白;bsa=牛血清白蛋白;dmem=伊戈尔氏培养基的dulbeco氏改良培养基(dulbeco’s modification of eagle’s medium);gc=基因组拷贝;edta=乙二胺四乙酸。
[0688]
6.1实施例1
–
m70的液体制剂
[0689]
下面提供的是液体制剂设计。
[0690][0691][0692]
6.2实施例2
–
稳定性/制剂研究设计
[0693]
所有稳定性研究都用蛋白质浓度为1mg/ml和10mg/ml,渗透压为300osmol/l,持续期间为0至24周来进行。
[0694]
小瓶中的体积为0.5-1ml/小瓶,在温度-80℃、2-8℃和37℃下,在0周、1周、2周、4周、3个月和6个月的时间点时。
[0695]
m70浓缩至10+mg/ml,基于a
280
(mw=21320,e=16180)。用1xpbs将浓缩贮液稀释至1mg/ml或10mg/ml,并且在透析步骤之前加入tween-20(0.01%v/v)。
[0696]
缓冲液组成表观ph(4c)实际ph(4c)110mm kphos,150mm nacl,0.01%tween-207.37.252
220mm kphos,125mm nacl,0.01%tween-207.37.261320mm kphos,125mm nacl,0.01%tween-207.57.540420mm kphos,125mm nacl,0.01%tween-208.08.120520mm tris,8.2%海藻糖,0.01%tween-207.57.586620mm tris,8.2%海藻糖,0.01%tween-2088.053720mm tris,8.2%海藻糖,0.01%tween-208.58.562820mm tris,140mm nacl,0.01%tween-207.57.499920mm tris,140mm nacl,0.01%tween-2088.0751020mm tris,140mm nacl,0.01%tween-208.58.507
[0697]
用于这些研究中的海藻糖是目录号bp26871(fisher)。也注意到tris ph温度依赖性:
[0698] 5℃25℃37℃ph7.506.926.72ph8.007.427.15ph8.507.927.64
[0699]
将样品透析过夜到各缓冲液,使用装有10kmwco的盒。所有小瓶都用空气吹洗以除去灰尘,并且然后在干循环上于121℃高压灭菌2小时以确保无菌。样品通过在通风橱中的0.22μm滤器过滤除菌。在组织培养通风橱中进行小瓶灌装以确保稳定性。
[0700]
总之,检验了每时间点60个条件。小瓶编号在本文提供的全部实施例中使用。
[0701]
[0702]
[0703][0704]
在先进仪器3300机上也测定了缓冲液的osometer值,在m70的存在或不存在下,20μl标称注射体积:
[0705][0706]
然后,在0、1、2、4周,在所有样品上进行了目视浊度评估。将样品涡旋使得留在管底的任何沉淀物重新悬浮。所使用的评分系统如下:0
–
清亮;1
–
轻微模糊;2
–
轻微混浊;3
–
混浊;4
–
非常混浊;和5
–
极度混浊。
[0707]
在4周时进行了a
340
/a
280
测量(nanodrop;1mm光程长度),并且各样品针对相应制剂缓冲液做了空白对照。
[0708]
在37℃下,在4周时,对样品的目视浊度进行了分析。在图1中描绘了关于用蛋白质浓度为1mg/ml的样品的目测结果。在图2中描绘了关于用蛋白质浓度为10mg/ml的样品的目测结果。
[0709]
研究显示,在样品中,在-80℃和4℃下和在任何时间点,对任何条件均无目视沉淀
物或聚集物的证据。在37℃记录样品的可变聚集(数据未显示),可变聚集是ph和蛋白质剂量依赖性的。
[0710]
注意到,在含有tris的缓冲液中,海藻糖相对于nacl是一种优异的张力调节剂。实际上,观测到在37℃下在20mm tris(ph 8.5)与8.2%海藻糖(缓冲液7)或140mm nacl(缓冲液10)之间的聚集状态中的显著差异。
[0711]
缓冲液7(20mm tris、8.2%海藻糖、0.01%tween-20)是在任何条件、浓度或时间点下均无目视沉淀物证据的唯一的制剂缓冲液,因此选择它用于进一步研究。
[0712]
6.3实施例3.sec-hplc分析
[0713]
基于a
280
/a
340
(比率≤0.07)和目视检查(无目视沉淀物),在无沉淀物证据的样品上在下列条件下进行了hplc分析:
[0714]
硬件-hplc 1200系列
[0715]
流动相-1xpbs的5%乙醇(v/v)
[0716]
流量-1ml/min
[0717]
样品运行时间-15min/run
[0718]
柱子-tosoh tskgel3000
[0719]
温度-25℃
[0720]
注射体积-20μl,对于1mg/ml样品(20μg上样量);或
[0721]
2μl,对于10mg/ml样品(20μg上样量)。
[0722]
在每次注射之间进行了pbs空白运转以确保在子序列注射上最小样品保留下来。也包括了对于各时间点(t=1、2和4周),在时间=0时总auc的百分(%)回收率。
[0723]
在各种缓冲液中,对于1mg/ml,在a
210
下,基于吸光度的sec auc,hplc分析的数据示于图3;和图4显示对于1mg/ml的缓冲液7,在a
210
下,基于吸光度的sec auc,hplc分析的数据。对于10mg/ml样品,相同的数据分别示于图5和图6。
[0724]
结果证明对于所有被分析样品,基于总auc,百分(%)回收率高于92%,随后通过正交法(auc
sv
)对其进行了确认(数据未显示)。缓冲液7也证明了在37℃下在百分二聚体/聚集物形成中的时间依赖性增加。总体趋势表明,在液体制剂中,ph越高,二聚体的倾向越高,并且mw聚集物随时间增加而增加。此外,在液体制剂中,在4℃下,增加m70的浓度仅对二聚体的倾向具有最小的影响,并且较高的mw聚集物随时间增加而增加。
[0725]
6.4实施例4.sds-page凝胶分析
[0726]
基于a
280
/a
340
和目视检查(缓冲液1-10),在无沉淀物证据的样品上在下列条件下进行了sds-page凝胶分析:
[0727]
硬件-novex 4-20%tris-甘氨酸凝胶
[0728]
样品处理缓冲液-lamelli 3x运行缓冲液
±
100mm dtt。
[0729]
将样品在1x lamelli运行缓冲液中稀释至0.1μg/μl。将样品在95℃下离心5分钟,并且然后以10μl/泳道(总计1μg)上样到凝胶上。也使用了t=0参考标准品。在完成后,将凝胶在1%乙酸(v/v)中固定30min,在milli-q
tm
水中洗涤15分钟,在考马斯生物安全染色剂(coomassie biosafe stain)中染色1小时,并且然后在milli-q
tm
水中脱色过夜。
[0730]
对于缓冲液7(左)和缓冲液8(右),对于1mg/ml和10mg/ml,sds-page凝胶分别示于图7a和图7b(其他缓冲液;数据未显示)。结果显示对于所有被测样品,观测到m70主峰强度
的最小降解。缓冲液7含有在还原后不分解的非二硫键二聚体条带,采用约5%的总蛋白质泳道强度,在4周、37℃和10mg/ml下。对于10mg/ml样品(在4℃下在4周时),相对于t=0参考标准品,对于二聚体条带来说无显著增加。此外,对于任何被测样品,在泳道各孔中,无高分子量聚集物的证据。
[0731]
基于这次实验和先前实验的数据,选择前3种缓冲液做了进一步分析。缓冲液排序是基于在t=0、1、2和4周时间分析点的以下分析:
[0732]-目视检查(实施例2)
[0733]-a
340
/a
280
浊度(turbity)(实施例2)
[0734]-sec-hplc(实施例3)
[0735]-sds-page凝胶(实施例4)
[0736]
关于用于选择的标准,焦点是在10mg/ml样品分析上以消除高浓度制剂(高达10mg/ml)的风险来满足临床需求。另外一个焦点在4℃样品上,4℃样品可提供用于液体制剂储藏条件的基础。
[0737]
鉴于以上标准,选择缓冲液1、7和10做了进一步分析。缓冲液1对于10mg/ml样品(4周,4℃)具有100%回收率,而在时间点分析具有98.9%单体。此外,使用其他方法进行分析,在t=4周时,有最小非二硫键共价二聚体,并且显示长期4℃稳定性(数据未显示)。在37℃,在10mg/ml,在t=4周时,缓冲液7中无沉淀物;并且对于10mg/ml,持续4周,在4℃下观测到最少降解途径(98.9%单体)。缓冲液10基本上等同于缓冲液7;然而,用nacl制剂,对于张力(数据未显示),对于赋形剂范围,增加了多样性。
[0738]
6.5实施例5.离子交换色谱法-高效液相色谱法(iec-hplc)分析
[0739]
缓冲液7的iec-hplc分析在下列条件下进行:
[0740]
硬件:hplc 1200系列
[0741]
流动相:(a)20mm tris hcl;ph 8.5;20%乙腈
[0742]
(b)20mm tris hcl;ph 8.5;20%乙腈;500mm nacl
[0743]
流量:0.5ml/min,同时增加%b的线性梯度
[0744]
柱子:tosoh tskgel q-5pw阴离子交换柱,7.5mmx75mm(pn 18257)
[0745]
注射体积:20μl,对于1mg/ml样品
[0746]
2μl,对于10mg/ml样品
[0747]
样品的时间点分析:缓冲液7,在1mg/ml和10mg/ml,在t=0、1、2和4周时;参考标准品对37℃热应力样品,在t=0、1、2和4周时。
[0748]
图8描绘了对于缓冲液7在37℃、1mg/ml的浓度下在t=0周、1周、2周和4周时的iec-hplc。图9描绘了对于缓冲液7在37℃、10mg/ml的浓度下在t=0周、1周、2周和4周时的iec-hplc。
[0749]
6.6实施例5.反相高效液相色谱法(rp-hplc)分析
[0750]
基于a
340/a280和
目视检查,在无沉淀物证据的样品上在下列条件下进行了rp-hplc分析:
[0751]
硬件:hplc 1200系列
[0752]
流动相:(a)0.1tfa
[0753]
(b)0.1tfa,90%can
[0754]
流量:0.4ml/min
[0755]
柱子:phenomenox
tm
c4-jupiter柱
[0756]
注射体积:20μl,对于1mg/ml样品
[0757]
2μl,对于10mg/ml样品
[0758]
样品的时间点分析:缓冲液7,在1mg/ml和10mg/ml下,在t=0、1、2和4周时;参考标准品对37℃热应力样品,在t=0、1、2和4周时。
[0759]
图10描绘了对于缓冲液7在37℃、1mg/ml的浓度下在t=0周、1周、2周和4周时的rp-hplc。图11描绘了对于缓冲液7在37℃、10mg/ml的浓度下在t=0周、1周、2周和4周时的rp-hplc。
[0760]
6.7实施例7
–
冻-融分析
[0761]
为了分析对多次冻/融循环的m70制剂的影响而做了冻/融分析。
[0762]
提供了浓度为10mg/ml的m70,并且osmol/l靶标为300osmol/l。使用了以下缓冲液组成(类似于缓冲液7):20mm tris ph 8.0(25℃)、8.3%(w/v)海藻糖、0.01%tween-20。小瓶中的灌装量为1.0ml/小瓶,并且将6个等分试样储放在玻璃小瓶中,供在以上讨论的制剂稳定性研究中使用。
[0763]
使用了以下冻/融条件:
[0764]
冻/融循环的次数:1、3、5
[0765]
冷冻条件:置于-80℃下达30分钟
[0766]
融化条件:(a)室温直到融化(1小时)
[0767]
(b)4℃直到融化的(1小时)
[0768]
然后使用rp-hplc、sec-hplc或aiex-hplc中的一种或多种对稳定性进行了评估。
[0769]
图12显示m70制剂在多次冻/融循环之后的稳定性。冻/融循环并不影响缓冲液中的产品稳定性。20mm tris ph 8.0(25℃)、8.3%海藻糖(w/v)、0.01%聚山梨酯-20(“ttp”缓冲液)中的m70在冻/融循环期间从-80℃到室温都是稳定的。对于任何样品条件或被分析物,相对于输入(参考标准)没有可检测到的差异。此外,使用ttp作为流动相,通过sec-hplc没有可逆低聚体形成的证据。
[0770]
7.序列表
[0771]
本说明书与序列表的计算机可读形式(crf)拷贝一起提交。该crf标题为13370-018-228_seqlist.txt,于2015年10月14日创建,大小为255,604字节,与序列表的纸质复印件完全相同,并且其在此通过全文引用并入本发明。
具体实施方案:
[0772]
1.一种药物组合物,包含嵌合肽序列,包含:
[0773]
(a)(i)包含至少七个氨基酸残基的n-末端区,该n-末端区具有第一氨基酸位置和最后氨基酸位置,其中所述n-末端区包含dsspl(seq id no:121)或dasph(seq id no:122);和
[0774]
(ii)包含seq id no:99(fgf19)的一部分的c-末端区,该c-末端区具有第一氨基酸位置和最后氨基酸位置,其中所述c-末端区包含seq id no:99(fgf19)的氨基酸残基16-29,wgdpirlrhlytsg(seq id no:169),其中所述w残基对应于所述c-末端区的第一氨基酸
位置,和
[0775]
(b)药学上可接受的载体,其包含tris、海藻糖和聚山梨酯-20(tween-20)。
[0776]
2.一种药物组合物,包含嵌合肽序列,包含:
[0777]
(a)(i)包含seq id no:100(fgf21)的一部分的n-末端区,该n-末端区具有第一氨基酸位置和最后氨基酸位置,其中所述n-末端区包含氨基酸残基gqv,和其中所述v残基对应于所述n-末端区的最后氨基酸位置;和
[0778]
(ii)包含seq id no:99(fgf19)的一部分的c-末端区,该c-末端区具有第一氨基酸位置和最后氨基酸位置,其中所述c-末端区包含seq id no:99(fgf19)的氨基酸残基21-29,rlrhlytsg(seq id no:185),和其中所述r残基对应于所述c-末端区的第一位置;和
[0779]
(b)药学上可接受的载体,其包含tris、海藻糖和聚山梨酯-20(tween-20)。
[0780]
3.一种药物组合物,包含嵌合肽序列,包含:
[0781]
(a)(i)包含seq id no:100(fgf21)的一部分的n-末端区,该n-末端区具有第一氨基酸位置和最后氨基酸位置,其中所述n-末端区包含包括氨基酸残基gqv的seq id no:100(fgf21)的至少5个毗连氨基酸,和其中所述v残基对应于所述n-末端区的最后氨基酸位置;和
[0782]
(ii)包含seq id no:99(fgf19)的一部分的c-末端区,该c-末端区具有第一氨基酸位置和最后氨基酸位置,其中所述c-末端区包含seq id no:99(fgf19)的氨基酸残基21-29,rlrhlytsg(seq id no:185),和其中所述r残基对应于所述c-末端区的第一位置;和
[0783]
(b)药学上可接受的载体,其包含tris、海藻糖和聚山梨酯-20(tween-20)。
[0784]
4.实施方案3的药物年组合物,其中所述n-末端区包含seq id no:100(fgf21)的至少6个毗连氨基酸,包括氨基酸残基gqv。
[0785]
5.实施方案3的药物组合物,其中所述n-末端区包含seq id no:100(fgf21)的至少7个毗连氨基酸,包括氨基酸残基gqv。
[0786]
6.一种药物组合物,包含肽序列,包含以下(a)和(b)或由其组成:
[0787]
(a)i)与参比或野生型fgf19相比,具有一个或多个氨基酸取代、插入或缺失的fgf19序列变异体;
[0788]
ii)与参比或野生型fgf21相比,具有一个或多个氨基酸取代、插入或缺失的fgf21序列变异体;
[0789]
iii)与fgf21序列的一部分融合的fgf19序列的一部分;或
[0790]
iv)与fgf21序列的一部分融合的fgf19序列的一部分,其中与参比或野生型fgf19和/或fgf21相比,所述fgf19和/或fgf21序列部分具有一个或多个氨基酸取代、插入或缺失;和
[0791]
(b)药学上可接受的载体,其包含tris、海藻糖和聚山梨酯-20(tween-20)。
[0792]
7.实施方案6的药物组合物,其中所述肽序列包含以下(i)、(ii)、(iii)、(iv)或(v)或由其组成:
[0793]
(i)与seq id no:99(fgf19)的羧基-末端氨基酸21-194融合的seq id no:100(fgf21)的氨基-末端氨基酸1-16,
[0794]
(ii)与seq id no:100(fgf21)的羧基-末端氨基酸147-181融合的seq id no:99(fgf19)的氨基-末端氨基酸1-147(m41),
[0795]
(iii)与seq id no:100(fgf21)的羧基-末端氨基酸17-181融合的seq id no:99(fgf19)的氨基-末端氨基酸1-20(m44),
[0796]
(iv)与seq id no:99(fgf19)的羧基-末端氨基酸148-194融合的seq id no:100(fgf21)的氨基-末端氨基酸1-146(m45),或
[0797]
(v)与seq id no:100(fgf21)的内部氨基酸17-146融合的seq id no:99(fgf19)的氨基-末端氨基酸1-20,该seq id no:100(fgf21)的内部氨基酸17-146与seq id no:99(fgf19)的羧基-末端氨基酸148-194融合(m46)。
[0798]
8.实施方案6的药物组合物,其中所述肽序列包含对seq id no:99(fgf19)的氨基酸残基125-129eirpd的至少一个氨基酸取代。
[0799]
9.实施方案6的药物组合物,其中所述肽序列包含对seq id no:99(fgf19)的氨基酸残基126-128 irp的至少一个氨基酸取代。
[0800]
10.实施方案6的药物组合物,其中所述肽序列包含对seq id no:99(fgf19)的氨基酸残基127-128rp的至少一个氨基酸取代。
[0801]
11.实施方案10的药物组合物,其中所述肽序列包含对seq id no:99(fgf19)的氨基酸残基127-128 irp之一的取代,其中至少一个氨基酸取代是r127l或p128e。
[0802]
12.实施方案11的药物组合物,其中所述肽序列包含
[0803]
rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m3)(seq id no:3);或
[0804]
rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiredgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m140)(seq id no:194)。
[0805]
13.实施方案8-10中任一项的药物组合物,其中所述肽序列还包含对seq id no:99(fgf19)的氨基酸残基1-124和/或对seq id no:99(fgf19)的氨基酸残基130-194的至少一个氨基酸取代。
[0806]
14.实施方案13的药物组合物,其中所述肽序列是
[0807]
rplafsdagphvhygwgdpirqrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m160)(seq id no:196)。
[0808]
15.实施方案1、2、3和6中任一项的药物组合物,其中所述肽序列包含本发明阐述为m1至m98或m101至m160,或者seq id no:1至98、101至135或138至196的任何序列或由其组成。
[0809]
16.实施方案1、2、3和6中任一项的药物组合物,其中所述肽序列包含表1中所列出的任何序列或由其组成。
[0810]
17.实施方案1、2、3和6中任一项的药物组合物,其中所述肽序列包含本发明的序列表中所列出的任何序列或由其组成。
[0811]
18.实施方案1、2和6中任一项的药物组合物,其中所述肽具有wgdpi(seq id no:170)序列基序,该基序对应于seq id no:99(fgf19)的氨基酸16-20的wgdpi序列。
[0812]
19.实施方案18的药物组合物,其中所述肽维持或增加fgfr4介导的活性。
[0813]
20.实施方案1、2和6中任一项的药物组合物,其中所述肽具有取代的、突变的或不存在的wgdpi(seq id no:170)序列基序,该基序对应于fgf19的氨基酸16-20的fgf19wgdpi序列。
[0814]
21.实施方案20的药物组合物,其中所述wgdpi(seq id no:170)序列具有取代的、突变的或不存在的一个或多个氨基酸。
[0815]
22.实施方案1、2和6中任一项的药物组合物,其中所述肽的所述序列区别于fgf 19变异体序列,该fgf 19变异体序列具有在氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代fgf19 wgdpi(seq id no:170)序列。
[0816]
23.实施方案1、3和6中任一项的药物组合物,其中所述n-末端区或c-末端区的长度为约20至约200个氨基酸残基。
[0817]
24.实施方案1的药物组合物,其中所述n-末端区包含氨基酸残基vhyg(seq id no:101),其中所述n-末端区包含氨基酸残基dasphvhyg(seq id no:102),或其中所述n-末端区包含氨基酸残基dssplvhyg(seq id no:103)。
[0818]
25.实施方案24的药物组合物,其中所述g对应于所述n-末端区的最后位置。
[0819]
26.实施方案1或6的药物组合物,其中所述n-末端区包含氨基酸残基dsspllq(seq id no:104),和其中所述q残基是所述n-末端区的最后氨基酸位置。
[0820]
27.实施方案13或14的药物组合物,其中所述n-末端区还包含:rhpip(seq id no:106),其中r是所述n-末端区的第一氨基酸位置;或hpip(seq id no:107),其中h是所述n-末端区的第一氨基酸位置;或rplaf(seq id no:108),其中r是所述n-末端区的第一氨基酸位置;或plaf(seq id no:109),其中p是所述n-末端区的第一氨基酸位置;或r,其中r是所述n-末端区的第一氨基酸位置。
[0821]
28.实施方案1、3和6中任一项的药物组合物,其中所述肽序列包含m1至m98或m101至m160变异体肽序列中的任一个,或所述m1至m98或m101至m160变异体肽序列中的任一个的子序列或片段;或由其组成。
[0822]
29.实施方案1、3和6中任一项的药物组合物,其中所述肽序列包含以下序列中的任一个或由其组成:
[0823]
rdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m69)(seq id no:69);
[0824]
rdsspllqwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m52)(seq id no:52);
[0825]
rhpipdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m5)(seq id no:5);
[0826]
hpipdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m5-r)(seq id no:160);
[0827]
hpipdsspllqfggqvrqrylytddaqqteahleiredgtvggaadqspesllqlkalkpgviqilgvktsrflcqrpdgalygslhfdpeacsfrellledgynvyqseahslplhlpgnksphrdpaprgparflplpglppalpeppgilapqppdvgssdplsmvgpsqgrspsyas(m71)(seq id no:71);
[0828]
hpipdsspllqfggqvrqrylytddaqqteahleiredgtvggaadqspesllqlkalkpgviqilgvktsrflcqrpdgalygslhfdpeacsfrellledgynvyqseahglplhlpgnksphrdpaprgparflplpglppappeppgilapqppdvgssdplsmvgpsqgrspsyas(m72)(seq id no:72);
[0829]
hpipdsspllqfggqvrqrylytddaqqteahleiredgtvggaadqspesllqlkalkpgviqilgvktsrflcqrpdgalygslhfdpeacsfrellledgynvyqseahglplhlpgnksphrdpaprgparflplpglppalpeppgilapqppdvgssdplsmvvqdelqgvggegchmhpencktlltdidrthtekpvwdgitge(m73)(seq id no:73);
[0830]
rplafsdasphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m1)(seq id no:1或139);
[0831]
rplafsdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m2)(seq id no:2或140);
[0832]
rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m3)(seq id no:3);
[0833]
rdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m48)(seq id no:48或6或148);
[0834]
rplafsdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m49)(seq id no:49或7或149);
[0835]
rhpipdsspllqfgdqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m50)(seq id no:50);
[0836]
rhpipdsspllqfggnvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m51)(seq id no:51或36或155);
[0837]
mdsspllqwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m53)(seq id no:192);
[0838]
mrdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlp
mvpeepedlrghlesdmfsspletds16mdpfglvtgleavrspsfek(m70)(seq id no:70);
[0839]
rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeilpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m139)(seq id no:193);
[0840]
rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiredgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m140)(seq id no:194);
[0841]
rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeilcdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m141)(seq id no:195);或
[0842]
rplafsdagphvhygwgdpirqrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeiledgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(m160)(seq id no:196);
[0843]
或上述肽序列中的任一个的子序列或片段,或其中所述r末端残基缺失的上述肽序列中的任一个。
[0844]
30.实施方案1或2的药物组合物,其中所述n-末端区包含氨基酸残基dsspllqfggqv(seq id no:105),和其中所述v残基对应于所述n-末端区的最后位置。
[0845]
31.实施方案1、3和6中任一项的药物组合物,其中氨基酸残基hpip(seq id no:107)是所述n-末端区的前4个氨基酸残基。
[0846]
32.实施方案1、3、6和31中任一项的药物组合物,其中所述n-末端区的第一位置是r残基,或其中所述n-末端区的第一位置是m残基,或其中所述n-末端区的第一和第二位置是mr序列,或其中所述n-末端区的第一和第二位置是rm序列,或其中所述n-末端区的第一和第二位置是rd序列,或其中所述n-末端区的第一和第二位置是ds序列,或其中所述n-末端区的第一和第二位置是md序列,或其中所述n-末端区的第一和第二位置是ms序列,或其中所述n-末端区的从第一到第三位置是mds序列,或其中所述n-末端区的从第一到第三位置是rds序列,或其中所述n-末端区的从第一到第三位置是msd序列,或其中所述n-末端区的从第一到第三位置是mss序列,或其中所述n-末端区的从第一到第三位置是dss序列,或其中所述n-末端区的从第一到第四位置是rdss(seq id no:115)序列,或所述n-末端区的从第一到第四位置是mdss(seq id no:116)序列,或所述n-末端区的从第一到第五位置是mrdss(seq id no:117)序列,或所述n-末端区的从第一到第五位置是msspl(seq id no:118)序列,或所述n-末端区的从第一到第六位置是mdsspl(seq id no:119)序列,或所述n-末端区的从第一到第七位置是msdsspl(seq id no:120)序列。
[0847]
33.实施方案1、3和6中任一项的药物组合物,其中所述c-末端区的最后位置对应于seq id no:99(fgf19)的约残基194。
[0848]
34.实施方案1、3和6中任一项的药物组合物,其中所述肽具有包含以下一项或由其组成的序列:
[0849]
hpipdsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:160);
[0850]
dsspllqfggqvrlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:138或161);
[0851]
rplafsdasphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:1或139);
[0852]
rplafsdssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:2或140);或
[0853]
dssplvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:141);
[0854]
或上述肽序列中的任一个的子序列或片段,或其中所述r末端残基缺失的上述肽序列中的任一个。
[0855]
35.实施方案18、19和34中任一项的药物组合物,其中所述的其子序列或片段具有自氨基末端、羧基-末端或内部的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个或更多个氨基酸缺失。
[0856]
36.实施方案1、3和6中任一项的药物组合物,其中所述n-末端区或所述c-末端区包含约5至10、10至20、20至30、30至40、40至50、60至70、70至80、80至90、90至100个或更多个氨基酸的氨基酸序列,或由其组成。
[0857]
37.实施方案3或6的药物组合物,其中所述fgf19序列部分或所述fgf21序列部分包含fgf19或fgf21的约5至10、10至20、20至30、30至40、40至50、50至60、60至70、70至80、80至90、90至100个或更多个氨基酸的氨基酸序列,或由其组成。
[0858]
38.实施方案1、3和6中任一项的药物组合物,其中所述n-末端区,或所述c-末端区,或所述fgf19序列部分,或所述fgf21序列部分,均由接头或间隔区连接。
[0859]
39.实施方案1、3和6中任一项的药物组合物,其中所述肽包含以下序列中的任一个或由其组成:
[0860]
hpipdsspllqfggqvrlrhlytsg(m5-r)(seq id no:160的氨基酸1-25);
[0861]
dsspllqfggqvrlrhlytsg(m6-r)(seq id no:6的氨基酸2-22);
[0862]
rplafsdsspllqfggqvrlrhlytsg(m7)(seq id no:7的氨基酸1-27);
[0863]
hpipdsspllqwgdpirlrhlytsg(m8-r)(seq id no:8的氨基酸2-26);
[0864]
hpipdsspllqfgwgdpirlrhlytsg(m9-r)(seq id no:9的氨基酸2-28);
[0865]
hpipdssphvhygwgdpirlrhlytsg(m10-r)(seq id no:10的氨基酸2-28);
[0866]
rplafsdagpllqwgdpirlrhlytsg(m11)(seq id no:11的氨基酸1-27);
[0867]
rplafsdagpllqfgwgdpirlrhlytsg(m12)(seq id no:12的氨基酸1-29);
[0868]
rplafsdagpllqfggqvrlrhlytsg(m13)(seq id no:13的氨基酸1-27);
[0869]
hpipdssphvhyggqvrlrhlytsg(m14-r)(seq id no:14的氨基酸2-26);
[0870]
rplafsdagphvhyggqvrlrhlytsg(m15)(seq id no:15的氨基酸1-27);
[0871]
rplafsdagphvhwgdpirlrhlytsg(m16)(seq id no:16的氨基酸1-27);
[0872]
rplafsdagphvgwgdpirlrhlytsg(m17)(seq id no:17的氨基酸1-27);
[0873]
rplafsdagphygwgdpirlrhlytsg(m18)(seq id no:18的氨基酸1-27);
[0874]
rplafsdagpvygwgdpirlrhlytsg(m19)(seq id no:19的氨基酸1-27);
[0875]
rplafsdagpvhgwgdpirlrhlytsg(m20)(seq id no:20的氨基酸1-27);
[0876]
rplafsdagpvhywgdpirlrhlytsg(m21)(seq id no:21的氨基酸1-27);
[0877]
rplafsdagphvhgwgdpirlrhlytsg(m22)(seq id no:22的氨基酸1-27);
[0878]
rplafsdagphhgwgdpirlrhlytsg(m23)(seq id no:23的氨基酸1-27);
[0879]
rplafsdagphhywgdpirlrhlytsg(m24)(seq id no:24的氨基酸1-27);
[0880]
rplafsdagphvywgdpirlrhlytsg(m25)(seq id no:25的氨基酸1-27);
[0881]
rplafsdssplvhwgdpirlrhlytsg(m26)(seq id no:26的氨基酸1-27);
[0882]
rplafsdssphvhwgdpirlrhlytsg(m27)(seq id no:27的氨基酸1-27);
[0883]
rplafsdagphvwgdpirlrhlytsg(m28)(seq id no:28的氨基酸1-26);
[0884]
rplafsdagphvhywgdpirlrhlytsg(m29)(seq id no:29的氨基酸1-28);
[0885]
rplafsdagphvhyawgdpirlrhlytsg(m30)(seq id no:30的氨基酸1-29);
[0886]
rhpipdsspllqfgaqvrlrhlytsg(m31)(seq id no:31的氨基酸1-26);
[0887]
rhpipdsspllqfgdqvrlrhlytsg(m32)(seq id no:32的氨基酸1-26);
[0888]
rhpipdsspllqfgpqvrlrhlytsg(m33)(seq id no:33的氨基酸1-26);
[0889]
rhpipdsspllqfggavrlrhlytsg(m34)(seq id no:34的氨基酸1-26);
[0890]
rhpipdsspllqfggevrlrhlytsg(m35)(seq id no:35的氨基酸1-26);
[0891]
rhpipdsspllqfggnvrlrhlytsg(m36)(seq id no:36的氨基酸1-26);
[0892]
rhpipdsspllqfggqarlrhlytsg(m37)(seq id no:37的氨基酸1-26);
[0893]
rhpipdsspllqfggqirlrhlytsg(m38)(seq id no:38的氨基酸1-26);
[0894]
rhpipdsspllqfggqtrlrhlytsg(m39)(seq id no:39的氨基酸1-26);
[0895]
rhpipdsspllqfgwgqpvrlrhlytsg(m40)(seq id no:40的氨基酸1-28);
[0896]
dagphvhygwgdpirlrhlytsg(m74-r)(seq id no:74的氨基酸2-24);
[0897]
vhygwgdpirlrhlytsg(m75-r)(seq id no:75的氨基酸2-19);
[0898]
rlrhlytsg(m77-r)(seq id no:77的氨基酸2-10);
[0899]
或上述肽序列中的任一个,其中所述氨基末端的r残基缺失。
[0900]
40.实施方案1、3和6中任一项的药物组合物,其中所述肽序列的n-末端包含以下序列中的任一个或由其组成:
[0901]
rhpipdsspllqfgwgdpirlrhlytsg(m9)(seq id no:9的氨基酸1-28);
[0902]
rhpipdsspllqwgdpirlrhlytsg(m8)(seq id no:8的氨基酸1-26);
[0903]
rplafsdagpllqfgwgdpirlrhlytsg(m12)(seq id no:12的氨基酸1-29);
[0904]
rhpipdssphvhygwgdpirlrhlytsg(m10)(seq id no:10的氨基酸1-28);
[0905]
rplafsdagpllqfggqvrlrhlytsg(m13)(seq id no:13的氨基酸1-27);
[0906]
rhpipdssphvhyggqvrlrhlytsg(m14)(seq id no:14的氨基酸1-26);
[0907]
rplafsdagphvhyggdirlrhlytsg(m43)seq id no:43的氨基酸1-27);或
[0908]
rdsspllqfggqvrlrhlytsg(m6)(seq id no:6的氨基酸1-22);
[0909]
或上述肽序列中的任一个,其中所述氨基末端的r残基缺失。
[0910]
41.实施方案39或40的药物组合物,其中所述肽序列还包含在所述c-末端添加seq id no:99(fgf19)的氨基酸残基30-194,导致产生嵌合多肽。
[0911]
42.实施方案39或40中任一项的药物组合物,其中所述肽序列还包含如下所述的fgf19序列的全部或一部分:
[0912]
phglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:188),其位于所述肽的c-末端,或其中所述氨基末端的“r”残基从所述肽缺失。
[0913]
43.实施方案1、3和6中任一项的药物组合物,其中所述子序列具有至少一个氨基酸缺失。
[0914]
44.实施方案43的药物组合物,其中所述子序列具有自氨基末端、羧基-末端或内部的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个或更多个氨基酸缺失。
[0915]
45.实施方案6的药物组合物,其中所述参比或野生型fgf19序列如下所述:
[0916]
rplafsdagphvhygwgdpirlrhlytsgphglsscflriradgvvdcargqsahslleikavalrtvaikgvhsvrylcmgadgkmqgllqyseedcafeeeirpdgynvyrsekhrlpvslssakqrqlyknrgflplshflpmlpmvpeepedlrghlesdmfsspletdsmdpfglvtgleavrspsfek(seq id no:99)。
[0917]
46.实施方案6的药物组合物,其中所述参比或野生型fgf21序列如下所述:rhpipdsspllqfggqvrqrylytddaqqteahleiredgtvggaadqspesllqlkalkpgviqilgvktsrflcqrpdgalygslhfdpeacsfrellledgynvyqseahglplhlpgnksphrdpaprgparflplpglppalpeppgilapqppdvgssdplsmvgpsqgrspsyas(seq id no:100)。
[0918]
47.实施方案1、3和6中任一项的药物组合物,其中所述n-末端区第一氨基酸位置是“m”残基、“r”残基、“s”残基、“h”残基、“p”残基、“l”残基或“d”残基,或其中在所述n-末端区的第一氨基酸位置,所述肽序列不具有“m”残基或“r”残基。
[0919]
48.实施方案1、3和6中任一项的药物组合物,其中所述n-末端区包含以下序列中的任一个:mdsspl(seq id no:119)、msdsspl(seq id no:120)、sdsspl(seq id no:112)、msspl(seq id no:113)或sspl(seq id no:114)。
[0920]
49.实施方案1、3和6中任一项的药物组合物,其中所述肽与fgf19或fgf 19变异体序列相比具有降低的肝细胞癌(hcc)形成,该fgf 19变异体序列具有在fgf19的氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代wgdpi(seq id no:170)序列。
[0921]
50.实施方案1、3和6中任一项的药物组合物,其中所述肽与fgf19或fgf 19变异体序列相比具有更大的葡萄糖降低活性,该fgf 19变异体序列具有在fgf19的氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)
中的任一个取代wgdpi(seq id no:170)序列。
[0922]
51.实施方案1、3和6中任一项的药物组合物,其中所述肽与fgf19或fgf 19变异体序列相比具有较少的脂质增加活性,该fgf 19变异体序列具有在fgf19的氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代wgdpi(seq id no:170)序列。
[0923]
52.实施方案1、3和6中任一项的药物组合物,其中所述肽与fgf19或fgf 19变异体序列相比具有较少的甘油三酯、胆固醇、非hdl或hdl增加活性,该fgf 19变异体序列具有在fgf19的氨基酸16-20处用gqv、gdi、wgpi(seq id no:171)、wgdpv(seq id no:172)、wgdi(seq id no:173)、gdpi(seq id no:174)、gpi、wgqpi(seq id no:175)、wgapi(seq id no:176)、agdpi(seq id no:177)、wadpi(seq id no:178)、wgdai(seq id no:179)、wgdpa(seq id no:180)、wdpi(seq id no:181)、wgdi(seq id no:182)、wgdp(seq id no:183)或fgdpi(seq id no:184)中的任一个取代wgdpi(seq id no:170)取代wgdpi序列。
[0924]
53.实施方案1、3和6中任一项的药物组合物,其中与fgf21相比,所述肽具有较少的瘦体质量减少活性。
[0925]
54.实施方案1、3和6中任一项的药物组合物,其中所述肽序列与成纤维细胞生长因子受体4(fgfr4)结合或激活fgfr4,或不可检测地与fgfr4结合或激活fgfr4。
[0926]
55.实施方案1、3和6中任一项的药物组合物,其中所述肽序列以小于、相当于或大于fgf19对fgfr4的结合亲和力的亲和力与fgfr4结合。
[0927]
56.实施方案1、3和6中任一项的药物组合物,其中所述肽序列以小于、相当于或大于fgf19激活fgfr4的程度或量激活fgfr4。
[0928]
57.实施方案1、3和6中任一项的药物组合物,其中所述肽序列具有1、2、3、4、5、6、7、8、9或10个氨基酸取代、缺失或插入。
[0929]
58.实施方案57的药物组合物,其中所述氨基酸缺失位于所述n-或c-末端,或内部。
[0930]
59.实施方案57的药物组合物,其中所述氨基酸取代或缺失位于fgf19的氨基酸位置8-20(agphvhygwgdpi)(seq id no:187)中的任一位置处。
[0931]
60.实施方案1、3和6中任一项的药物组合物,其中所述肽序列包含一个或多个l-氨基酸、d-氨基酸、非天然存在的氨基酸,或氨基酸模拟物、衍生物或类似物。
[0932]
61.实施方案1-60中任一项的药物组合物,包含浓度为1至10mg/ml的所述肽。
[0933]
62.实施方案61的药物组合物,包含浓度为1mg/ml的所述肽。
[0934]
63.实施方案61的药物组合物,包含浓度为5mg/ml的所述肽。
[0935]
64.实施方案61的药物组合物,包含浓度为10mg/ml的所述肽。
[0936]
65.实施方案1-64中任一项的药物组合物,其中所述肽与免疫球蛋白fc区域融合。
[0937]
66.实施方案1-65中任一项的药物组合物,其中所述肽包含seq id no:70的氨基酸序列。
[0938]
67.实施方案1-65中任一项的药物组合物,其中所述肽由seq id no:70的氨基酸
序列组成。
[0939]
68.实施方案1-65中任一项的药物组合物,其中所述肽包含seq id no:69的氨基酸序列。
[0940]
69.实施方案1-65中任一项的药物组合物,其中所述肽由seq id no:69的氨基酸序列组成。
[0941]
70.实施方案1-65中任一项的药物组合物,其中所述肽包含seq id no:204的氨基酸序列或由seq id no:204的氨基酸序列组成。
[0942]
71.实施方案1-70中任一项的药物组合物,其中所述tris在5和50mm、15和40mm、20和35mm、20和30mm或20和25mm的范围内存在。
[0943]
72.实施方案71的药物组合物,其中所述tris以20mm存在。
[0944]
73.实施方案1-72中任一项的药物组合物,其中1000ml的制剂体积包含2.0、2.1、2.2.、2.3.、2.4、2.5、2.6、2.7、2.8、2.9或3.0g的tris,或其任何范围。
[0945]
74.实施方案73的药物组合物,其中1000ml的制剂体积包含2.4至2.5g的tris。
[0946]
75.实施方案1-74中任一项的药物组合物,其中所述海藻糖在1%和20%、2%和15%、3%和10%、4%和9.5%、5%和9.25%、6%和9%、7%和8.5%、8%和8.4%或8.1%和8.3%的范围内存在。
[0947]
76.实施方案75的药物组合物,其中所述海藻糖以8.2%、8.3%或8.4%存在。
[0948]
77.实施方案1-74中任一项的药物组合物,其中1000ml的制剂体积包含92.0、92.1、92.2、92.3、92.4、92.5、92.6、92.7、92.8、92.9或93.0g的海藻糖二水合物。
[0949]
78.实施方案77的药物组合物,其中1000ml的制剂体积包含92.4至92.5g的海藻糖二水合物。
[0950]
79.实施方案1-74中任一项的药物组合物,其中所述海藻糖脱水物的摩尔浓度为240至300mm、240至290mm、250至290mm、260至290mm、270至290mm或244至245mm。
[0951]
80.实施方案79的药物组合物,其中所述海藻糖脱水物的摩尔浓度为约280mm。
[0952]
81.实施方案1-80中任一项的药物组合物,其中tween-20的浓度是在0.001至0.1%(v/v)、0.0025至0.075%(v/v)、0.005至0.05%(v/v)或0.0075至0.025%(v/v)的范围内。
[0953]
82.实施方案81的药物组合物,其中tween-20的浓度为0.01%(v/v)。
[0954]
83.实施方案1-82中任一项的药物组合物,其中所述药物组合物的ph在6.5和9.5、6.8和9.3、7.0和9.0、7.3和8.7、7.5和8.5或7.7和8.2的范围内。
[0955]
84.实施方案83的药物组合物,其中所述药物组合物的ph为7.3、7.5、8.0或8.5。
[0956]
85.实施方案83或84的药物组合物,其中在4℃下取ph值。
[0957]
86.实施方案83或84的药物组合物,其中在25℃下取ph值。
[0958]
87.实施方案1-69中任一项的药物组合物,包含20mm tris、8.37%(w/v)海藻糖和0.01%tween-20。
[0959]
88.实施方案1-69中任一项的药物组合物,包含20mm tris、8.2%(w/v)海藻糖和0.01%tween-20。
[0960]
89.实施方案1-69中任一项的药物组合物,包含20mm tris、280mm海藻糖和0.01%tween-20。
[0961]
90.实施方案85-89中任一项的药物组合物,其中在25℃下ph为8.0。
[0962]
91.一种药物组合物,包含:
[0963]
a.肽,其包含seq id no:70或由seq id no:70组成,和
[0964]
b.药学上可接受的载体,包含:
[0965]
i. 20mm tris,
[0966]
ii. 8.2%至8.4%(w/v)海藻糖,和
[0967]
iii. 0.01%tween-20;
[0968]
c.其中在25℃下,ph为8.0。
[0969]
92.实施方案91的药物组合物,包含浓度为1mg/ml的所述肽。
[0970]
93.实施方案91的药物组合物,包含浓度为5mg/ml的所述肽。
[0971]
94.实施方案91的药物组合物,包含浓度为10mg/ml的所述肽。
[0972]
95.实施方案92-94中任一项的药物组合物,其中所述肽与免疫球蛋白fc区域融合。
[0973]
96.一种药物组合物,包含:
[0974]
a.肽,其包含seq id no:69或由seq id no:69组成,和
[0975]
b.药学上可接受的载体,包含:
[0976]
i. 20mm tris,
[0977]
ii. 8.2%至8.4%(w/v)海藻糖,和
[0978]
iii. 0.01%tween-20;
[0979]
c.其中在25℃下,ph为8.0。
[0980]
97.实施方案96的药物组合物,包含浓度为1mg/ml的所述肽。
[0981]
98.实施方案96的药物组合物,包含浓度为5mg/ml的所述肽。
[0982]
99.实施方案96的药物组合物,包含浓度为10mg/ml的所述肽。
[0983]
100.实施方案96-99中任一项的药物组合物,其中所述肽与免疫球蛋白fc区域融合。
[0984]
101.实施方案1-100中任一项的药物组合物,其中所述药物组合物不包含盐。
[0985]
102.实施方案1-100中任一项的药物组合物,其中所述药物组合物不包含nacl。
[0986]
103.实施方案1-102中任一项的药物组合物,其中所述药物组合物是呈液体形式。
[0987]
104.实施方案1-103中任一项的药物组合物,其中所述药物组合物为冻干的。
[0988]
105.实施方案1-104中任一项的药物组合物,其中在一段时间周期以后,小于20%、小于15%、小于10%、小于5%或小于2%的所述肽聚集。
[0989]
106.实施方案105的药物组合物,其中所述时间周期为1天、7天、14天、28天、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、18个月、24个月或更长时间。
[0990]
107.实施方案105或106的药物组合物,其中所述药物组合物贮存在-80℃、4℃、25℃或37℃。
[0991]
108.一种预防、治疗或处理对象的疾病或紊乱的方法,包括向所述对象给予有效量的实施方案1-107中任一项的药物组合物。
[0992]
109.实施方案108的方法,其中所述疾病或紊乱包含胆汁酸体内稳态或胆汁酸有
关或相关紊乱。
[0993]
110.实施方案108的方法,其中所述疾病或紊乱包含选自代谢综合征;脂质或葡萄糖紊乱;胆固醇或甘油三酯代谢;2型糖尿病;胆汁淤积症、肝内胆汁淤积症、原发性胆汁性肝硬化(pbc)、原发性家族性肝内胆汁淤积症(pfic)、进行性pfic、原发性硬化性胆管炎(psc)、妊娠期肝内胆汁淤积症(pic)、新生儿胆汁淤积症和药物诱发的胆汁淤积症、肝外胆汁淤积的疾病、肿瘤所致的胆汁切向压缩、胆结石所致的胆管堵塞、胆汁酸吸收不良和累及远端小肠的其他紊乱、回肠切除、炎症性肠疾病、克罗恩氏病、溃疡性结肠炎、损害胆汁酸吸收的特发性紊乱、腹泻、胆汁酸性腹泻(bad)、gi症状、gi癌症、肝癌、胆汁性癌症、结肠癌、肝细胞癌、胆汁酸合成异常、非酒精性脂肪性肝炎(nash)、肝硬化、门静脉高压及其组合的疾病或紊乱。
[0994]
111.实施方案108的方法,其中所述疾病或紊乱包含脂质-或葡萄糖-相关紊乱。
[0995]
112.实施方案108的方法,其中所述疾病或紊乱包含胆汁酸吸收不良或腹泻。
[0996]
113.实施方案108的方法,其中所述疾病或紊乱包含胆汁淤积症或原发性胆汁性肝硬化。
[0997]
114.实施方案108的方法,其中所述疾病或紊乱包含原发性硬化性胆管炎。
[0998]
115.实施方案108的方法,其中所述疾病或紊乱包含pfic或进行性pfic。
[0999]
116.实施方案108的方法,其中所述疾病或紊乱包含非酒精性脂肪性肝炎(nash)。
[1000]
117.实施方案108的方法,其中所述疾病或紊乱包含代谢紊乱。
[1001]
118.实施方案108的方法,其中所述代谢紊乱包含高血糖症、胰岛素抵抗、高胰岛素血症、葡萄糖不耐症或代谢综合征。
[1002]
119.实施方案109的方法,其中所述高血糖症包含糖尿病。
[1003]
120.实施方案110的方法,其中所述高血糖症包含胰岛素依赖性(i型)糖尿病、ii型糖尿病或妊娠期糖尿病。
[1004]
121.实施方案108的方法,其中所述疾病或紊乱包含肥胖症或不理想的体重质量。
[1005]
122.实施方案108的方法,其中所述方法导致降低的葡萄糖水平、增加的胰岛素敏感性、降低的胰岛素抵抗、降低的胰高血糖素、葡萄糖耐量或葡萄糖代谢或体内稳态的改善、改善的胰腺功能、降低的甘油三酯、胆固醇、idl、ldl或vldl水平、血压下降、血管内膜增厚的减少或身体质量或体重增加的减少。
[1006]
123.实施方案108的方法,其中所述疾病或紊乱是癌症或肿瘤。
[1007]
124.实施方案123的方法,其中所述癌症或肿瘤是fgf19依赖性癌症或肿瘤。
[1008]
125.实施方案124的方法,其中所述fgf19依赖性癌症或肿瘤是肝细胞癌。
[1009]
126.实施方案124的方法,其中所述fgf19癌症或肿瘤不是肝细胞癌。
[1010]
127.实施方案124的方法,其中所述癌症或肿瘤是结肠癌或肿瘤。
[1011]
128.实施方案124的方法,其中所述癌症或肿瘤是前列腺癌或肿瘤。
[1012]
129.实施方案124的方法,其中所述癌症或肿瘤是肺癌或肿瘤。
[1013]
130.实施方案123-129的方法中任一项,其中所述方法导致肿瘤数量、肿瘤大小或肿瘤重量的减少。
[1014]
131.实施方案108-130的方法中任一项,其中所述对象是有其需要的对象。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1