一种依帕司他与西格列汀或其可药用盐的复方缓释片及其制备方法与流程
1.本发明属于药物制剂领域,具体涉及一种依帕司他与西格列汀或其可药用盐的复方缓释片及其制备方法。
背景技术:
2.依帕司他是一种醛糖还原酶抑制药,主要用于治疗糖尿病及其并发症。依帕司他对糖尿病诱发的神经病变具有绝对的治疗作用,同时对糖尿病肾病、糖尿病心肌病、糖尿病视网膜病变、糖尿病性胃轻瘫、白内障、足部溃疡、糖尿病大血管病变、糖尿病微血管病变、高血糖、高糖化血红蛋白水平等并发症具有治疗效果。
3.西格列汀是一种二肽基肽酶4(dpp-4)抑制剂,可增加活性肠促胰岛激素、c肽水平,降低胰高糖素水平,通过减少葡萄糖生成并增加组织对血糖的摄取而改善血糖控制。
4.有研究表明,糖尿病周围神经病变患者伴有no合成、释放功能缺陷,而低浓度的no会引起神经内膜血管舒张不良,导致局部血流量下降。临床上合用依帕司他与西格列汀则有助于改善神经功能,改善氧化应激和no水平,提高临床疗效。且二者合用不会使不良反应增加,临床安全性较高。依帕司他虽属于bcsⅱ类药物,但其溶解度与ph相关,依帕司他片剂在肠道内表现出释药速度较快,易释放不均匀的特点,1小时血药浓度即可达到峰值,t
1/2
为2小时。西格列汀片剂服药1-4小时后血浆药物浓度达峰值。将两种活性成分的药物制成复方缓释片,可长时间保持两种活性组分的协同增效作用。且目前市场上并未见将依帕司他与西格列汀或其可药用盐的药物组合物制成复方缓释片的产品或相关报道。
技术实现要素:
5.本发明的目的是克服现有技术中的不足,提供了一种依帕司他与西格列汀或其可药用盐的复方缓释片及其制备方法。
6.本发明一方面提供了一种依帕司他与西格列汀或其可药用盐的复方缓释片,其含有依帕司他、西格列汀活性组分、无水磷酸氢钙、骨架缓释材料、药用辅料;所述复方缓释片的片芯为单层片,片芯外包裹有缓释包衣膜;
7.所述西格列汀活性组分为西格列汀和/或其药学上可接受的盐和/或所述盐的水合物;其中,依帕司他和西格列汀活性组分质量比为0.2:1~5:1;西格列汀活性组分的总重量与无水磷酸氢钙的重量比为0.6-1.2:1;所述骨架缓释材料与单层片芯的总重量质量比为0.1-0.5:1。
8.本发明进一步提供了上述的依帕司他与西格列汀或其可药用盐的复方缓释片的制备方法包括如下步骤:
9.1)将依帕司他、西格列汀活性组分过100目筛,辅料过60目筛;
10.2)处方量的原料和辅料通过湿法制粒和/或干法制粒制备含有活性物质的颗粒;
11.3)将制备的含有活性物质的颗粒进行整粒、总混;所用整粒筛网目数为1.0mm;
12.4)制备的含有活性物质的颗粒压制成单层片芯;
13.5)配制包衣液进行薄膜包衣即得复方缓释片成品。
14.本发明另一方面提供了一种依帕司他与西格列汀或其可药用盐的复方缓释片,所述复方缓释片的片芯为双层片,片芯外包裹有缓释包衣膜;
15.所述双层片由依帕司他层和西格列汀活性组分层组成;其中,依帕司他层包括依帕司他、骨架缓释材料、第一药用辅料,依帕司他和骨架缓释材料质量比为1:0.15~1:0.65;
16.西格列汀活性组分层包括西格列汀活性组分、无水磷酸氢钙、第二药用辅料,西格列汀活性组分的总重量与无水磷酸氢钙的重量比为0.6-1.2:1;
17.所述片芯中,依帕司他和西格列汀活性组分质量比为0.2:1~5:1;
18.所述西格列汀活性组分为西格列汀和/或其药学上可接受的盐和/或所述盐的水合物。
19.进一步的,上述的依帕司他与西格列汀或其可药用盐的复方缓释片的制备方法包括如下步骤:
20.1)原辅料预处理:将依帕司他、西格列汀活性组分原料过100目筛,辅料过60目筛。
21.2)依帕司他层湿法制粒:称取处方量依帕司他原料与除润滑剂外的辅料混合均匀制软材,于60-80℃通风干燥1-2.5h,得依帕司他层干燥后颗粒;
22.3)将依帕司他层干燥后颗粒用1.0mm筛网整粒,加入润滑剂总混,得依帕司他层总混颗粒;
23.4)西格列汀活性组分层干法制粒:称取处方量西格列汀原料与除润滑剂外的辅料混合均匀,用干法制粒机制粒,将制粒得到的带状物以合适的速度通过1.0mm筛网进行粉碎整粒,得西格列汀层颗粒;
24.4)西格列汀层颗粒加入润滑剂总混,得西格列汀层总混颗粒;
25.5)将依帕司他层总混颗粒和西格列汀层总混颗粒用压片机压制双层片芯;
26.6)配制包衣液进行缓释薄膜包衣。
27.作为本发明的优选方案,所述依帕司他、西格列汀活性组分的粒径范围d(0.9)为50-300μm。
28.作为本发明的优选方案,所述依帕司他和西格列汀活性组分质量比为0.4:1~3:1。
29.作为本发明的优选方案,所述西格列汀活性组分为西格列汀、磷酸西格列汀、西格列汀磷酸盐或其水合物中的一种或多种。
30.作为本发明的优选方案,所述西格列汀活性组分的总重量与无水磷酸氢钙的重量比为0.8-1.2:1。
31.作为本发明的优选方案,所述骨架缓释材料是纤维素衍生物或乙烯基、丙烯基聚合物,包括甲基纤维素、羟甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素、羧乙基纤维素、微晶纤维素、淀粉、聚乙烯吡咯烷酮、丙烯酸树脂中的一种或几种的混合物。
32.所述的缓释包衣膜由如下组分组成:30%-60%质量百分比的成膜材料、5%-10%质量百分比的增塑剂、10%-30%质量百分比的速度调节剂或致孔剂、8%-18%质量百分比的遮光剂;缓释包衣膜增重为5%-8%。
33.由于依帕司他遇光易分解,故所述的复方缓释片需薄膜包衣达到避光目的。包衣还可以控制药物释放。所述包衣材料包括成膜材料、增塑剂、速度调节剂、致孔剂、遮光剂中的几种,成膜材料选自醋酸纤维素、聚丙烯酸树脂、羧甲基纤维素、乙基纤维素、羟丙基纤维素;增塑剂选自甘油、丙二醇、聚乙二醇、蓖麻油、甘油醋酸酯、邻苯二甲酸二乙酯;速度调节剂选自氯化钠、氧化钾、乳糖、蔗糖、羟丙甲基纤维素、羧甲基纤维素钠;致孔剂选自蔗糖、甘露醇、淀粉、聚乙二醇;遮光剂选自二氧化钛。可根据情况需要添加不同的包衣材料。
34.作为本发明的优选方案,复方缓释片的片芯为单层片时,所述药用辅料包括相当于片芯总重的20%-60%的填充剂、0%-10%的粘合剂、0%-5%的崩解剂、0%-5%的助流剂、0%-5%的润滑剂;
35.复方缓释片的片芯为双层片时,所述第一药用辅料包括相当于依帕司他层重量的20%-45%的填充剂、0%-6%的粘合剂、0%-5%的崩解剂、0%-2%的助流剂、0%-2%的润滑剂;
36.所述第二药用辅料包括相当于西格列汀活性组分层重量的40%-60%的填充剂、0%-5%的粘合剂、0%-5%的崩解剂、0%-2%的助流剂、0%-2%的润滑剂;
37.填充剂选自除无水磷酸氢钙之外的微晶纤维素、甘露醇、乳糖、淀粉中的一种或多种;粘合剂选自淀粉浆、聚维酮、羟丙基甲基纤维素、羟丙基纤维素中的一种或多种;崩解剂选自羧甲基淀粉钠、羧甲基纤维素钙、交联聚维酮、交联羧甲基纤维素钠中的一种或多种;助流剂选自滑石粉、胶态二氧化硅的一种或多种;润滑剂选自硬脂酸镁、硬脂富马酸钠、滑石粉中的一种或多种。
38.本发明的目的是提供一种依帕司他与西格列汀或其可药用盐的复方缓释片,用于治疗2型糖尿病,特别是2型糖尿病引起的周围神经病变。本发明将两种活性组分制成复方缓释片,使两种活性组分的溶出度接近,从而一方面延长两种药物协同增效的时间,另一方面可减少依帕司他、西格列汀或其可药用盐在胃中的释放,降低局部药物浓度,能减少药物对胃肠道的刺激作用;本发明通过将两种活性成分制成复方缓释片,服药方便,可改善患者依从性;相比于普通制剂,避免了普通制剂服药后在血液中的峰谷现象,降低不良反应发生,提高用药安全性,提高临床疗效。
具体实施方式
39.下文中本发明通过优选的实施例进一步进行阐述,但是本发明并不限于以下实施例。
40.实施例1:依帕司他、西格列汀膜控型骨架缓释单层片(1000片)
41.(1)片芯部分
42.依帕司他75g,磷酸西格列汀50g,无水磷酸氢钙45g,甘露醇80g,羟丙基甲基纤维素60g,羟丙基纤维素6g,交联羧甲基纤维素钠5g,胶态二氧化硅2g,硬脂富马酸钠5g,硬脂酸镁2g;
43.(2)膜控缓释包衣部分
44.乙基纤维素18g,羟丙甲基纤维素5g,邻苯二甲酸二乙酯2g,二氧化钛5g
45.制法:
46.(1)原辅料预处理:将依帕司他、西格列汀或其可药用盐原料过100目筛,填充剂等
辅料过60目筛。
47.(2)湿法制粒:称取原料与羟丙基纤维素、助流剂、润滑剂之外的辅料混合均匀,加入羟丙基纤维素水溶液混合制软材,于60-80℃通风干燥1-2.5h。
48.(3)将上述制备的含有活性物质的颗粒与助流剂混合后,用1.0mm筛网整粒,加入润滑剂总混。
49.(4)总混颗粒用压片机压制单层片芯。
50.(5)配制包衣液进行缓释薄膜包衣。
51.实施例2:依帕司他、西格列汀膜控型骨架缓释单层片(1000片)
52.(1)片芯部分
53.依帕司他75g,西格列汀50g,无水磷酸氢钙50g,微晶纤维素52g,甘露醇35g,羧甲基纤维素60g,羟丙基甲基纤维素5g,交联羧甲基纤维素钠6g,胶态二氧化硅2g,硬脂富马酸钠4g,硬脂酸镁2g;
54.(2)膜控缓释包衣材料
55.醋酸纤维素14g,羟丙甲纤维素9g,聚氧乙烯聚氧丙烯乙二醇2g,二氧化钛5g。
56.制法:与实施例1制法一致,片芯部分由实施例1的羟丙基纤维素水溶液做粘合剂制粒改为用纯化水做润湿剂混合制粒。
57.实施例3:依帕司他、西格列汀膜控型骨架缓释双层片(1000片)
58.(1)片芯部分
59.依帕司他缓释层:依帕司他75g,甘露醇42g,乳糖12g,羟丙基甲基纤维素35g,羧甲基纤维素钙4g,硬脂酸镁2g;
60.西格列汀或其可药用盐速释层:磷酸西格列汀50g,无水磷酸氢钙50g,甘露醇40g,交联羧甲基纤维素钠3g,硬脂富马酸钠5g,硬脂酸镁2g;
61.(2)膜控缓释包衣部分
62.eudragit rs 14g,eudragit rl 4g,聚乙二醇4g,邻苯二甲酸二乙酯3g,二氧化钛5g。
63.制法:
64.(1)原辅料预处理:将依帕司他、西格列汀或其可药用盐原料过100目筛,填充剂等辅料过60目筛。
65.(2)湿法制粒:称取适量依帕司他原料与辅料混合均匀,加入纯化水做润湿剂混合制软材,于60-80℃通风干燥1-2.5h,得依帕司他层干燥后颗粒。
66.(3)将依帕司他层干燥后颗粒用1.0mm筛网整粒,加入润滑剂总混,得依帕司他层总混颗粒。(4)干法制粒:称取适量西格列汀原料与辅料混合均匀,用干法制粒机制粒,将制粒得到的带状物以合适的速度通过1.0mm筛网进行粉碎整粒,得西格列汀层颗粒。
67.(4)将上述制备的含有活性物质的颗粒分别用1.0mm筛网整粒,加入润滑剂总混。
68.(5)将依帕司他层总混颗粒和西格列汀层总混颗粒用压片机压制双层片芯。
69.(6)配制包衣液进行缓释薄膜包衣。
70.实施例4:依帕司他、西格列汀膜控型骨架缓释双层片(1000片)
71.(1)片芯部分
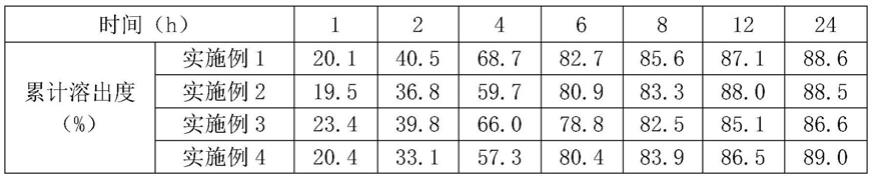
72.依帕司他缓释层:依帕司他75g,甘露醇60g,羧甲基纤维素20g,羟丙基甲基纤维素
19g,羧甲基纤维素钙4g,硬脂酸镁2g;
73.西格列汀或其可药用盐速释层:西格列汀50g,无水磷酸氢钙60g,微晶纤维素28g,交联聚维酮3g,硬脂富马酸钠5g,硬脂酸镁2g;
74.(2)包衣材料
75.eudragit rs 14g,eudragit rl 4g,聚乙二醇4g,邻苯二甲酸二乙酯3g,二氧化钛5g。
76.制法:与实施例3制法一致。
77.根据中国药典2020版四部通则0931溶出度与释放度测定方法第一法,将复方缓释片置于溶出杯中,分别在1h,2h,4h,6h,8h,12h,24h吸取溶液适量并及时补充相同体积的温度为37℃
±
0.5℃的溶出介质。照规定方法测定,计算每片(粒)的溶出量。
78.实施例1-4的依帕司他与西格列汀或其可药用盐的复方缓释片体外溶出试验数据如表1-2。
79.表1依帕司他与西格列汀或其可药用盐的复方缓释片的依帕司他体外溶出试验数据
[0080][0081]
表2依帕司他与西格列汀或其可药用盐的复方缓释片的西格列汀体外溶出试验数据
[0082][0083]
由表中数据可知,本发明的复方缓释片中,依帕司他、西格列汀或其可药用盐这两种活性组分的溶出曲线较为接近,从而可以使两种活性成分在较长的时间内发挥协同增效的作用,避免依帕司他溶出过快导致的对胃肠道刺激及无法发挥协同增效作用的问题。本发明的两种活性组分均是缓释的,可减少活性成分在胃中的释放,降低局部药物浓度,能减少药物对胃肠道的刺激作用。
[0084]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1